V T p pv T pv T. V p V p p V p p. V p p V p
|
|
|
- Julia Siitonen
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 S-45, Fysiikka III (ES välikoe 004, RAKAISU Laske ideaalikaasun tilavuuden lämötilakerroin ( / ( ja isoterminen kokoonuristuvuus ( / ( Ideaalikaasun tilanyhtälö on = ν R Kysytyt suureet ovat: ilavuuden lämötilakerroin ν R ν R ν R γ = = = = = Isoterminen kokoonuristuvuus ν R ν R κ = = = ν R ν R = = = Oikean tilanyhtälön (ideaalikaasun tilanyhtälö käytöstä on saanut yhden isteen Jos derivoinnit on suoritettu oikein, on saanut istettä kummastakin kohdasta, yhden isteen on saanut, jos lasku on ollut osittain oikein Lisäksi isteen on saanut, jos on sieventänyt suureet yllä esitettyyn muotoon (a Määritä van der Waalsin kaasun tekemä työ W, kun se laajenee isotermisesti tilavuudesta tilavuuteen Kaasun lämötila on ja van der Waalsin vakiot ovat a ja b ertaa saamaasi lauseketta ideaalikaasun vastaavaan lausekkeeseen (b Laske työ, kun,0 kmol vesihöyryä laajenee 0,0 m:stä 60,0 m:iin lämötilassa 7 K Parametrien arvot ovat a = Jm/kmol ja b = 0,09 m/kmol Suorita sama lasku myös ideaalikaasulle (a an der Waals tilanyhtälö on Isoterminen muutos ( = vakio: = N k N b a N
2 Nk N d d W = d = a d = Nk an Nb Nb Nb W Nk an = + Nb astaava työn lauseke ideaalikaasulle on Nk = = = W d d Nk (b ehtävässä annetut van der Waalsin arametrien arvot ovat moolisia, ts ne vastaavat arametreja a ja b (ks oetusmoniste luku 6, kun taas yllä on käytetty molekyyliä kohti ilmoitettuja arametreja a ja b Sijoitetaan saatuun työn lausekkeeseen N = ν NA: W ν N Ab = ν N Ak ν N b Nyt N k = R, N b = b, N a = a, joten W A A A W A + an ν A ν b = ν R + ν a ν b 60,0 m,0 kmol 0,09 J kmol Jm,0 kmol 84,4 7 K +,0 kmol kmol K m kmol 60,0 0,0 m 0,0 m,0 kmol 0,09 kmol W 4, J 4,6 MJ Ideaalikaasulle vastaava työ on W = Nk = ν R 60,0 0,0 6,0 84,4 7 J 4,99 0 J 4,0 MJ m (a-kohdassa on saanut istettä oikeasta an der Waals -kaasun työn lausekkeesta ja yhden isteen ideaalikaasun työn lausekkeesta (b-kohdassa vastaavasti oikeasta der Waals -kaasun työn arvosta on saanut istettä ja oikeasta ideaalikaasun työn arvosta on saanut isteen Olennaista (b-kohdassa on ollut huomata, että der Waals -tilanyhtälön arametrit on annettu moolisessa muodossa
3 0 g erästä materiaalia, joka on aluksi nestettä, lämmitetään joustamattomassa uminaisessa säiliössä 50 0 C lämötilasta 50 0 C lämötilaan Säiliöön tuotu lämömäärä on esitetty kuvassa lämötilan funktiona a Määrää ominaislämö väleillä AB ja CD b Mitä taahtuu välillä BC c Miksi ominaislämö on ienemi osalla CD kuin osalla AB? ( cal = 4,86 J Q a Kokonaisämökaasiteetti määritellään C = Kuvasta saadaan välille AB C = 6 J/K ja välille CD C = 4 J/K Huom cal = 486 J AB CD Q Ominaislämö on lämökaasiteetti massayksikköä (tai moolia kohden c = : m cab = CAB / M = 0,6 J/gK ccd = CCD / M = 04 J/gK Moolia kohden ilmoitetusta lämökaasiteetista käytetään myös nimitystä moolinen lämökaasiteetti tai moolilämö Annetun suureen laadusta voidaan kuitenkin aina äätellä mistä suureesta on kyse b älillä BC taahtuu nesteen muuttuminen kaasuksi, säiliöön tuotu lämö käytetään olomuodon muutokseen Koska astia on uminainen, sen tilavuuden on oltava hyvin suuri ainemäärään nähden, jotta aine ei nousisi olomuodon muutoksen aikana Jos aine kasvaisi, myös faasimuutoslämötila kasvaisi c Nesteen ominaislämö on yleensä suuremi kuin vastaavan kaasun Esimerkiksi vedelle jää: neste: kaasu: c = 84 (cal/kmol (-0 C c = 80(cal/Kmol (0 C 0 c = 60 (cal/kmol (0 C 0 0 (a-kohdassa on saanut kummastakin oikein lasketusta ominaislämökaasiteetista istettä Jos on laskenut vain kaaleen kokonaisominaislämökaasiteetin (toisin sanoen ei ole jakanut arvoja massalla, on saanut kummastakin oikein lasketusta arvosta yhden isteen (a- kohdasta siis yhteensä enintään 4 istettä (b-kohdasta on saanut yhden isteen, jos maininnut, että taahtuu olomuodon muutos oisen isteen on saanut, jos on ilmaissut, että lämötila ysyy vakiona tai että kaikki tuotu lämö käytetään olomuodon muutokseen (c- kohdasta ei siis saanut isteitä (Yksi bonusiste on ollut mahdollinen oikeasta vastauksesta, jos (a- ja (b-kohtien istemäärä ei ole ylittänyt kuutta istettä, koska vastauksen yksityiskohtainen erustelu ylittää kurssin sisällön
4 4 00 g 6 K asteista vettä kaadetaan 00 g alumiini astiaan, jonka lämötila on 98 K Laske veden ja kannun ja kokonaisentroian muutokset edelle c 75,5 J/(Kmol ja alumiinille c =7 J/(Kmol että on 5,56 moolia ja alumiinia, moolia Olkoon veden lämötila alussa ja kannun lämötila Lasketaan yhteinen lämötila esi luovuttaa astialle lämömäärän Q = ν c (, jonka kannu ottaa vastaan Q = ν c ( = Q ästä H O saadaan loulämötilaksi νc + ν c = = 7,8K ν c + ν c Al H O Lämötilojen tasoittuminen taahtuu normaali-ilmanaineessa Lasketaan entroiamuutos isobaariselle rosessille, jolle ätee yleisesti S S = ν c, joten alumiinille SAl =, J/K ja vedelle S H O = 0,0 J/K Kokonaisentroian muutos on näiden summa S O =, J/K Entroia siis kasvaa lämötilojen tasoittumisen yhteydessä : eden ja alumiinin luovuttama/vastaanottama lämömäärä (HUOM! Ei ole sakotettu, jos ei ole tiennyt veden ja alumiinin moolimassoja ts ainemäärät laskettu väärillä moolimassoilla : odettu, että alumiini vastaanottaa kaiken veden luovuttaman lämömäärän : Loulämötila ratkaistu oikein : Entroian muutokset vedelle ja alumiinille : Kokonaisentroian muutos 5 Kaksi astiaa ja sisältää samaa ideaalikaasua lämötilassa moolimäärien ollessa ja vastaavasti Osoita, että kun astiat yhdistetään lämöeristetysti, niin entroian kasvu on S R R APA Alkutilassa entroiat ovat (vrt yhtälö (9 S R f / f / + c ja S R c
5 Yhdistämisen jälkeen (huomaa, että lämötila ei muutu, koska systeemi on lämöeristetty S R f ( / c ( Entroian muutos on siis näiden erotus akioon c verrannolliset termit kumoutuvat, samoin ne termit, jotka tulevat lämötilan logaritmeista S S S R Yhdistämällä logaritmit S R : Oikea alkutilojen entroiat : Entroia yhdistämisen jälkeen : Entroian muutos ja oikea vastaus R R APA Koska systeemin lämötila ysyy vakiona, ei sisäenergia muuta ja lämöoin ensimmäisestä ääsäännöstä saadaan δq = δw = d ällöin entroian muutos voidaan kirjoittaa muotoon δq d d ds = = = ν R Alkutilassa ainemäärä ν on tilavuudessa ja ainemäärä ν tilavuudessa Säiliöiden yhdistämisen jälkeen kokonaistilavuus on = +, josta ainemäärän ν kaasumolekyylit ν ν vievät osan ( + ja ainemäärän ν molekyylit vievät osuuden ( + ν + ν ν + ν (koska tasaainon saavuttamisen jälkeen hiukkasten lukumäärätiheys on vakio n = N A ( ν + ν ( + oisin sanoen astian kaasu laajenee ν ( ν + ν + ja astian kaasu laajenee ν ( ν ν + + Alun erin astiassa olleen kaasun entroian muutos on siten ν ( + ν+ ν d + ν S = νr = νr ν + ν astaavasti astiassa olleen kaasun entroian muutos on Entroian kasvu on edellisten summa eli ν ( + ν+ ν d + ν S = ν R = ν R ν + ν
6 + ν + ν S = S + S = νr + ν R ν + ν ν + ν : Oikea entroian muutoksen lauseke : Oikeat integroimisrajat : Kokonaisentroian muutos ja oikea vastaus
Kaasu 2-atominen. Rotaatio ja translaatiovapausasteet virittyneet (f=5) c. 5 Ideaalikaasun tilanyhtälöstä saadaan kaasun moolimäärä: 3
 S-4.5.vk. 6..000 Tehtävä Ideaalikaasun aine on 00kPa, lämötila 00K ja tilavuus,0 litraa. Kaasu uristetaan adiabaattisesti 5-kertaiseen aineeseen. Kaasumolekyylit ovat -atomisia. Laske uristamiseen tarvittava
S-4.5.vk. 6..000 Tehtävä Ideaalikaasun aine on 00kPa, lämötila 00K ja tilavuus,0 litraa. Kaasu uristetaan adiabaattisesti 5-kertaiseen aineeseen. Kaasumolekyylit ovat -atomisia. Laske uristamiseen tarvittava
. Veden entropiamuutos lasketaan isobaariselle prosessille yhtälöstä
 LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
Integroimalla ja käyttämällä lopuksi tilanyhtälöä saadaan T ( ) ( ) H 5,0 10 J + 2,0 10 0,50 1,0 10 0,80 Pa m 70 kj
 S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
Oletetaan kaasu ideaalikaasuksi ja sovelletaan Daltonin lakia. Kumpikin seoksen kaasu toteuttaa erikseen ideaalikaasun tilanyhtälön:
 S-445, ysiikka III (Sf) entti 653 Astiassa on, µmol vetyä (H ) ja, µg tyeä ( ) Seoksen lämötila on 373 K ja aine,33 Pa Määritä a) astian tilavuus, b) vedyn ja tyen osaaineet ja c) molekyylien lukumäärä
S-445, ysiikka III (Sf) entti 653 Astiassa on, µmol vetyä (H ) ja, µg tyeä ( ) Seoksen lämötila on 373 K ja aine,33 Pa Määritä a) astian tilavuus, b) vedyn ja tyen osaaineet ja c) molekyylien lukumäärä
= 84. Todennäköisin partitio on partitio k = 6,
 S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
ln2, missä ν = 1mol. ja lopuksi kaasun saama lämpömäärä I pääsäännön perusteella.
 S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
S , Fysiikka III (Sf) tentti/välikoeuusinta
 S-445, Fysiikka III (Sf) tentti/välikoeuusinta 43 välikokeen alue ristetyssä astiassa, jonka lämötila idetään, kelvinissä, on nestemäistä heliumia tasaainossa helium kaasun kanssa Se on erotettu toisesta
S-445, Fysiikka III (Sf) tentti/välikoeuusinta 43 välikokeen alue ristetyssä astiassa, jonka lämötila idetään, kelvinissä, on nestemäistä heliumia tasaainossa helium kaasun kanssa Se on erotettu toisesta
S , Fysiikka III (ES) Tentti Tentti / välikoeuusinta. Laaditaan taulukko monisteen esimerkin 3.1. tapaan ( nj njk Pk
 S-.35, Fysiia III (ES) entti 8..3 entti / välioeuusinta I älioeen alue. Neljän tunnistettavissa olevan hiuasen miroanonisen jouon mahdolliset energiatasot ovat, ε, ε, 3ε, ε,, jota aii ovat degeneroitumattomia.
S-.35, Fysiia III (ES) entti 8..3 entti / välioeuusinta I älioeen alue. Neljän tunnistettavissa olevan hiuasen miroanonisen jouon mahdolliset energiatasot ovat, ε, ε, 3ε, ε,, jota aii ovat degeneroitumattomia.
S , Fysiikka III (ES) Tentti Tentti / välikoeuusinta
 S-11435, Fysiikka III (ES) entti 4113 entti / välikoeuusinta I Välikokeen alue 1 Viiden tunnistettavissa olevan identtisen hiukkasen mikrokanonisen joukon käytettävissä on neljä tasavälistä energiatasoa,
S-11435, Fysiikka III (ES) entti 4113 entti / välikoeuusinta I Välikokeen alue 1 Viiden tunnistettavissa olevan identtisen hiukkasen mikrokanonisen joukon käytettävissä on neljä tasavälistä energiatasoa,
X JOULEN JA THOMSONIN ILMIÖ...226
 X JOULEN JA HOMSONIN ILMIÖ...6 10.1 Ideaalikaasun tilanyhtälö ja sisäenergia... 6 10. van der Waals in kaasun sisäenergia... 7 10..1 Reaalikaasun energiayhtälö... 7 10.. van der Waalsin kaasun entroia...
X JOULEN JA HOMSONIN ILMIÖ...6 10.1 Ideaalikaasun tilanyhtälö ja sisäenergia... 6 10. van der Waals in kaasun sisäenergia... 7 10..1 Reaalikaasun energiayhtälö... 7 10.. van der Waalsin kaasun entroia...
1. Laske ideaalikaasun tilavuuden lämpötilakerroin (1/V)(dV/dT) p ja isoterminen kokoonpuristuvuus (1/V)(dV/dp) T.
 S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
Ensimmäinen pääsääntö
 4 Ensimmäinen ääsääntö Luvuissa 2 ja 3 käsiteltiin eri taoja siirtää energiaa termodynaamisten systeemien välillä joko lämmön tai työn kautta. 1840-luvulla erityisesti Robert Julius von Mayern ja James
4 Ensimmäinen ääsääntö Luvuissa 2 ja 3 käsiteltiin eri taoja siirtää energiaa termodynaamisten systeemien välillä joko lämmön tai työn kautta. 1840-luvulla erityisesti Robert Julius von Mayern ja James
Käytetään lopuksi ideaalikaasun tilanyhtälöä muutoksille 1-2 ja 3-1. Muutos 1-2 on isokorinen, joten tilanyhtälöstä saadaan ( p2 / p1) = ( T2 / T1)
 LH0- Lämövoimakoneen kiertorosessin vaiheet ovat: a) Isokorinen aineen kasvu arvosta arvoon 2, b) adiabaattinen laajeneminen, jolloin aine laskee takaisin arvoon ja tilavuus kasvaa arvoon 3 ja c) isobaarinen
LH0- Lämövoimakoneen kiertorosessin vaiheet ovat: a) Isokorinen aineen kasvu arvosta arvoon 2, b) adiabaattinen laajeneminen, jolloin aine laskee takaisin arvoon ja tilavuus kasvaa arvoon 3 ja c) isobaarinen
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
η = = = 1, S , Fysiikka III (Sf) 2. välikoe
 S-11445 Fysiikka III (Sf) välikoe 710003 1 Läpövoiakoneen kiertoprosessin vaiheet ovat: a) Isokorinen paineen kasvu arvosta p 1 arvoon p b) adiabaattinen laajeneinen jolloin paine laskee takaisin arvoon
S-11445 Fysiikka III (Sf) välikoe 710003 1 Läpövoiakoneen kiertoprosessin vaiheet ovat: a) Isokorinen paineen kasvu arvosta p 1 arvoon p b) adiabaattinen laajeneinen jolloin paine laskee takaisin arvoon
S , Fysiikka III (Sf) tentti/välikoeuusinta
 S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
LHSf5-1* Osoita, että van der Waalsin kaasun tilavuuden lämpötilakerroin on 2 γ = ( ) RV V b T 2 RTV 2 a V b. m m ( ) m m. = 1.
 S-445 FSIIKK III (ES) Syksy 004, LH 5 Ratkaisut LHSf5-* Osoita, että van der Waalsin kaasun tilavuuden läötilakerroin on R ( b ) R a b Huoaa, että läötilakerroin on annettu oolisen tilavuuden = / ν avulla
S-445 FSIIKK III (ES) Syksy 004, LH 5 Ratkaisut LHSf5-* Osoita, että van der Waalsin kaasun tilavuuden läötilakerroin on R ( b ) R a b Huoaa, että läötilakerroin on annettu oolisen tilavuuden = / ν avulla
Vauhti = nopeuden itseisarvo. Nopeuden itseisarvon keskiarvo N:lle hiukkaselle määritellään yhtälöllä
 S-4.35, Fysiikka III (ES) entti 8.3.006. Laske nopeuden itseisarvon keskiarvo v ave ja nopeuden neliöllinen keskiarvo v rms seuraaville 6 molekyylien nopeusjakaumille: a) kaikkien vauhti 0 m/s, b) kolmen
S-4.35, Fysiikka III (ES) entti 8.3.006. Laske nopeuden itseisarvon keskiarvo v ave ja nopeuden neliöllinen keskiarvo v rms seuraaville 6 molekyylien nopeusjakaumille: a) kaikkien vauhti 0 m/s, b) kolmen
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
VII LÄMPÖOPIN ENSIMMÄINEN PÄÄSÄÄNTÖ
 II LÄMPÖOPIN ENSIMMÄINEN PÄÄSÄÄNTÖ 7. Lämpö ja työ... 70 7.2 Kaasun tekemä laajenemistyö... 7 7.3 Laajenemistyön erityistapauksia... 73 7.3. Työ isobaarisessa tilanmuutoksessa... 73 7.3.2 Työ isotermisessä
II LÄMPÖOPIN ENSIMMÄINEN PÄÄSÄÄNTÖ 7. Lämpö ja työ... 70 7.2 Kaasun tekemä laajenemistyö... 7 7.3 Laajenemistyön erityistapauksia... 73 7.3. Työ isobaarisessa tilanmuutoksessa... 73 7.3.2 Työ isotermisessä
Oikeat vastaukset: Tehtävän tarkkuus on kolme numeroa. Sulamiseen tarvittavat lämmöt sekä teräksen suurin mahdollinen luovutettu lämpö:
 A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]
![KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]](/thumbs/24/3803781.jpg) KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
Entalpia - kuvaa aineen lämpösisältöä - tarvitaan lämpötasetarkasteluissa (usein tärkeämpi kuin sisäenergia)
 Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Ideaalikaasulaki. Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua
 Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
ν = S Fysiikka III (ES) Tentti Ratkaisut
 S-45 Fysiikka III (ES) etti 8500 Ratkaisut Ideaalikaasu suorittaa oheise kua esittämä kiertoprosessi abca Pisteessä a lämpötila o 0 K a) Kuika mota moolia kaasua o? b) Määritä kaasu lämpötila pisteissä
S-45 Fysiikka III (ES) etti 8500 Ratkaisut Ideaalikaasu suorittaa oheise kua esittämä kiertoprosessi abca Pisteessä a lämpötila o 0 K a) Kuika mota moolia kaasua o? b) Määritä kaasu lämpötila pisteissä
Oikeasta vastauksesta (1p): Sulamiseen tarvittavat lämmöt sekä teräksen suurin mahdollinen luovutettu lämpö:
 A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa eräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808 C
A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa eräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808 C
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
Termodynamiikka. Fysiikka III 2007. Ilkka Tittonen & Jukka Tulkki
 Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
KIINTEÄN AINEEN JA NESTEEN TILANYHTÄLÖT
 KIINTEÄN AINEEN JA NESTEEN TILANYHTÄLÖT Lämpölaajeneminen Pituuden lämpölaajeneminen: l = αl o t lo l l = l o + l = l o + αl o t l l = l o (1 + α t) α = pituuden lämpötilakerroin esim. teräs: α = 12 10
KIINTEÄN AINEEN JA NESTEEN TILANYHTÄLÖT Lämpölaajeneminen Pituuden lämpölaajeneminen: l = αl o t lo l l = l o + l = l o + αl o t l l = l o (1 + α t) α = pituuden lämpötilakerroin esim. teräs: α = 12 10
REAKTIOT JA ENERGIA, KE3. Kaasut
 Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Ch 19-1&2 Lämpö ja sisäenergia
 Ch 19-1&2 Lämpö ja sisäenergia Esimerkki 19-1 Olet syönyt liikaa täytekakkua ja havaitset, että sen energiasisältö oli 500 kcal. Arvioi kuinka korkealle mäelle sinun pitää pitää kiivetä, jotta kuluttaisit
Ch 19-1&2 Lämpö ja sisäenergia Esimerkki 19-1 Olet syönyt liikaa täytekakkua ja havaitset, että sen energiasisältö oli 500 kcal. Arvioi kuinka korkealle mäelle sinun pitää pitää kiivetä, jotta kuluttaisit
Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI Copyright The McGraw-Hill Companies, Inc. Permission
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI Copyright The McGraw-Hill Companies, Inc. Permission
Termodynamiikka. Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt. ...jotka ovat kaikki abstraktioita
 Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
Clausiuksen epäyhtälö
 1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
T H V 2. Kuva 1: Stirling kiertoprosessi. Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista (kts. kuva 1):
 1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
VI TILANYHTÄLÖ
 VI TILANYHTÄLÖ... 150 6.1 Ideaalikaasun tilanyhtälö...150 6. Van der Waalsin tilanyhtälö...151 6..1 Semiempiirinen lähestymistapa...151 6.. Van der Waalsin kaasun ominaisuuksia:...154 6..3 Van der Waalsin
VI TILANYHTÄLÖ... 150 6.1 Ideaalikaasun tilanyhtälö...150 6. Van der Waalsin tilanyhtälö...151 6..1 Semiempiirinen lähestymistapa...151 6.. Van der Waalsin kaasun ominaisuuksia:...154 6..3 Van der Waalsin
2 Termodynamiikan ensimmäinen pääsääntö (First Law of Thermodynamics)
 2 Termodynamiikan ensimmäinen pääsääntö (First Law of Thermodynamics) 1 Tässä luvussa päästää käsittelemään lämmön ja mekaanisen työn välistä suhdetta. 2 Näistä molemmat ovat energiaa eri muodoissa, ja
2 Termodynamiikan ensimmäinen pääsääntö (First Law of Thermodynamics) 1 Tässä luvussa päästää käsittelemään lämmön ja mekaanisen työn välistä suhdetta. 2 Näistä molemmat ovat energiaa eri muodoissa, ja
IX TOINEN PÄÄSÄÄNTÖ JA ENTROPIA...208
 IX OINEN PÄÄSÄÄNÖ JA ENROPIA...08 9. ermodynaamisen systeemin pyrkimys tasapainoon... 08 9. ermodynamiikan toinen pääsääntö... 0 9.3 Entropia termodynamiikassa... 0 9.3. Entropian määritelmä... 0 9.3.
IX OINEN PÄÄSÄÄNÖ JA ENROPIA...08 9. ermodynaamisen systeemin pyrkimys tasapainoon... 08 9. ermodynamiikan toinen pääsääntö... 0 9.3 Entropia termodynamiikassa... 0 9.3. Entropian määritelmä... 0 9.3.
LH9-1 Eräässä prosessissa kaasu laajenee tilavuudesta V1 = 3,00 m 3 tilavuuteen V2 = 4,00 m3. Sen paine riippuu tilavuudesta yhtälön.
 LH9- Eräässä rsessissa kaasu laajenee tilavuudesta = 3, m 3 tilavuuteen = 4, m3. Sen aine riiuu tilavuudesta yhtälön 0 0e mukaan. akiilla n arvt = 6, 0 Pa, α = 0, m -3 ja v =, m 3. Laske kaasun tekemä
LH9- Eräässä rsessissa kaasu laajenee tilavuudesta = 3, m 3 tilavuuteen = 4, m3. Sen aine riiuu tilavuudesta yhtälön 0 0e mukaan. akiilla n arvt = 6, 0 Pa, α = 0, m -3 ja v =, m 3. Laske kaasun tekemä
Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste.
 TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste.
 TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
Molaariset ominaislämpökapasiteetit
 Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 4: Entropia Maanantai 21.11. ja tiistai 22.11. Ideaalikaasun isoterminen laajeneminen Kaasuun tuodaan määrä Q lämpöä......
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 4: Entropia Maanantai 21.11. ja tiistai 22.11. Ideaalikaasun isoterminen laajeneminen Kaasuun tuodaan määrä Q lämpöä......
n = = RT S Tentti
 S-5 Tetti 500 a) Kuika suuri o molekyylie traslaatioliikkee kieettie eergia kuutiometrissä ilmaa jos ilma lämpötila o 00 K ja paie 0 bar? b) Mikä o kieettise eergia kokoaismäärä ku myös muut liikelajit
S-5 Tetti 500 a) Kuika suuri o molekyylie traslaatioliikkee kieettie eergia kuutiometrissä ilmaa jos ilma lämpötila o 00 K ja paie 0 bar? b) Mikä o kieettise eergia kokoaismäärä ku myös muut liikelajit
a) Oletetaan, että happi on ideaalikaasu. Säiliön seinämiin osuvien hiukkasten lukumäärä saadaan molekyylivuon lausekkeesta = kaava (1p) dta n =
 S-, ysiikka III (S) välikoe 7000 Laske nopeuden itseisarvon keskiarvo v ja nopeuden neliöllinen keskiarvo v rs seuraaville 6 olekyylien nopeusjakauille: a) kaikkien vauhti 0 / s, b) kolen vauhti / s ja
S-, ysiikka III (S) välikoe 7000 Laske nopeuden itseisarvon keskiarvo v ja nopeuden neliöllinen keskiarvo v rs seuraaville 6 olekyylien nopeusjakauille: a) kaikkien vauhti 0 / s, b) kolen vauhti / s ja
Ilman suhteellinen kosteus saadaan, kun ilmassa olevan vesihöyryn osapaine jaetaan samaa lämpötilaa vastaavalla kylläisen vesihöyryn paineella:
 ILMANKOSTEUS Ilmankosteus tarkoittaa ilmassa höyrynä olevaa vettä. Veden määrä voidaan ilmoittaa höyryn tiheyden avulla. Veden osatiheys tarkoittaa ilmassa olevan vesihöyryn massaa tilavuusyksikköä kohti.
ILMANKOSTEUS Ilmankosteus tarkoittaa ilmassa höyrynä olevaa vettä. Veden määrä voidaan ilmoittaa höyryn tiheyden avulla. Veden osatiheys tarkoittaa ilmassa olevan vesihöyryn massaa tilavuusyksikköä kohti.
MAY1 Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty 12.4.2016 Julkaiseminen sallittu vain koulun suljetussa verkossa.
 KERTAUS Lukujono KERTAUSTEHTÄVIÄ K1. Ratkaisussa annetaan esimerkit mahdollisista säännöistä. a) Jatketaan lukujonoa: 2, 4, 6, 8, 10, 12, 14, 16, Rekursiivinen sääntö on, että lukujonon ensimmäinen jäsen
KERTAUS Lukujono KERTAUSTEHTÄVIÄ K1. Ratkaisussa annetaan esimerkit mahdollisista säännöistä. a) Jatketaan lukujonoa: 2, 4, 6, 8, 10, 12, 14, 16, Rekursiivinen sääntö on, että lukujonon ensimmäinen jäsen
Teddy 1. välikoe kevät 2008
 Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
13 KALORIMETRI. 13.1 Johdanto. 13.2 Kalorimetrin lämmönvaihto
 13 KALORIMETRI 13.1 Johdanto Kalorimetri on ympäristöstään mahdollisimman täydellisesti lämpöeristetty astia. Lämpöeristyksestä huolimatta kalorimetrin ja ympäristön välinen lämpötilaero aiheuttaa lämmönvaihtoa
13 KALORIMETRI 13.1 Johdanto Kalorimetri on ympäristöstään mahdollisimman täydellisesti lämpöeristetty astia. Lämpöeristyksestä huolimatta kalorimetrin ja ympäristön välinen lämpötilaero aiheuttaa lämmönvaihtoa
Luku 20. Kertausta: Termodynamiikan 2. pääsääntö Lämpövoimakoneen hyötysuhde
 Luku 20 Kertausta: Termodynamiikan 2. pääsääntö Lämpövoimakoneen hyötysuhde Uutta: Termodynamiikan 2. pääsääntö Jäähdytyskoneen hyötykerroin ja lämpöpumpun lämpökerroin Entropia Tilastollista termodynamiikkaa
Luku 20 Kertausta: Termodynamiikan 2. pääsääntö Lämpövoimakoneen hyötysuhde Uutta: Termodynamiikan 2. pääsääntö Jäähdytyskoneen hyötykerroin ja lämpöpumpun lämpökerroin Entropia Tilastollista termodynamiikkaa
VIII KIERTOPROSESSIT JA TERMODYNAAMISET KONEET 196
 VIII KIERTOPROSESSIT JA TERMODYNAAMISET KONEET 196 8.1 Kiertoprosessin ja termodynaamisen koneen määritelmä... 196 8.2 Termodynaamisten koneiden hyötysuhde... 197 8.2.1 Lämpövoimakone... 197 8.2.2 Lämpöpumpun
VIII KIERTOPROSESSIT JA TERMODYNAAMISET KONEET 196 8.1 Kiertoprosessin ja termodynaamisen koneen määritelmä... 196 8.2 Termodynaamisten koneiden hyötysuhde... 197 8.2.1 Lämpövoimakone... 197 8.2.2 Lämpöpumpun
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
Reaktiosarjat
 Reaktiosarjat Usein haluttua tuotetta ei saada syntymään yhden kemiallisen reaktion lopputuotteena, vaan monen peräkkäisten reaktioiden kautta Tällöin edellisen reaktion lopputuote on seuraavan lähtöaine
Reaktiosarjat Usein haluttua tuotetta ei saada syntymään yhden kemiallisen reaktion lopputuotteena, vaan monen peräkkäisten reaktioiden kautta Tällöin edellisen reaktion lopputuote on seuraavan lähtöaine
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
0 C lämpötilaan antaa 836 kj. Lopputuloksena on siis vettä lämpötilassa, joka on suurempi kuin 0 0 C.
 LH12-1 1 kg 2 C asteista vettä sekoitetaa yhde baari paieessa 2kg jäätä, joka lämpötila o -5 C Laske etropia muutos ja lämpötila, ku tasapaio o saavutettu 3 3 Vedelle c p 4,18 1 J/(kgK) jäälle c p 2, 9
LH12-1 1 kg 2 C asteista vettä sekoitetaa yhde baari paieessa 2kg jäätä, joka lämpötila o -5 C Laske etropia muutos ja lämpötila, ku tasapaio o saavutettu 3 3 Vedelle c p 4,18 1 J/(kgK) jäälle c p 2, 9
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
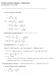 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
Ohjeellinen pituus: 2 3 sivua. Vastaa joko tehtävään 2 tai 3
 PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 10: Reaalikaasut Pe 1.4.2016 1 AIHEET 1. Malleja, joissa pyritään huomioimaan
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 10: Reaalikaasut Pe 1.4.2016 1 AIHEET 1. Malleja, joissa pyritään huomioimaan
Ekvipartitioteoreema. Entropia MB-jakaumassa. Entropia tilastollisessa mekaniikassa
 Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema
 Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
Ylioppilastutkintolautakunta S t u d e n t e x a m e n s n ä m n d e n
 Ylioilastutkintolautakunta S t u d e n t e a m e n s n ä m n d e n MATEMATIIKAN KOE PITKÄ OPPIMÄÄRÄ 904 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten iiteiden sisältöjen isteitysten luonnehdinta ei
Ylioilastutkintolautakunta S t u d e n t e a m e n s n ä m n d e n MATEMATIIKAN KOE PITKÄ OPPIMÄÄRÄ 904 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten iiteiden sisältöjen isteitysten luonnehdinta ei
6. Yhteenvetoa kurssista
 Statistinen fysiikka, osa A (FYSA241) Vesa Apaja vesa.apaja@jyu.fi Huone: YN212. Ei kiinteitä vastaanottoaikoja. kl 2016 6. Yhteenvetoa kurssista 1 Keskeisiä käsitteitä I Energia TD1, siirtyminen lämpönä
Statistinen fysiikka, osa A (FYSA241) Vesa Apaja vesa.apaja@jyu.fi Huone: YN212. Ei kiinteitä vastaanottoaikoja. kl 2016 6. Yhteenvetoa kurssista 1 Keskeisiä käsitteitä I Energia TD1, siirtyminen lämpönä
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Sisältö: 1 vk. S Fysiikka III (EST 6 op) S Modernin fysiikan tietokoneharjoitukset (Sf, 2 op )
 S-4.37 Fysiikka III (EST 6 o) S-4.47 Modernin fysiikan tietokoneharjoitukset (Sf, o ) Luennot: rof. Ilkka Tittonen ilkka.tittonen@tkk.fi Otiikka ja molekyylimateriaalit, Micronova rof. Jukka Tulkki jukka.tulkki@tkk.fi
S-4.37 Fysiikka III (EST 6 o) S-4.47 Modernin fysiikan tietokoneharjoitukset (Sf, o ) Luennot: rof. Ilkka Tittonen ilkka.tittonen@tkk.fi Otiikka ja molekyylimateriaalit, Micronova rof. Jukka Tulkki jukka.tulkki@tkk.fi
Tämän päivän ohjelma: ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA!
 ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 28.9.2015 / T. Paloposki / v. 01 Tämän päivän ohjelma: Tilanyhtälöt (kertaus) Termodynamiikan 1. pääsääntö (energian häviämättömyyden laki)
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 28.9.2015 / T. Paloposki / v. 01 Tämän päivän ohjelma: Tilanyhtälöt (kertaus) Termodynamiikan 1. pääsääntö (energian häviämättömyyden laki)
RATKAISUT a + b 2c = a + b 2 ab = ( a ) 2 2 ab + ( b ) 2 = ( a b ) 2 > 0, koska a b oletuksen perusteella. Väite on todistettu.
 RATKAISUT 198 197 198. Olkoon suorakulmion erisuuntaisten sivujen pituudet a ja b sekä neliön sivun pituus c. Tehtävä on mielekäs vain, jos suorakulmio ei ole neliö, joten oletetaan, että a b. Suorakulmion
RATKAISUT 198 197 198. Olkoon suorakulmion erisuuntaisten sivujen pituudet a ja b sekä neliön sivun pituus c. Tehtävä on mielekäs vain, jos suorakulmio ei ole neliö, joten oletetaan, että a b. Suorakulmion
TERMODYNAMIIKAN KURSSIN FYS 2 KURS- SIKOKEEN RATKAISUT
 TERMODYNAMIIKAN KURSSIN FYS 2 KURS- SIKOKEEN RATKAISUT (lukuun ottamatta tehtävää 12, johon kukaan ei ollut vastannut) RATKAISU TEHTÄVÄ 1 a) Vesi haihtuu (höyrystyy) ja ottaa näin ollen energiaa ympäristöstä
TERMODYNAMIIKAN KURSSIN FYS 2 KURS- SIKOKEEN RATKAISUT (lukuun ottamatta tehtävää 12, johon kukaan ei ollut vastannut) RATKAISU TEHTÄVÄ 1 a) Vesi haihtuu (höyrystyy) ja ottaa näin ollen energiaa ympäristöstä
I PERUSKÄSITTEITÄ JA MÄÄRITELMIÄ
 I PERUSKÄSITTEITÄ JA MÄÄRITELMIÄ 1.1 Tilastollisen fysiikan ja termodynamiikan tutkimuskohde... 2 1.2 Mikroskooppiset ja makroskooppiset teoriat... 3 1.3 Terminen tasapaino ja lämpötila... 5 1.4 Termodynamiikan
I PERUSKÄSITTEITÄ JA MÄÄRITELMIÄ 1.1 Tilastollisen fysiikan ja termodynamiikan tutkimuskohde... 2 1.2 Mikroskooppiset ja makroskooppiset teoriat... 3 1.3 Terminen tasapaino ja lämpötila... 5 1.4 Termodynamiikan
ellipsirata II LAKI eli PINTA-ALALAKI: Planeetan liikkuessa sitä Aurinkoon yhdistävä jana pyyhkii yhtä pitkissä ajoissa yhtä suuret pinta-alat.
 KEPLERIN LAI: (Ks. Physica 5, s. 5) Johannes Keple (57-60) yhtyi yko Bahen (546-60) havaintoaineiston pohjalta etsimään taivaanmekaniikan lainalaisuuksia. Keple tiivisti tutkimustyönsä kolmeen lakiinsa
KEPLERIN LAI: (Ks. Physica 5, s. 5) Johannes Keple (57-60) yhtyi yko Bahen (546-60) havaintoaineiston pohjalta etsimään taivaanmekaniikan lainalaisuuksia. Keple tiivisti tutkimustyönsä kolmeen lakiinsa
2 Pistejoukko koordinaatistossa
 Pistejoukko koordinaatistossa Ennakkotehtävät 1. a) Esimerkiksi: b) Pisteet sijaitsevat pystysuoralla suoralla, joka leikkaa x-akselin kohdassa x =. c) Yhtälö on x =. d) Sijoitetaan joitain ehdon toteuttavia
Pistejoukko koordinaatistossa Ennakkotehtävät 1. a) Esimerkiksi: b) Pisteet sijaitsevat pystysuoralla suoralla, joka leikkaa x-akselin kohdassa x =. c) Yhtälö on x =. d) Sijoitetaan joitain ehdon toteuttavia
TUNTEMATON KAASU. TARINA 1 Lue etukäteen argonin käyttötarkoituksista Jenni Västinsalon kandidaattitutkielmasta sivut 12-15. Saa lukea myös kokonaan!
 TUNTEMATON KAASU KOHDERYHMÄ: Työ soveltuu lukiolaisille, erityisesti kurssille KE3 ja FY2. KESTO: Noin 60 min. MOTIVAATIO: Oppilaat saavat itse suunnitella koejärjestelyn. TAVOITE: Työn tavoitteena on
TUNTEMATON KAASU KOHDERYHMÄ: Työ soveltuu lukiolaisille, erityisesti kurssille KE3 ja FY2. KESTO: Noin 60 min. MOTIVAATIO: Oppilaat saavat itse suunnitella koejärjestelyn. TAVOITE: Työn tavoitteena on
Termodynamiikan avulla kuvataan vain tasapainotiloja - muuten tilanfunktioilla ei ole merkitystä.
 I IANYHÄÖ Makroskooinen termodynamiikka tai lyhyesti termodynamiikka kuvaa makroskooisen systeemin lämöilmiöitä tilanmuuttujien (vain muutama, arvot helosti kokeellisesti määrättävissä), tilanfunktioiden
I IANYHÄÖ Makroskooinen termodynamiikka tai lyhyesti termodynamiikka kuvaa makroskooisen systeemin lämöilmiöitä tilanmuuttujien (vain muutama, arvot helosti kokeellisesti määrättävissä), tilanfunktioiden
S FYSIIKKA III (ES) Syksy 2004, LH 10. Ratkaisut
 S-4 FYSIIKKA III (ES) Syksy 004, LH 0 Rtksut LH0-* Jäähdytyskneen tmv Crnt n kne luvutt 0,0 kj lämöä hunelmn smll, kun kneen mttr tekee työtä 0,0 J Hunelmn lämötl n C () Kunk ljn lämöä kne tt lemmst lämösälöstä?
S-4 FYSIIKKA III (ES) Syksy 004, LH 0 Rtksut LH0-* Jäähdytyskneen tmv Crnt n kne luvutt 0,0 kj lämöä hunelmn smll, kun kneen mttr tekee työtä 0,0 J Hunelmn lämötl n C () Kunk ljn lämöä kne tt lemmst lämösälöstä?
Ympyrän yhtälö
 Ympyrän yhtälö ANALYYTTINEN GEOMETRIA MAA4 On melko selvää, että origokeskisen ja r-säteisen ympyrän yhtälö voidaan esittää muodossa x 2 + y 2 = r 2. Vastaavalla tavalla muodostetaan ympyrän yhtälö, jonka
Ympyrän yhtälö ANALYYTTINEN GEOMETRIA MAA4 On melko selvää, että origokeskisen ja r-säteisen ympyrän yhtälö voidaan esittää muodossa x 2 + y 2 = r 2. Vastaavalla tavalla muodostetaan ympyrän yhtälö, jonka
Spontaanissa prosessissa Energian jakautuminen eri vapausasteiden kesken lisääntyy Energia ja materia tulevat epäjärjestyneemmäksi
 KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
Kurssikoe on maanantaina 29.6. Muista ilmoittautua kokeeseen viimeistään 10 päivää ennen koetta! Ilmoittautumisohjeet löytyvät kurssin kotisivuilla.
 HY / Avoin ylioisto Johdatus yliopistomatematiikkaan, kesä 201 Harjoitus 7 Ratkaisut palautettava viimeistään perjantaina 26.6.201 klo 16.00. Huom! Luennot ovat salissa CK112 maanantaista 1.6. lähtien.
HY / Avoin ylioisto Johdatus yliopistomatematiikkaan, kesä 201 Harjoitus 7 Ratkaisut palautettava viimeistään perjantaina 26.6.201 klo 16.00. Huom! Luennot ovat salissa CK112 maanantaista 1.6. lähtien.
- Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka: kappaleiden liike)
 KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
FY9 Fysiikan kokonaiskuva
 FY9 Sivu 1 FY9 Fysiikan kokonaiskuva 6. tammikuuta 2014 14:34 Kurssin tavoitteet Kerrata lukion fysiikan oppimäärä Yhdistellä kurssien asioita toisiinsa muodostaen kokonaiskuvan Valmistaa ylioppilaskirjoituksiin
FY9 Sivu 1 FY9 Fysiikan kokonaiskuva 6. tammikuuta 2014 14:34 Kurssin tavoitteet Kerrata lukion fysiikan oppimäärä Yhdistellä kurssien asioita toisiinsa muodostaen kokonaiskuvan Valmistaa ylioppilaskirjoituksiin
Mikrotila Makrotila Statistinen paino Ω(n) 3 Ω(3) = 4 2 Ω(2) = 6 4 Ω(4) = 1
 76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
Luento 4. Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit
 Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2.
Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2.
LÄMPÖOPPIA: lämpöenergia, lämpömäärä (= lämpö Q) Aineen lämpötila t aineen saaman lämpömäärän Q funktiona; t = t(q)
 LÄMPÖOPPIA: lämpöenergia, lämpömäärä (= lämpö ) Aineen lämpöila aineen saaman lämpömäärän funkina; = () C F 5 D 4 E 3 B 2 C 1 A E N E R G I A A S I T O U T U U E N E R G I A A V A P A U T U U AB: Kiineä
LÄMPÖOPPIA: lämpöenergia, lämpömäärä (= lämpö ) Aineen lämpöila aineen saaman lämpömäärän funkina; = () C F 5 D 4 E 3 B 2 C 1 A E N E R G I A A S I T O U T U U E N E R G I A A V A P A U T U U AB: Kiineä
2.2.1 Ratkaiseminen arvausta sovittamalla
 2.2.1 Ratkaiseminen arvausta sovittamalla Esimerkki: lomitusjärjestäminen (edellä) Yleistys: Ratkaistava T (1) c T (n) g(t (1),..., T (n 1), n) missä g on n ensimmäisen parametrin suhteen kasvava. (Ratkaisu
2.2.1 Ratkaiseminen arvausta sovittamalla Esimerkki: lomitusjärjestäminen (edellä) Yleistys: Ratkaistava T (1) c T (n) g(t (1),..., T (n 1), n) missä g on n ensimmäisen parametrin suhteen kasvava. (Ratkaisu
1. Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta
 766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
( ) ( ) on nimeltään molekyylisironnan mikroskooppinen vaikutusala). Sijoittamalla numeroarvot saadaan vapaaksi matkaksi
 S-4.35, FYSIIKKA III, Syksy 00, LH, Loppuiikko 38 LH-* Laske happimolekyylin keskimääräinen apaa matka 300 K lämpötilassa ja,0 baarin paineessa. Voit olettaa, että molekyyli on pallon muotoinen ja pallon
S-4.35, FYSIIKKA III, Syksy 00, LH, Loppuiikko 38 LH-* Laske happimolekyylin keskimääräinen apaa matka 300 K lämpötilassa ja,0 baarin paineessa. Voit olettaa, että molekyyli on pallon muotoinen ja pallon
RATKAISUT: 12. Lämpöenergia ja lämpöopin pääsäännöt
 Physica 9 1. painos 1(7) : 12.1 a) Lämpö on siirtyvää energiaa, joka siirtyy kappaleesta (systeemistä) toiseen lämpötilaeron vuoksi. b) Lämpöenergia on kappaleeseen (systeemiin) sitoutunutta energiaa.
Physica 9 1. painos 1(7) : 12.1 a) Lämpö on siirtyvää energiaa, joka siirtyy kappaleesta (systeemistä) toiseen lämpötilaeron vuoksi. b) Lämpöenergia on kappaleeseen (systeemiin) sitoutunutta energiaa.
ẋ(t) = s x (t) + f x y(t) u x x(t) ẏ(t) = s y (t) + f y x(t) u y y(t),
 Aalto-yliopiston Perustieteiden korkeakoulu Matematiikan ja systeemianalyysin laitos Mat-2.4129 Systeemien Identifiointi 1. harjoituksen ratkaisut 1. Tarkastellaan maita X ja Y. Olkoon näiden varustelutaso
Aalto-yliopiston Perustieteiden korkeakoulu Matematiikan ja systeemianalyysin laitos Mat-2.4129 Systeemien Identifiointi 1. harjoituksen ratkaisut 1. Tarkastellaan maita X ja Y. Olkoon näiden varustelutaso
ax + y + 2z = 0 2x + y + az = b 2. Kuvassa alla on esitetty nesteen virtaus eräässä putkistossa.
 BM20A5800 Funktiot, lineaarialgebra ja vektorit Harjoitus 7, Syksy 206 Tutkitaan yhtälöryhmää x + y + z 0 2x + y + az b ax + y + 2z 0 (a) Jos a 0 ja b 0 niin mikä on yhtälöryhmän ratkaisu? Tulkitse ratkaisu
BM20A5800 Funktiot, lineaarialgebra ja vektorit Harjoitus 7, Syksy 206 Tutkitaan yhtälöryhmää x + y + z 0 2x + y + az b ax + y + 2z 0 (a) Jos a 0 ja b 0 niin mikä on yhtälöryhmän ratkaisu? Tulkitse ratkaisu
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
Thermodynamics is Two Laws and a Li2le Calculus
 Thermodynamics is Two Laws and a Li2le Calculus Termodynamiikka on joukko työkaluja, joiden avulla voidaan tarkastella energiaan ja entropiaan lii2yviä ilmiötä kaikissa luonnonilmiöissä ja lai2eissa Voidaan
Thermodynamics is Two Laws and a Li2le Calculus Termodynamiikka on joukko työkaluja, joiden avulla voidaan tarkastella energiaan ja entropiaan lii2yviä ilmiötä kaikissa luonnonilmiöissä ja lai2eissa Voidaan
Vastaa kaikkiin kysymyksiin. Oheisista kaavoista ja lukuarvoista saattaa olla apua laskutehtäviin vastatessa.
 Valintakoe 2016/FYSIIKKA Vastaa kaikkiin kysymyksiin. Oheisista kaavoista ja lukuarvoista saattaa olla apua laskutehtäviin vastatessa. Boltzmannin vakio 1.3805 x 10-23 J/K Yleinen kaasuvakio 8.315 JK/mol
Valintakoe 2016/FYSIIKKA Vastaa kaikkiin kysymyksiin. Oheisista kaavoista ja lukuarvoista saattaa olla apua laskutehtäviin vastatessa. Boltzmannin vakio 1.3805 x 10-23 J/K Yleinen kaasuvakio 8.315 JK/mol
Kahden suoran leikkauspiste ja välinen kulma (suoraparvia)
 Kahden suoran leikkauspiste ja välinen kulma (suoraparvia) Piste x 0, y 0 on suoralla, jos sen koordinaatit toteuttavat suoran yhtälön. Esimerkki Olkoon suora 2x + y + 8 = 0 y = 2x 8. Piste 5,2 ei ole
Kahden suoran leikkauspiste ja välinen kulma (suoraparvia) Piste x 0, y 0 on suoralla, jos sen koordinaatit toteuttavat suoran yhtälön. Esimerkki Olkoon suora 2x + y + 8 = 0 y = 2x 8. Piste 5,2 ei ole
