Teddy 7. harjoituksen malliratkaisu syksy 2011
|
|
|
- Pekka Tuominen
- 7 vuotta sitten
- Katselukertoja:
Transkriptio
1 Teddy 7. harjoituksen malliratkaisu syksy Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin energia on nolla ja koska G = H T S, höyrystymisentalpian ja entropian yhdistää toisiinsa yhtälö vap H T vap S = 0 vap S = vaph T Sijoitetaan tämä höyrystymisprosessia kuvaavaan Clapeyronin yhtälöön: dt = vaph m T vap V m. Tarkastellaan sen jälkeen tilavuudenmuutostermiä vap V m. Koska kyseessä on kaasun ja nesteen välinen raja, voidaan kirjoittaa vap V m = V m,g V m,l. Toisaalta kaasun moolitilavuus on aina paljon suurempi kuin nesteen, joten V m,g V m,l ja V m V m,g. Jos oletetaan kaasun vielä käyttäytyvän ideaalisesti,v m,g = RT p.käyttämällänäitähavaintojaclapeyroninyhtälössä päädytään Clausiuksen ja Clapeyronin yhtälöön: dt vaph m TV m,g = p vaph m RT 2. Tämä on differentiaaliyhtälö, joka voidaan ratkaista separoimalla muuttujat ja integroimalla: p = vaph m RT 2 dt = p p 0 p = T vap H m RT 2 dt lnp lnp 0 = ( vaph R T 1 lnp = vaph m 1 [ ] R T + vap H m +lnp 0 R Integroinnin tuloksena saatiin siis suoran yhtälö, jossa muuttujana on 1/T. Kyseinen yhtälö on Clausiuksen ja Clapeyronin yhtälön integroitu muoto. Suoran kulmakertoimesta voidaan laskea höyrystymisentalpia. Koska yllä olevassa yhtälössä on valittu p 0 vastaamaan normaalia ilmanpainetta eli painetta p 0 = 1 atm, voidaan normaali kiehumispiste määrittää joko suoran yhtälön hakasuluilla merkitystä vakiotermistä tai piirretystä kuvaajasta. Lasketaan lnp:n ja 1/T:n arvot ja piirretään ne kuvaajaan: T/ C (K/T/(10 3 3,66 3,41 3,19 3,09 2,91 2,83 2,75 2,68 ln(p/atm 3,97 2,77 1,74 1,30 0,49 0,13 0,21 0,52 a Normaalissa kiehumispisteessä nesteen höyrynpaine on p = 1 atm, joten täytyy etsiä se T 1 :n arvo, jolla lnp = ln1 = 0. Kyseinen piste on piirretty kuvaan mustilla viivoilla. Niiden perusteella T 1 0 = 0,0028 ja 1 T = 2, /K T = 357 K. 1
2 1 0 ln (p / atm Y = A + B * X Parameter Value Error A B K / T Kuva 1: Typpihapon Clausiuksen ja Clapeyronin kuvaaja. b Höyrystymisentalpia saadaan kulmakertoimesta B: vaph m R = B = 4, K vap H m = 4, K 8,31447 J K 1 mol 1 = 38 kj mol 1. Kommentti: Clapeyronin yhtälön muodosta nähdään, että se antaa kahden faasin välistä tasapainoa esittävän kuvaajan jyrkkyyden (T,p-koordinaatistossa. Sen integroitu muoto puolestaan antaa itse faasirajan käyrän (T,p- koordinaatistossa. Kuten kaikissa seuraavissa Clapeyronin yhtälöä käsittelevissä tehtävissä, tässäkinoletetaan,ettei H m riipulämpötilastaintegroimisvälillä.näinvoidaan tehdä vain, jos tarkasteltava väli on pieni. Suurilla lämpötilaväleillä on käytettävä Kirchhoffin lakia entalpian määrittämiseen. 2. Kuudennen laskuharjoituksen ensimmäisen tehtävän kommentissa saatiin sivutuotteena Gibbsin energialle yhtälö dg = V SdT. Jos paine on vakio = 0 ja tämä yhtälö voidaan kirjoittaa muotoon dg p = SdT p dg p dt p = S ( G Jakamalla molemmat puolet ainemäärällä saadaan yhtälö ( Gm = S m. p p = S. Toisaalta puhtaan aineen moolinen Gibbsin energia on määritelmän mukaan sama kuin kemiallinen potentiaali G m = µ ( µ = S m. p 2
3 Jos lämpötilaväli on riittävän pieni, voidaan derivaattaa arvioida yhtälöllä ja saadaan ( µ p µ T µ T = S m µ = S m T = 69,91 J K 1 mol 1 5 K = 349,55 J mol J mol 1, missä veden moolientropia on katsottu taulukosta. Kommentti: Kemiallinen potentiaalin on määritelty ( Gibbsin energian osittaisderivaattana tietyn komponentin i suhteen G n i eli partiaalisena p,t,n i j moolisena Gibbsin energiana. Sen merkitys tulee esille haluttaessa tarkastella systeemejä, joissa eri komponenttien ainemäärät ja faasit muuttuvat, kuten kemiallisessa reaktiossa. Tällöin on otettava huomioon, että Gibbsin energia riippuu paitsi paineesta ja lämpötilasta, myös systeemin koostumuksesta: G = G(T,p,n 1,n 2,..., missä n i ovat eri komponenttien ainemäärät. Näissä tapauksissa Gibbsin energian kokonaisdifferentiaali tulee muotoon ( ( ( ( G G G G dg = dn 1 + dn p n 1 T,p,n j 1 n 2 T,p,n k 2 = p,n i dt+ ( G p,n i dt + T,n i + ( G p T,n i +µ 1 dn 1 +µ 2 dn Osittaisdifferentiaalissa kemiallisesta potentiaalista riippuvat termit kuvaavat ainemäärien muutoksen vaikutusta Gibbsin energiaan. Niinpä aineen i kemiallinen potentiaali µ i kertoo, kuinka herkästi Gibbsin energia reagoi muutoksiin tämän aineen määrissä. 3. Tarkastellaan ensimmäisessä tehtävässä esitettyä Clausiuksen Clapeyronin yhtälöä, joka antaa nesteen höyrynpaineen p h lämpötilan funktiona lnp h lnp h,0 = H ( R T 1 ( ph ln = H ( R T 1. Kiehuminen tapahtuu, kun nesteen höyrynpaine on sama kuin ulkoinen paine eli p h = p. Ulkoisen paineen ja korkeuden liittää toisiinsa barometrinen kaava p = p 0 e Mgh RT i, missä p 0 on ilmanpaine merenpinnan tasolla ja T i ilman lämpötila, jonka on oletettu pysyvän vakiona kaavaa johdettaessa. Koska Clausiuksen Clapeyronin yhtälön p h,0 :ksi on valittu nesteen höyrynpaine normaalissa kiehumispisteessä, pätee p 0 = 1 atm = p h,0. Toisaalta, koska pätee p h = p, voidaan barometrisen kaavan tulos p:lle suoraan sijoittaa Clapeyronin yhtälöön: ln p 0e Mgh RT i p h,0 = H m R ( 1 T 1 p h,0 lne Mgh RT i = H ( R T 1 Mgh = H ( RT i R T 1 1 T = 1 + Mgh T i H m 3
4 Jos halutaan selvittää kiehumispiste 3000 m korkeudessa, täytyy ensin selvittää ilman moolimassa. Koska ilmassa on typpeä 78,1 %, happea 20,9 % ja argonia 1 %, moolimassaksi saadaan: M(ilma = 0,781M(N 2 +0,209M(O 2 +0,01M(Ar = (0,781 28,02+0,209 32,0+0,01 39,95 g/mol = 28,97 g/mol. Katsotaan veden höyrystymisentalpia taulukosta ja sijoitetaan tunnetut arvot johdettuun yhtälöön: 1 T = K +28, kg mol 1 9,81 m s m 293 K 40, J mol 1 = 2, K T = 363 K. Kommentti: Tarkastellaan suljettua astiaa, jonka pohjalle on laitettu nestemäistä ainetta A. Tämän jälkeen nestettä alkaa haihtua kaasufaasiin ja haihtuminen dominoi tiivistymiseen nähden, kunnes tasapaino neste- ja kaasufaasin välillä saavutetaan. Tähän tasapainotilaan liittyvää painetta A kutsutaan nesteen höyrynpaineeksi. Kuten Clausiuksen ja Clapeyronin yhtälöstä nähdään, lämpötilan nostaminen kasvattaa aineen höyrynpainetta. Kiehumispisteessä nesteen höyrynpaine saavuttaa ulkoisen paineen ja höyrystymistä pystyy tapahtumaan pinnan lisäksi myös nesteen sisällä. 4. Lähdetään jälleen liikkeelle Clapeyronin yhtälöstä eli yhtälöstä (1: dt = S V = S m V m Sijoitetaanaikaisempaantapaanyhtälöönentropianpaikalle S m = H m /T, oletetaan entalpian ja tilavuudenmuutokset lämpötilasta riippumattomiksi ja integroidaan: dt = H m = H m dt T V m T V m = p p 0 = T H m dt = H m T V m V m p = H ( m T ln. V m T dt T Ratkaistaan sen jälkeen p. Elohopeapatsaan yläosassa paine on p 0 ja alaosassa paine on p. Ero paineiden välillä aiheutuu elohopeapatsaan painosta. p = p p 0 = (p 0 +ρgh p 0 = ρgh. Siispä ρgh = H ( m T ln. V m 4
5 ( T ln = ρgh V m H m ( ρgh Vm T = exp H m Sijoitetaan ( kg m 3 9,81 m s 2 10 m 0, m 3 mol 1 T = 234,3K exp 2292 J mol 1 = 234,37 K 234,4 K Kommentti: Sovellettaessa Clapeyronin yhtälöä faasimuutokseen esimerkiksi kiinteän ja nesteen välillä ovat nesteen ja kiinteän aineen tilavuudet lähellätoisiaan, eikä tilavuudenmuutostermiä V m voida approksimoidakuten neste- ja kaasufaasin tapauksessa. Kiinteän ja kaasufaasin välisellä faasikäyrällä approksimaatio V m RT/p puolestaan on järkevä. 5. Merkitään vettä A:lla ja metanolia B:llä Ajatellaan, että 12 painoprosenttiseen liuokseen (liuos 1 lisätään metanolia niin paljon, että siitä tulee 13 painoprosenttinen liuos (liuos 2. Lisäyksen aikana lämpötila, paine ja veden ainemäärä ovat vakioita. On tärkeää, että toisen komponentin partiaalista moolitilavuutta laskettaessa toisen komponentin ainemäärä ajatellaan vakioksi. Kaavalla ( V V m,b = n B T,p,n A (2 saatu keskimääräinen partiaalinen moolitilavuus on likimain 12,5 painoprosenttisen liuoksen arvo. Oletetaan, että liuosta 1 on massa a kg. Tällöin ja n B = n A = 0,12a kg 0,88a kg M A sekä V(1 = (a kg ρ 1 Lisäyksen aikana n A on vakio, joten n A (2 = n A (1 = (0,88a kg/m A Liuoksen 2 massalle w(2 on voimassa kaava w(2 = 0,88a kg 0,87 joten n B (2 = 0,13w(2 = 0,13 0,88a kg 0,87 5
6 ja V(2 = 0,88a kg 0,87ρ 2 Näin ollen V m,b = V(2 V(1 n B (2 n B (1 = ( 0,88 cm 3 ( 0,13 0,88 0,87 0, ,042 mol 0,87 1 0, ,97942 = 36,925cm 3 mol 1 Veden partiaalinen moolitilavuus saadaan samalla tavalla. Ajatellaan, että veden suhteen 87 painoprosenttiseen liuokseen 2 lisätään vettä niin paljon, että siitä tulee 88 painoprosenttinen liuos 1. Lisäyksen aikana metanolin ainemäärä on vakio. Tällöin kysytty suure saadaan kaavasta ( V V m,a = n A T,p,n B Oletetaan, että liuosta 2 on massa b kg. Tällöin n A (2 = 0,87b kg M A n B (2 = 0,13b kg = n B (1 V(2 = b kg ρ 2 n A (1 = 0,88 0,13b kg 0,12M A sekä V(1 = 0,13b kg 0,12ρ 1 joten V m,a = V(1 V(2 n A (1 n A (2 = ( 0,13 cm 3 ( 0,88 0,13 0,12 0, ,015 mol 0,12 1 0, ,97799 = 18,071cm 3 mol 1 Oletetaan, että 12,5 painoprosenttista liuosta on massa c kg. Tällöin ja n A = n B = 0,875c kg M A 0,125c kg Kokonaistilavuudelle saadaan V = n A V m,a +n B V m,b = (0,875 18,071 0, ,125 36,925 0, c cm3 6
7 = 1021,77c cm 3 joten ρ = w V = 1000c g 1021,77c cm 3 = 0,97869 g cm 3. Kommentti: Yhtälön (2 mukaisia partiaalisia moolitilavuuksia tarvitaan, kun liuoksen komponenttien ainemäärät muuttuvat. Partiaalien moolitilavuusv m,i kertoo,kuinkapaljontilavuusmuuttuu,kunliuokseenlisätäänpieni määrä komponenttia i. Kokeellisesti partiaalinen moolitilavuus voidaan määrittää esimerkiksi tehtävässä esitetyllä tavalla. 7
Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen
 KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
Teddy 1. välikoe kevät 2008
 Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
1 Eksergia ja termodynaamiset potentiaalit
 1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA!
 ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
REAKTIOT JA ENERGIA, KE3. Kaasut
 Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
(l) B. A(l) + B(l) (s) B. B(s)
 FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA 6. 11. 1998 (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN
FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA 6. 11. 1998 (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2017 Emppu Salonen Lasse Laurson Touko Herranen Toni Mäkelä Luento 11: Faasitransitiot Ke 29.3.2017 1 AIHEET 1. 1. kertaluvun transitioiden (esim.
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2017 Emppu Salonen Lasse Laurson Touko Herranen Toni Mäkelä Luento 11: Faasitransitiot Ke 29.3.2017 1 AIHEET 1. 1. kertaluvun transitioiden (esim.
Teddy 10. harjoituksen malliratkaisu syksy 2011
 Teddy. harjoituksen malliratkaisu syksy 2. Tarkastellaan reaktioketjua k O 3 O2 +O () O 2 +O k O 3 (2) O 3 +O k 2 O 2 +O 2 (3) Vakiotilaolettamuksen mukaan välituotteen konsentraatio pysyy vakiona lyhyen
Teddy. harjoituksen malliratkaisu syksy 2. Tarkastellaan reaktioketjua k O 3 O2 +O () O 2 +O k O 3 (2) O 3 +O k 2 O 2 +O 2 (3) Vakiotilaolettamuksen mukaan välituotteen konsentraatio pysyy vakiona lyhyen
Teddy 1. harjoituksen malliratkaisu kevät 2011
 Teddy 1. harjoituksen malliratkaisu kevät 2011 1. Dipolimomentti voidaan määritellä pistevarauksille seuraavan vektoriyhtälön avulla: µ = q i r i, (1) i missä q i on i:nnen varauksen suuruus ja r i = (x
Teddy 1. harjoituksen malliratkaisu kevät 2011 1. Dipolimomentti voidaan määritellä pistevarauksille seuraavan vektoriyhtälön avulla: µ = q i r i, (1) i missä q i on i:nnen varauksen suuruus ja r i = (x
Termodynaamisten tasapainotarkastelujen tulokset esitetään usein kuvaajina, joissa:
 Lämpötila (Celsius) Luento 9: Termodynaamisten tasapainojen graafinen esittäminen, osa 1 Tiistai 17.10. klo 8-10 Termodynaamiset tasapainopiirrokset Termodynaamisten tasapainotarkastelujen tulokset esitetään
Lämpötila (Celsius) Luento 9: Termodynaamisten tasapainojen graafinen esittäminen, osa 1 Tiistai 17.10. klo 8-10 Termodynaamiset tasapainopiirrokset Termodynaamisten tasapainotarkastelujen tulokset esitetään
vetyteknologia Polttokennon tyhjäkäyntijännite 1 DEE-54020 Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
Luvun 12 laskuesimerkit
 Luvun 12 laskuesimerkit Esimerkki 12.1 Mikä on huoneen sisältämän ilman paino, kun sen lattian mitat ovat 4.0m 5.0 m ja korkeus 3.0 m? Minkälaisen voiman ilma kohdistaa lattiaan? Oletetaan, että ilmanpaine
Luvun 12 laskuesimerkit Esimerkki 12.1 Mikä on huoneen sisältämän ilman paino, kun sen lattian mitat ovat 4.0m 5.0 m ja korkeus 3.0 m? Minkälaisen voiman ilma kohdistaa lattiaan? Oletetaan, että ilmanpaine
Mikrotila Makrotila Statistinen paino Ω(n) 3 Ω(3) = 4 2 Ω(2) = 6 4 Ω(4) = 1
 76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
kuonasula metallisula Avoin Suljettu Eristetty S / Korkealämpötilakemia Termodynamiikan peruskäsitteitä
 Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
. Veden entropiamuutos lasketaan isobaariselle prosessille yhtälöstä
 LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
13. Ratkaisu. Kirjoitetaan tehtävän DY hieman eri muodossa: = 1 + y x + ( y ) 2 (y )
 MATEMATIIKAN JA TILASTOTIETEEN LAITOS Differentiaaliyhtälöt, kesä 00 Tehtävät 3-8 / Ratkaisuehdotuksia (RT).6.00 3. Ratkaisu. Kirjoitetaan tehtävän DY hieman eri muodossa: y = + y + y = + y + ( y ) (y
MATEMATIIKAN JA TILASTOTIETEEN LAITOS Differentiaaliyhtälöt, kesä 00 Tehtävät 3-8 / Ratkaisuehdotuksia (RT).6.00 3. Ratkaisu. Kirjoitetaan tehtävän DY hieman eri muodossa: y = + y + y = + y + ( y ) (y
Spontaanissa prosessissa Energian jakautuminen eri vapausasteiden kesken lisääntyy Energia ja materia tulevat epäjärjestyneemmäksi
 KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
RATKAISUT: 12. Lämpöenergia ja lämpöopin pääsäännöt
 Physica 9 1. painos 1(7) : 12.1 a) Lämpö on siirtyvää energiaa, joka siirtyy kappaleesta (systeemistä) toiseen lämpötilaeron vuoksi. b) Lämpöenergia on kappaleeseen (systeemiin) sitoutunutta energiaa.
Physica 9 1. painos 1(7) : 12.1 a) Lämpö on siirtyvää energiaa, joka siirtyy kappaleesta (systeemistä) toiseen lämpötilaeron vuoksi. b) Lämpöenergia on kappaleeseen (systeemiin) sitoutunutta energiaa.
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]
![KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]](/thumbs/24/3803781.jpg) KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
SISÄLLYSLUETTELO SYMBOLILUETTELO 4
 1 SISÄLLYSLUETTELO SYMBOLILUETTELO 4 1 KEMIALLISESTI REAGOIVA TERMODYNAAMINEN SYSTEEMI 6 11 Yleistä 6 12 Standarditila ja referenssitila 7 13 Entalpia- ja entropia-asteikko 11 2 ENTALPIA JA OMINAISLÄMPÖ
1 SISÄLLYSLUETTELO SYMBOLILUETTELO 4 1 KEMIALLISESTI REAGOIVA TERMODYNAAMINEN SYSTEEMI 6 11 Yleistä 6 12 Standarditila ja referenssitila 7 13 Entalpia- ja entropia-asteikko 11 2 ENTALPIA JA OMINAISLÄMPÖ
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen
 KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
Differentiaali- ja integraalilaskenta 1 Ratkaisut 5. viikolle /
 MS-A8 Differentiaali- ja integraalilaskenta, V/7 Differentiaali- ja integraalilaskenta Ratkaisut 5. viikolle / 9..5. Integroimismenetelmät Tehtävä : Laske osittaisintegroinnin avulla a) π x sin(x) dx,
MS-A8 Differentiaali- ja integraalilaskenta, V/7 Differentiaali- ja integraalilaskenta Ratkaisut 5. viikolle / 9..5. Integroimismenetelmät Tehtävä : Laske osittaisintegroinnin avulla a) π x sin(x) dx,
= 84. Todennäköisin partitio on partitio k = 6,
 S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
8 Aineen olomuodot. 8-1 Olomuodon muutokset
 96 8 Aineen olomuodot 8-1 Olomuodon muutokset Vesi voi esiintyä eri lämpötiloissa hyvin erilaisissa tiloissa jäänä, nestemäisenä vetenä ja höyrynä. Tällaisia tiloja sanotaan aineen olomuodoiksi (engl.
96 8 Aineen olomuodot 8-1 Olomuodon muutokset Vesi voi esiintyä eri lämpötiloissa hyvin erilaisissa tiloissa jäänä, nestemäisenä vetenä ja höyrynä. Tällaisia tiloja sanotaan aineen olomuodoiksi (engl.
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko klo 8-10
 Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Laskun vaiheet ja matemaattiset mallit
 Laskun vaiheet ja matemaattiset mallit Jukka Sorjonen sorjonen.jukka@gmail.com 26. syyskuuta 2016 Jukka Sorjonen (Jyväskylän Normaalikoulu) Mallit ja laskun vaiheet 26. syyskuuta 2016 1 / 14 Hieman kertausta
Laskun vaiheet ja matemaattiset mallit Jukka Sorjonen sorjonen.jukka@gmail.com 26. syyskuuta 2016 Jukka Sorjonen (Jyväskylän Normaalikoulu) Mallit ja laskun vaiheet 26. syyskuuta 2016 1 / 14 Hieman kertausta
2. Viikko. CDH: luvut (s ). Matematiikka on fysiikan kieli ja differentiaaliyhtälöt sen yleisin murre.
 2. Viikko Keskeiset asiat ja tavoitteet: 1. Peruskäsitteet: kertaluku, lineaarisuus, homogeenisuus. 2. Separoituvan diff. yhtälön ratkaisu, 3. Lineaarisen 1. kl yhtälön ratkaisu, CDH: luvut 19.1.-19.4.
2. Viikko Keskeiset asiat ja tavoitteet: 1. Peruskäsitteet: kertaluku, lineaarisuus, homogeenisuus. 2. Separoituvan diff. yhtälön ratkaisu, 3. Lineaarisen 1. kl yhtälön ratkaisu, CDH: luvut 19.1.-19.4.
Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste.
 TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
Differentiaali- ja integraalilaskenta 3 Ratkaisut viikko 3
 MS-A35 Differentiaali- ja integraalilaskenta 3, I/27 Differentiaali- ja integraalilaskenta 3 Ratkaisut viikko 3 Tehtävä : Hahmottele seuraavat vektorikentät ja piirrä niiden kenttäviivat. a) F(x, y) =
MS-A35 Differentiaali- ja integraalilaskenta 3, I/27 Differentiaali- ja integraalilaskenta 3 Ratkaisut viikko 3 Tehtävä : Hahmottele seuraavat vektorikentät ja piirrä niiden kenttäviivat. a) F(x, y) =
Faasi: Aineen tila, jonka kemiallinen koostumus ja fysikaalinen ominaisuudet ovat homogeeniset koko näytteessä. P = näytteen faasien lukumäärä.
 FAASIDIAGRAMMIT Määritelmiä Faasi: Aineen tila, jonka kemiallinen koostumus ja fysikaalinen ominaisuudet ovat homogeeniset koko näytteessä. P = näytteen faasien lukumäärä. Esimerkkejä: (a) suolaliuos (P=1),
FAASIDIAGRAMMIT Määritelmiä Faasi: Aineen tila, jonka kemiallinen koostumus ja fysikaalinen ominaisuudet ovat homogeeniset koko näytteessä. P = näytteen faasien lukumäärä. Esimerkkejä: (a) suolaliuos (P=1),
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
Ohjeellinen pituus: 2 3 sivua. Vastaa joko tehtävään 2 tai 3
 PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
- Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka: kappaleiden liike)
 KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 KEMIALLINEN TASAPAINO ATKINS LUKU 7
 KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste.
 TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
TYÖ 36b. ILMANKOSTEUS Tehtävä Työssä määritetään luokkahuoneen huoneilman vesihöyryn osapaine, osatiheys, huoneessa olevan vesihöyryn massa, absoluuttinen kosteus ja kastepiste. Välineet Taustatietoja
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt
 KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2011 Insinöörivalinnan fysiikan koe 1.6.2011, malliratkaisut
 A1 Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2011 Täydennä kuhunkin kohtaan yhtälöstä puuttuva suure tai vakio alla olevasta taulukosta. Anna vastauksena kuhunkin kohtaan ainoastaan
A1 Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2011 Täydennä kuhunkin kohtaan yhtälöstä puuttuva suure tai vakio alla olevasta taulukosta. Anna vastauksena kuhunkin kohtaan ainoastaan
f(x) f(y) x y f f(x) f(y) (x) = lim
 Y1 (Matematiikka I) Haastavampia lisätehtäviä Syksy 1 1. Funktio h määritellään seuraavasti. Kuvan astiaan lasketaan vettä tasaisella nopeudella 1 l/min. Astia on muodoltaan katkaistu suora ympyräkartio,
Y1 (Matematiikka I) Haastavampia lisätehtäviä Syksy 1 1. Funktio h määritellään seuraavasti. Kuvan astiaan lasketaan vettä tasaisella nopeudella 1 l/min. Astia on muodoltaan katkaistu suora ympyräkartio,
Ratkaisu. Tarkastellaan aluksi Fe 3+ - ja Fe 2+ -ionien välistä tasapainoa: Nernstin yhtälö tälle reaktiolle on:
 Esimerkki Pourbaix-piirroksen laatimisesta Laadi Pourbaix-piirros, jossa on esitetty metallisen ja ionisen raudan sekä raudan oksidien stabiilisuusalueet vesiliuoksessa 5 C:een lämpötilassa. Ratkaisu Tarkastellaan
Esimerkki Pourbaix-piirroksen laatimisesta Laadi Pourbaix-piirros, jossa on esitetty metallisen ja ionisen raudan sekä raudan oksidien stabiilisuusalueet vesiliuoksessa 5 C:een lämpötilassa. Ratkaisu Tarkastellaan
f (28) L(28) = f (27) + f (27)(28 27) = = (28 27) 2 = 1 2 f (x) = x 2
 BMA581 - Differentiaalilaskenta ja sovellukset Harjoitus 4, Syksy 15 1. (a) Olisiko virhe likimain.5, ja arvio antaa siis liian suuren arvon. (b) Esim (1,1.5) tai (,.5). Funktion toinen derivaatta saa
BMA581 - Differentiaalilaskenta ja sovellukset Harjoitus 4, Syksy 15 1. (a) Olisiko virhe likimain.5, ja arvio antaa siis liian suuren arvon. (b) Esim (1,1.5) tai (,.5). Funktion toinen derivaatta saa
KJR-C1001 Statiikka ja dynamiikka. Luento Susanna Hurme
 KJR-C1001 Statiikka ja dynamiikka Luento 16.3.2016 Susanna Hurme Päivän aihe: Translaatioliikkeen kinetiikka (Kirjan luvut 12.6, 13.1-13.3 ja 17.3) Oppimistavoitteet Ymmärtää, miten Newtonin toisen lain
KJR-C1001 Statiikka ja dynamiikka Luento 16.3.2016 Susanna Hurme Päivän aihe: Translaatioliikkeen kinetiikka (Kirjan luvut 12.6, 13.1-13.3 ja 17.3) Oppimistavoitteet Ymmärtää, miten Newtonin toisen lain
Ilman suhteellinen kosteus saadaan, kun ilmassa olevan vesihöyryn osapaine jaetaan samaa lämpötilaa vastaavalla kylläisen vesihöyryn paineella:
 ILMANKOSTEUS Ilmankosteus tarkoittaa ilmassa höyrynä olevaa vettä. Veden määrä voidaan ilmoittaa höyryn tiheyden avulla. Veden osatiheys tarkoittaa ilmassa olevan vesihöyryn massaa tilavuusyksikköä kohti.
ILMANKOSTEUS Ilmankosteus tarkoittaa ilmassa höyrynä olevaa vettä. Veden määrä voidaan ilmoittaa höyryn tiheyden avulla. Veden osatiheys tarkoittaa ilmassa olevan vesihöyryn massaa tilavuusyksikköä kohti.
Tehtävänanto oli ratkaista seuraavat määrätyt integraalit: b) 0 e x + 1
 Tehtävä : Tehtävänanto oli ratkaista seuraavat määrätyt integraalit: a) a) x b) e x + Integraali voisi ratketa muuttujanvaihdolla. Integroitava on muotoa (a x ) n joten sopiva muuttujanvaihto voisi olla
Tehtävä : Tehtävänanto oli ratkaista seuraavat määrätyt integraalit: a) a) x b) e x + Integraali voisi ratketa muuttujanvaihdolla. Integroitava on muotoa (a x ) n joten sopiva muuttujanvaihto voisi olla
REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos
 ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
12. Differentiaaliyhtälöt
 1. Differentiaaliyhtälöt 1.1 Johdanto Differentiaaliyhtälöitä voidaan käyttää monilla alueilla esimerkiksi tarkasteltaessa jonkin kohteen lämpötilan vaihtelua, eksponentiaalista kasvua, sähkölatauksen
1. Differentiaaliyhtälöt 1.1 Johdanto Differentiaaliyhtälöitä voidaan käyttää monilla alueilla esimerkiksi tarkasteltaessa jonkin kohteen lämpötilan vaihtelua, eksponentiaalista kasvua, sähkölatauksen
Valitse seuraavista joko tehtävä 1 tai 2
 PHYS-A0120 Termodynamiikka, syksy 2016 Kotitentti Vastaa tehtäviin 1/2, 3, 4/5, 6/7, 8 ja 9 (yhteensä kuusi vastausta). Tehtävissä 1 ja 2 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
PHYS-A0120 Termodynamiikka, syksy 2016 Kotitentti Vastaa tehtäviin 1/2, 3, 4/5, 6/7, 8 ja 9 (yhteensä kuusi vastausta). Tehtävissä 1 ja 2 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
lnx x 1 = = lim x = = lim lim 10 = x x0
 BM0A580 - Differentiaalilaskenta ja sovellukset Harjoitus 5, Syksy 05. (a) (b) ln = sin(t π ) t π t π = = 0 = = cos(t π = ) = 0 t π (c) e [ = ] = = e e 3 = e = 0 = 0 (d) (e) 3 3 + 6 + 8 + 6 5 + 4 4 + 4
BM0A580 - Differentiaalilaskenta ja sovellukset Harjoitus 5, Syksy 05. (a) (b) ln = sin(t π ) t π t π = = 0 = = cos(t π = ) = 0 t π (c) e [ = ] = = e e 3 = e = 0 = 0 (d) (e) 3 3 + 6 + 8 + 6 5 + 4 4 + 4
Matematiikan tukikurssi
 Matematiikan tukikurssi Kurssikerta 8 1 Suunnattu derivaatta Aluksi tarkastelemme vektoreita, koska ymmärrys vektoreista helpottaa alla olevien asioiden omaksumista. Kun liikutaan tasossa eli avaruudessa
Matematiikan tukikurssi Kurssikerta 8 1 Suunnattu derivaatta Aluksi tarkastelemme vektoreita, koska ymmärrys vektoreista helpottaa alla olevien asioiden omaksumista. Kun liikutaan tasossa eli avaruudessa
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
(b) Tunnista a-kohdassa saadusta riippuvuudesta virtausmekaniikassa yleisesti käytössä olevat dimensiottomat parametrit.
 Tehtävä 1 Oletetaan, että ruiskutussuuttimen nestepisaroiden halkaisija d riippuu suuttimen halkaisijasta D, suihkun nopeudesta V sekä nesteen tiheydestä ρ, viskositeetista µ ja pintajännityksestä σ. (a)
Tehtävä 1 Oletetaan, että ruiskutussuuttimen nestepisaroiden halkaisija d riippuu suuttimen halkaisijasta D, suihkun nopeudesta V sekä nesteen tiheydestä ρ, viskositeetista µ ja pintajännityksestä σ. (a)
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus
 Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
x + 1 πx + 2y = 6 2y = 6 x 1 2 πx y = x 1 4 πx Ikkunan pinta-ala on suorakulmion ja puoliympyrän pinta-alojen summa, eli
 BM0A5810 - Differentiaalilaskenta ja sovellukset Harjoitus, Syksy 015 1. a) Funktio f ) = 1) vaihtaa merkkinsä pisteissä = 1, = 0 ja = 1. Lisäksi se on pariton funktio joten voimme laskea vain pinta-alan
BM0A5810 - Differentiaalilaskenta ja sovellukset Harjoitus, Syksy 015 1. a) Funktio f ) = 1) vaihtaa merkkinsä pisteissä = 1, = 0 ja = 1. Lisäksi se on pariton funktio joten voimme laskea vain pinta-alan
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
BM20A0900, Matematiikka KoTiB3
 BM20A0900, Matematiikka KoTiB3 Luennot: Matti Alatalo Oppikirja: Kreyszig, E.: Advanced Engineering Mathematics, 8th Edition, John Wiley & Sons, 1999, luvut 1 4. 1 Sisältö Ensimmäisen kertaluvun differentiaaliyhtälöt
BM20A0900, Matematiikka KoTiB3 Luennot: Matti Alatalo Oppikirja: Kreyszig, E.: Advanced Engineering Mathematics, 8th Edition, John Wiley & Sons, 1999, luvut 1 4. 1 Sisältö Ensimmäisen kertaluvun differentiaaliyhtälöt
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 /
 ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 / 7.11.2016 v. 02 / T. Paloposki Tämän päivän ohjelma: Sisäenergia (kertaus) termodynamiikan 1. pääsääntö Entropia termodynamiikan 2. pääsääntö 1 Termodynamiikan
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 / 7.11.2016 v. 02 / T. Paloposki Tämän päivän ohjelma: Sisäenergia (kertaus) termodynamiikan 1. pääsääntö Entropia termodynamiikan 2. pääsääntö 1 Termodynamiikan
1 Oikean painoisen kuulan valinta
 Oikean painoisen kuulan valinta Oheisessa kuvaajassa on optimoitu kuulan painoa niin, että se olisi mahdollisimman nopeasti perillä tietyltä etäisyydeltä ammuttuna airsoft-aseella. Tulos on riippumaton
Oikean painoisen kuulan valinta Oheisessa kuvaajassa on optimoitu kuulan painoa niin, että se olisi mahdollisimman nopeasti perillä tietyltä etäisyydeltä ammuttuna airsoft-aseella. Tulos on riippumaton
MS-A0207 Differentiaali- ja integraalilaskenta 2 Luento 5: Gradientti ja suunnattu derivaatta. Vektoriarvoiset funktiot. Taylor-approksimaatio.
 MS-A0207 Differentiaali- ja integraalilaskenta 2 Luento 5: Gradientti ja suunnattu derivaatta. Vektoriarvoiset funktiot. Taylor-approksimaatio. Riikka Korte Matematiikan ja systeemianalyysin laitos 1 Aalto-yliopisto
MS-A0207 Differentiaali- ja integraalilaskenta 2 Luento 5: Gradientti ja suunnattu derivaatta. Vektoriarvoiset funktiot. Taylor-approksimaatio. Riikka Korte Matematiikan ja systeemianalyysin laitos 1 Aalto-yliopisto
Clausiuksen epäyhtälö
 1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
Aineen olomuodot ja olomuodon muutokset
 Aineen olomuodot ja olomuodon muutokset Jukka Sorjonen sorjonen.jukka@gmail.com 8. helmikuuta 2017 Jukka Sorjonen (Jyväskylän Normaalikoulu) Aineen olomuodot ja olomuodon muutokset 8. helmikuuta 2017 1
Aineen olomuodot ja olomuodon muutokset Jukka Sorjonen sorjonen.jukka@gmail.com 8. helmikuuta 2017 Jukka Sorjonen (Jyväskylän Normaalikoulu) Aineen olomuodot ja olomuodon muutokset 8. helmikuuta 2017 1
Integroimalla ja käyttämällä lopuksi tilanyhtälöä saadaan T ( ) ( ) H 5,0 10 J + 2,0 10 0,50 1,0 10 0,80 Pa m 70 kj
 S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
(a) Potentiaali ja virtafunktiot saadaan suoraan summaamalla lähteen ja pyörteen funktiot. Potentiaalifunktioksi
 Tehtävä 1 Tornadon virtauskenttää voidaan approksimoida kaksiulotteisen nielun ja pyörteen summana Oleta, että nielun voimakkuus on m < ja pyörteen voimakkuus on > (a Määritä tornadon potentiaali- ja virtafunktiot
Tehtävä 1 Tornadon virtauskenttää voidaan approksimoida kaksiulotteisen nielun ja pyörteen summana Oleta, että nielun voimakkuus on m < ja pyörteen voimakkuus on > (a Määritä tornadon potentiaali- ja virtafunktiot
Ainemäärien suhteista laskujen kautta aineiden määriin
 REAKTIOT JA ENERGIA, KE3 Ainemäärien suhteista laskujen kautta aineiden määriin Mitä on kemia? Kemia on reaktioyhtälöitä, ja niiden tulkitsemista. Ollaan havaittu, että reaktioyhtälöt kertovat kemiallisen
REAKTIOT JA ENERGIA, KE3 Ainemäärien suhteista laskujen kautta aineiden määriin Mitä on kemia? Kemia on reaktioyhtälöitä, ja niiden tulkitsemista. Ollaan havaittu, että reaktioyhtälöt kertovat kemiallisen
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 2 Kevät 2017
 763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 2 Kevät 207. Nelinopeus ympyräliikkeessä On siis annettu kappaleen paikkaa kuvaava nelivektori X x µ : Nelinopeus U u µ on määritelty kaavalla x µ (ct,
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 2 Kevät 207. Nelinopeus ympyräliikkeessä On siis annettu kappaleen paikkaa kuvaava nelivektori X x µ : Nelinopeus U u µ on määritelty kaavalla x µ (ct,
3 = Lisäksi z(4, 9) = = 21, joten kysytty lineaarinen approksimaatio on. L(x,y) =
 BM20A5810 Differentiaalilaskenta ja sovellukset Harjoitus 6, Syksy 2016 1. (a) Olkoon z = z(x,y) = yx 1/2 + y 1/2. Muodosta z:lle lineaarinen approksimaatio L(x,y) siten että approksimaation ja z:n arvot
BM20A5810 Differentiaalilaskenta ja sovellukset Harjoitus 6, Syksy 2016 1. (a) Olkoon z = z(x,y) = yx 1/2 + y 1/2. Muodosta z:lle lineaarinen approksimaatio L(x,y) siten että approksimaation ja z:n arvot
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
Laskun vaiheet ja matemaattiset mallit
 Laskun vaiheet ja matemaattiset mallit Jukka Sorjonen sorjonen.jukka@gmail.com 28. syyskuuta 2016 Jukka Sorjonen (Jyväskylän Normaalikoulu) Mallit ja laskun vaiheet 28. syyskuuta 2016 1 / 22 Hieman kertausta
Laskun vaiheet ja matemaattiset mallit Jukka Sorjonen sorjonen.jukka@gmail.com 28. syyskuuta 2016 Jukka Sorjonen (Jyväskylän Normaalikoulu) Mallit ja laskun vaiheet 28. syyskuuta 2016 1 / 22 Hieman kertausta
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
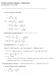 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
Reaktiosarjat
 Reaktiosarjat Usein haluttua tuotetta ei saada syntymään yhden kemiallisen reaktion lopputuotteena, vaan monen peräkkäisten reaktioiden kautta Tällöin edellisen reaktion lopputuote on seuraavan lähtöaine
Reaktiosarjat Usein haluttua tuotetta ei saada syntymään yhden kemiallisen reaktion lopputuotteena, vaan monen peräkkäisten reaktioiden kautta Tällöin edellisen reaktion lopputuote on seuraavan lähtöaine
ja piirrä sitä vastaavat kaksi käyrää ja tarkista ratkaisusi kuvastasi.
 Harjoituksia yhtälöryhmistä ja matriiseista 1. Ratkaise yhtälöpari (F 1 ja F 2 ovat tuntemattomia) cos( ) F 1 + cos( ) F 2 = 0 sin( ) F 1 + sin( ) F 2 = -1730, kun = -50 ja = -145. 2. Ratkaise yhtälöpari
Harjoituksia yhtälöryhmistä ja matriiseista 1. Ratkaise yhtälöpari (F 1 ja F 2 ovat tuntemattomia) cos( ) F 1 + cos( ) F 2 = 0 sin( ) F 1 + sin( ) F 2 = -1730, kun = -50 ja = -145. 2. Ratkaise yhtälöpari
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
x = π 3 + nπ, x + 1 f (x) = 2x (x + 1) x2 1 (x + 1) 2 = 2x2 + 2x x 2 = x2 + 2x f ( 3) = ( 3)2 + 2 ( 3) ( 3) + 1 3 1 + 4 2 + 5 2 = 21 21 = 21 tosi
 Mallivastaukset - Harjoituskoe F F1 a) (a + b) 2 (a b) 2 a 2 + 2ab + b 2 (a 2 2ab + b 2 ) a 2 + 2ab + b 2 a 2 + 2ab b 2 4ab b) tan x 3 x π 3 + nπ, n Z c) f(x) x2 x + 1 f (x) 2x (x + 1) x2 1 (x + 1) 2 2x2
Mallivastaukset - Harjoituskoe F F1 a) (a + b) 2 (a b) 2 a 2 + 2ab + b 2 (a 2 2ab + b 2 ) a 2 + 2ab + b 2 a 2 + 2ab b 2 4ab b) tan x 3 x π 3 + nπ, n Z c) f(x) x2 x + 1 f (x) 2x (x + 1) x2 1 (x + 1) 2 2x2
Muita lämpökoneita. matalammasta lämpötilasta korkeampaan. Jäähdytyksen tehokerroin: Lämmityksen lämpökerroin:
 Muita lämpökoneita Nämäkin vaativat ovat työtälämpövoimakoneiden toimiakseen sillä termodynamiikan pääsääntö Lämpökoneita lisäksi laitteet,toinen jotka tekevät on Clausiuksen mukaan: laiteilmalämpöpumppu
Muita lämpökoneita Nämäkin vaativat ovat työtälämpövoimakoneiden toimiakseen sillä termodynamiikan pääsääntö Lämpökoneita lisäksi laitteet,toinen jotka tekevät on Clausiuksen mukaan: laiteilmalämpöpumppu
Spektrofotometria ja spektroskopia
 11 KÄYTÄNNÖN ESIMERKKEJÄ INSTRUMENTTIANALYTIIKASTA Lisätehtävät Spektrofotometria ja spektroskopia Esimerkki 1. Mikä on transmittanssi T ja transmittanssiprosentti %T, kun absorbanssi A on 0, 1 ja 2. josta
11 KÄYTÄNNÖN ESIMERKKEJÄ INSTRUMENTTIANALYTIIKASTA Lisätehtävät Spektrofotometria ja spektroskopia Esimerkki 1. Mikä on transmittanssi T ja transmittanssiprosentti %T, kun absorbanssi A on 0, 1 ja 2. josta
Matemaattinen Analyysi
 Vaasan yliopisto, kevät 01 / ORMS1010 Matemaattinen Analyysi. harjoitus, viikko 1 R1 ke 1 16 D11 (..) R to 10 1 D11 (..) 1. Määritä funktion y(x) MacLaurinin sarjan kertoimet, kun y(0) = ja y (x) = (x
Vaasan yliopisto, kevät 01 / ORMS1010 Matemaattinen Analyysi. harjoitus, viikko 1 R1 ke 1 16 D11 (..) R to 10 1 D11 (..) 1. Määritä funktion y(x) MacLaurinin sarjan kertoimet, kun y(0) = ja y (x) = (x
5.9 Voiman momentti (moment of force, torque)
 5.9 Voiman momentti (moment of force, torque) Voiman momentti määritellään ristitulona M = r F missä r on voiman F vaikutuspisteen paikkavektori tarkasteltavan pisteen suhteen Usean voiman tapauksessa
5.9 Voiman momentti (moment of force, torque) Voiman momentti määritellään ristitulona M = r F missä r on voiman F vaikutuspisteen paikkavektori tarkasteltavan pisteen suhteen Usean voiman tapauksessa
Lämmityksen lämpökerroin: Jäähdytin ja lämmitin ovat itse asiassa sama laite, mutta niiden hyötytuote on eri, jäähdytyksessä QL ja lämmityksessä QH
 Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
Teddy 2. välikoe kevät 2008
 Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
kolminkertaisesti tehtäviä tavallisiin harjoituksiin verrattuna, voi sen kokonaan tekemällä saada suunnilleen kolmen tavallisen harjoituksen edestä
 Matematiikkaa kemisteille, kevät 2013 Ylimääräisiä laskuharjoituksia Tällä laskuharjoituksella voi korottaa laskuharjoituspisteitään, mikäli niitä ei ole riittävästi kurssin läpäisemiseen, tai vaihtoehtoisesti
Matematiikkaa kemisteille, kevät 2013 Ylimääräisiä laskuharjoituksia Tällä laskuharjoituksella voi korottaa laskuharjoituspisteitään, mikäli niitä ei ole riittävästi kurssin läpäisemiseen, tai vaihtoehtoisesti
Luento 8 6.3.2015. Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit
 Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
