(l) B. A(l) + B(l) (s) B. B(s)
|
|
|
- Seppo Karjalainen
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B
2 FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA Kyllästetyssä liuoksessa kiinteä aine on tasapainossa liuenneen aineen kanssa. Merkitään kiinteää ainetta B(s), missä s tulee sanasta solidus ja liuennutta ainetta B(l), missä l = liquidus. Dynaamisessa tasapainossa molekyylejä siirtyy kiinteästä faasista nestefaasiin samalla nopeudella kuin nestefaasista saostuu molekyyejä kiinteäksi faasiksi. B(s) *) B(l): (1) Ajattelemme, mitä tapahtuu kun kiinteä aine liukenee. Sen kidehilan täytyy purkautua ja tähän tarvitaan energiaa. Otamme käsitteen ideaaliliukeneminen, jonka ymmärrämme samaksi kuin sulaminen. Siten ideaaliliukenemisessa ei tarkastella muuta kuin sulamisenergiaa eli molekyylien irroittamiseen kiderakenteesta tarvittavaa energiaa. Ideaaliliukoisuus ja liukoisuus Ideaaliliukoisuuden yhtälö on ln x B = mh m T 1 T Λ ; (2) missä mh m on sulamisprosessissa tarvittava moolientalpia (jota voidaan kutsua differentiaaliseksi liukenemislämmöksi), T Λ aineen B sulamispiste ja T on lämpötila missä liukoisuus mitataan. Tästä yhtälöstä voidaan laskea ideaaliliukoisuus ln x B. Aineen B liukoisuus vähenee eksponenttiaalisesti kun lämpötilaa alennetaan sen sulamispisteestä. Yhtälöstä (2) voidaan myös saada käyttökelpoinen kun verrataan kahta eri lämpötilaa T ja T 0 sekä mooliosuuksia x B ja x 0 B vähentämällä nämä kaksi yhtälön (2) muotoista yhtälöä toisistaan ln x B x 0 B = mh m;b T 1 T 0 ; (3); missä moolientalpia on täsmennetty aineen B liukenemisesta johtuvaksi. Yhtälö (2) voidaan esittää myös differentiaalimuodossa ja käyttäen mooliosuuden x asemesta molaalisuutta m S ; missä S tarkoittaa mooliosuutta kyllästetyssä liuoksessa d ln m mh m;b S = d 2 T ; (4)
3 1 Siten piirtämällä ln m S :n funktiona saadaan lämpötilaa T vastaava differentiaalinen liukenemislämpö määritettyä kulmakertoimesta T mhm : Liukoisuus ilmoitetaan tavallisesti painomoolisuutena eli molaalisuutena (m) mooliosuuden asemesta, myös joskus grammoina 100 g kohti liuotinta. Koska kemialliset potentiaalit reaalisissa tapauksissa riippuvat aktiivisuuksista, niin poikkeamia ideaalisuudesta on odotettavissa. 1 Ideaaliliukoisuuden muutos lampotilan muuttuessa eri kayrat saatu erilaisilla sulamisentalpioilla pieni entalpia Liukoisuus x2 0.5 suuri T/T* Partiaaliset moolisuureet ja liukenemislämmöt Partiaaliset moolisuureet, kuten kemiallinen potentiaali, ovat intensiivisuureita. Erään partiaalisen moolisuureen Y m arvomuodostuu komponenttien n i Y mi summasta. Gibbs- Duhemin yhtälö kertoo, P että komponenttien partiaaliset suureet eivät ole toisistaan riippumattomia, vaan i dy m i = 0: Seuraavaa terminologiaa käytetään liuos entalpioiden yhteydessä. Sekoitusentalpiaa jaettuna ainemäärällä H mix kutsutaan integraaliseksi liukenemislämmöksi. Integraalinen liukenemislämpö on lämpösisällön n B kokonaismuutos kun mooli puhdasta ainetta liuotetaan isotermisesti n mooliin puhdasta liuotinta syntyvässä loppukonsentraatiossa. Differentiaalinen liukenemislämpö 3
4 määritellään Hmix H diff;b = H m;b H Λ m;b = B!T;p;nA missä entalpiaerotus sekoitusprosessille on (H m;b H Λ m;b )dn B: Differentiaalinen liukenemislämpö ilmoittaa lämpösisällön muutoksen kun mooli ainetta liuotetaan niin suureen määrään liuosta, ettei konsentraatio lisäyksen johdosta muutu. 2. TYÖN SUOITUS Työssä määritetään meripihkahapon (CH 2 COOH) 2 liukoisuuskäyrä välillä 313 K K ja sen differentiaalinen liukenemislämpö standarditilassa. Olennaista kokeen onnistumiselle on, että mitattava systeemi on aina kyllästetyssä tilassa. Se merkitsee sitä, että jokaisessa lämpötilassa on dynaaminen tasapaino ja että aina on läsnä kumpaakin faasia sekä liuosta että kiinteää ainetta, muuten liukoisuus ei noudata logaritmistä funktiota. Myös sen vuoksi aloitat kokeen temperoimalla kyllästettyä liuosta 333 K ja lisäät tarpeen mukaan kiinteätä meripihkahappoa systeemiin. Viisi kaksoismittausta suoritetaan alkaen 313 K lämpötilasta alaspäin noin kymmenen asteen välein. Tarkka lämpötila otetaan ±0:1 asteen tarkkuudella. Kun määrität liukoisuutta 273 K lämpötilassa älä temperoi isossa altaassa vaan ota pienempi astia, esim. alumiinikattila, johon panet jäät. Otetaan näyte (10 ml) kussakin lämpötilassa temperoituneesta liuoksesta 10 ml (1 ml = 1 cm 3 ) pipetillä, joka on lämmitetty lämpökaapissa hiukan mittauslämpötilaa korkeammassa lämpötilassa. Näyte lasketaan heti pipetistä taarattuun 100 ml erlenmayeriin ja näyteen massa punnitaan. Näyte titrataan samassa erlenmayerissa käyttäen 0.5 M NaOH emäksenä ja fenoliflaleiiniä indikaattorina. Kussakin lämpötilassa tehdään kaksi määritystä virheen saamiseksi. Mittauspöytäkirjassa ilmoitetaan NaOH liuoksen tarkistettu konsentraatio ja tarkistustapa sekä tarkat lämpötilat, punnitus- ja titraustulokset. 4
5 3. TULOSTEN KÄSITTELY Tulokset esitetään taulukon muodossa rinnakkaisnäytteet alekkain: näyte T=K 1 T 10 3 liuoksen massa / g kulutus NAOH/ml hapon massa g/10 ml jne Λ taulukko jatkuu näyte veden massa kg/ 10 ml hapon ja veden massasuhde g/kg m S m S ln m S jne NaOH liuoksen tarkistus lasku ja ensimmäisestä näytteestä yksityiskohtaiset laskut näkyviin. Kirjoita myös neutraloitumisreaktio ja laske hapon konsentraatio. 1 Piirretään ln m S funktiona ja määritetään kulmakerroin. Piirretään virhesuorat, T joista saadaan virherajat. Näistä edelleen mh m;b ja sen virhe. Piirretään hapon ja veden massasuhde g/kg m S lämpötilan funktiona ja määritetään kuvaajasta meripihkahapon liukoisuus standarditilassa 298 K g/kg H 2 O ja verrataan kirjallisuusarvoon. 4. SYVENTÄVIÄ KYSYMYKSIÄ 1. Mitä tapahtuu kiinteän aineen liuetessa? 2. Mikä ero on differentiaalisella ja integraalisella liukenemislämöllä? 3. Arvioi kuinka paljon virhettä johtuu siitä ettei tehollista konsentraatiota eli aktiivisuutta käytetty funktion piirtämisessä. 4. Perustele miksi metodi sopii suhteellisen niukkaliukoiselle yhdisteelle muttei suoloille. 5. Mistä johtuu joidenkin aineiden liukoisuuden suuret muutokset lämpötilan muuttuessa? 6. Mieti kuinka kaasu liukenee nesteeseen eri lämpötiloissa 5
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt
 KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen
 KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos
 ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
Valitse seuraavista joko tehtävä 1 tai 2
 PHYS-A0120 Termodynamiikka, syksy 2016 Kotitentti Vastaa tehtäviin 1/2, 3, 4/5, 6/7, 8 ja 9 (yhteensä kuusi vastausta). Tehtävissä 1 ja 2 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
PHYS-A0120 Termodynamiikka, syksy 2016 Kotitentti Vastaa tehtäviin 1/2, 3, 4/5, 6/7, 8 ja 9 (yhteensä kuusi vastausta). Tehtävissä 1 ja 2 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta.
 Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
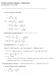 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
Faasipiirrokset, osa 2 Binääristen piirrosten tulkinta
 Faasipiirrokset, osa 2 Binääristen piirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 4 Tavoite Oppia tulkitsemaan 2-komponenttisysteemien faasipiirroksia 1 Binääriset
Faasipiirrokset, osa 2 Binääristen piirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 4 Tavoite Oppia tulkitsemaan 2-komponenttisysteemien faasipiirroksia 1 Binääriset
kuonasula metallisula Avoin Suljettu Eristetty S / Korkealämpötilakemia Termodynamiikan peruskäsitteitä
 Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
Eksimeerin muodostuminen
 Fysikaalisen kemian Syventävät-laboratoriotyöt Eksimeerin muodostuminen 02-2010 Työn suoritus Valmista pyreenistä C 16 H 10 (molekyylimassa M = 202,25 g/mol) 1*10-2 M liuos metyylisykloheksaaniin.
Fysikaalisen kemian Syventävät-laboratoriotyöt Eksimeerin muodostuminen 02-2010 Työn suoritus Valmista pyreenistä C 16 H 10 (molekyylimassa M = 202,25 g/mol) 1*10-2 M liuos metyylisykloheksaaniin.
Helsingin yliopisto/tampereen yliopisto Henkilötunnus - Molekyylibiotieteet/Bioteknologia Etunimet valintakoe Tehtävä 3 Pisteet / 30
 Helsingin yliopisto/tampereen yliopisto Henkilötunnus - hakukohde Sukunimi Molekyylibiotieteet/Bioteknologia Etunimet valintakoe 20.5.2013 Tehtävä 3 Pisteet / 30 3. Osa I: Stereokemia a) Piirrä kaikki
Helsingin yliopisto/tampereen yliopisto Henkilötunnus - hakukohde Sukunimi Molekyylibiotieteet/Bioteknologia Etunimet valintakoe 20.5.2013 Tehtävä 3 Pisteet / 30 3. Osa I: Stereokemia a) Piirrä kaikki
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
Ohjeellinen pituus: 2 3 sivua. Vastaa joko tehtävään 2 tai 3
 PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
Luku 13 KAASUSEOKSET
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2010 Luku 13 KAASUSEOKSET Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2010 Luku 13 KAASUSEOKSET Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction
5 LIUOKSEN PITOISUUS Lisätehtävät
 LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
Palautus yhtenä tiedostona PDF-muodossa viimeistään torstaina
 PHYS-A0120 Termodynamiikka, syksy 2018 Kotitentti Vastaa tehtäviin 1/2/3, 4, 5/6, 7/8, 9 (yhteensä viisi vastausta). Tehtävissä 1, 2, 3 ja 9 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
PHYS-A0120 Termodynamiikka, syksy 2018 Kotitentti Vastaa tehtäviin 1/2/3, 4, 5/6, 7/8, 9 (yhteensä viisi vastausta). Tehtävissä 1, 2, 3 ja 9 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen
 KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
c) Nimeä kaksi alkuainetta, jotka kuuluvat jaksollisessa järjestelmässä samaan ryhmään kalsiumin kanssa.
 Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Aineopintojen laboratoriotyöt 1. Veden ominaislämpökapasiteetti
 Aineopintojen laboratoriotyöt 1 Veden ominaislämpökapasiteetti Aki Kutvonen Op.nmr 013185860 assistentti: Marko Peura työ tehty 19.9.008 palautettu 6.10.008 Sisällysluettelo Tiivistelmä...3 Johdanto...3
Aineopintojen laboratoriotyöt 1 Veden ominaislämpökapasiteetti Aki Kutvonen Op.nmr 013185860 assistentti: Marko Peura työ tehty 19.9.008 palautettu 6.10.008 Sisällysluettelo Tiivistelmä...3 Johdanto...3
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
Tärkeitä tasapainopisteitä
 Tietoa tehtävistä Tasapainopiirrokseen liittyviä käsitteitä Tehtävä 1 rajojen piirtäminen Tehtävä 2 muunnos atomi- ja painoprosenttien välillä Tehtävä 3 faasien koostumus ja määrät Tehtävä 4 eutektinen
Tietoa tehtävistä Tasapainopiirrokseen liittyviä käsitteitä Tehtävä 1 rajojen piirtäminen Tehtävä 2 muunnos atomi- ja painoprosenttien välillä Tehtävä 3 faasien koostumus ja määrät Tehtävä 4 eutektinen
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
Chem-C2400 Luento 3: Faasidiagrammit Ville Jokinen
 Chem-C2400 Luento 3: Faasidiagrammit 16.1.2019 Ville Jokinen Oppimistavoitteet Faasidiagrammit ja mikrorakenteen muodostuminen Kahden komponentin faasidiagrammit Sidelinja ja vipusääntö Kolmen faasin reaktiot
Chem-C2400 Luento 3: Faasidiagrammit 16.1.2019 Ville Jokinen Oppimistavoitteet Faasidiagrammit ja mikrorakenteen muodostuminen Kahden komponentin faasidiagrammit Sidelinja ja vipusääntö Kolmen faasin reaktiot
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Sähkökemian perusteita, osa 1
 Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Osio 1. Laskutehtävät
 Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Liukeneminen 31.8.2016
 Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
LUKU 16 KEMIALLINEN JA FAASITASAPAINO
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 LUKU 16 KEMIALLINEN JA FAASITASAPAINO Copyright The McGraw-Hill Companies, Inc. Permission required
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 LUKU 16 KEMIALLINEN JA FAASITASAPAINO Copyright The McGraw-Hill Companies, Inc. Permission required
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
Faasi: Aineen tila, jonka kemiallinen koostumus ja fysikaalinen ominaisuudet ovat homogeeniset koko näytteessä. P = näytteen faasien lukumäärä.
 FAASIDIAGRAMMIT Määritelmiä Faasi: Aineen tila, jonka kemiallinen koostumus ja fysikaalinen ominaisuudet ovat homogeeniset koko näytteessä. P = näytteen faasien lukumäärä. Esimerkkejä: (a) suolaliuos (P=1),
FAASIDIAGRAMMIT Määritelmiä Faasi: Aineen tila, jonka kemiallinen koostumus ja fysikaalinen ominaisuudet ovat homogeeniset koko näytteessä. P = näytteen faasien lukumäärä. Esimerkkejä: (a) suolaliuos (P=1),
Liukoisuus
 Liukoisuus REAKTIOT JA TASAPAINO, KE5 Kertausta: Eri suolojen liukeneminen veteen on tärkeä arkipäivän ilmiö. Yleensä suolan liukoisuus veteen kasvaa, kun lämpötila nousee. Tosin esimerkiksi kalsiumkarbonaatti,
Liukoisuus REAKTIOT JA TASAPAINO, KE5 Kertausta: Eri suolojen liukeneminen veteen on tärkeä arkipäivän ilmiö. Yleensä suolan liukoisuus veteen kasvaa, kun lämpötila nousee. Tosin esimerkiksi kalsiumkarbonaatti,
KE5 Kurssikoe Kastellin lukio 2012 Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko.
 KE5 Kurssikoe Kastellin lukio 01 Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko. 1. a) Selvitä, mitä tarkoitetaan seuraavilla käsitteillä lyhyesti sanallisesti ja esimerkein: 1) heikko happo polyproottinen
KE5 Kurssikoe Kastellin lukio 01 Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko. 1. a) Selvitä, mitä tarkoitetaan seuraavilla käsitteillä lyhyesti sanallisesti ja esimerkein: 1) heikko happo polyproottinen
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
Luku 5. Yksinkertaiset seokset
 Luku 5. Yksinkertaiset seokset Seosten termodynamiikkaan lii5yy joukko par8aalisia moolisuureita Par8aalinen mooli8lavuus kuvaa 8lavuuden muutosta kun mooli aine5a (J) lisätään seokseen " V J = V % $ '
Luku 5. Yksinkertaiset seokset Seosten termodynamiikkaan lii5yy joukko par8aalisia moolisuureita Par8aalinen mooli8lavuus kuvaa 8lavuuden muutosta kun mooli aine5a (J) lisätään seokseen " V J = V % $ '
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
CHEM-C2230 Pintakemia. Työ 2: Etikkahapon adsorptio aktiivihiileen. Työohje
 CHEM-C2230 Pintakemia Tö 2: Etikkahapon orptio aktiivihiileen Töohje 1 Johdanto Kaasun ja kiinteän aineen rajapinnalla tapahtuu leensä kaasun orptiota. Mös liuoksissa tapahtuu usein liuenneen aineen orptiota
CHEM-C2230 Pintakemia Tö 2: Etikkahapon orptio aktiivihiileen Töohje 1 Johdanto Kaasun ja kiinteän aineen rajapinnalla tapahtuu leensä kaasun orptiota. Mös liuoksissa tapahtuu usein liuenneen aineen orptiota
Seokset ja liuokset. 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen
 Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
. Veden entropiamuutos lasketaan isobaariselle prosessille yhtälöstä
 LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
LIITE 1 VIRHEEN ARVIOINNISTA
 Oulun yliopisto Fysiikan opetuslaboratorio Fysiikan laboratoriotyöt 1 1 LIITE 1 VIRHEEN RVIOINNIST Mihin tarvitset virheen arviointia? Mittaustuloksiin sisältyy aina virhettä, vaikka mittauslaite olisi
Oulun yliopisto Fysiikan opetuslaboratorio Fysiikan laboratoriotyöt 1 1 LIITE 1 VIRHEEN RVIOINNIST Mihin tarvitset virheen arviointia? Mittaustuloksiin sisältyy aina virhettä, vaikka mittauslaite olisi
ln2, missä ν = 1mol. ja lopuksi kaasun saama lämpömäärä I pääsäännön perusteella.
 S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
VESI JA VESILIUOKSET
 VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
Kuva 1. Ohmin lain kytkentäkaavio. DC; 0 6 V.
 TYÖ 37. OHMIN LAKI Tehtävä Tutkitaan metallijohtimen päiden välille kytketyn jännitteen ja johtimessa kulkevan sähkövirran välistä riippuvuutta. Todennetaan kokeellisesti Ohmin laki. Välineet Tasajännitelähde
TYÖ 37. OHMIN LAKI Tehtävä Tutkitaan metallijohtimen päiden välille kytketyn jännitteen ja johtimessa kulkevan sähkövirran välistä riippuvuutta. Todennetaan kokeellisesti Ohmin laki. Välineet Tasajännitelähde
Teddy 2. välikoe kevät 2008
 Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Korkealämpötilakemia
 1.11.217 Korkealämpötilakemia Standarditilat Ti 1.11.217 klo 8-1 SÄ11 Tavoite Tutustua standarditiloihin liuosten termodynaamisessa mallinnuksessa Miksi? Millaisia? Miten huomioidaan tasapainotarkasteluissa?
1.11.217 Korkealämpötilakemia Standarditilat Ti 1.11.217 klo 8-1 SÄ11 Tavoite Tutustua standarditiloihin liuosten termodynaamisessa mallinnuksessa Miksi? Millaisia? Miten huomioidaan tasapainotarkasteluissa?
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
KERTAUS KERTAUSTEHTÄVIÄ K1. P( 1) = 3 ( 1) + 2 ( 1) ( 1) 3 = = 4
 KERTAUS KERTAUSTEHTÄVIÄ K1. P( 1) = 3 ( 1) + ( 1) + 3 ( 1) 3 = 3 + 3 = 4 K. a) x 3x + 7x 5x = 4x + 4x b) 5x 3 (1 x ) = 5x 3 1 + x = 6x 4 c) (x + 3)(x 4) = x 3 4x + 3x 1 = x 3 + 3x 4x 1 Vastaus: a) 4x +
KERTAUS KERTAUSTEHTÄVIÄ K1. P( 1) = 3 ( 1) + ( 1) + 3 ( 1) 3 = 3 + 3 = 4 K. a) x 3x + 7x 5x = 4x + 4x b) 5x 3 (1 x ) = 5x 3 1 + x = 6x 4 c) (x + 3)(x 4) = x 3 4x + 3x 1 = x 3 + 3x 4x 1 Vastaus: a) 4x +
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
Standarditilat. Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 2 - Luento 2. Tutustua standarditiloihin
 Standarditilat Ilmiömallinnus prosessimetallurgiassa Syksy 216 Teema 2 - Luento 2 Tavoite Tutustua standarditiloihin Miksi käytössä? Millaisia käytössä? Miten huomioitava tasapainotarkasteluissa? 1 Miten
Standarditilat Ilmiömallinnus prosessimetallurgiassa Syksy 216 Teema 2 - Luento 2 Tavoite Tutustua standarditiloihin Miksi käytössä? Millaisia käytössä? Miten huomioitava tasapainotarkasteluissa? 1 Miten
Korkealämpötilakemia
 Korkealämpötilakemia Binääriset tasapainopiirrokset To 30.10.2017 klo 8-10 SÄ114 Tavoite Oppia lukemaan ja tulkitsemaan binäärisiä tasapainopiirroksia 1 Sisältö Hieman kertausta - Gibbsin vapaaenergian
Korkealämpötilakemia Binääriset tasapainopiirrokset To 30.10.2017 klo 8-10 SÄ114 Tavoite Oppia lukemaan ja tulkitsemaan binäärisiä tasapainopiirroksia 1 Sisältö Hieman kertausta - Gibbsin vapaaenergian
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
LÄÄKETEHTAAN UUMENISSA
 LÄÄKETEHTAAN UUMENISSA KOHDERYHMÄ: Soveltuu lukion KE1- ja KE3-kurssille. KESTO: n. 1h MOTIVAATIO: Työskentelet lääketehtaan laadunvalvontalaboratoriossa. Tuotantolinjalta on juuri valmistunut erä aspiriinivalmistetta.
LÄÄKETEHTAAN UUMENISSA KOHDERYHMÄ: Soveltuu lukion KE1- ja KE3-kurssille. KESTO: n. 1h MOTIVAATIO: Työskentelet lääketehtaan laadunvalvontalaboratoriossa. Tuotantolinjalta on juuri valmistunut erä aspiriinivalmistetta.
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Heikot sidokset voimakkuusjärjestyksessä: -Sidos poolinen, kun el.neg.ero on 0,5-1,7. -Poolisuus merkitään osittaisvarauksilla
 Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
Kemiallinen tasapaino 3: Puskuriliuokset Liukoisuustulo. Luento 8 CHEM-A1250
 Kemiallinen tasapaino 3: Puskuriliuokset Liukoisuustulo Luento 8 CHEM-A1250 Puskuriliuokset Puskuriliuos säilyttää ph:nsa, vaikka liuosta väkevöidään tai laimennetaan tai siihen lisätään pieniä määriä
Kemiallinen tasapaino 3: Puskuriliuokset Liukoisuustulo Luento 8 CHEM-A1250 Puskuriliuokset Puskuriliuos säilyttää ph:nsa, vaikka liuosta väkevöidään tai laimennetaan tai siihen lisätään pieniä määriä
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Työ 1: ph-indikaattorin tasapainovakion arvon määrittäminen spektrofotometrisesti
 CHEM-C2200 Kemiallinen termodynamiikka Työ 1: ph-indikaattorin tasapainovakion arvon määrittäminen spektrofotometrisesti Työohje 1 Johdanto Happo-emäsindikaattorina käytetty bromitymolisininen muuttaa
CHEM-C2200 Kemiallinen termodynamiikka Työ 1: ph-indikaattorin tasapainovakion arvon määrittäminen spektrofotometrisesti Työohje 1 Johdanto Happo-emäsindikaattorina käytetty bromitymolisininen muuttaa
Oppikirjan tehtävien ratkaisut
 Oppikirjan tehtävien ratkaisut Liukoisuustulon käyttö 10. a) Selitä, mitä eroa on käsitteillä liukoisuus ja liukoisuustulo. b) Lyijy(II)bromidin PbBr liukoisuus on 1,0 10 mol/dm. Laske lyijy(ii)bromidin
Oppikirjan tehtävien ratkaisut Liukoisuustulon käyttö 10. a) Selitä, mitä eroa on käsitteillä liukoisuus ja liukoisuustulo. b) Lyijy(II)bromidin PbBr liukoisuus on 1,0 10 mol/dm. Laske lyijy(ii)bromidin
Ainemäärien suhteista laskujen kautta aineiden määriin
 REAKTIOT JA ENERGIA, KE3 Ainemäärien suhteista laskujen kautta aineiden määriin Mitä on kemia? Kemia on reaktioyhtälöitä, ja niiden tulkitsemista. Ollaan havaittu, että reaktioyhtälöt kertovat kemiallisen
REAKTIOT JA ENERGIA, KE3 Ainemäärien suhteista laskujen kautta aineiden määriin Mitä on kemia? Kemia on reaktioyhtälöitä, ja niiden tulkitsemista. Ollaan havaittu, että reaktioyhtälöt kertovat kemiallisen
Biomolekyylit ja biomeerit
 Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
LIITE 1 VIRHEEN ARVIOINNISTA
 1 Mihin tarvitset virheen arviointia? Mittaustuloksiin sisältyy aina virhettä, vaikka mittauslaite olisi miten uudenaikainen tai kallis tahansa ja mittaaja olisi alansa huippututkija Tästä johtuen mittaustuloksista
1 Mihin tarvitset virheen arviointia? Mittaustuloksiin sisältyy aina virhettä, vaikka mittauslaite olisi miten uudenaikainen tai kallis tahansa ja mittaaja olisi alansa huippututkija Tästä johtuen mittaustuloksista
JÄÄTYMISPISTEEN ALENEMA Johdanto. 2 Termodynaaminen tausta
 JÄÄTYMISPISTEEN ALENEMA 2-2010 1 Johdanto Kolligatiiviset ominaisuudet ovat liuosten ominaisuuksia, jotka riippuvat ainoastaan liuotetun aineen määrästä (konsentraatiosta) ei sen laadusta. Kolligatiivisia
JÄÄTYMISPISTEEN ALENEMA 2-2010 1 Johdanto Kolligatiiviset ominaisuudet ovat liuosten ominaisuuksia, jotka riippuvat ainoastaan liuotetun aineen määrästä (konsentraatiosta) ei sen laadusta. Kolligatiivisia
Sarake 1 Sarake 2 Sarake 3 Sarake 4. Vahvistumisen jälkeen tavaran hinta on 70. Uusi tilavuus on
 AMMATTIKORKEAKOULUJEN TEKNIIKAN VALINTAKOE 1/5 TEHTÄVÄOSA / Ongelmanratkaisu 1.6. 2017 TEHTÄVÄOSA ONGELMANRATKAISU Vastaa kullekin tehtävälle varatulle ratkaisusivulle. Vastauksista tulee selvitä tehtävien
AMMATTIKORKEAKOULUJEN TEKNIIKAN VALINTAKOE 1/5 TEHTÄVÄOSA / Ongelmanratkaisu 1.6. 2017 TEHTÄVÄOSA ONGELMANRATKAISU Vastaa kullekin tehtävälle varatulle ratkaisusivulle. Vastauksista tulee selvitä tehtävien
TKK, TTY, LTY, OY, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 31.5.2006
 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
Kemiaa tekemällä välineitä ja työmenetelmiä
 Opiskelijalle 1/4 Kemiaa tekemällä välineitä ja työmenetelmiä Ennen työn aloittamista huomioi seuraavaa Tarkista, että sinulla on kaikki tarvittavat aineet ja välineet. Kirjaa tulokset oikealla tarkkuudella
Opiskelijalle 1/4 Kemiaa tekemällä välineitä ja työmenetelmiä Ennen työn aloittamista huomioi seuraavaa Tarkista, että sinulla on kaikki tarvittavat aineet ja välineet. Kirjaa tulokset oikealla tarkkuudella
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
LIITE 1 VIRHEEN ARVIOINNISTA
 1 LIITE 1 VIRHEEN ARVIOINNISTA Mihin tarvitset virheen arviointia? Mittaustulokset ovat aina todellisten luonnonvakioiden ja tutkimuskohdetta kuvaavien suureiden likiarvoja, vaikka mittauslaite olisi miten
1 LIITE 1 VIRHEEN ARVIOINNISTA Mihin tarvitset virheen arviointia? Mittaustulokset ovat aina todellisten luonnonvakioiden ja tutkimuskohdetta kuvaavien suureiden likiarvoja, vaikka mittauslaite olisi miten
Luku 5: Diffuusio kiinteissä aineissa
 Luku 5: Diffuusio kiinteissä aineissa Käsiteltävät aiheet... Mitä on diffuusio? Miksi sillä on tärkeä merkitys erilaisissa käsittelyissä? Miten diffuusionopeutta voidaan ennustaa? Miten diffuusio riippuu
Luku 5: Diffuusio kiinteissä aineissa Käsiteltävät aiheet... Mitä on diffuusio? Miksi sillä on tärkeä merkitys erilaisissa käsittelyissä? Miten diffuusionopeutta voidaan ennustaa? Miten diffuusio riippuu
KEMIAN MIKROMAAILMA, KE2 VESI
 VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
KALIUMPERMANGANAATIN KULUTUS
 sivu 1/6 Kohderyhmä: Työ on suunniteltu lukiolaisille Aika: n. 1h + laskut KALIUMPERMANGANAATIN KULUTUS TAUSTATIEDOT tarkoitaa veden sisältämien kemiallisesti hapettuvien orgaanisten aineiden määrää. Koeolosuhteissa
sivu 1/6 Kohderyhmä: Työ on suunniteltu lukiolaisille Aika: n. 1h + laskut KALIUMPERMANGANAATIN KULUTUS TAUSTATIEDOT tarkoitaa veden sisältämien kemiallisesti hapettuvien orgaanisten aineiden määrää. Koeolosuhteissa
Reaktiot ja tasapaino
 Reaktiot ja tasapaino Kurssi 5, KE5 Kurssin yleiset tiedot Kurssi 5 (syventävä): Reaktiot ja tasapaino Tunnit (45min ja 1,5h): ma 14:10 14:55, ke 08:00 09:50, to 11:20 12:05 ja 14:10 14:55 pe 14:10 14:55
Reaktiot ja tasapaino Kurssi 5, KE5 Kurssin yleiset tiedot Kurssi 5 (syventävä): Reaktiot ja tasapaino Tunnit (45min ja 1,5h): ma 14:10 14:55, ke 08:00 09:50, to 11:20 12:05 ja 14:10 14:55 pe 14:10 14:55
KE5 Kurssikoe Kastellin lukio 2014
 KE5 Kurssikoe Kastellin lukio 014 Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko. 1. a) Selvitä, mitä tarkoitetaan seuraavilla käsitteillä lyhyesti sanallisesti ja esimerkein: 1) heterogeeninen tasapaino
KE5 Kurssikoe Kastellin lukio 014 Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko. 1. a) Selvitä, mitä tarkoitetaan seuraavilla käsitteillä lyhyesti sanallisesti ja esimerkein: 1) heterogeeninen tasapaino
Termodynaamisten tasapainotarkastelujen tulokset esitetään usein kuvaajina, joissa:
 Lämpötila (Celsius) Luento 9: Termodynaamisten tasapainojen graafinen esittäminen, osa 1 Tiistai 17.10. klo 8-10 Termodynaamiset tasapainopiirrokset Termodynaamisten tasapainotarkastelujen tulokset esitetään
Lämpötila (Celsius) Luento 9: Termodynaamisten tasapainojen graafinen esittäminen, osa 1 Tiistai 17.10. klo 8-10 Termodynaamiset tasapainopiirrokset Termodynaamisten tasapainotarkastelujen tulokset esitetään
Neutraloituminen = suolan muodostus
 REAKTIOT JA TASAPAINO, KE5 Neutraloituminen = suolan muodostus Taustaa: Tähän asti ollaan tarkasteltu happojen ja emästen vesiliuoksia erikseen, mutta nyt tarkastellaan mitä tapahtuu, kun happo ja emäs
REAKTIOT JA TASAPAINO, KE5 Neutraloituminen = suolan muodostus Taustaa: Tähän asti ollaan tarkasteltu happojen ja emästen vesiliuoksia erikseen, mutta nyt tarkastellaan mitä tapahtuu, kun happo ja emäs
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Puhtaat aineet ja seokset
 Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
KALKINPOISTOAINEET JA IHOMME
 KALKINPOISTOAINEET JA IHOMME Martta asuu kaupungissa, jossa vesijohtovesi on kovaa 1. Yksi kovan veden Martalle aiheuttama ongelma ovat kalkkisaostumat (kalsiumkarbonaattisaostumat), joita syntyy kylpyhuoneeseen
KALKINPOISTOAINEET JA IHOMME Martta asuu kaupungissa, jossa vesijohtovesi on kovaa 1. Yksi kovan veden Martalle aiheuttama ongelma ovat kalkkisaostumat (kalsiumkarbonaattisaostumat), joita syntyy kylpyhuoneeseen
Molaariset ominaislämpökapasiteetit
 Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
782630S Pintakemia I, 3 op
 782630S Pintakemia I, 3 op Ulla Lassi Puh. 0400-294090 Sposti: ulla.lassi@oulu.fi Tavattavissa: KE335 (ma ja ke ennen luentoja; Kokkolassa huone 444 ti, to ja pe) Prof. Ulla Lassi Opintojakson toteutus
782630S Pintakemia I, 3 op Ulla Lassi Puh. 0400-294090 Sposti: ulla.lassi@oulu.fi Tavattavissa: KE335 (ma ja ke ennen luentoja; Kokkolassa huone 444 ti, to ja pe) Prof. Ulla Lassi Opintojakson toteutus
joka voidaan määrittää esim. värinmuutosta seuraamalla tai lukemalla
 REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
2CHEM-A1210 Kemiallinen reaktio Kevät 2017 Laskuharjoitus 7.
 HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
Lämpö- eli termokemiaa
 Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Reaktiot ja tasapaino
 Kurssi 5, KE5 Kurssin yleiset tiedot Kurssi 5 (syventävä/ohjattu tenttiminen*): Tunnit (ohjausajat ja labrat 1,5h): labrat: ke 12:15 14:00, ohjausajat: ti 14-15 ja pe 10-11 sopiiko? Kurssikirja: Reaktio
Kurssi 5, KE5 Kurssin yleiset tiedot Kurssi 5 (syventävä/ohjattu tenttiminen*): Tunnit (ohjausajat ja labrat 1,5h): labrat: ke 12:15 14:00, ohjausajat: ti 14-15 ja pe 10-11 sopiiko? Kurssikirja: Reaktio
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
SAIPPUALIUOKSEN SÄHKÖKEMIA 09-2009 JOHDANTO
 SAIPPUALIUOKSEN SÄHKÖKEMIA 09-009 JOHDANTO 1 lainaus ja kuvat lähteestä: Työssä tutkitaan johtokyky- ja ph-mittauksilla tavallisen palasaippuan kemiallista koostumusta ja misellien ja aggregaattien muodostumista
SAIPPUALIUOKSEN SÄHKÖKEMIA 09-009 JOHDANTO 1 lainaus ja kuvat lähteestä: Työssä tutkitaan johtokyky- ja ph-mittauksilla tavallisen palasaippuan kemiallista koostumusta ja misellien ja aggregaattien muodostumista
KEMA221 2009 KEMIALLINEN TASAPAINO ATKINS LUKU 7
 KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
Työ 1: ph-indikaattorin tasapainovakion arvon määrittäminen spektrofotometrisesti
 CHEM-C2200 Kemiallinen termodynamiikka Työ 1: ph-indikaattorin tasapainovakion arvon määrittäminen spektrofotometrisesti Työohje 1 Johdanto Happo-emäsindikaattorina käytetty bromitymolisininen muuttaa
CHEM-C2200 Kemiallinen termodynamiikka Työ 1: ph-indikaattorin tasapainovakion arvon määrittäminen spektrofotometrisesti Työohje 1 Johdanto Happo-emäsindikaattorina käytetty bromitymolisininen muuttaa
