Ellinghamin diagrammit
|
|
|
- Aino Hänninen
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Ellinghamin diagrammit Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 2 Tavoite Oppia tulkitsemaan (ja laatimaan) vapaaenergiapiirroksia eli Ellinghamdiagrammeja 1
2 Tasapainopiirrokset Tasapaino- eli stabiilisuuspiirrokset Kuvaavat graafisesti eri faasien keskinäisiä stabiilisuuksia olosuhteiden funktiona Koostumus-lämpötila-piirrokset Tasapaino- tai faasipiirrokset Potentiaali-potentiaali-piirrokset E-pH-piirrokset (Pourbaix) Vapaaenergiapiirrokset (Ellingham) Vallitsevuusaluekaaviot (Kellogg) Kellogg- ja Ellinghamdiagrammien vertailua Ellingham Useiden eri metallien muodostamia yhdisteitä Vain yhdenlaisia yhdisteitä samassa tarkastelussa Kellogg Vain yhden metallin muodostamia yhdisteitä (yleensä) Erilaisia yhdisteitä samassa tarkastelussa 2
3 Kuva: HSC Chemistry. Mikä on Ellinghamin diagrammi? (Yleensä) Puhtaille yhdisteille laadittu kuvaaja, jossa yhdisteiden G f :t on esitetty lämpötilan funktiona Vain yhden tyyppisten yhdisteiden tarkastelu kerrallaan Esim. oksidit, nitridit, karbidit, sulfidit, jne. y-akselina on potentiaalisuure (RTlna i ) Happi-, rikki- ym. potentiaalipiirrokset Vapaaenergiapiirrokset (Ellingham-diagrammit) 3
4 Vapaaenergiapiirroksen laatiminen oksideille Kirjoitetaan yhdisteiden muodostumisreaktiot yhtä happimoolia kohden m Me + O 2 (g) = n Me m/n O 2/n Haetaan reaktioille G 0 R:n arvot Piirretään muodostumisreaktioiden Gibbsin energiat lämpötilan funktiona Puhtaille aineille G 0 R = R T lnp O2 Ei-puhtaille aineille on huomioitava ykkösestä poikkeavat aktiivisuuden arvot Kuvaajassa alin reaktio on spontaanein ja sitä vastaava yhdiste stabiilein Vapaaenergiapiirroksen laatiminen oksideille Oksidien stabiilisuuksia vertailtaessa on niiden muodostumisreaktiot kirjoitettava samaa happimäärää kohden m Me O g n Me O 2 ( ) m / n 2 / n a K a G 0 R Mem no2 n 1 m Me p O2 O2 Sama pätee myös muita yhdisteitä tarkasteltaessa p R T ln K R T ln 1 po R T ln p 2 O2 4
5 Mitä Ellinghamin diagrammista voidaan lukea? Yhdisteiden stabiilisuuksien vertailu eri lämpötiloissa Kaasufaasin tasapainokoostumukset alkuaineen ja sen muodostaman yhdisteen ollessa tasapainossa tietyssä lämpötilassa Yhdisteiden muodostumisreaktioiden H, S ja G Tarvittaessa voidaan laatia kuvaajia myös ei-puhtaille aineille Yhdisteiden keskinäisen stabiilisuuden vertailu eri lämpötiloissa Kuvaajassa alempana olevalla yhdisteellä on negatiivisempi muodostumis-gibbsin energia Eli kuvaajassa alempana oleva yhdiste on stabiilimpi kuin ylempänä oleva yhdiste esim. MnO ja SiO 2 lämpötilassa 1000 C Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. 5
6 Yhdisteiden stabiilisuuksien lämpötilariippuvuudet ovat erilaisia Yhdisteiden keskinäisen stabiilisuus voi vaihtua lämpötilan muuttuessa esim. Na 2 O ja Cr 2 O 3 Kun T < 420 C, niin Na 2 O on stabiilimpi Kun T > 420 C, niin Cr 2 O 3 on stabiilimpi Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. Apuasteikot Apuasteikkojen laatimisesta löytyy aineistoa kurssin www-sivulta Luennolla keskitytään siihen, miten apuasteikkoja luetaan 6
7 Tasapainohapenpaine Hapen osapaine, jolla metalli ja sen muodostama oksidi ovat tasapainossa keskenään Jos hapen osapaine systeemissä on suurempi kuin tasapainohapenpaine Metalli pyrkii hapettumaan (kuluu happea) Jos hapen osapaine systeemissä on pienempi kuin tasapainohapenpaine Oksidi pyrkii pelkistymään (vapautuu happea) Apuasteikot Kuva: Gaskell (1973) Introduction to metallurgical thermodynamics. 7
8 Apuasteikot Kuva: Gaskell (1973) Introduction to metallurgical thermodynamics. Esimerkki: Jos Si ja SiO 2 ovat tasapainossa 1200 C:een lämpötilassa, niin mikä on vallitseva... a)... tasapainohapenpaine? b)... CO/CO 2 -suhde? c)... H 2 /H 2 O-suhde? a) Noin atm b) Noin 10 6 /1 c) Hieman alle 10 6 /1 Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. 8
9 Kuvat: HSC Chemistry. Termodynaamisten suureiden lukeminen kuvaajasta Kuvaajissa on esitetty muodostumis-gibbsin energiat lämpötilan funktiona Ts. G = f(t) Määritelmän mukaan G = H - T S Suoran yhtälö, jossa: H on vakiotermi ja - S on kulmakerroin Kuvaajasta voidaan lukea likiarvot yhdisteiden muodostumisentropioille ja -entalpioille HUOM! Taustalla oletus, että H:n ja S:n arvot eivät riipu lämpötilasta (Ei ole täysin oikein!) Termodynaamisten suureiden lukeminen kuvaajasta H:n ja S:n lämpötilariippuvuudet ovat kuitenkin vähäisiä lukuunottamatta faasimuutoslämpötiloja, joissa muutenkin on taitekohta Ellinghamin diagrammissa kcal/mol Delta H cal/(mol*k) Delta S -200 Si + O2(g) = SiO Al + O2(g) = 2/3 Al2O3-40 Si + O2(g) = SiO2 2 Mg + O2(g) = 2 MgO Al + O2(g) = 2/3 Al2O Ca + O2(g) = 2 CaO Ca + O2(g) = 2 CaO File: -400 Prosessimetallurgian tutkimusryhmä Eetu-Pekka Heikkinen, 2014 Temperature C -100 Mg + O2(g) = 2 MgO -110 Temperature C File: 9
10 Yhdisteen muodostumisreaktion entalpianmuutos Yhdisteen muodostumisentalpia on ko. yhdistettä kuvaavan suoran vakiotermi Ellinghamin diagrammissa Ts. G = f(t) :n saama arvo, kun T = 0 K G f = H f - T S f = H f - 0 S f = H f Jos H f < 0, reaktio on eksoterminen eli lämpöä vapauttava Jos H f > 0, reaktio on endoterminen eli lämpöä sitova Olomuodon muutokset vapaaenergiapiirroksissa Yleisesti: S kaasu > S sula > S kiinteä Lähtöaineen sulaessa tai höyrystyessä Lähtöaineiden entropia kasvaa Reaktioentropia (S R = S Tuotteet - S Lähtöaineet ) pienenee Vapaaenergiakäyrän kulmakerroin (= -S R ) kasvaa Tuotteen (yhdiste) sulaessa tai höyrystyessä Tuotteiden entropia kasvaa Reaktioentropia kasvaa Vapaaenergiakäyrän kulmakerroin pienenee 10
11 Olomuodon muutokset vapaaenergiapiirroksissa Metallin sulaminen kulmakerroin suurenee Metallin höyrystyminen kulmakerroin suurenee Yhdisteen sulaminen kulmakerroin pienenee Yhdisteen höyrystyminen kulmakerroin pienenee Kuva: Gaskell (1973) Introduction to metallurgical thermodynamics. Alkuaineiden ja yhdisteiden sulamis-, höyrystymis-, sublimaatio- ja faasimuutospisteet on merkitty diagrammiin kukin omalla merkinnällä Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. 11
12 Kellogg- ja Ellingham-diagrammien vertailua Ellinghamin diagrammin mukaan Mn:n ja MnO:n välinen tasapainohapenpaine 1000 C:ssa on Vastaava arvo saadaan luonnollisesti luettua myös Kelloggdiagrammista log pso2(g) 50 Mn-O -S Phase Stability Diagram at C Mn2(SO4)3 10 MnS2 MnSO MnS MnO Mn3O4 MnO2 Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. Mn2O3 Mn File: C:\HSC7\Lpp\MnOS1000.ips log po2(g) Aktiivisuuksien huomiointi vapaaenergiapiirroksissa Ellinghamin diagrammi voidaan laatia myös tapauksissa, joissa tarkasteltavat alkuaineet tai yhdisteet eivät ole puhtaita (a < 1) Ykkösestä poikkeavat aktiivisuudet huomioidaan y-akselina olevan RTlnp O2 - termin lausekkeessa 12
13 Aktiivisuuksien huomiointi vapaaenergiapiirroksissa Alkuaineen aktiivisuus laskee Vapaaenergiakäyrä nousee Yhdiste epästabiilimpi Yhdisteen aktiivisuus laskee Vapaaenergiakäyrä laskee Yhdiste stabiilimpi Kuva: Pickering & Batchelor: Am. Ceram. Soc. Bull. 50 (1971) 7, Vapaaenergiapiirrokset muille kuin oksidisille yhdisteille Luennolla on käytetty esimerkkinä oksidien vapaaenergiapiirrosta, koska se on metallurgiassa selkeästi yleisimmin käytetty Vastaavia piirroksia voidaan laatia myös muille yhdisteille kuten sulfideille, sulfaateille, karbideilla, karbonaateille, nitrideille, nitraateille, klorideille, fluorideille, jne. 13
14 Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. Sulfidit Tasapainorikinpaine = Rikin osapaine, jolla metalli ja sen sulfidit ovat keskenään tasapainossa Sulfidien syntyreaktiot kirjoitettava aina samaa rikkimäärää kohden m Me S g n Me S 2 ( ) m / n 2 / n G 0 R R T ln K R T ln 1 Apuasteikot kuvaavat ps R T ln p 2 S2 Rikin osapainetta (p S2 ) kaasussa (fokuspiste S) Kaasun p H2 /p H2S -suhdetta (fokuspiste H) 14
15 Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. Karbidit Karbidien syntyreaktiot kirjoitettava aina samaa hiilimäärää kohden m Me C n Me C m / n 1/ n G 0 R R T ln K R T ln 1 Apuasteikot kuvaavat Hiilen aktiivisuutta (a C ) kaasussa (fokuspiste C) Kaasun (p CO ) 2 /p CO2 -suhdetta (fokuspiste ) Kaasun p CH4 /(p H2 ) 2 -suhdetta (fokuspiste CH4) ac R T ln ac 15
16 Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. Kloridit Kloridien syntyreaktiot kirjoitettava aina samaa kloorimäärää kohden m Me Cl n Me Cl 2 m / n 2 / n G 0 R R T ln K R T ln 1 p R T ln p Cl 2 Cl 2 Nitridit Nitridien syntyreaktiot kirjoitettava aina samaa typpimäärää kohden m Me N n Me N 2 m / n 2 / n G 0 R Apuasteikot kuvaavat R T ln K R T ln 1 pn R T ln p 2 N2 Typen osapainetta (p N2 ) kaasussa (fokuspiste A) Kaasun (p NH3 ) 2 /(p H2 ) 3 -suhdetta (fokuspiste N) 16
17 Kuva: Coudurier et al. (1985) Fundamentals of metallurgical processes. 17
Korkealämpötilakemia
 Korkealämpötilakemia Ellingham-diagrammit To 9.11.2017 klo 8-10 SÄ114 Tavoite Oppia tulkitsemaan (ja laatimaan) vapaaenergiapiirroksia eli Ellinghamdiagrammeja 1 Sisältö Mikä on Ellinghamin diagrammi?
Korkealämpötilakemia Ellingham-diagrammit To 9.11.2017 klo 8-10 SÄ114 Tavoite Oppia tulkitsemaan (ja laatimaan) vapaaenergiapiirroksia eli Ellinghamdiagrammeja 1 Sisältö Mikä on Ellinghamin diagrammi?
Termodynaamisten tasapainotarkastelujen tulokset esitetään usein kuvaajina, joissa:
 Lämpötila (Celsius) Luento 9: Termodynaamisten tasapainojen graafinen esittäminen, osa 1 Tiistai 17.10. klo 8-10 Termodynaamiset tasapainopiirrokset Termodynaamisten tasapainotarkastelujen tulokset esitetään
Lämpötila (Celsius) Luento 9: Termodynaamisten tasapainojen graafinen esittäminen, osa 1 Tiistai 17.10. klo 8-10 Termodynaamiset tasapainopiirrokset Termodynaamisten tasapainotarkastelujen tulokset esitetään
Kellogg-diagrammit. Ilmiömallinnus prosessimetallurgiassa Syksy 2012 Teema 1 - Luento 1
 Kellogg-diagrammit Ilmiömallinnus rosessimetallurgiassa Syksy Teema - Luento Eetu-Pekka Heikkinen, Tavoite Oia tulkitsemaan ja laatimaan ns. Kellogg-diagrammeja eli vallitsevuusaluekaavioita Eetu-Pekka
Kellogg-diagrammit Ilmiömallinnus rosessimetallurgiassa Syksy Teema - Luento Eetu-Pekka Heikkinen, Tavoite Oia tulkitsemaan ja laatimaan ns. Kellogg-diagrammeja eli vallitsevuusaluekaavioita Eetu-Pekka
Kellogg-diagrammit. Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 1
 Kellogg-diagrammit Ilmiömallinnus rosessimetallurgiassa Syksy 6 Teema - Luento Tavoite Oia tulkitsemaan ja laatimaan ns. Kellogg-diagrammeja eli vallitsevuusaluekaavioita Aluksi tutustutaan yleisesti tasaainoiirroksiin
Kellogg-diagrammit Ilmiömallinnus rosessimetallurgiassa Syksy 6 Teema - Luento Tavoite Oia tulkitsemaan ja laatimaan ns. Kellogg-diagrammeja eli vallitsevuusaluekaavioita Aluksi tutustutaan yleisesti tasaainoiirroksiin
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko klo 8-10
 Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
MT Erikoismateriaalit tuotantoprosesseissa (3 op)
 MT-0.6101 Erikoismateriaalit tuotantoprosesseissa (3 op) 6. Luento - Ke 11.11.2015 Reaktiotermodynamiikan käyttö tulenkestävien valinnassa Marko Kekkonen MT-0.6101 Erikoismateriaalit tuotantoprosesseissa
MT-0.6101 Erikoismateriaalit tuotantoprosesseissa (3 op) 6. Luento - Ke 11.11.2015 Reaktiotermodynamiikan käyttö tulenkestävien valinnassa Marko Kekkonen MT-0.6101 Erikoismateriaalit tuotantoprosesseissa
Korkealämpötilakemia
 ..7 Korkealämötilakemia Teema Luento Kellogg-diagrammit To..7 klo 8- SÄ4 Tavoite Oia tulkitsemaan ja laatimaan ns. Kelloggdiagrammeja eli vallitsevuusaluekaavioita Aluksi tutustutaan yleisesti tasaainoiirroksiin
..7 Korkealämötilakemia Teema Luento Kellogg-diagrammit To..7 klo 8- SÄ4 Tavoite Oia tulkitsemaan ja laatimaan ns. Kelloggdiagrammeja eli vallitsevuusaluekaavioita Aluksi tutustutaan yleisesti tasaainoiirroksiin
Faasipiirrokset, osa 2 Binääristen piirrosten tulkinta
 Faasipiirrokset, osa 2 Binääristen piirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 4 Tavoite Oppia tulkitsemaan 2-komponenttisysteemien faasipiirroksia 1 Binääriset
Faasipiirrokset, osa 2 Binääristen piirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 4 Tavoite Oppia tulkitsemaan 2-komponenttisysteemien faasipiirroksia 1 Binääriset
Sähkökemialliset tarkastelut HSC:llä
 Sähkökemialliset tarkastelut HSC:llä Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 4 - Luento 5 Tavoite Oppia hyödyntämään HSC-ohjelmistoa sähkökemiallisissa tarkasteluissa 1 Sisältö Sähkökemiallisiin
Sähkökemialliset tarkastelut HSC:llä Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 4 - Luento 5 Tavoite Oppia hyödyntämään HSC-ohjelmistoa sähkökemiallisissa tarkasteluissa 1 Sisältö Sähkökemiallisiin
Korkealämpötilakemia
 Korkealämpötilakemia Metallurgiset liuosmallit Yleistä To 15.11.218 klo 8-1 PR126A Tavoite Tutustua ideaali- ja reaaliliuosten käsitteisiin Tutustua liuosmalleihin yleisesti - Jaottelu - Hyvän liuosmallin
Korkealämpötilakemia Metallurgiset liuosmallit Yleistä To 15.11.218 klo 8-1 PR126A Tavoite Tutustua ideaali- ja reaaliliuosten käsitteisiin Tutustua liuosmalleihin yleisesti - Jaottelu - Hyvän liuosmallin
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
Sulamisen ja jähmettymisen tarkastelu faasipiirroksia hyödyntäen
 Sulamisen ja jähmettymisen tarkastelu faasipiirroksia hyödyntäen Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 6 Tavoite Oppia muutamien esimerkkien avulla tarkastelemaan monikomponenttisysteemien
Sulamisen ja jähmettymisen tarkastelu faasipiirroksia hyödyntäen Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 6 Tavoite Oppia muutamien esimerkkien avulla tarkastelemaan monikomponenttisysteemien
Sähkökemian perusteita, osa 1
 Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Korkealämpötilakemia
 Korkealämpötilakemia Binääriset tasapainopiirrokset To 30.10.2017 klo 8-10 SÄ114 Tavoite Oppia lukemaan ja tulkitsemaan binäärisiä tasapainopiirroksia 1 Sisältö Hieman kertausta - Gibbsin vapaaenergian
Korkealämpötilakemia Binääriset tasapainopiirrokset To 30.10.2017 klo 8-10 SÄ114 Tavoite Oppia lukemaan ja tulkitsemaan binäärisiä tasapainopiirroksia 1 Sisältö Hieman kertausta - Gibbsin vapaaenergian
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen
 KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Ratkaisu. Tarkastellaan aluksi Fe 3+ - ja Fe 2+ -ionien välistä tasapainoa: Nernstin yhtälö tälle reaktiolle on:
 Esimerkki Pourbaix-piirroksen laatimisesta Laadi Pourbaix-piirros, jossa on esitetty metallisen ja ionisen raudan sekä raudan oksidien stabiilisuusalueet vesiliuoksessa 5 C:een lämpötilassa. Ratkaisu Tarkastellaan
Esimerkki Pourbaix-piirroksen laatimisesta Laadi Pourbaix-piirros, jossa on esitetty metallisen ja ionisen raudan sekä raudan oksidien stabiilisuusalueet vesiliuoksessa 5 C:een lämpötilassa. Ratkaisu Tarkastellaan
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Johdanto laskennalliseen termodynamiikkaan ja mikroluokkaharjoituksiin
 Johdanto laskennalliseen termodynamiikkaan ja mikroluokkaharjoituksiin Torstai 27.10.2016 klo 14-16 Luennon tavoite Tutustua eri tapoihin määrittää termodyn. tasapaino laskennallisesti Tutustua termodynaamisten
Johdanto laskennalliseen termodynamiikkaan ja mikroluokkaharjoituksiin Torstai 27.10.2016 klo 14-16 Luennon tavoite Tutustua eri tapoihin määrittää termodyn. tasapaino laskennallisesti Tutustua termodynaamisten
Standarditilat. Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 2 - Luento 2. Tutustua standarditiloihin
 Standarditilat Ilmiömallinnus prosessimetallurgiassa Syksy 216 Teema 2 - Luento 2 Tavoite Tutustua standarditiloihin Miksi käytössä? Millaisia käytössä? Miten huomioitava tasapainotarkasteluissa? 1 Miten
Standarditilat Ilmiömallinnus prosessimetallurgiassa Syksy 216 Teema 2 - Luento 2 Tavoite Tutustua standarditiloihin Miksi käytössä? Millaisia käytössä? Miten huomioitava tasapainotarkasteluissa? 1 Miten
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin?
 Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
Korkealämpötilakemia
 1.11.217 Korkealämpötilakemia Standarditilat Ti 1.11.217 klo 8-1 SÄ11 Tavoite Tutustua standarditiloihin liuosten termodynaamisessa mallinnuksessa Miksi? Millaisia? Miten huomioidaan tasapainotarkasteluissa?
1.11.217 Korkealämpötilakemia Standarditilat Ti 1.11.217 klo 8-1 SÄ11 Tavoite Tutustua standarditiloihin liuosten termodynaamisessa mallinnuksessa Miksi? Millaisia? Miten huomioidaan tasapainotarkasteluissa?
 mak37135 MAK-37.135 Materiaalien ja prosessien termodynaamis-kineettiset perusteet Tentti 22.2.2001 Vastaa 7:ään kysymykseen 1. Sinun olisi arvioitava hiilettyykö teräs, jonka hiilipitoisuus on 0.35% vai
mak37135 MAK-37.135 Materiaalien ja prosessien termodynaamis-kineettiset perusteet Tentti 22.2.2001 Vastaa 7:ään kysymykseen 1. Sinun olisi arvioitava hiilettyykö teräs, jonka hiilipitoisuus on 0.35% vai
vetyteknologia Polttokennon tyhjäkäyntijännite 1 DEE-54020 Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
* FINAS -akkreditoitu menetelmä. Mittausepävarmuus ilmoitetaan tarvittaessa. Akkreditointi ei koske lausuntoa.
 Pvm: 16.9.2015 Projekti: 1510019970/1 Näytteenottopvm: 8.9.2015 Näytteenottopiste: Alvettula, kaivo Näyte saapui: 8.9.2015 Näytteenottaja: Antti Rehula Analysointi aloitettu: 8.9.2015 Määritys 15TP02480
Pvm: 16.9.2015 Projekti: 1510019970/1 Näytteenottopvm: 8.9.2015 Näytteenottopiste: Alvettula, kaivo Näyte saapui: 8.9.2015 Näytteenottaja: Antti Rehula Analysointi aloitettu: 8.9.2015 Määritys 15TP02480
Entalpia - kuvaa aineen lämpösisältöä - tarvitaan lämpötasetarkasteluissa (usein tärkeämpi kuin sisäenergia)
 Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Johdanto laskennalliseen termodynamiikkaan ja mikroluokkaharjoituksiin
 Johdanto laskennalliseen termodynamiikkaan ja mikroluokkaharjoituksiin Torstai 7.9.2017 klo 8-10 Prosessimetallurgian tutkimusyksikkö Eetu-Pekka Heikkinen, 2017 Luennon tavoite Tutustua eri tapoihin määrittää
Johdanto laskennalliseen termodynamiikkaan ja mikroluokkaharjoituksiin Torstai 7.9.2017 klo 8-10 Prosessimetallurgian tutkimusyksikkö Eetu-Pekka Heikkinen, 2017 Luennon tavoite Tutustua eri tapoihin määrittää
Oikeat vastaukset: Tehtävän tarkkuus on kolme numeroa. Sulamiseen tarvittavat lämmöt sekä teräksen suurin mahdollinen luovutettu lämpö:
 A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
KEMA221 2009 KEMIALLINEN TASAPAINO ATKINS LUKU 7
 KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kertaustehtävien ratkaisut LUKU 2
 Kertaustehtävien ratkaisut LUKU 1. Neutraoitumisen reaktioyhtäö: H (aq) NaOH(aq) Na (aq) H O(). Lasketaan NaOH-iuoksen konsentraatio, kun V(NaOH) 150 m 0,150, m(naoh),40 ja M(NaOH) 39,998. n m Kaavoista
Kertaustehtävien ratkaisut LUKU 1. Neutraoitumisen reaktioyhtäö: H (aq) NaOH(aq) Na (aq) H O(). Lasketaan NaOH-iuoksen konsentraatio, kun V(NaOH) 150 m 0,150, m(naoh),40 ja M(NaOH) 39,998. n m Kaavoista
17VV VV Veden lämpötila 14,2 12,7 14,2 13,9 C Esikäsittely, suodatus (0,45 µm) ok ok ok ok L. ph 7,1 6,9 7,1 7,1 RA2000¹ L
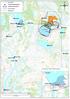 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
17VV VV 01021
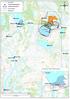 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA!
 ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
Faasipiirrokset, osa 1: Laatiminen sekä 1-komponenttipiirrosten tulkinta
 Faasipiirrokset, osa 1: Laatiminen sekä 1-komponenttipiirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 3 Tavoite Tutustua faasipiirrosten kokeelliseen ja laskennalliseen
Faasipiirrokset, osa 1: Laatiminen sekä 1-komponenttipiirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 3 Tavoite Tutustua faasipiirrosten kokeelliseen ja laskennalliseen
- Termodynaamiset edellytykset - On olemassa ajava voima prosessin tapahtumiselle - Perusta - Kemiallinen potentiaali
 Luento 1: Yleistä kurssista ja sen suorituksesta Tiistai 9.10. klo 10-12 Kemiallisten prosessien edellytykset - Termodynaamiset edellytykset - On olemassa ajava voima prosessin tapahtumiselle - Perusta
Luento 1: Yleistä kurssista ja sen suorituksesta Tiistai 9.10. klo 10-12 Kemiallisten prosessien edellytykset - Termodynaamiset edellytykset - On olemassa ajava voima prosessin tapahtumiselle - Perusta
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
HSC-ohje laskuharjoituksen 1 tehtävälle 2
 HSC-ohje laskuharjoituksen 1 tehtävälle 2 Metanolisynteesin bruttoreaktio on CO 2H CH OH (3) 2 3 Laske metanolin tasapainopitoisuus mooliprosentteina 350 C:ssa ja 350 barin paineessa, kun lähtöaineena
HSC-ohje laskuharjoituksen 1 tehtävälle 2 Metanolisynteesin bruttoreaktio on CO 2H CH OH (3) 2 3 Laske metanolin tasapainopitoisuus mooliprosentteina 350 C:ssa ja 350 barin paineessa, kun lähtöaineena
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
Korkealämpötilakemia
 Korkealämpötilakemia Gibbsin faasisääntö, kuvaajien laadinta sekä1-komponenttipiirrokset To 23.11.2017 klo 8-10 SÄ114 Tavoite Tutustua faasipiirrosten kokeelliseen ja laskennalliseen laadintaan ja siten
Korkealämpötilakemia Gibbsin faasisääntö, kuvaajien laadinta sekä1-komponenttipiirrokset To 23.11.2017 klo 8-10 SÄ114 Tavoite Tutustua faasipiirrosten kokeelliseen ja laskennalliseen laadintaan ja siten
MIKROTEORIA 1, HARJOITUS 1 BUDJETTISUORA, PREFERENSSIT, HYÖTYFUNKTIO JA VALINTA
 MIKROTEORIA, HARJOITUS BUDJETTISUORA, PREFERENSSIT, HYÖTYFUNKTIO JA VALINTA tilasto (600 00) 00 a. Kulmakerroin: = = =, koska 00 sivua lisää ta aiheuttaa (00 400) 00 luopumisen 00 sivusta tilastoa. Toisin
MIKROTEORIA, HARJOITUS BUDJETTISUORA, PREFERENSSIT, HYÖTYFUNKTIO JA VALINTA tilasto (600 00) 00 a. Kulmakerroin: = = =, koska 00 sivua lisää ta aiheuttaa (00 400) 00 luopumisen 00 sivusta tilastoa. Toisin
Eksponenttifunktio ja Logaritmit, L3b
 ja Logaritmit, L3b eksponentti-funktio Eksponentti-funktio Linkkejä kurssi8, / Etälukio (edu.) kurssi8, logaritmifunktio / Etälukio (edu.) Potenssifunktio y = f (x) = 2 Vakiofunktion y = a kuvaaja on vaakasuora
ja Logaritmit, L3b eksponentti-funktio Eksponentti-funktio Linkkejä kurssi8, / Etälukio (edu.) kurssi8, logaritmifunktio / Etälukio (edu.) Potenssifunktio y = f (x) = 2 Vakiofunktion y = a kuvaaja on vaakasuora
Lukion kemia 3, Reaktiot ja energia. Leena Piiroinen Luento 2 2015
 Lukion kemia 3, Reaktiot ja energia Leena Piiroinen Luento 2 2015 Reaktioyhtälöön liittyviä laskuja 1. Reaktioyhtälön kertoimet ja tuotteiden määrä 2. Lähtöaineiden riittävyys 3. Reaktiosarjat 4. Seoslaskut
Lukion kemia 3, Reaktiot ja energia Leena Piiroinen Luento 2 2015 Reaktioyhtälöön liittyviä laskuja 1. Reaktioyhtälön kertoimet ja tuotteiden määrä 2. Lähtöaineiden riittävyys 3. Reaktiosarjat 4. Seoslaskut
c) Tasapainota seuraava happamassa liuoksessa tapahtuva hapetus-pelkistysreaktio:
 HTKK, TTY, LTY, OY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 26.05.2004 1. a) Kun natriumfosfaatin (Na 3 PO 4 ) ja kalsiumkloridin (CaCl 2 ) vesiliuokset sekoitetaan keske- nään, muodostuu
HTKK, TTY, LTY, OY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 26.05.2004 1. a) Kun natriumfosfaatin (Na 3 PO 4 ) ja kalsiumkloridin (CaCl 2 ) vesiliuokset sekoitetaan keske- nään, muodostuu
Faasipiirrokset, osa 3 Ternääristen ja monikomponenttipiirrosten tulkinta
 Faasipiirrokset, osa 3 Ternääristen ja monikomponenttipiirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 5 Tavoite Oppia tulkitsemaan 3-komponenttisysteemien faasipiirroksia
Faasipiirrokset, osa 3 Ternääristen ja monikomponenttipiirrosten tulkinta Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 1 - Luento 5 Tavoite Oppia tulkitsemaan 3-komponenttisysteemien faasipiirroksia
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
Luku 2. Kemiallisen reaktion tasapaino
 Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
781611S KIINTEÄN OLOMUODON KEMIA (4 op)
 781611S KIINTEÄN OLOMUODON KEMIA (4 op) ma ti ke to pe 12.9. klo 12-14 19.9. klo 12-14 26.9. klo 12-14 3.10. klo 12-14 KE351 10.10. klo 12-14 17.10. klo 12-14 24.10. klo 12-14 31.10. klo 12-14 KE351 14.9.
781611S KIINTEÄN OLOMUODON KEMIA (4 op) ma ti ke to pe 12.9. klo 12-14 19.9. klo 12-14 26.9. klo 12-14 3.10. klo 12-14 KE351 10.10. klo 12-14 17.10. klo 12-14 24.10. klo 12-14 31.10. klo 12-14 KE351 14.9.
Top Analytica Oy Ab. XRF Laite, menetelmät ja mahdollisuudet Teemu Paunikallio
 XRF Laite, menetelmät ja mahdollisuudet Teemu Paunikallio Röntgenfluoresenssi Röntgensäteilyllä irroitetaan näytteen atomien sisäkuorilta (yleensä K ja L kuorilta) elektroneja. Syntyneen vakanssin paikkaa
XRF Laite, menetelmät ja mahdollisuudet Teemu Paunikallio Röntgenfluoresenssi Röntgensäteilyllä irroitetaan näytteen atomien sisäkuorilta (yleensä K ja L kuorilta) elektroneja. Syntyneen vakanssin paikkaa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017
 CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
www.ruukki.com MINERAALI- TUOTTEET Kierrätys ja Mineraalituotteet
 www.ruukki.com MINERAALI- TUOTTEET Kierrätys ja Mineraalituotteet Masuunihiekka stabiloinnit (sideaineena) pehmeikkörakenteet sidekivien alusrakenteet putkijohtokaivannot salaojan ympärystäytöt alapohjan
www.ruukki.com MINERAALI- TUOTTEET Kierrätys ja Mineraalituotteet Masuunihiekka stabiloinnit (sideaineena) pehmeikkörakenteet sidekivien alusrakenteet putkijohtokaivannot salaojan ympärystäytöt alapohjan
Korkealämpötilakemia
 Korkealämpötilakemia Useamman komponentin tasapainopiirrokset To 7.12.2017 klo 8-10 SÄ114 Tavoite Oppia lukemaan ja tulkitsemaan ternäärisiä tasapainopiirroksia 1 Sisältö Ternääriset tasapainopiirrokset
Korkealämpötilakemia Useamman komponentin tasapainopiirrokset To 7.12.2017 klo 8-10 SÄ114 Tavoite Oppia lukemaan ja tulkitsemaan ternäärisiä tasapainopiirroksia 1 Sisältö Ternääriset tasapainopiirrokset
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
3 Eksponentiaalinen malli
 Eksponentiaalinen malli Eksponentiaalinen kasvaminen ja väheneminen 6. Kulunut aika (h) Bakteerien määrä 0 80 0 60 0 0 7 7 0 0 0 6. 90 % 0,90 Pienennöksiä (kpl) Piirroksen korkeus (cm) 0,90 6,0, 0,90 6,0,06,
Eksponentiaalinen malli Eksponentiaalinen kasvaminen ja väheneminen 6. Kulunut aika (h) Bakteerien määrä 0 80 0 60 0 0 7 7 0 0 0 6. 90 % 0,90 Pienennöksiä (kpl) Piirroksen korkeus (cm) 0,90 6,0, 0,90 6,0,06,
Korkealämpötilakemia
 Korkealämpötilakemia Gibbsin faasisääntö, kuvaajien laadinta sekä 1-komponenttipiirrokset Ti 13.11.2018 klo 8-10 AT115A Tavoite Tutustua faasipiirrosten kokeelliseen ja laskennalliseen laadintaan ja siten
Korkealämpötilakemia Gibbsin faasisääntö, kuvaajien laadinta sekä 1-komponenttipiirrokset Ti 13.11.2018 klo 8-10 AT115A Tavoite Tutustua faasipiirrosten kokeelliseen ja laskennalliseen laadintaan ja siten
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
OSA 1: YHTÄLÖNRATKAISUN KERTAUSTA JA TÄYDENNYSTÄ SEKÄ FUNKTIO
 OSA : YHTÄLÖNRATKAISUN KERTAUSTA JA TÄYDENNYSTÄ SEKÄ FUNKTIO Tekijät: Ari Heimonen, Hellevi Kupila, Katja Leinonen, Tuomo Talala, Hanna Tuhkanen ja Pekka Vaaraniemi Alkupala Kolme kaverusta, Olli, Pekka
OSA : YHTÄLÖNRATKAISUN KERTAUSTA JA TÄYDENNYSTÄ SEKÄ FUNKTIO Tekijät: Ari Heimonen, Hellevi Kupila, Katja Leinonen, Tuomo Talala, Hanna Tuhkanen ja Pekka Vaaraniemi Alkupala Kolme kaverusta, Olli, Pekka
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos
 ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
Kuonien rakenne ja tehtävät
 Kuonien rakenne ja tehtävät Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 8 - Luento 1 Tavoite Oppia tuntemaan kuonien tehtävät pyrometallurgisissa prosesseissa Oppia tuntemaan silikaattipohjaisten
Kuonien rakenne ja tehtävät Ilmiömallinnus prosessimetallurgiassa Syksy 2016 Teema 8 - Luento 1 Tavoite Oppia tuntemaan kuonien tehtävät pyrometallurgisissa prosesseissa Oppia tuntemaan silikaattipohjaisten
Liitetaulukko 1/11. Tutkittujen materiaalien kokonaispitoisuudet KOTIMAINEN MB-JÄTE <1MM SAKSAN MB- JÄTE <1MM POHJAKUONA <10MM
 Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Rak Betonitekniikka 2 Harjoitus Rakennussementit, klinkkerimineraalikoostumus ja lämmönkehitys
 Rak-82.3131 Betonitekniikka 2 Harjoitus 2 23.9.2010 Rakennussementit, klinkkerimineraalikoostumus ja lämmönkehitys Portlandsementti Portlandsementin kemiallinen koostumus KOMPONENTTI LYHENNE PITOISUUS
Rak-82.3131 Betonitekniikka 2 Harjoitus 2 23.9.2010 Rakennussementit, klinkkerimineraalikoostumus ja lämmönkehitys Portlandsementti Portlandsementin kemiallinen koostumus KOMPONENTTI LYHENNE PITOISUUS
Dislokaatiot - pikauusinta
 Dislokaatiot - pikauusinta Ilman dislokaatioita Kiteen teoreettinen lujuus ~ E/8 Dislokaatiot mahdollistavat deformaation Kaikkien atomisidosten ei tarvitse murtua kerralla Dislokaatio etenee rakeen läpi
Dislokaatiot - pikauusinta Ilman dislokaatioita Kiteen teoreettinen lujuus ~ E/8 Dislokaatiot mahdollistavat deformaation Kaikkien atomisidosten ei tarvitse murtua kerralla Dislokaatio etenee rakeen läpi
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
Luku 15 KEMIALLISET REAKTIOT
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 15 KEMIALLISET REAKTIOT Copyright The McGraw-Hill Companies, Inc. Permission required for
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 15 KEMIALLISET REAKTIOT Copyright The McGraw-Hill Companies, Inc. Permission required for
Prosessi- ja ympäristötekniikan perusta
 Prosessi- ja ympäristötekniikan perusta Aihe 2: Materiaalitaseet Tavoite Tavoitteena on oppia tasetarkastelun käsite ja oppia tuntemaan, miten materiaalitaseita voidaan hyödyntää kokonaisprosessien sekä
Prosessi- ja ympäristötekniikan perusta Aihe 2: Materiaalitaseet Tavoite Tavoitteena on oppia tasetarkastelun käsite ja oppia tuntemaan, miten materiaalitaseita voidaan hyödyntää kokonaisprosessien sekä
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus
 Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
Säteilyturvakeskuksen määräys turvallisuusluvasta ja valvonnasta vapauttamisesta
 1 (33) LUONNOS 2 -MÄÄRÄYS STUK SY/1/2017 Säteilyturvakeskuksen määräys turvallisuusluvasta ja valvonnasta vapauttamisesta Säteilyturvakeskuksen päätöksen mukaisesti määrätään säteilylain ( / ) 49 :n 3
1 (33) LUONNOS 2 -MÄÄRÄYS STUK SY/1/2017 Säteilyturvakeskuksen määräys turvallisuusluvasta ja valvonnasta vapauttamisesta Säteilyturvakeskuksen päätöksen mukaisesti määrätään säteilylain ( / ) 49 :n 3
Ruostumattoman teräksen valmistaminen loppupään terässulattoprosessit.
 Ruostumattoman teräksen valmistaminen loppupään terässulattoprosessit www.outokumpu.com Johdanto Tuotantokaavio AOD-konvertteri AOD Senkka-asema SA Yhteenveto Ruostumaton teräs Ruostumaton teräs koostuu
Ruostumattoman teräksen valmistaminen loppupään terässulattoprosessit www.outokumpu.com Johdanto Tuotantokaavio AOD-konvertteri AOD Senkka-asema SA Yhteenveto Ruostumaton teräs Ruostumaton teräs koostuu
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I
 Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
EPÄORGAANINEN KEMIA HARJOITUKSIA. Jaksollinen järjestelmä
 EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Luento 10:Kertausta: Kemiallinen tasapaino + Kiinteän olomuodon kemia CHEM-A1250
 Luento 10:Kertausta: Kemiallinen tasapaino + Kiinteän olomuodon kemia 9.2.2017 CHEM-A1250 Tasapaino ja tasapainovakio Kaksisuuntainen reaktio a A+ b B p P + r R Eteenpäin menevän reaktion nopeus: rr 1
Luento 10:Kertausta: Kemiallinen tasapaino + Kiinteän olomuodon kemia 9.2.2017 CHEM-A1250 Tasapaino ja tasapainovakio Kaksisuuntainen reaktio a A+ b B p P + r R Eteenpäin menevän reaktion nopeus: rr 1
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
Luento 9: Potentiaalienergia
 Luento 9: Potentiaalienergia Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta gradientti Laskettuja esimerkkejä Luennon sisältö Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta
Luento 9: Potentiaalienergia Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta gradientti Laskettuja esimerkkejä Luennon sisältö Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta
Luento 2: Lämpökemiaa, osa 1 Keskiviikko klo Termodynamiikan käsitteitä
 Luento 2: Lämpökemiaa, osa 1 Keskiviikko 12.9. klo 8-10 477401A - ermodynaamiset tasapainot (Syksy 2018) ermodynamiikan käsitteitä - Systeemi Eristetty - suljettu - avoin Homogeeninen - heterogeeninen
Luento 2: Lämpökemiaa, osa 1 Keskiviikko 12.9. klo 8-10 477401A - ermodynaamiset tasapainot (Syksy 2018) ermodynamiikan käsitteitä - Systeemi Eristetty - suljettu - avoin Homogeeninen - heterogeeninen
Näiden aihekokonaisuuksien opetussuunnitelmat ovat luvussa 8.
 9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
luku2 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen
 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
YHTÄLÖ kahden lausekkeen merkitty yhtäsuuruus
 YHTÄLÖ kahden lausekkeen merkitty yhtäsuuruus Ensimmäisen asteen yhtälö: :n korkein eksponentti = 1 + 5 = 4( 3) Toisen asteen yhtälö: :n korkein eksponentti = 3 5 + 4 = 0 Kolmannen asteen yhtälö: :n korkein
YHTÄLÖ kahden lausekkeen merkitty yhtäsuuruus Ensimmäisen asteen yhtälö: :n korkein eksponentti = 1 + 5 = 4( 3) Toisen asteen yhtälö: :n korkein eksponentti = 3 5 + 4 = 0 Kolmannen asteen yhtälö: :n korkein
MAY1 Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty 12.4.2016 Julkaiseminen sallittu vain koulun suljetussa verkossa.
 KERTAUS Lukujono KERTAUSTEHTÄVIÄ K1. Ratkaisussa annetaan esimerkit mahdollisista säännöistä. a) Jatketaan lukujonoa: 2, 4, 6, 8, 10, 12, 14, 16, Rekursiivinen sääntö on, että lukujonon ensimmäinen jäsen
KERTAUS Lukujono KERTAUSTEHTÄVIÄ K1. Ratkaisussa annetaan esimerkit mahdollisista säännöistä. a) Jatketaan lukujonoa: 2, 4, 6, 8, 10, 12, 14, 16, Rekursiivinen sääntö on, että lukujonon ensimmäinen jäsen
KOTITEKOINEN PALOSAMMUTIN (OSA 1)
 KOTITEKOINEN PALOSAMMUTIN (OSA 1) Johdanto Monet palosammuttimet, kuten kuvassa esitetty käsisammutin, käyttävät hiilidioksidia. Jotta hiilidioksidisammutin olisi tehokas, sen täytyy vapauttaa hiilidioksidia
KOTITEKOINEN PALOSAMMUTIN (OSA 1) Johdanto Monet palosammuttimet, kuten kuvassa esitetty käsisammutin, käyttävät hiilidioksidia. Jotta hiilidioksidisammutin olisi tehokas, sen täytyy vapauttaa hiilidioksidia
Luento 11: Potentiaalienergia. Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta gradientti Esimerkkejä ja harjoituksia
 Luento 11: Potentiaalienergia Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta gradientti Esimerkkejä ja harjoituksia 1 / 22 Luennon sisältö Potentiaalienergia Konservatiiviset voimat
Luento 11: Potentiaalienergia Potentiaalienergia Konservatiiviset voimat Voima potentiaalienergiasta gradientti Esimerkkejä ja harjoituksia 1 / 22 Luennon sisältö Potentiaalienergia Konservatiiviset voimat
TUTKIMUSTODISTUS. Jyväskylän Ympäristölaboratorio. Sivu: 1(1) Päivä: 09.10.14. Tilaaja:
 Jyväskylän Ympäristölaboratorio TUTKIMUSTODISTUS Päivä: 09.10.14 Sivu: 1(1) Tilaaja: PIHTIPUTAAN LÄMPÖ JA VESI OY C/O SYDÄN-SUOMEN TALOUSHAL. OY ARI KAHILAINEN PL 20 44801 PIHTIPUDAS Näyte: Verkostovesi
Jyväskylän Ympäristölaboratorio TUTKIMUSTODISTUS Päivä: 09.10.14 Sivu: 1(1) Tilaaja: PIHTIPUTAAN LÄMPÖ JA VESI OY C/O SYDÄN-SUOMEN TALOUSHAL. OY ARI KAHILAINEN PL 20 44801 PIHTIPUDAS Näyte: Verkostovesi
Aineen häviämättömyyden periaate Jos lähtöaineissa on tietty määrä joitakin atomeja, reaktiotuotteissa täytyy olla sama määrä näitä atomeja.
 KE3 Pähkinänkuressa Olmudt reaktiyhtälössä 1) Ilmassa esiintyvät alkuaineet ja yhdisteet kaasuja (g). 2) Metallit, lukuun ttamatta elhpeaa, vat huneen lämmössä kiinteitä (s). 3) Iniyhdisteet vat huneen
KE3 Pähkinänkuressa Olmudt reaktiyhtälössä 1) Ilmassa esiintyvät alkuaineet ja yhdisteet kaasuja (g). 2) Metallit, lukuun ttamatta elhpeaa, vat huneen lämmössä kiinteitä (s). 3) Iniyhdisteet vat huneen
4.1 Kaksi pistettä määrää suoran
 4.1 Kaksi pistettä määrää suoran Kerrataan aluksi kurssin MAA1 tietoja. Geometrisesti on selvää, että tason suora on täysin määrätty, kun tunnetaan sen kaksi pistettä. Joskus voi tulla vastaan tilanne,
4.1 Kaksi pistettä määrää suoran Kerrataan aluksi kurssin MAA1 tietoja. Geometrisesti on selvää, että tason suora on täysin määrätty, kun tunnetaan sen kaksi pistettä. Joskus voi tulla vastaan tilanne,
(l) B. A(l) + B(l) (s) B. B(s)
 FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA 6. 11. 1998 (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN
FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA 6. 11. 1998 (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
KaiHali & DROMINÄ hankkeiden loppuseminaari
 KaiHali & DROMINÄ hankkeiden loppuseminaari Sedimentin geokemiallisten olojen muuttuminen kaivoskuormituksessa (KaiHali-projektin työpaketin 2 osatehtävä 3), Jari Mäkinen, Tommi Kauppila ja Tatu Lahtinen
KaiHali & DROMINÄ hankkeiden loppuseminaari Sedimentin geokemiallisten olojen muuttuminen kaivoskuormituksessa (KaiHali-projektin työpaketin 2 osatehtävä 3), Jari Mäkinen, Tommi Kauppila ja Tatu Lahtinen
