CHEM-C2230 Pintakemia Barnes & Gentle: luku 8 L7 Kaasun adsorptio kiinteän aineen pinnalle
|
|
|
- Esa Jurkka
- 5 vuotta sitten
- Katselukertoja:
Transkriptio
1 CHEM-C2230 Pintakemia Barnes & Gentle: luku 8 L7 Kaasun adsorptio kiinteän aineen pinnalle Prof. Monika Österberg
2 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 2
3 Kertausta: Adsorptio kiinteälle pinnalle nesteessä c A o Sekoitetaan Erotetaan c A c B 0 m c B m Pintakonsentraatio, Γ A Γ ( ) B = ( o c c ) B A m s B V Konsentraatio liuoksessa, c Tänään: Kaasun adsorption: paine (p) eikä konsentraatio (c) 3
4 Käytännön hyöty Pintaenergian muuttaminen Affiniteetin muuttaminen (varauksen muuttaminen) AtriaInnovation BASF 4
5 Kertausta: Adsorptio nestepinnalle Pintajännitys Pintakonsentraatiota lasketaan käyrän kaltevuudesta Käytännön hyöty ln c B Γ B (A) = 1 RT dγ d lnc B 5
6 Kertausta: Emulsiot Emulsio on kolloidi ja koostuu dispergoituneesta faasista (nestepisarat) jotka ovat dispergoituneet jatkuvaan faasiin (toinen neste) Emulgointiainetta käytetään emulsion stabilointiin, se adsorboituu neste neste-rajapintaan vähentäen pintajännitystä Pinta-aktiiviset aineet, proteiinit, polymeerit, nanopartikkelit Steerinen ja elektrostaattinen stabilointi vesi öljy vesi öljy O/Wemulsio W/Oemulsio öljy vesi vesi öljy 6
7 Emulsion stabiliteetti ja hajoaminen Flokkulointi Kermottuminen Emulsio Pisaroiden yhteenkasvaminen Hajoaminen 7
8 Kaasun adsorption kiinteälle pinnalle: Oppimistavoitteet Luennon jälkeen Tunnet eri adsorptioisotermityypit ja minkälaista adsorptiota ne kuvaavat Tunnet fysisorption ja kemisorption erot 8
9 Adsorptio Kaasun adsorptio pinnalle tärkeää mm. katalyysissä GG = HH TT SS Vapaan energian muutos Entalpia Entropia Kaasu adsorboituu pinnalle, kun GG < 00 Yleensä kaasumolekyylien entropia S pienenee, SS < 00 Tällöin entalpiamuutoksen, HH, on oltava tarpeeksi suuri ja negatiivinen adsorbentti adsorbaatti 9
10 Fysikaalinen vs. kemiallinen adsorptio Fysikaalinen adsorptio eli fysisorptio Heikot vuorovaikutukset, esim. van der Waals -voimat Reversiibeli (vaikkakin desorptio joskus hidasta) Ei spesifinen Entalpiamuutos ( kj/mol) Monikerrosadsorptio mahdollinen Kemiallinen adsorptio eli kemisorptio Kemiallinen sidos muodostuu Käytännössä irreversiibeli Spesifinen Entalpiamuutos paljon suurempi kuin fysisorptiossa ( kj/mol) Vain monomolekulaarinen kerros voi sitoutua kemiallisesti 10
11 Adsorptioisotermi Adsorptioisotermi kuvaa adsorboituneen kaasun määrää kaasun paineen funktiona tasapainossa ja vakiolämpötilassa. (Vrt. Adsorptioisotermi nesteelle) n m kiinteä = f ( P) T vakio n = adsorboituneen kaasun ainemäärä m kiinteä = kiinteän aineen massa p/p* p* = puhtaan adsorbaatin kylläisen höyryn paine kyseisessä lämpötilassa (saturation pressure) p/p* = suhteellinen paine 11
12 Adsorptioisotermi jatk. Usein kaasun määrä ilmaistaan tilavuutena V, 1 atm paineessa ja muunnettuna 0 C lämpötilaan. V v = = m kiinteä f ( P) T vakio jossa v on adsorboituneen kaasun tilavuus adsorboivan aineen massayksikköä kohti. 12
13 Adsorptioisotermien luokittelu Isotermityyppi I: Langmuir-isotermi Kuvaa monomolekulaarista adsorptiota, usein kemisorptiota adsorbentti Isotermityyppi II: Kuvaa monikerrosadsorptiota Hyvin tavallinen Ensin kemi- tai fysisorptio ensimmäiseen kerrokseen, sitten adsorboituu seuraavin kerroksiin 13
14 Adsorptioisotermien luokittelu jatk. Isotermityyppi III: Harvinainen Monikerrosadsorptiota esiintyy ennen kuin monomolekulaarinen kerros on täyttynyt Isotermityypit IV ja V: Analogisia tyyppien II ja III kanssa, mutta tasoittuvat paineessa P < P*. Kuvaavat adsorptiota huokoiseen materiaaliin. 14
15 Langmuir-isotermi Oletukset: Adsorptioentalpia on riippumaton pinnan peittoasteesta θ. Molekyylit adsorboituvat tiettyyn kohtaan eivätkä pysty liikkumaan pinnalla Tietty kohta voi adsorboida vain yhden molekyylin monomolekulaarinen kerros Peittoaste θ : θ kuvaa sitä osuutta pinnan kaikista mahdollisista adsorptiopaikoista, jotka ovat jo täyttyneet adsorboituvalla kaasulla. S on pinnalla oleva vapaa paikka, johon kaasu A voi adsorboitua [S] o on kaikkien adsorptiopaikkojen lukumäärä [AS] on täyttyneiden paikkojen lukumäärä θ = AAAA SS 00 15
16 Langmuir-isotermi jatk. Adsorption voi kuvata reaktiona A(g) + S AS Adsorptionopeus: R a = k a P(1 - θ) missä P on kaasun paine Desorptionopeus: R d = k d θ k = nopeusvakioita Tasapainossa: R a = R d θ = k d kap + k a P = KP 1+ KP missä K = k k a d Jos K vakio Langmuir-isotermin mukainen adsorptio 16
17 Langmuir: K pieni: θ KP. K suuri: θ 1. KP θ = 1+ KP Peittoaste voidaan myös määritellä kokeellisten suureiden avulla θ = v v m KP = 1+ KP missä v m on adsorboitunut määrä kun pinta on täysi (eli θ = 1). P v = 1 v m P 1 + Kv m Yo. yhtälö on lineaarinen Langmuirin mukaiselle adsorptiolle. Langmuirin isotermi eri K:n arvoilla
18 Harjoitus: Alla oleva data kuvaa hiilimonoksidin adsorptiota puuhiileen. T = 273 K. Vahvista, että adsorptio seuraa Langmuir-isotermiä ja laske sekä V m että K:n arvo p (Torr) V(cm 3 ) p/v Kulmakerroin = ( )/600 = V m = 1/0.009 = 110 cm 3 Leikkauskohta, (missä p = 0) = 1/KV m = 9 Torr/cm 3 K = 1/(110 cm 3 *9 Torr*cm -3 ) = 1.0*10-3 Torr -1 18
19 0,6 30 0,5 25 0,4 20 V (cm 3 ) 0,3 0,2 Langmuir isotherm 1/V (cm -3 ) y = a + b x R 2 = a = 2.01 cm -3 b = Pa/cm 3 0,1 5 0, P (Pa) 0 0,00 0,01 0,02 0,03 0,04 0,05 1/P (Pa -1 ) 11 = VV KKVV mm PP VVVV Jos piirtää 1/V 1/P:n funktiona saadaan lineaarinen funktio 04/19
20 Brunauer, Emmet ja Tellerin isotermi (BET) Monikerrosadsorptio Oletukset: Langmuirin yhtälö soveltuu joka kerrokseen. Desorptioentalpia ensimmäisessä kerroksessa, H des, voi olla erilainen muihin kerroksiin verrattuna, joissa se on adsorbaatin höyrystymisentalpian, H vap, suuruusluokkaa. Ei lateraalia vuorovaikutuksia adsorboituneiden molekyylien välillä. V V mon = 1 P c P * P 1 P * P P * ( 1 c) missä V mon on tilavuus silloin, kun θ = 1 ja P* on puhtaan adsorbaatin höyrynpaine koelämpötilassa. c = H vakio = exp des H RT vap (Kirjassa Z =c) 04/20
21 BET-isotermi jatk. Mitä isotermimuotoa BET-isotermi muistuttaa, kun c on iso? Entäs c:n ollessa pieni? c c kuvastaa vuorovaikutusta pinnan (adsorbentin) ja adsorbaatin välillä 21
22 Freundlich-isotermi Adsorptioentalpia ei välttämättä ole riippumaton peittoasteesta. Kohtalaisen alhaisissa paineissa pätee usein Freundlichin isotermi θ = k P1/n missä k ja n ovat kokeellisia vakioita (yleensä 2 < n < 10). Adsorption tapahtuminen liuoksesta kiintofaasiin esitetään usein käyttäen Freundlichin isotermiä. Tällöin P c. Analyysiä varten otetaan yhtälön molemmista puolista logaritmi log θ = log k + (1/n) log P jolloin log θ = f(log P) on suora Freundlichin mukaiselle adsorptiolle. 22
23 Käytännön applikaatiot Heterogeeninen katalyysi = Katalyytti ja reagoivat aineet eri faasissa Kiinteä aines katalysoi kaasufaasissa tapahtuvaa reaktiota Ammoniakin valmistus, Metanolisynteesi, Heterogeenisen katalyysin vaiheet: Diffuusio pinnalle Adsorptio Reaktio pinnalla Reaktiotuotteiden desorptio pinnalta Reaktiotuotteiden diffuusio pois pinnalta Heveling, J. J. Chem. Educ, 89 (2012)
24 Etyleenin hydrogenointi platinapinnalla Published in: Josef Heveling; J. Chem. Educ. 2012, 89, DOI: /ed200816g Copyright 2012 The American Chemical Society and Division of Chemical Education, Inc. 24
25 Auton katalysaattori hiilivedyt Typen ja happen kemisorptiota eri jalometallipinnoille Kuva: Josef Heveling; J. Chem. Educ. 2012, 89, DOI: /ed200816g Copyright 2012 The American Chemical Society and Division of Chemical Education, Inc. 25
26 Yhteenveto Langmuir-isotermi kuvaa monokerrosadsorptiota ja BETisotermi monikerrosadsorptiota. BET Langmuir 26
27 Kirjallisuus Interfacial Science: An Introduction, Barnes & Gentle Luku 8 Foundations of Colloid Science, Hunter Adsorptiosta ja isotermeistä 6.3, s (Surface chemistry of surfactants and polymers, Kronberg & Holmberg & Lindman Luku 8: Surfactant Adsorption and Solid Surfaces) 27
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
Tänään 1. Emulsiot 2. Projetityötupa
 Tänään 1. Emulsiot 2. Projetityötupa 1 CHEMC2230 Pintakemia Barnes & Gentle: luku 6 L6 Neste nesterajapinnat: Emulsiot Prof. Monika Österberg Mitä yhdistää näitä tuotteita? maito voi majoneesi Ne ovat
Tänään 1. Emulsiot 2. Projetityötupa 1 CHEMC2230 Pintakemia Barnes & Gentle: luku 6 L6 Neste nesterajapinnat: Emulsiot Prof. Monika Österberg Mitä yhdistää näitä tuotteita? maito voi majoneesi Ne ovat
CHEM-C2230 Pintakemia L12 Yhteenveto
 CHEM-C2230 Pintakemia L12 Yhteenveto Monika Österberg, 2019 Sisältö Tenttirakenne Yhteenveto/Tärkeimmät aihealueet Epäselvät asiat Esimerkkikysymyksiä Tenttirakenne 5 kysymystä: lasku, projektityö, laboratoriotyö,
CHEM-C2230 Pintakemia L12 Yhteenveto Monika Österberg, 2019 Sisältö Tenttirakenne Yhteenveto/Tärkeimmät aihealueet Epäselvät asiat Esimerkkikysymyksiä Tenttirakenne 5 kysymystä: lasku, projektityö, laboratoriotyö,
L10 Polyelektrolyytit pinnalla
 CHEM-2230 Pintakemia L10 Polyelektrolyytit pinnalla Monika Österberg Polyelektrolyyttiadsorptio (mg/m 1 0.5 2 ) C Muistatteko kemisorption ja fysisorption ero? Adsorptiota kuvataan adsorptioisotermin avulla
CHEM-2230 Pintakemia L10 Polyelektrolyytit pinnalla Monika Österberg Polyelektrolyyttiadsorptio (mg/m 1 0.5 2 ) C Muistatteko kemisorption ja fysisorption ero? Adsorptiota kuvataan adsorptioisotermin avulla
L6 Neste-neste rajapinnat: Emulsiot
 CHEMC2230 Pintakemia L6 Nesteneste rajapinnat: Emulsiot Monika Österberg Barnes&Gentle, 2005, luku 6 Mitä yhdistää näitä tuotteita? Maito Voi Ne ovat emulsioita majoneesi maali kosmetiikka lääkkeet asfaltti
CHEMC2230 Pintakemia L6 Nesteneste rajapinnat: Emulsiot Monika Österberg Barnes&Gentle, 2005, luku 6 Mitä yhdistää näitä tuotteita? Maito Voi Ne ovat emulsioita majoneesi maali kosmetiikka lääkkeet asfaltti
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
Adsorptio ja pintojen termodynamiikka
 CHEM-C2230 Pintakemia Adsorptio ja pintojen termodynamiikka Monika Österberg 6.3.2017 1 Päivän teemat ja oppimistavoitteet 1) Kertaus viime luennolta ja laskuesimerkkejä: 1) Kapilaaripaine 2) Kelvinin
CHEM-C2230 Pintakemia Adsorptio ja pintojen termodynamiikka Monika Österberg 6.3.2017 1 Päivän teemat ja oppimistavoitteet 1) Kertaus viime luennolta ja laskuesimerkkejä: 1) Kapilaaripaine 2) Kelvinin
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
CHEM-C2230 Pintakemia. Työ 2: Etikkahapon adsorptio aktiivihiileen. Työohje
 CHEM-C2230 Pintakemia Tö 2: Etikkahapon orptio aktiivihiileen Töohje 1 Johdanto Kaasun ja kiinteän aineen rajapinnalla tapahtuu leensä kaasun orptiota. Mös liuoksissa tapahtuu usein liuenneen aineen orptiota
CHEM-C2230 Pintakemia Tö 2: Etikkahapon orptio aktiivihiileen Töohje 1 Johdanto Kaasun ja kiinteän aineen rajapinnalla tapahtuu leensä kaasun orptiota. Mös liuoksissa tapahtuu usein liuenneen aineen orptiota
782630S Pintakemia I, 3 op
 782630S Pintakemia I, 3 op Ulla Lassi Puh. 0400-294090 Sposti: ulla.lassi@oulu.fi Tavattavissa: KE335 (ma ja ke ennen luentoja; Kokkolassa huone 444 ti, to ja pe) Prof. Ulla Lassi Opintojakson toteutus
782630S Pintakemia I, 3 op Ulla Lassi Puh. 0400-294090 Sposti: ulla.lassi@oulu.fi Tavattavissa: KE335 (ma ja ke ennen luentoja; Kokkolassa huone 444 ti, to ja pe) Prof. Ulla Lassi Opintojakson toteutus
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen
 KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I
 Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Päivän teemat. 1) Käsittelemättä jääneet asiat ensimmäiseltä luennolta. 2) Kotitehtävä 3) Adsorptio ja pintojen termodynamiikka
 Päivän teemat 1) Käsittelemättä jääneet asiat ensimmäiseltä luennolta a) Kolloidi- ja pintakemian käytännön haasteet b) Muutamat käsitteet 2) Kotitehtävä 3) Adsorptio ja pintojen termodynamiikka Miksi
Päivän teemat 1) Käsittelemättä jääneet asiat ensimmäiseltä luennolta a) Kolloidi- ja pintakemian käytännön haasteet b) Muutamat käsitteet 2) Kotitehtävä 3) Adsorptio ja pintojen termodynamiikka Miksi
Luku 5: Diffuusio kiinteissä aineissa
 Luku 5: Diffuusio kiinteissä aineissa Käsiteltävät aiheet... Mitä on diffuusio? Miksi sillä on tärkeä merkitys erilaisissa käsittelyissä? Miten diffuusionopeutta voidaan ennustaa? Miten diffuusio riippuu
Luku 5: Diffuusio kiinteissä aineissa Käsiteltävät aiheet... Mitä on diffuusio? Miksi sillä on tärkeä merkitys erilaisissa käsittelyissä? Miten diffuusionopeutta voidaan ennustaa? Miten diffuusio riippuu
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
Teddy 1. välikoe kevät 2008
 Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
vetyteknologia Polttokennon tyhjäkäyntijännite 1 DEE-54020 Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
CHEM-A1250 KEMIAN PERUSTEET kevät 2016
 CHEM-A1250 KEMIAN PERUSTEET kevät 2016 Luennoitsijat Tuula Leskelä (huone B 201c, p. 0503439120) sähköposti: tuula.leskela@aalto.fi Gunilla Fabricius (huone C219, p. 0504095801) sähköposti: gunilla.fabricius@aalto.fi
CHEM-A1250 KEMIAN PERUSTEET kevät 2016 Luennoitsijat Tuula Leskelä (huone B 201c, p. 0503439120) sähköposti: tuula.leskela@aalto.fi Gunilla Fabricius (huone C219, p. 0504095801) sähköposti: gunilla.fabricius@aalto.fi
CHEM-C2230 Pintakemia Barnes & Gentle: luku 4 L4 Pinta-aktiiviset aineet ja niiden adsorptio
 CHEM-C2230 Pintakemia Barnes & Gentle: luku 4 L4 Pinta-aktiiviset aineet ja niiden adsorptio Prof. Monika Österberg Sisältö Pinta-aktiiviset aineet Ominaisuudet Esimerkit Misellien ja muiden järjestäytyneiden
CHEM-C2230 Pintakemia Barnes & Gentle: luku 4 L4 Pinta-aktiiviset aineet ja niiden adsorptio Prof. Monika Österberg Sisältö Pinta-aktiiviset aineet Ominaisuudet Esimerkit Misellien ja muiden järjestäytyneiden
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt
 KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia)
 ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia) Elämän edellytykset: Solun täytyy pystyä (a) replikoitumaan (B) katalysoimaan tarvitsemiaan reaktioita tehokkaasti ja selektiivisesti eli sillä on oltava
ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia) Elämän edellytykset: Solun täytyy pystyä (a) replikoitumaan (B) katalysoimaan tarvitsemiaan reaktioita tehokkaasti ja selektiivisesti eli sillä on oltava
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin?
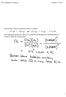 Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
Esimerkiksi ammoniakin valmistus typestä ja vedystä on tyypillinen teollinen tasapainoreaktio.
 REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
SAMI VESAMÄKI PINTAKEMIAN LABORATORIOTYÖN KEHITTÄMINEN
 SAMI VESAMÄKI PINTAKEMIAN LABORATORIOTYÖN KEHITTÄMINEN Kandidaatintyö Kemian ja biotekniikan laboratorio Tarkastaja: Yliopistonlehtori Elina Vuorimaa-Laukkanen 30.04.2018 I TIIVISTELMÄ TAMPEREEN TEKNILLINEN
SAMI VESAMÄKI PINTAKEMIAN LABORATORIOTYÖN KEHITTÄMINEN Kandidaatintyö Kemian ja biotekniikan laboratorio Tarkastaja: Yliopistonlehtori Elina Vuorimaa-Laukkanen 30.04.2018 I TIIVISTELMÄ TAMPEREEN TEKNILLINEN
Bensiiniä voidaan pitää hiilivetynä C8H18, jonka tiheys (NTP) on 0,703 g/ml ja palamislämpö H = kj/mol
 Kertaustehtäviä KE3-kurssista Tehtävä 1 Maakaasu on melkein puhdasta metaania. Kuinka suuri tilavuus metaania paloi, kun täydelliseen palamiseen kuluu 3 m 3 ilmaa, jonka lämpötila on 50 C ja paine on 11kPa?
Kertaustehtäviä KE3-kurssista Tehtävä 1 Maakaasu on melkein puhdasta metaania. Kuinka suuri tilavuus metaania paloi, kun täydelliseen palamiseen kuluu 3 m 3 ilmaa, jonka lämpötila on 50 C ja paine on 11kPa?
CHEM-C2230 Pintakemia
 CHEM-C2230 Pintakemia Prof. Monika Österberg Yhteystiedot Monika Österberg: monika.osterberg@alto.fi, Puu I, huone 323, Koko kurssi/luennot/projektityö/tentti Gunilla Fabricius: gunilla.fabricius@aalto.fi,
CHEM-C2230 Pintakemia Prof. Monika Österberg Yhteystiedot Monika Österberg: monika.osterberg@alto.fi, Puu I, huone 323, Koko kurssi/luennot/projektityö/tentti Gunilla Fabricius: gunilla.fabricius@aalto.fi,
Teddy 2. välikoe kevät 2008
 Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Luento 2: Lämpökemiaa, osa 1 Keskiviikko klo Termodynamiikan käsitteitä
 Luento 2: Lämpökemiaa, osa 1 Keskiviikko 12.9. klo 8-10 477401A - ermodynaamiset tasapainot (Syksy 2018) ermodynamiikan käsitteitä - Systeemi Eristetty - suljettu - avoin Homogeeninen - heterogeeninen
Luento 2: Lämpökemiaa, osa 1 Keskiviikko 12.9. klo 8-10 477401A - ermodynaamiset tasapainot (Syksy 2018) ermodynamiikan käsitteitä - Systeemi Eristetty - suljettu - avoin Homogeeninen - heterogeeninen
Termodynamiikka. Fysiikka III 2007. Ilkka Tittonen & Jukka Tulkki
 Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
(l) B. A(l) + B(l) (s) B. B(s)
 FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA 6. 11. 1998 (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN
FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 LIUKOISUUDEN IIPPUVUUS LÄMPÖTILASTA 6. 11. 1998 (HJ) A(l) + B(l) µ (l) B == B(s) µ (s) B FYSIKAALISEN KEMIAN LAUDATUTYÖ N:o 3 1. TEOIAA Kyllästetty liuos LIUKOISUUDEN
Tasapainotilaan vaikuttavia tekijöitä
 REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
Kemian koe, Ke3 Reaktiot ja energia RATKAISUT Perjantai VASTAA YHTEENSÄ KUUTEEN TEHTÄVÄÄN
 Kemian koe, Ke3 Reaktiot ja energia RATKAISUT Kannaksen lukio Perjantai 26.9.2014 VASTAA YHTEENSÄ KUUTEEN TEHTÄVÄÄN 1. A. Selitä käsitteet ja määritelmät (lyhyesti), lisää tarvittaessa kemiallinen merkintätapa:
Kemian koe, Ke3 Reaktiot ja energia RATKAISUT Kannaksen lukio Perjantai 26.9.2014 VASTAA YHTEENSÄ KUUTEEN TEHTÄVÄÄN 1. A. Selitä käsitteet ja määritelmät (lyhyesti), lisää tarvittaessa kemiallinen merkintätapa:
Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen
 KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 10: Reaalikaasut Pe 1.4.2016 1 AIHEET 1. Malleja, joissa pyritään huomioimaan
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 10: Reaalikaasut Pe 1.4.2016 1 AIHEET 1. Malleja, joissa pyritään huomioimaan
REAKTIOT JA ENERGIA, KE3. Kaasut
 Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Molaariset ominaislämpökapasiteetit
 Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
Luku 2. Kemiallisen reaktion tasapaino
 Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
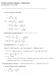 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
HSC-ohje laskuharjoituksen 1 tehtävälle 2
 HSC-ohje laskuharjoituksen 1 tehtävälle 2 Metanolisynteesin bruttoreaktio on CO 2H CH OH (3) 2 3 Laske metanolin tasapainopitoisuus mooliprosentteina 350 C:ssa ja 350 barin paineessa, kun lähtöaineena
HSC-ohje laskuharjoituksen 1 tehtävälle 2 Metanolisynteesin bruttoreaktio on CO 2H CH OH (3) 2 3 Laske metanolin tasapainopitoisuus mooliprosentteina 350 C:ssa ja 350 barin paineessa, kun lähtöaineena
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
Ohjeellinen pituus: 2 3 sivua. Vastaa joko tehtävään 2 tai 3
 PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
KEMIAN MIKROMAAILMA, KE2 VESI
 VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
Lämmityksen lämpökerroin: Jäähdytin ja lämmitin ovat itse asiassa sama laite, mutta niiden hyötytuote on eri, jäähdytyksessä QL ja lämmityksessä QH
 Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
Mitkä ovat aineen kolme olomuotoa ja miksi niiden välisiä olomuodon muutoksia kutsutaan?
 2.1 Kolme olomuotoa Mitkä ovat aineen kolme olomuotoa ja miksi niiden välisiä olomuodon muutoksia kutsutaan? pieni energia suuri energia lämpöä sitoutuu = endoterminen lämpöä vapautuu = eksoterminen (endothermic/exothermic)
2.1 Kolme olomuotoa Mitkä ovat aineen kolme olomuotoa ja miksi niiden välisiä olomuodon muutoksia kutsutaan? pieni energia suuri energia lämpöä sitoutuu = endoterminen lämpöä vapautuu = eksoterminen (endothermic/exothermic)
CHEM-C2230 Pintakemia. Prof. Monika Österberg
 CHEM-C2230 Pintakemia Prof. Monika Österberg Yhteystiedot Monika Österberg: monika.osterberg@aalto.fi, Puu I, huone 323, Koko kurssi/luennot/projektityö/tentti Gunilla Fabricius: gunilla.fabricius@aalto.fi,
CHEM-C2230 Pintakemia Prof. Monika Österberg Yhteystiedot Monika Österberg: monika.osterberg@aalto.fi, Puu I, huone 323, Koko kurssi/luennot/projektityö/tentti Gunilla Fabricius: gunilla.fabricius@aalto.fi,
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA!
 ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
KEMA221 2009 KEMIALLINEN TASAPAINO ATKINS LUKU 7
 KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI Copyright The McGraw-Hill Companies, Inc. Permission
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI Copyright The McGraw-Hill Companies, Inc. Permission
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
CHEM-C2230 Pintakemia L11 Pintakemia teollisissa prosesseissa - yhteenveto
 HEM2230 Pintakemia L11 Pintakemia teollisissa prosesseissa yhteenveto Monika Österberg, 2017 Vaahdotus erotusmenetelmänä Prosessit: Siistaus, mineraalien rikastus, jätevedenpuhdistus Pintakemian rooli
HEM2230 Pintakemia L11 Pintakemia teollisissa prosesseissa yhteenveto Monika Österberg, 2017 Vaahdotus erotusmenetelmänä Prosessit: Siistaus, mineraalien rikastus, jätevedenpuhdistus Pintakemian rooli
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
Palautus yhtenä tiedostona PDF-muodossa viimeistään torstaina
 PHYS-A0120 Termodynamiikka, syksy 2018 Kotitentti Vastaa tehtäviin 1/2/3, 4, 5/6, 7/8, 9 (yhteensä viisi vastausta). Tehtävissä 1, 2, 3 ja 9 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
PHYS-A0120 Termodynamiikka, syksy 2018 Kotitentti Vastaa tehtäviin 1/2/3, 4, 5/6, 7/8, 9 (yhteensä viisi vastausta). Tehtävissä 1, 2, 3 ja 9 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
Luvun 12 laskuesimerkit
 Luvun 12 laskuesimerkit Esimerkki 12.1 Mikä on huoneen sisältämän ilman paino, kun sen lattian mitat ovat 4.0m 5.0 m ja korkeus 3.0 m? Minkälaisen voiman ilma kohdistaa lattiaan? Oletetaan, että ilmanpaine
Luvun 12 laskuesimerkit Esimerkki 12.1 Mikä on huoneen sisältämän ilman paino, kun sen lattian mitat ovat 4.0m 5.0 m ja korkeus 3.0 m? Minkälaisen voiman ilma kohdistaa lattiaan? Oletetaan, että ilmanpaine
REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos
 ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
Paula Jantunen, FM (väit.) MUTKU-päivät, Hämeenlinna Sorption merkitys kemikaaliriskinarvioinnissa
 Paula Jantunen, FM (väit.) MUTKU-päivät, Hämeenlinna 31.3.2011 Sorption merkitys kemikaaliriskinarvioinnissa Taustani Ympäristötieteen FM 1999 (Kuopion yliopisto) European Master in Risk Analysis and Risk
Paula Jantunen, FM (väit.) MUTKU-päivät, Hämeenlinna 31.3.2011 Sorption merkitys kemikaaliriskinarvioinnissa Taustani Ympäristötieteen FM 1999 (Kuopion yliopisto) European Master in Risk Analysis and Risk
Puhtaat aineet ja seokset
 Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
TKK, TTY, LTY, OY, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 31.5.2006
 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
1 Eksergia ja termodynaamiset potentiaalit
 1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
2. Pintajännitys ja kostutus
 CHEM-C2230 2. Pintajännitys ja kostutus Prof Monika Österberg Osaamistavoitteet Barnes & Gentle: luku 2 Luennon jälkeen ymmärrät miksi vesi leviää poolisille pinnoille mutta ei poolittomille. Tunnet käsitteet:
CHEM-C2230 2. Pintajännitys ja kostutus Prof Monika Österberg Osaamistavoitteet Barnes & Gentle: luku 2 Luennon jälkeen ymmärrät miksi vesi leviää poolisille pinnoille mutta ei poolittomille. Tunnet käsitteet:
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Muita lämpökoneita. matalammasta lämpötilasta korkeampaan. Jäähdytyksen tehokerroin: Lämmityksen lämpökerroin:
 Muita lämpökoneita Nämäkin vaativat ovat työtälämpövoimakoneiden toimiakseen sillä termodynamiikan pääsääntö Lämpökoneita lisäksi laitteet,toinen jotka tekevät on Clausiuksen mukaan: laiteilmalämpöpumppu
Muita lämpökoneita Nämäkin vaativat ovat työtälämpövoimakoneiden toimiakseen sillä termodynamiikan pääsääntö Lämpökoneita lisäksi laitteet,toinen jotka tekevät on Clausiuksen mukaan: laiteilmalämpöpumppu
Ellinghamin diagrammit
 Ellinghamin diagrammit Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 2 Tavoite Oppia tulkitsemaan (ja laatimaan) vapaaenergiapiirroksia eli Ellinghamdiagrammeja 1 Tasapainopiirrokset
Ellinghamin diagrammit Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 1 - Luento 2 Tavoite Oppia tulkitsemaan (ja laatimaan) vapaaenergiapiirroksia eli Ellinghamdiagrammeja 1 Tasapainopiirrokset
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Luku 8. Reaktiokinetiikka
 Luku 8 Reaktiokinetiikka 234 8.1 Reaktion nopeus Reaktiokinetiikka tarkastelee reaktioiden nopeuksia (vrt. termodynamiikka) reaktionopeus = konsentraation muutos aikayksikössä Tarkastellaan yksinkertaista
Luku 8 Reaktiokinetiikka 234 8.1 Reaktion nopeus Reaktiokinetiikka tarkastelee reaktioiden nopeuksia (vrt. termodynamiikka) reaktionopeus = konsentraation muutos aikayksikössä Tarkastellaan yksinkertaista
1. Laske ideaalikaasun tilavuuden lämpötilakerroin (1/V)(dV/dT) p ja isoterminen kokoonpuristuvuus (1/V)(dV/dp) T.
 S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
Lämpö- eli termokemiaa
 Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Biodiesel Tuotantomenetelmien kemiaa
 Biodiesel Tuotantomenetelmien kemiaa Tuotantomenetelmät Kasviöljyjen vaihtoesteröinti Kasviöljyjen hydrogenointi Fischer-Tropsch-synteesi Kasviöljyt Rasvan kemiallinen rakenne Lähde: Malkki, Rypsiöljyn
Biodiesel Tuotantomenetelmien kemiaa Tuotantomenetelmät Kasviöljyjen vaihtoesteröinti Kasviöljyjen hydrogenointi Fischer-Tropsch-synteesi Kasviöljyt Rasvan kemiallinen rakenne Lähde: Malkki, Rypsiöljyn
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus
 Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
:TEKES-hanke. 40121/04 Leijukerroksen kuplien ilmiöiden ja olosuhteiden kokeellinen ja laskennallinen tutkiminen
 FB-kupla :TEKES-hanke 40121/04 Leijukerroksen kuplien ilmiöiden ja olosuhteiden kokeellinen ja laskennallinen tutkiminen Ryhmähankkeen osapuolet: Tampereen teknillinen yliopisto Osahanke: Biopolttoaineiden
FB-kupla :TEKES-hanke 40121/04 Leijukerroksen kuplien ilmiöiden ja olosuhteiden kokeellinen ja laskennallinen tutkiminen Ryhmähankkeen osapuolet: Tampereen teknillinen yliopisto Osahanke: Biopolttoaineiden
kuonasula metallisula Avoin Suljettu Eristetty S / Korkealämpötilakemia Termodynamiikan peruskäsitteitä
 Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
- Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka: kappaleiden liike)
 KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
1. Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta
 766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
PINTA-AKTIIVISET AINEET
 PINTA-AKTIIVISET AINEET 1 ohdanto Aineita; jotka laskevat liuoksen pintajännitystä kutsutaan pinta-aktiivisiksi aineiksi. Voimakkaasti pintajännitystä alentavia aineita kutsutaan tensideiksi. Tällaisia
PINTA-AKTIIVISET AINEET 1 ohdanto Aineita; jotka laskevat liuoksen pintajännitystä kutsutaan pinta-aktiivisiksi aineiksi. Voimakkaasti pintajännitystä alentavia aineita kutsutaan tensideiksi. Tällaisia
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2017 Emppu Salonen Lasse Laurson Touko Herranen Toni Mäkelä Luento 11: Faasitransitiot Ke 29.3.2017 1 AIHEET 1. 1. kertaluvun transitioiden (esim.
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2017 Emppu Salonen Lasse Laurson Touko Herranen Toni Mäkelä Luento 11: Faasitransitiot Ke 29.3.2017 1 AIHEET 1. 1. kertaluvun transitioiden (esim.
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]
![KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]](/thumbs/24/3803781.jpg) KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko klo 8-10
 Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
Termodynamiikka. Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt. ...jotka ovat kaikki abstraktioita
 Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
