9 Klassinen ideaalikaasu
|
|
|
- Taisto Juusonen
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 111 9 Klassinen ideaalikaasu 9-1 Klassisen ideaalikaasun patitiofunktio Ideaalikaasu on eaalikaasun idealisaatio, jossa molekyylien väliset keskimäääiset etäisyydet oletetaan hyvin suuiksi molekyylien kokoon veattuna. Tällöin molekyylien väliset pitkän kantaman vetovoimat (jotka heikkenevät molekyylien välisen etäisyyden kasvaessa kuten 1/ 7, 1/ 8 jne.) ovat mekityksettömän pieniä. Molekyylien välinen vuoovaikutus on voimakasta ainoastaan niiden tömätessä toisiinsa, mutta kullakin ajan hetkellä vain hyvin pieni osa molekyyleistä osallistuu tömäyksiin. Ideaalikaasun molekyylien välisen vuoovaikutuksen potentiaalienegia on siis keskimääin häviävän pieni niiden liike-enegiaan veattuna. Voidaan sanoa, että ideaalikaasu on vuoovaikuttamattomien hiukkasten muodostama systeemi. Jos hiukkasten välinen vuoovaikutusenegia on nolla, jokainen hiukkanen on omassa kvanttitilassaan, joka on joku tiloista 1,,...,,.... Tällaisia yhden molekyylin tiloja sanotaan yksihiukkastiloiksi (engl. single-paticle state). Tilassa olevan molekyylin enegia (yksihiukkasenegia) on ɛ, ja tilojen numeointi voidaan valita siten, että enegia kasvaa :n kasvaessa: ɛ 1 ɛ ɛ. (9.1) Yleensä samaan yksihiukkasenegiaan kuuluu useita yksihiukkastiloja, ts., monilla tiloilla on sama enegia. Hiukkasten muodostaman systeemin kokonaisenegia on yksittäisten hiukkasten enegioiden summa. Jos yksihiukkastilassa 1 on n 1 hiukkasta (joiden enegiat ovat ɛ 1 ), yksihiukkastilassa on n hiukkasta (joiden enegiat ovat ɛ ), jne., kokonaisenegia on E(n 1, n,..., n,...) = n 1 ɛ 1 + n ɛ +... = n ɛ, (9.) missä summataan yli kaikkien yksihiukkastilojen. Systeemin tila spesifioidaan siis antamalla kussakin yksihiukkastilassa olevien hiukkasten lukumääät n, joita sanotaan yksihiukkastilojen miehitysluvuiksi (engl. occupation numbe). Jos hiukkasia on yhteensä kpl, miehityslukujen summan täytyy olla : n =. (9.3) On syytä koostaa, että yksihiukkastila ja koko systeemin tila ovat aivan ei asioita. Yhden molekyylin tila spesifioidaan antamalla yksihiukkastilan indeksi, mutta ko. molekyyleistä muodostuvan kaasun tila spesifioidaan antamalla kaikki miehitysluvut (n 1, n, n 3,...).
2 Seuaavassa takastellaan :n vuoovaikuttamattoman molekyylin muodostamaa ideaalikaasua, jonka lämpötila on T ja tilavuus on V. Pykimyksenä on johtaa kaasun patitiofunktion Z(T, V, ) lauseke, sillä systeemin kaikki temodynaamiset tasapaino-ominaisuudet voidaan laskea sen avulla. Jos kaasussa olisi vain yksi molekyyli ( = 1), systeemin tilat olisivat yksihiukkastiloja 1,, 3,...,,... ja sen enegiat olisivat yksihiukkasenegioita ɛ 1, ɛ,..., ɛ,.... Tällöin kaasun patitiofunktio olisi sama kuin yksihiukkaspatitiofunktio Z 1, joka voidaan laskea suoaan määitelmän (4.5) avulla: 11 Z 1 (T, V ) Z(T, V, 1) = e βɛ. (9.4) Jos kaasu muodostuu kahdesta molekyylistä, systeemin tila voidaan spesifioida antamalla kummankin molekyylin yksihiukkastila, ts. kaksi indeksiä. Jos toinen molekyyli on yksihiukkastilassa ja toinen on yksihiukkastilassa s, systeemin tila spesifioidaan indeksipailla (, s). Jos kumpikin molekyyli voi olla toisesta iippumatta missä tahansa yksihiukkastilassa, systeemin mahdolliset tilat ovat (, s) = (1, 1), (1, ), (1, 3),..., (, ), (, 3),.... äitä tiloja vastaavat systeemin enegiat ovat ɛ + ɛ s. Tässä tapauksessa summaus yli systeemin kaikkien tilojen mekitsee ajoitettua kaksinketaista summausta yli kaikkien yksihiukkastilojen, joten kaasun patitiofunktioksi tulee Z(T, V, ) = e β(ɛ +ɛ s ). (9.5) s Kuten yhtälöön (9.5) on mekitty, summaa laskettaessa indeksit ja s eivät ole täysin iippumattomia toisistaan. Indeksi saa kaikki avot 1:stä lähtien ( = 1,, 3,...), mutta indeksin s ensimmäinen avo on (s =, + 1, +,...). Tästä seuaa, että summassa esiintyvät vain indeksipait (, s) = (1, 1), (1, ), (1, 3),..., (, ), (, 3),.... Siinä eivät esiinny indeksipait (, s) = (, 1), (3, 1), (3, ),..., jotka saadaan edellä luetelluista paeista vaihtamalla indeksien jäjestystä. Tämä ajoitus johtuu molekyylien identtisyydestä. Esimekiksi systeemin tila (1, ) mekitsee sitä, että toinen molekyyli on yksihiukkastilassa 1 ja toinen on yksihiukkastilassa. Jos molekyylit ovat identtisiä, on täysin samantekevää, kumpi molekyyli on tilassa 1 ja kumpi on tilassa. Systeemin tila pysyy täsmälleen samana, jos molekyylit vaihdetaan keskenään. äin ollen systeemin tilaa (1, ) voidaan yhtä hyvin kuvata myös indeksipailla (, 1). Molemmat pait kuvaavat samaa tilaa. Jos siis indeksit ja s olisivat patitiofunktiota laskettaessa toisistaan iippumattomia, summassa esiintyisivät indeksipait (1, ) ja (, 1), (1, 3) ja (3, 1) jne., joten tilat (, s), joilla s, tulisivat mukaan kahteen ketaan. Edellä olevasta takastelusta seuaa, että summan (9.5) temit voidaan yhmitellä seuaavasti: Z(T, V, ) = 1 e β(ɛ+ɛs) + e βɛ. (9.6) s Tämän yhtälön oikean puolen ensimmäinen summalauseke muodostuu kaikista niistä temeistä, joilla s. Se on siis summa yli systeemin niiden tilojen (, s) = (1, ), (, 1), (1, 3), (3, 1)..., joissa molekyylit ovat ei yksihiukkastiloissa. Tämä on ainoa summausta ajoittava ehto muuten indeksit ja s ovat toisistaan iippumattomia. Koska tällaisessa ajoittamattomassa kaksinketaisessa summauksessa systeemin jokaisen tilan (, s) = (s, )
3 antama osuus tulee lasketuksi kahteen ketaan, on summa jaettava :lla. Yhtälön (9.6) oikean puolen jälkimmäinen summalauseke muodostuu kaikista muista temeistä, joilla siis = s. Se on summa yli systeemin niiden tilojen (, ) = (1, 1), (, ), (3, 3),..., joissa kumpikin molekyyli on samassa yksihiukkastilassa = 1,, 3,.... Jos lämpötila on tapeeksi kokea, hiukkasten käytettävissä on hyvin suui joukko yksihiukkastiloja. Tämä takoittaa sitä, että hyvin monien yksihiukkastilojen Boltzmannin tekijät exp( βɛ ) eoavat mekittävästi nollasta, joten hiukkaset voivat miehittää näitä tiloja. Tällöin summaan (9.6) kuuluu hyvin suui joukko temejä, jotka eoavat mekittävästi nollasta. Jos käytettävissä on n yksihiukkastilaa, indeksipait (, s) muodostavat n n-matiisin. Sen diagonaalilla on n elementtiä ja diagonaalin ulkopuolella on n n = n(n 1) elementtiä. äin ollen yhtälön (9.6) oikean puolen ensimmäiseen summalausekkeeseen kuuluu n(n 1)/ temiä (kun tekijä 1/ otetaan huomioon) ja jälkimmäiseen lausekkeeseen kuuluu n temiä. Kun n kasvaa, jälkimmäisen summalausekkeen mekitys vähenee. Esimekiksi tapauksessa n = 100 ensimmäiseen ja jälkimmäiseen summalausekkeeseen kuuluu 4950 ja 100 temiä (98 % ja % temeistä), ja tapauksessa n = 1000 ensimmäiseen ja jälkimmäiseen lausekkeeseen kuuluu ja 1000 temiä (99,8 % ja 0, % temeistä). Rajalla n jälkimmäinen summalauseke voidaan jättää kokonaan huomiotta. Tällöin myös ensimmäisen summalausekkeen ajoitus s voidaan jättää pois. Tästä ajoituksesta luopuminen mekitsee sitä, että summaan tulee mukaan n uutta temiä, joilla indeksit ja s ovat samat (ja jotka jaetaan :lla). Kun n, näillä n:llä temillä ei ole mitään mekitystä summalausekkeen n(n 1)/:n muun temin joukossa. Jos siis hiukkasten käytettävissä olevien yksihiukkastilojen lukumäää on hyvin suui, summa (9.6) edusoituu muotoon 113 Z(T, V, ) = 1 e β(ɛ +ɛ s ), (9.7) missä summausindeksit ja s ovat toisistaan iippumattomia. Tällöin systeemin patitiofunktio voidaan esittää muodossa ( ) ( ) Z(T, V, ) = 1 e βɛ e βɛ s = 1 e βɛ e βɛ s = 1 ( s e βɛ s ) = 1 [Z 1(T, V )], (9.8) missä Z 1 (T, V ) on yhtälön (9.4) mukainen yksihiukkaspatitiofunktio. Jos kaasu muodostuu :stä molekyylistä, sen eksakti patitiofunktio voidan kijoittaa lausekkeen (9.6) yleistyksenä muodossa Z Z(T, V, ) = 1 e β(ɛ 1 +ɛ + +ɛ ) + +! 1 } {{ } (kaikki i :t eisuuia) s e βɛ. (9.9) Tämän yhtälön oikean puolen ensimmäinen lauseke on summa yli systeemin kaikkien niiden tilojen ( 1,,..., ), joissa molekyylit ovat ei yksihiukkastiloissa. Tällaisessa - ketaisessa summauksessa systeemin jokaisen tilan antama osuus tulee lasketuksi mukaan
4 ! ketaa, koska :n ei indeksin ( 1,,..., ) keskinäinen jäjestys voidaan valita!:lla ei tavalla. Tästä syystä ensimmäinen summalauseke on jaettava!:lla. Yhtälön (9.9) muut summalausekkeet muodostuvat temeistä, joissa osa molekyyleistä (tai viimeisessä lausekkeessa kaikki molekyylit) ovat samassa yksihiukkastilassa. Jos molekyylien käytettävissä olevien yksihiukkastilojen lukumäää on paljon suuempi kuin molekyylien lukumäää, näiden muiden summalausekkeiden antama osuus kokonaissummaan (9.9) on mekityksetön. Tässä tapauksessa myös yhtälön (9.9) ensimmäistä summalauseketta ajoittava ehto (jonka mukaan kaikkien indeksien 1,,..., on oltava eisuuia) on mekityksetön. Tällöin kaasun patitiofunktion lauseke (9.9) edusoituu hyvin yksinketaiseen muotoon Z = 1 e β(ɛ1 +ɛ + +ɛ ) = 1 e βɛ1 e βɛ e βɛ!! 1 1 ( ) ( ) ( ) ( ) = 1 e βɛ1 e βɛ e βɛ = 1 e βɛ!! = 1! [Z 1(T, V )]. (9.10) Lauseke (9.10) on klassisen ideaalikaasun patitiofunktio. Ideaalikaasua sanotaan klassiseksi, jos yksihiukkastilojen lukumäää kullakin enegia-alueella on hyvin suui veattuna ko. enegian omaavien molekyylien lukumääään. Tällöin useimmat yksihiukkastilat ovat tyhjiä, joissakin on yksi molekyyli, ja vain häviävän pieni määä yksihiukkastiloja sisältää enemmän kuin yhden molekyylin. Tällaisissa klassisissa olosuhteissa (engl. classical egime) ideaalikaasun kaikista mahdollisista tiloista (n 1, n, n 3,...) ovat siis mekityksellisiä vain ne, joissa suuin osa miehitysluvuista on nollia (n = 0) ja :n miehitysluvun avo on yksi (n = 1), mutta muita miehityslukuja (n =, 3,...) ei esiinny. 9- Yksihiukkaspatitiofunktio Ideaalikaasun molekyylin yksihiukkasenegia ɛ voidaan jakaa kahteen toisistaan iippumattomaan osaan: ɛ ɛ sα = ɛ t s + ɛ int α. (9.11) Ensimmäinen osa ɛ t s on molekyylin massakeskipisteen etenemisliikkeen (tanslaatioliikkeen) liike-enegia, tanslaatioenegia, joka voidaan spesifioida tanslaatiotilan indeksillä s. Molekyylin kaikki muu enegia sisältyy toiseen osaan, molekyylin sisäiseen enegiaan ɛ int α, joka spesifioidaan sisäisen tilan indeksillä α. Siihen kuuluvat mm. molekyylin pyöimisja väähdysenegia sekä sen elektoninen enegia. Tästä seuaa, että yksihiukkaspatitiofunktio Z 1 voidaan sepaoida kahden tekijän tuloksi: Z 1 = e βɛ = s α e β(ɛt s +ɛint α ) = ( s e βɛt s ) ( α e βɛint α ) = Z t 1 Z int. (9.1) Ensimmäinen tekijä Z t 1 = Z t 1 (T, V ) = s e βɛt s (9.13)
5 on molekyylin tanslaatiopatitiofunktio (engl. tanslational patition function), joka on summa yli molekyylin kaikkien tanslaatiotilojen. Toinen tekijä 115 Z int = Z int (T ) = α e βɛint α (9.14) on molekyylin sisäinen patitiofunktio (engl. intenal patition function), joka on summa yli molekyylin kaikkien sisäisten tilojen. Sisäisen patitiofunktion Z int lauseke iippuu vain molekyylin sisäisistä ominaisuuksista. Se on siis ei molekyyleille eilainen, mutta ei iipu kaasusäiliön tilavuudesta V : Z int = Z int (T ). Sen sijaan tanslaatiopatitiofunktion Z1 t = Z1 t (T, V ) lauseke on kaikille molekyyleille sama. Se voidaan siis määittää yleisessä muodossa, tuntematta molekyylin sisäisiä ominaisuuksia. Tanslaatiopatitiofunktion Z1 t (9.13) lausekkeen määittämiseksi on laskettava temien exp( βɛ t s ) summa yli kaikkien tanslaatiotilojen. äissä temeissä esiintyvän massakeskipisteen liike-enegian lauseke on sekä klassisessa mekaniikassa että kvanttimekaniikassa ɛ t s = p s m, (9.15) missä p s = p s on molekyylin liikemäään itseisavo tilassa s ja m on sen massa. Kvanttimekaniikan mukaan p s voi saada vain tiettyjä diskeettejä avoja. Voidaan osoittaa, että niiden tanslaatiotilojen lukumäää, joissa tilavuuteen V ajoitetun hiukkasen liikemäään itseisavo on pienellä välillä (p, p + dp), on f(p) dp = 4πV p dp h 3, (9.16) missä h on Planckin vakio. Tämä tulos on voimassa, jos f(p) dp on suui, ts., jos välille (p, p + dp) kuuluu hyvin monta tanslaatiotilaa. Jos lämpötila on iittävän kokea, hiukkasen liikemäää p on käytännöllisesti katsoen aina niin suui, että yhtälö (9.16) on voimassa. Tällöin tanslaatiotilat ovat niin lähellä toisiaan, että Boltzmannin tekijä exp( βɛ t s ) muuttuu hyvin hitaasti s:n avon kasvaessa. äin ollen kaikki liikemääävälillä (p, p + dp) olevat Boltzmannin tekijät voidaan kovata indeksistä s iippumattomalla vakiolla, joka on exp( βp /m). iiden lukumäää tällä välillä on sama kuin tanslaatiotilojen lukumäää, siis f(p) dp. Tästä syystä välillä (p, p+dp) olevien Boltzmannin tekijöiden summa saadaan ketomalla yksittäisen tekijän avo exp( βp /m) niiden lukumääällä f(p) dp: dz t 1 = s e βɛt s } {{ } p s (p,p+dp) = f(p) dp e βɛt s = f(p) e βp /m dp. (9.17) Tanslaatiopatitiofunktion Z t 1 lauseke (9.13) on yhtälön (9.17) mukaisten osuuksien summa yli kaikkien liikemääävälien (p, p + dp), ts., integaali Z t 1 = s e βɛt s = 0 f(p) e βp /m dp = 4πV h 3 0 p e βp /m dp. (9.18)
6 116 Kun integointi suoitetaan, saadaan tulos Z t 1 = 4πV h 3 m πm β β = V ( ) 3/ πmkt. (9.19) h Kun yhtälöiden (9.1) ja (9.19) mukainen yksihiukkaspatitiofunktio sijoitetaan klassisen ideaalikaasun patitiofunktion lausekkeeseen (9.10), se saa muodon Z(T, V, ) = 1! [Z 1(T, V )] = 1! [Zt 1 (T, V )Z int (T )] = V! ( ) 3/ πmkt [Z int(t )]. h (9.0) Koska kaasun molekyylien lukumäää on hyvin suui, lauseketta (9.0) voidaan yksinketaistaa käyttämällä Stilingin appoksimaatiota (5.3), joka voidaan kijoittaa muodossa missä e on epein luku. lausekkeeksi tulee Z(T, V, ) =! ( ), (9.1) e Tällöin klassisen ideaalikaasun lopulliseksi patitiofunktion [ ev ( ) ] 3/ πmkt Z int(t ). (9.) h 9-3 Klassisuusehdon toteutuminen Klassisen ideaalikaasun patitiofunktion lauseketta (9.) johdettaessa oletettiin, että kaasu esiintyy olosuhteissa, joita voidaan luonnehtia klassisiksi. Tällöin kaasun lämpötila on niin kokea, että molekyylien tavoitettavissa on niiden lukumääään veattuna hyvin paljon yksihiukkastiloja. Tästä seuaa, että suuin osa yksihiukkastiloista on tyhjiä ja käytännöllisesti katsoen kaikki molekyylit miehittävät ei tiloja. äin ollen kaikkien yksihiukkastilojen miehityslukujen n keskiavot n ovat hyvin pieniä: n 1. Milloin tämä ehto on voimassa? Boltzmannin jakaumafunktion (4.3) mukaan todennäköisyys sille, että yksi tietty molekyyli on yksihiukkastilassa = sα, on yhtälöiden (9.11) ja (9.1) mukaan p sα = 1 Z 1 e βɛ sα = 1 Z1 tz e β(ɛt s +ɛint int α ) = 1 Z t 1 Z int e βɛt s e βɛ int α. (9.3) Tämä on siis todennäköisyys sille, että ko. molekyylin tanslaatiotila on s ja samalla sen sisäinen tila on α. Kokonaistodennäköisyys sille, että molekyyli on tanslaatiotilassa s (iippumatta sen sisäisestä tilasta), on todennäköisyyksien (9.3) summa yli kaikkien sisäisten tilojen: p s = α p sα = 1 Z1 tz e βɛt s int α e βɛint α } {{ } Z int = 1 Z1 t e βɛt s. (9.4) Tässä on käytetty hyväksi sisäisen patitiofunktion määitelmää (9.14). Todennäköisyys p s ei siis iipu mitenkään molekyylin sisäisestä akenteesta.
7 Jos molekyylien lukumäää olisi paljon suuempi kuin yksihiukkastilojen = sα lukumäää ja ne käyttäytyisivät toisistaan iippumattomasti, tilassa sα olisi todennäköisyyden fekvenssitulkinnan mukaan yhteensä n sα = p sα molekyyliä. Tällöin siis tilan sα miehitysluku olisi p sα 1. Klassisen ideaalikaasun tapauksessa on kuitenkin niin pieni, että p sα 1. Tässä tapauksessa p sα voidaan tulkita miehitysluvun n sα keskiavoksi n sα. Ideaalikaasu käyttäytyy siis klassisesti, jos seuaava ehto on voimassa: 117 n sα = p sα 1 kaikilla s:n ja α:n avoilla. (9.5) Tämän epäyhtälön vasen puoli kasvaa, jos se kovataan summalla yli molekyylin kaikkien sisäisten tilojen. äin saadaan yksinketaisempi, mutta ankaampi ehto n s = α n sα = α p sα = p s 1 kaikilla s:n avoilla. (9.6) Tämä epäyhtälö vaatii, että kaikkien tanslaatiotilojen s keskimäääiset miehitysluvut n s ovat hyvin pieniä. Kyseessä on tiukempi ehto kuin epäyhtälössä (9.5) esitetty, sillä jokaiseen tanslaatiotilaan kuuluu yleensä useita yksihiukkastiloja (molekyyli voi olla monessa eilaisessa sisäisessä tilassa). Käyttämällä p s :n lauseketta (9.4) ja sijoittamalla siihen Z t 1 :n lauseke (9.19) epäyhtälö (9.6) saadaan muotoon n s = p s = Z1 t e βɛt s = V ( h πmkt ) 3/ e βɛt s 1. (9.7) Tämä ehto on voimassa kaikille tanslaatiotiloille, jos se on voimassa peustilalle, jossa tanslaatioenegia on nolla (ɛ t s = 0). Tästä saadaan ehto V ( h πmkt ) 3/ 1. (9.8) Epäyhtälö (9.8) antaa matemaattisesti fomuloituna iittävän ehdon sille, että ideaalikaasu käyttäytyy klassisesti. Se on automaattisesti voimassa klassisella ajalla h 0. Tästä syystä kappaleissa 9-1 ja 9- johdettua statistiikkaa kutsutaan klassiseksi tai Maxwell-Boltzmann-statistiikaksi. Kuten voidaan odottaa, ehto (9.8) on sitä paemmin voimassa, mitä pienempi on kaasun hiukkastiheys ϱ = /V, mitä suuempi on molekyylin massa m, ja mitä kokeampi on lämpötila T. Epäyhtälölle (9.8) saadaan selkeä fysikaalinen tulkinta esittämällä se hiukkasen kvanttimekaanisen aaltofunktion aallonpituuden λ avulla. Jos hiukkasen liikemäää on p, sen aallonpituus on λ = h p = h, (9.9) mɛ t missä p on esitetty hiukkasen tanslaatioenegian ɛ t = p /m funktiona. Myöhemmin osoitetaan, että klassisessa ideaalikaasussa molekyylin tanslaatioenegian keskiavo on ɛ t = 3 kt. äin ollen aallonpituus on suuuusluokkaa λ h m ɛ t = h 3mkT. (9.30)
8 118 Kun tämä tulos sijoitetaan epäyhtälöön (9.8), se saa muodon ( ) 3/ 3 π V λ3 1. (9.31) Koska V/ on tilavuus yhtä molekyyliä kohti, se voidaan kijoittaa muodossa V/ = l 3, missä l on lähimpien naapuimolekyylien keskimäääinen etäisyys toisistaan. Jättämällä lisäksi epäyhtälön (9.31) kannalta mekityksetön tekijä (3/π) 3/ 0,330 huomiotta saadaan yksinketainen lopputulos λ 3 l 3. (9.3) Ideaalikaasu käyttäytyy klassisesti, jos molekyylien aallonpituus on pieni niiden välimatkoihin veattuna. Tällöin molekyylien kvanttimekaanisella aaltoluonteella ei ole mekitystä ja ne käyttäytyvät kuten klassista mekaniikkaa noudattavat hiukkaset. Esimekki Ideaalikaasun hiukkastiheys on nomaaliolosuhteissa (lämpötilassa 0 C ja paineessa 1 atm) tilanyhtälön P V = kt mukaan ϱ = /V = P/kT =, molekyyliä/m 3. Tällöin lähimpien naapuimolekyylien keskimäääinen etäisyys toisistaan on l = (V/) 1/3 = 3, m = 3,34 nm. Kevyimmän kaasun, vedyn (H ), moolimassa on M m =, 016 g/mol, joten H -molekyylin massa on m = M m / A = 3, kg. Yhtälöllä (9.30) laskettu H -molekyylin aallonpituus lämpötilassa 0 C on λ = 1, m = 0,108 nm. Koska λ = 0, 11 nm 3, 34 nm = l ja (λ/l) 3 = 3, , voidaan päätellä, että nomaaleissa olosuhteissa kevytkin kaasu käyttäytyy vasin matalissakin lämpötiloissa klassisesti. 9-4 Temodynaamiset ominaisuudet Klassisen ideaalikaasun patitiofunktiosta (9.) saadaan systeemin Helmholtzin vapaan enegian (5.9) lausekkeeksi [ ( ) 3/ ev πmkt F = F (T, V, ) = kt ln Z(T, V, ) = kt ln h Z int(t )]. (9.33) äin saatu funktio F on suoaan veannollinen molekyylien lukumääään ja muut siinä esiintyvät tilamuuttujat (lämpötila T ja hiukkastiheys /V ) ovat systeemin koosta iippumattomia (intensiivisiä) suueita. äin ollen F on ekstensiivinen suue, kuten elaatio F = E T S vaatiikin. Tämä tulos on seuausta molekyylien identtisyydestä johtuvan tekijän 1/! mukanaolosta klassisen ideaalikaasun patitiofunktion lausekkeessa (9.10). Helmholtzin vapaa enegia (9.33) voidaan esittää kahden temin summana: F (T, V, ) = F t (T, V, ) + F int (T, ). (9.34) Ensimmäinen temi F t (T, V, ) = kt ln [ ev ( ) ] 3/ πmkt h (9.35)
9 on molekyylien tanslaatioenegian antama osuus Helmholtzin vapaaseen enegiaan. Sen lauseke ei iipu molekyylien sisäisestä akenteesta. Jälkimmäinen temi 119 F int (T, ) = kt ln [Z int (T )] (9.36) on molekyylien sisäisen enegian antama osuus, jonka lauseke on eityyppisille molekyyleille eilainen. Tilanyhtälö Klassisen ideaalikaasun tilanyhtälö saadaan paineen lausekkeesta (5.19) tai (7.39), P = ( F/ V ) T,. Koska F :n jälkimmäinen temi F int (T, ) ei iipu tilavuudesta V, tilanyhtälöksi saadaan kaasumolekyylien sisäisestä akenteesta iippumatta P = ( Ft V ) T, = kt V. (9.37) Tuloksena on klassiselle ideaalikaasulle kokeellisesti saatu tilanyhtälö P V = kt (1.1), jonka avulla on kappaleessa 1-3 määitelty ideaalikaasulämpötila T. Yhtälössä (9.37) esiintyvä T on temodynaaminen lämpötila, joka peustuu kappaleessa 4-4 tehtyyn valintaan ( ) S E V, = 1 T. (4.9) Tulos (9.37) osoittaa, että yhtälöllä (4.9) määitelty temodynaaminen lämpötila-asteikko on identtinen ideaalikaasulämpötila-asteikon kanssa. Samaan johtopäätökseen päädyttiin aikaisemmin (kappaleessa 6-) Canot n kietoposessia analysoimalla. Sisäinen enegia Makoskooppisen systeemin sisäisellä enegialla E takoitetaan sen keskiavoa E, joka on yhtälön (4.30) mukaan E = E = ( ln Z/ β) V,. Toisaalta yhtälön (5.9) mukaan ln Z = F/kT. äin ollen klassisen ideaalikaasun sisäinen enegia on kahden temin summa: E = E t + E int. (9.38) Molekyylien tanslaatioenegian antama osuus kaasun enegiaan on ( ) (Ft /kt ) E t (T, ) = β V, = 3 kt. (9.39) Tämä tulos osoittaa, että yhden molekyylin tanslaatioenegian keskiavo on ɛ t = 3 kt, (9.40) mikä on sopusoinnussa aikaisemmin esitetyn tuloksen (.39) kanssa. Molekyylien sisäisen enegian antama osuus on ( ) (Fint /kt ) E int (T, ) = β V, = d ln [Z int(t )]. (9.41) dβ
10 Yhden molekyylin sisäisen enegian keskiavo on siis ɛ int = d ln Z int /dβ, kuten yhtälö (4.30) edellyttääkin. On syytä koostaa, että E int ei ole sama kuin kaasun sisäinen enegia E, vaan molekyylien sisäisen enegian siihen antama osuus. Yhtälöt (9.39) ja (9.41) osoittavat, että sekä E t että E int ovat kaasun tilavuudesta V iippumattomia. äin ollen tietyn kaasumäään ( kiinnitetty) sisäinen enegia on vain lämpötilan funktio: E = E(T ). Sama tulos johdettiin aikaisemmin (kappaleessa -3) matematiikkaa käyttämättä suoaan ideaalikaasun yleisistä ominaisuuksista. Lämpökapasiteetti Koska E = E(T ), myös tietyn kaasumäään lämpökapasiteetti vakiotilavuudessa, C V = ( E/ T ) V, (.11), on kaikilla klassisilla ideaalikaasuilla vain lämpötilan funktio (molekyylien sisäisestä akenteesta iippumatta): C V = C V (T ). Molekyylien tanslaatioenegian antama osuus kaasun lämpökapasiteettiin vakiotilavuudessa on ( ) CV t Et () = = 3 k, (9.4) T joka on lämpötilasta iippumaton. Tämän lisäksi molekyylien sisäinen enegia antaa lämpökapasiteettiin osuuden ( ) CV int Eint (T, ) =, (9.43) T joka on yleisessä tapauksessa lämpötilan funktio. Yksiatomisilla kaasuilla (jalokaasuilla) CV int on nomaaleissa lämpötiloissa nolla. Tämä johtuu siitä, että yksittäisen atomin sisäinen enegia on sen elektonisysteemin enegiaa. Atomin siitäminen elektonisysteemin peustilasta (enegiasta ɛ int 1 ) mihin tahansa kokeampaan enegiatilaan (enegiaan ɛ int α ) vaatii tavallisesti vähintään usean ev:n enegian. Temistä enegiaa ei kuitenkaan ole nomaaleissa lämpötiloissa saatavissa näin suuina annoksina. Esimekiksi 300 K:n lämpötilassa molekyylin tanslaatioenegian keskiavo on yhtälön (9.40) mukaan ɛ t = 3 kt = 0,039 ev. Yhtälön (7.47) mukaan enegioiden ɛ int α ja ɛ int 1 esiintymistodennäköisyyksien suhde on suoaan veannollinen Boltzmannin tekijään exp[ (ɛ int α ɛ int 1 )/kt ], joka on hyvin lähellä nollaa, kun (ɛ int α ɛ int 1 ) kt. Teminen enegia ei siis nomaaleissa lämpötiloissa iitä atomin siitämiseen peustilan yläpuolelle. Tällöin atomin sisäisen enegian keskiavo ɛ int on sama kuin peustilan enegia ɛ int 1, joka ei iipu lämpötilasta. äin ollen atomien sisäisen enegian antama osuus kaasun enegiaan, E int = ɛ int = ɛ int 1, on lämpötilasta iippumaton, ja sen deivaatta = ( E int/ T ) on nolla. C int V Yksiatomisten ideaalikaasujen lämpökapasiteetti vakiotilavuudessa on siis yhtälön (9.4) mukaan C V = CV t = 3 k. Jos kaasua on yksi mooli, C V = CV m = 3 k A = 3 R = 1,47 J/(mol K). Tämä teoeettinen tulos vastaa eittäin hyvin (noin 1 %:n takkuudella) kokeellisesti määitettyjä jalokaasujen lämpökapasiteetteja. Moniatomisen molekyylin sisäinen enegia muodostuu elektonisen enegian lisäksi molekyylin pyöimis- ja väähdysliikkeen enegioista. äiden liikkeiden (eityisesti pyöimisliikkeen) enegiatasot ovat paljon lähempänä toisiaan kuin elektonisysteemin enegiatasot. Tästä syystä teminen enegia iittää jo huoneen lämpötilassa siitämään osan molekyyleistä peustilan yläpuolelle (lähinnä pyöimisliikkeen viitettyihin tiloihin). Tällöin molekyylin sisäisen enegian keskiavo ɛ int on lämpötilan funktio ja CV int eoaa nollasta. Tätä tapausta takastellaan kappaleessa
11 11 Entopia Klassisen ideaalikaasun entopian lauseke saadaan yhtälöstä S = ( F/ T ) V, (7.39). Yhtälön (9.34) mukaan sekin on kahden temin summa, S(T, V, ) = S t (T, V, ) + S int (T, ). Molekyylien tanslaatioliikkeen antama osuus on S t (T, V, ) = ( Ft T ) V, = k [ ln V + 3 ln T ln ( πmk h )]. (9.44) Entopia voidaan esittää myös muuttujien E, V ja funktiona sijoittamalla S(T, V, ):n lausekkeeseen T :n paikalle funktio T = T (E, ). Yksiatomisen ideaalikaasun enegia on yhtälöiden (9.38) ja (9.39) mukaan E = E t = 3 kt, missä molekyylien sisäisen enegian antama osuus E int = ɛ int = ɛ int 1 on lämpötilasta iippumaton vakio, joka on valittu nollaksi. Tällöin T = E/(3 k) ja yhtälöstä (9.44) saadaan S(E, V, ):n lausekkeeksi [ S(E, V, ) = k ln V + 3 ln E ( )] 4πm ln 3h. (9.45) Tämä on muotoa S(E, V, ) = k ln(v E 3/ ) + C, kuten aikaisemmin johdettu yhtälö (5.3) edellyttää. Yhtälöstä (9.45) nähdään, että lausekkeen (5.3) integoimisvakio on C = 1 k[ 5 ln ln(4πm/3h )]. Temodynamiikan kolmannen pääsäännön (kappale 7-4) mukaan systeemin entopia lähestyy lämpötilan laskiessa ei-negatiivista vakiota, joka on yhtälön (7.48) mukaan k ln g(e 1 ). Yhtälön (9.44) mukainen entopia ei kuitenkaan käyttäydy tällä tavoin, sillä se tulee matalissa lämpötiloissa negatiiviseksi ja itse asiassa divegoi absoluuttisessa nollapisteessä (tällöin S t ). Yhtälön (9.4) mukainen lämpökapasiteetti ei myöskään käyttäydy odotusten mukaisesti, sillä yhtälön (7.5) vastaisesti se ei lähesty lämpötilan laskiessa nollaa. Tämä johtuu siitä, että klassisuusehto ei toteudu alhaisissa lämpötiloissa. Esimekiksi epäyhtälö (9.8) ei voi olla voimassa, jos T 0. Maxwellin nopeusjakauma Yhtälöiden (9.7) ja (9.15) mukaan yhdessä tanslaatiotilassa s olevien molekyylien keskimäääinen lukumäää on n s = V ( h πmkt ) 3/ e p s /mkt. (9.46) Kaikki kapealla liikemääävälillä (p, p + dp) olevat n s :n ja p s :n avot voidaan kovata indeksistä s iippumattomilla vakioilla n ja p. Ketomalla yhtälön (9.46) mukainen keskimäääinen miehitysluku n s = n yhtälön (9.16) mukaisella tilojen lukumääällä liikemääävälillä (p, p + dp), f(p) dp, saadaan tällä välillä olevien molekyylien keskimäääiseksi lukumäääksi n f(p)dp = 4πp dp e p /mkt. (9.47) (πmkt ) 3/ Todennäköisyys sille, että jonkin tietyn molekyylin liikemäää on välillä (p, p + dp), saadaan jakamalla tällä välillä olevien molekyylien lukumäää (9.47) molekyylien kokonaislukumääällä. Tälle todennäköisyydelle käytetään mekintää P (p) dp, missä P (p) on takasteltavan jakauman todennäköisyystiheys: P (p) dp = n f(p)dp = 4πp dp e p /mkt. (9.48) (πmkt ) 3/
12 Jos molekyylin liikemäää p esitetään yhtälössä (9.48) muodossa p = mv, missä v on molekyylin nopeuden itseisavo (vauhti, engl. speed), saadaan todennäköisyys sille, että molekyylin vauhti on välillä (v, v + dv): ( m ) 3/ P (p) dp = P (v) dv = 4πv dv e mv /kt. (9.49) πkt Tälle todennäköisyydelle käytetään mekintää P (v) dv, missä esiintyvä todennäköisyystiheys P (v) on Maxwellin (tai Maxwell-Boltzmannin) vauhtijakaumafunktio (engl. Maxwell speed distibution function). Todennäköisyys sille, että takasteltavan molekyylin nopeusvektoin v komponentit v x, v y ja v z ovat pienillä väleillä (v x, v x + dv x ), (v y, v y + dv y ) ja (v z, v z + dv z ), on 1 P (v x, v y, v z ) dv x dv y dv z P (v) d 3 v, (9.50) missä määitelty P (v) on Maxwellin (tai Maxwell-Boltzmannin) nopeusjakaumafunktio (engl. Maxwell velocity distibution function). Tämän funktion voidaan kuvitella esiintyvän nopeusvektoien v muodostamassa kolmiulotteisessa avauudessa, nopeusavauudessa, jonka koodinaatit ovat v x, v y ja v z. Tulo dv x dv y dv z = d 3 v on tällaisen avauuden tilavuuselementin tilavuus. äin ollen P (v) d 3 v on todennäköisyys sille, että nopeusvektoin käkipiste osuu nopeusavauudessa pisteen v ympäillä olevan tilavuuuselementin d 3 v alueelle. Todennäköisyys sille, että nopeusvektoin itseisavo on pienellä välillä (v, v + dv) vektoin suunnasta iippumatta, on todennäköisyyksien P (v) d 3 v summa (integaali) yli nopeusavauuden ohuen pallonkuoen, jonka säde on v ja paksuus on dv: P (v) dv = P (v) d 3 v. (9.51) (v,v+dv) Koska tämän täytyy olla sama kuin yhtälöllä (9.49) määitelty vauhdin esiintymistodennäköisyys P (v) dv, sille käytetään tätä mekintää. Ideaalikaasu käyttäytyy kaikissa suunnissa samalla tavalla, joten nopeusvektoin v esiintymistodennäköisyys ei voi iippua v:n suunnasta. Tämä mekitsee sitä, että nopeusjakauman P (v) täytyy olla v:n suunnasta iippumaton (pallosymmetinen eli isotooppinen) funktio. Sen täytyy saada sama avo nopeusavauuden kaikissa niissä pisteissä, jotka ovat samalla etäisyydellä v oigosta. äin ollen yhtälössä (9.51) esiintyvä funktio P (v) voidaan siitää integaalimekin eteen: P (v) dv = P (v) d 3 v = 4πv dvp (v). (9.5) (v,v+dv) Jäljelle jäänyt integaali on takasteltavan pallonkuoen tilavuus, joka on 4πv dv. Kun tulosta (9.5) veataan yhtälöön (9.49), voidaan todeta, että Maxwellin nopeusjakaumafunktio on ( m ) 3/ P (v) = e mv /kt. (9.53) πkt Koska v = vx + vy + vz, nopeusjakaumafunktio P (v) sepaoituu kolmen tekijän tuloksi: P (v) = P (v x )P (v y )P (v z ), missä P (v x ), P (v y ) ja P (v z ) ovat nopeuden x-, y- ja z-komponenttien jakaumafunktiot. e ovat kaikki muotoa ( m ) 1/ P (v i ) = e mv i /kt. (9.54) πkt
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
5-1 Gibbsin entropia. Boltzmannin entropian lausekkeessa S = k ln Ω esiintyvä Ω on systeemin niiden mikrotilojen
 57 5 Yhdistetty pääsääntö 5-1 Gibbsin entopia Boltzmannin entopian lausekkeessa S = k ln Ω esiintyvä Ω on systeemin niiden mikotilojen lukumäää, joissa systeemin sisäinen enegia on hyvin pienellä välillä
57 5 Yhdistetty pääsääntö 5-1 Gibbsin entopia Boltzmannin entopian lausekkeessa S = k ln Ω esiintyvä Ω on systeemin niiden mikotilojen lukumäää, joissa systeemin sisäinen enegia on hyvin pienellä välillä
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
1. Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta
 766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 10, ratkaisut (syyslukukausi 2014)
 7668A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 4). Johdetaan yksiatomisen klassisen ideaalikaasun kemiallisen potentiaalin µ(t,, N) lauseke. (a) Luentojen yhtälön mukaan kemiallinen potentiaali
7668A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 4). Johdetaan yksiatomisen klassisen ideaalikaasun kemiallisen potentiaalin µ(t,, N) lauseke. (a) Luentojen yhtälön mukaan kemiallinen potentiaali
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
11 Kvantti-ideaalikaasu
 35 Kvantti-ideaalikaasu - Kvanttistatistiikka Kappaleessa 9 tarkasteltiin klassisissa olosuhteissa esiintyvää ideaalikaasua. Tällaisessa kaasussa molekyylien tavoitettavissa on niin paljon yksihiukkastiloja,
35 Kvantti-ideaalikaasu - Kvanttistatistiikka Kappaleessa 9 tarkasteltiin klassisissa olosuhteissa esiintyvää ideaalikaasua. Tällaisessa kaasussa molekyylien tavoitettavissa on niin paljon yksihiukkastiloja,
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]
![KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]](/thumbs/24/3803781.jpg) KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
Tietoa sähkökentästä tarvitaan useissa fysikaalisissa tilanteissa, esimerkiksi jos halutaan
 3 Sähköstatiikan laskentamenetelmiä Tietoa sähkökentästä tavitaan useissa fysikaalisissa tilanteissa, esimekiksi jos halutaan tietää missäläpilyönti on todennäköisin suujännitelaitteessa tai mikä on kahden
3 Sähköstatiikan laskentamenetelmiä Tietoa sähkökentästä tavitaan useissa fysikaalisissa tilanteissa, esimekiksi jos halutaan tietää missäläpilyönti on todennäköisin suujännitelaitteessa tai mikä on kahden
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
Ylioppilastutkintolautakunta S t u d e n t e x a m e n s n ä m n d e n
 Ylioilastutkintolautakunta S t u d e n t e x a m e n s n ä m n d e n MATEMATIIKAN KOE, PITKÄ OPPIMÄÄRÄ 904 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten iiteiden, sisältöjen ja isteitysten luonnehdinta
Ylioilastutkintolautakunta S t u d e n t e x a m e n s n ä m n d e n MATEMATIIKAN KOE, PITKÄ OPPIMÄÄRÄ 904 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten iiteiden, sisältöjen ja isteitysten luonnehdinta
8. Klassinen ideaalikaasu
 Statistinen fysiikka, osa B (FYSA242) Tuomas Lappi tuomas.v.v.lappi@jyu.fi Huone: FL240. Ei kiinteitä vastaanottoaikoja. kl 2016 8. Klassinen ideaalikaasu 1 Fysikaalinen tilanne Muistetaan: kokeellisesti
Statistinen fysiikka, osa B (FYSA242) Tuomas Lappi tuomas.v.v.lappi@jyu.fi Huone: FL240. Ei kiinteitä vastaanottoaikoja. kl 2016 8. Klassinen ideaalikaasu 1 Fysikaalinen tilanne Muistetaan: kokeellisesti
Öljysäiliö maan alla
 Kaigasniemen koulu Öljysäiliö maan alla Yläkoulun ketaava ja syventävä matematiikan tehtävä Vesa Maanselkä 009 Ostat talon jossa on öljylämmitys. Takapihalle on kaivettu maahan sylintein muotoinen öljysäiliö
Kaigasniemen koulu Öljysäiliö maan alla Yläkoulun ketaava ja syventävä matematiikan tehtävä Vesa Maanselkä 009 Ostat talon jossa on öljylämmitys. Takapihalle on kaivettu maahan sylintein muotoinen öljysäiliö
Mikrotila Makrotila Statistinen paino Ω(n) 3 Ω(3) = 4 2 Ω(2) = 6 4 Ω(4) = 1
 76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
Sähkökentät ja niiden laskeminen I
 ähkökentät ja niiden laskeminen I IÄLTÖ: 1.1. Gaussin lain integaalimuoto ähkökentän vuo uljetun pinnan sisään jäävän kokonaisvaauksen laskeminen Vinkkejä Gaussin lain käyttöön laskettaessa sähkökenttiä
ähkökentät ja niiden laskeminen I IÄLTÖ: 1.1. Gaussin lain integaalimuoto ähkökentän vuo uljetun pinnan sisään jäävän kokonaisvaauksen laskeminen Vinkkejä Gaussin lain käyttöön laskettaessa sähkökenttiä
kertausta Boltzmannin jakauma infoa Ideaalikaasu kertausta Maxwellin ja Boltzmannin vauhtijakauma
 infoa kertausta Boltzmannin jakauma Huomenna itsenäisyyspäivänä laitos on kiinni, ei luentoa, ei laskareita. Torstaina laboratoriossa assistentit neuvovat myös laskareissa. Ensi viikolla tiistaina vielä
infoa kertausta Boltzmannin jakauma Huomenna itsenäisyyspäivänä laitos on kiinni, ei luentoa, ei laskareita. Torstaina laboratoriossa assistentit neuvovat myös laskareissa. Ensi viikolla tiistaina vielä
ln2, missä ν = 1mol. ja lopuksi kaasun saama lämpömäärä I pääsäännön perusteella.
 S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
kertausta edellisestä seuraa, että todennäköisimmin systeemi löydetään sellaisesta mikrotilasta, jollaisia on
 tavoitteet kertausta Tiedät mitä on Boltzmann-jakauma ja osaat soveltaa sitä Ymmärrät miten päädytään kaasumolekyylien nopeusjakaumaan Ymmärrät kuinka voidaan arvioida hiukkasen vapaa matka Kaikki mikrotilat,
tavoitteet kertausta Tiedät mitä on Boltzmann-jakauma ja osaat soveltaa sitä Ymmärrät miten päädytään kaasumolekyylien nopeusjakaumaan Ymmärrät kuinka voidaan arvioida hiukkasen vapaa matka Kaikki mikrotilat,
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 206 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 2: BE- ja FD-jakaumat, kvanttikaasut Pe 5.4.206 AIHEET. Kvanttimekaanisesta vaihtosymmetriasta
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 206 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 2: BE- ja FD-jakaumat, kvanttikaasut Pe 5.4.206 AIHEET. Kvanttimekaanisesta vaihtosymmetriasta
Tapa II: Piirretään voiman F vaikutussuora ja lasketaan momentti sen avulla. Kuva 3. d r. voiman F vaikutussuora
 VOIMAN MOMENTTI Takastellaan jäykkää kappaletta, joka pääsee kietymään akselin O ympäi. VOIMAN MOMENTTI on voiman kietovaikutusta kuvaava suue. Voiman momentti määitellään voiman F ja voiman vaen tulona:
VOIMAN MOMENTTI Takastellaan jäykkää kappaletta, joka pääsee kietymään akselin O ympäi. VOIMAN MOMENTTI on voiman kietovaikutusta kuvaava suue. Voiman momentti määitellään voiman F ja voiman vaen tulona:
Lujuusopin jatkokurssi IV.1 IV. KUORIEN KALVOTEORIAA
 Lujuusoin jatkokussi IV. IV. KUORIE KALVOTEORIAA Kuoien kalvoteoiaa Lujuusoin jatkokussi IV. JOHDATO Kuoiakenteen keskiinta on jo ennen muoonmuutoksia kaaeva inta. Kaaevasta muoosta seuaa että keskiinnan
Lujuusoin jatkokussi IV. IV. KUORIE KALVOTEORIAA Kuoien kalvoteoiaa Lujuusoin jatkokussi IV. JOHDATO Kuoiakenteen keskiinta on jo ennen muoonmuutoksia kaaeva inta. Kaaevasta muoosta seuaa että keskiinnan
Vauhti = nopeuden itseisarvo. Nopeuden itseisarvon keskiarvo N:lle hiukkaselle määritellään yhtälöllä
 S-4.35, Fysiikka III (ES) entti 8.3.006. Laske nopeuden itseisarvon keskiarvo v ave ja nopeuden neliöllinen keskiarvo v rms seuraaville 6 molekyylien nopeusjakaumille: a) kaikkien vauhti 0 m/s, b) kolmen
S-4.35, Fysiikka III (ES) entti 8.3.006. Laske nopeuden itseisarvon keskiarvo v ave ja nopeuden neliöllinen keskiarvo v rms seuraaville 6 molekyylien nopeusjakaumille: a) kaikkien vauhti 0 m/s, b) kolmen
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokussi Fys10 Kevät 010 Jukka Maalampi LUENTO 5 Copyight 008 Peason Education, Inc., publishing as Peason Addison-Wesley. Newtonin painovoimateoia Knight Ch. 13 Satunuksen enkaat koostuvat
Mekaniikan jatkokussi Fys10 Kevät 010 Jukka Maalampi LUENTO 5 Copyight 008 Peason Education, Inc., publishing as Peason Addison-Wesley. Newtonin painovoimateoia Knight Ch. 13 Satunuksen enkaat koostuvat
4-1 Prosessien suunta
 43 4 Toinen pääsääntö 4-1 Posessien suunta Itsekseen jätetyn systeemin tilan tiedetään aina muuttuvan spontaanisti siten, että se lähestyy tasapainotilaa. Tällaiset luonnolliset posessit tapahtuvat siis
43 4 Toinen pääsääntö 4-1 Posessien suunta Itsekseen jätetyn systeemin tilan tiedetään aina muuttuvan spontaanisti siten, että se lähestyy tasapainotilaa. Tällaiset luonnolliset posessit tapahtuvat siis
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017 Emppu Salonen Lasse Laurson Toni Mäkelä Touko Herranen Luento 2: kineettistä kaasuteoriaa Pe 24.2.2017 1 Aiheet tänään 1. Maxwellin ja Boltzmannin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017 Emppu Salonen Lasse Laurson Toni Mäkelä Touko Herranen Luento 2: kineettistä kaasuteoriaa Pe 24.2.2017 1 Aiheet tänään 1. Maxwellin ja Boltzmannin
SMG-4200 Sähkömagneettisten järjestelmien lämmönsiirto Ehdotukset harjoituksen 3 ratkaisuiksi
 SMG-4 Sähkömagneettisten jäjestelmien lämmönsiito Ehdotukset hajoituksen 3 atkaisuiksi 1. Voidaan kohtuullisella takkuudella olettaa, että pallonmuotoisessa säiliössä lämpötila muuttuu vain pallon säteen
SMG-4 Sähkömagneettisten jäjestelmien lämmönsiito Ehdotukset hajoituksen 3 atkaisuiksi 1. Voidaan kohtuullisella takkuudella olettaa, että pallonmuotoisessa säiliössä lämpötila muuttuu vain pallon säteen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 7: Ekvipartitioteoreema, partitiofunktio ja ideaalikaasu Ke 16.3.2016 1 KURSSIN
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 7: Ekvipartitioteoreema, partitiofunktio ja ideaalikaasu Ke 16.3.2016 1 KURSSIN
Ekvipartitioperiaatteen mukaisesti jokaiseen efektiiviseen vapausasteeseen liittyy (1 / 2)kT energiaa molekyyliä kohden.
 . Hiilidioksidiolekyyli CO tiedetään lineaariseksi a) Mitkä ovat eteneisliikkeen, pyöriisliikkeen ja värähtelyn suuriat ekvipartitioperiaatteen ukaiset läpöenergiat olekyyliä kohden, kun kaikki vapausasteet
. Hiilidioksidiolekyyli CO tiedetään lineaariseksi a) Mitkä ovat eteneisliikkeen, pyöriisliikkeen ja värähtelyn suuriat ekvipartitioperiaatteen ukaiset läpöenergiat olekyyliä kohden, kun kaikki vapausasteet
S Fysiikka III (EST) Tentti ja välikoeuusinta
 S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
S , Fysiikka III (ES) Tentti Tentti / välikoeuusinta
 S-11435, Fysiikka III (ES) entti 4113 entti / välikoeuusinta I Välikokeen alue 1 Viiden tunnistettavissa olevan identtisen hiukkasen mikrokanonisen joukon käytettävissä on neljä tasavälistä energiatasoa,
S-11435, Fysiikka III (ES) entti 4113 entti / välikoeuusinta I Välikokeen alue 1 Viiden tunnistettavissa olevan identtisen hiukkasen mikrokanonisen joukon käytettävissä on neljä tasavälistä energiatasoa,
= 84. Todennäköisin partitio on partitio k = 6,
 S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
Ideaalikaasulaki. Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua
 Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Fysp240/1 Ising-malli (lyhyt raportti)
 Tiia Monto Työ tehty: 19.1. tiia.monto@jyu. 7515 Fysp/1 Ising-malli (lyhyt apotti) Assistentti: Avostellaan (joko hyväksytty tai hylätty) Työ jätetty: Abstact I simulated paamagnet, feomagnet and antifeomagnet
Tiia Monto Työ tehty: 19.1. tiia.monto@jyu. 7515 Fysp/1 Ising-malli (lyhyt apotti) Assistentti: Avostellaan (joko hyväksytty tai hylätty) Työ jätetty: Abstact I simulated paamagnet, feomagnet and antifeomagnet
HYDRODYNAMIIKKA 763654S. Erkki Thuneberg
 HYDRODYNAMIIKKA 763654S Ekki Thunebeg Fysiikan laitos Oulun yliopisto 2011 Jäjestelyjä Kussin vekkosivu on https://wiki.oulu.fi/display/763654s/etusivu Vekkosivulta löytyy luentomateiaali (tämä moniste),
HYDRODYNAMIIKKA 763654S Ekki Thunebeg Fysiikan laitos Oulun yliopisto 2011 Jäjestelyjä Kussin vekkosivu on https://wiki.oulu.fi/display/763654s/etusivu Vekkosivulta löytyy luentomateiaali (tämä moniste),
1 Eksergia ja termodynaamiset potentiaalit
 1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
y 2 h 2), (a) Näytä, että virtauksessa olevan fluidialkion tilavuus ei muutu.
 Tehtävä 1 Tarkastellaan paineen ajamaa Poisseuille-virtausta kahden yhdensuuntaisen levyn välissä Levyjen välinen etäisyys on 2h Nopeusjakauma raossa on tällöin u(y) = 1 dp ( y 2 h 2), missä y = 0 on raon
Tehtävä 1 Tarkastellaan paineen ajamaa Poisseuille-virtausta kahden yhdensuuntaisen levyn välissä Levyjen välinen etäisyys on 2h Nopeusjakauma raossa on tällöin u(y) = 1 dp ( y 2 h 2), missä y = 0 on raon
1240eV nm. 410nm. Kun kappaleet saatetaan kontaktiin jännite-ero on yhtä suuri kuin työfunktioiden erotus ΔV =
 S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
6. Yhteenvetoa kurssista
 Statistinen fysiikka, osa A (FYSA241) Vesa Apaja vesa.apaja@jyu.fi Huone: YN212. Ei kiinteitä vastaanottoaikoja. kl 2016 6. Yhteenvetoa kurssista 1 Keskeisiä käsitteitä I Energia TD1, siirtyminen lämpönä
Statistinen fysiikka, osa A (FYSA241) Vesa Apaja vesa.apaja@jyu.fi Huone: YN212. Ei kiinteitä vastaanottoaikoja. kl 2016 6. Yhteenvetoa kurssista 1 Keskeisiä käsitteitä I Energia TD1, siirtyminen lämpönä
Kvanttifysiikan perusteet 2017
 Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Ylioppilastutkintolautakunta S t u d e n t e x a m e n s n ä m n d e n
 Ylioilastutkintolautakunta S t u d e n t e a m e n s n ä m n d e n MATEMATIIKAN KOE PITKÄ OPPIMÄÄRÄ 904 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten iiteiden sisältöjen isteitysten luonnehdinta ei
Ylioilastutkintolautakunta S t u d e n t e a m e n s n ä m n d e n MATEMATIIKAN KOE PITKÄ OPPIMÄÄRÄ 904 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten iiteiden sisältöjen isteitysten luonnehdinta ei
TILASTOLLISEN KVANTTIMEKANIIKAN PERUSTEITA (AH 5.1-5.3) Mikrotilat (kertausta Kvanttimekaniikan kurssilta)
 TILASTOLLISEN KVANTTIMEKANIIKAN PERUSTEITA (AH 5.1-5.3) Mikrotilat (kertausta Kvanttimekaniikan kurssilta) Kvanttimekaniikassa yhden hiukkasen systeemin täydellisen kuvauksen antaa tilavektori, joka on
TILASTOLLISEN KVANTTIMEKANIIKAN PERUSTEITA (AH 5.1-5.3) Mikrotilat (kertausta Kvanttimekaniikan kurssilta) Kvanttimekaniikassa yhden hiukkasen systeemin täydellisen kuvauksen antaa tilavektori, joka on
Ilman suhteellinen kosteus saadaan, kun ilmassa olevan vesihöyryn osapaine jaetaan samaa lämpötilaa vastaavalla kylläisen vesihöyryn paineella:
 ILMANKOSTEUS Ilmankosteus tarkoittaa ilmassa höyrynä olevaa vettä. Veden määrä voidaan ilmoittaa höyryn tiheyden avulla. Veden osatiheys tarkoittaa ilmassa olevan vesihöyryn massaa tilavuusyksikköä kohti.
ILMANKOSTEUS Ilmankosteus tarkoittaa ilmassa höyrynä olevaa vettä. Veden määrä voidaan ilmoittaa höyryn tiheyden avulla. Veden osatiheys tarkoittaa ilmassa olevan vesihöyryn massaa tilavuusyksikköä kohti.
7 Termodynaamiset potentiaalit
 82 7 ermodynaamiset potentiaalit 7-1 Clausiuksen epäyhtälö Kappaleessa 4 tarkasteltiin Clausiuksen entropiaperiaatetta, joka määrää eristetyssä systeemissä (E, ja N vakioita) tapahtuvien prosessien suunnan.
82 7 ermodynaamiset potentiaalit 7-1 Clausiuksen epäyhtälö Kappaleessa 4 tarkasteltiin Clausiuksen entropiaperiaatetta, joka määrää eristetyssä systeemissä (E, ja N vakioita) tapahtuvien prosessien suunnan.
Erityinen suhteellisuusteoria (Harris luku 2)
 Erityinen suhteellisuusteoria (Harris luku 2) Yliopistonlehtori, TkT Sami Kujala Mikro- ja nanotekniikan laitos Kevät 2016 Ajan ja pituuden suhteellisuus Relativistinen työ ja kokonaisenergia SMG-aaltojen
Erityinen suhteellisuusteoria (Harris luku 2) Yliopistonlehtori, TkT Sami Kujala Mikro- ja nanotekniikan laitos Kevät 2016 Ajan ja pituuden suhteellisuus Relativistinen työ ja kokonaisenergia SMG-aaltojen
Integroimalla ja käyttämällä lopuksi tilanyhtälöä saadaan T ( ) ( ) H 5,0 10 J + 2,0 10 0,50 1,0 10 0,80 Pa m 70 kj
 S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
Luento 8. Lämpökapasiteettimallit Dulong-Petit -laki Einsteinin hilalämpömalli Debyen ääniaaltomalli. Sähkönjohtavuus Druden malli
 Luento 8 Lämpökapasiteettimallit Dulong-Petit -laki Einsteinin hilalämpömalli Debyen ääniaaltomalli Sähkönjohtavuus Druden malli Klassiset C V -mallit Termodynamiikka kun Ei ennustetta arvosta! Klassinen
Luento 8 Lämpökapasiteettimallit Dulong-Petit -laki Einsteinin hilalämpömalli Debyen ääniaaltomalli Sähkönjohtavuus Druden malli Klassiset C V -mallit Termodynamiikka kun Ei ennustetta arvosta! Klassinen
Teddy 1. välikoe kevät 2008
 Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Opiskeluintoa ja menestystä tuleviin valintakokeisiin!
 RATKAISUT TESTIKYSYMYKSIIN Tästä löydät astaukset lääketieteen alintakoetyyppisiin testikysymyksiin. Jos osa kysymyksistä tuotti sinulle paljon päänaiaa, älä masennu, keään alintakokeeseen on ielä pitkä
RATKAISUT TESTIKYSYMYKSIIN Tästä löydät astaukset lääketieteen alintakoetyyppisiin testikysymyksiin. Jos osa kysymyksistä tuotti sinulle paljon päänaiaa, älä masennu, keään alintakokeeseen on ielä pitkä
Luku 13 KAASUSEOKSET
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2010 Luku 13 KAASUSEOKSET Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2010 Luku 13 KAASUSEOKSET Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction
Matematiikan kurssikoe, Maa 9 Integraalilaskenta RATKAISUT Torstai A-OSA
 Matematiikan kussikoe, Maa 9 Integaalilaskenta RATKAISUT Tostai..8 A-OSA Sievin lukio. a) Integoi välivaiheineen i) (x t ) dt ii) x dx. b) Määittele integaalifunktio. c) i) Olkoon 5 f(x) dx =, f(x) dx
Matematiikan kussikoe, Maa 9 Integaalilaskenta RATKAISUT Tostai..8 A-OSA Sievin lukio. a) Integoi välivaiheineen i) (x t ) dt ii) x dx. b) Määittele integaalifunktio. c) i) Olkoon 5 f(x) dx =, f(x) dx
Tarkastellaan tilannetta, jossa kappale B on levossa ennen törmäystä: v B1x = 0:
 8.4 Elastiset törmäykset Liike-energia ja liikemäärä säilyvät elastisissa törmäyksissä Vain konservatiiviset voimat vaikuttavat 1D-tilanteessa kappaleiden A ja B törmäykselle: 1 2 m Av 2 A1x + 1 2 m Bv
8.4 Elastiset törmäykset Liike-energia ja liikemäärä säilyvät elastisissa törmäyksissä Vain konservatiiviset voimat vaikuttavat 1D-tilanteessa kappaleiden A ja B törmäykselle: 1 2 m Av 2 A1x + 1 2 m Bv
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
Käyttämällä annettua kokoonpuristuvuuden määritelmää V V. = κv P P = P 0 = P. (b) Lämpölaajenemisesta johtuva säiliön tilavuuden muutos on
 766328A ermofysiikka Harjoitus no. 3, ratkaisut (syyslukukausi 201) 1. (a) ilavuus V (, P ) riippuu lämpötilasta ja paineesta P. Sen differentiaali on ( ) ( ) V V dv (, P ) dp + d. P Käyttämällä annettua
766328A ermofysiikka Harjoitus no. 3, ratkaisut (syyslukukausi 201) 1. (a) ilavuus V (, P ) riippuu lämpötilasta ja paineesta P. Sen differentiaali on ( ) ( ) V V dv (, P ) dp + d. P Käyttämällä annettua
40 LUKU 3. GAUSSIN LAKI
 Luku 3 Gaussin laki 3.1 Coulombin laista Gaussin lakiin Takastellaan pistemäisen vaauksen q aiheuttamaa sähkökenttää, joka noudattaa yhtälöä (1.1). Tämän sähkökentän vuo etäisyydellä olevan pienen pintaelementin
Luku 3 Gaussin laki 3.1 Coulombin laista Gaussin lakiin Takastellaan pistemäisen vaauksen q aiheuttamaa sähkökenttää, joka noudattaa yhtälöä (1.1). Tämän sähkökentän vuo etäisyydellä olevan pienen pintaelementin
Lämmityksen lämpökerroin: Jäähdytin ja lämmitin ovat itse asiassa sama laite, mutta niiden hyötytuote on eri, jäähdytyksessä QL ja lämmityksessä QH
 Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 2: Kaasujen kineettistä teoriaa Pe 26.2.2016 1 AIHEET 1. Maxwellin-Boltzmannin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 2: Kaasujen kineettistä teoriaa Pe 26.2.2016 1 AIHEET 1. Maxwellin-Boltzmannin
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 4: Entropia Maanantai 21.11. ja tiistai 22.11. Ideaalikaasun isoterminen laajeneminen Kaasuun tuodaan määrä Q lämpöä......
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 4: Entropia Maanantai 21.11. ja tiistai 22.11. Ideaalikaasun isoterminen laajeneminen Kaasuun tuodaan määrä Q lämpöä......
Ekvipartitioteoreema. Entropia MB-jakaumassa. Entropia tilastollisessa mekaniikassa
 Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema
 Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ch7 Kvanttimekaniikan alkeita. Tässä luvussa esitellään NMR:n kannalta keskeiset kvanttimekaniikan tulokset.
 Ch7 Kvanttimekaniikan alkeita Tässä luvussa esitellään NMR:n kannalta keskeiset kvanttimekaniikan tulokset. Spinnittömät hiukkaset Hiukkasta kuvaa aineaaltokenttä eli aaltofunktio. Aaltofunktio riippuu
Ch7 Kvanttimekaniikan alkeita Tässä luvussa esitellään NMR:n kannalta keskeiset kvanttimekaniikan tulokset. Spinnittömät hiukkaset Hiukkasta kuvaa aineaaltokenttä eli aaltofunktio. Aaltofunktio riippuu
a) Sievennä lauseke 1+x , kun x 0jax 1. b) Aseta luvut 2, 5 suuruusjärjestykseen ja perustele vastauksesi. 3 3 ja
 1 YLIOPPILASTUTKINTO- LAUTAKUNTA 1.10.2018 MATEMATIIKAN KOE PITKÄ OPPIMÄÄRÄ A-osa Ratkaise kaikki tämän osan tehtävät 1 4. Tehtävät arvostellaan pistein 0 6. Kunkin tehtävän ratkaisu kirjoitetaan tehtävän
1 YLIOPPILASTUTKINTO- LAUTAKUNTA 1.10.2018 MATEMATIIKAN KOE PITKÄ OPPIMÄÄRÄ A-osa Ratkaise kaikki tämän osan tehtävät 1 4. Tehtävät arvostellaan pistein 0 6. Kunkin tehtävän ratkaisu kirjoitetaan tehtävän
S , Fysiikka III (Sf) tentti/välikoeuusinta
 S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
Maxwell-Boltzmannin jakauma
 Maxwell-Boltzmannin jakauma Homogeenisessa tasapainotilassa redusoidut yksihiukkastodennäköisyydet f voivat olla vain nopeuden funktioita, f = f(v ), ja H-funktio ei toisaalta voi riippua ajasta, eli dh
Maxwell-Boltzmannin jakauma Homogeenisessa tasapainotilassa redusoidut yksihiukkastodennäköisyydet f voivat olla vain nopeuden funktioita, f = f(v ), ja H-funktio ei toisaalta voi riippua ajasta, eli dh
SÄHKÖMAGNEETTINEN KYTKEYTYMINEN
 SÄHKÖMAGNEETTINEN KYTKEYTYMINEN H. Honkanen SÄHKÖMAGNEETTISEN KYTKEYTYMISEN TEORIAA Sähkömagneettinen kytkeytyminen on häiiöiden siitymistä sähkömagneettisen aaltoliikkeen välityksellä. Sähkömagneettisen
SÄHKÖMAGNEETTINEN KYTKEYTYMINEN H. Honkanen SÄHKÖMAGNEETTISEN KYTKEYTYMISEN TEORIAA Sähkömagneettinen kytkeytyminen on häiiöiden siitymistä sähkömagneettisen aaltoliikkeen välityksellä. Sähkömagneettisen
Diplomi-insinööri- ja arkkitehtikoulutuksen yhteisvalinta 2018 Insinöörivalinnan matematiikan koe, , Ratkaisut (Sarja A)
 Diplomi-insinööri- ja arkkitehtikoulutuksen yhteisvalinta 2018 Insinöörivalinnan matematiikan koe, 2952018, Ratkaisut (Sarja A) 1 Anna kaikissa kohdissa vastaukset tarkkoina arvoina Kohdassa d), anna kulmat
Diplomi-insinööri- ja arkkitehtikoulutuksen yhteisvalinta 2018 Insinöörivalinnan matematiikan koe, 2952018, Ratkaisut (Sarja A) 1 Anna kaikissa kohdissa vastaukset tarkkoina arvoina Kohdassa d), anna kulmat
. Veden entropiamuutos lasketaan isobaariselle prosessille yhtälöstä
 LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
( ) ( ) on nimeltään molekyylisironnan mikroskooppinen vaikutusala). Sijoittamalla numeroarvot saadaan vapaaksi matkaksi
 S-4.35, FYSIIKKA III, Syksy 00, LH, Loppuiikko 38 LH-* Laske happimolekyylin keskimääräinen apaa matka 300 K lämpötilassa ja,0 baarin paineessa. Voit olettaa, että molekyyli on pallon muotoinen ja pallon
S-4.35, FYSIIKKA III, Syksy 00, LH, Loppuiikko 38 LH-* Laske happimolekyylin keskimääräinen apaa matka 300 K lämpötilassa ja,0 baarin paineessa. Voit olettaa, että molekyyli on pallon muotoinen ja pallon
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA!
 ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
ENY-C2001 Termodynamiikka ja lämmönsiirto TERVETULOA! Luento 14.9.2015 / T. Paloposki / v. 03 Tämän päivän ohjelma: Aineen tilan kuvaaminen pt-piirroksella ja muilla piirroksilla, faasimuutokset Käsitteitä
1 Ensimmäisen asteen polynomifunktio
 Ensimmäisen asteen polynomifunktio ENNAKKOTEHTÄVÄT. a) f(x) = x 4 b) Nollakohdassa funktio f saa arvon nolla eli kuvaaja kohtaa x-akselin. Kuvaajan perusteella funktion nollakohta on x,. c) Funktion f
Ensimmäisen asteen polynomifunktio ENNAKKOTEHTÄVÄT. a) f(x) = x 4 b) Nollakohdassa funktio f saa arvon nolla eli kuvaaja kohtaa x-akselin. Kuvaajan perusteella funktion nollakohta on x,. c) Funktion f
Mustan kappaleen säteily
 Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Termodynamiikka. Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt. ...jotka ovat kaikki abstraktioita
 Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
Diplomi-insinööri- ja arkkitehtikoulutuksen yhteisvalinta 2017 Insinöörivalinnan matematiikan koe , Ratkaisut (Sarja A)
 Diplomi-insinööri- ja arkkitehtikoulutuksen yhteisvalinta 017 Insinöörivalinnan matematiikan koe 30..017, Ratkaisut (Sarja A) 1. a) Lukujen 9, 0, 3 ja x keskiarvo on. Määritä x. (1 p.) b) Mitkä reaaliluvut
Diplomi-insinööri- ja arkkitehtikoulutuksen yhteisvalinta 017 Insinöörivalinnan matematiikan koe 30..017, Ratkaisut (Sarja A) 1. a) Lukujen 9, 0, 3 ja x keskiarvo on. Määritä x. (1 p.) b) Mitkä reaaliluvut
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
H7 Malliratkaisut - Tehtävä 1
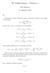 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
T H V 2. Kuva 1: Stirling kiertoprosessi. Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista (kts. kuva 1):
 1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
LIITTEET Liite A Stirlingin kaavan tarkkuudesta...2. Liite B Lagrangen kertoimet...3
 LIITTEET... 2 Liite A Stirligi kaava tarkkuudesta...2 Liite B Lagrage kertoimet... 2 Liitteet Liitteet Liite A Stirligi kaava tarkkuudesta Luoollista logaritmia suureesta! approksimoidaa usei Stirligi
LIITTEET... 2 Liite A Stirligi kaava tarkkuudesta...2 Liite B Lagrage kertoimet... 2 Liitteet Liitteet Liite A Stirligi kaava tarkkuudesta Luoollista logaritmia suureesta! approksimoidaa usei Stirligi
IX TOINEN PÄÄSÄÄNTÖ JA ENTROPIA...208
 IX OINEN PÄÄSÄÄNÖ JA ENROPIA...08 9. ermodynaamisen systeemin pyrkimys tasapainoon... 08 9. ermodynamiikan toinen pääsääntö... 0 9.3 Entropia termodynamiikassa... 0 9.3. Entropian määritelmä... 0 9.3.
IX OINEN PÄÄSÄÄNÖ JA ENROPIA...08 9. ermodynaamisen systeemin pyrkimys tasapainoon... 08 9. ermodynamiikan toinen pääsääntö... 0 9.3 Entropia termodynamiikassa... 0 9.3. Entropian määritelmä... 0 9.3.
Wien R-J /home/heikki/cele2008_2010/musta_kappale_approksimaatio Wed Mar 13 15:33:
 1.2 T=12000 K 10 2 T=12000 K 1.0 Wien R-J 10 0 Wien R-J B λ (10 15 W/m 3 /sterad) 0.8 0.6 0.4 B λ (10 15 W/m 3 /sterad) 10-2 10-4 10-6 10-8 0.2 10-10 0.0 0 200 400 600 800 1000 nm 10-12 10 0 10 1 10 2
1.2 T=12000 K 10 2 T=12000 K 1.0 Wien R-J 10 0 Wien R-J B λ (10 15 W/m 3 /sterad) 0.8 0.6 0.4 B λ (10 15 W/m 3 /sterad) 10-2 10-4 10-6 10-8 0.2 10-10 0.0 0 200 400 600 800 1000 nm 10-12 10 0 10 1 10 2
3.6 Feynman s formulation of quantum mechanics
 3.6 Feynman s formulation of quantum mechanics Course MAT-66000: Quantum mechanics and the particles of nature Ilkka Kylänpää Tampere University of Technology 14.10.2010 Sisältö Johdattelua Klassinen action
3.6 Feynman s formulation of quantum mechanics Course MAT-66000: Quantum mechanics and the particles of nature Ilkka Kylänpää Tampere University of Technology 14.10.2010 Sisältö Johdattelua Klassinen action
Tekijä MAA2 Polynomifunktiot ja -yhtälöt = Vastaus a)
 K1 a) Tekijä MAA Polynomifunktiot ja -yhtälöt 6.8.016 ( + + ) + ( ) = + + + = + + + = + 4 b) 4 4 ( 5 + ) ( 5 + 1) = 5 + + 5 + 1 4 = + + + 4 = + 5 5 1 1 Vastaus a) 4 + b) 4 + 1 K a) f ( ) = + 1 f () = +
K1 a) Tekijä MAA Polynomifunktiot ja -yhtälöt 6.8.016 ( + + ) + ( ) = + + + = + + + = + 4 b) 4 4 ( 5 + ) ( 5 + 1) = 5 + + 5 + 1 4 = + + + 4 = + 5 5 1 1 Vastaus a) 4 + b) 4 + 1 K a) f ( ) = + 1 f () = +
Entalpia - kuvaa aineen lämpösisältöä - tarvitaan lämpötasetarkasteluissa (usein tärkeämpi kuin sisäenergia)
 Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden MATEMATIIKAN KOE, LYHYT OPPIMÄÄRÄ.9.013 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten piirteiden ja sisältöjen luonnehdinta ei sido ylioppilastutkintolautakunnan
Ylioppilastutkintolautakunta S tudentexamensnämnden MATEMATIIKAN KOE, LYHYT OPPIMÄÄRÄ.9.013 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten piirteiden ja sisältöjen luonnehdinta ei sido ylioppilastutkintolautakunnan
K = Q C W = T C T H T C. c = 1 dq. f) Isokoorinen prosessi: prosessi joka suoritetaan vakiotilavuudessa
 Sallitut apuvälineet: kijoitusvälineet ja gaafinen laskin. Muun oman mateiaalin tuominen ei sallittu. Tämä on fysiikan kussi, joten desimaalilleen oikeaa numeeista vastausta täkeämpää on että osoitat ymmätäneesi
Sallitut apuvälineet: kijoitusvälineet ja gaafinen laskin. Muun oman mateiaalin tuominen ei sallittu. Tämä on fysiikan kussi, joten desimaalilleen oikeaa numeeista vastausta täkeämpää on että osoitat ymmätäneesi
Yksinkertainen korkolasku
 Sivu 1/7 Rahan lainaus voidaan innastaa tavaan vuokaukseen, jolloin lainatusta ahasta maksetaan kokoa sitä enemmän, mitä suuemmasta ahamääästä on kysymys ja mitä pidempään aha on lainattuna. äyttöön saatua
Sivu 1/7 Rahan lainaus voidaan innastaa tavaan vuokaukseen, jolloin lainatusta ahasta maksetaan kokoa sitä enemmän, mitä suuemmasta ahamääästä on kysymys ja mitä pidempään aha on lainattuna. äyttöön saatua
Jukka Tulkki 8. Laskuharjoitus (ratkaisut) Palautus torstaihin 3.4 klo 12:00 mennessä. x 2
 S 437 Fysiikka III Kevät 8 Jukka Tulkki 8 askuharjoitus (ratkaisut) Palautus torstaihin 34 klo : mennessä Assistentit: Jaakko Timonen Ville Pale Pyry Kivisaari auri Salmia (jaakkotimonen@tkkfi) (villepale@tkkfi)
S 437 Fysiikka III Kevät 8 Jukka Tulkki 8 askuharjoitus (ratkaisut) Palautus torstaihin 34 klo : mennessä Assistentit: Jaakko Timonen Ville Pale Pyry Kivisaari auri Salmia (jaakkotimonen@tkkfi) (villepale@tkkfi)
Pienten rakenteiden lämpöliikkeen mittaus ja mallinnus. S-108.4010 Mittaustekniikan Lisensiaattikurssi 17.3.2010 Tuomo Hyvönen
 Pienten akenteiden lämpöliikkeen mittaus ja mallinnus S-108.4010 Mittaustekniikan Lisensiaattikussi 17.3.2010 Tuomo Hyvönen Esityksen akenne -Tutkimuksen motiivina elektoniikan sovellukset, eityisesti
Pienten akenteiden lämpöliikkeen mittaus ja mallinnus S-108.4010 Mittaustekniikan Lisensiaattikussi 17.3.2010 Tuomo Hyvönen Esityksen akenne -Tutkimuksen motiivina elektoniikan sovellukset, eityisesti
Fysiikka 8. Aine ja säteily
 Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Luvun 12 laskuesimerkit
 Luvun 12 laskuesimerkit Esimerkki 12.1 Mikä on huoneen sisältämän ilman paino, kun sen lattian mitat ovat 4.0m 5.0 m ja korkeus 3.0 m? Minkälaisen voiman ilma kohdistaa lattiaan? Oletetaan, että ilmanpaine
Luvun 12 laskuesimerkit Esimerkki 12.1 Mikä on huoneen sisältämän ilman paino, kun sen lattian mitat ovat 4.0m 5.0 m ja korkeus 3.0 m? Minkälaisen voiman ilma kohdistaa lattiaan? Oletetaan, että ilmanpaine
Helsingin, Itä-Suomen, Jyväskylän, Oulun, Tampereen ja Turun yliopisto Matematiikan valintakoe 11.6.2012 klo 10 13 Ratkaisut ja pisteytysohjeet
 Helsingin, Itä-Suomen, Jyväskylän, Oulun, Tampereen ja Turun yliopisto Matematiikan valintakoe 11.6.01 klo 10 13 t ja pisteytysohjeet 1. Ratkaise seuraavat yhtälöt ja epäyhtälöt. (a) 3 x 3 3 x 1 4, (b)
Helsingin, Itä-Suomen, Jyväskylän, Oulun, Tampereen ja Turun yliopisto Matematiikan valintakoe 11.6.01 klo 10 13 t ja pisteytysohjeet 1. Ratkaise seuraavat yhtälöt ja epäyhtälöt. (a) 3 x 3 3 x 1 4, (b)
Osa 5. lukujonot ja sarjat.
 Osa 5. lukujonot ja sarjat. Summamerkintä Kurssilla on jo tullut vastaan ns. summamerkintä (kreikkalainen iso sigma): n k=1 Indeksin loppuarvo Indeksi jonka suhteen summataan a k =a 1 +a +a 3 +...+a n
Osa 5. lukujonot ja sarjat. Summamerkintä Kurssilla on jo tullut vastaan ns. summamerkintä (kreikkalainen iso sigma): n k=1 Indeksin loppuarvo Indeksi jonka suhteen summataan a k =a 1 +a +a 3 +...+a n
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 4 Kevät 2017
 763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 4 Keät 207. Rekyyli Luentomonisteessa on käsitelty tilanne, jossa hiukkanen (massa M) hajoaa kahdeksi hiukkaseksi (massat m ja m 2 ). Tässä käytetään
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 4 Keät 207. Rekyyli Luentomonisteessa on käsitelty tilanne, jossa hiukkanen (massa M) hajoaa kahdeksi hiukkaseksi (massat m ja m 2 ). Tässä käytetään
