X JOULEN JA THOMSONIN ILMIÖ...226
|
|
|
- Aino Katriina Lehtilä
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 X JOULEN JA HOMSONIN ILMIÖ Ideaalikaasun tilanyhtälö ja sisäenergia van der Waals in kaasun sisäenergia Reaalikaasun energiayhtälö van der Waalsin kaasun entroia van der Waalsin kaasun sisäenergia Joulen ilmiö Joulen ja homsonin ilmiö Koejärjestely Ideaalikaasu Reaalikaasu Entroian ja entalian differentiaalit muuttujien ja avulla Joulen ja homsonin ilmiö van der Waalsin kaasulle... 36
2 6 X Joulen ja homsonin ilmiö X Joulen ja homsonin ilmiö 10.1 Ideaalikaasun tilanyhtälö ja sisäenergia Systeemin sisäenergia on tilanfunktio, joka yhdessä tilanyhtälön kanssa määrää yksikäsitteisesti -systeemin termodynaamiset ominaisuudet. Aiemmin olemme todenneet ideaalikaasun sisäenergian riiuvan vain lämötilasta. Ideaalikaasun sisäenergian muoto johdettiin kuitenkin kineettisestä kaasuteoriasta eikä makroskooisen termodynamiikan tilanyhtälöstä. Periaatteessa myös ideaalikaasun sisäenergia itäisi määrätä kokeellisesti, jos haluamme itäytyä makroskooisen termodynamiikan lähestymistavassa. Harvoilla kaasuilla tehdyt suorat mittaukset ovatkin osoittaneet sisäenergian riiuvan mittaustarkkuuden rajoissa vain lämötilasta. Kun kokeellisesti on ensin havaittu sisäenergian olevan vakiolämötilassa riiumaton tilavuudesta, on helo osoittaa, että sisäenergia on muotoa U = ν c + vakio. Gay-Lussac-Joule-kokeessa mitataan kaasun lämötilan muutos kaasun urkautuessa adiabaattisesti tyhjöön. Kokeessa havaittiin kaasun lämötilan säilyvän vakiona, joten U = 0. (10.1) Osoitamme aluksi, että tästä seuraa sisäenergian riiumattomuus tilavuudesta. Liitteessä C (yht. C.16) on osoitettu, että -systeemille ätee derivoinnin ketjusääntö U U U = 1. (10.) 1 Ominaislämmölle vakiotilavuudessa ätee c ν ( U / ) 7.33), joten saamme yhtälöstä 10. = (ks. yhtälö U = ν c. (10.3) U Koska ominaislämö on aina äärellinen, saamme yhdistämällä 10.1 ja 10.3
3 10. van der Waals in kaasun sisäenergia 7 U = 0, (10.4) joten ideaalikaasun sisäenergia on riiumaton tilavuudesta. Sisäenergian kokonaisdifferentiaali voidaan siis kirjoittaa U du = d = ν c d, josta integroimalla kiinteästä referenssiisteestä 0, 0, 0 isteeseen,, saamme U = U0 ν c0 + νc = νc + vakio, (10.5) mikä on vakiotekijää lukuun ottamatta sama kuin kineettisen teorian antama tulos. Kineettinen teoria on kuitenkin yleisemi kuin termodynamiikka, johon sisäenergia 10.5 erustuu, sillä kineettisen tarkastelun avulla voimme myös johtaa lausekkeen ideaalikaasun ominaislämmölle. Esimerkiksi yksiatomiselle ideaalikaasulle saadaan kineettisen teorian erusteella c = (3/ ) R. ermodynaamisessa yhtälössä 10.5 c on emiirisesti määrättävä vakio. 10. van der Waals in kaasun sisäenergia Reaalikaasun sisäenergia riiuu myös tilavuudesta, sillä molekyylien attraktiivisen kaukovuorovaikutuksen takia molekyylien keskimääräinen etäisyys vaikuttaa molekyylien keskimääräiseen otentiaalienergiaan. Reaalikaasujen termodynaamisten ominaisuuksien määräämiseksi on siis kaasun tilanyhtälön lisäksi tunnettava sisäenergian riiuvuus kahdesta riiumattomasta tilanmuuttujasta, esimerkiksi lämötilasta ja tilavuudesta Reaalikaasun energiayhtälö Johdamme aluksi tärkeän autuloksen, jota käytämme myöhemmin tehtävien ratkaisemisessa. Seuraavassa käytetään hyväksi systeemin entroiaa. Entroian termodynaamisen määritelmän ja ensimmäisen ääsäännön mukaan
4 8 X Joulen ja homsonin ilmiö δ Q 1 ds = = ( du + d ). (10.6) oisaalta tiedämme, että sisäenergiaa voidaan itää muuttujien ja funktiona, joten sen kokonaisdifferentiaali voidaan esittää muodossa U U du = d + d. (10.7) Yhdistämällä 10.6 ja 10.7 saamme 1 U 1 U ds = d + + d. (10.8) Myös entroia on tilanfunktio S (, ), joten S S ds = d + d (10.9) Koska ja ovat riiumattomia muuttujia, on niiden differentiaalien d ja d kertoimien yhtälöissä 10.8 ja 10.9 oltava samat: S 1 U =. (10.10) S 1 U = + Koska ja ovat riiumattomia muuttujia, toisen kertaluvun ristiderivaatat toteuttavat yhtälön S S S S = = =, (10.11) ts. derivaatta on riiumaton derivointijärjestyksestä. Derivoidaan nyt ylemi yhtälöistä :n suhteen ja alemi :n suhteen, vähennetään näin saadut yhtälöt uolittain toisistaan. asen uoli = 0 yhtälön erusteella ja oikealta uolelta saadaan 1 U 1 U 1 U =. (10.1)
5 10. van der Waals in kaasun sisäenergia 9 Suistamalla ja siirtämällä termejä uolelta toiselle saamme U =. (10.13) Lämökaasiteettien määritelmän yhteydessä olemme aiemmin johtaneet yhtälön c 1 U = ν. (10.14) Yhtälöiden ja avulla voidaan sisäenergian differentiaali 10.7 esittää muodossa U U du = d + d = ν c d + d. (10.15) Yhtälöä voidaan kutsua reaalikaasun energiayhtälöksi. Yhtälöstä voidaan uolittain integroimalla johtaa reaalikaasun sisäenergian lauseke jos (1) differentiaalin d kerroin on riiumaton lämötilasta ja () c on riiumaton tilavuudesta. Paine ja sen derivaatta lämötilan suhteen saadaan ratkaistua tilanyhtälöstä. Palaamme sisäenergian lausekkeeseen myöhemmin ja johdamme yhtälön avulla ensin van der Waalsin kaasun entroian lausekkeen van der Waalsin kaasun entroia Johdamme seuraavaksi energiayhtälön avulla lausekkeen van der Waalsin kaasun entroialle. Osoitamme, että myös van der Waalsin kaasun entroia ja sisäenergia voidaan määrätä vakiotekijää lukuun ottamatta, jos tunnemme van der Waalsin kaasun ominaislämmön c. Osoitamme aluksi, että c ei riiu kaasun ominaistilavuudesta. Ensimmäisen ääsäännön erusteella ( ) du d d ds = + = ν c + d (10.16)
6 30 X Joulen ja homsonin ilmiö Entroian ristiderivaattojen tulee olla riiumattomia derivointijärjestyksestä, joten saamme νc c = ν =. (10.17) an der Waalsin kaasun tilanyhtälöstä ν + a ( νb ) = νr (10.18) saamme = 0, (10.19) sillä vakiotilavuudessa van der Waalsin kaasun aine riiuu lämötilasta lineaarisesti. Yhtälöistä ja seuraa, että c on riiumaton tilavuudesta. ilanyhtälöstä saamme edelleen νr =. (10.0) νb Sijoittamalla yhtälö 10.0 yhtälöön huomaamme, että entroian differentiaali searoituu lämötilasta ja tilavuudesta riiuviin osiin. Integroimalla yhtälö referenssiisteestä 0, 0, 0 isteeseen,, saamme 0 c S S = ν d + R ν. (10.1) ( ν b ) 0 0 d Jos ominaislämö c on likimain vakio yhtälö 10.1 voidaan integroida. Keräämällä integraalien alarajaan liittyvät vakiotermit yhteen saadaan ( ) S = νc ln + νrln b + νvakio. (10.) m m0 0 m0 on riiumaton ainemäärästä. Kokonaisentroia saadaan kertomalla yhtälö 10. Yhtälössä 10. esiintyvä vakio S c ln Rln( b)
7 10.3 Joulen ilmiö 31 moolimäärällä. Huomattakoon, että myös entroian lausekkeessa 10. esiintyvä vakio tulee tällöin verrannolliseksi moolimäärään, jotta entroia olisi ekstensiivinen suure van der Waalsin kaasun sisäenergia Sisäenergian lauseke johdetaan samaan taaan kuin entroian. Sijoittamalla yhtälö 10.0 sisäenergian differentiaaliin saamme sisäenergialle moolia kohden ν du ν c d a d = +. (10.3) Differentiaali searoituu jälleen lämötilan ja tilavuuden sisältäviin osiin. Integroimalla yhtälö (10.3) referenssiisteestä 0, 0, 0 isteeseen,, saamme 0 ν 1 1 ν. (10.4) 0 0 U U = c d a Jos ominaislämöä voidaan itää vakiona, saamme ν = ν + ν vakio, (10.5) U c a missä esiintyvä vakio = U c ( a ) m0 0 + m0 on riiumaton ainemäärästä Joulen ilmiö Joulen tai Gay-Lussac-Joulen ilmiöllä tarkoitetaan reaalikaasun jäähtymistä sen urkautuessa tyhjöön. Koejärjestelyssä kaasu on aluksi ienessä säiliössä, josta se ääsee Kuva 10-1 Kaasun vaaa adiabaattinen urkautuminen urkautumaan toiseen tilavuudeltaan tyhjöön. Kaasu on aluksi suljettuna vasemaan mahdollisimman suureen säiliöön säiliöön. Loutilassa kaasun tilavuus on astioiden yhteinen esimerkiksi hanan kautta ks. Kuva 10- tilavuus.
8 3 X Joulen ja homsonin ilmiö 1. Koska kaasun urkautumista suuremaan säiliöön ei rajoita ulkoisen aineen tukema massaton seinä, kaasu ei tee työtä urkautumisen aikana. Oletamme lisäksi, että urkautuminen taahtuu adiabaattisesti (muttei välttämättä kvasistaattisesti), joten kaasun sisäenergia on vakio. Kaasun lämötilan muutoksen laskemiseksi on tunnettava kaasun energiayhtälö. van der Waalsin kaasun sisäenergian avulla voimme kirjoittaa a a U U c c m1= m 1 =, (10.6) m1 m josta ratkaisemalla a =. c m m1 (10.7) Esimerkki Yksi mooli haea on aluksi 1,0 l tilavuudessa ja 300 K lämötilassa. Kaasu ääsee urkautumaan vaaasti hanan kautta 10 l suuruiseen tyhjään tilaan. Kaasu on lämöeristetty laajenemisen aikana. Mikä on kaasun lämötila, kun kaasu on jälleen tasaainossa loutilavuuden ollessa 11 l. Sijoittamalla yhtälöön 10.7 a = N A a= Pam /mol ja c (5/ ) R saamme = 94 K. Kaasu siis jäähtyy laajetessaan. oidaan ajatella, että osa liike-energiasta käytetään molekyylien vetämiseen kauemmas toisistaan, jolloin lämöliikkeen energia ienenee ja lämötila laskee. Huomaa, että käytimme ideaalikaasun lämökaasiteettia, mikä on aroksimaatio Joulen ja homsonin ilmiö Koejärjestely Kuva 10- Kaasun virtaus adiabaattisesti huokoisen tulan läi. arkastelemme kuvan 10. mukaista koejärjestelyä. Kaasua johdetaan utkessa olevan huokoisen tulan läi siten, että aine laskee arvosta 1 arvoon. Putki ja siinä oleva
9 10.4 Joulen ja homsonin ilmiö 33 tula ovat täysin lämöeristetyt. Kaasun lämötilan muutosta sen virratessa tulan läi kutsutaan Joulen ja homsonin ilmiöksi. Käytännön koejärjestelyssä säädetään ensin aineet 1 ja vakioiksi, jonka jälkeen mitataan näitä aineenarvoja vastaava kaasun lämötilan muutos. Kaasun ei ole tulan sisällä termodynaamisessa tasaainotilassa. Jos tula on eristetty, voimme kuitenkin käyttää energian säilymislakia. ietty määrä kaasua vaatii tulan vasemmalla uolella tilavuuden 1 aineen ollessa 1, tulan jälkeen oikealla uolella sama kaasumäärä vaatii tilavuuden aineen ollessa. oidaan olettaa, että tulan sisällä on kulloinkin hyvin ieni määrä kaasua. arkastellaan kaasun sisäenergian muutosta. Oletamme, että virtausnoeus on molemmilla uolin tulaa niin ieni, ettei kaasun massakeskiisteen noeuden muutoksella ole merkitystä. Olkoon vastaavat energiat ennen ja jälkeen tulan U 1 ja U. Kaasun liikkuessa tulan läi vasemmalta vaikuttava voima työntää kaasua oikealle ja tekee työn W1 = s1f1 = s11a1 = 11 (10.8) missä s 1 ja A 1 ovat kaasuvolyymin 1 ituus ja oikkiinta-ala. astaavasti oikealla uolella kaasun siirtymistä vastustaa voima F = A, jonka tekemä työ on negatiivinen (siirtymä on vastakkaiseen suuntaan voimaan nähden): W = sf = sa = (10.9) missä s ja A ovat kaasuvolyymin ituus ja oikkiinta-ala. Kaasun liikkuessa tulan läi sisäenergia muuttuu siis määrällä U = U U1 = W1 W = 1 1. ästä saadaan ryhmittelemällä U = U +. (10.30) ts. sanoen entalia H = U + on vakio kaasun virratessa tulan läi.
10 34 X Joulen ja homsonin ilmiö Ideaalikaasu arkastellaan aluksi ideaalikaasua. Oletetaan vaausasteiden lukumääräksi 1 f. Sisäenergia on U = fν R, joten käyttämällä ideaalikaasun tilanyhtälöä entaliaksi saadaan 1 1 H = U + = fνr + νr = ( f + ) νr. oisaalta entalia on vakio, joten tästä seuraa, että myös lämötila on vakio - ideaalikaasu ei jäähdy virratessaan huokoisen tulan läi Reaalikaasu Entalian differentiaali voidaan esittää muodossa H H dh = d + d = 0, (10.31) joten entalian ollessa vakio H µ = H H. (10.3) Jos aine laskee tulassa ( d < 0 ), huomaamme, että kun µ > 0 kaasu jäähtyy. Jos taas µ < 0 kaasu lämenee kulkiessaan tulan läi. Suuretta µ kutsutaan Joulen ja homsonin kertoimeksi. Määräämme seuraavaksi tämän kertoimen arvon van der Waalsin kaasulle Entroian ja entalian differentiaalit muuttujien ja avulla Johdamme seuraavaksi tärkeän autuloksen. Entroian määritelmän ja I ääsäännön avulla saamme δ Q 1 1 ds = = [ du + d( )] = ( dh d) (10.33) yhdistämällä ja saadaan
11 10.4 Joulen ja homsonin ilmiö 35 1 H 1 H ds = d + dp. (10.34) Koska entroia on tilanfunktio S (, P ), ätee aina S S ds = d + d. (10.35) Koska d ja d yhtälöissä ovat mielivaltaiset, ne ovat yhtäaikaisesti voimassa vain jos S 1 H =. (10.36) S 1 H = Derivoimme ensimmäisen yhtälöistä aineen suhteen vakiolämötilassa ja jälkimmäisen lämötilan suhteen vakioaineessa S 1 H = S 1 H 1 H 1 = + Ristiderivaattojen itää olla yhtä suuret, joten. (10.37) H = +. (10.38) Yhtälö voidaan johtaa helosti myös soveltamalla derivoinnin ketjusääntöä Jos yhtälön lisäksi käytämme aiemmin ominaislämmölle c johtamaamme lauseketta (Yht. 7,38) H = ν c, (10.39) saamme sijoittamalla yhtälöön 10.3
12 36 X Joulen ja homsonin ilmiö 1 µ = =. (10.40) h νc ätä Joulen ja homsonin kertoimen esitysmuotoa käytämme seuraavassa auneuvona Joulen ja homsonin ilmiö van der Waalsin kaasulle Laskemme nyt Joule-homsonin kertoimen 10.3 van der Waalsin kaasulle. Seuraavassa tarkastelussa käytämme moolitilavuutta = / ν kokonaistilavuuden sijaan. Yhtälön 7.37 mukaan m m a a ( ) R 3 m b = + + m m Sijoittamalla tämä yhtälöön saamme sieventämällä 1. (10.41) 1 1 a a µ = R ( ) 3 m b + + c m m ja edelleen arin välimuodon jälkeen m, (10.4) µ ( ) ( ) 3 1 Rm b a m m b =. (10.43) c 3 Rm a m b Inversiolämötilalla tarkoitetaan lausekkeen nollakohtaa ( b ) am i = Rmb. (10.44) Inversiolämötilaa vastaava aine saadaan ratkaisemalla tilavuuden suhteen ja sijoittamalla näin saatu tilavuus tilanyhtälöön. Näin saadaan inversiokäyrän yhtälö i = f( i). ätä edustaa katkoviiva oheisessa kuvassa. Kullakin vakioentaliakäyrällä on yksi tai ei yhtään inversioistettä, kun taas kiinteällä aineen arvolla saadaan nolla, yksi, tai kaksi inversiolämötilaa.
13 10.4 Joulen ja homsonin ilmiö 37 an der Waalsin yhtälön antamat inversiolämötilat muistuttavat kvalitatiivisesti reaalikaasuille tehtyjä mittauksia. Kuva 10.3 esittää skemaattisesti reaalikaasun vakioentaliakäyriä Joulen ja homsonin kokeessa. Kullakin käyrällä idetään kaasun alkulämötilaa ja ainetta vakiona. Kaasun ainetta tulan jälkeen muutetaan, jolloin kaasun lämötila tulan jälkeen muuttuu siten, että entalia on vakio. Näin saadaan kuvan vakioentaliakäyrästö. Kuljettaessa tulan läi aine laskee, joten liikumme vakioentaliakäyriä itkin oikealta vasemmalle! Jos alkulämötila ei ole liian korkea, käyrällä on maksimi, joka on juuri yhtälön määräämä inversioiste. Kaasu jäähtyy laajetessaan esimerkiksi isteestä a tai b isteeseen c, mutta kuumenee laajetessaan isteestä d isteeseen e. Kuva 10-3 Reaalikaasun vakioentaliakäyriä. Paineen ja lämötilan arvot vastaavat kaasun tilaa tulan jälkeen. aulukko 10.1 Eräiden kaasujen inversiolämötiloja. Inversiolämötilojen maksimit ovat kokeellisesti mitattuja arvoja. Kaasu a / Rb (K) i (max)(k) CO HO 4 00 He Joulen ja homsonin ilmiötä voidaan käyttää kaasujen nesteyttämiseen. Alkulämötila ja aine on tällöin valittava siten, että kaasu jäähtyy tulassa faasimuutosisteeseen. Kaasu on esijäähdytettävä ylemmän inversiolämötilan maksimiarvon alauolelle, jotta kaasu jäähtyy tulassa. ällöin kaasun aine on ieni ja ominaistilavuus suuri (ks. kuvaa 10.3), jolloin voimme yhtälössä korvata m b m ja inversiolämötila tulee muotoon a i = Rb (10.45) Oheisessa taulukossa on annettu yhtälön inversiolämötilat ja vastaavat kokeellisesti mitatut arvot eräille kaasuille. Kuten edellä totesimme ideaalikaasun lämötila ei muutu Joulen ja homsonin kokees-
14 38 X Joulen ja homsonin ilmiö sa. ämä havaitaan myös asettamalla van der Waalsin arametrit nolliksi yhtälössä 10.43, jolloin µ = 0.
= 84. Todennäköisin partitio on partitio k = 6,
 S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
S-435, Fysiikka III (ES) entti 43 entti / välikoeuusinta I Välikokeen alue Neljän tunnistettavissa olevan hiukkasen mikrokanonisen joukon mahdolliset energiatasot ovat, ε, ε, 3ε, 4ε,, jotka kaikki ovat
ln2, missä ν = 1mol. ja lopuksi kaasun saama lämpömäärä I pääsäännön perusteella.
 S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
Integroimalla ja käyttämällä lopuksi tilanyhtälöä saadaan T ( ) ( ) H 5,0 10 J + 2,0 10 0,50 1,0 10 0,80 Pa m 70 kj
 S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
S-4.35 Fysiikka (ES) entti 3.8.. ääritä yhden haikaasumoolin (O) (a) sisäenergian, (b) entalian muutos tilanmuutoksessa alkutilasta =, bar, =,8 m3 loutilaan =, bar, =,5 m3. ärähtelyn vaausasteet voidaan
Ensimmäinen pääsääntö
 4 Ensimmäinen ääsääntö Luvuissa 2 ja 3 käsiteltiin eri taoja siirtää energiaa termodynaamisten systeemien välillä joko lämmön tai työn kautta. 1840-luvulla erityisesti Robert Julius von Mayern ja James
4 Ensimmäinen ääsääntö Luvuissa 2 ja 3 käsiteltiin eri taoja siirtää energiaa termodynaamisten systeemien välillä joko lämmön tai työn kautta. 1840-luvulla erityisesti Robert Julius von Mayern ja James
S , Fysiikka III (Sf) tentti/välikoeuusinta
 S-445, Fysiikka III (Sf) tentti/välikoeuusinta 43 välikokeen alue ristetyssä astiassa, jonka lämötila idetään, kelvinissä, on nestemäistä heliumia tasaainossa helium kaasun kanssa Se on erotettu toisesta
S-445, Fysiikka III (Sf) tentti/välikoeuusinta 43 välikokeen alue ristetyssä astiassa, jonka lämötila idetään, kelvinissä, on nestemäistä heliumia tasaainossa helium kaasun kanssa Se on erotettu toisesta
Oletetaan kaasu ideaalikaasuksi ja sovelletaan Daltonin lakia. Kumpikin seoksen kaasu toteuttaa erikseen ideaalikaasun tilanyhtälön:
 S-445, ysiikka III (Sf) entti 653 Astiassa on, µmol vetyä (H ) ja, µg tyeä ( ) Seoksen lämötila on 373 K ja aine,33 Pa Määritä a) astian tilavuus, b) vedyn ja tyen osaaineet ja c) molekyylien lukumäärä
S-445, ysiikka III (Sf) entti 653 Astiassa on, µmol vetyä (H ) ja, µg tyeä ( ) Seoksen lämötila on 373 K ja aine,33 Pa Määritä a) astian tilavuus, b) vedyn ja tyen osaaineet ja c) molekyylien lukumäärä
V T p pv T pv T. V p V p p V p p. V p p V p
 S-45, Fysiikka III (ES välikoe 004, RAKAISU Laske ideaalikaasun tilavuuden lämötilakerroin ( / ( ja isoterminen kokoonuristuvuus ( / ( Ideaalikaasun tilanyhtälö on = ν R Kysytyt suureet ovat: ilavuuden
S-45, Fysiikka III (ES välikoe 004, RAKAISU Laske ideaalikaasun tilavuuden lämötilakerroin ( / ( ja isoterminen kokoonuristuvuus ( / ( Ideaalikaasun tilanyhtälö on = ν R Kysytyt suureet ovat: ilavuuden
S , Fysiikka III (ES) Tentti Tentti / välikoeuusinta
 S-11435, Fysiikka III (ES) entti 4113 entti / välikoeuusinta I Välikokeen alue 1 Viiden tunnistettavissa olevan identtisen hiukkasen mikrokanonisen joukon käytettävissä on neljä tasavälistä energiatasoa,
S-11435, Fysiikka III (ES) entti 4113 entti / välikoeuusinta I Välikokeen alue 1 Viiden tunnistettavissa olevan identtisen hiukkasen mikrokanonisen joukon käytettävissä on neljä tasavälistä energiatasoa,
S , Fysiikka III (ES) Tentti Tentti / välikoeuusinta. Laaditaan taulukko monisteen esimerkin 3.1. tapaan ( nj njk Pk
 S-.35, Fysiia III (ES) entti 8..3 entti / välioeuusinta I älioeen alue. Neljän tunnistettavissa olevan hiuasen miroanonisen jouon mahdolliset energiatasot ovat, ε, ε, 3ε, ε,, jota aii ovat degeneroitumattomia.
S-.35, Fysiia III (ES) entti 8..3 entti / välioeuusinta I älioeen alue. Neljän tunnistettavissa olevan hiuasen miroanonisen jouon mahdolliset energiatasot ovat, ε, ε, 3ε, ε,, jota aii ovat degeneroitumattomia.
S , Fysiikka III (Sf) tentti/välikoeuusinta
 S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
Kaasu 2-atominen. Rotaatio ja translaatiovapausasteet virittyneet (f=5) c. 5 Ideaalikaasun tilanyhtälöstä saadaan kaasun moolimäärä: 3
 S-4.5.vk. 6..000 Tehtävä Ideaalikaasun aine on 00kPa, lämötila 00K ja tilavuus,0 litraa. Kaasu uristetaan adiabaattisesti 5-kertaiseen aineeseen. Kaasumolekyylit ovat -atomisia. Laske uristamiseen tarvittava
S-4.5.vk. 6..000 Tehtävä Ideaalikaasun aine on 00kPa, lämötila 00K ja tilavuus,0 litraa. Kaasu uristetaan adiabaattisesti 5-kertaiseen aineeseen. Kaasumolekyylit ovat -atomisia. Laske uristamiseen tarvittava
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
η = = = 1, S , Fysiikka III (Sf) 2. välikoe
 S-11445 Fysiikka III (Sf) välikoe 710003 1 Läpövoiakoneen kiertoprosessin vaiheet ovat: a) Isokorinen paineen kasvu arvosta p 1 arvoon p b) adiabaattinen laajeneinen jolloin paine laskee takaisin arvoon
S-11445 Fysiikka III (Sf) välikoe 710003 1 Läpövoiakoneen kiertoprosessin vaiheet ovat: a) Isokorinen paineen kasvu arvosta p 1 arvoon p b) adiabaattinen laajeneinen jolloin paine laskee takaisin arvoon
Vauhti = nopeuden itseisarvo. Nopeuden itseisarvon keskiarvo N:lle hiukkaselle määritellään yhtälöllä
 S-4.35, Fysiikka III (ES) entti 8.3.006. Laske nopeuden itseisarvon keskiarvo v ave ja nopeuden neliöllinen keskiarvo v rms seuraaville 6 molekyylien nopeusjakaumille: a) kaikkien vauhti 0 m/s, b) kolmen
S-4.35, Fysiikka III (ES) entti 8.3.006. Laske nopeuden itseisarvon keskiarvo v ave ja nopeuden neliöllinen keskiarvo v rms seuraaville 6 molekyylien nopeusjakaumille: a) kaikkien vauhti 0 m/s, b) kolmen
Clausiuksen epäyhtälö
 1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 7.11. ja tiistai 8.11. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan
IX TOINEN PÄÄSÄÄNTÖ JA ENTROPIA...208
 IX OINEN PÄÄSÄÄNÖ JA ENROPIA...08 9. ermodynaamisen systeemin pyrkimys tasapainoon... 08 9. ermodynamiikan toinen pääsääntö... 0 9.3 Entropia termodynamiikassa... 0 9.3. Entropian määritelmä... 0 9.3.
IX OINEN PÄÄSÄÄNÖ JA ENROPIA...08 9. ermodynaamisen systeemin pyrkimys tasapainoon... 08 9. ermodynamiikan toinen pääsääntö... 0 9.3 Entropia termodynamiikassa... 0 9.3. Entropian määritelmä... 0 9.3.
. Veden entropiamuutos lasketaan isobaariselle prosessille yhtälöstä
 LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
Ideaalikaasulaki. Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua
 Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Käytetään lopuksi ideaalikaasun tilanyhtälöä muutoksille 1-2 ja 3-1. Muutos 1-2 on isokorinen, joten tilanyhtälöstä saadaan ( p2 / p1) = ( T2 / T1)
 LH0- Lämövoimakoneen kiertorosessin vaiheet ovat: a) Isokorinen aineen kasvu arvosta arvoon 2, b) adiabaattinen laajeneminen, jolloin aine laskee takaisin arvoon ja tilavuus kasvaa arvoon 3 ja c) isobaarinen
LH0- Lämövoimakoneen kiertorosessin vaiheet ovat: a) Isokorinen aineen kasvu arvosta arvoon 2, b) adiabaattinen laajeneminen, jolloin aine laskee takaisin arvoon ja tilavuus kasvaa arvoon 3 ja c) isobaarinen
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
Entalpia - kuvaa aineen lämpösisältöä - tarvitaan lämpötasetarkasteluissa (usein tärkeämpi kuin sisäenergia)
 Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
Luento 4: Entroia orstai 12.11. klo 14-16 47741A - ermodynaamiset tasaainot (Syksy 215) htt://www.oulu.fi/yomet/47741a/ ermodynaamisten tilansuureiden käytöstä Lämökaasiteetti/ominaislämö - kuvaa aineiden
VII LÄMPÖOPIN ENSIMMÄINEN PÄÄSÄÄNTÖ
 II LÄMPÖOPIN ENSIMMÄINEN PÄÄSÄÄNTÖ 7. Lämpö ja työ... 70 7.2 Kaasun tekemä laajenemistyö... 7 7.3 Laajenemistyön erityistapauksia... 73 7.3. Työ isobaarisessa tilanmuutoksessa... 73 7.3.2 Työ isotermisessä
II LÄMPÖOPIN ENSIMMÄINEN PÄÄSÄÄNTÖ 7. Lämpö ja työ... 70 7.2 Kaasun tekemä laajenemistyö... 7 7.3 Laajenemistyön erityistapauksia... 73 7.3. Työ isobaarisessa tilanmuutoksessa... 73 7.3.2 Työ isotermisessä
Termodynamiikka. Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt. ...jotka ovat kaikki abstraktioita
 Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
Termodynamiikka Termodynamiikka on outo teoria. Siihen kuuluvat keskeisinä: Systeemit Tilanmuuttujat Tilanyhtälöt...jotka ovat kaikki abstraktioita Miksi kukaan siis haluaisi oppia termodynamiikkaa? Koska
1 Eksergia ja termodynaamiset potentiaalit
 1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
1 Clausiuksen epäyhtälö
 1 PHYS-C0220 ermodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Clausiuksen epäyhtälö Carnot n koneen syklissä lämpötilassa H ja L vastaanotetuille lämmöille Q H ja Q L pätee oisin ilmaistuna,
1 PHYS-C0220 ermodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Clausiuksen epäyhtälö Carnot n koneen syklissä lämpötilassa H ja L vastaanotetuille lämmöille Q H ja Q L pätee oisin ilmaistuna,
Ohjeellinen pituus: 2 3 sivua. Vastaa joko tehtävään 2 tai 3
 PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI
 Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI Copyright The McGraw-Hill Companies, Inc. Permission
Thermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 2011 Luku 4 SULJETTUJEN SYSTEEMIEN ENERGIA- ANALYYSI Copyright The McGraw-Hill Companies, Inc. Permission
Differentiaali- ja integraalilaskenta 1 Ratkaisut 5. viikolle /
 MS-A8 Differentiaali- ja integraalilaskenta, V/7 Differentiaali- ja integraalilaskenta Ratkaisut 5. viikolle / 9..5. Integroimismenetelmät Tehtävä : Laske osittaisintegroinnin avulla a) π x sin(x) dx,
MS-A8 Differentiaali- ja integraalilaskenta, V/7 Differentiaali- ja integraalilaskenta Ratkaisut 5. viikolle / 9..5. Integroimismenetelmät Tehtävä : Laske osittaisintegroinnin avulla a) π x sin(x) dx,
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
LHSf5-1* Osoita, että van der Waalsin kaasun tilavuuden lämpötilakerroin on 2 γ = ( ) RV V b T 2 RTV 2 a V b. m m ( ) m m. = 1.
 S-445 FSIIKK III (ES) Syksy 004, LH 5 Ratkaisut LHSf5-* Osoita, että van der Waalsin kaasun tilavuuden läötilakerroin on R ( b ) R a b Huoaa, että läötilakerroin on annettu oolisen tilavuuden = / ν avulla
S-445 FSIIKK III (ES) Syksy 004, LH 5 Ratkaisut LHSf5-* Osoita, että van der Waalsin kaasun tilavuuden läötilakerroin on R ( b ) R a b Huoaa, että läötilakerroin on annettu oolisen tilavuuden = / ν avulla
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
I PERUSKÄSITTEITÄ JA MÄÄRITELMIÄ
 I PERUSKÄSITTEITÄ JA MÄÄRITELMIÄ 1.1 Tilastollisen fysiikan ja termodynamiikan tutkimuskohde... 2 1.2 Mikroskooppiset ja makroskooppiset teoriat... 3 1.3 Terminen tasapaino ja lämpötila... 5 1.4 Termodynamiikan
I PERUSKÄSITTEITÄ JA MÄÄRITELMIÄ 1.1 Tilastollisen fysiikan ja termodynamiikan tutkimuskohde... 2 1.2 Mikroskooppiset ja makroskooppiset teoriat... 3 1.3 Terminen tasapaino ja lämpötila... 5 1.4 Termodynamiikan
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 10: Reaalikaasut Pe 1.4.2016 1 AIHEET 1. Malleja, joissa pyritään huomioimaan
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 10: Reaalikaasut Pe 1.4.2016 1 AIHEET 1. Malleja, joissa pyritään huomioimaan
- Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka: kappaleiden liike)
 KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
Termodynamiikka. Fysiikka III 2007. Ilkka Tittonen & Jukka Tulkki
 Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]
![KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille]](/thumbs/24/3803781.jpg) KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
KAASUJEN YLEISET TILANYHTÄLÖT ELI IDEAALIKAASUJEN TILANYHTÄLÖT (Kaasulait) [pätevät ns. ideaalikaasuille] A) p 1, V 1, T 1 ovat paine tilavuus ja lämpötila tilassa 1 p 2, V 2, T 2 ovat paine tilavuus ja
1. Laske ideaalikaasun tilavuuden lämpötilakerroin (1/V)(dV/dT) p ja isoterminen kokoonpuristuvuus (1/V)(dV/dp) T.
 S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
Sisältö: 1 vk. S Fysiikka III (EST 6 op) S Modernin fysiikan tietokoneharjoitukset (Sf, 2 op )
 S-4.37 Fysiikka III (EST 6 o) S-4.47 Modernin fysiikan tietokoneharjoitukset (Sf, o ) Luennot: rof. Ilkka Tittonen ilkka.tittonen@tkk.fi Otiikka ja molekyylimateriaalit, Micronova rof. Jukka Tulkki jukka.tulkki@tkk.fi
S-4.37 Fysiikka III (EST 6 o) S-4.47 Modernin fysiikan tietokoneharjoitukset (Sf, o ) Luennot: rof. Ilkka Tittonen ilkka.tittonen@tkk.fi Otiikka ja molekyylimateriaalit, Micronova rof. Jukka Tulkki jukka.tulkki@tkk.fi
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
2 Termodynamiikan ensimmäinen pääsääntö (First Law of Thermodynamics)
 2 Termodynamiikan ensimmäinen pääsääntö (First Law of Thermodynamics) 1 Tässä luvussa päästää käsittelemään lämmön ja mekaanisen työn välistä suhdetta. 2 Näistä molemmat ovat energiaa eri muodoissa, ja
2 Termodynamiikan ensimmäinen pääsääntö (First Law of Thermodynamics) 1 Tässä luvussa päästää käsittelemään lämmön ja mekaanisen työn välistä suhdetta. 2 Näistä molemmat ovat energiaa eri muodoissa, ja
Ch 19-1&2 Lämpö ja sisäenergia
 Ch 19-1&2 Lämpö ja sisäenergia Esimerkki 19-1 Olet syönyt liikaa täytekakkua ja havaitset, että sen energiasisältö oli 500 kcal. Arvioi kuinka korkealle mäelle sinun pitää pitää kiivetä, jotta kuluttaisit
Ch 19-1&2 Lämpö ja sisäenergia Esimerkki 19-1 Olet syönyt liikaa täytekakkua ja havaitset, että sen energiasisältö oli 500 kcal. Arvioi kuinka korkealle mäelle sinun pitää pitää kiivetä, jotta kuluttaisit
Termodynamiikan avulla kuvataan vain tasapainotiloja - muuten tilanfunktioilla ei ole merkitystä.
 I IANYHÄÖ Makroskooinen termodynamiikka tai lyhyesti termodynamiikka kuvaa makroskooisen systeemin lämöilmiöitä tilanmuuttujien (vain muutama, arvot helosti kokeellisesti määrättävissä), tilanfunktioiden
I IANYHÄÖ Makroskooinen termodynamiikka tai lyhyesti termodynamiikka kuvaa makroskooisen systeemin lämöilmiöitä tilanmuuttujien (vain muutama, arvot helosti kokeellisesti määrättävissä), tilanfunktioiden
Spontaanissa prosessissa Energian jakautuminen eri vapausasteiden kesken lisääntyy Energia ja materia tulevat epäjärjestyneemmäksi
 KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
LH9-1 Eräässä prosessissa kaasu laajenee tilavuudesta V1 = 3,00 m 3 tilavuuteen V2 = 4,00 m3. Sen paine riippuu tilavuudesta yhtälön.
 LH9- Eräässä rsessissa kaasu laajenee tilavuudesta = 3, m 3 tilavuuteen = 4, m3. Sen aine riiuu tilavuudesta yhtälön 0 0e mukaan. akiilla n arvt = 6, 0 Pa, α = 0, m -3 ja v =, m 3. Laske kaasun tekemä
LH9- Eräässä rsessissa kaasu laajenee tilavuudesta = 3, m 3 tilavuuteen = 4, m3. Sen aine riiuu tilavuudesta yhtälön 0 0e mukaan. akiilla n arvt = 6, 0 Pa, α = 0, m -3 ja v =, m 3. Laske kaasun tekemä
Molaariset ominaislämpökapasiteetit
 Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
Molaariset ominaislämpökapasiteetit Yleensä, kun systeemiin tuodaan lämpöä, sen lämpötila nousee. (Ei kuitenkaan aina, kannattaa muistaa, että työllä voi olla osuutta asiaan.) Lämmön ja lämpötilan muutoksen
NESTEIDEN ja ja KAASUJEN MEKANIIKKA
 NESTEIDEN ja KSUJEN MEKNIIKK Väliaineen astus Kaaleen liikkuessa nesteessä tai kaasussa, kaaleeseen törmääät molekyylit ja aine-erot erot aiheuttaat siihen liikkeen suunnalle astakkaisen astusoiman, jonka
NESTEIDEN ja KSUJEN MEKNIIKK Väliaineen astus Kaaleen liikkuessa nesteessä tai kaasussa, kaaleeseen törmääät molekyylit ja aine-erot erot aiheuttaat siihen liikkeen suunnalle astakkaisen astusoiman, jonka
Jyväskylässä 27. tammikuuta Hyvät fysiikkavalmennuksen perussarjalaiset,
 Jyväskylässä 7. tammikuuta 017 Hyvät fysiikkavalmennuksen erussarjalaiset, Ohessa ovat toisen valmennuskirjeen tehtävät. Kirjeen ainotusalueena ovat olleet mekaniikan tehtävät, jotka toivoakseni haastavat
Jyväskylässä 7. tammikuuta 017 Hyvät fysiikkavalmennuksen erussarjalaiset, Ohessa ovat toisen valmennuskirjeen tehtävät. Kirjeen ainotusalueena ovat olleet mekaniikan tehtävät, jotka toivoakseni haastavat
4. Termodynaamiset potentiaalit
 Statistinen fysiikka, osa A (FYSA241) uomas Lappi tuomas.v.v.lappi@jyu.fi Huone: FL249. Ei kiinteitä vastaanottoaikoja. kl 2013 4. ermodynaamiset potentiaalit 1 asapainotila Mikrokanoninen ensemble Eristetty
Statistinen fysiikka, osa A (FYSA241) uomas Lappi tuomas.v.v.lappi@jyu.fi Huone: FL249. Ei kiinteitä vastaanottoaikoja. kl 2013 4. ermodynaamiset potentiaalit 1 asapainotila Mikrokanoninen ensemble Eristetty
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
Luento 4. Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit
 Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2.
Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2.
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
Ekvipartitioteoreema. Entropia MB-jakaumassa. Entropia tilastollisessa mekaniikassa
 Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema
 Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
Ekvipartitioteoreema lämpötilan ollessa riittävän korkea, kukin molekyylin liikkeen vapausaste tuo energian ½ kt sekä keskimääräiseen liike-energiaan ja kineettiseen energiaan energian lisäys ja riittävän
KAASULÄMPÖMITTARI. 1. Työn tavoitteet. 2. Työn taustaa
 Oulun ylioisto Fysiikan oetuslaboratorio Fysiikan laboratoriotyöt 3 1 AASULÄMPÖMIARI 1. yön tavoitteet ässä työssä tutustutaan kaasulämömittariin, jonka avulla lämötiloja voidaan määrittää tarkasti. aasulämömittarin
Oulun ylioisto Fysiikan oetuslaboratorio Fysiikan laboratoriotyöt 3 1 AASULÄMPÖMIARI 1. yön tavoitteet ässä työssä tutustutaan kaasulämömittariin, jonka avulla lämötiloja voidaan määrittää tarkasti. aasulämömittarin
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
VI TILANYHTÄLÖ
 VI TILANYHTÄLÖ... 150 6.1 Ideaalikaasun tilanyhtälö...150 6. Van der Waalsin tilanyhtälö...151 6..1 Semiempiirinen lähestymistapa...151 6.. Van der Waalsin kaasun ominaisuuksia:...154 6..3 Van der Waalsin
VI TILANYHTÄLÖ... 150 6.1 Ideaalikaasun tilanyhtälö...150 6. Van der Waalsin tilanyhtälö...151 6..1 Semiempiirinen lähestymistapa...151 6.. Van der Waalsin kaasun ominaisuuksia:...154 6..3 Van der Waalsin
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 /
 ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 / 7.11.2016 v. 02 / T. Paloposki Tämän päivän ohjelma: Sisäenergia (kertaus) termodynamiikan 1. pääsääntö Entropia termodynamiikan 2. pääsääntö 1 Termodynamiikan
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 / 7.11.2016 v. 02 / T. Paloposki Tämän päivän ohjelma: Sisäenergia (kertaus) termodynamiikan 1. pääsääntö Entropia termodynamiikan 2. pääsääntö 1 Termodynamiikan
Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen
 KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017 Emppu Salonen Lasse Laurson Toni Mäkelä Touko Herranen Luento 2: kineettistä kaasuteoriaa Pe 24.2.2017 1 Aiheet tänään 1. Maxwellin ja Boltzmannin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017 Emppu Salonen Lasse Laurson Toni Mäkelä Touko Herranen Luento 2: kineettistä kaasuteoriaa Pe 24.2.2017 1 Aiheet tänään 1. Maxwellin ja Boltzmannin
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 9: Fotonit ja relativistiset kaasut Ke 30.3.2016 1 AIHEET 1. Fotonikaasun termodynamiikkaa.
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 9: Fotonit ja relativistiset kaasut Ke 30.3.2016 1 AIHEET 1. Fotonikaasun termodynamiikkaa.
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
Matematiikan tukikurssi
 Matematiikan tukikurssi Kurssikerta 2 Lisää osamurtoja Tutkitaan jälleen rationaalifunktion P(x)/Q(x) integrointia. Aiemmin käsittelimme tapauksen, jossa nimittäjä voidaan esittää muodossa Q(x) = a(x x
Matematiikan tukikurssi Kurssikerta 2 Lisää osamurtoja Tutkitaan jälleen rationaalifunktion P(x)/Q(x) integrointia. Aiemmin käsittelimme tapauksen, jossa nimittäjä voidaan esittää muodossa Q(x) = a(x x
T H V 2. Kuva 1: Stirling kiertoprosessi. Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista (kts. kuva 1):
 1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
PHYS-A0120 Termodynamiikka. Emppu Salonen
 PHYS-A0120 ermodynamiikka Emppu Salonen 1. joulukuuta 2016 ermodynamiikka 1 1 Lämpötila ja lämpö 1.1 ilanyhtälö arkastellaan kolmea yksinkertaista fluidisysteemiä 1, jotka koostuvat kukin vain yhdentyyppisistä
PHYS-A0120 ermodynamiikka Emppu Salonen 1. joulukuuta 2016 ermodynamiikka 1 1 Lämpötila ja lämpö 1.1 ilanyhtälö arkastellaan kolmea yksinkertaista fluidisysteemiä 1, jotka koostuvat kukin vain yhdentyyppisistä
y 2 h 2), (a) Näytä, että virtauksessa olevan fluidialkion tilavuus ei muutu.
 Tehtävä 1 Tarkastellaan paineen ajamaa Poisseuille-virtausta kahden yhdensuuntaisen levyn välissä Levyjen välinen etäisyys on 2h Nopeusjakauma raossa on tällöin u(y) = 1 dp ( y 2 h 2), missä y = 0 on raon
Tehtävä 1 Tarkastellaan paineen ajamaa Poisseuille-virtausta kahden yhdensuuntaisen levyn välissä Levyjen välinen etäisyys on 2h Nopeusjakauma raossa on tällöin u(y) = 1 dp ( y 2 h 2), missä y = 0 on raon
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 4.12. ja tiistai 5.12. Metallilangan venytys Metallilankaan tehty työ menee atomien välisten
H7 Malliratkaisut - Tehtävä 1
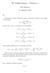 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
BM20A0900, Matematiikka KoTiB3
 BM20A0900, Matematiikka KoTiB3 Luennot: Matti Alatalo Oppikirja: Kreyszig, E.: Advanced Engineering Mathematics, 8th Edition, John Wiley & Sons, 1999, luvut 1 4. 1 Sisältö Ensimmäisen kertaluvun differentiaaliyhtälöt
BM20A0900, Matematiikka KoTiB3 Luennot: Matti Alatalo Oppikirja: Kreyszig, E.: Advanced Engineering Mathematics, 8th Edition, John Wiley & Sons, 1999, luvut 1 4. 1 Sisältö Ensimmäisen kertaluvun differentiaaliyhtälöt
Termodynamiikan suureita ja vähän muutakin mikko rahikka
 Termodynamiikan suureita ja vähän muutakin mikko rahikka 2006 m@hyl.fi 1 Lämpötila Suure lämpötila kuvaa kappaleen/systeemin lämpimyyttä (huono ilmaisu). Ihmisen aisteilla on hankala tuntea lämpötilaa,
Termodynamiikan suureita ja vähän muutakin mikko rahikka 2006 m@hyl.fi 1 Lämpötila Suure lämpötila kuvaa kappaleen/systeemin lämpimyyttä (huono ilmaisu). Ihmisen aisteilla on hankala tuntea lämpötilaa,
Yleisiä integroimissääntöjä
 INTEGRAALILASKENTA, MAA9 Yleisiä integroimissääntöjä Integroiminen eli annetun funktion f integraalifunktion F määrittäminen (löytäminen) on yleisesti haastavaa. Joskus joutuu jopa arvata tai kokeilla.
INTEGRAALILASKENTA, MAA9 Yleisiä integroimissääntöjä Integroiminen eli annetun funktion f integraalifunktion F määrittäminen (löytäminen) on yleisesti haastavaa. Joskus joutuu jopa arvata tai kokeilla.
Luku 12 THERMODYNAAMISTEN OMINAISUUKSIEN YHTÄLÖT
 hermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 011 Luku 1 HERMODYNAAMISEN OMINAISUUKSIEN YHÄLÖ Copyright he McGraw-Hill Companies, Inc. ermission required
hermodynamics: An Engineering Approach, 7 th Edition Yunus A. Cengel, Michael A. Boles McGraw-Hill, 011 Luku 1 HERMODYNAAMISEN OMINAISUUKSIEN YHÄLÖ Copyright he McGraw-Hill Companies, Inc. ermission required
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
Mikrotila Makrotila Statistinen paino Ω(n) 3 Ω(3) = 4 2 Ω(2) = 6 4 Ω(4) = 1
 76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
Kuluttajan valinta ja kysyntä. Viime kerralta. Onko helppoa ja selvää? Mitä tänään opitaan?
 6..00 Viime kerralta Kuluttajan valinta ja kysyntä Y56 Luento 3 5..00 Preferenssit valintojen arvostus, järjestäminen Indifferenssikäyrät Rajakorvattavuussuhde Hyöty Hyötyfunktiot Rajahyöty Onko heloa
6..00 Viime kerralta Kuluttajan valinta ja kysyntä Y56 Luento 3 5..00 Preferenssit valintojen arvostus, järjestäminen Indifferenssikäyrät Rajakorvattavuussuhde Hyöty Hyötyfunktiot Rajahyöty Onko heloa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Nesteen ominaisuudet ja nestetilavuuden mallinnus
 Kon-4.47 Hydraulijärjestelmien mallintaminen ja simulointi Nesteen ominaisuudet ja nestetilavuuden mallinnus Hydrauliikka on tehon siirtoa nesteen välityksellä. Jos yrit ymmärtämään hydrauliikkaa, on sinun
Kon-4.47 Hydraulijärjestelmien mallintaminen ja simulointi Nesteen ominaisuudet ja nestetilavuuden mallinnus Hydrauliikka on tehon siirtoa nesteen välityksellä. Jos yrit ymmärtämään hydrauliikkaa, on sinun
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
3Työ. 3.1 Yleinen määritelmä
 3Työ Edellisessä luvussa käsittelimme systeemin sisäenergian muutosta termisen energiansiirron myötä, joka tapahtuu spontaanisti kahden eri lämpötilassa olevan kappaleen välillä. Toisena mekanismina systeemin
3Työ Edellisessä luvussa käsittelimme systeemin sisäenergian muutosta termisen energiansiirron myötä, joka tapahtuu spontaanisti kahden eri lämpötilassa olevan kappaleen välillä. Toisena mekanismina systeemin
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
Johdantoa INTEGRAALILASKENTA, MAA9
 Lyhyehkö johdanto integraalilaskentaan. Johdantoa INTEGRAALILASKENTA, MAA9 Integraalilaskennan lähtökohta 1: Laskutoimitukset + ja ovat keskenään käänteisiä, samoin ja ovat käänteisiä, kunhan ei jaeta
Lyhyehkö johdanto integraalilaskentaan. Johdantoa INTEGRAALILASKENTA, MAA9 Integraalilaskennan lähtökohta 1: Laskutoimitukset + ja ovat keskenään käänteisiä, samoin ja ovat käänteisiä, kunhan ei jaeta
Thermodynamics is Two Laws and a Li2le Calculus
 Thermodynamics is Two Laws and a Li2le Calculus Termodynamiikka on joukko työkaluja, joiden avulla voidaan tarkastella energiaan ja entropiaan lii2yviä ilmiötä kaikissa luonnonilmiöissä ja lai2eissa Voidaan
Thermodynamics is Two Laws and a Li2le Calculus Termodynamiikka on joukko työkaluja, joiden avulla voidaan tarkastella energiaan ja entropiaan lii2yviä ilmiötä kaikissa luonnonilmiöissä ja lai2eissa Voidaan
Matematiikan tukikurssi
 Matematiikan tukikurssi Kertausluento 2. välikokeeseen Toisessa välikokeessa on syytä osata ainakin seuraavat asiat:. Potenssisarjojen suppenemissäde, suppenemisväli ja suppenemisjoukko. 2. Derivaatan
Matematiikan tukikurssi Kertausluento 2. välikokeeseen Toisessa välikokeessa on syytä osata ainakin seuraavat asiat:. Potenssisarjojen suppenemissäde, suppenemisväli ja suppenemisjoukko. 2. Derivaatan
Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori!
 6.1 Työ Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori! Siirtymä s = r 2 r 1 Kun voiman kohteena olevaa kappaletta voidaan kuvata
6.1 Työ Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori! Siirtymä s = r 2 r 1 Kun voiman kohteena olevaa kappaletta voidaan kuvata
VIII KIERTOPROSESSIT JA TERMODYNAAMISET KONEET 196
 VIII KIERTOPROSESSIT JA TERMODYNAAMISET KONEET 196 8.1 Kiertoprosessin ja termodynaamisen koneen määritelmä... 196 8.2 Termodynaamisten koneiden hyötysuhde... 197 8.2.1 Lämpövoimakone... 197 8.2.2 Lämpöpumpun
VIII KIERTOPROSESSIT JA TERMODYNAAMISET KONEET 196 8.1 Kiertoprosessin ja termodynaamisen koneen määritelmä... 196 8.2 Termodynaamisten koneiden hyötysuhde... 197 8.2.1 Lämpövoimakone... 197 8.2.2 Lämpöpumpun
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
a) Mikä on integraalifunktio ja miten derivaatta liittyy siihen? Anna esimerkki. 8 3 + 4 2 0 = 16 3 = 3 1 3.
 Integraalilaskenta. a) Mikä on integraalifunktio ja miten derivaatta liittyy siihen? Anna esimerkki. b) Mitä määrätty integraali tietyllä välillä x tarkoittaa? Vihje: * Integraali * Määrätyn integraalin
Integraalilaskenta. a) Mikä on integraalifunktio ja miten derivaatta liittyy siihen? Anna esimerkki. b) Mitä määrätty integraali tietyllä välillä x tarkoittaa? Vihje: * Integraali * Määrätyn integraalin
Ensimmäisen ja toisen kertaluvun differentiaaliyhtälöistä
 1 MAT-1345 LAAJA MATEMATIIKKA 5 Tampereen teknillinen yliopisto Risto Silvennoinen Kevät 9 Ensimmäisen ja toisen kertaluvun differentiaaliyhtälöistä Yksi tavallisimmista luonnontieteissä ja tekniikassa
1 MAT-1345 LAAJA MATEMATIIKKA 5 Tampereen teknillinen yliopisto Risto Silvennoinen Kevät 9 Ensimmäisen ja toisen kertaluvun differentiaaliyhtälöistä Yksi tavallisimmista luonnontieteissä ja tekniikassa
1. Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta
 766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
Luku6 Tilanyhtälö. Ideaalikaasun N V. Yleinen aineen. paine vakio. tilavuus vakio
 Luku6 Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät saadaan leikkaamalla painepinta pv suuntaisilla
Luku6 Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät saadaan leikkaamalla painepinta pv suuntaisilla
f(x 1, x 2 ) = x x 1 k 1 k 2 k 1, k 2 x 2 1, 0 1 f(1, 1)h 1 = h = h 2 1, 1 12 f(1, 1)h 1 h 2
 HY / Matematiikan ja tilastotieteen laitos Vektorianalyysi I, syksy 7 Harjoitus 6 Ratkaisuehdotukset 6.. Olkoon f : G R, G = {(x, x ) R x > }, f(x, x ) = x x. Etsi differentiaalit d k f(, ), k =,,. Ratkaisu:
HY / Matematiikan ja tilastotieteen laitos Vektorianalyysi I, syksy 7 Harjoitus 6 Ratkaisuehdotukset 6.. Olkoon f : G R, G = {(x, x ) R x > }, f(x, x ) = x x. Etsi differentiaalit d k f(, ), k =,,. Ratkaisu:
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
4. Termodynaamiset potentiaalit
 FYSA241, kevät 2012 uomas Lappi tuomas.v.v.lappi@jyu.fi Huone: FL249. Ei kiinteitä vastaanottoaikoja. kl 2012 4. ermodynaamiset potentiaalit 1 asapainotila Mikrokanoninen ensemble Eristetty järjestelmä
FYSA241, kevät 2012 uomas Lappi tuomas.v.v.lappi@jyu.fi Huone: FL249. Ei kiinteitä vastaanottoaikoja. kl 2012 4. ermodynaamiset potentiaalit 1 asapainotila Mikrokanoninen ensemble Eristetty järjestelmä
