KIINTEÄN AINEEN RAKENNE JA FYSIKAALISET OMINAISUUDET
|
|
|
- Anne Aro
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 KIINTEÄN AINEEN RAKENNE JA FYSIKAALISET OMINAISUUDET 7.1 Johdanto Kiteiden perustyypit Kiinteän aineen elektronirakenne Vapaaelektronimalli Elektronien liike periodisessa potentiaalirakenteessa Johteet, eristeet ja puolijohteet Sähkönjohtavuuden kvanttimekaanista tarkastelua Sähkömagneettisen säteilyn ja kiteisen aineen välinen vuorovaikutus Kiderakenteiden peruskäsitteitä...337
2 Johdanto Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 7.1 Johdanto Aine esiintyy kolmessa eri olomuodossa: kaasuna, nesteenä ja kiteenä. Näiden olomuotojen lisäksi havaitaan atomien järjestäytymistä kompleksiseksi systeemiksi, joka ei noudata edellä mainittuja yksinkertaisia malleja. Esimerkkejä viimeksi mainitusta olomuodosta ovat amorfinen aine, vaahdot ja biologiset molekyylirakenteet. Amorfista ainetta, kiinteää ainetta ja nesteitä kutsutaan usein yhdessä tiiviiksi aineeksi. Aineen järjestäytymistä eri olomuotoihin ohjaa energiaminimiperiaate ja pyrkimys termodynaamiseen tasapainotilaan. Yksinkertaistaen aine on kaasumaista korkeissa lämpötiloissa. Lämpötilan laskiessa yksittäisten atomien (tai molekyylien) energia pienenee, atomien väliset vetovoimat korostuvat ja aine tiivistyy nesteeksi. Lämpötilan laskiessa edelleen atomit järjestäytyvät (yleensä) kiteeksi. Kaasuissa molekyylien välinen keskimääräinen etäisyys on paljon suurempi kuin molekyylien ulottuvuus ja molekyylien väliset voimat ovat paljon heikompia kuin ne voimat, jotka sitovat yksittäiset atomit toisiinsa molekyylissä. Kaasujen ominaisuuksia voidaan ymmärtää tarkastelemalla yksittäisten molekyylien käyttäytymistä, erityisesti jos molekyylien väliset vuorovaikutukset ovat heikkoja. Toisessa ääritapauksessa, kiinteässä aineessa, atomit tai molekyylit ovat tiiviisti pakattuina ja niiden keskinäiset asemat ovat kiinteitä tai lähes kiinteitä. Atomeja pitää kiinni toisissaan sähkömagneettinen vuorovaikutus, jonka suuruus on samaa suuruusluokkaa kuin atomien väliset voimat molekyylisidoksissa. Kiinteästä aineesta koostuvan kappaleen muoto ja tilavuus eivät muutu niin kauan, kuin ulkoiset fysikaaliset olosuhteet, kuten paine ja lämpötila, ovat likimain vakioita. Nesteet sijoittuvat kaasujen ja kiinteän aineen väliin. Nesteiden teoreettinen tarkastelu on vaikeampaa ja tämän
3 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 79 oppikurssin ulkopuolella. Tässä luvussa tulemme tarkastelemaan lähinnä kiteistä ainetta. Kiinteässä aineessa naapuriatomien läheisyys muuttaa atomin uloimpien elektronikuorien rakennetta siten, että yksittäisen kiteeseen kuuluvan atomin elektronien kokonaisenergia on pienempi kuin vapaassa atomissa. Näin muodostuu stabiili atomien muodostama systeemi. Atomien järjestäytyminen säännölliseksi verkoksi on kiteisen aineen tärkein tunnusmerkki. Jos atomit muodostavat säännöllisen periodisen rakenteen, eli kidehilan, joka jatkuu ehyenä koko makroskooppisen kiteen läpi sanomme ainetta erilliskiteiseksi. Jos kide koostuu useista osista eli rakeista, joiden sisällä kidesymmetria on ehyt, mutta joiden rajoilla kiderakenne katkeaa, on tapana puhua monikiteisestä aineesta. Kiteisen aineen geometrian määrää kidehilan perusyksikkö eli yksikkökopiksi. Erilliskiteinen aine voidaan aina muodostaa latomalla yksikkökoppeja pitkittäin, poikittain ja päällekkäin. Vastaavasti aineen kaikki ominaisuudet toistuvat periodisesti liikuttaessa yksikkökopista toiseen. Tärkeimpiä kidehilan rakenteen analysointimenetelmiä ovat röntgen- ja neutronidiffraktiokokeet. Kiinteän aineen elektronirakenne ja muut ominaisuudet määräytyvät elektronien ja ytimien Schrödingerin yhtälöstä samaan tapaan kuin molekyyleille. Elektronirakenteen laskemiseksi meidän tulee löytää sellainen atomiydinten muodostama geometria ja sellaiset ydinten väliset etäisyydet, joilla kiteen elektroninen kokonaisenergia saa minimiarvon. Tämä vastaa kaksiatomisen molekyylin elektronisen kokonaisenergian ja ytimien repulsioenergian minimikohtaa. Verrattaessa kiinteää ainetta ja molekyylejä on erona lähinnä atomien suuri määrä kiinteässä aineessa ja niiden järjestäytyminen säännölliseksi hilaverkoksi. Koska tarkat kvanttimekaaniset laskut kiteen elektronirakenteen selvittämiseksi ovat yhä mahdottomia nopeimmillakin tietokoneilla on elektronirakenteen ja aineen geometrian ja muiden ominaisuuksien määräämiseksi kehitetty useita likimääräismenetelmiä. Tässä kappaleessa tulemme perehtymään tärkeimpiin kidetyyppeihin, elektronirakenteen määräämisessä käytettäviin approksimaatioihin ja kiteiden tärkeimpiin elektronisiin, mekaanisiin ja optisiin ominaisuuksiin.
4 80 7. Kiteiden perustyypit 7. Kiteiden perustyypit Kiteet voidaan luokitella dominoivan sidostyypin perusteella. Tärkeimmät kiinteän aineen perustyypit ovat: (1) Kovalentit kiteet. Kovalentissa kiteessä atomeja sitoo toisiinsa lokaali suuntaominaisuuksia omaava sidos, joihin olemme perehtyneet jo muun muassa vetymolekyylin tarkastelun yhteydessä. Kiteen rakenne määräytyy sidosten suuntaominaisuuksien ja luonteen perusteella. Tyypillinen esimerkki kovalentista kiteestä on timantti, jossa hiiliatomin s- ja pelektronit muodostavat sp 3 - hybridisaation kautta neljä sitovaa orbitaalia. Näin muodostuva kiderakenne on esitetty kuvassa 7-1. Kukin pallo esittää hiiliatomia ja kuvaan on myös merkitty hiiliatomien väliset sp 3 - hybridisaation kautta muodostuvat sidokset. Hiiliatomien etäisyys kiteessä -10 on 1,54 10 m. Kovalenttiset kiteet ovat yleensä kovia ja vaikeasti muokkautuvia. Ne ovat huonoja lämmön- ja sähkönjohteita koska elektronit on tiukasti sidottu lokaalisiin elektronitiloihin. Kiteet ovat hyvin stabiileja ja kidevärähtelyjen muodostamiseen tarvitaan runsaasti energiaa. Elektronien alin viritysenergia on varsin korkea. Esimerkiksi timantissa alin energia, jolla sp 3 - orbitaalilla oleva elektroni voidaan virittää tyhjälle spinorbitaalille on noin 6eV. Tämä energia on hyvin suuri verrattuna keskimääräiseen lämpöenergiaan huonelämpötilassa ( kt 4 mev), joten kovalenteissa kiteissä elektronit ovat Paulin kieltosäännön Kuva 7-1 Timanttikide. Kide on kaksiatomisesta kannasta koostuva FCC-hila, ks. lähemmin luku 7.9. sallimassa alimmassa energiatilassa. Useimmat kovalentit kiteet ovat läpinäkyviä. Esimerkiksi timantin alin viritysenergia (ylimmän miehitetyn orbitaalin ja alimman miehittämättömän orbitaalin energioiden ero) vastaa ultravioletti alueen fotonienergiaa.
5 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 81 () Ionisidos. Toinen kiteissä esiintyvä sidoksen päätyyppi on ionisidos. Siinä kidehila muodostuu vierekkäisten positiivisesti ja negatiivisesti varattujen ionien muodostamasta kokonaisuudesta. Ionisidos on mahdollinen, jos kide koostuu vähintään kahdesta eri alkuaineesta, joista toinen on hyvin elektronegatiivinen eli sitoo mielellään ylimääräisen elektronin toiselta atomilta, joka vastaavasti Kuva 7- (a) NaCl-kide, negatiiviset Cl ionit on mielellään luovuttaa elektronin. merkitty suurempina. Kyseessä on kaksiatomisesta kantaklusterista muodostuva ns. FCC-hila, lähemmin Esimerkkinä ionikiteestä mainittakoon luku 7.9 natriumkloridin NaCl, jonka kiderakenne on esitetty kuvassa 7-. Natrium- ja klooriatomien etäisyys natriumkloridissa on,81 10 m ja vastaavasti identtisten atomien etäisyys ,97 10 m. Ionikidettä pitää kasassa ionien välinen sähköstaattinen vuorovaikutus. Koska ionikiteen elektronit on sidottu atomeihin, kiteessä ei ole vapaita elektroneita ja tästä syystä ionikiteet ovat huonoja lämmön- ja sähkönjohteita. Sähkönjohtavuus suurenee korkeissa lämpötiloissa, jolloin ionit voivat liikkua hilapaikasta toiseen. Ionikiteet ovat kovia, hauraita, niillä on korkea sulamispiste ja sähköstaattiset voimat ionien välillä ovat suuria. Eräät ionikiteet absorboivat voimakkaasti sähkömagneettista säteilyä pitkästä infrapuna-alueesta alkaen. Tämä ominaisuus liittyy kidevärähtelyihin. Niiden Kuva 7-3 Infrapunavalon transmissio NaCl-kalvon kynnysenergia on ionikiteessä pienempi kuin kovalenteissa kiteissä, läpi.minimi vastaa 0.3 mev hilavärähtelyn kvantin eli fononin muodostumista. heikommasta sidosvoimasta johtuen.
6 8 7. Kiteiden perustyypit Kuva 7-3 esittää infrapunasäteilyn 7 transmissiota ohuen, 1,7 10 m paksun, natriumkloridi-kalvon läpi. Maksimiabsorptio havaitaan taajuudella 4,91 10 Hz. Tähän liittyvän 1 fotonin energia on 0,3meV. Useimmat ionikiteet ovat Kuva 7-4 (a) kuutiollinen tiivis pakkaus, (b) avattuna. diamagneettisia sillä molemmilla (c) heksagonaalinen tiivis pakkaus, (d) avattuna. muodostuneista ioneista on yleensä suljettu kuorirakenne johon ei liity keskimääräistä magneettista momenttia. Ruokasuolakiteessä natrium atomi luovuttaa yhden elektronin klooriatomille. Positiivisen natriumionin 6 elektronikonfiguraatioksi tulee tällöin 1s s p (neonin konfiguraatio) ja 6 6 negatiivisen kloorin configuraatioksi 1s s p 3s 3p (argonin elektronikonfiguraatio). Natrium ja kloori ionit ovat pallosymmetrisiä eikä sidoksella ole suuntaominaisuuksia samaan tapaan kuin kovalentissa kiteessä. Tästä syystä ionit järjestäytyvät kiteessä ns. tiiviin pakkauksen geometriaan. Kuva 7-4 (a) esittää kuutiollista tiiviiksipakkausta ja (c) heksagonaalista tiiviispakkausta. Vetysidoksiin perustuvat kiteet. Vetysidoksiin perustuvat kiteet koostuvat voimakkaasti polaarisista molekyyleistä, joissa on yksi tai useampia vetyatomeja. Esimerkkejä ovat vesi HO ja fluorivety HF. Kuva 7-5 Jääkide. Vesimolekyylit sijoittuvat tetraedrin Positiiviset vetyionit, jotka ovat kärkiin ja keskukseen. kooltaan pieniä vetävät puoleensa negatiivisia fluori-ioneita muodostaen ketjuja. Jäässä vesimolekyylit muodostavat tetraedrin kaltaisen rakenteen, joka on esitetty kuvassa 7-5. Jään suhteellisen avoin rakenne aiheuttaa suuren ominaistilavuuden veden nestemäiseen olomuotoon verrattuna.
7 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 83 (3) Molekyylikiteet. Näissä kiteissä molekyylit eivät ole polaarisia. Atomien kaikki valenssielektronit on sidottu kovalenttisiin sidoksiin molekyyliin kuuluvien atomien välillä. Molekyylit säilyvät näin ollen yksilöinä kiteessä. Niitä sitoo heikko molekyylien välinen Van der Waalsin voima, joka aiheutuu molekyyleihin indusoituvista dipolimomenteista kahden tai useamman Kuva 7-6 Jalokaasuatomien välinen Van der Waalsin potentiaalienergia atomien etäisyyden molekyylin ollessa lähellä toisiaan. funktiona. Voimme ymmärtää Van der Waalsin voimiin perustuvan kiteen seuraavasti. Molekyyleillä ei ole keskimääräistä sähköistä dipolimomenttia, mutta niiden uloimmat elektronit ja toisaalta ydin- ja kuorielektronit muodostavat hetkellisen ajasta riippuvan sähködipolin. Van der Waalsin voima aiheutuu näiden hetkellisten dipolien vuorovaikutuksesta vierekkäisissä molekyyleissa. Molekyylisidokset ovat heikkoja lämmön- ja sähkönjohteita, niillä on alhainen sulamispiste ja ne ovat helposti muokattavia ja kokoonpuristuvia. Esimerkkejä ovat metaani, kloori, iodiini, hiilidioksidi, bentseeni, jne., kiinteässä olomuodossaan. Jalokaasut joiden uloin elektronikuori on suljettu, muodostavat Van der Waalsin voimiin perustuvan kiteen alhaisissa lämpötiloissa. Kuva 7-6 esittää jalokaasukiteessä vallitsevia atomien välisiä voimia atomien etäisyyden funktiona. (4) Metallit. Lopuksi tarkastelemme metallisidosta, joka on tärkeä sekä käytännön sovellutusten, että teoreettisen tarkastelun kannalta. Metalliatomeilla on suhteellisen pieni ionisaatioenergia ja niiden uloimmalla elektronikehällä on vain muutama elektroni suljettujen kuorien ulkopuolella. Nämä heikosti sidotut elektronit irtoavat atomien väliseen tilaan kiteen muodostuessa. Metallin kiderakenne koostuu pallomaisista positiivisista ionikuorista, jotka muodostuvat vajaiden kuorien elektronien vapautuessa atomien väliseen tilaan elektronikaasuksi, joka pitää kiderakenteen koossa. Metallikiteet ovat hyviä lämmön- ja sähkönjohteita. Vapaista elektronit absorboida sähkömagneettista säteilyä kaikilla aallonpituuksilla ja myös vuorovaikuttaa kidevärähtelyjen kanssa. Metallit
8 84 7. Kiteiden perustyypit ovat läpinäkymättömiä ts. elektronit absorboivat tehokkaasti fotoneita näkyvän valon aallonpituuksilla. Vapaat elektronit määräävät myös muut sähkömagneettisen säteilyn ja väliaineen vuorovaikutukseen liittyvät ominaisuudet, eli suuren heijastuskertoimen sähkömagneettisille aalloille, erityisesti radio- ja infrapuna-alueilla. Metallikidettä koossapitävät voimat ovat pallosymmetrisiä. Tästä syystä metallikiteellä on tiivispakkauksen kiderakenne. Yllä oleva kidetyyppien luokittelu on viitteellinen. Monet kiteet ovat kuvattujen perustyyppien välimuotoja. Esimerkki on grafiitti, jonka kiderakenne on kuvattu kuvassa 7-7. Se koostuu heksagonaalisista hiiliatomikerroksista, jotka ovat järjestäytyneet kuusikulmioiden muotoon. Kussakin kerroksessa atomit ovat sidottu toisiinsa lokalisoituneilla sigmasidoksilla jotka perustuvat sp -hybridisoitumisiin ja ei-lokaaleihin π - sidoksiin, samaan tapaan kuin bentseenissä, ks. kappale 7-6. Ei-lokaalit π - elektronit voivat liikkua vapaasti tasoa pitkin, mikä selittää grafiitin hyvän sähkönjohtavuuden tasojen suunnassa. Sähkönjohtavuus tasoihin nähden kohtisuorassa suunnassa on kuitenkin huomattavasti alhaisempi. Atomikerroksia sitoo toisiinsa Van der Kuva 7-7 Grafiittikide. Heksagonaalisten renkaiden sisällä on Waalsin sidokset, kovalenttinen sidos ja tasojen välillä van der Waalsin sidos. samaan tapaan kuin molekyylikiteissä. Nämä sidokset ovat lokaaleja eivätkä johda sähköä. Ne ovat myös heikkoja, mikä selittää grafiitin liukkauden. Tästä johtuu, että grafiittia käytetään voiteluaineena. sp 10 -sidosten pituus grafiitissa on 1,4 10 m ja hiiliatomikerrosten etäisyys toisistaan on 10 3,35 10 m. Aineet jakautuvat edellä kuvattuihin kiteiden perustyyppeihin kiteeseen kuuluvien atomien uloimpien elektronikuorien ominaisuuksien perusteella. Uloimpien elektronikuorien perusteella määräytyy se kuinka monta
9 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 85 elektronia kukin atomi voi luovuttaa sidoksen muodostamiseen ja kuinka paljon energiaa tarvitaan siiihen elektronin orbitaalin muutokseen, jolla kidetyypin tarvitsema sidos voidaan muodostaa. Yleisesti kiteen muodostuessa tarvitaan tietty määrä energiaa, jotta elektronien atomiset ominaistilat saadaan muokattua kidetyyppiä vastaavaksi. Toisaalta taas nettomääräisesti saadaan enemmän energiaa takaisin kiteen muodostuessa. Näin saadaan stabiili kiderakenne. Kiderakenteet eivät ole täydellisiä, vaan niissä esiintyy usein poikkeamia. Kuva 7-8 havainnollistaa muutamia tärkeimpiä kidevirheitä. Kuvassa (a) on esitetty vakanssitila. Sillä tarkoitetaan säännöllisestä kiderakenteesta puuttuvaa atomia. Kuva (b) esittää epäpuhtaustomia. Siinä säänölliseen hilaverkkoon kuuluva atomi on korvautunut jonkin toisen alkuaineen atomilla. Kuvat (c) ja (d) esittävät välisijaatomeja. Näissä tietty kiteeseen kuulumattoman alkuaineen atomi sijaitsee jossakin säännöllisen hilan ulkopuolisessa pisteessä. Kuva (e) esittää dislokaatiota. Siinä ylimääräinen atomitaso on tunkeutunut kiderakenteeseen. Virheillä on huomattava vaikutus Kuva 7-8 Kidevirheitä. kiteen sähköisiin, elastisiin ja optisiin ominaisuuksiin. Esimerkki 7.1. Ionikiteen sisäisen potentiaalienergian laskeminen. Voimme pitää ionikidettä alimmassa approksimaatiossa positiivisten ja negatiivisten varausten muodostamana rakenteena, jossa sisäinen potentiaalienergia aiheutuu ionien välisistä Coulombin vuorovaikutuksista. Tarkastellaan esimerkkinä natriumkloridikidettä ja lasketaan yksittäisen mielivaltaisesti valitun Na + ionin vuorovaikutus kaikkiin kiteessä olevien muiden natrium- ja kloori-ionien kanssa. Kuten voimme havaita kuvasta 7-, lähinnä jokaista Na + -ionia on kuusi kappaletta Cl - ioneita. Kaikki sa-
10 86 7. Kiteiden perustyypit malla etäisyydellä tarkastelun kohteena olevasta Na + ionista. Koska natrium- ja kloori-ionien varaukset ovat samat, oletamme että ne ovat yhden alkeisvarauksen suuruiset, on niiden välinen attraktiivinen sähköpotentiaali esitettävissä Coulombin vuorovaikutuksen muodossa. E p1 e e = 6 = ( 6), 4πε0R 4πε0R missä R on lähinaapurien välinen etäisyys kiteessä. Seuraavaksi lähinnä kiteessä sijaitsee 1 kappaletta Na + -ioneita, etäisyydellä R, mistä aiheutuva hylkivä potentiaalienergia on muotoa E p e e 1 = 1 =. 4πε0 R 4πε0R Seuraavana meillä on kahdeksan Cl - ionia etäisyydellä jälleen attraktiivisen potentiaalienergian 3R. Nyt saamme E p3 e e 8 = 8 =. 4πε0 3R 4πε0R 3 Seuraavaksi lähinnä on kuusi kappaletta Na + ioneita etäisyydellä R. Mistä aiheutuvat hylkivä potentiaalienergia on E p4 e e = 6 = ( 3). 4πε0R 4πε0R Jatkamme tätä tarkastelua siten, että vähitellen kiteen kaikki atomit ovat mukana potentiaalienergian lausekkeessa. Voimme esittää potentiaalienergian päättymättömänä summana E p e 1 8 αe = =, (7.1) 4πε0R 3 4πε0R missä vakio α on edeltävän sulkulausekkeeseen merkityn päättymättömän summan arvo. Tätä vakiota kutsutaan Magelundin vakioksi. Se on kullekin kidesymmetrialle ominainen vakio. Tahkokeskeiselle kuutiolliselle hilalle kuten natriumkloridissa Magelundin vakion arvo on α = 1,7476. Yleisesti Magelundin vakion arvo riippuu ainoastaan kiteen symmetriasta. Koppikeskeiselle kuutiolliselle hilalle kuten cesiumkloridille Magelundin vakion arvo on α = 1,767. Magelundin vakio α on positiivinen, joten potentiaalienergia on negatiivinen ja näin ollen ionien välisistä voimista
11 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 87 aiheutuva voima on attraktiivinen kaikilla etäisyyksillä ilman, että energialla olisi minimiarvoa. Jos ionien välinen voima olisi ainoa kiderakenteen määräävä tekijä kide romahtaisi kasaan. Kokeellisista tuloksista kuitenkin tiedämme kuitenkin, että ionikiteet ovat stabiileja. Edellisen tarkastelun puutteena on ionien kuvaaminen pistemäisinä varauksina. Tosi asiassa niillä on äärellinen kuorielektroneista aiheutuva ulottuvuus. Ionien ollessa tarpeeksi lähellä toisiaan kuorielektroneista aiheutuu voimakas lyhyen kantaman hylkivä voima. Ilmiön vastaa kaksiatomisen molekyylin potentiaalienergian nopeaa kasvua tasapainoetäisyyttä pienemmillä ytimien välisen etäisyyden arvoilla. Saadaksemme hylkivän potentiaalienergian mukaan tarkasteluumme käytämme semi-empiiristä lähestymistapaa. Pyrimme löytämään järkevän lausekkeen potentiaalienergialle ja sovittamaan tarvittavan parametrin kokeellisiin tuloksiin.. Hylkivälle potentiaalienergialle on esitetty useita muotoja mutta yksi laajimmin hyväksyttyjä on saksalaisen fyysikon Max Bornin esittämä lauseke βe Ep =, n 4πε0R missä β ja n ovat empiirisesti määrättäviä sovitettavia parametrejä. Koska parametri n > 1, lyhyen kantaman voima on häviävän pieni suurilla etäisyyksillä Coulombin voimaan verrattuna. Kun laskemme nämä kaksi potentiaalienergiaa yhteen saamme potentiaalienergian kokonaismääräksi E p e α β = 4πε R n. (7.) R 0 Tämä potentiaalienergian kuvaaja on esitetty kuvassa Merkitsemme ytimien välistä tasapainoetäisyyttä suureella R 0. Tämä etäisyys vastaa potentiaalienergian paikallista minimiä eli potentiaalienergian derivaatan nollakohtaa ytimen välisen etäisyyden suhteen, joten derivoimalla de p e α nβ 0 dr = + =. 4πε n+ 1 0 R0 R 0 R= R0 Ratkaisemalla 1 = R0 n n. Näin voimme kirjoittaa yhtälön 7. käyttämällä β α hyväksi tasapainoetäisyyttä muodossa E n αe R0 1 R0 p = 4πε0R0 R n R.
12 88 7. Kiteiden perustyypit Kun sijoitamme tähän tasapainoetäisyyden arvon saamme potentiaalienergian arvoksi tasapainoasemassa αe 1 Ep = 1 4πε0R 0 n. Voimme osoittaa, että kloori-ionin potentiaalienergian kokonaismäärälle saadaan tarkalleen sama lauseke. Saadaksemme kiteen koko sidosenergian meidän on laskettava yhteen kaikkien ionien potentiaalienergiat. Kun teemme tämän meidän on pidettävä lukua siitä että kunkin ioniparin välinen vuorovaikutus lasketaan vain yhden kerran. Jos kiteessä on N kappaletta ionipareja, saadaan potentiaalienergian kokonaismääräksi Nαe 1 U = 1 4πε0R 0 n. (7.3) Kokeellisista mittauksista kokonaisenergian arvoksi on saatu 5 7,77 10 J mooli. Tämä arvo on saatu mittaamalla kiteen muodostumisenergia. Sijoittamalla tämä muodostumisenergian arvo yhtälöön 7.3 ja 3 sijoittamalla siihen edelleen arvoksi N Avogadron luku ( 6, mooli ) 10 ja tasapainoetäisyydeksi R 0 =,81 10 m, saamme eksponentin n arvoksi n = 9,4. Muille kuutiollisille kiteille parametrin n arvo samaa suuruusluokkaa. Parametri n voidaan laskea myös muilla tavoilla ja tulokset ovat sopusoinnussa edellä mainitun tuloksen kanssa. Esimerkki 7.. Hilavärähtetelyt kiinteässä aineessa. Hilavärähtelyt on eräs kiteiden tärkeimpiä fysikaalisia ominaisuuksia. Seuraavassa esimerkissä tarkastelemme lineaarisessa atomiketjussa esiintyviä värähtelyjä. Oletamme että identtiset atomit ovat lepotilassa etäisyydellä a Kuva 7-9 Identtisten atomien ketju. toisistaan. Atomin n koordinaatti x- akselilla voidaan tällöin esittää muodossa xn = na. Merkitään luvulla ξ n atomin n siirtymään tasapainoasemastaan. Alimmassa approksimaatiossa voimme olettaa että kukin atomi vuorovaikuttaa ainoastaan kahden n + 1 välinen etäisyys naapurinsa kanssa. Tällöin atomin n ja atomin ( ) kasvaa määrällä ξn+ 1 ξn. Jos merkitsemme atomien välisen voiman
13 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 89 voimavakiota β atomiin n kohdistuvat atomin ( n + 1) aiheuttama voima on tällöin β ξ ξ. Tässä yhtälössä ( ) n+ 1 n olemme tietenkin olettaneet että atomien välinen voima on harmoninen, mikä onkin alimmassa kertaluvussa hyvä approksimaatio. Vastaavasti voimme osoittaa että n 1 atomiin n atomin ( ) kohdistama voima on vastaavasti β ξ. Nyt voimme muotoa ( ) n ξn 1 kirjoittaa atomille n klassisen mekaniikan mukaisen liikeyhtälön muodossa Kuva 7-10 Hilavärähtelyjen taajuus aaltovektorin k funktiona. n d ξ M dt ( ) ( ) ( ) = β ξ ξ β ξ ξ = β ξ + ξ ξ. (7.4) n+ 1 n n n 1 n+ 1 n 1 n Jos oletamme että ketju on äärettömän pitkä, voimme jättää kaikki reunaefektit huomiotta ja etsimme liikeyhtälön 7.4 ratkaisua tasoaaltomuodossa i( t kna e ω + ξ = ξ ). (7.5) n 0 Tässä vaihetekijä kna muistuttaa tasoaallon vaihetekijää kx jatkuvassa aineessa etenevässä tasoaallossa. Sijoittamalla yrite 7.5 yhtälöön 7.4 ja eliminoimalla yhteiset tekijät saamme ika ika ( ) 4 sin 1 Mω = β e + e = β ka, mistä ratkaisemalla taajuuden aaltovektorin k funktiona 1 ω = β M sin ka. (7.6) Tämä yhtälö kertoo atomiketjussa etenevän värähtelyn taajuuden sen aallonpituuden funktiona. Taajuuden maksimiarvo saavutetaan kun k = π a. Kulmataajuuden riippuvuus aaltovektorista on esitetty kuvassa Taajuuden maksimiarvo takia akustisilla aalloilla on katkaisutaajuus 15 kiinteässä aineessa. Tämä raja on kuitenkin suuruusluokkaa 10 Hz
14 90 7. Kiteiden perustyypit useimmissa aineissa ja näin ollen huomattavan korkean verrattuna niihin taajuuksiin joita on voitu tutkia laboratorio-olosuhteissa. Yhtälön 7.6 aaltoja kutsutaan akustisiksi, koska pienillä aaltovektrin arvoilla ω β Mka. Tällöin aalloista mudostetun paketin ryhmänopeus on ( β ) v = dω/ dk = / M a. Tämä on sama kuin adiabaattisten elastisten g aaltojen etenemisnopeus kiinteässä aineessa, mikä nähdään seuraavasti. Elastisuusteorian mukaan sauvassa, jonka poikkipinta-ala on A vaikuttaa voima F = EAε, missä ε on venymä esimerkiksi x-akselin suunnassa ja E A kimmokerroin. Toisaalta poikkipinta-alaan A mahtuu A/ a atomiketjua, ja venymä ε = (1/ a) ξn, joten parametrin β avulla FA = ( A/ a ) βεa. Ratkaisemalla β kimmokertoimen avulla β = Ea. Kun sijoitamme tämän 3 v = Ea M a. Sijoittamalla lopuksi M = ρa, ryhmänopeuteen saamme ( ) g missä ρ on aineen tiheys saamme äänen nopeudeksi v = E/ ρ, mikä on myös elastisuusteorian antama tulos pitkittäisen ääniaallon etenemisnopeudelle kiintässä aineessa. g Esimerkki 7.3 Tarkastellaan lineaarista hilaa, jossa on vuorotellen kahden eri alkuaineen atomeja. Atomien massat ovat M A ja M B ja atomien välisten sidosten voimavakio β. Osoita, että hilavärähtelyjen ominaistaajuudet saadaan yhtälöstä Kuva 7-11 Lineaarinen ketju kahden tyyppisistä 1/ sin ka = + ± + MA MB MA MB MAMB ω β β, missä hilavakio on a. atomeista. Ratkaisu: Olkoon u n ja v n eri alkuaineisiin A ja B kuuluvien atomien poikkeamat tasapainoasemasta. Olkoon atomien massat vastaavasti M A ja M A. Tarkastellaan atomiin n kohdistuvaa lähinaapureista aiheutuvaa voimaa. Voima Kuva 7-1 Atomien siirtymät kaksiatomisessa ketjussa. on verrannollinen atomien välisen etäisyyden poikkeamaan tasapainoetäisyydestä. B-tyypin atomi n+1 kohdistaa A-tyypin atomiin n voiman, joka on F = β ( vn+ 1 un ), missä β on sidoksen voimavakio. Voima on siis positiivinen, (vektori osoittaa x-akselin suuntaan) jos vn+ 1 > un eli jos
15 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 91 etäisyys on suurempi kuin tasapainoetäisyys. Vastaavasti B atomin n A- F = β u v. A-atomin n liikeyhtälö on atomiin n kohdistama voima on ( ) siis n n d un A β n n β n n+ 1 β n+ 1 n n ( ) ( ) ( ) M = u v u v = v + v u. (7.7) dt Vastaavasti B-atomin n liikeyhtälö on d vn B β n n 1 β n n β n n 1 n ( ) ( ) ( ) M = v u v u = u + u v. (7.7) dt Etsimme nyt differentiaaliyhtälöiden 7.7 tasoaaltoratkaisuja. Oletamme, että ratkaisu voisi olla muotoa i( ωt+ kna u ) n = u0e i( ωt+ kna v = v e ) n 0 (7.8) ja sijoitamme yritteen yhtälöön 7.7 määrätäksemme vakiot ω ja k siten, että yrite toteuttaa yhtälön. Sijoittaminen antaa tuloksen A B ika ( ) ika ( ) 0 β β M ω u = v + v e u M ω v = u + u e v Ryhmittelemällä termejä saamme ika ( ) ika ( ) = (7.9) ( MAω β) u β 1 e v 0. (7.10) ( M ω β) v + β 1 + e u = 0 B Tasoaaltojen amplitudien u 0 ja v 0 tulee toteuttaa yhtälö 7.10 jotta yrite 7.8 olisi yhtälön 7.7 ratkaisu. Yhtälöllä 7.10 puolestaan on ratkaisu vain, jos amplitudien kerroin determinantti on nolla (vrt. lineaarisen yhtälöryhmän ratkaiseminen matematiikassa). Merkitään determinantti nollaksi : ika ( 0 e ) ika ( e ) ( MAω β) β 1+ = 0. (7.11) β 1 + ( ω β) MB Laskemalla determinantti saadaan pienin järjestelyin
16 9 7. Kiteiden perustyypit ika ika ( ) ( ) 4 A Bω β A B ω β β M M M + M e + e + 1 = 0, josta edelleen käyttämällä e + e = cos ka ja saamme ika ika cos ka = 1 sin ka ( ) 4 A Aω β A B ω β M M M + M + 4 sin ka = 0. (7.1) Yhtälöstä 7.1 voimme ratkaista kulmataajuuden neliön toisen asteen yhtälön juurien avulla, jolloin saamme ω = β + ± β + M M M M M M A B A B A B sin ka. (7.13) Tarkastellaan lopuksi pitkäaaltorajaa eli λ ka << 1. Tällöin sin ka ka ja dispersiorelaatio 7.13 voidaan kirjoittaa muodossa ω 1 1 4M M (7.14) = β 1 1 A B + ± k a M ( ) A MB MA + MB Käyttämällä vielä neliöjuurelle binomiapproksimaatiota 1+ x 1 (1/) x; x << 1 saamme ω 1 1 M M = β + 1 ± 1 A B k a M ( ) A MA MA + MB (7.15) Saamme kaksi dispersiohaaraa A β k a ω = M + M B (akustinen haara) ja ω 1 1 = β + MA MB (optinen haara) π Huomaa, että I Brillouinin vyöhyke päättyy nyt pisteessä k =. Nimitys a akustinen haara, johtuu siitä, että pienillä k arvoilla aallon nopeus on ultraäänen nopeus kiteessä. Nimitys optinen haara liittyy siihen, että jos atomit A ja B muodostavat ionisen sidoksen liittyy yhteen kahden atomin baasiin, joka on ketjussa toistuva elementti permanentti dipoli. Voidaan osoittaa, että optisessa haarassa tämä dipoli saa aikaan makroskooppisen
17 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 93 polarisaatioefektin, joka kytkeytyy aikariippuvan kentän tasoaaltoon. Tästä syystä optiset fononit kytkeytyvät SM-kentän fotoneihin mutta akustiset fononit eivät kytkeydy. Jakautuminen optiseen ja akustiseen haaraan tapahtuu aina kun ketjun toistuva rakenneyksikkö baasi sisältää kaksi atomia. Näin on esimerkiksi erilliskiteisessä piissä, jossa atomit muodostavat kahden atomin pareja, jotka toistuvat FCC hilassa. Sidos on kovalenttinen, joten optinen aktiivisuus on vähäistä, mutta optinen ja akustinen haara ovat yhä olemassa, koska yksittäiset piiatomit eivät sijaitse ketjussa tasavälein vaan Si atomiparin muodostamana ryppäänä. Kuva 7-13 Dispersiorelaatiot a) pitkittäiselle aaltoliikkeelle b) pitkittäiselle ja poikittaiselle aaltoliikkeelle. Kulmataajuudella saadaan kaksi erilaista riippuvuutta aaltovektorista. Näitä on esitetty kuvassa 7-13b. Ylempi kuvaaja muodostaa hilavärähtelyjen optisen haaran ja alempaa kutsutaan akustiseksi haaraksi. Kuva 7-14 Akustiset ja optiset värähtelymoodit lineaarisessa ketjussa. Yllä olemme tarkastelleet ainoastaan pitkittäisiä hilavärähtelyjä. Atomitasot voivat kuitenkin värähdellä myös aaltovektoria vasten kohtisuorassa suunnassa, joten sekä akustiselle että optisella haaralle saamme kaksi riippumatonta poikittaista värähtelymoodia, pitkittäisen moodin lisäksi. Moodeihin liittyvät voimavakiot ovat yleisesti erilaisia ja näin saamme kaikkiaan kolme optisten ja akustisten dispersiokäyrää. Akusti-
18 Kiinteän aineen elektronirakenne sessa haarassa molemmat atomityypit värähtelevät samassa vaiheessa, kun sen sijaan optisessa haarassa niillä on 180 vaihe-ero. Tarkastelemme lähemmin poikittaisia värähtelyjä. Atomien keskinäiset vaihe-erot käyvät ilmi kuvasta Optisessa haarassa positiivisten ja negatiivisten ionien suhteellisesta etäisyydestä johtuva dipolimomentti on paljon suurempi, kuin akustisessa haarassa. Tästä syystä optiseen haaraan liittyvät värähtelymoodit kytkeytyvät paljon voimakkaammin sähkömagneettiseen säteilyyn kuin akustiseen haaraan liittyvät moodit. Optiseen haaraan kuuluvat värähtelyt sijoittuvat infrapuna-alueelle ja tästä syystä ionikiteet vuorovaikuttavat sähkömagneettisen säteilyn kanssa voimakkaasti infrapuna-alueella. Infrapuna-alueella fotonien taajuus on Hz, aallonpituus suuruusluokkaa 10 m ja aaltovektorien k arvo on 4 suuruusluokkaa 10 m -1. Useimmille ionisille kiteille hilavakion a arvo on 10 suuruusluokkaa 10 6 m, joten ka on suuruusluokkaa 10. Tästä syystä voimme arvioida kiteen resonanssitaajuuden sijoittamalla likimain ka 0 yhtälöön 7.13 ω = β +. (7.16) MA MB Tämä on optisen fononin energia natriumkloridikiteessä ja vastaa kuvan 7-3 maksimiarbsorbtion aallonpituutta. Tutkitttaessa hilavärähtelyjen vuorovaikutusta elektronien ja fotonien kanssa on otettava huomioon hilavärähtelyjen kvantittuminen. Hilavärähtelyjen kvanttimekaaninen kuvaaminen edellyttää siirtymistä atomien paikkakoordinaateista ns. normaalikoordinaatteihin. Normaalikoordinaateissa saadaan hilavärähtelyt esitettyä yksittäisten atomien kytkettyjen värähtelyjen sijaan lähes riippumattomien harmonisten oskillaattorieden avulla. Näin hilavärähtelyt voidaan kvantisoida harmonisen oskillaattorien mallin avulla. Fononit ovat normaalikoordinaattioskillaattoreiden energiatiloja, joiden avulla voidaan esittää kiteessä eteneviä kvantittuneita hilavärähtelyjä.
19 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet Kiinteän aineen elektronirakenne Elektronin näkemää potentiaalia on havainnollistettu kuvassa 7-15a. Jos yhden ytimen sijaan rakenteessa on kaksi ydintä, kuten vetymolekyyliioneissa H ja vetymolekyyleissä H, pote Kun elektroni liikkuu kide- + hilaan kuuluvan ionin läheisyydessä siihen kohdistuu ytimen positiivisesta varauksesta johtuva Coulombin voima, johon liittyvä potentiaalienergia on muotoa 1 r. ntiatarkastelemme seuraavaksi molekyyliä jossa on useita ioneita säännöllisellä etäisyydellä toisistaan ja samalle suoralle sijoittuen. alienergia on kuvan 7-15b kaltainen. Tätä vastaava potentiaaliprofiili on esitetty kuvassa 7-15c. Jos jätämme molekyylin alku- ja loppuioneihin liittyvät reunaefektit huomiotta, potentiaaliprofiili 7-15c vastaa yksiulotteisessa kidehilassa elektronien Kuva 7-15 Coulombin potentiaalienergia (a) atomissa (b) näkemää potentiaalia. molekyylissä ja (c) kiinteässä aineessa. Todellisessa kidehilassa atomit ovat järjestäytyneet kolmiulotteiseksi rakenteeksi ja näin ollen kuvan 7-15c esittämä säännöllinen potentiaaliprofiili toistuu kaikissa kolmessa ulottuvuudessa siirryttäessä yksikkökopista toiseen. Voidaksemme määrätä tällaisessa potentiaalikentässä muodostuvat elektronitilat, meidän on jälleen palattava Schrödingerin yhtälöön. Periaatteessa potentiaalienergian paikkariippuvuus määrää elektronirakenteen. Kiinteän aineen potentiaalienergialle ominainen periodisuus Kuva 7-16 Energiatasoja lineaarisessa kidehilassa. mahdollistaa sen, että elektronirakenteesta voidaan saada
20 Kiinteän aineen elektronirakenne kohtuullisen paljon tietoa ilman, että eksplisiittisesti ratkaistaan vastaava Schrödingerin yhtälö. Tarkastelemme yksiulotteista hilaa, joka koostuu N ionista jotka sijaitsevat säännöllisellä etäisyydellä a toisistaan, kuva Elektroni, jolla on energia E 1 ei voi liikkua vapaasti kidehilassa vaan sen liike rajoittuu alueille jotka on kuvassa merkitty AB, CD, jne. Hiukkanen voi kuitenkin tunneloitua alueesta AB alueeseen CD. Näiden alueiden välinen potentiaalikynnys on kuitenkin suhteellisen korkea joten tunneloitumistodennäköisyys on hyvin pieni. Tästä johtuen kidehilassa sisimpien elektronikuorten energiat ja aaltofunktiot ovat hyvin tarkkaan samoja, kuin tämän saman alkuaineen vapaissa atomeissa. Sisäkuorilla olevat elektronit ovat siis lähes täydellisesti lokalisoituneet, jonkin kidehilaan kuuluvan atomin lähiympäristöön. Elektroni, jolla on energia E ei ole yhtä tiukasti sidottu yksittäiseen ioniin ja sillä on huomattavan suuri todennäköisyys tunneloitua potentiaaliprofiilissa esiintyvien vallikerrrosten läpi. Lopuksi elektroni, jolla on energia E 3 ei ole lainkaan sidottu kidehilassa olevaan atomiin ja se voi liikkua hyvin vapaasti kidehilassa. Jälkimmäiset lähes vapaat elektronit määräävät kidehilan kollektiiviset ominaisuudet kuten sähkön- ja lämmönjohtavuuden ja ne myös osallistuvat keskeisesti kidehilan sidosenergian muodostumiseen. Seuraavaksi määräämme mahdolliset energiatasot. Palautamme aluksi + mieliin vetymolekyyli-ionin H ja vetymolekyylin H tärkeimmät ominaisuudet. Kaksiatomisessa molekyylissä potentiaalienergia aiheutuu kahden ionin tai atomin potentiaalienergian summasta. Atomien ollessa kaukana toisistaan elektronitilat ovat eristetyn atomin energiatiloja ja kahdesti degeneroituneita. Kun atomit tai ionit lähestyvät toisiaan energiatasot hajoavat kahdeksi eri energiatasoksi. Tämä on esitetty kuvassa 6-4. Vastaavasti lineaarisessa molekyylissä π -sidoksen elektronit liikkuvat periodisessa potentiaalissa ja jokainen vapaan atomin energiataso hajoaa molekyylissä yhtä moneksi energiatasoksi kuin molekyylissä on atomeja. Tätä on havainnollistettu kuvassa 6-1 butadiinille. Tämän perusteella voimme olettaa että kuvan 7-16 mukaisessa yksiulotteisessa kiteessä jokainen atomin energiataso hajoaa N lähellä toisiaan olevaksi energiatasoksi. Näiden energiatasojen energiaerot ja energiat määräytyvät atomien välisen etäisyyden perusteella. Tätä on havainnollistettu kuvassa
21 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet Atomien ollessa etäisyydellä a toisistaan energiatasot sijaitsevat pisteiden P ja Q välillä energiaakselilla. Kun atomien lukumäärä N tulee hyvin suureksi energiatasot tulevat hyvin lähelle toisiaan ja sanomme että ne muodostavat jatkuvan energiatilavyön tai lyhyesti elektronivyön. Paulin kieltosäännön mukaan jokaiselle energiatasolle voidaan sijoittaa kaksi elektronia, toinen spin ylös ja toinen spin alas tilaan. Näin Kuva 7-17 Lineaarisen kidehilan energiatasot ionien ollen kullekin potentiaaliprofiiliin 7- välisen etäisyyden funktiona. 16 muodostuvalle energiavyölle voidaan sijoittaa enintään N elektronia, eli kaksi elektronia yksiulotteisessa kiteessä olevaa ionia tai atomia kohden. Näitä vöitä merkitsemme s-, p-, d-,... kirjaimella sen mukaan, mikä eristetyn atomin energiatasoon liittyvä kulmaliikemäärän arvo dominoi vastaavaa vyötilan aaltofunktiota. Yleisesti kiteessä on useita energiavöitä, joista kukin liittyy johonkin sellaisen eristetyn atomin energiatilaan josta kide on tehty. Kuva 7-18 esittää useita energiavöitä ionien välisen etäisyyden funktiona. Kuvasta huomaamme, että mitä ylempänä (energia-asteikolla) on se vapaan atomin energiataso, josta vyö muodostuu, sitä suuremmilla etäisyyksillä vyön muodostuminen alkaa. Niiden elektronien, joilla on pieni sidosenergia, aaltofunktio ulottuu laajemmalla atomin ympäristöön ja näin tuotaessa atomeja lähemmäs toisiaan nämä energia-asteikolla Kuva 7-18 Energiavöiden muodostuminen ytimien uloimpana olevat elektronit alkavat etäisyyden pienentyessä. ensimmäisenä nähdä toisensa ja muodostaa vyötilaan liittyviä aaltofunktioita. Edelleen kuvasta 7-18 huomataan, että kun ionien välinen etäisyys pienenee alkaa osa
22 Vapaaelektronimalli muodostuneista vyötiloista peittää toisiaan. Esimerkiksi ionien ollessa etäisyydellä a toisistaan, kolmas ja neljäs vyö peittävät energia-asteikolla osittain toisensa. Tällä on, oleellinen merkitys kiinteän aineen elektronisille ominaisuuksille. Niillä energiavöillä, jotka muodostuvat kiteen atomien sisäkuorien elektroneista on kaikki sallitut energiatilat miehitetty Paulin kieltosäännön määräämissä rajoissa. Näillä energiavöillä olevat elektronit ovat lähes puhtaissa atomisissa elektronitiloissa ja jätämme ne tarkastelumme ulkopuolelle. Energiavyöt, jotka liittyvät kiteen atomien uloimpiin elektronikuoriin ja joilla olevia elektroneita kutsumme valenssielektroneiksi, ovat tärkeinpiä kiinteän aineen sähköisten ja optisten ominaisuuksien kannalta. Tästä syystä keskitymme atomien uloimmista elektronikuorista muodostuviin elektronivöihin. Jos uloin, ainakin osittain miehitetty vyö, on täynnä, sitä kutsutaan valenssivyöksi ja ensimmäistä tyhjää vyötä täyden valenssivyön yläpuolella kutsutaan johtovyöksi. Tämä on usein tilanne puolijohteissa. Jos uloin vyö on vajaa, sitä kutsutaan johtovyöksi. Tämä on yleensä metalleissa vallitseva elektronivyörakenne. 7.4 Vapaaelektronimalli Vapaaelektronimalli on yksinkertaisin kiinteän aineen elektroneita kuvaava approksimaatio. Siinä oletetaan, että johtovyön elektronit näkevät kiteen sisällä vakiopotentiaalin. Potentiaalin arvo kiteen sisällä olkoon E p0. Jätämme siis täysin huomiotta kuvassa 7-16 esiintyvän ionikuorista aiheutuvan potentiaalin periodisuuden. Kiteen ulkopuolella potentiaalilla on ns. vakuumiarvo, joka on huomattavasti korkeampi kuin potentiaalin arvo kiteen sisällä. Näin ollen kiteessä olevat elektronit ovat äärellisessä kolmiulotteisessa potentiaalilaatikossa. Vapaaelektronimalli on erityisen käyttökelpoinen metallien johtovyön elektronien kuvaamiseen. Seuraavassa tarkastelemme kuitenkin alussa tällaisen potentiaalilaatikon energiatiloja yksiulotteisessa kidehilassa. Jos oletamme, että kide on tarpeeksi suuri, voimme aluksi jättää huomiotta potentiaaliaskeleen kiteen reunoilla. Tällöin hilassa olevia elektroneita voidaan kuvata vapaan elektronin yksiulotteisella aaltofunktiolla. Tämän vapaan elektronin Schrödingerin yhtälön ratkaisu on kuten aiemmin olemme osoittaneet
23 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 99 ikx ψ = e. (7.17) Aaltovektori k voi olla positiivinen tai negatiivinen, jolloin elektroni voi vastaavasti liikkua x-akselin positiiviseen tai negatiiviseen suuntaan. Vastaava kolmiulotteinen ratkaisu vapaan elektronin aaltofunktiolle on, kuten aiemmin olemme todenneet, muotoa ψ = e i k r i. (7.18) Molemmille aaltofunktiolle aaltofunktion todennäköisyystiheys eli itseisarvon neliö on 1, ψ = 1, joka tarkoittaa, että elektronin aaltofunktioon liittyvä todennäköisyystiheys on sama kaikkialla kiteen sisällä. Tämä ei tietenkään ole tarkkaan sopusoinnussa todellisen hilaperiodisen potentiaaliprofiilin 7-16 kanssa. On järkevää olettaa, että elektronilla on suurempi todennäköisyys sijaita potentiaalin minimikohdassa eli lähellä ioneita. Metalleille kuvan 7-16 potentiaalienergian minimit ovat kuitenkin niin matalia, että niillä on hyvin vähäinen vaikutus johtovyön elektronien aaltofunktioon ja näin ollen myös todennäköisyystiheys on likimain vakio. Jos jätämme potentiaalienergian vakioarvon E p0 huomiotta (se ainoastaan siirtää energia-asteikkon 0- kohtaa) on aaltofunktioihin 7.17 ja 7.18 liittyvä elektronin energia = e = " e. (7.19) E p m k m Tämä vastaa sellaisen elektronin liikeenergiaa jolla on liikemäärää p = " k. Tätä energian riippuvuutta aaltovektorin itseisarvosta on havainnollistettu kuvassa Vapaaelektronimalli sallii kaikki aaltovektorin k, ja näin ollen myös kineettisen energian E k arvot. Kuva 7-19 Vapaan elektronin energia aaltovektorin k funktiona. Vapaaelektronimalli ei voi antaa tietoa energiavyön leveydestä. Voimme kuitenkin arvioida energiavyön leveyden seuraavasti. Tarkastellaan hilaa, joka koostuu N ionista jotka ovat etäisyydellä a toisistaan. Tällöin lineaa-
24 Vapaaelektronimalli risen kiteen pituus L = Na. Jotta tällaiseen kiteeseen voisi muodostua seisovia aaltoja elektronin aallonpituuden λ täytyy toteuttaa vaatimus n λ = L. Toisin sanoen kutakin n arvoa kohden saamme stationäärisen ( ) tilan. Toisaalta tiedämme että jos hilassa on N ionia, siinä on ainoastaan N kappaletta lineaarisesti riippumattomia energiatiloja, jotka voidaan esittää yksittäisten atomien tietyn elektronitilan lineaarikombinaationa. Näin ollen mahdolliset vakion n arvot ovat 1,,3,...,N. Sijoittamalla k = π λ, saamme k = nπ L = nπ Na, n = 1,,3,..., N. (7.0) Perättäisten sallittujen aaltovektorin arvojen väli on siis π Na, joka on hyvin pieni jos N on suuri ja oikeuttaa sen että voimme pitää aaltovektoria k oleellisesti jatkuvana suureena kvantittumisehdosta 7.0 huolimatta. Jos asetamme vakiolle n suurimman mahdollisen arvon, eli n = N, saamme vastaavan aaltovektorin maksimiarvon, kmax = π a. (7.1) Näin ollen huomaamme että sallitut k arvot sijoittuvat välille [ π a, π a], kuten kuvassa 7-19 on esitetty. Huomaa, että tämän äärellisen k-avaruuden alueen rajaa yllämainittu lineaarisen riippumattomuuden vaatimus, jonka avulla olemme tuoneet vapaaelektronimalliin kiteen periodista atomista rakennetta koskevan oletuksen. Vastaavasti elektronin maksimienergia vastaa aaltovektorin suurinta arvoa, jolloin saamme maksimienergiaksi π Emax = ". (7.) m e a Maksimienergia 7. riippuu atomien lähinaapurietäisyydestä, mutta se on riippumaton kiteessä olevien ionien lukumäärästä. Uusien ionien liittäminen kiteeseen lisää energiavyön tilojen kokonaismäärää energian E max alapuolella. Kiteen periodisuusehto, joka määrää aaltovektorin k ja energian maksimiarvon, yhtälöiden 7.1 ja 7. mukaisesti, säilyy muuttumattomana. Sähköisten ominaisuuksien ymmärtämiseksi on tärkeää tietää, miten elektronit sijoittuvat sallituille energiatiloille maksimiarvon E max alapuolelle. Esimerkissä.3 on osoitettu, että vapaaelektronimallissa
25 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 301 niiden elektronitilojen lukumäärä, jotka sijaitsevat potentiaalilaatikossa E, E + de, saadaan lausekkeesta energiavälillä [ ] 3 ( m ) 1 4πV 1 dn( E) = E de. 3 " Kullekin energiatasolle voidaan sijoittaa kaksi elektronia, toinen spin ylös ja toinen spin alas tilaan. Jos jaamme tämän lukumäärän laatikon tilavuudella saamme elektronien lukumäärän tilavuusyksikköä kohden energiavä- E, E+ de, toisin sanoen lillä [ ] 3 ( m ) 1 8π e 1 dn = E de = g( E) de. (7.3) 3 " Vapaaelektronimallin tilatiheys energia- ja tilavuusyksikköä kohden g( E) = dn de on esitetty kuvassa 7-0. Huomaa, että käytännössä vapaaelektronimalli ei ole hyvä approksimaatio maksimienergian E max läheisyydessä. Niiden elektronitilojen lukumäärä, jotka sijaitsevat vyön alareunan ja energian E välillä saadaan integroimalla tilatiheysfunktio, E n = g( E) de. 0 Käyttämällä nyt yhtälöä 7.3 saamme tilojen lukumääräksi välillä [ 0, E ] 3 ( me ) 1 E π 1 n = E de = h. (7.4) 3 16π ( me ) 3 = E 3 3h Jos metalli on perustilassa, eli absoluuttisessa nollapisteessä, kaikki elektronit sijoittuvat alimmille Paulin kieltosäännön mukaisille tiloille, alimmasta tilasta alkaen. Jos elektronien kokonaistiheys n 0 on Kuva 7-0 Elektronien jakautuminen johtovyön energiatiloille absoluuttisessa nollapisteessä.
26 Vapaaelektronimalli Kuva 7-1 Vapaiden elektronien energiatilojen miehittyminen äärellisessä lämpötilassa. pienempi kuin elektronitilojen kokonaismäärä (tilavuusyksikköä kohden) tässä vyössä katkaisuenergian E max alapuolella, energiatilat täyttyvät ainoastaan arvoon ε saakka, jota kutsutaan F fermienergiaksi. Jos asetamme nyt E = ε F yhtälössä 7.4 täytyy elektronitilojen määrän olla n = n0. Näin voimme ratkaista fermienergian, jolle saamme arvon ε 3 h 3n0 F = 8m e π. (7.5) Absoluuttisessa nollapisteessä metallin miehitettyjä elektronitiloja kuvaa kuvan 7-0 varjostettu alue. Taulukossa 7-1 on esitetty laskettuja fermienergian arvoja muutamille metalleille. Kuva 7- (a) Elektronien jakautuminen kun T = 0 (b) Energiatilojen täyttyminen korkeammissa lämpötiloissa. Jos elektronivyö ei ole täynnä voidaan ylimmillä miehitetyillä tiloilla olevia elektroneja virittää korkeammille energiatiloille hyvin pienellä energialla. Tämä johtuu siitä että energiatilat muodostavat jatkumon, joka koostuu useista hyvin lähellä toisistaan olevista tiloista. Lämpöliike voi virittää elektroneja fermitason yläpuolisille elektronitiloille. Lämpöliikkeen aiheuttamaan virittymiseen osallistuvat kuitenkin kapealla alueella fermipinnan läheisyydessä olevat elektronit. Tämä johtuu siitä, että huoneenlämpötilassakin tilastollinen keskimääräinen energia kt on vain 5meV. Se ei riitä alimmilla
27 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 303 elektronitiloilla olevien elektronien virittämiseen fermipinnan yläpuolisille tyhjille tiloille, mutta alueella joka ulottuu fermipinnasta noin 50meV alaspäin lämpöliike voi siirtää elektroneja fermitason yläpuolisille tyhjille Taulukko 7.1 Fermienergia Metalli Li Na K Rb Cs Cu Ag Au Mg Al ε F, ev 4,7 3,1,14 1,8 1,53 4,07 5,51 5,54 7,3 11,9 tiloille. Tätä on havainnollistettu kuvissa Kuten aiemmin olemme valosähköisen ilmiön yhteydessä maininneet metallin työfunktiolla tai irrotustyöllä tarkoitetaan sitä energiaa, joka tarvitaan johtovyön ylimmällä miehitetyllä tilalla olevan elektronin siirtämiseksi metallin ulkopuolelle. Jos lämpötila on alhainen ylin miehitetty tila vastaa juuri fermienergiaa. Koska keskimääräinen terminen energia on hyvin pieni fermienergiaan verrattuna, vain muutamia elektroneja on merkittävästi fermipinnan yläpuolella huoneenlämpötilassa. Tästä syystä työfunktio on käytännössä lähes vakio laajalla lämpötilaalueella. Esimerkki 7.3. Paulin spinparamagnetismin tarkastelua. Ratkaisu: Edellä esitetyn vapaaelektronimallin avulla voidaan ymmärtää monia metallien ominaisuuksia, muun muassa useille metalleille ominainen paramagnetismi. Wolfgang Pauli osoitti paramagnetismin olevan yhteydessä spin ylös ja spin alas -tilojen miehittymiseen ulkoisessa magneettikentässä. Tällöin spin alas-tilat tulevat energeettisesti edullisemmiksi, koska niillä olevien elektronien vuorovaikutus ulkoisen kentän kanssa saa negatiivisen arvon suuruudeltaan µ BB. Ulkoisessa magneettikentässä elektronin kokonaisenergia koostuu kineettisestä energiasta ja tästä magneettisen momentin ja ulkoisen magneettikentän välisestä vuorovaikutusenergiasta. Kun merkitsemme elektronin kokonaisenergiaa suureella E, voidaan kineettinen energia esittää muodossa E µ B, missä ylempi merkki viittaa spin ylös ja alempi spin alas-tilaan. Tästä syystä voimme kirjoittaa spin ylös ja spin alas-tilojen miehitysluvut muodossa B dn dn = g( E µ B), = g( E+ µ BB), de 1 1 B de
28 Vapaaelektronimalli missä tekijä 1/ottaa huomioon sen, että nollakentässä molemmilla spintiloilla on puolet metallin elektronitiheydestä. Kuva 7-3 esittää dn de. Jos oletamme, että lämpötilan on lähellä tilatiheyksiä ( dn de) ja ( ) absoluuttista nollapistettä spin alas-tiloilla olevien elektronien määrä on suurempi kuin spin ylös-tiloilla olevien elektronien kokonaismäärä. Huomattakoon että olemme säilyttäneet fermipinnan arvon saman kuin sen on nollamagneettikentässä. Voimakkaimmissakin magneettikentissä energia 6 µ BB on vain suuruusluokkaa 6 10 ev, joten fermipinta siirtyy vain merkityksettömän vähän taulukossa 7-1 annetusta arvosta. Näin spin ylös ja spin alas tilatiheydet siirtyvät vain hyvin vähän. Elektroneilla, joilla spin ylös on magneettinen momentti µ B kentän suuntaan ja niillä joilla on spin alas on vastaavasti magneettinen momentti + µ B. Näin ollen voimme kirjoittaa kokonaismagneettisen momentin tilavuusyksikköä kohden metallissa integraalina εf dn dn M = µ B µ B de 0 de de 1 εf B B B 0 ( ) ( ) = µ g E+ µ B g E µ B de ε BB de BBg F 0 de F dg ( ). = µ = µ ε Tässä käytimme yhtälöä g ( E ± µ BB) = g ( E) ± µ BB( dg de), joka saadaan Taylorin sarjakehitelmän avulla. Käyttämällä nyt yhtälöitä 7.3 ja 7.5 saamme g( εf) = 3n0 ε F ja näin ollen ulkoisen magneettikentän aiheuttama magnetisaatio on 3n0µ B ε F M = B. Kuva 7-3 Energiatilojen täyttyminen ulkoisessa magneettikentässä. Magnetisaatio on saman suuntainen kuin ulkoinen kenttä ja tämän takia puhumme paramagneettisesta efektistä. Palauttamalla mieliin magneettisen suskeptibiliteetin määritelmä voimme
29 Kiinteän aineen rakenne ja fysikaaliset ominaisuudet 305 kirjoittaa paramagneettisen suskeptibiliteetin lausekkeeksi χ m 3n 0µ Bµ 0 ε F =. Kun sijoitamme tähän fermienergian arvoksi εf ev, saamme 6 χ m Tämä tulos on suuruusluokaltaan hyvässä sopusoinnussa kokeellisten tulosten kanssa. Vaikka teimme laskun olettamalla nollalämpötilan, tulos on pätevä varsin korkeissakin lämpötiloissakin. Huomattakoon että yleisesti suure n 0 on suurempi ja ε F pienempi metalleille joissa johtavuuselektronit ovat d-elektroneja, kuin metalleille joissa ne ovat s- ja p-elektroneja. Tästä syystä paramagnetismi on voimakkaampaa metalleissa joiden johtavuuselektronien kulmaliikemäärää dominoi d-symmetria.
30 Elektronien liike periodisessa potentiaalirakenteessa 7.5 Elektronien liike periodisessa potentiaalirakenteessa Seuraavassa pyrimme parantamaan vapaaelektronimallia ottamalla huomioon kidehilan periodisen potentiaalin. Tarkastelemme aluksi Schrödingerin yhtälön mahdollisia ratkaisuja. Tiedämme että vapaan elektronin aaltofunktio on tasoaalto e ki r. On luonnollista olettaa että kidehilan i aiheuttama periodinen potentiaali voi muuttaa tämä tasoaallon amplitudia paikan funktiona. Tästä syystä kirjoitamme Schrödingerin yhtälön ratkaisulle periodisessa potentiaalissa muodossa yritteen i i ( r) e u ( r) ψ = kr k (7.6), missä tasoaallon amplitudi u ( r ) on paikan funktio. Tarkastelemme aluksi yksiulotteista kidettä, jossa atomien välinen etäisyys on a. Tällöin voimme kirjoittaa yhtälön 7.6 muodossa ( x) e u ( x) ikx k ψ =, (7.7) missä atominen Blochin u x toteuttaa tila ( ) k periodisuusehdon ( ) ( ) uk x+ a = uk x. (7.8) Kuva 7-4 Aaltofunktiot kahdeksan ionin muodostamassa hilassa. Yhtälöt 7.7 ja 7.8 muodostavat yhdessä Blochin teoreeman, jonka todistukseen palaamme myöhemmin. Voimme saada kvalitatiivisen kuvan ratkaisujen 7.7 luonteesta ajattelemalla, että amplitudi u ( x ) muistuttaa kiteen eri hilapaikkoihin keskittyvien atomiorbitaalien summaa, jota moduloidaan
Luento 1: Sisältö. Vyörakenteen muodostuminen Molekyyliorbitaalien muodostuminen Atomiketju Energia-aukko
 Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
KIINTEÄN AINEEN RAKENNE JA FYSIKAALISET OMINAISUUDET
 KIINTEÄN AINEEN RAKENNE JA FYSIKAALISET OMINAISUUDET... 78 7.1 Johdanto...78 7. Kiteiden perustyypit...80 7.3 Kiderakenteiden peruskäsitteitä...85 7.4 Hilavärähtelyt kiinteässä aineessa....91 7.4.1 Identtisten
KIINTEÄN AINEEN RAKENNE JA FYSIKAALISET OMINAISUUDET... 78 7.1 Johdanto...78 7. Kiteiden perustyypit...80 7.3 Kiderakenteiden peruskäsitteitä...85 7.4 Hilavärähtelyt kiinteässä aineessa....91 7.4.1 Identtisten
PHYS-C0240 Materiaalifysiikka (5op), kevät 2016
 PHYS-C0240 Materiaalifysiikka (5op), kevät 2016 Prof. Martti Puska Emppu Salonen Tomi Ketolainen Ville Vierimaa Luento 7: Hilavärähtelyt tiistai 12.4.2016 Aiheet tänään Hilavärähtelyt: johdanto Harmoninen
PHYS-C0240 Materiaalifysiikka (5op), kevät 2016 Prof. Martti Puska Emppu Salonen Tomi Ketolainen Ville Vierimaa Luento 7: Hilavärähtelyt tiistai 12.4.2016 Aiheet tänään Hilavärähtelyt: johdanto Harmoninen
, m s ) täytetään alimmasta energiatilasta alkaen. Alkuaineet joiden uloimmalla elektronikuorella on samat kvanttiluvut n,
 S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering, Micro- and Nanosciences Laboratory. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Matematiikan tukikurssi
 Matematiikan tukikurssi Kurssikerta 8 1 Derivaatta Tarkastellaan funktion f keskimääräistä muutosta tietyllä välillä ( 0, ). Funktio f muuttuu tällä välillä määrän. Kun tämä määrä jaetaan välin pituudella,
Matematiikan tukikurssi Kurssikerta 8 1 Derivaatta Tarkastellaan funktion f keskimääräistä muutosta tietyllä välillä ( 0, ). Funktio f muuttuu tällä välillä määrän. Kun tämä määrä jaetaan välin pituudella,
Fononit. Värähtelyt lineaarisessa atomiketjussa Dispersiorelaatio Kaksi erilaista atomia ketjussa Fononit kolmessa dimensiossa
 Fononit Värähtelyt lineaarisessa atomiketjussa Dispersiorelaatio Kaksi erilaista atomia ketjussa Fononit kolmessa dimensiossa Atomien lämpövärähtely Mikä on atomien värähtelyn taajuus ja amplitudi? Tarkastellaan
Fononit Värähtelyt lineaarisessa atomiketjussa Dispersiorelaatio Kaksi erilaista atomia ketjussa Fononit kolmessa dimensiossa Atomien lämpövärähtely Mikä on atomien värähtelyn taajuus ja amplitudi? Tarkastellaan
12. Eristeet Vapaa atomi. Muodostuva sähköinen dipolimomentti on p =! " 0 E loc (12.4)
 12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Sähköstaattisen potentiaalin laskeminen
 Sähköstaattisen potentiaalin laskeminen Potentiaalienegia on tuttu mekaniikan kussilta eikä se ole vieas akielämässäkään. Sen sijaan potentiaalin käsite koetaan usein vaikeaksi. On hyvä muistaa, että staattisissa
Sähköstaattisen potentiaalin laskeminen Potentiaalienegia on tuttu mekaniikan kussilta eikä se ole vieas akielämässäkään. Sen sijaan potentiaalin käsite koetaan usein vaikeaksi. On hyvä muistaa, että staattisissa
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
2.7 Neliöjuuriyhtälö ja -epäyhtälö
 2.7 Neliöjuuriyhtälö ja -epäyhtälö Neliöjuuren määritelmä palautettiin mieleen jo luvun 2.2 alussa. Neliöjuurella on mm. seuraavat ominaisuudet. ab = a b, a 0, b 0 a a b =, a 0, b > 0 b a2 = a a > b, a
2.7 Neliöjuuriyhtälö ja -epäyhtälö Neliöjuuren määritelmä palautettiin mieleen jo luvun 2.2 alussa. Neliöjuurella on mm. seuraavat ominaisuudet. ab = a b, a 0, b 0 a a b =, a 0, b > 0 b a2 = a a > b, a
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
12. Eristeet Vapaa atomi
 12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
Kvanttifysiikan perusteet 2017
 Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
9. JAKSOLLINEN JÄRJESTELMÄ
 9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa
 Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
Aluksi. 2.1. Kahden muuttujan lineaarinen epäyhtälö
 Aluksi Matemaattisena käsitteenä lineaarinen optimointi sisältää juuri sen saman asian kuin mikä sen nimestä tulee mieleen. Lineaarisen optimoinnin avulla haetaan ihannearvoa eli optimia, joka on määritelty
Aluksi Matemaattisena käsitteenä lineaarinen optimointi sisältää juuri sen saman asian kuin mikä sen nimestä tulee mieleen. Lineaarisen optimoinnin avulla haetaan ihannearvoa eli optimia, joka on määritelty
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Luento 8. Lämpökapasiteettimallit Dulong-Petit -laki Einsteinin hilalämpömalli Debyen ääniaaltomalli. Sähkönjohtavuus Druden malli
 Luento 8 Lämpökapasiteettimallit Dulong-Petit -laki Einsteinin hilalämpömalli Debyen ääniaaltomalli Sähkönjohtavuus Druden malli Klassiset C V -mallit Termodynamiikka kun Ei ennustetta arvosta! Klassinen
Luento 8 Lämpökapasiteettimallit Dulong-Petit -laki Einsteinin hilalämpömalli Debyen ääniaaltomalli Sähkönjohtavuus Druden malli Klassiset C V -mallit Termodynamiikka kun Ei ennustetta arvosta! Klassinen
ψ(x) = A cos(kx) + B sin(kx). (2) k = nπ a. (3) E = n 2 π2 2 2ma 2 n2 E 0. (4)
 76A KIINTEÄN AINEEN FYSIIKKA Ratkaisut 4 Kevät 214 1. Tehtävä: Yksinkertainen malli kovalenttiselle sidokselle: a) Äärimmäisen yksinkertaistettuna mallina elektronille atomissa voidaan pitää syvää potentiaalikuoppaa
76A KIINTEÄN AINEEN FYSIIKKA Ratkaisut 4 Kevät 214 1. Tehtävä: Yksinkertainen malli kovalenttiselle sidokselle: a) Äärimmäisen yksinkertaistettuna mallina elektronille atomissa voidaan pitää syvää potentiaalikuoppaa
Mustan kappaleen säteily
 Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
766334A Ydin- ja hiukkasfysiikka
 1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
Voima ja potentiaalienergia II Energian kvantittuminen
 Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
1240eV nm. 410nm. Kun kappaleet saatetaan kontaktiin jännite-ero on yhtä suuri kuin työfunktioiden erotus ΔV =
 S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
Miehitysluvuille voidaan kirjoittaa Maxwell Boltzmann jakauman mukaan. saamme miehityslukujen summan muodossa
 S-4.7 Fysiia III (EST) Tetti..6. Tarastellaa systeemiä, jossa ullai hiuasella o olme mahdollista eergiatasoa, ε ja ε, missä ε o eräs vaio. Oletetaa, että systeemi oudattaa Maxwell-Boltzma jaaumaa ja, että
S-4.7 Fysiia III (EST) Tetti..6. Tarastellaa systeemiä, jossa ullai hiuasella o olme mahdollista eergiatasoa, ε ja ε, missä ε o eräs vaio. Oletetaa, että systeemi oudattaa Maxwell-Boltzma jaaumaa ja, että
MUUTOKSET ELEKTRONI- RAKENTEESSA
 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MAA10 HARJOITUSTEHTÄVIÄ
 MAA0 Määritä se funktion f: f() = + integraalifunktio, jolle F() = Määritä se funktion f : f() = integraalifunktio, jonka kuvaaja sivuaa suoraa y = d Integroi: a) d b) c) d d) Määritä ( + + 8 + a) d 5
MAA0 Määritä se funktion f: f() = + integraalifunktio, jolle F() = Määritä se funktion f : f() = integraalifunktio, jonka kuvaaja sivuaa suoraa y = d Integroi: a) d b) c) d d) Määritä ( + + 8 + a) d 5
E p1 = 1 e 2. e 2. E p2 = 1. Vuorovaikutusenergian kolme ensimmäistä termiä on siis
 763343A IINTEÄN AINEEN FYSIIA Ratkaisut 3 evät 2017 1. Tehtävä: CsCl muodostuu Cs + - ja Cl -ioneista, jotka asettuvat tilakeskeisen rakenteen vuoropaikoille (kuva). Laske tämän rakenteen Madelungin vakion
763343A IINTEÄN AINEEN FYSIIA Ratkaisut 3 evät 2017 1. Tehtävä: CsCl muodostuu Cs + - ja Cl -ioneista, jotka asettuvat tilakeskeisen rakenteen vuoropaikoille (kuva). Laske tämän rakenteen Madelungin vakion
Molekyylit. Atomien välisten sidosten muodostuminen
 Molekyylit. Johdanto. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit 6. Orgaaniset
Molekyylit. Johdanto. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit 6. Orgaaniset
( ) ( ) ( ) ( ( ) Pyramidi 4 Analyyttinen geometria tehtävien ratkaisut sivu 271 Päivitetty 19.2.2006. 701 a) = keskipistemuoto.
 Pyramidi Analyyttinen geometria tehtävien ratkaisut sivu 7 Päivitetty 9..6 7 a) + y = 7 + y = 7 keskipistemuoto + y 7 = normaalimuoto Vastaus a) + y = ( 7 ) + y 7= b) + y+ 5 = 6 y y + + = b) c) ( ) + y
Pyramidi Analyyttinen geometria tehtävien ratkaisut sivu 7 Päivitetty 9..6 7 a) + y = 7 + y = 7 keskipistemuoto + y 7 = normaalimuoto Vastaus a) + y = ( 7 ) + y 7= b) + y+ 5 = 6 y y + + = b) c) ( ) + y
Epäyhtälön molemmille puolille voidaan lisätä sama luku: kaikilla reaaliluvuilla a, b ja c on voimassa a < b a + c < b + c ja a b a + c b + c.
 Epäyhtälö Kahden lausekkeen A ja B välisiä järjestysrelaatioita A < B, A B, A > B ja A B nimitetään epäyhtälöiksi. Esimerkiksi 2 < 6, 9 10, 5 > a + + 2 ja ( + 1) 2 2 + 2 ovat epäyhtälöitä. Epäyhtälössä
Epäyhtälö Kahden lausekkeen A ja B välisiä järjestysrelaatioita A < B, A B, A > B ja A B nimitetään epäyhtälöiksi. Esimerkiksi 2 < 6, 9 10, 5 > a + + 2 ja ( + 1) 2 2 + 2 ovat epäyhtälöitä. Epäyhtälössä
5.10. HIUKKANEN POTENTIAALIKUOPASSA
 5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
Kaasu Neste Kiinteä aine Plasma
 Olomuodot Kaasu: atomeilla/molekyyleillä suuri nopeus, vuorovaikuttavat vain törmätessään toisiinsa Neste: atomit/molekyylit/ionit liukuvat toistensa lomitse, mutta pysyvät yhtenä nestetilavuutena (molekyylien
Olomuodot Kaasu: atomeilla/molekyyleillä suuri nopeus, vuorovaikuttavat vain törmätessään toisiinsa Neste: atomit/molekyylit/ionit liukuvat toistensa lomitse, mutta pysyvät yhtenä nestetilavuutena (molekyylien
Esimerkki 8. Ratkaise lineaarinen yhtälöryhmä. 3x + 5y = 22 3x + 4y = 4 4x 8y = 32. 3 5 22 r 1 + r 3. 0 13 26 4 8 32 r 3 4r 1. LM1, Kesä 2014 47/68
 Esimerkki 8 Ratkaise lineaarinen yhtälöryhmä 3x + 5y = 22 3x + 4y = 4 4x 8y = 32. 3 5 22 r 1 + r 3 3 4 4 4 8 32 1 3 10 0 13 26 4 8 32 r 3 4r 1 1 3 10 3 4 4 r 2 3r 1 4 8 32 1 3 10 0 13 26 r 2 /13 0 4 8
Esimerkki 8 Ratkaise lineaarinen yhtälöryhmä 3x + 5y = 22 3x + 4y = 4 4x 8y = 32. 3 5 22 r 1 + r 3 3 4 4 4 8 32 1 3 10 0 13 26 4 8 32 r 3 4r 1 1 3 10 3 4 4 r 2 3r 1 4 8 32 1 3 10 0 13 26 r 2 /13 0 4 8
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 7 Harmonisen värähdysliikkeen energia Jousen potentiaalienergia on U k( x ) missä k on jousivakio ja Dx on poikkeama tasapainosta. Valitaan
Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 7 Harmonisen värähdysliikkeen energia Jousen potentiaalienergia on U k( x ) missä k on jousivakio ja Dx on poikkeama tasapainosta. Valitaan
Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014
 Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Kvanttimekaaninen atomimalli
 Kvanttimekaaninen atomimalli Kvanttimekaaninen atomimalli Rakenne: Pääkuori Alakuori Orbitaalit Elektronit sijaitsevat ydintä ympäröivässä energiapilvessä tietyillä energiatiloilla (pääkuoret). Elektronien
Kvanttimekaaninen atomimalli Kvanttimekaaninen atomimalli Rakenne: Pääkuori Alakuori Orbitaalit Elektronit sijaitsevat ydintä ympäröivässä energiapilvessä tietyillä energiatiloilla (pääkuoret). Elektronien
S Fysiikka III (Est), 2 VK Malliratkaisut (Arvosteluperusteita täydennetään vielä)
 S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
KEMA221 2009 KEMIALLINEN TASAPAINO ATKINS LUKU 7
 KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
monissa laskimissa luvun x käänteisluku saadaan näyttöön painamalla x - näppäintä.
 .. Käänteisunktio.. Käänteisunktio Mikäli unktio : A B on bijektio, niin joukkojen A ja B alkioiden välillä vallitsee kääntäen yksikäsitteinen vastaavuus eli A vastaa täsmälleen yksi y B, joten myös se
.. Käänteisunktio.. Käänteisunktio Mikäli unktio : A B on bijektio, niin joukkojen A ja B alkioiden välillä vallitsee kääntäen yksikäsitteinen vastaavuus eli A vastaa täsmälleen yksi y B, joten myös se
Kvantittuminen. E = hf f on säteilyn taajuus h on Planckin vakio h = 6, Js = 4, evs. Planckin kvanttihypoteesi
 Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Kiinteän aineen ominaisuuksia I. Kiteisen aineen perusominaisuuksia
 Kiinteän aineen ominaisuuksia I Kiteiden perustyypit Kiderakenteiden peruskäsitteitä Kiteisen aineen perusominaisuuksia Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan
Kiinteän aineen ominaisuuksia I Kiteiden perustyypit Kiderakenteiden peruskäsitteitä Kiteisen aineen perusominaisuuksia Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan
Diskreetit rakenteet
 Diskreetit rakenteet 811120P 5 op 7. Oulun yliopisto Tietojenkäsittelytieteiden laitos 2015 / 2016 Periodi 1 Mikä on verkko? verkko (eli graafi) koostuu solmuista ja väleistä, jotka yhdistävät solmuja
Diskreetit rakenteet 811120P 5 op 7. Oulun yliopisto Tietojenkäsittelytieteiden laitos 2015 / 2016 Periodi 1 Mikä on verkko? verkko (eli graafi) koostuu solmuista ja väleistä, jotka yhdistävät solmuja
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
23 VALON POLARISAATIO 23.1 Johdanto. 23.2 Valon polarisointi ja polarisaation havaitseminen
 3 VALON POLARISAATIO 3.1 Johdanto Mawellin htälöiden avulla voidaan johtaa aaltohtälö sähkömagneettisen säteiln etenemiselle väliaineessa. Mawellin htälöiden ratkaisusta seuraa aina, että valo on poikittaista
3 VALON POLARISAATIO 3.1 Johdanto Mawellin htälöiden avulla voidaan johtaa aaltohtälö sähkömagneettisen säteiln etenemiselle väliaineessa. Mawellin htälöiden ratkaisusta seuraa aina, että valo on poikittaista
2. Maitohapon CH3 CH(OH) COOH molekyylissä
 1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
14.1. Lämpötilan mittaaminen
 14 16. LÄMPÖOPPIA 14.1. Lämpötilan mittaaminen Neste lasi lämpömittari Nesteen lämpölaajeneminen Kaksoismetallilämpömittari Aineilla erilainen lämpölaajeneminen, jolloin lämpeneminen aiheuttaa taipumista
14 16. LÄMPÖOPPIA 14.1. Lämpötilan mittaaminen Neste lasi lämpömittari Nesteen lämpölaajeneminen Kaksoismetallilämpömittari Aineilla erilainen lämpölaajeneminen, jolloin lämpeneminen aiheuttaa taipumista
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
11. MOLEKYYLIT. Kvanttimekaniikka on käyttökelpoinen molekyyleille, jos se pystyy selittämään atomien välisten sidosten syntymisen.
 11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
S Fysiikka III (EST) Tentti ja välikoeuusinta
 S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
Luku 14: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Nyt n = 1. Tästä ratkaistaan kuopan leveys L ja saadaan sijoittamalla elektronin massa ja vakiot
 S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
SMG-4450 Aurinkosähkö
 SMG-4450 Aurinkosähkö Toisen luennon aihepiirit Lyhyt katsaus aurinkosähkön historiaan Valosähköinen ilmiö: Mistä tässä luonnonilmiössä on kyse? Piihin perustuvan puolijohdeaurinkokennon toimintaperiaate
SMG-4450 Aurinkosähkö Toisen luennon aihepiirit Lyhyt katsaus aurinkosähkön historiaan Valosähköinen ilmiö: Mistä tässä luonnonilmiössä on kyse? Piihin perustuvan puolijohdeaurinkokennon toimintaperiaate
Luku 9: Atomien rakenne ja spektrit. https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
 Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Liukeneminen 31.8.2016
 Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Luento 13: Periodinen liike. Johdanto Harmoninen värähtely Esimerkkejä F t F r
 Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä θ F t m g F r 1 / 27 Luennon sisältö Johdanto Harmoninen värähtely Esimerkkejä 2 / 27 Johdanto Tarkastellaan jaksollista liikettä (periodic
Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä θ F t m g F r 1 / 27 Luennon sisältö Johdanto Harmoninen värähtely Esimerkkejä 2 / 27 Johdanto Tarkastellaan jaksollista liikettä (periodic
Valtteri Lindholm (Helsingin Yliopisto) Horisonttiongelma 21.11.2013 1 / 9
 : Valtteri Lindholm (Helsingin Yliopisto) Horisonttiongelma 21.11.2013 1 / 9 Horisonttiongelma Valtteri Lindholm Helsingin Yliopisto Teoreettisen fysiikan syventävien opintojen seminaari Valtteri Lindholm
: Valtteri Lindholm (Helsingin Yliopisto) Horisonttiongelma 21.11.2013 1 / 9 Horisonttiongelma Valtteri Lindholm Helsingin Yliopisto Teoreettisen fysiikan syventävien opintojen seminaari Valtteri Lindholm
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 8 Vaimennettu värähtely Elävässä elämässä heilureiden ja muiden värähtelijöiden liike sammuu ennemmin tai myöhemmin. Vastusvoimien takia värähtelijän
Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 8 Vaimennettu värähtely Elävässä elämässä heilureiden ja muiden värähtelijöiden liike sammuu ennemmin tai myöhemmin. Vastusvoimien takia värähtelijän
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
LIITE 11A: VALOSÄHKÖINEN ILMIÖ
 LIITE 11A: VALOSÄHKÖINEN ILMIÖ Valosähköisellä ilmiöllä ymmärretään tässä oppikirjamaisesti sitä, että kun virtapiirissä ja tyhjiölampussa olevan anodi-katodi yhdistelmän katodia säteilytetään fotoneilla,
LIITE 11A: VALOSÄHKÖINEN ILMIÖ Valosähköisellä ilmiöllä ymmärretään tässä oppikirjamaisesti sitä, että kun virtapiirissä ja tyhjiölampussa olevan anodi-katodi yhdistelmän katodia säteilytetään fotoneilla,
Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen)
 Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen Vapaaseen hiukkaseen ei vaikuta voimia, joten U(x = 0. Vapaan hiukkasen energia on sen liike-energia eli E=p /m. Koska hiukkasella on määrätty energia,
Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen Vapaaseen hiukkaseen ei vaikuta voimia, joten U(x = 0. Vapaan hiukkasen energia on sen liike-energia eli E=p /m. Koska hiukkasella on määrätty energia,
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
c) Määritä paraabelin yhtälö, kun tiedetään, että sen huippu on y-akselilla korkeudella 6 ja sen nollakohdat ovat x-akselin kohdissa x=-2 ja x=2.
 MAA4. Koe 8.5.0 Jussi Tyni Kaikkiin tehtäviin ratkaisujen välivaiheet näkyviin! Ota kokeesta poistuessasi tämä paperi mukaasi! Tee konseptiin pisteytysruudukko! Muista kirjata nimesi ja ryhmäsi. Valitse
MAA4. Koe 8.5.0 Jussi Tyni Kaikkiin tehtäviin ratkaisujen välivaiheet näkyviin! Ota kokeesta poistuessasi tämä paperi mukaasi! Tee konseptiin pisteytysruudukko! Muista kirjata nimesi ja ryhmäsi. Valitse
Fysiikan perusteet. Työ, energia ja energian säilyminen. Antti Haarto 20.09.2011. www.turkuamk.fi
 Fysiikan perusteet Työ, energia ja energian säilyminen Antti Haarto 0.09.0 Voiman tekemä työ Voiman F tekemä työ W määritellään kuljetun matkan s ja matkan suuntaisen voiman komponentin tulona. Yksikkö:
Fysiikan perusteet Työ, energia ja energian säilyminen Antti Haarto 0.09.0 Voiman tekemä työ Voiman F tekemä työ W määritellään kuljetun matkan s ja matkan suuntaisen voiman komponentin tulona. Yksikkö:
3 Ääni ja kuulo. Ihmiskorva aistii paineen vaihteluita, joten yleensä äänestä puhuttaessa määritellään ääniaalto paineen vaihteluiden kautta.
 3 Ääni ja kuulo 1 Mekaanisista aalloista ääni on ihmisen kannalta tärkein. Ääni on pitkittäistä aaltoliikettä, eli ilman (tai muun väliaineen) hiukkaset värähtelevät suuntaan joka on sama kuin aallon etenemissuunta.
3 Ääni ja kuulo 1 Mekaanisista aalloista ääni on ihmisen kannalta tärkein. Ääni on pitkittäistä aaltoliikettä, eli ilman (tai muun väliaineen) hiukkaset värähtelevät suuntaan joka on sama kuin aallon etenemissuunta.
2.2 Täydellinen yhtälö. Ratkaisukaava
 . Täydellinen yhtälö. Ratkaisukaava Tulon nollasäännöstä näkee silloin tällöin omituisia sovellutuksia. Jotkut näet ajattelevat, että on olemassa myöskin tulon -sääntö tai tulon "mikä-tahansa"- sääntö.
. Täydellinen yhtälö. Ratkaisukaava Tulon nollasäännöstä näkee silloin tällöin omituisia sovellutuksia. Jotkut näet ajattelevat, että on olemassa myöskin tulon -sääntö tai tulon "mikä-tahansa"- sääntö.
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
4A 4h. KIMMOKERROIN E
 TURUN AMMATTIKORKEAKOULU TYÖOHJE 1/5 A h. KIMMOKERROIN E 1. TYÖN TAVOITE 2. TEORIAA Tässä työssä muista töistä poiketen tärkein tavoite on ymmärtää fysikaalisten suureiden keskinäistä riippuvuutta toisistaan
TURUN AMMATTIKORKEAKOULU TYÖOHJE 1/5 A h. KIMMOKERROIN E 1. TYÖN TAVOITE 2. TEORIAA Tässä työssä muista töistä poiketen tärkein tavoite on ymmärtää fysikaalisten suureiden keskinäistä riippuvuutta toisistaan
1.7 Gradientti ja suunnatut derivaatat
 1.7 Gradientti ja suunnatut derivaatat Funktion ensimmäiset osittaisderivaatat voidaan yhdistää yhdeksi vektorifunktioksi seuraavasti: Missä tahansa pisteessä (x, y), jossa funktiolla f(x, y) on ensimmäiset
1.7 Gradientti ja suunnatut derivaatat Funktion ensimmäiset osittaisderivaatat voidaan yhdistää yhdeksi vektorifunktioksi seuraavasti: Missä tahansa pisteessä (x, y), jossa funktiolla f(x, y) on ensimmäiset
Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori!
 6.1 Työ Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori! Siirtymä s = r 2 r 1 Kun voiman kohteena olevaa kappaletta voidaan kuvata
6.1 Työ Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori! Siirtymä s = r 2 r 1 Kun voiman kohteena olevaa kappaletta voidaan kuvata
Infrapunaspektroskopia
 ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
1 WKB-approksimaatio. Yleisiä ohjeita. S Harjoitus
 S-114.1427 Harjoitus 3 29 Yleisiä ohjeita Ratkaise tehtävät MATLABia käyttäen. Kirjoita ratkaisut.m-tiedostoihin. Tee tuloksistasi lyhyt seloste, jossa esität laskemasi arvot sekä piirtämäsi kuvat (sekä
S-114.1427 Harjoitus 3 29 Yleisiä ohjeita Ratkaise tehtävät MATLABia käyttäen. Kirjoita ratkaisut.m-tiedostoihin. Tee tuloksistasi lyhyt seloste, jossa esität laskemasi arvot sekä piirtämäsi kuvat (sekä
S Fysiikka III (EST) (6 op) 1. välikoe
 S-114.1327 Fysiikka III (EST) (6 op) 1. välikoe 1.3.21 Ilkka Tittonen 1. Vastaa seuraaviin kysymyksiin perustellusti, mutta ytimekkäästi (esim. 5-1 lausetta) (2p per kohta). a) Mikä on sidottu tila? Anna
S-114.1327 Fysiikka III (EST) (6 op) 1. välikoe 1.3.21 Ilkka Tittonen 1. Vastaa seuraaviin kysymyksiin perustellusti, mutta ytimekkäästi (esim. 5-1 lausetta) (2p per kohta). a) Mikä on sidottu tila? Anna
Huomaa, että 0 kitkakerroin 1. Aika harvoin kitka on tasan 0. Koska kitkakerroin 1, niin
 Kun alat vetää jotain esinettä pitkin alustaa, huomaat, että tarvitaan tietty nollaa suurempi voima ennen kuin mainittu esine lähtee edes liikkeelle. Yleensä on vielä niin, että liikkeelle lähteminen vaatii
Kun alat vetää jotain esinettä pitkin alustaa, huomaat, että tarvitaan tietty nollaa suurempi voima ennen kuin mainittu esine lähtee edes liikkeelle. Yleensä on vielä niin, että liikkeelle lähteminen vaatii
TASASUUNTAUS JA PUOLIJOHTEET
 TASASUUNTAUS JA PUOLIJOHTEET (YO-K06+13, YO-K09+13, YO-K05-11,..) Tasasuuntaus Vaihtovirran suunta muuttuu jaksollisesti. Tasasuuntaus muuttaa sähkövirran kulkemaan yhteen suuntaan. Tasasuuntaus toteutetaan
TASASUUNTAUS JA PUOLIJOHTEET (YO-K06+13, YO-K09+13, YO-K05-11,..) Tasasuuntaus Vaihtovirran suunta muuttuu jaksollisesti. Tasasuuntaus muuttaa sähkövirran kulkemaan yhteen suuntaan. Tasasuuntaus toteutetaan
Materiaalifysiikan perusteet P Ratkaisut 1, Kevät 2017
 Materiaalifysiikan perusteet 51104P Ratkaisut 1, Kevät 017 1. Kiderakenteen alkeiskopin hahmottamiseksi pyritään löytämään kuvitteellisesta rakenteesta sen pienin toistuva yksikkö (=kanta). Kunkin toistuvan
Materiaalifysiikan perusteet 51104P Ratkaisut 1, Kevät 017 1. Kiderakenteen alkeiskopin hahmottamiseksi pyritään löytämään kuvitteellisesta rakenteesta sen pienin toistuva yksikkö (=kanta). Kunkin toistuvan
Chem-C2400 Luento 2: Kiderakenteet Ville Jokinen
 Chem-C2400 Luento 2: Kiderakenteet 11.1.2019 Ville Jokinen Oppimistavoitteet Metalli-, ioni- ja kovalenttinen sidos ja niiden rooli metallien ja keraamien kiderakenteissa. Metallien ja keraamien kiderakenteen
Chem-C2400 Luento 2: Kiderakenteet 11.1.2019 Ville Jokinen Oppimistavoitteet Metalli-, ioni- ja kovalenttinen sidos ja niiden rooli metallien ja keraamien kiderakenteissa. Metallien ja keraamien kiderakenteen
Atomien rakenteesta. Tapio Hansson
 Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
H7 Malliratkaisut - Tehtävä 1
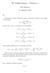 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
Vaihdetaan ryhmässä (1) summausindeksiksi K, jolloin saadaan (E E 0 k K 1
 Heikot periodiset potentiaalit Useiden metallien (alkuaineryhmissä I, II, III ja IV) johde-elektronit liikkuvat heikossa kiteen ionien muodostamassa potentiaalissa, sillä näillä metalleilla on s- tai p-elektroni
Heikot periodiset potentiaalit Useiden metallien (alkuaineryhmissä I, II, III ja IV) johde-elektronit liikkuvat heikossa kiteen ionien muodostamassa potentiaalissa, sillä näillä metalleilla on s- tai p-elektroni
MS-A0004 - Matriisilaskenta Laskuharjoitus 3
 MS-A0004 - Matriisilaskenta Laskuharjoitus 3 atkaisut Tehtävä Merkitään matriisin rivejä, 2 ja 3. Gaussin eliminoinnilla saadaan 3 5 4 7 3 5 4 7 3 2 4 2+ 0 3 0 6 6 8 4 3+2 2 0 3 0 6 3 5 4 7 0 3 0 6 3+
MS-A0004 - Matriisilaskenta Laskuharjoitus 3 atkaisut Tehtävä Merkitään matriisin rivejä, 2 ja 3. Gaussin eliminoinnilla saadaan 3 5 4 7 3 5 4 7 3 2 4 2+ 0 3 0 6 6 8 4 3+2 2 0 3 0 6 3 5 4 7 0 3 0 6 3+
Matematiikan tukikurssi 3.4.
 Matematiikan tukikurssi 3.4. Neliömuodot, Hessen matriisi, deiniittisyys, konveksisuus siinä tämän dokumentin aiheet. Neliömuodot ovat unktioita, jotka ovat muotoa T ( x) = x Ax, missä x = (x 1,, x n )
Matematiikan tukikurssi 3.4. Neliömuodot, Hessen matriisi, deiniittisyys, konveksisuus siinä tämän dokumentin aiheet. Neliömuodot ovat unktioita, jotka ovat muotoa T ( x) = x Ax, missä x = (x 1,, x n )
Oletetaan, että funktio f on määritelty jollakin välillä ]x 0 δ, x 0 + δ[. Sen derivaatta pisteessä x 0 on
![Oletetaan, että funktio f on määritelty jollakin välillä ]x 0 δ, x 0 + δ[. Sen derivaatta pisteessä x 0 on Oletetaan, että funktio f on määritelty jollakin välillä ]x 0 δ, x 0 + δ[. Sen derivaatta pisteessä x 0 on](/thumbs/39/20459750.jpg) Derivaatta Erilaisia lähestymistapoja: geometrinen (käyrän tangentti sekanttien raja-asentona) fysikaalinen (ajasta riippuvan funktion hetkellinen muutosnopeus) 1 / 13 Derivaatan määritelmä Määritelmä
Derivaatta Erilaisia lähestymistapoja: geometrinen (käyrän tangentti sekanttien raja-asentona) fysikaalinen (ajasta riippuvan funktion hetkellinen muutosnopeus) 1 / 13 Derivaatan määritelmä Määritelmä
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Faradayn laki ja sähkömagneettinen induktio
 Faradayn laki ja sähkömagneettinen induktio Haarto & Karhunen Magneettivuo Magneettivuo Φ määritellään magneettivuon tiheyden B ja sen läpäisemän pinta-alavektorin A pistetuloksi Φ B A BAcos Acosθ θ θ
Faradayn laki ja sähkömagneettinen induktio Haarto & Karhunen Magneettivuo Magneettivuo Φ määritellään magneettivuon tiheyden B ja sen läpäisemän pinta-alavektorin A pistetuloksi Φ B A BAcos Acosθ θ θ
2.2 Ääni aaltoliikkeenä
 2.1 Äänen synty Siirrymme tarkastelemaan akustiikkaa eli äänioppia. Ääni on ilman tai nesteen paineen vaihteluita (pitkittäistä aaltoliikettä). Kiinteissä materiaaleissa ääni voi edetä poikittaisena aaltoliikkeenä.
2.1 Äänen synty Siirrymme tarkastelemaan akustiikkaa eli äänioppia. Ääni on ilman tai nesteen paineen vaihteluita (pitkittäistä aaltoliikettä). Kiinteissä materiaaleissa ääni voi edetä poikittaisena aaltoliikkeenä.
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 206 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 2: BE- ja FD-jakaumat, kvanttikaasut Pe 5.4.206 AIHEET. Kvanttimekaanisesta vaihtosymmetriasta
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 206 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 2: BE- ja FD-jakaumat, kvanttikaasut Pe 5.4.206 AIHEET. Kvanttimekaanisesta vaihtosymmetriasta
Kvanttimekaaninen atomimalli. "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman
 Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kidehilan perusominaisuudet
 Kidehilan perusominaisuudet Kiteen muodostaa hila (usein kutsutaan Bravaisin hilaksi) ja yhdestä tai useammasta atomista muodostuva kanta(klusteri). Kantaklusteri toistuu kiteessä hilan määräämällä tavalla
Kidehilan perusominaisuudet Kiteen muodostaa hila (usein kutsutaan Bravaisin hilaksi) ja yhdestä tai useammasta atomista muodostuva kanta(klusteri). Kantaklusteri toistuu kiteessä hilan määräämällä tavalla
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2012 Insinöörivalinnan fysiikan koe 30.5.2012, malliratkaisut
 A1 Kappale, jonka massa m = 2,1 kg, lähtee liikkeelle levosta paikasta x = 0,0 m pitkin vaakasuoraa alustaa. Kappaleeseen vaikuttaa vaakasuora vetävä voima F, jonka suuruus riippuu paikasta oheisen kuvan
A1 Kappale, jonka massa m = 2,1 kg, lähtee liikkeelle levosta paikasta x = 0,0 m pitkin vaakasuoraa alustaa. Kappaleeseen vaikuttaa vaakasuora vetävä voima F, jonka suuruus riippuu paikasta oheisen kuvan
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Nyt. = R e ik R ψ n (r + R R ) = e ik R [ = e ik R b n ψ n (r R),
 Tiukan sidoksen malli Tarkastellaan sellaisia kiderakenteita, joissa atomien elektronien aaltofunktiot ovat lokalisoituneet isäntäionien läheisyyteen. Jos unohdetaan periodisuuden vaikutukset, elektronien
Tiukan sidoksen malli Tarkastellaan sellaisia kiderakenteita, joissa atomien elektronien aaltofunktiot ovat lokalisoituneet isäntäionien läheisyyteen. Jos unohdetaan periodisuuden vaikutukset, elektronien
