Luku 14: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
|
|
|
- Esa-Pekka Majanlahti
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1
2 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien pyörimismäärän komponentti molekyylin sidosakselilla "h " = 0,1,2,... ",#,$,... tilat (vrt. S, P, D,...) "h koostuu yksittäisten elektronien pyörimismäärän komponenteista "h (vrt l ja L elektroneille atomeissa) Esim. σ orbitaalilla olevilla elektroneilla ei ole pyörimismäärää sidosaksellilla (λ=0) (vrt s-elektroni) Σ tila 2
3 π elektroneille λ = +1 tai -1 1 Pariton π elektroni Π-tila 2 Paritonta π elektronia eri π orbitaalilla (joko saman- tai vastakkaissuuntaisin spinnein) Σ tilat 2 paritonta π elektronia samalla π orbitaalille Δ tila 1 " tai 1 " 3 " 3
4 Kokonaispariteetti sadaan säännöistä: (suljettu kuori) g x g = g u x u = g u x g = u g ja u käyttäytyvät kuten luvut 1 ja -1 kertolaskussa 3 " g # (suljettu kuori) x (+) x (-) = (-) + tai - kertoo elektronikonfiguraation symmetriasta (symmetrinen + antisymmetrinen -) heijastuksessa tasosta, joka sisältää ytimet (yz-taso) 4
5 3 " u + tai 3 " u # 5
6 Valintasääntöjen pohjana on pyörimismäärien molekyylin akselin suuntaisten komponenttien säilyminen absorptio- ja emissioprosesseissa Kyseessä on elektronien liikkeeseen liittyvät pyörimismäärät valintasäännöt: "# = 0,±1 "S = 0 "$ = 0 "% = 0,±1 L = ratapyörimiseen liittyvä pyörimismäärä Λ= sen komponentti akselilla S = spinneistä aiheutuva pyörimismäärä Σ= sen komponentti akselilla Ω = Λ+Σ = kokonaispyörimismäärä akselilla Lisäksi symmetriaan liittyvät valintasäännöt: Σ -termeille sallittuja " + # " + ja " $ # " $ sentrosymmetrisille molekyyleille: u " g 6
7 Elektronispektroskopiassa absorption seurauksena elektroni siirtyy ylemmälle molekyyliorbitaalille. ydinten kokema elektronien muodostama potentiaali muuttuu voidaan kuvitella, että molekyyli siirtyy potentiaalipinnalta toiselle tässä esimerkissä viritystilaisen molekyylin tasapainosidospituus on pidempi kuin perustilassa Elektronin siirtyminen orbitaalilta toiselle fotonin absorption ansiosta on hyvin nopea prosessi Molekyyli mukautuu myöhemmin elektronisen viritystilan potentiaaliin ytimet eivät ennätä liikkua elektronin siirtymisen aikana Molekyyli hyppää vertikaalisesti perustilan potentiaalipinnalta viritystilan potentiaalipinnalle Franck-Condon periaate 7
8 Elektronisiin transitioihin liittyy muutoksia myös värähdytiloissa Tästä johtuu nimitys vibroninen transitio. Spektriä kutsutaan vibroniseksi tai elektroni-vibraatio spektriksi. Spektrin rakennetta kutsutaan vibroniseksi rakenteeksi v f tässä kuvassa on havainnollistettu yhtä siirtymää v i ja v f tilojen välillä v i Kutakin piikkiä vastaa siirtymä (kuten toisessa kuvassa). Alatiloja (v i ) on tyypillisesti vain yksi, ylätiloja (v f ) voi olla useita Yksittäisten transitioiden intensiteetit riippuvat perustilan ja viritystilan aaltofunktioiden keskenäisen peittointegraalin neliöstä S(v f,v i ) 2 tätä kutsutaan siirtymän Franck-Condon tekijäksi 8
9 Siirtymien suhteelliset F-C tekijät riippuvat siitä miten elektronisen perustilan ja viritystilan potentiaalit ovat sijoittuneet toisiinsa nähden 9
10 Moniatomisilla molekyyleillä elektroninen viritys lokalisoituu tiettyihin atomiryhmiin, joita kutsutaan kromoforeiksi (chromophore) Spektreissä on tyypillisesti leveitä absorptiovöitä, värillisissä yhdisteissä on absorptioita näkyvän valon aallonpituuksilla 10
11 Siirtymämetallikomplekseilla on voimakkaita absorptioita Ligandien (ligandikenttä) vaikutuksesta d-orbitaalien ympäristö ei ole isotrooppinen d-d siirtymä d-orbitaalien degeneraatio purkautuu ja niistä muodostuu kaksi energiatasoa 11
12 Metallikomplekseilla on myös voimakkaita metallin ja ligandin välisiä elektronisiirtymiä: LMCT = ligand to metal charge transfer transition MLCT = metal to ligand charge transfer transition "* # " MLCT LMCT 12
13 "* # " siirtymässä kaksoissidoksen elektroni siirtyy antibonding orbitaalille - - "*# n + + Karbonyyliryhmän (C=O) sitomaton elektroni siirtyy antibonding orbitaalille 13
14 Elektronisella viritystilalla on äärellinen elinikä ja viritys purkautuu fotonin emission kautta (säteilevä siirtymä) tai säteilyksettömästi siten, että elektroninen energia muuttuu värähtelyenergiaksi (lämmöksi) Säteilevät siirtymät: fluoresenssi ja fosforesenssi = hidas prosessi (kielletty siirtymä) = yleensä hyvin nopea prosessi (sallittu siirtymä) elektroninen viritystila S 1 vibraatiorelaksaatio sallittu S 1 " S 0 absorptio sallittu S 1 " S 0 emissio elektroninen perustila S 0 14
15 Fosforesenssissa viritys on kuten edellä, eli sallittu S 1 S 0 Virittyneen singletin S 1 ja alimman triplettitilan T 1 potentiaalipinnat risteävät vibraatiorelaksaation aikana molekyyli voi hypätä triplettitilalle. Tätä kutsutaan systeemien väliseksi siirtymäksi (intersystem crossing) Molekyyli siirtyy tripletitilan alimmalta värähtelytilalta säteilemällä elektroniseen perustilaan S 0. Tämä siirtymä on spinkielletty T 1 S 0 ja tästä johtuen hidas 15
Luku 13: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Nyt n = 1. Tästä ratkaistaan kuopan leveys L ja saadaan sijoittamalla elektronin massa ja vakiot
 S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
Kvantittuminen. E = hf f on säteilyn taajuus h on Planckin vakio h = 6, Js = 4, evs. Planckin kvanttihypoteesi
 Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Luku 9: Atomien rakenne ja spektrit. https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
 Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Kemian syventävät kurssit
 Kemian syventävät kurssit KE2 Kemian mikromaailma aineen rakenteen ja ominaisuuksien selittäminen KE3 Reaktiot ja energia laskuja ja reaktiotyyppejä KE4 Metallit ja materiaalit sähkökemiaa: esimerkiksi
Kemian syventävät kurssit KE2 Kemian mikromaailma aineen rakenteen ja ominaisuuksien selittäminen KE3 Reaktiot ja energia laskuja ja reaktiotyyppejä KE4 Metallit ja materiaalit sähkökemiaa: esimerkiksi
766334A Ydin- ja hiukkasfysiikka
 1 766334A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 4 Juhani Lounila Oulun yliopisto, Fysiikan laitos, 01 6 Radioaktiivisuus Kuva 1 esittää radioaktiivisen aineen ydinten lukumäärää
1 766334A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 4 Juhani Lounila Oulun yliopisto, Fysiikan laitos, 01 6 Radioaktiivisuus Kuva 1 esittää radioaktiivisen aineen ydinten lukumäärää
3.1 Varhaiset atomimallit (1/3)
 + 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
+ 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
Luku 10: Atomien rakenne ja spektrit. Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit
 Luku 10: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit 1 n 1 = 3 n 1 = 4 n 1 = 2 n 1 =1 Vetyatomin spektri koostuu viivoista Viivojen sijainti
Luku 10: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit 1 n 1 = 3 n 1 = 4 n 1 = 2 n 1 =1 Vetyatomin spektri koostuu viivoista Viivojen sijainti
11. MOLEKYYLIT. Kvanttimekaniikka on käyttökelpoinen molekyyleille, jos se pystyy selittämään atomien välisten sidosten syntymisen.
 11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
8. MONIELEKTRONISET ATOMIT
 8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
Demo: Kahden elektronin spintilojen muodostaminen
 Demo: Kahden elektronin spintilojen muodostaminen Tämän demonstraation tarkoituksena on havainnollistaa kvanttimekaniikan operaattoriformalismin soveltamista kahden elektronin systeemin spintilojen muodostamiseen.
Demo: Kahden elektronin spintilojen muodostaminen Tämän demonstraation tarkoituksena on havainnollistaa kvanttimekaniikan operaattoriformalismin soveltamista kahden elektronin systeemin spintilojen muodostamiseen.
Molekyylit. Atomien välisten sidosten muodostuminen
 Molekyylit. Johdanto. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit 6. Orgaaniset
Molekyylit. Johdanto. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit 6. Orgaaniset
Fysikaalinen kemia II
 Fysikaalinen kemia II Perttu Lantto Luentokalvot perustuvat kirjaan: Atkins Physical Chemistry, 10 th Edition P. Atkins & J. de Paula (Oxford University Press, 2014) 23. marraskuuta 2015 Osa VI Elektroniset
Fysikaalinen kemia II Perttu Lantto Luentokalvot perustuvat kirjaan: Atkins Physical Chemistry, 10 th Edition P. Atkins & J. de Paula (Oxford University Press, 2014) 23. marraskuuta 2015 Osa VI Elektroniset
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering, Micro- and Nanosciences Laboratory. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
766326A Atomifysiikka 1 - Syksy 2013
 766326A Atomifysiikka 1 - Syksy 2013 Luennot n. 46 tuntia Torstaisin 8-10 sali IT116 Perjantaisin 8-10 sali L6 Poikkeuksia: to 19.9. luento vain 8-9 to 17.10. luento vain 8-9 to 14.11. luento vain 8-9
766326A Atomifysiikka 1 - Syksy 2013 Luennot n. 46 tuntia Torstaisin 8-10 sali IT116 Perjantaisin 8-10 sali L6 Poikkeuksia: to 19.9. luento vain 8-9 to 17.10. luento vain 8-9 to 14.11. luento vain 8-9
Luento 1: Sisältö. Vyörakenteen muodostuminen Molekyyliorbitaalien muodostuminen Atomiketju Energia-aukko
 Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Hiilen ja vedyn reaktioita (1)
 Hiilen ja vedyn reaktioita (1) Hiilivetyjen tuotanto alkaa joko säteilevällä yhdistymisellä tai protoninvaihtoreaktiolla C + + H 2 CH + 2 + hν C + H + 3 CH+ + H 2 Huom. Reaktio C + + H 2 CH + + H on endoterminen,
Hiilen ja vedyn reaktioita (1) Hiilivetyjen tuotanto alkaa joko säteilevällä yhdistymisellä tai protoninvaihtoreaktiolla C + + H 2 CH + 2 + hν C + H + 3 CH+ + H 2 Huom. Reaktio C + + H 2 CH + + H on endoterminen,
pääkiertoakseli #$%%ä 2C 2 C 2!"
 Tehtävä 1 Määritä seuraavien molekyylien pisteryhmät: (a) H 3 N H 3 N l o l NH 3 + NH 3 urataan lohkokaaviota: lineaari!"!" suuri symmetria 2s v #$%%ä 2v!" pääkiertoakseli #$%%ä 2 2 2!" s h Vastaavasti:
Tehtävä 1 Määritä seuraavien molekyylien pisteryhmät: (a) H 3 N H 3 N l o l NH 3 + NH 3 urataan lohkokaaviota: lineaari!"!" suuri symmetria 2s v #$%%ä 2v!" pääkiertoakseli #$%%ä 2 2 2!" s h Vastaavasti:
Fysiikka 8. Aine ja säteily
 Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Voima ja potentiaalienergia II Energian kvantittuminen
 Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
Aikaerotteinen spektroskopia valokemian tutkimuksessa
 Aikaerotteinen spektroskopia valokemian tutkimuksessa TkT Marja Niemi Tampereen teknillinen yliopisto Kemian ja biotekniikan laitos 23.4.2012 Suomalainen Tiedeakatemia, Nuorten klubi DI 2002, TTKK Materiaalitekniikan
Aikaerotteinen spektroskopia valokemian tutkimuksessa TkT Marja Niemi Tampereen teknillinen yliopisto Kemian ja biotekniikan laitos 23.4.2012 Suomalainen Tiedeakatemia, Nuorten klubi DI 2002, TTKK Materiaalitekniikan
5.1 Johdanto 185. 5.2 Helium-atomi 186. 5.3 Keskeiskenttämalli 201. 5.4 Paulin kieltosääntö 206. 5.5 Atomien elektronirakenne 208
 MONIELEKTRONIATOMIT 5. Johdanto 85 5. Helium-atomi 86 5.3 Keskeiskenttämalli 0 5.4 Paulin kieltosääntö 06 5.5 Atomien elektronirakenne 08 5.6 L--kytkentä monen elektronin atomeissa 3 5.7 Röntgenspektrien
MONIELEKTRONIATOMIT 5. Johdanto 85 5. Helium-atomi 86 5.3 Keskeiskenttämalli 0 5.4 Paulin kieltosääntö 06 5.5 Atomien elektronirakenne 08 5.6 L--kytkentä monen elektronin atomeissa 3 5.7 Röntgenspektrien
TURUN AMMATTIKORKEAKOULU TYÖOHJE 1 TEKNIIKKA FYSIIKAN LABORATORIO V
 TURUN AMMATTIKORKAKOUU TYÖOHJ 1 3A. asertyö 1. Työn tarkoitus Työssä perehdytään interferenssi-ilmiöön tutkimalla sitä erilaisissa tilanteissa laservalon avulla. 2. Teoriaa aser on lyhennys sanoista ight
TURUN AMMATTIKORKAKOUU TYÖOHJ 1 3A. asertyö 1. Työn tarkoitus Työssä perehdytään interferenssi-ilmiöön tutkimalla sitä erilaisissa tilanteissa laservalon avulla. 2. Teoriaa aser on lyhennys sanoista ight
MOLEKYYLIFYSIIKAN OPETUKSESTA SEKÄ KEMIALLISEN SIDOKSEN VAIKUTUKSESTA MOLEKYYLIEN AUGER-ELEKTRONISPEKTREIHIN
 MOLEKYYLIFYSIIKAN OPETUKSESTA SEKÄ KEMIALLISEN SIDOKSEN VAIKUTUKSESTA MOLEKYYLIEN AUGER-ELEKTRONISPEKTREIHIN PRO GRADU -TUTKIELMA SAKARI MIKKONEN OULUN YLIOPISTO FYSIKAALISTEN TIETEIDEN LAITOS 2005 Sisällysluettelo
MOLEKYYLIFYSIIKAN OPETUKSESTA SEKÄ KEMIALLISEN SIDOKSEN VAIKUTUKSESTA MOLEKYYLIEN AUGER-ELEKTRONISPEKTREIHIN PRO GRADU -TUTKIELMA SAKARI MIKKONEN OULUN YLIOPISTO FYSIKAALISTEN TIETEIDEN LAITOS 2005 Sisällysluettelo
S-108.189 Mittaustekniikan erikoistyö. Fluoresoivat materiaalit ja fluoresenssimittaussovellukset
 S-108.189 Mittaustekniikan erikoistyö Fluoresoivat materiaalit ja fluoresenssimittaussovellukset Kotamäki Ilkka Laurila Marko Ohjaaja: Holopainen Silja Tiistai, 19. huhtikuuta 2005 Sisällysluettelo Sisällysluettelo...2
S-108.189 Mittaustekniikan erikoistyö Fluoresoivat materiaalit ja fluoresenssimittaussovellukset Kotamäki Ilkka Laurila Marko Ohjaaja: Holopainen Silja Tiistai, 19. huhtikuuta 2005 Sisällysluettelo Sisällysluettelo...2
Atomin ydin. Z = varausluku (järjestysluku) = protonien määrä N = neutroniluku A = massaluku (nukleoniluku) A = Z + N
 Atomin ydin ytimen rakenneosia, protoneja (p + ) ja neutroneja (n) kutsutaan nukleoneiksi Z = varausluku (järjestysluku) = protonien määrä N = neutroniluku A = massaluku (nukleoniluku) A = Z + N saman
Atomin ydin ytimen rakenneosia, protoneja (p + ) ja neutroneja (n) kutsutaan nukleoneiksi Z = varausluku (järjestysluku) = protonien määrä N = neutroniluku A = massaluku (nukleoniluku) A = Z + N saman
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
FRANCKIN JA HERTZIN KOE
 FYSP106/2 Franckin ja Hertzin koe 1 FYSP106/2 FRANCKIN JA HERTZIN KOE Työssä mitataan elohopea-atomin erään viritystilan energia käyttäen samantyyppistä koejärjestelyä, jolla Franck ja Hertz vuonna 1914
FYSP106/2 Franckin ja Hertzin koe 1 FYSP106/2 FRANCKIN JA HERTZIN KOE Työssä mitataan elohopea-atomin erään viritystilan energia käyttäen samantyyppistä koejärjestelyä, jolla Franck ja Hertz vuonna 1914
LIISA-ionilähteen vetyplasman VUV-spektrin ja H -ionisuihkun intensiteetin korrelaatio
 LIISA-ionilähteen vetyplasman VUV-spektrin ja H -ionisuihkun intensiteetin korrelaatio Pro gradu -tutkielma, 21.12.2016 Tekijä: Sakari Lätti Ohjaaja: Olli Tarvainen 2 3 Tiivistelmä Lätti, Sakari Tapio
LIISA-ionilähteen vetyplasman VUV-spektrin ja H -ionisuihkun intensiteetin korrelaatio Pro gradu -tutkielma, 21.12.2016 Tekijä: Sakari Lätti Ohjaaja: Olli Tarvainen 2 3 Tiivistelmä Lätti, Sakari Tapio
PHYS-C0240 Materiaalifysiikka kevät 2017
 PHYS-C0240 Materiaalifysiikka kevät 2017 Prof. Martti Puska Emppu Salonen Ville Vierimaa Janika Tang Luennot 9 ja 10: Sironta kiteistä torstait 13.4. ja 20.4.2017 Aiheet Braggin sirontaehto Lauen sirontaehto
PHYS-C0240 Materiaalifysiikka kevät 2017 Prof. Martti Puska Emppu Salonen Ville Vierimaa Janika Tang Luennot 9 ja 10: Sironta kiteistä torstait 13.4. ja 20.4.2017 Aiheet Braggin sirontaehto Lauen sirontaehto
Luku 15: Magneettinen resonanssi
 Luku 15: Magneettinen resonanssi Ytimen ja elektronin vuorovaikutus ulkoisen magneettikentän kanssa: magneettinen momentti ja energiatilat Ydinmagneettinen resonanssi, NMR (nuclear magnetic resonance)
Luku 15: Magneettinen resonanssi Ytimen ja elektronin vuorovaikutus ulkoisen magneettikentän kanssa: magneettinen momentti ja energiatilat Ydinmagneettinen resonanssi, NMR (nuclear magnetic resonance)
766334A Ydin- ja hiukkasfysiikka
 1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
S Fysiikka III (EST) Tentti ja välikoeuusinta
 S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
Säteily ja suojautuminen Joel Nikkola
 Säteily ja suojautuminen 28.10.2016 Joel Nikkola Kotitehtävät Keskustele parin kanssa aurinkokunnan mittakaavasta. Jos maa olisi kolikon kokoinen, minkä kokoinen olisi aurinko? Jos kolikko olisi luokassa
Säteily ja suojautuminen 28.10.2016 Joel Nikkola Kotitehtävät Keskustele parin kanssa aurinkokunnan mittakaavasta. Jos maa olisi kolikon kokoinen, minkä kokoinen olisi aurinko? Jos kolikko olisi luokassa
Infrapunaspektroskopia
 ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
Linssin kuvausyhtälö (ns. ohuen linssin approksimaatio):
 Fysiikan laboratorio Työohje 1 / 5 Optiikan perusteet 1. Työn tavoite Työssä tutkitaan valon kulkua linssisysteemeissä ja perehdytään interferenssi-ilmiöön. Tavoitteena on saada perustietämys optiikasta
Fysiikan laboratorio Työohje 1 / 5 Optiikan perusteet 1. Työn tavoite Työssä tutkitaan valon kulkua linssisysteemeissä ja perehdytään interferenssi-ilmiöön. Tavoitteena on saada perustietämys optiikasta
Atomien rakenteesta. Tapio Hansson
 Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Cis trans isomeria. Pohdintaa: Kummalla 1,2 dikloorieteenin isomeerillä on korkeampi kiehumispiste? kp = 60,2 o C. kp = 48,5 o C
 Cis trans isomeria Pohdintaa: Kummalla 1,2 dikloorieteenin isomeerillä on korkeampi kiehumispiste? kp = 48,5 o C kp = 60,2 o C 1 Cis trans isomeriaa voi ilmetä kahdessa erilaisessa tilanteessa: Tapaus
Cis trans isomeria Pohdintaa: Kummalla 1,2 dikloorieteenin isomeerillä on korkeampi kiehumispiste? kp = 48,5 o C kp = 60,2 o C 1 Cis trans isomeriaa voi ilmetä kahdessa erilaisessa tilanteessa: Tapaus
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
2. Fotonit, elektronit ja atomit
 Luento 4 2. Fotonit, elektronit ja atomit Valon kvanttiteoria; fotoni Valosähköinen ilmiö ja sen kvanttiselitys Valon emissio ja absorptio Säteilyn spektri; atomin energiatasot Atomin rakenne Niels Bohrin
Luento 4 2. Fotonit, elektronit ja atomit Valon kvanttiteoria; fotoni Valosähköinen ilmiö ja sen kvanttiselitys Valon emissio ja absorptio Säteilyn spektri; atomin energiatasot Atomin rakenne Niels Bohrin
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli
 KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
a) Jos törmäysten määrä sekunnissa on f = s 1 ja jokainen törmäys deaktivoi virityksen, niin viritystilan keskimääräinen elinikä on
 KEMA225 syksy 2016 Demo 6 Malliratkaisut 1. Törmäyksistä johtuva viivan levenemä on muotoa δe = h τ, (1) jossa τ on viritystilan keskimääräinen elinaika. Tämä tulos löytyy luentoslaideista ja Atkinsista
KEMA225 syksy 2016 Demo 6 Malliratkaisut 1. Törmäyksistä johtuva viivan levenemä on muotoa δe = h τ, (1) jossa τ on viritystilan keskimääräinen elinaika. Tämä tulos löytyy luentoslaideista ja Atkinsista
8. MONIELEKTRONISET ATOMIT
 8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
1240eV nm. 410nm. Kun kappaleet saatetaan kontaktiin jännite-ero on yhtä suuri kuin työfunktioiden erotus ΔV =
 S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
Luku 13: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia
 Luku 13: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia Yleisiä piirteitä Puhdas rotaatiospektri 2-atomisen molekyylin värähtely moniatomisten molekyylien värähtely 1 Tarkastellaan sähkömagneettisen
Luku 13: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia Yleisiä piirteitä Puhdas rotaatiospektri 2-atomisen molekyylin värähtely moniatomisten molekyylien värähtely 1 Tarkastellaan sähkömagneettisen
Atomin elektronikonfiguraatiot (1)
 Atomin elektronikonfiguraatiot (1) Atomiin sidotun elektronin tilaa kuvataan neljällä kvanttiluvulla: n pääkvattiluku - aaltofunktion eli orbitaalin energia, keskimääräinen etäisyys ytimestä, saa arvot
Atomin elektronikonfiguraatiot (1) Atomiin sidotun elektronin tilaa kuvataan neljällä kvanttiluvulla: n pääkvattiluku - aaltofunktion eli orbitaalin energia, keskimääräinen etäisyys ytimestä, saa arvot
Kvanttifysiikan perusteet 2017
 Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Luku 11: Molekyylien rakenne. Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H
 Luku 11: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Elektronien liike on hyvin
Luku 11: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Elektronien liike on hyvin
5.10. HIUKKANEN POTENTIAALIKUOPASSA
 5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
Kvanttisointi Aiheet:
 Kvanttisointi Luento 5 4 Aiheet: Valosähköilmiö Einsteinin selitys Fotonit Aineaallot ja energian kvantittuminen Bohrin kvanttimalli atomille Bohrin malli vetyatomille Vedyn spektri Mitä olet oppinut?
Kvanttisointi Luento 5 4 Aiheet: Valosähköilmiö Einsteinin selitys Fotonit Aineaallot ja energian kvantittuminen Bohrin kvanttimalli atomille Bohrin malli vetyatomille Vedyn spektri Mitä olet oppinut?
Jakso 8: Monielektroniset atomit
 Jakso 8: Monielektroniset atomit Näytä tai palauta tämän jakson tehtävät viimeistään tiistaina 9.6.2015. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 6 ja 7. Suunnilleen samat asiat ovat
Jakso 8: Monielektroniset atomit Näytä tai palauta tämän jakson tehtävät viimeistään tiistaina 9.6.2015. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 6 ja 7. Suunnilleen samat asiat ovat
Luku 10: Molekyylien rakenne. Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H
 Luku 10: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Molekyylien elektronirakennetta
Luku 10: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Molekyylien elektronirakennetta
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 4 Kevät 2017
 763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 4 Keät 207. Rekyyli Luentomonisteessa on käsitelty tilanne, jossa hiukkanen (massa M) hajoaa kahdeksi hiukkaseksi (massat m ja m 2 ). Tässä käytetään
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 4 Keät 207. Rekyyli Luentomonisteessa on käsitelty tilanne, jossa hiukkanen (massa M) hajoaa kahdeksi hiukkaseksi (massat m ja m 2 ). Tässä käytetään
Aineen ja valon vuorovaikutukset
 Aineen ja valon vuorovaikutukset Yliopistonlehtori, TkT Sami Kujala Mikro- ja nanotekniikan laitos Kevät 2016 Johdanto Tutkitaan aineen ja valon vuorovaikutuksia Ensiksi tutustutaan häiriöteoriaan, jonka
Aineen ja valon vuorovaikutukset Yliopistonlehtori, TkT Sami Kujala Mikro- ja nanotekniikan laitos Kevät 2016 Johdanto Tutkitaan aineen ja valon vuorovaikutuksia Ensiksi tutustutaan häiriöteoriaan, jonka
, m s ) täytetään alimmasta energiatilasta alkaen. Alkuaineet joiden uloimmalla elektronikuorella on samat kvanttiluvut n,
 S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
TURUN AMMATTIKORKEAKOULU TYÖOHJE 1/7 TIETOTEKNIIKKA / SALO FYSIIKAN LABORATORIO V1.5 12.2007
 TURUN AMMATTIKORKEAKOULU TYÖOHJE 1/7 Työ 24AB S4h. LASERTYÖ JA VALON SPEKTRIN ANALYSOINTI TYÖN TARKOITUS LASERTYÖ Lasereita käytetään esimerkiksi tiedonsiirrossa, analysoinnissa ja terapiassa ja työstämisessä.
TURUN AMMATTIKORKEAKOULU TYÖOHJE 1/7 Työ 24AB S4h. LASERTYÖ JA VALON SPEKTRIN ANALYSOINTI TYÖN TARKOITUS LASERTYÖ Lasereita käytetään esimerkiksi tiedonsiirrossa, analysoinnissa ja terapiassa ja työstämisessä.
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Valo ja muu sähkömagneettinen säteily
 Valo ja muu sähkömagneettinen säteily Valon luonne on yksi kvanttimekaniikan omituisuuksista. Joissakin tilanteissa valo käyttäytyy kuin aaltoliike, toisissa kuin hiukkaset. Valohiukkanen eli fotoni on
Valo ja muu sähkömagneettinen säteily Valon luonne on yksi kvanttimekaniikan omituisuuksista. Joissakin tilanteissa valo käyttäytyy kuin aaltoliike, toisissa kuin hiukkaset. Valohiukkanen eli fotoni on
MIKKELIN LUKIO SPEKTROMETRIA. NOT-tiedekoulu La Palma
 MIKKELIN LUKIO SPEKTROMETRIA NOT-tiedekoulu La Palma Kasper Honkanen, Ilona Arola, Lotta Loponen, Helmi-Tuulia Korpijärvi ja Anastasia Koivikko 20.11.2011 Ryhmämme työ käsittelee spektrometriaa ja sen
MIKKELIN LUKIO SPEKTROMETRIA NOT-tiedekoulu La Palma Kasper Honkanen, Ilona Arola, Lotta Loponen, Helmi-Tuulia Korpijärvi ja Anastasia Koivikko 20.11.2011 Ryhmämme työ käsittelee spektrometriaa ja sen
Valo ja muu sähkömagneettinen säteily
 Valo ja muu sähkömagneettinen säteily Valon luonne Valon luonne on yksi kvanttimekaniikan omituisuuksista. Joissakin tilanteissa valo käyttäytyy kuin aaltoliike, toisissa kuin hiukkaset. Valoaallot eivät
Valo ja muu sähkömagneettinen säteily Valon luonne Valon luonne on yksi kvanttimekaniikan omituisuuksista. Joissakin tilanteissa valo käyttäytyy kuin aaltoliike, toisissa kuin hiukkaset. Valoaallot eivät
Hiukkasfysiikan luento 21.3.2012 Pentti Korpi. Lapuan matemaattisluonnontieteellinen seura
 Hiukkasfysiikan luento 21.3.2012 Pentti Korpi Lapuan matemaattisluonnontieteellinen seura Atomi Aine koostuu molekyyleistä Atomissa on ydin ja fotonien ytimeen liittämiä elektroneja Ytimet muodostuvat
Hiukkasfysiikan luento 21.3.2012 Pentti Korpi Lapuan matemaattisluonnontieteellinen seura Atomi Aine koostuu molekyyleistä Atomissa on ydin ja fotonien ytimeen liittämiä elektroneja Ytimet muodostuvat
Luento Atomin rakenne
 Luento 10 5. Atomin rakenne Vetatomi Ulkoisten kenttien aiheuttama energiatasojen hajoaminen Zeemanin ilmiö Elektronin spin Monen elektronin atomit Röntgensäteiln spektri 1 Schrödingerin htälö kolmessa
Luento 10 5. Atomin rakenne Vetatomi Ulkoisten kenttien aiheuttama energiatasojen hajoaminen Zeemanin ilmiö Elektronin spin Monen elektronin atomit Röntgensäteiln spektri 1 Schrödingerin htälö kolmessa
Jukka Tulkki 8. Laskuharjoitus (ratkaisut) Palautus torstaihin 3.4 klo 12:00 mennessä. x 2
 S 437 Fysiikka III Kevät 8 Jukka Tulkki 8 askuharjoitus (ratkaisut) Palautus torstaihin 34 klo : mennessä Assistentit: Jaakko Timonen Ville Pale Pyry Kivisaari auri Salmia (jaakkotimonen@tkkfi) (villepale@tkkfi)
S 437 Fysiikka III Kevät 8 Jukka Tulkki 8 askuharjoitus (ratkaisut) Palautus torstaihin 34 klo : mennessä Assistentit: Jaakko Timonen Ville Pale Pyry Kivisaari auri Salmia (jaakkotimonen@tkkfi) (villepale@tkkfi)
MUUTOKSET ELEKTRONI- RAKENTEESSA
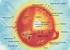 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa
 Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
7. Atomien rakenne ja spektrit
 7. Atomien rakenne ja spektrit Atomien rakenteella tarkoitetaan niiden elektroniverhojen rakennetta, erilaisia jakautumia ja erityisesti elektronien energiatiloja. Atomien spektreillä taas tarkoitetaan
7. Atomien rakenne ja spektrit Atomien rakenteella tarkoitetaan niiden elektroniverhojen rakennetta, erilaisia jakautumia ja erityisesti elektronien energiatiloja. Atomien spektreillä taas tarkoitetaan
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 206 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 2: BE- ja FD-jakaumat, kvanttikaasut Pe 5.4.206 AIHEET. Kvanttimekaanisesta vaihtosymmetriasta
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 206 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 2: BE- ja FD-jakaumat, kvanttikaasut Pe 5.4.206 AIHEET. Kvanttimekaanisesta vaihtosymmetriasta
1.1 ATOMIN DISKREETIT ENERGIATILAT
 1.1 ATOMIN DISKREETIT ENERGIATILAT 1. MITTAUKSET Franckin ja Hertzin kokeen ja ionisaatiopotentiaalin mittauslaitteisto: jännitelähde digitaalinen yleismittari suojatut banaanijohdot neonputki telineineen
1.1 ATOMIN DISKREETIT ENERGIATILAT 1. MITTAUKSET Franckin ja Hertzin kokeen ja ionisaatiopotentiaalin mittauslaitteisto: jännitelähde digitaalinen yleismittari suojatut banaanijohdot neonputki telineineen
Luento5 8. Atomifysiikka
 Atomifysiikka Luento5 8 54 Kvanttimekaniikan avulla ymmärrämme atomin rakenteen ja toiminnan. Laser on yksi esimerkki atomien ja valon kvanttimekaniikasta. Luennon tavoite: Oppia ymmärtämään atomin rakenne
Atomifysiikka Luento5 8 54 Kvanttimekaniikan avulla ymmärrämme atomin rakenteen ja toiminnan. Laser on yksi esimerkki atomien ja valon kvanttimekaniikasta. Luennon tavoite: Oppia ymmärtämään atomin rakenne
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Lisävaatimuksia aaltofunktiolle
 Lisävaatimuksia aaltofunktiolle (1) Koska Ψ*Ψ on äärellinen => Ψ on äärellinen. () Koska P = Ψ*Ψdτ => Ψ on yksiselitteinen. (3) Ψ on jatkuva. (4) dψ/dτ on jatkuva. Esimerkki Epäkelpoja aaltofunktioita
Lisävaatimuksia aaltofunktiolle (1) Koska Ψ*Ψ on äärellinen => Ψ on äärellinen. () Koska P = Ψ*Ψdτ => Ψ on yksiselitteinen. (3) Ψ on jatkuva. (4) dψ/dτ on jatkuva. Esimerkki Epäkelpoja aaltofunktioita
ψ(x) = A cos(kx) + B sin(kx). (2) k = nπ a. (3) E = n 2 π2 2 2ma 2 n2 E 0. (4)
 76A KIINTEÄN AINEEN FYSIIKKA Ratkaisut 4 Kevät 214 1. Tehtävä: Yksinkertainen malli kovalenttiselle sidokselle: a) Äärimmäisen yksinkertaistettuna mallina elektronille atomissa voidaan pitää syvää potentiaalikuoppaa
76A KIINTEÄN AINEEN FYSIIKKA Ratkaisut 4 Kevät 214 1. Tehtävä: Yksinkertainen malli kovalenttiselle sidokselle: a) Äärimmäisen yksinkertaistettuna mallina elektronille atomissa voidaan pitää syvää potentiaalikuoppaa
HANNELE TYKKÄ UV-KOVETTUVAN TARRALIIMAN KOVETTUMISASTEEN VAIKU- TUS LIIMAN OMINAISUUKSIIN
 HANNELE TYKKÄ UV-KOVETTUVAN TARRALIIMAN KOVETTUMISASTEEN VAIKU- TUS LIIMAN OMINAISUUKSIIN Diplomityö Tarkastaja: professori Helge Lemmetyinen Tarkastaja ja aihe hyväksytty luonnontieteiden ja ympäristötekniikan
HANNELE TYKKÄ UV-KOVETTUVAN TARRALIIMAN KOVETTUMISASTEEN VAIKU- TUS LIIMAN OMINAISUUKSIIN Diplomityö Tarkastaja: professori Helge Lemmetyinen Tarkastaja ja aihe hyväksytty luonnontieteiden ja ympäristötekniikan
Kiinteiden materiaalien magneettiset ominaisuudet
 Kiinteiden materiaalien magneettiset ominaisuudet Peruskäsite: Yhdisteessä elektronien orbtaaliliike ja spin vaikuttavat magneettisiin ominaisuuksiin (spinin vaikutus on merkittävämpi) Diamagnetismi Kaikki
Kiinteiden materiaalien magneettiset ominaisuudet Peruskäsite: Yhdisteessä elektronien orbtaaliliike ja spin vaikuttavat magneettisiin ominaisuuksiin (spinin vaikutus on merkittävämpi) Diamagnetismi Kaikki
Shrödingerin yhtälön johto
 Shrödingerin yhtälön johto Tomi Parviainen 4. maaliskuuta 2018 Sisältö 1 Schrödingerin yhtälön johto tasaisessa liikkeessä olevalle elektronille 1 2 Schrödingerin yhtälöstä aaltoyhtälöön kiihtyvässä liikkeessä
Shrödingerin yhtälön johto Tomi Parviainen 4. maaliskuuta 2018 Sisältö 1 Schrödingerin yhtälön johto tasaisessa liikkeessä olevalle elektronille 1 2 Schrödingerin yhtälöstä aaltoyhtälöön kiihtyvässä liikkeessä
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Laskennalinen kemia. Menetelmien hierarkia: Molekyyligeometria Molekyylimekaniikka Molekyylidynamiikka
 Laskennalinen kemia Menetelmien hierarkia: Molekyyligeometria Molekyylimekaniikka Molekyylidynamiikka Molekyyligeometria ja elektronirakenteet Empiiriset menetelmät (Hückel, Extended Hückel) Semi-empiiriset
Laskennalinen kemia Menetelmien hierarkia: Molekyyligeometria Molekyylimekaniikka Molekyylidynamiikka Molekyyligeometria ja elektronirakenteet Empiiriset menetelmät (Hückel, Extended Hückel) Semi-empiiriset
12. Eristeet Vapaa atomi. Muodostuva sähköinen dipolimomentti on p =! " 0 E loc (12.4)
 12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI
 sivu 1/5 MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI Kohderyhmä: Kesto: Tavoitteet: Toteutus: Peruskoulu / lukio 15 min. Työn tavoitteena on havainnollistaa
sivu 1/5 MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI Kohderyhmä: Kesto: Tavoitteet: Toteutus: Peruskoulu / lukio 15 min. Työn tavoitteena on havainnollistaa
elektroni = -varautunut tosi pieni hiukkanen nukleoni = protoni/neutroni
 3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI
 sivu 1/5 MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI TEORIA Spektroskopia on erittäin yleisesti käytetty analyysimenetelmä laboratorioissa, koska se soveltuu
sivu 1/5 MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI TEORIA Spektroskopia on erittäin yleisesti käytetty analyysimenetelmä laboratorioissa, koska se soveltuu
n=5 n=4 M-sarja n=3 L-sarja n=2 Lisäys: K-sarjan hienorakenne K-sarja n=1
 10.1 RÖNTGENSPEKTRI Kun kiihdytetyt elektronit törmäävät anodiin, syntyy jatkuvaa säteilyä sekä anodimateriaalille ominaista säteilyä (spektrin terävät piikit). Atomin uloimpien elektronien poistamiseen
10.1 RÖNTGENSPEKTRI Kun kiihdytetyt elektronit törmäävät anodiin, syntyy jatkuvaa säteilyä sekä anodimateriaalille ominaista säteilyä (spektrin terävät piikit). Atomin uloimpien elektronien poistamiseen
S Fysiikka III (Est), 2 VK Malliratkaisut (Arvosteluperusteita täydennetään vielä)
 S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
Luku 12: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia
 Luku 12: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia Yleisiä piirteitä Puhdas rotaatiospektri 2-atomisen molekyylin värähtely moniatomisten molekyylien värähtely 1 Tarkastellaan sähkömagneettisen
Luku 12: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia Yleisiä piirteitä Puhdas rotaatiospektri 2-atomisen molekyylin värähtely moniatomisten molekyylien värähtely 1 Tarkastellaan sähkömagneettisen
1.1 Magneettinen vuorovaikutus
 1.1 Magneettinen vuorovaikutus Magneettien välillä on niiden asennosta riippuen veto-, hylkimis- ja vääntövaikutuksia. Magneettinen vuorovaikutus on etävuorovaikutus Magneeti pohjoiseen kääntyvää päätä
1.1 Magneettinen vuorovaikutus Magneettien välillä on niiden asennosta riippuen veto-, hylkimis- ja vääntövaikutuksia. Magneettinen vuorovaikutus on etävuorovaikutus Magneeti pohjoiseen kääntyvää päätä
c λ n m hf n m E m = h = E n 1. Teoria 1.1. Atomin energiatilat ja säteily
 SPEKTROMETRIA Tekijät: Mönkkönen Tomi, Reinikainen Mikko, Tiilikainen Eero, Toivanen Maria ja Rikkinen Topi Koulut: Mikkelin Lyseon lukio ja Mikkelin Yhteiskoulun lukio Päiväys: 21.11.2008 Lukion oppiaine:
SPEKTROMETRIA Tekijät: Mönkkönen Tomi, Reinikainen Mikko, Tiilikainen Eero, Toivanen Maria ja Rikkinen Topi Koulut: Mikkelin Lyseon lukio ja Mikkelin Yhteiskoulun lukio Päiväys: 21.11.2008 Lukion oppiaine:
Aurinko. Tähtitieteen peruskurssi
 Aurinko K E S K E I S E T K Ä S I T T E E T : A T M O S F Ä Ä R I, F O T O S F Ä Ä R I, K R O M O S F Ä Ä R I J A K O R O N A G R A N U L A A T I O J A A U R I N G O N P I L K U T P R O T U B E R A N S
Aurinko K E S K E I S E T K Ä S I T T E E T : A T M O S F Ä Ä R I, F O T O S F Ä Ä R I, K R O M O S F Ä Ä R I J A K O R O N A G R A N U L A A T I O J A A U R I N G O N P I L K U T P R O T U B E R A N S
MOLEKYYLIT Johdanto Vetymolekyyli-ioni Kaksiatomiset molekyylit...239
 MOLEKYYLIT... 8 6.1 Johdanto...8 6. Vetymolekyyli-ioni...9 6.3 Kaksiatomiset molekyylit...39 6.4 Kaksiatomisten molekyylien elektronikonfiguraatioita...43 6.5 Moniatomiset molekyylit...5 6.6 Orgaaniset
MOLEKYYLIT... 8 6.1 Johdanto...8 6. Vetymolekyyli-ioni...9 6.3 Kaksiatomiset molekyylit...39 6.4 Kaksiatomisten molekyylien elektronikonfiguraatioita...43 6.5 Moniatomiset molekyylit...5 6.6 Orgaaniset
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
SÄHKÖMAGNEETTINEN SÄTEILY JA SEN VUOROVAIKUTUS MATERIAN KANSSA
 SÄHKÖMAGNEETTINEN SÄTEILY JA SEN VUOROVAIKUTUS MATERIAN KANSSA PRO GRADU -TUTKIELMA HENRIK VAHTOLA OULUN YLIOPISTO FYSIKAALISTEN TIETEIDEN LAITOS OULU 2000 Alkusanat Kiitän professori Helena Akselaa ja
SÄHKÖMAGNEETTINEN SÄTEILY JA SEN VUOROVAIKUTUS MATERIAN KANSSA PRO GRADU -TUTKIELMA HENRIK VAHTOLA OULUN YLIOPISTO FYSIKAALISTEN TIETEIDEN LAITOS OULU 2000 Alkusanat Kiitän professori Helena Akselaa ja
9. JAKSOLLINEN JÄRJESTELMÄ
 9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
Jaksollinen järjestelmä
 Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
KE-4.1100 Orgaaninen kemia 1
 KE-4.1100 rgaaninen kemia 1 Tentti 27.10.2005, malliratkaisu ja mallipisteytys Kokeessa sallitut apuvälineet: Molekyylimallisarja, taskulaskin. Mikäli vastaat koepaperiin, palauta paperi nimelläsi ja opiskelijanumerollasi
KE-4.1100 rgaaninen kemia 1 Tentti 27.10.2005, malliratkaisu ja mallipisteytys Kokeessa sallitut apuvälineet: Molekyylimallisarja, taskulaskin. Mikäli vastaat koepaperiin, palauta paperi nimelläsi ja opiskelijanumerollasi
KEMA211 EPÄORGAANINEN KEMIA 1 (4 op)
 KEMA211 EPÄORGAANINEN KEMIA 1 (4 op) Luennot 16.3. - 5.5., ti 1215 ja ke 1015, salissa YlistöKem 1 Loppukoe 6.5., klo 1200-1500, salissa MaA 103 Kirjallisuus C.E. Housecroft, A.G. Sharpe Inorganic Chemistry,
KEMA211 EPÄORGAANINEN KEMIA 1 (4 op) Luennot 16.3. - 5.5., ti 1215 ja ke 1015, salissa YlistöKem 1 Loppukoe 6.5., klo 1200-1500, salissa MaA 103 Kirjallisuus C.E. Housecroft, A.G. Sharpe Inorganic Chemistry,
KALLE TUOMI FLUORESENSSIELINAIKAMIKROSKOOPILLE SOVELTUVAT ph-herkät MERKKIAINEET
 KALLE TUMI FLURESESSIELIAIKAMIKRSKPILLE SVELTUVAT ph-herkät MERKKIAIEET Kandidaatintyö Kemian ja biotekniikan laitos Tarkastaja: Yliopistonlehtori Elina Vuorimaa-Laukkanen I TIIVISTELMÄ TAMPEREE TEKILLIE
KALLE TUMI FLURESESSIELIAIKAMIKRSKPILLE SVELTUVAT ph-herkät MERKKIAIEET Kandidaatintyö Kemian ja biotekniikan laitos Tarkastaja: Yliopistonlehtori Elina Vuorimaa-Laukkanen I TIIVISTELMÄ TAMPEREE TEKILLIE
Monen elektronin atomit
 Monen elektronin atomit Helium atomi Keskimääräisen kentän approksimaatio Aaltofunktion symmetria hiukkasvaihdossa Paulin kieltosääntö Alkuaineiden jaksollinen järjestelmä Heliumin emissiospektri Vety
Monen elektronin atomit Helium atomi Keskimääräisen kentän approksimaatio Aaltofunktion symmetria hiukkasvaihdossa Paulin kieltosääntö Alkuaineiden jaksollinen järjestelmä Heliumin emissiospektri Vety
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
