Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava
|
|
|
- Lasse Mäki
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1
2 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava kurssi (KE6, ½ kurssia) Kurssit KE2-KE6 järjestetään joka toinen vuosi. KE2-KE3 lv KE4-KE6 lv Kirjoitukset keväällä 2016!! 2
3 3
4 Arvioinnista: Kurssikoe Kotitehtävät ja tuntityöskentely vaikuttavat arvosanaan noin yhdellä numerolla. 4
5 Kotitehtävät: Merkitse listaan vain kotitehtävät, jotka merkitään taululle KTtunnuksella. Merkitse listaan vain ne tehtävät, jotka olet tehnyt niin huolella, että olet valmis esittämään ne muille joko dokumenttikameralla tai tussitaululla. Laita yksi tehtävä/ruutu. Tarvittaessa lisää ruutuun a,b,, jos olet tehnyt vain osan tehtävästä. Poissaolo täytyy olla selvitetty heti seuraavalla kerralla, mikäli haluaa merkitä kotitehtäviä poissaolon ajalta! Kotitehtävät säilytettävä ja pyydettäessä annettava opettajalle ennen kurssin arviointia. 5
6 1. Kemia luonnontieteenä Ajattele omilla aivoillasi, et voi ajatella muiden aivoilla 6
7 7
8 Lue s.6-14 & liite1/s Tehtävät 9-13/s.17-8
9 Käsitteitä: Atomi= aineen perusrakenneosanen (ei voida hajottaa kemiallisesti) Ioni= sähköisesti varautunut atomi tai atomiryhmä (e - ) Molekyyli= vähintään 2 atomia liittynyt toisiinsa (epämetalliatomit kovalenttiset sidokset) Alkuaine=sisältää vain yhdenlaisia atomeja (järjestysluku) Yhdiste= sisältää vähintään kahta erilaista atomia Ioniyhdisteessä metalli+epämetalli Molekyyliyhdisteessä vain epämetalleja Tehtävä 1/ s.15. 9
10 2. Elinympäristömme alkuaineita ja yhdisteitä 13
11 14
12 15
13 Eksoterminen reaktio = energiaa vapautuu (esim. kaasu tiivistyy nesteeksi, puu palaa) Endoterminen reaktio= energiaa sitoutuu (esim. vesi haihtuu) 16
14 Puhdas aine & alkuaine Puhtaassa aineessa kaikki rakenneosat (atomit, molekyylit tai ionit) ovat samanlaisia tarkka sulamis- ja kiehumispiste (paitsi amorfisilla aineilla). Alkuaineet jaetaan metalleihin, puolimetalleihin ja epämetalleihin. 17
15 Alkuainemolekyylin muodostuminen atomeista Oktetti= jalokaasun elektronirakenne, jossa on 8 elektronia uloimmalla kuorella (jalokaasut 8.pääryhmä, poikkeus helium, jolla on vain 2 elektronia). Molekyylissä atomeilla on yhteisiä elektroneja = kovalenttinen sidos (epämetalliatomien välillä). Jaksollinen järjestelmä: Alkuaineet ovat järjestysluvun mukaisessa järjestyksessä Jakso= vaakarivi (kertoo kuinka monta elektronikuorta on käytössä, 2n 2 ) Ryhmä=pystysarake (pääryhmän numero kertoo, kuinka monta elektronia on uloimmalla kuorella). Jaksollinen järjestelmä 18
16 Kaksoissidos- ja kolmoissidos 19
17 Ioniyhdiste Ioniyhdisteessä atomit ovat luovuttaneet tai vastaanottaneet elektroneja ja näin muodostuvat positiiviset ja negatiiviset ionit vetävät toisiaan puoleensa muodostaen ionisidoksen. Ionisidos muodostuu metallin ja epämetallin välille. Suola on yleisnimitys ioniyhdisteestä. Esim. ruokasuola NaCl 20
18 Molekyyliyhdiste Molekyyliyhdisteessä kovalenttisia sidoksia on muodostunut vähintään kahden eri epämetalliatomin välille. Esim. metaanin muodostuminen: 21
19 Lue sivut & tee tehtävät sivulta (Nopeimmat&halukkaat voivat tehdä myös tehtävää 27) 22
20 Elektronegatiivisuus Elektronegatiivisuus kuvaa atomin kykyä vetää sidoselektroneja puoleensa (MAOL s. 145/137 ). Poolinen sidos muodostuu atomien välille, kun niillä on erilainen elektronegatiivisuus elektronit (e - ) jakautuneet epätasaisesti muodostuu +- ja navat. 23
21 Poolisuus Katso taulukosta hapen ja vedyn elektronegatiivisuusarvot: 24
22 Molekyylien väliset sidokset Molekyylien välillä on dispersiovoimia ja dipoli-dipolisidoksia Myös vetysidos on dipoli-dipolisidos (H-N, H-O, H-F) (Katso kuvat s.32-33) 25
23 26
24 27
25 3. Seokset koostuvat useista eri aineista Lue sivut ja selitä seuraavat käsitteet sekä selosta lyhyesti ao. erotusmenetelmiä vihkoosi (mihin perustuu). Tee myös tehtäviä (valitse itse). OPH Homogeeninen seos: Heterogeeninen seos: Faasi: Suodatus: Dekantointi: Sentrifugointi: Haihdutus: Tislaus: Sublimointi: Uutto eli uuttaminen: Kromatografia: Kaasukromatografia 28
26 Kuva s.42 29
27 Luokittele seuraavat mallit alkuaineisiin, yhdisteisiin ja seoksiin. 30
28 Pitoisuuden ilmoittaminen: Massaprosentti m%: m % = määritettävän aineen massa tutkittavan näytteen massa 100% Erityisesti liuoksille Massaprosentti m%: m % = liuenneen aineen massa 100% tutkittavan liuoksen massa Tilavuusprosentti: til % = liuenneen aineen tilavuus tutkittavan aineen tilavuus 100% 1% = % 0 = ppm =
29 4. Ainemäärä ja konsentraatio Atomi muodostuu ytimestä (protonit ja neutronit) sekä sitä ympäröivästä elektronipilvestä. Ihminen vs. lintu 32
30 ATOMI ydin elektroniverho protoni (p + ) -Varaus positiivinen neutroni (n) -Varaukseton elektroni (e - ) -Varaus negatiivinen Atomi on ulospäin varaukseton eli siinä on yhtä monta protonia (järjestysluku) ja elektronia. 33
31 Massaluku= neutronien ja protonien yhteismäärä. Toinen merkintätapa Cl
32 Saman alkuaineen erimassaisia atomeja sanotaan isotoopeiksi (neutronien määrä vaihtelee). Vedyllä on kolme isotooppia: tavallinen vety 1 H raskas vety (deuterium) 2 H raskain vety (tritium) 3 H. 35
33 Avogadron vakio MAOL s.138/131 36
34 Yhtälöt löytyvät selityksineen sivuilta 62-65! Vastaavat yhtälöt ovat taulukon sivulla / ! Piirros 37
35 Esimerkki a) Kuinka monta moolia hiiliatomeja piirroksessa on? b) Kuinka monta kappaletta hiiliatomeja piirroksessa on? n= m M n= N N A 38
36 39
37 Kertaus: (taulukkokirja s / ) Tehtävä 1. Laske ainemäärä, kun sinulla on 15,0g vettä Tehtävä 2. Laske konsentraatio, kun 22,0g magnesiumkloridia (MgCl 2 ) liuotetaan kolmeen litraan vettä. 40
38 Ratkaisut: Tehtävä 1. n(h 2 O)= m M = massa moolimassa = 15,0g (2 1,008 g g +16,00 mol mol ) 0,833 mol Tehtävä 2. Laske konsentraatio, kun 22,0g magnesiumkloridia (MgCl 2 ) liuotetaan kolmeen litraan vettä. 41
39 Ratkaisut: Tehtävä 1. n(h 2 O)= m M = massa moolimassa = 15,0g (2 1,008 g g +16,00 mol mol ) 0,833 mol Tehtävä 2. n(mgcl 2 )= m M = massa moolimassa = 22,0g (24,31 g g +2 35,45 mol mol ) 0, mol c(mgcl 2 )= n V = ainemäärä tilavuus 0, mol = 3 l 0,0770 mol/l 42
40 5. Erilaisia orgaanisia yhdisteitä Hiiliatomissa C on neljä ulkoelektronia hiiliatomi muodostaa aina neljä sidosta! Esim. metaani CH 4 43
41 Mikäli yhdisteessä on hiilen lisäksi vain vetyä, niin yhdistettä sanotaan hiilivedyksi. Hiileen voi sitoutua myös muita alkuaineita, esimerkiksi happea, typpeä, halogeeneja 44
42 Alkaanit Alkaaneissa kaikki hiilien väliset sidokset ovat yksinkertaisia (-aani). Alkaaneja sanotaan tyydyttyneiksi hiilivedyiksi. Alkaanin nimessä on pääte aani. Alkaani Hiiliatomien määrä Rakennekaava Molekyylikaava metaani 1 etaani 2 propaani 3 butaani 4 pentaani 5 45
43 Alkaanit Alkaaneissa kaikki hiilien väliset sidokset ovat yksinkertaisia (-aani). Alkaaneja sanotaan tyydyttyneiksi hiilivedyiksi. Alkaanin nimessä on pääte aani. Alkaani Hiiliatomien määrä Rakennekaava Molekyylikaava metaani 1 CH 4 etaani 2 C 2 H 6 propaani 3 C 3 H 8 butaani 4 C 4 H 10 pentaani 5 C 5 H 12 46
44 Sykliset hiilivedyt Rengasrakenteessa nimeen lisätään syklo etuliite. 47
45 Alkeenit ja alkyynit Alkeeneissa yksi hiilien välinen sidos on kaksoissidos ja pääte on -eeni. Alkyyneissa yksi hiilien välinen sidos on kolmoissidos ja pääte on -yyni. Numero nimen edessä kertoo kaksois- /kolmoissidoksen paikan. Hiilivetyjen nimen etuliite kertoo hiiliatomien lukumäärän (MAOL s & 138 / & s.130). Alkeeneja ja alkyynejä sanotaan tyydyttymättömiksi hiilivedyiksi. 48
46 Alkoholit Alkoholeissa on vähintään yksi hydroksyyliryhmä OH. Alkoholimolekyylit sisältävät hiiltä, vetyä ja happea. Alkoholin nimessä on pääte -oli. Yksinkertaisimpia alkoholeja ovat metanoli CH 3 OH ja etanoli C 2 H 5 OH. 49
47 Alkaani Rakennekaava Alkoholi Rakennekaava molekyylikaava Metaani metanoli OH CH 3 OH (CH 4 O) Etaani etanoli OH C 2 H 4 OH Propaani propanoli OH C 3 H 7 OH Butaani butanoli OH C 4 H 9 OH Pentaani pentanoli OH C 5 H 11 OH 50
48 Glykoli ja glyseroli ovat moniarvoisia alkoholeja (=useampi OH ryhmä). Myrkyllisen glykolin (1,2-etaanidioli) ja veden seosta käytetään jäähdytysnesteenä ja jäänestoaineena. Glyserolin (1,2,3-propaanitrioli) käyttökohteita ovat mm. kosmeettiset tuotteet ja räjähdysaineet. Glykoli C 2 H 4 (OH) 2 Glyseroli C 3 H 5 (OH) 3 51
49 Ksylitoli Myös ksylitoli on moniarvoinen alkoholi. 52
50 Karboksyylihapot Karboksyylihapot sisältävät karboksyyliryhmän COOH. Yksinkertaisimpia karboksyylihappoja ovat metaani- eli muurahaishappo HCOOH ja etaani- eli etikkahappo CH 3 COOH. Pienimolekyyliset karboksyylihapot ovat voimakastuoksuisia. Etikkahappo CH 3 COOH 53
51 Hiilivetyjen ominaisuuksia Kemiallisesti samanlainen aine liuottaa samanlaista ainetta (pooliton poolitonta ja poolinen poolista). Hiilivetyjen sulamis- ja kiehumispiste kasvaa moolimassan kasvaessa (hetkelliset dipolit voimakkaampia). 54
52 Funktionaaliset eli toiminnalliset ryhmät kirja s.82) 55
53 56
54 Bentseeni Bentseenirenkaan C 6 H 6 sisältävät yhdisteet ovat aromaattisia yhdisteitä. Esimerkiksi fenolit ovat aromaattisia. 57
55 Amiinit Amiinit ovat typpeä N sisältäviä orgaanisia yhdisteitä (ammoniakin NH 3 johdannaisia). Typpi sitoutuu kolmella kovalenttisella sidoksella vetyyn tai hiileen. 58
56 59
57 Aldehydit Happi on liittynyt kaksoissidoksella hiiliketjun päähän. Nimessä pääte aali (metanaali, etanaali, ) Ketonit Happi on liittynyt kaksoissidoksella hiiliketjun keskelle. Nimessä pääte oni (propanoni, butanoni, ) 60
58 6. Orgaanisten yhdisteiden reaktioita ja yhdisteiden nimeäminen. Hiilivetyjen (ja alkoholien) palaessa syntyy hiilidioksidia ja vettä eli hiilivety + happi hiilidioksidi ja vesi Esim. metaanin palaminen: CH O 2 CO 2 + 2H 2 O 61
59 Propaanin C 3 H 8 palamisreaktio: _C 3 H 8 + _O 2 _CO 2 + _H 2 O 62
60 Propaanin C 3 H 8 palamisreaktio: _C 3 H 8 + 5O 2 3CO 2 + 4H 2 O 63
61 Hapettuminen ja pelkistyminen Orgaanisen yhdisteen hapettumisessa molekyyliin tulee lisää happiatomeja tai vetyatomien määrä pienenee. Orgaanisen yhdisteen pelkistymisessä happiatomien määrä pienenee tai vetyatomien määrä kasvaa. 64
62 65
63 66
64 Protolyysireaktio Happo on aine, joka voi luovuttaa protonin (H + ). Happamuuden (ph alle 7) aiheuttavat vedessä olevat oksoniumionit (H 3 O + ). Hapot, Karboksyylihapot, fenoli. Emäs on aine, joka vastaanottaa protonin (H + ). Emäksisyyden (ph yli 7) aiheuttavat vedessä olevat hydroksidi-ionit (OH - ). Protolyysireaktiossa protoni (H + ) siirtyy hapolta emäkselle (tai päinvastoin). NaOH ja amiinit 67
65 (Kuvat s ) 68
66 Neutraloituminen Neutraloitumisessa happamuuden aiheuttavat oksoniumionit H 3 O + ja emäksisyyden aiheuttavat hydroksidi-ionit OH liittyvät yhteen muodostaen vettä. Neutraloitumisreaktiossa syntyy veden lisäksi suolaa eli happo + emäs suola + vesi. Esim. NaOH + HCl NaCl + H 2 O 69
67 70
68 Esteröitymisreaktio Karboksyylihappo + alkoholi esteri + vesi Esim. 71
69 72
70 Nimeämisohjeet s
71 74
72 75
73 76
74 77
75 Nimeäminen (1-2 kertaa): Tutustu sivujen nimeämisohjeisiin samalla, kun teet alla olevia tehtäviä. Käytä tehdessäsi apuna mahdollisimman paljon myös taulukkokirjan sivuja 138 ja (vanha painos 130 ja ), tutustuen samalla taulukossa oleviin esimerkkeihin! Tehtävien joukossa on muutamia turhankin hankalia, joten älä suotta takerru niihin! Kysy apua, kun eteen tulee hankala asia!!! Tehtävät: 148, 149, , 156, 157, (158, 102) 78
76 7. Solujen tärkeitä yhdisteitä 79
77 Sokeria ja happea syntyy vedestä ja hiilidioksidista fotosynteesin eli yhteyttämisreaktion tuloksena: _CO 2 + _H 2 O _C 6 H 12 O 6 + _O 2 Rypälesokeri eli glukoosi ja hedelmäsokeri eli fruktoosi ovat perussokereita eli monosakkarideja (C 6 H 12 O 6 ). 80
78 Sokeria ja happea syntyy vedestä ja hiilidioksidista fotosynteesin eli yhteyttämisreaktion tuloksena: 6CO 2 + 6H 2 O _C 6 H 12 O 6 + 6O 2 Rypälesokeri eli glukoosi ja hedelmäsokeri eli fruktoosi ovat perussokereita eli monosakkarideja (C 6 H 12 O 6 ). (MAOL s.167/157) 81
79 82
80 Hiilihydraatit jaetaan mono-, di- ja polysakkarideihin (tai sokereihin ja polysakkarideihin). 83
81 84
82 Rasvat Pitkäketjuisia karboksyylihappoja sanotaan rasvahapoiksi (4-, MAOL s. 166/156 ). Rasvamolekyyli muodostuu glyserolista ja kolmesta rasvahaposta (muodostuu esteri). Rasvat ovat hyviä energialähteitä. Rasvat eivät liukene veteen. Rasvat ovat kasvien ja eläinten vararavintoa. 85
83 Rasvahapot, joissa kaikki hiilien väliset sidokset ovat yksinkertaisia, ovat tyydyttyneitä.. Rasvahapot, joissa on kaksois- tai kolmoissidoksia, ovat tyydyttymättömiä. Useita kaksois- tai kolmoissidoksia sisältävät rasvahapot ovat monityydyttymättömiä. Tyydyttyneet rasvat ovat yleensä kiinteitä ja tyydyttymättömät nestemäisiä 86
84 Aminohapot Aminohapot sisältävät karboksyyliryhmän COOH ja aminoryhmän NH 2. (MAOL s.167/157) Valkuaisaineet eli proteiinit ovat aminohapoista muodostuneita elimistön rakennusaineita. Valkuaisaineissa satoja aminohappoja on liittynyt toisiinsa peptidisidoksin. 87
85 Nukleiinihapot Lue s
86 Vihjeitä kokeeseen valmistautumiseen: Liitteessä 5 (s ) on kurssin keskeisiä käsitteitä ja ne kannattaa käydä huolellisesti läpi. Tekstin välissä olevat opittiin laatikot toimivat myös hyvänä kertauksena. Vihkomuistiinpanoista löytyy keskeisimpiä asioita ja käsitteitä. Tehtyjä ja tekemättä jääneitä tehtäviä kannattaa myös käydä läpi (muista romppu!). Muista myös liitteen 1 pyöristyssäännöt yms.! Viimekertaisen kokeen löydät laittamalla esim. Googleen hakusanaksi petrike1. Pohjatunti ke kello Koe xx x.x.2014 kello Tukiopetusaikoja: ILMOITA VIIMEISTÄÄN EDELLISENÄ PÄIVÄNÄ, MIKÄLI HALUAT OSALLISTUA TUKIOPETUKSEEN! 89
87 Kiitos mielenkiinnosta 90
88 Kurssilla tehtyjä tehtäviä: Suluissa olevat tehtävät voivat olla vähän vaikeampia tai ne on jostain muusta syystä jätetty vähemmälle huomiolle. 1. 1, 4, 8-13, , (25-27), , , 63-67, 69, 70, 76, 77, 80, (85-91) , 97, 100, 107, 110, 118, 122, 127, , (136), 137, 138, 140, (141), 143, 148, 149, , 156, 157, (158) , 162, (165), 168ab(c), (170) 91
89 Luku 5 & nimeämisohjeita s Tehtäviä 92,93,94,97,100,107,109,110,118,122,127,128,102,111,132, 133,134,137 92
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
ORGAANINEN KEMIA. = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY
 ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
Orgaanisissa yhdisteissä on hiiltä
 Orgaaninen kemia 31 Orgaanisissa yhdisteissä on hiiltä Kaikki orgaaniset yhdisteet sisältävät hiiltä. Hiilen kemiallinen merkki on C. Usein orgaanisissa yhdisteissä on myös vetyä, typpeä ja happea. Orgaaniset
Orgaaninen kemia 31 Orgaanisissa yhdisteissä on hiiltä Kaikki orgaaniset yhdisteet sisältävät hiiltä. Hiilen kemiallinen merkki on C. Usein orgaanisissa yhdisteissä on myös vetyä, typpeä ja happea. Orgaaniset
Orgaanisten yhdisteiden rakenne ja ominaisuudet
 Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
SIDOKSET. Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
KPL1 Hiili ja sen yhdisteet. KPL2 Hiilivedyt
 KPL1 Hiili ja sen yhdisteet 1. Mikä on hiilen kemiallinen kaava? C 2. Mitkä ovat hiilen 4 eri esiintymismuotoa? Miten ne eroavat toisistaan? Timantti, grafiitti, fullereeni, nanoputki. Eroavat rakenteelta
KPL1 Hiili ja sen yhdisteet 1. Mikä on hiilen kemiallinen kaava? C 2. Mitkä ovat hiilen 4 eri esiintymismuotoa? Miten ne eroavat toisistaan? Timantti, grafiitti, fullereeni, nanoputki. Eroavat rakenteelta
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Puhdasaine Seos Aineen olomuodot
 1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Työ 6/s.174-175 Tutustu työn 6 työohjeeseen, siten että osaat toimia sujuvasti sen mukaan ja kysyä asioista joita et ymmärtänyt/osaa
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Työ 6/s.174-175 Tutustu työn 6 työohjeeseen, siten että osaat toimia sujuvasti sen mukaan ja kysyä asioista joita et ymmärtänyt/osaa
MUUTOKSET ELEKTRONI- RAKENTEESSA
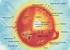 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA
 MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Lämpö- eli termokemiaa
 Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
Orgaaninen tarkoittaa eloperäistä ja alunperin kaikki elollisesta luonnosta peräisin olevat yhdisteet luokiteltiin orgaanisiksi yhdisteiksi.
 Orgaaninen kemia Orgaaninen tarkoittaa eloperäistä ja alunperin kaikki elollisesta luonnosta peräisin olevat yhdisteet luokiteltiin orgaanisiksi yhdisteiksi. Nykyään orgaanisia yhdisteitä osataan valmistaa
Orgaaninen kemia Orgaaninen tarkoittaa eloperäistä ja alunperin kaikki elollisesta luonnosta peräisin olevat yhdisteet luokiteltiin orgaanisiksi yhdisteiksi. Nykyään orgaanisia yhdisteitä osataan valmistaa
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Näiden aihekokonaisuuksien opetussuunnitelmat ovat luvussa 8.
 9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
Atomi. Aineen perusyksikkö
 Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
EPIONEN Kemia 2015. EPIONEN Kemia 2015
 EPIONEN Kemia 2015 1 Epione Valmennus 2014. Ensimmäinen painos www.epione.fi ISBN 978-952-5723-40-3 Painopaikka: Kopijyvä Oy, Kuopio Tämän teoksen painamiseen käytetty paperi on saanut Pohjoismaisen ympäristömerkin.
EPIONEN Kemia 2015 1 Epione Valmennus 2014. Ensimmäinen painos www.epione.fi ISBN 978-952-5723-40-3 Painopaikka: Kopijyvä Oy, Kuopio Tämän teoksen painamiseen käytetty paperi on saanut Pohjoismaisen ympäristömerkin.
Biomolekyylit ja biomeerit
 Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Orgaanista kemiaa. Yhdistetyypit ja nimeäminen
 Orgaanista kemiaa Yhdistetyypit ja nimeäminen Molekyylikaava Termejä: molekyylikaava, bruttokaava, empiirinen kaava, suhdekaava Molekyylikaavan kirjoittaminen ensin hiilet, sitten vedyt näiden jälkeen
Orgaanista kemiaa Yhdistetyypit ja nimeäminen Molekyylikaava Termejä: molekyylikaava, bruttokaava, empiirinen kaava, suhdekaava Molekyylikaavan kirjoittaminen ensin hiilet, sitten vedyt näiden jälkeen
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
Jaksollinen järjestelmä
 Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Nimi: Orgaaninen kemia. orgaanista.wordpress.com. 9. luokan kurssi
 Nimi: Orgaaninen kemia orgaanista.wordpress.com 9. luokan kurssi Aikataulu Tässä on kurssin aikataulu. Kirjoita jokaisen oppitunnin päätteeksi muistiin, mitä sillä tunnilla teit. Merkitse tähän muistiin
Nimi: Orgaaninen kemia orgaanista.wordpress.com 9. luokan kurssi Aikataulu Tässä on kurssin aikataulu. Kirjoita jokaisen oppitunnin päätteeksi muistiin, mitä sillä tunnilla teit. Merkitse tähän muistiin
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
a) Puhdas aine ja seos b) Vahva happo Syövyttävä happo c) Emäs Emäksinen vesiliuos d) Amorfinen aine Kiteisen aineen
 1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
Kaikki ympärillämme oleva aine koostuu alkuaineista.
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Kurssin 1 kertaus 13. elokuuta 2013 15:49
 Kurssin 1 kertaus 13. elokuuta 2013 15:49 Aine Puhdas aine Alkuaine Metalli Metallisidos Uloimmat elektronit pääsevät vaeltamaan vapaasti positiivisten atomiydinten välillä pitäen rakenteen kasassa Epämetalli
Kurssin 1 kertaus 13. elokuuta 2013 15:49 Aine Puhdas aine Alkuaine Metalli Metallisidos Uloimmat elektronit pääsevät vaeltamaan vapaasti positiivisten atomiydinten välillä pitäen rakenteen kasassa Epämetalli
c) Nimeä kaksi alkuainetta, jotka kuuluvat jaksollisessa järjestelmässä samaan ryhmään kalsiumin kanssa.
 Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
2. Alkaanit. Suoraketjuiset alkaanit: etuliite+aani Metaani, etaani... Dekaani (10), undekaani, dodekaani, tridekaani, tetradekaani, pentadekaani..
 2. Alkaanit SM -08 Kaikkein yksinkertaisimpia orgaanisia yhdisteitä. Sisältävät vain hiiltä ja vetyä ja vain yksinkertaisia - sidoksia. Yleinen molekyylikaava n 2n+2 Alkaanit voivat olla suoraketjuisia
2. Alkaanit SM -08 Kaikkein yksinkertaisimpia orgaanisia yhdisteitä. Sisältävät vain hiiltä ja vetyä ja vain yksinkertaisia - sidoksia. Yleinen molekyylikaava n 2n+2 Alkaanit voivat olla suoraketjuisia
HEIKOT SIDOKSET. Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
8. Alkoholit, fenolit ja eetterit
 8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
2. Täydennä seuraavat reaktioyhtälöt ja nimeä reaktiotuotteet
 /Tapio evalainen Loppukuulustelun..00 mallivastaukset. imi: vsk:. Piirrä karboksyylihapporyhmän ja aminoryhmän rakenteet ja piirrä näkyviin myös vapaat elektroniparit. soita mikä hybridisaatio karboksyyli-
/Tapio evalainen Loppukuulustelun..00 mallivastaukset. imi: vsk:. Piirrä karboksyylihapporyhmän ja aminoryhmän rakenteet ja piirrä näkyviin myös vapaat elektroniparit. soita mikä hybridisaatio karboksyyli-
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
Isomerian lajit. Rakenne- eli konstituutioisomeria. Avaruus- eli stereoisomeria. Ketjuisomeria Funktioisomeria Paikkaisomeria
 Isomeria Isomeria Yhdisteellä on sama molekyylikaava, mutta eri rakenne: siksi eri isomeereillä voi olla erilaiset fysikaaliset ja kemialliset ominaisuudet!!!! Esim. yhdisteellä C2H6O on kaksi isomeeriä.
Isomeria Isomeria Yhdisteellä on sama molekyylikaava, mutta eri rakenne: siksi eri isomeereillä voi olla erilaiset fysikaaliset ja kemialliset ominaisuudet!!!! Esim. yhdisteellä C2H6O on kaksi isomeeriä.
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
Puhtaat aineet ja seokset
 Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Mitkä ovat aineen kolme olomuotoa ja miksi niiden välisiä olomuodon muutoksia kutsutaan?
 2.1 Kolme olomuotoa Mitkä ovat aineen kolme olomuotoa ja miksi niiden välisiä olomuodon muutoksia kutsutaan? pieni energia suuri energia lämpöä sitoutuu = endoterminen lämpöä vapautuu = eksoterminen (endothermic/exothermic)
2.1 Kolme olomuotoa Mitkä ovat aineen kolme olomuotoa ja miksi niiden välisiä olomuodon muutoksia kutsutaan? pieni energia suuri energia lämpöä sitoutuu = endoterminen lämpöä vapautuu = eksoterminen (endothermic/exothermic)
KE1 Ihmisen ja elinympäristön kemia
 KE1 Ihmisen ja elinympäristön kemia Arvostelu: koe 60 %, tuntitestit (n. 3 kpl) 20 %, kokeelliset työt ja palautettavat tehtävät 20 %. Kurssikokeesta saatava kuitenkin vähintään 5. Uusintakokeessa testit,
KE1 Ihmisen ja elinympäristön kemia Arvostelu: koe 60 %, tuntitestit (n. 3 kpl) 20 %, kokeelliset työt ja palautettavat tehtävät 20 %. Kurssikokeesta saatava kuitenkin vähintään 5. Uusintakokeessa testit,
c) Mitkä alkuaineet ovat tärkeitä ravinteita kasveille?
 ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
ATOMIN ELEKTRONIVERHO
 2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella
2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella
elektroni = -varautunut tosi pieni hiukkanen nukleoni = protoni/neutroni
 3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemia s10 Ratkaisut. b) Kloorin hapetusluvun muutos: +VII I, Hapen hapetusluvun muutos: II 0. c) n(liclo 4 ) = =
 1. 2. a) Yhdisteen molekyylikaava on C 6 H 10 : A ja E b) Yhdisteessä on viisi CH 2 yksikköä : D ja F c) Yhdisteet ovat tyydyttyneitä ja syklisiä : D ja F d) Yhdisteet ovat keskenään isomeereja: A ja E
1. 2. a) Yhdisteen molekyylikaava on C 6 H 10 : A ja E b) Yhdisteessä on viisi CH 2 yksikköä : D ja F c) Yhdisteet ovat tyydyttyneitä ja syklisiä : D ja F d) Yhdisteet ovat keskenään isomeereja: A ja E
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
3. Protolyysireaktiot ja vesiliuoksen ph
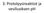 3. Protolyysireaktiot ja vesiliuoksen ph Happo Happo on protonin (H+) luovuttaja Esim. suolahappo (tässä vesi on emäs) Happo luovuttaa vetyionin ja syntyy oksoniumioni H₃O+ Maistuu happamalta, esim. karboksyylihapot
3. Protolyysireaktiot ja vesiliuoksen ph Happo Happo on protonin (H+) luovuttaja Esim. suolahappo (tässä vesi on emäs) Happo luovuttaa vetyionin ja syntyy oksoniumioni H₃O+ Maistuu happamalta, esim. karboksyylihapot
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Heikot sidokset voimakkuusjärjestyksessä: -Sidos poolinen, kun el.neg.ero on 0,5-1,7. -Poolisuus merkitään osittaisvarauksilla
 Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Seokset ja liuokset. 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen
 Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
1-12 R1-R3. 21, 22 T4 Tutkielman palautus kurssin lopussa (Työ 2 ja Työ 3), (R4-R6) Sopii myös itsenäiseen opiskeluun Työ 4 R7 - R8
 I Aineet ympärillämme 1 Kemia on 1x75 min tai 1-12 R1-R3 Kemia 1 kurssiin tutustumisen voi aloittaa Pohditehtävällä, jonka jälkeen opiskelijat tekevät ryhmissä yhden tehtävistä R1-R3 (tietokoneet). Oheismateriaali:
I Aineet ympärillämme 1 Kemia on 1x75 min tai 1-12 R1-R3 Kemia 1 kurssiin tutustumisen voi aloittaa Pohditehtävällä, jonka jälkeen opiskelijat tekevät ryhmissä yhden tehtävistä R1-R3 (tietokoneet). Oheismateriaali:
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Helsingin yliopiston kemian valintakoe. Keskiviikkona klo Vastausselvitykset: Tehtävät:
 1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Solun perusrakenne I Solun perusrakenne. BI2 I Solun perusrakenne 3. Solujen kemiallinen rakenne
 Solun perusrakenne I Solun perusrakenne 3. Solujen kemiallinen rakenne 1. Avainsanat 2. Solut koostuvat molekyyleistä 3. Hiilihydraatit 4. Lipidit eli rasva-aineet 5. Valkuaisaineet eli proteiinit rakentuvat
Solun perusrakenne I Solun perusrakenne 3. Solujen kemiallinen rakenne 1. Avainsanat 2. Solut koostuvat molekyyleistä 3. Hiilihydraatit 4. Lipidit eli rasva-aineet 5. Valkuaisaineet eli proteiinit rakentuvat
VESI JA VESILIUOKSET
 VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Nimi sosiaaliturvatunnus. Vastaa lyhyesti, selkeällä käsialalla. Vain vastausruudun sisällä olevat tekstit, kuvat jne huomioidaan
 1. a) Seoksen komponentit voidaan erotella toisistaan kromatografisilla menetelmillä. Mihin kromatografiset menetelmät perustuvat? (2p) Menetelmät perustuvat seoksen osasten erilaiseen sitoutumiseen paikallaan
1. a) Seoksen komponentit voidaan erotella toisistaan kromatografisilla menetelmillä. Mihin kromatografiset menetelmät perustuvat? (2p) Menetelmät perustuvat seoksen osasten erilaiseen sitoutumiseen paikallaan
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
TERVEYDEN BIOTIETEIDEN Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 24.5.2007 Etunimet: Nimikirjoitus: KEMIA. Kemian kuulustelu klo 12.
 TERVEYDEN BIOTIETEIDEN Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 24.5.2007 Etunimet: Nimikirjoitus: KEMIA Kemian kuulustelu klo 12.00 YLEISET OHJEET 1. Tarkista, että saamassasi tehtävänipussa on sivut
TERVEYDEN BIOTIETEIDEN Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 24.5.2007 Etunimet: Nimikirjoitus: KEMIA Kemian kuulustelu klo 12.00 YLEISET OHJEET 1. Tarkista, että saamassasi tehtävänipussa on sivut
Yhdisteiden nimeäminen
 Yhdisteiden nimeäminen Binääriyhdisteiden nimeäminen 1. Ioniyhdisteet 2. Epämetallien väliset yhdisteet Kompleksiyhdisteiden nimeäminen Kemiallinen reaktio 1. Reaktioyhtälö 2. Määrälliset laskut 3. Reaktionopeuteen
Yhdisteiden nimeäminen Binääriyhdisteiden nimeäminen 1. Ioniyhdisteet 2. Epämetallien väliset yhdisteet Kompleksiyhdisteiden nimeäminen Kemiallinen reaktio 1. Reaktioyhtälö 2. Määrälliset laskut 3. Reaktionopeuteen
Bensiiniä voidaan pitää hiilivetynä C8H18, jonka tiheys (NTP) on 0,703 g/ml ja palamislämpö H = kj/mol
 Kertaustehtäviä KE3-kurssista Tehtävä 1 Maakaasu on melkein puhdasta metaania. Kuinka suuri tilavuus metaania paloi, kun täydelliseen palamiseen kuluu 3 m 3 ilmaa, jonka lämpötila on 50 C ja paine on 11kPa?
Kertaustehtäviä KE3-kurssista Tehtävä 1 Maakaasu on melkein puhdasta metaania. Kuinka suuri tilavuus metaania paloi, kun täydelliseen palamiseen kuluu 3 m 3 ilmaa, jonka lämpötila on 50 C ja paine on 11kPa?
Kemia keskeinen luonnontiede
 KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
KE2 KURSSIKOE 4/2014 Kastellin lukio
 KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
Reaktiomekanismi. Tänä päivänä hyödynnetään laskennallista kemiaa reaktiomekanismien määrittämisessä/selvittämisessä!
 REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
Syntymäaika: 2. Kirjoita nimesi ja syntymäaikasi kaikkiin sivuille 1 ja 3-11 merkittyihin kohtiin.
 1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 15.6. 2011 klo 9-12 Nimi: Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-12. 2. Kirjoita nimesi
1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 15.6. 2011 klo 9-12 Nimi: Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-12. 2. Kirjoita nimesi
8. Alkoholit, fenolit ja eetterit
 8. Alkoholit, fenolit ja eetterit Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
8. Alkoholit, fenolit ja eetterit Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Nimi sosiaaliturvatunnus. Vastaa lyhyesti, selkeällä käsialalla. Vain vastausruudun sisällä olevat tekstit, kuvat jne huomioidaan
 1. a) Mitä tarkoitetaan biopolymeerilla? Mihin kolmeen ryhmään biopolymeerit voidaan jakaa? (1,5 p) Biopolymeerit ovat luonnossa esiintyviä / elävien solujen muodostamia polymeerejä / makromolekyylejä.
1. a) Mitä tarkoitetaan biopolymeerilla? Mihin kolmeen ryhmään biopolymeerit voidaan jakaa? (1,5 p) Biopolymeerit ovat luonnossa esiintyviä / elävien solujen muodostamia polymeerejä / makromolekyylejä.
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
VirtuaaliKemia. Versio 2.0 Lahden Teho-Opetus Oy
 VirtuaaliKemia Versio 2.0 Lahden Teho-Opetus Oy 1. Johdanto... 3 2. Asennusvaihtoehdot ja ohjelmaan kirjautuminen... 3 3. Ohjelman yleisrakenne... 4 4. Ohjelman sisältö... 7 4.1. Aineen rakenne... 7 4.1.1.
VirtuaaliKemia Versio 2.0 Lahden Teho-Opetus Oy 1. Johdanto... 3 2. Asennusvaihtoehdot ja ohjelmaan kirjautuminen... 3 3. Ohjelman yleisrakenne... 4 4. Ohjelman sisältö... 7 4.1. Aineen rakenne... 7 4.1.1.
sosiaaliturvatunnus Tehtävissä tarvittavia atomipainoja: hiili 12,01; vety 1,008; happi 16,00. Toisen asteen yhtälön ratkaisukaava: ax 2 + bx + c = 0;
 Valintakoe 2012 / Biokemia Nimi sosiaaliturvatunnus Tehtävissä tarvittavia atomipainoja: hiili 12,01; vety 1,008; happi 16,00. Toisen asteen yhtälön ratkaisukaava: ax 2 + bx + c = 0; 1. Kuvassa on esitetty
Valintakoe 2012 / Biokemia Nimi sosiaaliturvatunnus Tehtävissä tarvittavia atomipainoja: hiili 12,01; vety 1,008; happi 16,00. Toisen asteen yhtälön ratkaisukaava: ax 2 + bx + c = 0; 1. Kuvassa on esitetty
