Ionisidos ja ionihila:
|
|
|
- Reino Palo
- 7 vuotta sitten
- Katselukertoja:
Transkriptio
1 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on vahva sidos. Ionirakenteisia yhdisteitä kutsutaan yleisesti suoloiksi. Oktettisäännön avulla voidaan päätellä siirtyvien elektronien määrä. Pyrkimys lähimmän jalokaasun rakenteeseen, s 2 p 6. Huomaa, että d-lohkoon kuuluvat metallit eivät luovuta kaikkia ulkoelektronejaan. Siksi ne voivat esiintyvä useilla eri hapetusluvuilla. Esim. Mangaanilla on +II, +III, +IV, +VI ja +VII.! 1
2 Huomautus Ionisidosta ei voida osoittaa samalla tapaa kuin kovalenttista sidosta. Kukin ioni pyrkii saamaan ympärilleen mahdollisimman monta erimerkkistä ionia ja toisaalta pitämään samanmerkkiset ionit mahd. kaukana. Tämä pyrkimys johtaa siihen, että ionit pakkautuvat kolmiulotteiseksi rakenteeksi, ionihilaksi. Se pysyy koossa sähköisten vetovoimien avulla. Hilassa positiivisten ja negatiivisten varausten summan on oltava nolla ulospäin ioniyhdisteet ovat neutraaleja. Määritelmä, alkeiskoppi: Pienintä yksikköä, jota monistamalla saadaan koko kiderakenne, kutsutaan alkeiskopiksi. ns. alkeiskoppi On huomattava, että ionit järjestyvät tilaan, jossa niiden väliset vetovoimat ovat mahdollisimman suuret ja hylkivät voimat ovat pienet. Ionien koko ja varaus huomioiden huomataan, että suolat kiteytyvät eri tavalla. Eri yhdisteet luokitellaan ja tunnistetaan kidetyypeistä. Ionihilat ovat kovia mutta hauraita, ne rikkoontuvat iskust. Tällöin samanmerkkiset ionit joutuvat kohdakkain ja ne hylkivät toisiaan. Rakenne murtuu. 2
3 Huomautus Kiinteässä ionihilassa ei ole varauksen kuljettajia, eli se ei johda sähköä. Kun sitten suola liukenee esim. veteen, niin vedessä olevat ionit toimivat varauksen kuljettajina, eli elektrolyytteinä. Veteen liukenevan suolan vesiliuos johtaa siis sähköä. Ei ioneita Kun liuoksessa ei ole elektrolyyttejä, ei lamppu pala. Muutamia ioneita Kun liuoksessa on hieman elektrolyyttejä, lamppu palaa himmeästi. Runsaasti ioneita Kun liuoksessa on paljon elektrolyyttejä, lamppu palaa kirkkaasti. Määritelmä, kidevesi: Joidenkin suolojen vesiliuoksessa ionien ja vesimolekyylien väliset ioni-dipolisidokset ovat melko vahvoja, jolloin vesimolekyylit seuraavat ioneita niiden kiteytyessä. Tällöin vesimolekyylit jäävät suolan kiderakenteeseen sisään. Tällaista vettä sanotaan kidevedeksi ja se merkitään pistemerkinnällä (älä sekoita kertolaskun pisteeseen), esimerkiksi kuparisulfaatti CuSO 4 5 H 2 O. Eli yhtä kuparisulfaattiyksikköä kohti kiderakenteeseen on sitoutunut 5 kidevesimolekyyliä. Määritelmä: Hygroskooppinen aine on aine, jolla on kyky imeä vettä itseensä. Näitä aineita käytetään kuivattamaan ilmasta vesihöyryä. Määritelmä: Aineiden erilaiseen liukoisuuteen perustuvaa erotusmenetelmää kutsutaan uutoksi. Kuparisulfaatti on hygroskooppinen aine. 3
4 Ioniyhdisteen kaavan kirjoittaminen Kationi (+-merkkinen ioni) ennen anionia ( -merkkinen ioni)! Ioniyhdisteen nimeäminen Huomautus Orgaaniset suolat: CH 3 COONa natriumetanaatti (tai natriumasetaatti) ensin anioni CH 3 COO - ja sitten kationi Na +, eli juuri toisinpäin kuin epäorgaaniset suolat. Tai HCOOK Kaliummetanaatti, HCOO - -metanaattiioni (formiaatti-ioni) ja K + -kaliumioni. 4
5 KOVALENTTINEN SIDOS Sidoselektroniparin kaksi elektronia ovat lähtöisin sidokseen osallistuvilta atomeilta, yksi elektroni kummaltakin. Epämetalleista kovalenttisin sidoksin rakentuvia yhdisteitä kutsutaan molekyyleiksi. Kovalenttiset sidokset ovat vahvoja, joten sekä alkuainemolekyylit että yhdistemolekyylit ovat pysyviä rakenteita. Elektronegatiivisuus kuvaa siis sidoksen muodostumiseen osallistuvan alkuaineen kykyä vetää sidoselektroneja puoleensa. Kaikkein elektronegatiivisimmalla aineella, fluorilla, tämä kyky on suurin, χ F = 4,0. Kun elektronegatiivisuusarvojen erotus on 0 0,5 on kyseessä pooliton kovalenttinen sidos. Kun 0,5 1,7, niin poolinen kovalenttinen sidos ja kun yli 1,7 niin ionisidos. Muista kuitenkin, ionisidos on metallin ja epämetallin välinen! 5
6 ERINOMAINEN KAAVIO! Avaruusrakenne Hiiliketjun avaruusrakenne pyrkii järjestäytymään siten, että kokonaisuus saavuttaa energiaminimin. Biologisissa tapahtumissa molekyylit tunnistavat toisensa avaruusrakenteen perusteella. Kun hiili muodostaa neljä yksinkertaista sidosta, ne suuntautuvat avaruudessa tetraedrisesti. 6
7 MOLEKYYLIN POOLISUUS Molekyylin poolisuuteen/poolittomuuteen vaikuttaa poolisten/ poolittomien sidosten lisäksi molekyylin koko ja symmetria: - Jos molekyylissä on vain yksi sidos, niin molekyyli on poolinen/ pooliton sen mukaan onko sidos poolinen / pooliton. - Molekyyli on pooliton, jos siinä on vain poolittomia sidoksia. - Nettodipoli häviää täysin symmetrisissä molekyyleissä. Myös funktionaalinen ryhmä (2.-kurssi) kuten koko molekyyli voi olla poolinen tai pooliton. Puhutaan myös nettodipolista. 7
8 8
HEIKOT SIDOKSET. Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
MUUTOKSET ELEKTRONI- RAKENTEESSA
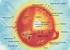 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
SIDOKSET. Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
Kvanttimekaaninen atomimalli. "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman
 Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Johdantoa/Kertausta. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
Heikot sidokset voimakkuusjärjestyksessä: -Sidos poolinen, kun el.neg.ero on 0,5-1,7. -Poolisuus merkitään osittaisvarauksilla
 Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
Orgaanisten yhdisteiden rakenne ja ominaisuudet
 Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
1. ELEKTRONIEN ENERGIA
 1. ELEKTRONIEN ENERGIA Pääkvanttiluku Bohrin atomimallin mukaan elektronit asettuvat atomissa energiatasoille n=1,2,3,4,... (ns. päätasot) Tason järjestyslukua kutsutaan pääkvanttiluvuksi n. Mitä kauempana
1. ELEKTRONIEN ENERGIA Pääkvanttiluku Bohrin atomimallin mukaan elektronit asettuvat atomissa energiatasoille n=1,2,3,4,... (ns. päätasot) Tason järjestyslukua kutsutaan pääkvanttiluvuksi n. Mitä kauempana
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017
 CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
KE1 Kemiaa kaikkialla
 Kalle Lehtiniemi ja Leena Turpeenoja 1 KE1 Kemiaa kaikkialla HELSINGISSÄ KUSTANNUSOSAKEYHTIÖ OTAVA otavan asiakaspalvelu Puh. 0800 17117 asiakaspalvelu@otava.fi tilaukset Kirjavälitys Oy Puh. 010 345 1520
Kalle Lehtiniemi ja Leena Turpeenoja 1 KE1 Kemiaa kaikkialla HELSINGISSÄ KUSTANNUSOSAKEYHTIÖ OTAVA otavan asiakaspalvelu Puh. 0800 17117 asiakaspalvelu@otava.fi tilaukset Kirjavälitys Oy Puh. 010 345 1520
Puhdasaine Seos Aineen olomuodot
 1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
KE2 KURSSIKOE 4/2014 Kastellin lukio
 KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Luento 1: Sisältö. Vyörakenteen muodostuminen Molekyyliorbitaalien muodostuminen Atomiketju Energia-aukko
 Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
2. Maitohapon CH3 CH(OH) COOH molekyylissä
 1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
Chem-C2400 Luento 2: Kiderakenteet Ville Jokinen
 Chem-C2400 Luento 2: Kiderakenteet 11.1.2019 Ville Jokinen Oppimistavoitteet Metalli-, ioni- ja kovalenttinen sidos ja niiden rooli metallien ja keraamien kiderakenteissa. Metallien ja keraamien kiderakenteen
Chem-C2400 Luento 2: Kiderakenteet 11.1.2019 Ville Jokinen Oppimistavoitteet Metalli-, ioni- ja kovalenttinen sidos ja niiden rooli metallien ja keraamien kiderakenteissa. Metallien ja keraamien kiderakenteen
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
Metallien sähkökemiallisen jännitesarjan opettaminen draaman avulla yläasteella
 Metallien sähkökemiallisen jännitesarjan opettaminen draaman avulla yläasteella Tarvittavat ennakkotiedot ja käsitteet: Atomi, anioni, kationi, atomien yleisimmät hapetustilat, metallien jännitesarja,
Metallien sähkökemiallisen jännitesarjan opettaminen draaman avulla yläasteella Tarvittavat ennakkotiedot ja käsitteet: Atomi, anioni, kationi, atomien yleisimmät hapetustilat, metallien jännitesarja,
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
Liukeneminen 31.8.2016
 Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
ATOMIN ELEKTRONIVERHO
 2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella
2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella
CHEM-A1200 Kemiallinen rakenne ja sitoutuminen
 CHEM-A1200 Kemiallinen rakenne ja sitoutuminen Orgaaninen reaktio Opettava tutkija Pekka M Joensuu Orgaaniset reaktiot Syyt Pelkkä törmäys ei riitä Varaukset (myös osittaisvaraukset) houkuttelevat molekyylejä
CHEM-A1200 Kemiallinen rakenne ja sitoutuminen Orgaaninen reaktio Opettava tutkija Pekka M Joensuu Orgaaniset reaktiot Syyt Pelkkä törmäys ei riitä Varaukset (myös osittaisvaraukset) houkuttelevat molekyylejä
VESI JA VESILIUOKSET
 VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Kemialliset sidokset lukion kemian opetuksessa
 Kemialliset sidokset lukion kemian opetuksessa Linda Gustafsson Pro gradu -tutkielma 4.9.2007 Kemian opettajan suuntautumisvaihtoehto Kemian koulutusohjelma Matemaattis-luonnontieteellinen tiedekunta Helsingin
Kemialliset sidokset lukion kemian opetuksessa Linda Gustafsson Pro gradu -tutkielma 4.9.2007 Kemian opettajan suuntautumisvaihtoehto Kemian koulutusohjelma Matemaattis-luonnontieteellinen tiedekunta Helsingin
KERTAUSTA 1.-KURSSISTA
 KERTAUSTA 1.-KURSSISTA Atomin rakenne 1. Atomin päärakenneosat ovat elektronit, protonit ja neutronit. 2. Positiivisesti varautuneet protonit ja varauksettomat neutronit muodostavat atomin ytimen. 3. Negatiivisesti
KERTAUSTA 1.-KURSSISTA Atomin rakenne 1. Atomin päärakenneosat ovat elektronit, protonit ja neutronit. 2. Positiivisesti varautuneet protonit ja varauksettomat neutronit muodostavat atomin ytimen. 3. Negatiivisesti
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Työ 6/s.174-175 Tutustu työn 6 työohjeeseen, siten että osaat toimia sujuvasti sen mukaan ja kysyä asioista joita et ymmärtänyt/osaa
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Työ 6/s.174-175 Tutustu työn 6 työohjeeseen, siten että osaat toimia sujuvasti sen mukaan ja kysyä asioista joita et ymmärtänyt/osaa
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA
 MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
Reaktioyhtälö. Sähköisen oppimisen edelläkävijä www.e-oppi.fi. Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava
 Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Kiinteiden materiaalien rakenne
 Kiinteiden materiaalien rakenne Ketelaarin diagrammi Fajansin säännöt: (1) Sidoksen polaarisuus pienenee kationin koon pienentyessä tai varauksen kasvaessa () Sidoksen polaarisuus pienenee anionin koon
Kiinteiden materiaalien rakenne Ketelaarin diagrammi Fajansin säännöt: (1) Sidoksen polaarisuus pienenee kationin koon pienentyessä tai varauksen kasvaessa () Sidoksen polaarisuus pienenee anionin koon
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
CHEM-A1250 Luento 3 Sidokset (jatkuu) + kemiallinen reaktio
 CHEM-A1250 Luento 3 Sidokset (jatkuu) + kemiallinen reaktio Eeva-Leena Rautama Elektronien vastaanottaminen, luovuttaminen ja jakaminen Pääsääntöisesti kemiallisten sidosten muodostumista Sitoutumisella
CHEM-A1250 Luento 3 Sidokset (jatkuu) + kemiallinen reaktio Eeva-Leena Rautama Elektronien vastaanottaminen, luovuttaminen ja jakaminen Pääsääntöisesti kemiallisten sidosten muodostumista Sitoutumisella
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering, Micro- and Nanosciences Laboratory. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
1-12 R1-R3. 21, 22 T4 Tutkielman palautus kurssin lopussa (Työ 2 ja Työ 3), (R4-R6) Sopii myös itsenäiseen opiskeluun Työ 4 R7 - R8
 I Aineet ympärillämme 1 Kemia on 1x75 min tai 1-12 R1-R3 Kemia 1 kurssiin tutustumisen voi aloittaa Pohditehtävällä, jonka jälkeen opiskelijat tekevät ryhmissä yhden tehtävistä R1-R3 (tietokoneet). Oheismateriaali:
I Aineet ympärillämme 1 Kemia on 1x75 min tai 1-12 R1-R3 Kemia 1 kurssiin tutustumisen voi aloittaa Pohditehtävällä, jonka jälkeen opiskelijat tekevät ryhmissä yhden tehtävistä R1-R3 (tietokoneet). Oheismateriaali:
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Lukion kemian OPS 2016
 Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta - yhdisteryhmät KE2-kurssiin
Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta - yhdisteryhmät KE2-kurssiin
Jaksollinen järjestelmä
 Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
3.1 Sidostyyppejä ja reaktiotyyppejä. Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa
 3.1 Sidostyyppejä ja reaktiotyyppejä Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa Jos kahden aineen välinen elektronegatiivisuusero on riittävän suuri (>1,7), on se ionisidos. Jos
3.1 Sidostyyppejä ja reaktiotyyppejä Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa Jos kahden aineen välinen elektronegatiivisuusero on riittävän suuri (>1,7), on se ionisidos. Jos
Kemia keskeinen luonnontiede
 KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
Liukoisuus
 Liukoisuus REAKTIOT JA TASAPAINO, KE5 Kertausta: Eri suolojen liukeneminen veteen on tärkeä arkipäivän ilmiö. Yleensä suolan liukoisuus veteen kasvaa, kun lämpötila nousee. Tosin esimerkiksi kalsiumkarbonaatti,
Liukoisuus REAKTIOT JA TASAPAINO, KE5 Kertausta: Eri suolojen liukeneminen veteen on tärkeä arkipäivän ilmiö. Yleensä suolan liukoisuus veteen kasvaa, kun lämpötila nousee. Tosin esimerkiksi kalsiumkarbonaatti,
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Siirtymämetallien erityisominaisuuksia
 Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
c) Nimeä kaksi alkuainetta, jotka kuuluvat jaksollisessa järjestelmässä samaan ryhmään kalsiumin kanssa.
 Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Reaktiomekanismi. Tänä päivänä hyödynnetään laskennallista kemiaa reaktiomekanismien määrittämisessä/selvittämisessä!
 REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
c) Mitkä alkuaineet ovat tärkeitä ravinteita kasveille?
 ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
Helsingin yliopiston kemian valintakoe. Keskiviikkona klo Vastausselvitykset: Tehtävät:
 1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Kiteet kimpaleiksi (Veli-Matti Ikävalko)
 Kiteet kimpaleiksi (Veli-Matti Ikävalko) VINKKEJÄ OPETTAJALLE: Työ voidaan suorittaa 8 luokalla ionisidosten yhteydessä. Teoria ja kysymysosa osa voidaan suorittaa kotitehtävänä. Kirjallisuudesta etsimiseen
Kiteet kimpaleiksi (Veli-Matti Ikävalko) VINKKEJÄ OPETTAJALLE: Työ voidaan suorittaa 8 luokalla ionisidosten yhteydessä. Teoria ja kysymysosa osa voidaan suorittaa kotitehtävänä. Kirjallisuudesta etsimiseen
ATOMIHILAT. Määritelmä, hila: Hilaksi sanotaan järjestelmää, jossa kiinteän aineen rakenneosat ovat pakkautuneet säännöllisesti.
 ATOMIHILAT KEMIAN MIKRO- MAAILMA, KE2 Määritelmä, hila: Hilaksi sanotaan järjestelmää, jossa kiinteän aineen rakenneosat ovat pakkautuneet säännöllisesti. Hiloja on erilaisia. Hilojen ja sidosten avulla
ATOMIHILAT KEMIAN MIKRO- MAAILMA, KE2 Määritelmä, hila: Hilaksi sanotaan järjestelmää, jossa kiinteän aineen rakenneosat ovat pakkautuneet säännöllisesti. Hiloja on erilaisia. Hilojen ja sidosten avulla
Kondensaatio ja hydrolyysi
 Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Metallit materiaaleina. kappale 4
 Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Lukiolaisten käsityksiä aineen rakenteesta
 Lukiolaisten käsityksiä aineen rakenteesta Pro gradu-tutkielma Jyväskylän yliopisto Kemian laitos Opettajankoulutuslinja 12.1.2007 Jari-Petteri Juhani Kautto Tiivistelmä Kautto, Jari-Petteri Juhani. Pro
Lukiolaisten käsityksiä aineen rakenteesta Pro gradu-tutkielma Jyväskylän yliopisto Kemian laitos Opettajankoulutuslinja 12.1.2007 Jari-Petteri Juhani Kautto Tiivistelmä Kautto, Jari-Petteri Juhani. Pro
Bentseeni on vaikeasti reagoiva yhdiste. Bentseeni on avaruusrakenteeltaan tasomainen. Bentseenin
 Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Keskiviikko 24.5.2017 VASTAA TEHTÄVIIN 1 3 JA KAHTEEN TEHTÄVÄÄN TEHTÄVISTÄ 4 6! MAOL JA LASKINOHJELMISTOT OVAT SALLITTUJA! Sievin lukio
Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Keskiviikko 24.5.2017 VASTAA TEHTÄVIIN 1 3 JA KAHTEEN TEHTÄVÄÄN TEHTÄVISTÄ 4 6! MAOL JA LASKINOHJELMISTOT OVAT SALLITTUJA! Sievin lukio
Lukion kemian OPS 2016
 Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. Keskeiset sisällöt muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta
Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. Keskeiset sisällöt muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta
SÄHKÖMAGNETISMI: kevät 2017
 SÄHKÖMAGNETISMI: kevät 2017 Viikko Aihe kirjan luku Viikko 1 Sähköken>ä, pistevaraukset 14 Viikko 2 Varausjakauman sähköken>ä 16 Viikko 2 Sähköinen poteniaalienergia ja poteniaali 17 Viikko 3 Sähköken>ä
SÄHKÖMAGNETISMI: kevät 2017 Viikko Aihe kirjan luku Viikko 1 Sähköken>ä, pistevaraukset 14 Viikko 2 Varausjakauman sähköken>ä 16 Viikko 2 Sähköinen poteniaalienergia ja poteniaali 17 Viikko 3 Sähköken>ä
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
RAPORTTI. Kemian mallit ja visualisointi. Raportti. Elina Rautapää. Piia Tikkanen
 RAPORTTI Kemian mallit ja visualisointi Raportti Elina Rautapää Piia Tikkanen 1 Johdanto Mallinnusharjoitusta suunniteltiin 5. luokan opetussuunnitelman perusteisiin pohjautuen. Opettajaa konsultoitiin
RAPORTTI Kemian mallit ja visualisointi Raportti Elina Rautapää Piia Tikkanen 1 Johdanto Mallinnusharjoitusta suunniteltiin 5. luokan opetussuunnitelman perusteisiin pohjautuen. Opettajaa konsultoitiin
Workshop: Tekniikan kemia OAMK:ssa
 1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU 2012 Workshop: Tekniikan kemia OAMK:ssa Miksi betonissa rauta ruostuu ulkopuolelta ja puussa sisäpuolelta? Rautatanko betonissa:
1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU 2012 Workshop: Tekniikan kemia OAMK:ssa Miksi betonissa rauta ruostuu ulkopuolelta ja puussa sisäpuolelta? Rautatanko betonissa:
Keraamit ja komposiitit
 Keraamit ja komposiitit MATERIAALIT JA TEKNOLOGIA, KE4 Määritelmä, keraami: Keraami on yleisnimitys materiaaleille, jotka valmistetaan polttamalla savipohjaista (alumiinisilikaatti) ainetta kovassa kuumuudessa.
Keraamit ja komposiitit MATERIAALIT JA TEKNOLOGIA, KE4 Määritelmä, keraami: Keraami on yleisnimitys materiaaleille, jotka valmistetaan polttamalla savipohjaista (alumiinisilikaatti) ainetta kovassa kuumuudessa.
Liittymis- eli additioreaktio Määritelmä, liittymisreaktio:
 Liittymis- eli additioreaktio Määritelmä, liittymisreaktio: REAKTIOT JA ENERGIA, KE3 Liittymis- eli additioreaktiossa molekyyliin, jossa on kaksois- tai kolmoissidos, liittyy jokin toinen molekyyli. Reaktio
Liittymis- eli additioreaktio Määritelmä, liittymisreaktio: REAKTIOT JA ENERGIA, KE3 Liittymis- eli additioreaktiossa molekyyliin, jossa on kaksois- tai kolmoissidos, liittyy jokin toinen molekyyli. Reaktio
