Puhdasaine Seos Aineen olomuodot
|
|
|
- Ilmari Härkönen
- 7 vuotta sitten
- Katselukertoja:
Transkriptio
1 1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu keskenään samanlaisista atomien yhteenliittymistä (molekyyleistä tai ioneista) Esim. vesi H 2 O, ruokasuola NaCl. Yhdisteellä on kemiallinenkaava. Seos Seos koostuu kahdesta tai useammasta aineesta. Seos voi olla homogeeninen tai heterogeeninen. Homogeeninen seos on tasakoosteinen. Esim. ilma ja liuokset. Heterogeenisessa seoksessa sekoittuneiden aineiden rajapinnat voidaan havaita. Esim. liete. Aineen olomuodot Aineella on kolme olomuotoa: kiinteä, neste ja kaasu. kts. olomuodon muutokseen liittyvät termit kirjasta s. 17. Kemiallisessa reaktiossa aine muuttuu toiseksi aineeksi Fysikaalisessa muutoksessa aine pysyy samana, mutta fysikaaliset ominaisuudet (tiheys, olomuoto, lämpötila) muuttuvat. 1
2 2 2. ATOMI Atomi on aineen pienin rakenneosa. Atomin pääosat ovat ydin ja elektroniverho. Ytimessä ovat pos. varautuneet protonit p + ja varauksettomat neutronit n 0 Elektroniverhossa ydintä kiertävät neg. varautuneet elektronit e. Ydin määrää atomin massan ja elektroniverho kemialliset ominaisuudet. Hiukkasten lukumäärä Protonien määrä=elektronien määrä=aineen järjestysluku. Protonien ja neutronien määrä= massaluku 14 6 C Isotooppi on saman alkuaineen erimassainen atomi. Esimerkiksi vedyllä on kolme isotooppia, jotka eroavat toisistaan neutronien lukumäärän mukaan tavallinen vety eli pronium 1 1H deuterium 2 1H tritium 3 1H Aineen isotoopeilla kemialliset ominaisuudet säilyvät, koska elektronirakenne isotoopeilla on sama. Atomimassa Atomien massat ovat pieniä ja siksi massat ilmoitetaan atomimassayksikön avulla. Atomimassayksikkö on 1u = 1, kg Sopimuksen mukaan hiili-12 isotoopin 12 6 C massa on tasan 12u. Alkuaineiden atomimassat lasketaan alkuaineen luonnossa esiintyvän isotooppiseoksen mukaan. Elektroniverho Elektroniverhossa elektronit asettuvat energiatasoille (n=1-7) eli kuorille (K, L, M, N...) Mitä kauempana energiataso on ytimestä sitä suurempi energia elektronilla on. Energiatasolle n mahtuu 2n 2 elektronia.
3 Uloimmalla kuorella olevia elektroneita sanotaan ulko- eli valenssielektroneiksi. Atomit pyrkivät oktettiin eli saamaan uloimmalle kuorelleen kahdeksan elektronia. Ulkoelektronit määräävät aineen kemiallisen ominaisuudet. Ulkoelektroneita voidaan merkitä piste- tai viivamerkinnällä. N Ċ Ö N Ċ Ō Jaksollinen järjestelmä Jaksollisessa järjestelmässä aineet ovat kasvavan järjestysluvun mukaisessa järjestyksessä. Jaksollisen järjestelmän perusteella voit päätellä aineen metallisuus (metalli, epämetalli, puolimetalli) tai aineen ominaisuuksia. 3 Ryhmät Pystysarakkeet ovat ryhmiä Ryhmän ykkösiä osoittava numero kertoo atomin ulkoelektronien määrän. Ryhmät 1, ovat pääryhmiä, joilla on kullakin oma nimi. (Kts. kirja s. 23) Väliin jäävät sivuryhmät. Ryhmän alkuaineiden kemialliset ominaisuudet ovat samanlaiset. Jaksot Vaakarivit ovat jaksoja. Jakson järjestysluku kertoo käytössä olevien energiatasojen määrän.
4 4 3. ATOMEISTA YHDISTEIKSI Atomit muodostavat molekyylejä ja ioneja pyrkiessään saamaan itselleen oktetti rakenteen. Yhdisteissä molekyylien ja ionien välillä esiintyy heikkoja ja vahvoja sidoksia. Vahvat sidokset pitävät molekyylien tai ionien atomeja yhdessä. Heikot sidokset ovat molekyylien tai ionien välisiä voimia. Elektronegatiivisuus Elektronegatiivisuus kertoo aineen kyvyn vetää elektroneja puoleensa. Epämetalleilla on suuri elektronegatiivisuus eli ne vastaanottavat helposti elektroneja. Metalleilla on pieni elektronegatiivisuus eli ne luovuttavat helposti elektroneja. Atomien välisen eletronegatiivisuusarvojen erotuksen χ avulla voidaan päätellä yhdisteen sidostyyppi Jos χ > 1, 7, muodostuu ionissidos Jos χ < 1, 7, muodostuu molekyylisidos. Elektronegatiivisuus χ kasvaa ryhmässä alhaalta ylöspäin ja jaksossa vasemmalta oikealle. (Fluorilla suurin χ = 4, 0) Ionisidos Ioni on varauksellinen atomi, joka syntyy atomin pyrkiessä oktettiin. Metalliatomin luovuttaessa elektroneja syntyy positiivinen ioni eli kationi. Na Na + + e Mg Mg e Epämetalliatomin vastaanottaessa elektroneja syntyy negatiivinen ioni anioni. O + 2e O 2 F + e F Luovutettavien/vastaanotettavien elektronien määrän voi päätellä jaksollisen järjestelmän avulla.
5 Ionien välinen sähköinen vetovoima eli ionisidos saa ionit pysymään yhdessä. 5 Kaavan kirjoittaminen Nimessä kationi ennen anionia. Kaavassa varausten summan oltava nolla. Natriumoksidin muodostuminen 2Na + + O 2 Na 2 O Kovalenttinen sidos Epämetalliatomit muodostavat välilleen elektronipareja pyrkiessään oktettiin. Elektronipari syntyy, kun kaksi atomia jakavat kaksi elektronia keskenään. Atomin viivamallissa vapaat, parittomat elektronit voivat muodostaa elektronipareja. Elektronipareja voi muodostua atomien välille yksi, kaksi tai kolme. Kovalenttiset sidokset ovat vahvoja. Esim Typpi N 2 on erittäin passiivinen kaasu.
6 6 4. HIILIYHDISTEIDEN KEMIAA ELI ORGAANISTA KEMIAA Elollisen luonnon yhdisteet ovat hiilen yhdisteitä. Hiilen muodostamia yhdisteitä tunnetaan miljoonia. Hiili voi muodostaa pitkiä kestäviä hiiliketjuja, joissa hiilet sitoutuvat toisiinsa kovalenttisilla sidoksilla. Lisäksi ketjuihin voi liittyä vetyä, happea, typpeä, fosforia, rikkiä ja halogeenejä. Hiilirungot Hiili atomi voi muodostaa neljä kovalenttista sidosta. Yksinkertaisimmat hiilen yhdisteet hiilivedyt sisältävät vain hiiltä ja vetyä. Hiilivetyjen nimen etuliite tulee hiilien lukumäärän mukaan ja loppupääte -aani, -eeni tai -yyni määräytyy hiiliatomien välisten sidosten mukaan. Jos hiilestä lähtee vain yksinkertaisia sidoksia, saa hiili tetraedrisen rakenteen, jossa kaikki sidoskulmat ovat 109, 5. Jos hiilestä lähtee kaksoisidos, on rakenne tasomainen ja sidoskulmat 120. Jos hiilestä lähtee kolmoisidos, on rakenne lineaarinen ja sidoskulmat 180.
7 Rakenteiden esitystapoja Molekyylikaava Molekyylikaava ilmoittaa aineen atomit, mutta ei voida nähdä isomeriaa. Atomit yleensä aakkosjärjestyksessä. 7 Rakennekaava Ilmoittaa atomien väliset sidokset. Voidaan käyttää tiivistettyä rakennekaavaa tai viivakaavaa tai näiden yhdistelmää. Hiilirungot Ketjurakenteiset eli avoketjuiset hiilivedyt. Sykliset eli rengasrakenteiset hiilivedyt. Tyydyttyneet hiilivedyt sisältävät vain yksinkertaisia hiili-hiili-sidoksia. Tyydyttymättömät hiilivedyt sisältävät kaksois- tai kolmoissidoksia hiiliten välillä. Aromaattiset hiilivedyt sisältävät bentseenirenkaan, jossa kaksoissidokset delokalisoituvat. Funktionaaliset ryhmät Hiilivetyketjuun voi liittyä erilaisia funktionaalisia ryhmiä. Funktionaaliset ryhmät määräävät yhdisteen kemialliset ominaisuudet. katso kirja s Nimeäminen (1) Etsi pisin hiiliketju. Funktionaalinen ryhmä määrää nimen loppuosan. (2) Numeroi ketju, niin että funktionaalinen ryhmä ja sivuryhmät saavat mahd. pienet numerot. (3) Nimeä sivuryhmät ja niiden paikat. Eetterien nimeäminen Nimeä happeen liittyneet hiiliketjut aakkosjärjestyksessä sivuryhminä ja lisää loppuun pääte -eetteri. Esterien nimeäminen Nimeä kaksoissidokselliseen happeen liittynyt hiiliketju happona ja toinen pää sivuryhmänä ja loppuun pääte -esteri.
8 8 Amiinien nimeäminen Nimeä vedyt korvanneet hiilivetyryhmät aakkosjärjestyksessä sivuryhminä ja loppuun pääte -amiini.
9 Poolinen ja pooliton molekyyli Sidos on poolinen, jos toinen sidoksen molekyyleistä on elektronegatiivisempi kuin toinen. Poolisuus kuvaa sidoksen osittaista sähköistä varausta, joka aiheutuu sidoselektronien siirtymisestä kohti elektronegatiivisempaa atomia. Jos elektronegatiivisuus ero λ > 1, 7, elektronit siirtyvät täydellisesti ja syntyy ionisidos. Hiiliyhdisteissä hiili-hiili ja hiili-vety sidokset ovat poolittomia, mutta hiilityppi, hiili-happi jne. sidokset poolisia. Molekyyli on pooliton, jos kaikki sidokset ovat poolittomia. Molekyyli on poolinen, jos jokin sen sidoksista on poolinen. Molekyylin symmetria voi josku kumota poolisuuden. Jos molekyylissä pooliton osa on suuri verrattuna pooliseen osaan, on molekyyli pooliton. 9
10 10 Ainemäärä 5. AINEMÄÄRÄ JA LIUOKSEN PITOISUUS Reaktiot tapahtuvat aineiden rakenneosien välillä ja siksi rakenneosien määrien laskeminen on reaktiossa tärkeää. Aineen rakenne osia ovat atomit, molekyylit tai ionit. Ainemäärää n mitataan mooleina mol. Yksi mooli ainetta sisältää Avogadron luvun N A = 6, mol verran rakenneosia. Jos aineen rakenneosia on N kappaletta, on ainetta ainemäärä n = N N A. Moolimassa Aineen atomimassa kertoo, kuinka paljon 1 mol aineen atomeita painaa grammoina. Yhdisteen moolimassa saadaan yhdisteen atomien atomimassojen summana. Moolimassan tunnus on M ja yksikkö g/mol. Samalla ainemäärällä kahta eri ainetta on eri massat, koska atomimassat ovat erilaiset. Aineen massan m, moolimassan M ja ainemäärän n välillä on yhteys n = m M. Liuoksen pitoisuus Konsentraatio c (mol/l = mol/dm 3 ) ilmoittaa liuenneen aineen ainemäärän n liuoksessa (tilavuus V ) c = n V.
11 11 6. HEIKOT SIDOKSET Heikot sidokset ovat atomien, ionien ja molekyylien välisiä sidoksia. Heikot sidokset vaikuttavat aineen olomuotoon ja sulamis- ja kiehumispisteisiin. Tarkastellaan heikkoja sidoksia heikoimmasta vahvimpaan. Dispersio voimat Dispersio voimia esiintyy poolittomien molekyylien välillä. Sidokset ovat sitä vahvempia mitä suurempi atomimassa molekyyleillä on. Dipoili-dipoili-sidokset Dipoli-dipoli-sidos syntyy poolisten molekyylien välille, kun molekyylin osittaisvaraukset vetävät toisiaan puoleensa. Erikois tapauksena syntyy vahva vety-sidos, jos molekyylin vety on kiinnittynyt happeen, typpeen tai fluoriin. mm. vesi, karboksyylihapot, amiinit ja amidit muodostavat vetysidoksia. Ioni-dipolisidos Poolisen molekyylin ja ioni välille voi syntyä ioni-dipolisidos. Esim. Natriumkloridi vedessä. Liukeneminen Pooliset yhdisteet liukenevat poolisiin liuottimiin ja poolittomat yhdisteet poolittomiin liuottimmiin. Esim. ruokasuola ja sokeri liukenevat veteen, mutta eivät heksaaniin. Poolisia liuottimia ovat vesi, etanoli, metanoli. Poolittomia liuottimia ovat heksaani (bensiini), tolueeni ja dietyylieetteri. Jos molekyylin pooliton osa on suuri verrattuna pooliseen osaan liukeneminen pooliseen liuottimeen vähenee.(vrt. rasvat ja vahat)
12 12 7. ALKOHOLIT Alkohit syntyvät, kun yksi tai useampi hiilivedyn vedyistä korvautuu hydroksyyliryhmällä -OH. Alkoholit nimetään lisäämäällä hiilivetyketjun loppuun pääte -anoli. Jos OH-ryhmä on yhdisteen sivuryhmä, se saa nimen hydroksi. Kun OH-ryhmä liittyy suoraan bentseenirenkaaseen syntyy fenoli. Arkielämän alkoholeja ovat metanoli, etanoli, ksylitoli, glyseroli, glykoli, sorbitoli. Jos hiilivetyyn liittyy useampi hydroksyyliryhmä, puhutaan moniarvoisista alkoholeista. Esim. Ksylitoli on viisiarvoinen alkoholi. Alkoholit ovat primäärisiä, sekundäärisiä tai tertiäärisiä. Primäärisessä alkoholissa hiilessä, johon OH-ryhmä on kiinnittynyt, on lisäksi kaksi vetyä, sekundäärisessä yksi vety ja tertiäärisessä ei yhtään. 8. EETTERIT Eettereissä kaksi hiilivetyketjua liittyy happisillalla toisiinsa. Nimeämisessä merkitään hiilivetyketjut sivuryhminä aakkosjärjestyksessä ja loppuun lisätään eetteri. Eetterit ovat vain heikosti poolisia, joten niitä käytetään liuottamaan poolittomia yhdisteitä. 9. AMIINIT Amiinit ovat ammoniakin NH 3 johdannaisia. Amiineissa yksi tai useampi ammoniakin vedyistä korvautuu hiiliketjulla. Yksinkertaiset amiinit nimetään ilmoittamalla sivuryhmät ja lisäämällä loppuun amiini. Sivuryhmänä NH 2 -ryhmä on aminoryhmä. Amiinit voidaan luokitella kuten alkoholit primäärisiin, sekundäärisiin ja tertiäärisiin typessä kiinni olevien vetyjen mukaan. Amiinit ovat pahan hajuisia.
13 KARBONYYLIYHDISTEET Karbonyyliyhdisteet sisältävät karbonyyliryhmä -C=O. Karbonyyliyhdisteitä ovat karboksyylihapot, aldehydit, ketonit, esterit ja amidit. Aldehydit Aldehydeissä karbonyyliryhmään liittyy vety ja hiilivetyketju. Aldehydit nimetään lakemalla hiilivetyketjun hiilet (karbonyyliryhmän hiili mukaan lukien) ja lisätään loppuun -anaali. Fomaldehydi eli metanaali on bakteereja tuhoavaa ja siksi sitä käytetään desifiointiaineena. Ketonit Ketoneissa karbonyyliryhmään liittyy kaksi hiilivetyketjua. Ketonit nimetään myös laskemalla hiilivetyketjun pituus ja loppuun laitetaan pääte -anoni. Karbonyyliryhmän paikka ilmoitetaan numerolla. Asetoni eli propanoni on yleinen liuotin. Karboksyylihapot Karboksyylihapoilla karbonyyliryhmään on liittynyt -OH-ryhmä. Karboksyylihapot nimetään lisäämällä hiilketjun perään sana happo. Karboksyylihapot luovuttavat vesiliuoksessa protonin eli vety-ionin -OHryhmästä. Arkielämästä tuttuja karboksyylihappoja ovat muurahaishappo eli metaanihappo, etikka eli etaanihappo, sitruunahappo (sitrusheldelmät), oksaalihappo (ketunleipä) ja bentsoehappo (puolukka). Esterit Esterit syntyvät karboksyylihapon ja alkoholin reagoidessa. Esterit nimetään nimeämällä happeen liittynyt hiilivetyketju sivuryhmänä ja lisäämäällä karbonyyliryhmään kuuluvaan hiilivetyketjuun pääte -anaatti.
14 14 Esterit ovat hyvän tuoksuisia ja niitä käytetään mm. hajuvesissä ja aromiaineissa. Aminohapot Aminohapoissa karboksyylihapporyhmä -COOH ja aminoryhmä NH 2 ovat kiinittyneet samaan hiiliatomiin. Luonnossa esiintyy 20 aminohappoa. Kun aminohapot liittyvät toisiinsa peptidisidoksella syntyy proteiineja. 11. KEMIALLINEN REAKTIO Kemiallisessa reaktiossa lähtöaineista syntyy uusia aineita eli reaktio tuotteita. Jotta reaktio tapahtuisi on lähtöaineiden törmättävä toisiinsa, jolloin vanhoja sidoksia katkeaa ja uusia muodostuu. Törmäyksissä heikoimmat sidokset katkeavat helpoiten. Funktionaaliset ryhmät ovat hiiliyhdisteiden heikkoja kohtia. Reaktioihin liittyy aina myös energian muutoksia. Reaktion voi havaita saostumana, kuplimisena, värin muutoksena, palamisena. Hapettumis ja pelkistymisreaktiot Hiiliyhdisteen hapettuessa sen happiatomien lukumäärä kasvaa tai vetyatomien lukumäärä vähenee. Primääriset alkoholit hapettuvat aldehydeiksi ja edelleen karboksyylihapoiksi. Sekundääriset alkoholit hapettuvat ketoneiksi. Tertiäärinen alkoholi ei hapetu, koska siinä ei ole poistuvaa vetyä. Hapettava happi merkitään reaktionuolen päälle [O] Hiiliyhdisteen pelkistyessä sen vetyatomien lukumäärä kasvaa tai happiatomien lukumäärä vähenee. Karboksyylihapot pelkistyvät aldehydiksi ja edelleen alkoholiksi. Ketoniryhmä pelkistyy sekundääriseksi alkoholiksi. Pelkistävä vety merkitään reaktionuolen päälle [H]. Palaminen
15 Hiiliyhdisteen täydellisessä palamisreaktiossa syntyy vettä H 2 O ja hiilidioksidia CO 2. C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Epätäydellisessä palamisessa syntyy myös hiilimonoksidia CO 15 Happo-emäsreaktiot Happo on vetyionin H + eli protonin luovuttaja. Emäs on vetyionin H + eli protonin vastaanottaja. Karboksyylihapon OH-ryhmä luovuttaa vetyionin vedelle, jolloin syntyy happamuuden aiheuttava oksoniumioni H 3 O +. Karboksyylihapot (paitsi metaanihappo) ovat heikkoja happoja, joilloin vain osa niistä luovuttaa vetyioninsa. Vahvat hapot luovuttavat protoninsa täydellisesti. Esim. suolahappo HCl, rikkihappo H 2 SO 4. Fenolinen alkoholiryhmä voi luovuttaa vetyionin. Ammoniakin ja veden vesiliuos on emäksinen, koska ammoniakki ottaa vastaan vedeltä vetyionin. Syntyvät OH -ionit aiheuttavat liuoksen emäksisyyden. Metallihydroksidit (NaOH, Ca(OH) 2 ) liukenevat veteen metalli ja hydroksidiioneina, jolloin syntyvä liuos on emäksinen. Aminoryhmä -NH 2 on emäksinen ja voi ottaa vetyionin vastaan. Amfolyytti on aine joka voi toimia sekä happona että emäksenä. Esim. vesi ja aminohapot. Kahtaisionin voi muodostaa yhdiste, jossa on sekä happo että emäsryhmä. Esim. aminohapot.
16 16 Neutraloituminen Kun yhtäsuuret ainemäärät happoa ja emästä reagoi keskenään tapahtuu neturaloituminen, jossa syntyy vettä ja suolaa (ioniyhdiste). HCl + NaOH H 2 O + NaCl H 2 SO 4 + 2NaOH 2H 2 O + Na 2 SO 4 Vesi muodostuu vety- ja hydroksi-ionien reagoidessa. H + + OH H 2 O Suoloilla on korkeat sulamispisteet (ionisidos) ja ne liukenevat hyvin veteen (muodostuu ioni-dipolisidoksia).
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Orgaanisten yhdisteiden rakenne ja ominaisuudet
 Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
SIDOKSET. Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
MUUTOKSET ELEKTRONI- RAKENTEESSA
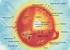 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA
 MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
Atomi. Aineen perusyksikkö
 Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
ATOMIN ELEKTRONIVERHO
 2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella
2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
8. Alkoholit, fenolit ja eetterit
 8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ORGAANINEN KEMIA. = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY
 ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
HEIKOT SIDOKSET. Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
KPL1 Hiili ja sen yhdisteet. KPL2 Hiilivedyt
 KPL1 Hiili ja sen yhdisteet 1. Mikä on hiilen kemiallinen kaava? C 2. Mitkä ovat hiilen 4 eri esiintymismuotoa? Miten ne eroavat toisistaan? Timantti, grafiitti, fullereeni, nanoputki. Eroavat rakenteelta
KPL1 Hiili ja sen yhdisteet 1. Mikä on hiilen kemiallinen kaava? C 2. Mitkä ovat hiilen 4 eri esiintymismuotoa? Miten ne eroavat toisistaan? Timantti, grafiitti, fullereeni, nanoputki. Eroavat rakenteelta
Lämpö- eli termokemiaa
 Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
Puhtaat aineet ja seokset
 Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Orgaanista kemiaa. Yhdistetyypit ja nimeäminen
 Orgaanista kemiaa Yhdistetyypit ja nimeäminen Molekyylikaava Termejä: molekyylikaava, bruttokaava, empiirinen kaava, suhdekaava Molekyylikaavan kirjoittaminen ensin hiilet, sitten vedyt näiden jälkeen
Orgaanista kemiaa Yhdistetyypit ja nimeäminen Molekyylikaava Termejä: molekyylikaava, bruttokaava, empiirinen kaava, suhdekaava Molekyylikaavan kirjoittaminen ensin hiilet, sitten vedyt näiden jälkeen
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
2. Täydennä seuraavat reaktioyhtälöt ja nimeä reaktiotuotteet
 /Tapio evalainen Loppukuulustelun..00 mallivastaukset. imi: vsk:. Piirrä karboksyylihapporyhmän ja aminoryhmän rakenteet ja piirrä näkyviin myös vapaat elektroniparit. soita mikä hybridisaatio karboksyyli-
/Tapio evalainen Loppukuulustelun..00 mallivastaukset. imi: vsk:. Piirrä karboksyylihapporyhmän ja aminoryhmän rakenteet ja piirrä näkyviin myös vapaat elektroniparit. soita mikä hybridisaatio karboksyyli-
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KE2 KURSSIKOE 4/2014 Kastellin lukio
 KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
Kemia keskeinen luonnontiede
 KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
2. Alkaanit. Suoraketjuiset alkaanit: etuliite+aani Metaani, etaani... Dekaani (10), undekaani, dodekaani, tridekaani, tetradekaani, pentadekaani..
 2. Alkaanit SM -08 Kaikkein yksinkertaisimpia orgaanisia yhdisteitä. Sisältävät vain hiiltä ja vetyä ja vain yksinkertaisia - sidoksia. Yleinen molekyylikaava n 2n+2 Alkaanit voivat olla suoraketjuisia
2. Alkaanit SM -08 Kaikkein yksinkertaisimpia orgaanisia yhdisteitä. Sisältävät vain hiiltä ja vetyä ja vain yksinkertaisia - sidoksia. Yleinen molekyylikaava n 2n+2 Alkaanit voivat olla suoraketjuisia
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
Orgaanisissa yhdisteissä on hiiltä
 Orgaaninen kemia 31 Orgaanisissa yhdisteissä on hiiltä Kaikki orgaaniset yhdisteet sisältävät hiiltä. Hiilen kemiallinen merkki on C. Usein orgaanisissa yhdisteissä on myös vetyä, typpeä ja happea. Orgaaniset
Orgaaninen kemia 31 Orgaanisissa yhdisteissä on hiiltä Kaikki orgaaniset yhdisteet sisältävät hiiltä. Hiilen kemiallinen merkki on C. Usein orgaanisissa yhdisteissä on myös vetyä, typpeä ja happea. Orgaaniset
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
VESI JA VESILIUOKSET
 VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
Jaksollinen järjestelmä
 Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Kaikki ympärillämme oleva aine koostuu alkuaineista.
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Kemian tehtävien vastaukset ja selitykset Lääketieteen ilmainen harjoituskoe, kevät 2017
 Kemian tehtävien vastaukset ja selitykset Lääketieteen ilmainen harjoituskoe, kevät 2017 Alla on esitetty vastaukset monivalintaväittämiin ja lyhyet perustelut oikeille väittämille. Tehtävä 3 A 2 B 5,8
Kemian tehtävien vastaukset ja selitykset Lääketieteen ilmainen harjoituskoe, kevät 2017 Alla on esitetty vastaukset monivalintaväittämiin ja lyhyet perustelut oikeille väittämille. Tehtävä 3 A 2 B 5,8
Reaktiomekanismi. Tänä päivänä hyödynnetään laskennallista kemiaa reaktiomekanismien määrittämisessä/selvittämisessä!
 REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
Näiden aihekokonaisuuksien opetussuunnitelmat ovat luvussa 8.
 9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
Kemia s10 Ratkaisut. b) Kloorin hapetusluvun muutos: +VII I, Hapen hapetusluvun muutos: II 0. c) n(liclo 4 ) = =
 1. 2. a) Yhdisteen molekyylikaava on C 6 H 10 : A ja E b) Yhdisteessä on viisi CH 2 yksikköä : D ja F c) Yhdisteet ovat tyydyttyneitä ja syklisiä : D ja F d) Yhdisteet ovat keskenään isomeereja: A ja E
1. 2. a) Yhdisteen molekyylikaava on C 6 H 10 : A ja E b) Yhdisteessä on viisi CH 2 yksikköä : D ja F c) Yhdisteet ovat tyydyttyneitä ja syklisiä : D ja F d) Yhdisteet ovat keskenään isomeereja: A ja E
10. Karbonyyliyhdisteet. Karboksyylihapot ja niiden johdannaiset
 10. Karbonyyliyhdisteet. Karboksyylihapot ja niiden johdannaiset Karboksyylihapot ja niiden johdannaiset ovat karbonyyliyhdisteitä, joilla on karbonyylihiileen liittynyt elektronegatiivinen atomi. Niillä
10. Karbonyyliyhdisteet. Karboksyylihapot ja niiden johdannaiset Karboksyylihapot ja niiden johdannaiset ovat karbonyyliyhdisteitä, joilla on karbonyylihiileen liittynyt elektronegatiivinen atomi. Niillä
12. Amiinit. Ammoniakki 1 amiini 2 amiini 3 amiini kvarternäärinen ammoniumioni
 12. Amiinit Amiinit ovat ammoniakin alkyyli- tai aryylijohdannaisia. e voivat olla primäärisiä, sekundäärisiä tai tertiäärisiä ja lisäksi ne voivat muodostaa kvaternäärisiä ammoniumioneja. Ammoniakki 1
12. Amiinit Amiinit ovat ammoniakin alkyyli- tai aryylijohdannaisia. e voivat olla primäärisiä, sekundäärisiä tai tertiäärisiä ja lisäksi ne voivat muodostaa kvaternäärisiä ammoniumioneja. Ammoniakki 1
Kondensaatio ja hydrolyysi
 Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Biomolekyylit ja biomeerit
 Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
c) Nimeä kaksi alkuainetta, jotka kuuluvat jaksollisessa järjestelmässä samaan ryhmään kalsiumin kanssa.
 Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Helsingin yliopiston kemian valintakoe. Keskiviikkona klo Vastausselvitykset: Tehtävät:
 1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
a) Puhdas aine ja seos b) Vahva happo Syövyttävä happo c) Emäs Emäksinen vesiliuos d) Amorfinen aine Kiteisen aineen
 1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
Alkuaineita luokitellaan atomimassojen perusteella
 IHMISEN JA ELINYMPÄRISTÖN KEMIAA, KE2 Alkuaineen suhteellinen atomimassa Kertausta: Isotoopin määritelmä: Saman alkuaineen eri atomien ytimissä on sama määrä protoneja (eli sama alkuaine), mutta neutronien
IHMISEN JA ELINYMPÄRISTÖN KEMIAA, KE2 Alkuaineen suhteellinen atomimassa Kertausta: Isotoopin määritelmä: Saman alkuaineen eri atomien ytimissä on sama määrä protoneja (eli sama alkuaine), mutta neutronien
Tehtävä 1. Valitse seuraavista vaihtoehdoista oikea ja merkitse kirjain alla olevaan taulukkoon
 Tehtävä 1. Valitse seuraavista vaihtoehdoista oikea ja merkitse kirjain alla olevaan taulukkoon A. Mikä seuraavista hapoista on heikko happo? a) etikkahappo b) typpihappo c) vetykloridihappo d) rikkihappo
Tehtävä 1. Valitse seuraavista vaihtoehdoista oikea ja merkitse kirjain alla olevaan taulukkoon A. Mikä seuraavista hapoista on heikko happo? a) etikkahappo b) typpihappo c) vetykloridihappo d) rikkihappo
Heikot sidokset voimakkuusjärjestyksessä: -Sidos poolinen, kun el.neg.ero on 0,5-1,7. -Poolisuus merkitään osittaisvarauksilla
 Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
1. ELEKTRONIEN ENERGIA
 1. ELEKTRONIEN ENERGIA Pääkvanttiluku Bohrin atomimallin mukaan elektronit asettuvat atomissa energiatasoille n=1,2,3,4,... (ns. päätasot) Tason järjestyslukua kutsutaan pääkvanttiluvuksi n. Mitä kauempana
1. ELEKTRONIEN ENERGIA Pääkvanttiluku Bohrin atomimallin mukaan elektronit asettuvat atomissa energiatasoille n=1,2,3,4,... (ns. päätasot) Tason järjestyslukua kutsutaan pääkvanttiluvuksi n. Mitä kauempana
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
sulfonihappoihin fenoleihin aldehydeihin amiineihin
 Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Sievin lukio Perjantai 25.5.2018 VASTAA YHTEENSÄ VIITEEN TEHTÄVÄÄN SITEN, ETTÄ OLET VASTANNUT TEHTÄVIIN 1-3! MAOL JA LASKINOHJELMISTOT OVAT
Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Sievin lukio Perjantai 25.5.2018 VASTAA YHTEENSÄ VIITEEN TEHTÄVÄÄN SITEN, ETTÄ OLET VASTANNUT TEHTÄVIIN 1-3! MAOL JA LASKINOHJELMISTOT OVAT
Liukeneminen 31.8.2016
 Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Kvanttimekaaninen atomimalli. "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman
 Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
3. Protolyysireaktiot ja vesiliuoksen ph
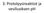 3. Protolyysireaktiot ja vesiliuoksen ph Happo Happo on protonin (H+) luovuttaja Esim. suolahappo (tässä vesi on emäs) Happo luovuttaa vetyionin ja syntyy oksoniumioni H₃O+ Maistuu happamalta, esim. karboksyylihapot
3. Protolyysireaktiot ja vesiliuoksen ph Happo Happo on protonin (H+) luovuttaja Esim. suolahappo (tässä vesi on emäs) Happo luovuttaa vetyionin ja syntyy oksoniumioni H₃O+ Maistuu happamalta, esim. karboksyylihapot
Yhdisteiden nimeäminen
 Yhdisteiden nimeäminen Binääriyhdisteiden nimeäminen 1. Ioniyhdisteet 2. Epämetallien väliset yhdisteet Kompleksiyhdisteiden nimeäminen Kemiallinen reaktio 1. Reaktioyhtälö 2. Määrälliset laskut 3. Reaktionopeuteen
Yhdisteiden nimeäminen Binääriyhdisteiden nimeäminen 1. Ioniyhdisteet 2. Epämetallien väliset yhdisteet Kompleksiyhdisteiden nimeäminen Kemiallinen reaktio 1. Reaktioyhtälö 2. Määrälliset laskut 3. Reaktionopeuteen
KEMIAN MIKROMAAILMA, KE2 VESI
 VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
Kemian perusteet farmasiassa osa II: orgaaniset yhdisteet/tapio Nevalainen Loppukuulustelu b) ketoni
 /Tapio evalainen Loppukuulustelu 16.1.05 imi: vsk: 1. Laadi rakennekaava ja anna nimi seuraavien yhdisteryhmien moolimassaltaan pienimmälle yhdisteelle: a) esteri, b) ketoni, c) amiini, d) tyydyttymätön
/Tapio evalainen Loppukuulustelu 16.1.05 imi: vsk: 1. Laadi rakennekaava ja anna nimi seuraavien yhdisteryhmien moolimassaltaan pienimmälle yhdisteelle: a) esteri, b) ketoni, c) amiini, d) tyydyttymätön
Liittymis- eli additioreaktio Määritelmä, liittymisreaktio:
 Liittymis- eli additioreaktio Määritelmä, liittymisreaktio: REAKTIOT JA ENERGIA, KE3 Liittymis- eli additioreaktiossa molekyyliin, jossa on kaksois- tai kolmoissidos, liittyy jokin toinen molekyyli. Reaktio
Liittymis- eli additioreaktio Määritelmä, liittymisreaktio: REAKTIOT JA ENERGIA, KE3 Liittymis- eli additioreaktiossa molekyyliin, jossa on kaksois- tai kolmoissidos, liittyy jokin toinen molekyyli. Reaktio
2. Maitohapon CH3 CH(OH) COOH molekyylissä
 1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
Johdantoa/Kertausta. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 22.1.2015 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 22.1.2015 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Määritelmät. Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin
 Hapot ja emäkset Määritelmät Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin Happo-emäsreaktioita kutsutaan tästä johtuen protoninsiirto eli protolyysi reaktioiksi Protolyysi Happo Emäs Emäs
Hapot ja emäkset Määritelmät Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin Happo-emäsreaktioita kutsutaan tästä johtuen protoninsiirto eli protolyysi reaktioiksi Protolyysi Happo Emäs Emäs
8. Alkoholit, fenolit ja eetterit
 8. Alkoholit, fenolit ja eetterit Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
8. Alkoholit, fenolit ja eetterit Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
elektroni = -varautunut tosi pieni hiukkanen nukleoni = protoni/neutroni
 3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
