ATOMIN ELEKTRONIVERHO
|
|
|
- Akseli Penttilä
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 2.1 AINEEN RAKENNE Tunnetun maailmankaikkeuden ajatellaan koostuvan aineesta eli materiasta sekä energiasta. Aineella on aina massa ja tilavuus. Jokaisella aineella on tietyt ominaisuudet, joiden perusteella aineet voidaan luokitella. AINEIDEN LUOKITTELU Luonnossa aineet esiintyvät harvoin puhtaina alkuaineina tai kemiallisina yhdisteinä. Jos seoksen koostumus ja ominaisuudet eivät ole samanlaiset, seosta kutsutaan heterogeeniseksi seokseksi. Jos seos on tasakoosteinen, kyseessä on homogeeninen aine. Homogeenisia seoksia kutsutaan usein liuoksiksi. Puhdas aine voi olla alkuaine tai yhdiste. Kemiallisen yhdisteen koostumus ilmaistaan kemiallisen kaavan avulla. Veden kaava on H 2 O. Kemiallisen yhdisteen ominaisuudet poikkeavat reaktioon osallistuneiden alkuaineiden ominaisuuksista. Kemiallisessa reaktiossa aine muuttuu toiseksi aineeksi, fysikaalisessa muutoksessa ei. Fysikaalisia ominaisuuksia ovat esim. aineen olomuodot, väri, kovuus ja tiheys. 2.2 ATOMI Atomin rakenneosat ovat elektronit, protonit ja neutronit. Positiivisesti varautuneet protonit ja varauksettomat neutronit muodostavat atomin ytimen. Negatiivisesti varautuneet elektronit kiertävät ydintä muodostaen elektroniverhon, jonka rakenne määrää atomin kemialliset ominaisuudet. Atomin ytimessä olevien protonien lukumäärä on ytimen protoniluku eli järjestysluku, Z. Protoneista ja neutroneista käytetään yhteisnimeä nukleonit ja niiden yhteistä lukumäärä on atomin massaluku, A. ISOTOOPIT Neutronien lukumäärä alkuaineen ytimessä voi vaihdella, joten alkuaineella on erimassaisia atomeja. Niitä kutsutaan kyseisen alkuaineen isotoopeiksi. Esim. edyllä on kolme isotooppia. ATOMIMASSA Atomien massat ovat suuruusluokkaa g. Koska laskeminen pienillä luvuilla on hankalaa, käyttöön on otettu atomimassayksikkö, u. Vuonna 1960 sovittiin, että hiili-12-isotoopin, massa on tasan 12 u. Lähes kaikki luonnossa esiintyvät alkuaineet ovat isotooppiseoksia. Esim. hiilen atomimassa on 12,01 u ja vedyn 1,008 u. ATOMIN ELEKTRONIVERHO Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi. Ne määräävät atomin kemialliset ominaisuudet, kuten reaktiokyvyn ja sen, missä suhteissa atomit liittyvät toisiinsa. Elektronikaavassa esitetään atomin ulkoelektroneja, yksi piste tarkoittaa yhtä elektronia, viiva elektroniparia. Täyttä kahdeksan ulkoelektronin joukkoa kutsutaan oktetiksi, mikä on kemiallisesti hyvin pysyvä elektronirakenne. Jalokaasuilla, heliumia lukuun ottamatta, on tällainen elektronirakenne. Myös muut alkuaineet pyrkivät reaktioissaan saavuttamaan mahdollisimman pysyvän elektronirakenteen joko luovuttamalla tai vastaanottamalla elektroneja tai muodostamalla yhteisiä elektronipareja. Tätä pyrkimystä kahdeksaan ulkoelektroniin sanotaan oktettisäännöksi. MITÄ SIDOKSET OVAT JA MITEN NE LUOKITELLAAN? Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat sidokset selittävät, miten alkuaineista muodostuu yhdisteitä ja miten metalliatomit sitoutuvat toisiinsa. Heikkoja sidoksia esiintyy molekyylien välillä tai molekyylien ja ionien välillä. Vahvojen sidosten katkaisemiseen tarvitaan enemmän lämpöenergiaa kuin heikkojen sidosten katkaisemiseen. 3.1 VAHVAT SIDOKSET Miksi vahvoja sidoksia muodostuu? Vahvoja sidoksia ovat ionisidos, kovalenttinen sidos ja metallisidos. Vahvoja sidoksia muodostuu, uusilla syntyvillä rakenteilla on pienempi energia kuin alkuperäisillä erillisillä atomeilla. Oktettisääntö on yksinkertaistus tästä periaatteesta. Miten eri alkuaineet pääsevät oktettiin ja miten sidostyyppi syntyy? Alkuaineet pyrkivät saamaan jalokaasujen elektronirakenteen joko luovuttamalla tai vastaanottamalla elektroneja, jolloin muodostuu ioneja. Toinen tapa on yhteisten elektroniparien muodostaminen. Mistä tiedetään, kumpaa tapaa alkuaine käyttää? Katsotaan jaksollista järjestelmää ja alkuaineiden elektronegatiivisuusarvoja. Epämetalleilla oktetista puuttuu vain yksi tai muutama elektroni. Epämetallien suuri elektronegatiivisuus kuvaa kykyä ottaa vastaan elektroneja. Metalleilla on vähän ulkoelektroneja. Metallien pieni elektronegatiivisuus kuvaa kykyä luovuttaa elektroneja. Kahden alkuaineen välinen sidostyyppi voidaan päätellä niiden elektronegatiivisuusarvojen erotuksesta. Jos erotus on suuri, elektronit siirtyvät kokonaan metallilta epämetallille ja syntyvää sidosta kutsutaan ionisidokseksi. Jos erotus on pieni, sidoselektronit jäävät yhteisiksi elektronipareiksi ja syntyvää sidosta kutsutaan kovalenttiseksi sidokseksi.
2 IONISIDOS Koska pääryhmien metalleilla on vain 1 3 ulkoelektronia, ne kaikki luovutetaan pois. Tällöin metalleista syntyy positiivisia ioneja, kationeja. Epämetalleilla on 4 8 ulkoelektronia (poikkeuksena vety ja helium), ja ne pääsevät oktettiin vastaanottamalla elektroneja. Tällöin elektronegatiivisemmista epämetalliatomeista syntyy negatiivisia ioneja eli anioneja. Ioniyhdisteissä ioneja sitoo toisiinsa vahva, erimerkkisten varausten välinen sähköinen vetovoima. Ioniyhdisteet ovat kiinteitä, haihtumattomia aineita ja niiden sulamispiste on korkea. Esim. NaCl:n sulamispiste on 801 C ja CaO:n 2614 C. Sulamispiste vaihtelee, koska ionisidoksen vahvuus riippuu ionien koosta ja ionivarauksesta. KOVALENTTINEN SIDOS Sidoselektroniparin kaksi elektronia ovat lähtöisinsidokseen osallistuvilta atomeilta, yksi elektroni kummaltakin. Epämetalleista kovalenttisin sidoksin rakentuvia yhdisteitä kutsutaan molekyyleiksi. Kovalenttiset sidokset ovat vahvoja, joten alkuainemolekyylit ja yhdistemolekyylit ovat pysyviä rakenteita. Kolmoissidoksen katkaiseminen vaatii paljon energiaa, joten typpikaasu on kemiallisesti passiivista. 3.2 MONIPUOLINEN HIILI Elollisen luonnon molekyylien runkoalkuaine on hiili. Hiilellä kaksi ominaisuutta, jotka tekevät siitä poikkeuksellisen hiiliatomien kyky muodostaa keskenään yksin-, kaksin- tai kolminkertaisia sidoksia. hiiliatomien kyky muodostaa pitkiä ketjuja, joissa voi olla jopa sata miljoonaa hiiliatomia. Hiiliyhdisteiden kemiaa kutsutaan orgaaniseksi kemiaksi ja hiilirunkoisia yhdisteitä orgaanisiksi yhdisteiksi. Eliöiden rakennusaineet, kuten proteiinit, hiilihydraatit ja rasvat, ovat biomolekyylejä. 3.3 HIILIRUNGOT Rakennekaavoihin kirjoitetaan ensin rungon hiiliatomit sidoksineen. Seuraavaksi lisätään vetyatomit sidoksineen. Lopuksi tarkastetaan, että jokainen hiiliatomi muodostaa neljä kovalenttista sidosta. Avaruusrakenne Hiiliketjun avaruusrakenne pyrkii järjestäytymään siten, että se saavuttaa energiaminimin. Biologisissa tapahtumissa molekyylit tunnistavat toisensa avaruusrakenteen perusteella. Kun hiili muodostaa neljä yksinkertaista sidosta, ne suuntautuvat avaruudessa tetraedrisesti. Molekyylien rakenteiden esitystavat Molekyylikaava ilmoittaa molekyylin atomien todelliset lukumäärät. Rakennekaava ilmoittaa molekyylin atomien tarkan sitoutumisjärjestyksen Tiivistetty rakennekaava on rakennekaavan lyhyempi muoto. Viivakaava on nopea ja selkeä tapa esittää monimutkaistenkin hiiliyhdisteiden rakenne. Jos molekyylissä on muitakin alku-aineita kuin hiiltä ja vetyä, näiden ns. heteroatomien (O, N, S, P ja halogeenit F, Cl, Br, I) kemialliset merkit kirjoitetaan aina näkyviin. Hiilirungot 1. Ketjurakenteiset eli avoketjuiset hiilivedyt, joissa hiilirunko on joko haarautumaton tai haarautunut ketju. 2. Sykliset eli rengasrakenteiset hiilivedyt, joissa hiiliatomit muodostavat renkaita. Rengasrakenne ilmoitetaan etuliitteellä syklo-. 3. Aromaattiset hiilivedyt, joista yksinkertaisin on bentseeni C 6 H 6. Bentseenin johdannaisiksi kutsutaan yhdisteitä, joissa bentseenin vetyatomeja on korvattu muilla atomeilla tai atomiryhmillä. Tyydyttyneet ja tyydyttymättömät hiiliyhdisteet 1. Jos hiilirungossa on vain yksinkertaisia hiili hiili-sidoksia, yhdiste on tyydyttynyt. esim. pentaani ja sykloheksaani 2. Jos hiilirungossa on vähintään yksi hiiliatomien välinen kaksois- tai kolmoissidos, yhdiste on tyydyttymätön. Kaksoissidoksen hiiliatomeista sidokset suuntautuvat 120 :n kulmissa. Kolmoissidoksen hiiliatomeista sidokset suuntautuvat 180 :n kulmissa, ja rakenne on lineaarinen. Pääte -eeni kertoo molekyylissä olevan hiili hiili-kaksoissidoksen ja pääte -yyni hiili hiili-kolmoissidoksen. 3. Aromaattiset yhdisteet ovat oma rakenneluokkansa. Niitä ei luokitella tyydyttymättömiksi, vaikka niiden rakennetta kuvataankin delokalisoituneiden kaksoissidoselektronien avulla. 3.5 POOLISET JA POOLITTOMAT KOVALENTTISET SIDOKSET Kovalenttinen sidos rakentuu elektroniparista, jonka elektronit ovat sidoksen muodostavien atomien yhteisiä. Jos atomit ovat samanlaisia, myös niiden elektronegatiivisuudet ovat samat ja yhteiset elektronit jakautuvat tasaisesti atomien välille. Tällaista kovalenttista sidosta sanotaan poolittomaksi. Elektronit siirtyvät elektronegatiivisemman atomin suuntaan, jolloin kovalenttinen sidos on poolinen. Elektronegatiivisuusarvojen eron kasvaessa kovalenttisen sidoksen poolisuus kasvaa. Kun erotus on suurempi kuin 1,7, sidostyyppi muuttuu kovalenttisesta ionisidokseksi. 3.6 POOLISET JA POOLITTOMAT MOLEKYYLIT Samoin kuin kovalenttinen sidos voi olla poolinen tai pooliton, myös funktionaalinen ryhmä ja koko molekyyli voivat olla poolisia tai poolittomia. Poolisessa molekyylissä on vähintään yksi poolinen sidos.
3 3.4 FUNKTIONAALISET RYHMÄT 4.1 AINEMÄÄRÄ Ainemäärän tunnus on n ja yksikkö mooli, mol. Moolin määritelmä Yksi mooli on sellaisen systeemin ainemäärä, joka sisältää yhtä monta rakenneosaa kuin niitä on tasan 12 grammassa hiili-12-isotoopin atomeja. Rakenneosa voi olla atomi, molekyyli, ioni tai elektroni. Yksi mooli mitä tahansa puhdasta ainetta sisältää Avogadron vakion ilmoittaman lukumäärän aineen rakenneosia. Avogadron vakion lukuarvo on käsittämättömän suuri. Jos tiedetään aineen ainemäärä n, aineen rakenneosien lukumäärä N lasketaan kertomalla ainemäärä Avogadron vakiolla. MOOLIMASSA Moolimassan tunnus on M ja yksikkö g/mol. Moolimassa ilmoittaa yhden moolin massan grammoina. 4.2 LIUOKSEN PITOISUUS Liuenneen aineen määrä liuoksessa ilmoitetaan massaprosentteina (m-%) tai tilavuusprosentteina (V-%). Konsentraatio c ilmoittaa liuenneen ainemäärän n liuostilavuutta V kohti. Konsentraation yksikkö on mol/dm 3, jonka lyhenne on M. 5.1 HEIKOT SIDOKSET Sidokset olomuodon muutoksissa Aineen rakenne määrää, millainen sidos purkautuu olomuodon muuttuessa: ioniyhdisteillä purkautuvat ionisidokset, molekyyliyhdisteillä ja alkuainemolekyyleillä molekyylien väliset heikot sidokset. Useat molekyyliyhdisteiden fysikaaliset ominaisuudet, kuten sulamis- ja kiehumispiste sekä liukoisuus, johtuvat molekyylien välisistä heikoista sidoksista. Heikot sidokset vahvimmasta heikoimpaan lueteltuina ovat ioni dipoli-sidos, vetysidos, dipoli dipoli-sidos ja Londonin dispersiovoima.
4 POOLISTEN MOLEKYYLIEN VÄLISET SIDOKSET Erimerkkiset sähkövaraukset vetävät toisiaan puoleensa, joten poolisen molekyylin positiivisesti varautunut pää vetää puoleensa toisen poolisen molekyylin negatiivisesti varautunutta päätä. Sidosta kutsutaan dipoli dipoli-sidokseksi. Jos vetyatomi on sitoutunut kovalenttisella sidoksella, elektronega-tiiviseen F-, O- tai N-atomiin, muodostuu molelyylien välille dipoli dipoli-sidoksen erikoistapaus, vetysidos. POOLITTOMIEN MOLEKYYLIEN VÄLISET SIDOKSET ELI DISPERSIOVOIMAT Dispersiovoimia esiintyy kaikkien atomien, ionien ja molekyylien välillä. Poolittomien molekyylien tai molekyylin osien välillä on vain dispersiovoimia, ja muut heikot sidosvoimat puuttuvat. Dispersiovoimat aiheutuvat siitä, että elektronien liike atomissa tekee molekyylistä hetkellisesti dipolin. 5.2 HEIKOT SIDOKSET TOIMINNASSA KIEHUMINEN JA SULAMINEN Hiilivedyt ovat poolittomia yhdisteitä, joten vain dispersiovoimat pitävät niiden molekyylejä kiinni toisissaan. Dispersiovoimat vahvistuvat ja kiehumispisteet nousevat, kun hiilivetyrunko pitenee ja moolimassa kasvaa. Alkoholit ja karboksyylihapot ovat poolisia yhdisteitä, mutta niidenkin dispersiovoimat vahvistuvat ja kiehumispisteet nousevat moolimassan kasvaessa. Alkoholimolekyylien välillä on dispersiovoimien lisäksi vetysidoksia. Karboksyylihappojen kiehumispisteet ovat korkeampia kuin vastaavien alkoholien, koska karboksyyliryhmien väliset vetysidokset ovat vahvempia kuin alkoholiryhmien väliset vetysidokset. Heikkojen sidosten katkeaminen ja uudelleenmuodostuminen Heikkojen sidosten takia molekyylirakenteiset nesteet ovat juoksevia. LIUKOISUUS Liukoisuus ilmoittaa liuenneen aineen määrän grammoina kylläisessä liuoksessa tietyssä lämpötilassa. Yleensä liukoisuuden yksikkönä on g/l tai g/100 g. Poolittomat molekyylit liukenevat poolittomiin liuottimiin ja pooliset molekyylit ja ioniyhdisteet poolisiin liuottimiin. Liukeneminen poolittomat aineet Heksaanissa ja tolueenissa on vain poolittomia hiili hiili- ja hiili vety-sidoksia, joten ne ovat poolittomia. Poolittomat aineet liukenevat toisiinsa kaikissa suhteissa. Liukeneminen pooliset aineet Pooliset molekyylit liukenevat hyvin poolisiin liuottimiin. Tällöin vetysidoksia tai dipoli dipoli-sidoksia katkeaa ja muodostuu. Esimerkiksi sakkaroosi eli tavallinen sokeri C 12 H 22 O 11 liukenee veteen, koska molekyylissä on kahdeksan poolista OHryhmää, jotka muodostavat liuotinveden kanssa vetysidoksia. Aineiden erilaiseen liukoisuuteen perustuvaa erotusmenetelmää kutsutaan uutoksi. Liukeneminen ioniyhdisteet Ioniyhdisteet liukenevat hyvin ainoastaan poolisiin liuottimiin, kuten veteen, metanoliin ja etanoliin. Ioniyhdisteet eivät liukene poolittomiin liuottimiin, kuten heksaaniin, tolueeniin tai bensiiniin, joka on hiilivetyjen seos. Ionien ja poolittomien liuotinmolekyylien väliset vetovoimat ovat heikkoja dispersiovoimia. 6.1 ALKOHOLIT, FENOLIT, EETTERIT JA AMIINIT Hiilirungon väliset sidokset ovat yksinkertaisia kovalenttisia sidoksia. ALKOHOLIT JA FENOLIT Ketjurakenteiseen tai sykliseen hiilirunkoon on liittynyt poolinen OH-ryhmä eli hydroksyyliryhmä. Yksinkertaisia alkoholeja nimettäessä perusosan pääte on -anoli. Jos OH-ryhmä nimetään perusosan sivuryhmänä, sen nimi on hydroksi. Fenoleissa OH-ryhmä on liittynyt suoraan bentseenirenkaan hiiliatomiin. Tällaista OH-ryhmää kutsutaan fenoliseksi hydroksyyliryhmäksi. Alkoholit ovat neutraaleja, mutta fenolit ovat heikkoja happoja. Alkoholien käyttökohteita Metanoli hyvin myrkyllistä väritöntä nestettä, kiehumispiste on 65 C, käytetään teollisuudessa liuottimena, lasinpesunesteissä, jäätymisenestoaineena, lennokkimoottorien ja kiihdytysautojen polttoaineena, lähtöaineena monien erilaisten kemikaalien valmistuksessa Etanoli liuotin, desinfiointiaine, monien teollisesti valmistettavien tuotteiden lähtöaine, uusiutuva biopolttoaine Alkoholien luokittelu Alkoholi on yhdenarvoinen, jos molekyylissä on vain yksi OH-ryhmä. Kahdenarvoisissa alkoholeissa on vastaavasti kaksi ja kolmenarvoisissa alkoholeissa kolme OH-ryhmää. Alkoholit ja OH-ryhmät luokitellaan primäärisiin,sekundäärisiin ja tertiäärisiin sen mukaan,kuinka monta hiiliatomia on sitoutunut hydroksyyliryhmää sitovaan hiiliatomiin. Useampiarvoisten alkoholien fysikaalisia ominaisuuksia Useampiarvoiset alkoholit sisältävät useita poolisia OH-ryhmiä, joten ne voivat sitoutua naapurimolekyyleihin useilla vetysidoksilla. Nämä alkoholit ovat jäykkäjuoksuisia, siirappimaisia nesteitä, joiden kiehumispisteet ovat huomattavasti korkeampia kuin vastaavien yhdenarvoisten alkoholien. Esim. 1-propanolin kp on 97 C (M = 60 g/mol) glykolin kp 198 C (M = 62 g/mol) Glykoli-vesiseoksen sulamispiste on alhainen, joten siitä valmistettu jäähdytysneste ei jäädy kovilla pakkasilla. Glykoli on makeampaa kuin sokeri mutta nautittuna myrkyllistä - vaurioittaa maksaa ja munuaisia korkea kiehumispiste, 198 C.
5 Glyseroli kiehumispiste (290 C), kolme OH-ryhmää, vedensitomiskyky on erinomainen, ei ole myrkyllinen käytetään ihonhoitotuotteissa, hammastahnoissa ja elintarvikkeissa kosteuden sitojana ja kuivumisenestoaineena EETTERIT Eettereissä on kaksi hiilivetyketjua kiinnittyneenä samaan happiatomiin. Funktionaalisena ryhmänä on happiatomi, jota kutsutaan eetterihapeksi tai happisillaksi. Vaikka eetterimolekyylit eivät voi keskenään muodostaa vetysidoksia, niiden happiatomi pystyy muodostamaan vetysidoksia veden vetyatomien kanssa. Monet poolittomat yhdisteet, kuten rasvat ja vahat, liukenevat hyvin eettereihin. AMIINIT Ammoniakin johdannaisina, koska ammoniakin vetyatomeja voidaan korvata hiiliketjulla: primäärisissä amiineissa on korvattu yksi vety, sekundäärisissä amiineissa kaksi ja tertiäärisissä amiineissa kolme. Funktionaalisista ryhmistä käytetään nimityksiä primäärinen, sekundäärinen ja tertiäärinen aminoryhmä. Yksinkertaisten amiinien nimen perusosa on -amiini, ja typpeen liittyneet hiilivetyketjut ilmoitetaan sivuryhminä. Jos NH 2 - ryhmä ilmoitetaan sivuryhmänä, sen nimi on amino. Pienimolekyylisiä amiineja syntyy luonnossa proteiinien mätänemistuotteina. Amiinien haju on hyvin epämiellyttävä. 6.2 KARBONYYLIYHDISTEET Aldehydien, ketonien, karboksyylihappojen, esterien ja amidien funktionaalisissa ryhmissäon hiilen ja hapen välinen kaksoissidos eli karbonyyliryhmä. ALDEHYDIT JA KETONIT Yksinkertaisten aldehydien nimen perusosan pääte on -anaali. Karbonyyliryhmän hiiliatomi lasketaan mukaan perusosan nimeä muodostettaessa. Metanaali eli formaldehydi, on pysymätön kaasu., mutta sen vesiliuos, formaliini, on säilyvää. Formaliinia käytetään erilaisten fenoli-, urea- ja melamiinimuovien sekä hartsien valmistukseen Formaldehydi tuhoaa tehokkaasti bakteereja, viruksia ja muita mikro-organismeja. Yksinkertaisten ketonien nimen perusosan pääte on -anoni. Karbonyyliryhmän hiiliatomi lasketaan mukaan perusosan nimeä muodostettaessa. Asetonia käytetään liuottimena erityisesti maali- ja pinnoiteteollisuudessa, koska se liuottaa hyvin hartseja, lakkoja, polymeerejä ja jopa epäorgaanisia suoloja. Myös kynsilakanpoistoaine on asetonia. KARBOKSYYLIHAPOT JA ESTERIT Karboksyylihappojen nimen perusosan pääte on -aanihappo. Karbonyyliryhmän hiiliatomi lasketaan mukaan perusosan nimeä muodostettaessa. Pienimmät karboksyylihapot ovat värittömiä, voimakkaan ja pistävän hajuisia nesteitä. Karboksyylihapot ovat nimensä mukaisesti happoja. Veteen liukenemattomia, yhdenarvoisia, pitkäketjuisia karboksyylihappoja (14, 16 tai 18 hiiliatomia) kutsutaan rasvahapoiksi. Ne ovat kiinteitä, vahamaisia aineita, kuten kynttilöiden steariinihappo. Esterien systemaattisissa nimissä happeen liittynyt hiilivetyosa R2 ilmoitetaan nimen alussa sivuryhmänä -yylipäätteisenä. Karbonyyliryhmän hiiliatomi lasketaan mukaan, ja perusosan pääte on -anaatti. Esterien haihtuvuus johtuu alhaisista kiehumispisteistä. Rasvat sekä monien hajuvesien ja kukkien tuoksut sekä hedelmien maku- ja aromiaineet ovat estereitä. Vahat Vahat ovat estereitä ja poolittomia, joten ne hylkivät vettä AMINOHAPOT Aminohapoissa on kaksi funktionaalista ryhmää: primäärinen aminoryhmä ja karboksyylihapporyhmä. Aminohapot ovat proteiinien rakennusosia. Eläin- ja kasviproteiinit rakentuvat 20 aminohaposta, joiden sivuketju R vaihtelee. Kun aminohapot liittyvät toisiinsa amidiryhmillä eli peptidisidoksilla, syntyy proteiiniketjuja. 6.3 ELÄMÄN RAKENNUSAINEET PROTEIINIT Proteiinit rakentuvat amidiryhmillä eli peptidisidoksilla yhteen liittyneistä aminohapoista. Perintötekijät eli geenit määräävät aminohappojärjestyksen. Proteiinien aminohappojärjestystä kutsutaan proteiinin primäärirakenteeksi. Sekundäärirakenteita ovat α-kierteet ja β- laskokset. Tertiäärirakenne syntyy, kun α-kierteitä ja β-laskoksia sisältävä pitkä proteiiniketju taipuu ja laskostuu kullekin proteiinille ominaiseen muotoon. Tertiäärirakenteen pitävät kasassa aminohappojen sivuketjujen väliset heikot ja vahvat sidokset. Kvaternäärirakenne syntyy, kun useita tertiäärirakenteita liittyy yhteen suuremmaksi kokonaisuudeksi. Esimerkiksi hemoglobiini koostuu neljästä samanlaisesta proteiiniyksiköstä. Kussakin yksikössä on happea sitova heemi. Monosakkaridit Glukoosia eli rypälesokeria syntyy yhteyttämisreaktiossa hiilidioksidista ja vedestä. Glukoosi on eliöiden polttoainetta ja sitä on mm. rypäleissä ja hunajassa. Fruktoosi on glukoosia makeampaa. Fruktoosi eli hedelmäsokeri on glukoosin isomeeri: kummankin molekyylikaava on C 6 H 12 O 6. Disakkaridit Kahden monosakkaridin muodostamia yhdisteitä kutsutaan disakkarideiksi. Tavallinen sokeri, sakkaroosi eli ruokosokeri, koostuu yhdestä glukoosi- ja yhdestä fruktoosiyksiköstä.
6 Laktoosi eli maitosokeri on disakkaridi, joka koostuu galaktoosista ja glukoosista Polysakkaridit Kasvit tuottavat energiaa yhteyttämällä, jolloin syntyy ensin glukoosia ja sitten pitkäketjuista polysakkaridia, tärkkelystä. Selluloosa koostuu tuhansista glukoosiyksiköistä, mutta ketjut ovat suoria eikä niissä ole haaroja. LIPIDIT Lipidit koostuvat poolittomista osista, esim. rasvahappoketjuista, ja erittäin poolisesta osasta. Rasvat ovat 1,2,3-propaanitriolin eli glyserolin ja rasvahappojen muodostamia triestereitä eli trigyseridejä. Tyydyttymättömässä rasvahapossa on yksi tai useampi C=C-sidos. Steroidit ovat rakenteeltaan rasvoista poikkeavia lipidejä. Niihin kuuluu sekä hormoneja, kuten progesteroni, että muita steroidirakenteisia molekyylejä, kuten kolesteroli. 7.1 KEMIALLINEN REAKTIO Kemiallinen reaktio tapahtuu, kun reagoivat molekyylit törmäävät toisiinsa riittävän voimakkaasti. Hiiliyhdisteissä heikkoja kohtia, joissa reaktiot tapahtuvat ovat molekyylien funktionaaliset ryhmät. Kemialliseen reaktioon liittyy aina energian muutoksia: energiaa joko vapautuu tai sitoutuu. 7.2 HAPETTUMINEN JA PELKISTYMINEN Hiiliyhdiste hapettuu, kun sen happiatomien lukumäärä kasvaa tai vetyatomien lukumäärä vähenee. Hiiliyhdiste pelkistyy, jos sen happiatomien lukumäärä vähenee tai vetyatomien lukumäärä kasvaa. Primäärinen alkoholiryhmä hapettuu ensin aldehydiryhmäksi ja se edelleen karboksyylihapporyhmäksi. Sekundäärinen OH-ryhmä hapettuu ketoniryhmäksi. Tertiäärinen ja fenolinen OH-ryhmä eivät hapetu. Ketoneissa karbonyyliryhmän hiileen ei ole liittynyt vetyatomia, joten ketonien edelleen hapettuminen on mahdotonta. Lihaksia voimakkaasti rasitettaessa niihin kerääntyy hapen puutteessa maitohappoa ja suoritustaso laskee. Hapettumisreaktioihin on kirjoitettu vain lähtöaine ja reaktiotuote sekä hapettavasta aineesta peräisin oleva [O]. Hapettavana aineena voidaan käyttää esimerkiksi kaliumpermanganaattia,kmno 4 Karboksyylihapporyhmä voidaan pelkistää takaisin aldehydiryhmäksi ja aldehydiryhmä edelleen primääriseksi OHryhmäksi. Samalla tavalla ketoniryhmä voidaan pelkistää sekundääriseksi OH-ryhmäksi. Hiiliyhdisteiden pelkistämiseen käytetään tavallisesti vetykaasua ja katalyyttiä tai metallihydridejä, kuten litiumalumiinihydridiä, LiAlH 4. Ravitsemustieteessä pelkistäviä aineita kutsutaan antioksidanteiksi eli hapettumisenestoaineiksi. Esim. askorbiinihappo eli C-vitamiini sekä E- vitamiini ja flavonoidit ovat antioksidantteja. Palaminen Palamista kutsutaan hapettumiseksi. Hiiliyhdiste reagoi hapen kanssa., jolloin hiiliyhdisteen sidokset ja happimolekyylin kaksoissidos purkautuvat ja syntyy CO 2 jah 2 O. Hiiliyhdisteiden kemiallinen energia muuttuu lämpöenergiaksi. Jos hiiliyhdiste sisältää typpeä, palamisessa syntyy myös typen oksideja. 7.3 HAPPO-EMÄSREAKTIOT ELI PROTONINSIIRTOREAKTIOT Hapon ja emäksen välillä tapahtuu protonin eli vetyionin H + siirtoreaktio. Happo luovuttaa protonin emäkselle ja emäs ottaa vastaan hapon luovuttaman protonin. Miten hapan vesiliuos syntyy? Karboksyylihapporyhmä on hapan. Fenolinen OH-ryhmä on myös hapan. Karboksyylihapot R COOH reagoivat veden kanssa luovuttamalla protoneja karboksyylihapporyhmästä COOH. Etikkahappo ja muut karboksyylihapot ovat heikkoja happoja. Hapon heikkous tarkoittaa sitä, että vain osa happomolekyyleistä luovuttaa protoninsa. Vahvat hapot, kuten vetykloridi HCl ja typpihappo HNO 3, luovuttavat protoninsa täydellisesti. Kahdenarvoiset hapot voivat luovuttaa kaksi protonia. Esim. oksaalihappo, viinihappo ja rikkihappo H 2 SO 4 Kolmenarvoiset hapot voivat luovuttaa kolme protonia.esim. sitruunahappo ja fosforihappo H 3 PO 4 Miten emäksinen vesiliuos syntyy? Ammoniakkimolekyylistä tulee ammoniumioni NH 4 +. Ammoniakki on heikko emäs, sillä kaikki ammoniakki- molekyylit eivät vastaanota protonia. Vesimolekyylistä tulee hydroksidi-ioni OH, joka aiheuttaa vesiliuoksen emäksisyyden. Primäärisen, sekundäärisen että tertiäärisen aminoryhmän typpiatomi voi vapaalla elektroniparillaan sitoa protonin. Metallihydroksidit, esimerkiksi NaOH, KOH, Ca(OH) 2, Mg(OH) 2 ja Al(OH) 3, ovat kiinteitä ioniyhdisteitä. Kun metallihydroksidit liukenevat veteen, niiden rakenne purkautuu metalli- ja hydroksidi-ioneiksi. Emäksinen liuos syntyy ilman protoninsiirtoreaktiota. Amfolyytit Hapon kanssa reagoidessaan vesi vastaanottaa protonin, mutta emäksen kanssa reagoidessaan se luovuttaa protonin. Aminohapot ovat amfolyyttejä, koska niissä tapahtuu molekyylinsisäinen protoninsiirto. Puhtaina ja neutraalissa liuoksessa aminohapot eivät esiinny varauksettomina molekyyleinä vaan kahtaisioneina. Kahtaisionissa on positiivinen ja negatiivinen ionivaraus kuten ioniyhdisteissä. Siksi aminohapot liukenevat hyvin veteen,muodostaen ioni dipoli-sidoksia. Neutraloituminen Hapon ja emäksen välistä reaktiota kutsutaan neutraloitumiseksi. Kun vesi haihdutetaan pois, emäksestä peräisin olevan kationin ja haposta muodostuvan anionin välille syntyy ionisidos. Muodostunutta kiinteää yhdistettä kutsutaan suolaksi. Karboksyylihappojen, fenolien ja amiinien suolat liukenevat veteen paljon paremmin kuin vastaavat karboksyylihapot, fenolit ja amiinit. Viimeksi mainitut muodostavat veteen liuetessaan vetysidoksia, kun taas suolat muodostavat ioni dipoli-sidoksia, jotka ovat vetysidoksia vahvempia.
SIDOKSET. Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
Puhdasaine Seos Aineen olomuodot
 1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Orgaanisten yhdisteiden rakenne ja ominaisuudet
 Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
MUUTOKSET ELEKTRONI- RAKENTEESSA
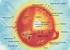 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
ORGAANINEN KEMIA. = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY
 ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
HEIKOT SIDOKSET. Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA
 MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
Lämpö- eli termokemiaa
 Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Biomolekyylit ja biomeerit
 Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KE2 KURSSIKOE 4/2014 Kastellin lukio
 KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
KE2 KURSSIKE 4/2014 Kastellin lukio Valitse kuusi (6) tehtävää. Piirrä pisteytystaulukko ja merkitse siihen rastilla vastaamatta jättämäsi tehtävät. 1. Eräiden alkuaineiden elektronirakenteet ovat seuraavat:
Orgaanisissa yhdisteissä on hiiltä
 Orgaaninen kemia 31 Orgaanisissa yhdisteissä on hiiltä Kaikki orgaaniset yhdisteet sisältävät hiiltä. Hiilen kemiallinen merkki on C. Usein orgaanisissa yhdisteissä on myös vetyä, typpeä ja happea. Orgaaniset
Orgaaninen kemia 31 Orgaanisissa yhdisteissä on hiiltä Kaikki orgaaniset yhdisteet sisältävät hiiltä. Hiilen kemiallinen merkki on C. Usein orgaanisissa yhdisteissä on myös vetyä, typpeä ja happea. Orgaaniset
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
8. Alkoholit, fenolit ja eetterit
 8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
Orgaanista kemiaa. Yhdistetyypit ja nimeäminen
 Orgaanista kemiaa Yhdistetyypit ja nimeäminen Molekyylikaava Termejä: molekyylikaava, bruttokaava, empiirinen kaava, suhdekaava Molekyylikaavan kirjoittaminen ensin hiilet, sitten vedyt näiden jälkeen
Orgaanista kemiaa Yhdistetyypit ja nimeäminen Molekyylikaava Termejä: molekyylikaava, bruttokaava, empiirinen kaava, suhdekaava Molekyylikaavan kirjoittaminen ensin hiilet, sitten vedyt näiden jälkeen
2. Täydennä seuraavat reaktioyhtälöt ja nimeä reaktiotuotteet
 /Tapio evalainen Loppukuulustelun..00 mallivastaukset. imi: vsk:. Piirrä karboksyylihapporyhmän ja aminoryhmän rakenteet ja piirrä näkyviin myös vapaat elektroniparit. soita mikä hybridisaatio karboksyyli-
/Tapio evalainen Loppukuulustelun..00 mallivastaukset. imi: vsk:. Piirrä karboksyylihapporyhmän ja aminoryhmän rakenteet ja piirrä näkyviin myös vapaat elektroniparit. soita mikä hybridisaatio karboksyyli-
Kemia keskeinen luonnontiede
 KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KPL1 Hiili ja sen yhdisteet. KPL2 Hiilivedyt
 KPL1 Hiili ja sen yhdisteet 1. Mikä on hiilen kemiallinen kaava? C 2. Mitkä ovat hiilen 4 eri esiintymismuotoa? Miten ne eroavat toisistaan? Timantti, grafiitti, fullereeni, nanoputki. Eroavat rakenteelta
KPL1 Hiili ja sen yhdisteet 1. Mikä on hiilen kemiallinen kaava? C 2. Mitkä ovat hiilen 4 eri esiintymismuotoa? Miten ne eroavat toisistaan? Timantti, grafiitti, fullereeni, nanoputki. Eroavat rakenteelta
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Liukeneminen 31.8.2016
 Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Liukeneminen KEMIAN MIKROMAAILMA, KE2 Kertausta: Kun liukenevan aineen rakenneosasten väliset vuorovaikutukset ovat suunnilleen samanlaisia kuin liuottimen, niin liukenevan aineen rakenneosasten välisiä
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
3. Protolyysireaktiot ja vesiliuoksen ph
 3. Protolyysireaktiot ja vesiliuoksen ph Happo Happo on protonin (H+) luovuttaja Esim. suolahappo (tässä vesi on emäs) Happo luovuttaa vetyionin ja syntyy oksoniumioni H₃O+ Maistuu happamalta, esim. karboksyylihapot
3. Protolyysireaktiot ja vesiliuoksen ph Happo Happo on protonin (H+) luovuttaja Esim. suolahappo (tässä vesi on emäs) Happo luovuttaa vetyionin ja syntyy oksoniumioni H₃O+ Maistuu happamalta, esim. karboksyylihapot
Atomi. Aineen perusyksikkö
 Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Puhtaat aineet ja seokset
 Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Helsingin yliopiston kemian valintakoe. Keskiviikkona klo Vastausselvitykset: Tehtävät:
 1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
Kemia s10 Ratkaisut. b) Kloorin hapetusluvun muutos: +VII I, Hapen hapetusluvun muutos: II 0. c) n(liclo 4 ) = =
 1. 2. a) Yhdisteen molekyylikaava on C 6 H 10 : A ja E b) Yhdisteessä on viisi CH 2 yksikköä : D ja F c) Yhdisteet ovat tyydyttyneitä ja syklisiä : D ja F d) Yhdisteet ovat keskenään isomeereja: A ja E
1. 2. a) Yhdisteen molekyylikaava on C 6 H 10 : A ja E b) Yhdisteessä on viisi CH 2 yksikköä : D ja F c) Yhdisteet ovat tyydyttyneitä ja syklisiä : D ja F d) Yhdisteet ovat keskenään isomeereja: A ja E
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Kemian perusteet farmasiassa osa II: orgaaniset yhdisteet/tapio Nevalainen Loppukuulustelu b) ketoni
 /Tapio evalainen Loppukuulustelu 16.1.05 imi: vsk: 1. Laadi rakennekaava ja anna nimi seuraavien yhdisteryhmien moolimassaltaan pienimmälle yhdisteelle: a) esteri, b) ketoni, c) amiini, d) tyydyttymätön
/Tapio evalainen Loppukuulustelu 16.1.05 imi: vsk: 1. Laadi rakennekaava ja anna nimi seuraavien yhdisteryhmien moolimassaltaan pienimmälle yhdisteelle: a) esteri, b) ketoni, c) amiini, d) tyydyttymätön
Heikot sidokset voimakkuusjärjestyksessä: -Sidos poolinen, kun el.neg.ero on 0,5-1,7. -Poolisuus merkitään osittaisvarauksilla
 Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Heikot sidokset voimakkuusjärjestyksessä: 1. Ioni-dipoli sidokset 2. Vetysidokset 3. 4. Dipoli-dipoli sidokset Dispersiovoimat -Sidos poolinen, kun el.neg.ero on 0,5-1,7 -Poolisuus merkitään osittaisvarauksilla
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Kondensaatio ja hydrolyysi
 Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Solun perusrakenne I Solun perusrakenne. BI2 I Solun perusrakenne 3. Solujen kemiallinen rakenne
 Solun perusrakenne I Solun perusrakenne 3. Solujen kemiallinen rakenne 1. Avainsanat 2. Solut koostuvat molekyyleistä 3. Hiilihydraatit 4. Lipidit eli rasva-aineet 5. Valkuaisaineet eli proteiinit rakentuvat
Solun perusrakenne I Solun perusrakenne 3. Solujen kemiallinen rakenne 1. Avainsanat 2. Solut koostuvat molekyyleistä 3. Hiilihydraatit 4. Lipidit eli rasva-aineet 5. Valkuaisaineet eli proteiinit rakentuvat
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 27.5.2014 Etunimet: Nimikirjoitus: KEMIA. Kemian kuulustelu klo 9.00
 TERVEYDE BITIETEIDE enkilötunnus: - KULUTUSJELMA Sukunimi: 27.5.2014 Etunimet: imikirjoitus: KEMIA Kemian kuulustelu klo 9.00 YLEISET JEET 1. Tarkista, että saamassasi tehtävänipussa on sivut 1-10. Paperinippua
TERVEYDE BITIETEIDE enkilötunnus: - KULUTUSJELMA Sukunimi: 27.5.2014 Etunimet: imikirjoitus: KEMIA Kemian kuulustelu klo 9.00 YLEISET JEET 1. Tarkista, että saamassasi tehtävänipussa on sivut 1-10. Paperinippua
12. Amiinit. Ammoniakki 1 amiini 2 amiini 3 amiini kvarternäärinen ammoniumioni
 12. Amiinit Amiinit ovat ammoniakin alkyyli- tai aryylijohdannaisia. e voivat olla primäärisiä, sekundäärisiä tai tertiäärisiä ja lisäksi ne voivat muodostaa kvaternäärisiä ammoniumioneja. Ammoniakki 1
12. Amiinit Amiinit ovat ammoniakin alkyyli- tai aryylijohdannaisia. e voivat olla primäärisiä, sekundäärisiä tai tertiäärisiä ja lisäksi ne voivat muodostaa kvaternäärisiä ammoniumioneja. Ammoniakki 1
Kaikki ympärillämme oleva aine koostuu alkuaineista.
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Näiden aihekokonaisuuksien opetussuunnitelmat ovat luvussa 8.
 9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
2. Alkaanit. Suoraketjuiset alkaanit: etuliite+aani Metaani, etaani... Dekaani (10), undekaani, dodekaani, tridekaani, tetradekaani, pentadekaani..
 2. Alkaanit SM -08 Kaikkein yksinkertaisimpia orgaanisia yhdisteitä. Sisältävät vain hiiltä ja vetyä ja vain yksinkertaisia - sidoksia. Yleinen molekyylikaava n 2n+2 Alkaanit voivat olla suoraketjuisia
2. Alkaanit SM -08 Kaikkein yksinkertaisimpia orgaanisia yhdisteitä. Sisältävät vain hiiltä ja vetyä ja vain yksinkertaisia - sidoksia. Yleinen molekyylikaava n 2n+2 Alkaanit voivat olla suoraketjuisia
a) Puhdas aine ja seos b) Vahva happo Syövyttävä happo c) Emäs Emäksinen vesiliuos d) Amorfinen aine Kiteisen aineen
 1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
BIOMOLEKYYLEJÄ. fruktoosi
 BIMLEKYYLEJÄ IMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Ihminen on käyttänyt luonnosta saatavia, kasveissa ja eläimissä esiintyviä polymeerejä eli biopolymeerejä jo pitkään arkipäivän tarpeisiinsa. Biomolekyylit
BIMLEKYYLEJÄ IMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Ihminen on käyttänyt luonnosta saatavia, kasveissa ja eläimissä esiintyviä polymeerejä eli biopolymeerejä jo pitkään arkipäivän tarpeisiinsa. Biomolekyylit
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
VESI JA VESILIUOKSET
 VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
Orgaaninen tarkoittaa eloperäistä ja alunperin kaikki elollisesta luonnosta peräisin olevat yhdisteet luokiteltiin orgaanisiksi yhdisteiksi.
 Orgaaninen kemia Orgaaninen tarkoittaa eloperäistä ja alunperin kaikki elollisesta luonnosta peräisin olevat yhdisteet luokiteltiin orgaanisiksi yhdisteiksi. Nykyään orgaanisia yhdisteitä osataan valmistaa
Orgaaninen kemia Orgaaninen tarkoittaa eloperäistä ja alunperin kaikki elollisesta luonnosta peräisin olevat yhdisteet luokiteltiin orgaanisiksi yhdisteiksi. Nykyään orgaanisia yhdisteitä osataan valmistaa
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
Isomerian lajit. Rakenne- eli konstituutioisomeria. Avaruus- eli stereoisomeria. Ketjuisomeria Funktioisomeria Paikkaisomeria
 Isomeria Isomeria Yhdisteellä on sama molekyylikaava, mutta eri rakenne: siksi eri isomeereillä voi olla erilaiset fysikaaliset ja kemialliset ominaisuudet!!!! Esim. yhdisteellä C2H6O on kaksi isomeeriä.
Isomeria Isomeria Yhdisteellä on sama molekyylikaava, mutta eri rakenne: siksi eri isomeereillä voi olla erilaiset fysikaaliset ja kemialliset ominaisuudet!!!! Esim. yhdisteellä C2H6O on kaksi isomeeriä.
Reaktiomekanismi. Tänä päivänä hyödynnetään laskennallista kemiaa reaktiomekanismien määrittämisessä/selvittämisessä!
 REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
REAKTIOT JA ENERGIA, KE3 Reaktiomekanismi Määritelmä, reaktiomekanismi: Reaktiomekanismi on yksityiskohtainen malli, joka selittää atomi- ja elektronitasolla, miten reaktio tapahtuu. Siis malli, jolla
EPIONEN Kemia 2015. EPIONEN Kemia 2015
 EPIONEN Kemia 2015 1 Epione Valmennus 2014. Ensimmäinen painos www.epione.fi ISBN 978-952-5723-40-3 Painopaikka: Kopijyvä Oy, Kuopio Tämän teoksen painamiseen käytetty paperi on saanut Pohjoismaisen ympäristömerkin.
EPIONEN Kemia 2015 1 Epione Valmennus 2014. Ensimmäinen painos www.epione.fi ISBN 978-952-5723-40-3 Painopaikka: Kopijyvä Oy, Kuopio Tämän teoksen painamiseen käytetty paperi on saanut Pohjoismaisen ympäristömerkin.
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Tehtävä 1. Valitse seuraavista vaihtoehdoista oikea ja merkitse kirjain alla olevaan taulukkoon
 Tehtävä 1. Valitse seuraavista vaihtoehdoista oikea ja merkitse kirjain alla olevaan taulukkoon A. Mikä seuraavista hapoista on heikko happo? a) etikkahappo b) typpihappo c) vetykloridihappo d) rikkihappo
Tehtävä 1. Valitse seuraavista vaihtoehdoista oikea ja merkitse kirjain alla olevaan taulukkoon A. Mikä seuraavista hapoista on heikko happo? a) etikkahappo b) typpihappo c) vetykloridihappo d) rikkihappo
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
c) Nimeä kaksi alkuainetta, jotka kuuluvat jaksollisessa järjestelmässä samaan ryhmään kalsiumin kanssa.
 Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Bentseeni on vaikeasti reagoiva yhdiste. Bentseeni on avaruusrakenteeltaan tasomainen. Bentseenin
 Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Keskiviikko 24.5.2017 VASTAA TEHTÄVIIN 1 3 JA KAHTEEN TEHTÄVÄÄN TEHTÄVISTÄ 4 6! MAOL JA LASKINOHJELMISTOT OVAT SALLITTUJA! Sievin lukio
Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Keskiviikko 24.5.2017 VASTAA TEHTÄVIIN 1 3 JA KAHTEEN TEHTÄVÄÄN TEHTÄVISTÄ 4 6! MAOL JA LASKINOHJELMISTOT OVAT SALLITTUJA! Sievin lukio
sulfonihappoihin fenoleihin aldehydeihin amiineihin
 Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Sievin lukio Perjantai 25.5.2018 VASTAA YHTEENSÄ VIITEEN TEHTÄVÄÄN SITEN, ETTÄ OLET VASTANNUT TEHTÄVIIN 1-3! MAOL JA LASKINOHJELMISTOT OVAT
Kemian kurssikoe, Ke2 Ihmisen ja elinympäristön kemiaa RATKAISUT Sievin lukio Perjantai 25.5.2018 VASTAA YHTEENSÄ VIITEEN TEHTÄVÄÄN SITEN, ETTÄ OLET VASTANNUT TEHTÄVIIN 1-3! MAOL JA LASKINOHJELMISTOT OVAT
2. Maitohapon CH3 CH(OH) COOH molekyylissä
 1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
Reaktioyhtälö. Sähköisen oppimisen edelläkävijä www.e-oppi.fi. Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava
 Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
c) Mitkä alkuaineet ovat tärkeitä ravinteita kasveille?
 ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
Määritelmät. Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin
 Hapot ja emäkset Määritelmät Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin Happo-emäsreaktioita kutsutaan tästä johtuen protoninsiirto eli protolyysi reaktioiksi Protolyysi Happo Emäs Emäs
Hapot ja emäkset Määritelmät Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin Happo-emäsreaktioita kutsutaan tästä johtuen protoninsiirto eli protolyysi reaktioiksi Protolyysi Happo Emäs Emäs
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
10. Karbonyyliyhdisteet. Karboksyylihapot ja niiden johdannaiset
 10. Karbonyyliyhdisteet. Karboksyylihapot ja niiden johdannaiset Karboksyylihapot ja niiden johdannaiset ovat karbonyyliyhdisteitä, joilla on karbonyylihiileen liittynyt elektronegatiivinen atomi. Niillä
10. Karbonyyliyhdisteet. Karboksyylihapot ja niiden johdannaiset Karboksyylihapot ja niiden johdannaiset ovat karbonyyliyhdisteitä, joilla on karbonyylihiileen liittynyt elektronegatiivinen atomi. Niillä
TERVEYDEN BIOTIETEIDEN Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 24.5.2007 Etunimet: Nimikirjoitus: KEMIA. Kemian kuulustelu klo 12.
 TERVEYDEN BIOTIETEIDEN Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 24.5.2007 Etunimet: Nimikirjoitus: KEMIA Kemian kuulustelu klo 12.00 YLEISET OHJEET 1. Tarkista, että saamassasi tehtävänipussa on sivut
TERVEYDEN BIOTIETEIDEN Henkilötunnus: - KOULUTUSOHJELMA Sukunimi: 24.5.2007 Etunimet: Nimikirjoitus: KEMIA Kemian kuulustelu klo 12.00 YLEISET OHJEET 1. Tarkista, että saamassasi tehtävänipussa on sivut
MAOL:n pistesuositus kemian reaalikokeen tehtäviin syksyllä 2012.
 MAL:n pistesuositus kemian reaalikokeen tehtäviin syksyllä 01. - Tehtävän eri osat arvostellaan 1/3 pisteen tarkkuudella ja loppusumma pyöristetään kokonaisiksi pisteiksi. Tehtävän sisällä pieniä puutteita
MAL:n pistesuositus kemian reaalikokeen tehtäviin syksyllä 01. - Tehtävän eri osat arvostellaan 1/3 pisteen tarkkuudella ja loppusumma pyöristetään kokonaisiksi pisteiksi. Tehtävän sisällä pieniä puutteita
