761359A Spektroskooppiset menetelmät INFRAPUNASPEKTROSKOPIA Seppo Alanko Kevät PERUSKÄSITTEITÄ
|
|
|
- Johannes Kouki
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 76359A Spektroskooppiset menetelmät INFRAPUNASPEKTROSKOPIA Seppo Alanko Kevät 05 PERUSKÄSITTEITÄ Kokeellinen molekyylispektroskopia mittaa sähkömagneettisen säteilyn ja molekyylin välistä vuorovaikutusta. Kokeellinen informaatio on molekyylin absorboiman (tai emittoiman) säteilyn taajuudet ja määrät. Mitataan ns. spektri. SISÄLTÖ Teoriaa Peruskäsitteitä Värähtelevät molekyylit 3 Pyörivät molekyylit Spektroskopiaa 4 FIR- ja MW-spektroskopia 5 MIR-spektroskopia 6 NIR-spektroskopia 7 Raman-spektroskopia 8 Kokeellisista menetelmistä Molekyyli absorboi vain tiettyjä, juuri sille ominaisia taajuuksia. Molekyylissä tapahtuu sisäisiä muutoksia niin, että se siirtyy diskreetistä energiatilasta toiseen. Spektrin tulkinta on näiden muutosten luonteen selvittämistä. Tuloksena saadaan yksityiskohtaista tietoa monista molekyylin ominaisuuksista, kuten koosta ja rakenteesta, voimakentästä, ydinspineistä, dipolimomentista, elektroniorbitaaleista, jne... Molekyylispektroskopialla on runsaasti yhteyksiä laser- ja astrofysiikkaan. Sillä on laajalti käytännön sovellutuksia ennen kaikkea kemiallisessa analytiikassa. Spektrometrit ovat laboratorioiden vakiokalustoa. Myös ilmakehän ja sen epäpuhtauksien tutkimisessa spektroskooppiset menetelmät ovat tärkeitä. Infrapunaspektroskopiassa tarkastelemme sitä osaa molekyylispektroskopiasta, joka liittyy molekyylien pyörimiseen ja värähtelyyn.
2 . SÄHKÖMAGNEETTINEN SPEKTRI Sähkömagneettista säteilyä voidaan pitää joko a) Sähkömagneettisena aaltoliikkeenä Sähkö- ja magneettikentät (E r ja B r ) värähtelevät toisiaan vastaan kohtisuorissa suunnissa ja etenevät samavaiheisina muodostaen yhdessä aallon, joka etenee valon nopeudella. SM-aallolla on - aallonpituus l yksikkö cm ( m) - taajuus n = c / l yksikkö s - = Hz - aaltoluku n = / l yksikkö cm - SM-aalto kuljettaa mukanaan energiaa. Aallon teho pinta-alayksikköä kohti (W/m ) eli irradianssi on esimerkiksi sähkökentästä laskettuna I = e ce, 0 0 missä E 0 on sähkökentän amplitudi. 3 tai SM-aallon ja molekyylin välinen vuorovaikutus on pääasiassa ns. dipolivuorovaikutus: Aallon värähtelevä sähkö(tai magneetti)kenttä "tarttuu" molekyylin sähköiseen (tai magneettiseen) dipolimomenttiin => energian vaihto b) Hiukkasvirtana (fotoneina/kvantteina) Kvantilla on energia hc E = hn = = hcn, l missä h on Planckin vakio. SM kvantti vuorovaikuttaa molekyylin kanssa absorboitumalla (tai emittoitumalla) molekyyliin, jolloin molekyylin energia kasvaa (pienenee) kvantin energian verran. Seuraavan sivun kuvassa on esitetty sähkömagneettisen spektrin eri osa-alueet taajuuden funktiona. Lisäksi kuvaan on merkitty ne spektrin alueet, joille molekyylien erilaisten energiamuotojen on havaittu sijoittuvan. 4
3 5 6. MOLEKYYLIMALLI g - säteily Röntgensäteily UV - säteily Näkyvä valo Infrapunasäteily Mikroaaltosäteily 0 9 Radiotaajuudet Taajuus (Hz) elektronit värähtely pyöriminen Molekyyli Joukko ytimiä, jotka muodostavat stabiilin rakenteen elektronien varausjakauman luomassa potentiaalikentässä. Ytimet värähtelevät tasapainoasemiensa ympäristössä. Molekyyli voi pyöriä massakeskipisteensä ympäri. Molekyylispektroskopian tärkein approksimaatio on Born-Oppenheimer-approksimaatio Perustuu ydin-elektroni-massaeroon: molekyylin värähdellessä ytimet liikkuvat hitaammin kuin elektronit "kiertäessään" radoillaan. Molekyylin värähdysliike (ja samalla pyöriminen) voidaan käsitellä erillään elektronien liikkeestä. 0 6
4 Värähtely- ja pyörimisliikkeisiin liittyvä molekyylin energia on E = Ev + Er + Evr, missä E v on värähdysenergia (vibraatioenergia) E r on pyörimis- eli rotaatioenergia E vr on värähtelyn ja pyörimisen vuorovaikutukseen liittyvä energia eli ns. Coriolis-energia Pätee (kuva s. 5) E? E v r ja lisäksi on havaittu, että Er? Evr. Kohtalaisen hyvä approksimaatio saadaan, jos asetetaan E vr» 0, jolloin myös värähtely ja pyöriminen separoituvat toisistaan. Vinkki: Hahmota itsellesi molekyylin värähtelyn ja pyörimisen keskinäisiä aikaskaaloja: Sinä aikana, kun molekyyli pyörähtää itsensä ympäri yhden kerran, se ehtii suorittaa noin tuhat värähdysliikettä. Ja myös: Sinä aikana, kun molekyyli värähtää yhden kerran, elektronit ehtivät tehdä noin tuhat periodista liikettään ytimien ympärillä. 7.3 SPEKTROSKOPIOISTA Elektronispektroskopiat Röntgen-, UV- ja näkyvän alueen kvantit pystyvät muuttamaan elektronirakennetta Þ elektroninen spektri, jossa hienorakenteena värähtely ja pyöriminen Infrapunaspektroskopia Infrapuna-alueen kvantit pystyvät muuttamaan molekyylin värähdystilaa Þ värähdysspektri, jossa hienorakenteene pyöriminen Raman-spektroskiopia Näkyvä/UV-laservalo kohdistetaan molekyyliin ja mitataan sironnutta valoa Þ värähdysspektri, jossa hienorakenteene pyöriminen (täydentää IR-spektroskopiaa) Mikroaaltospektroskopia Mikroaaltoalueen kvantit muuttavat molekyylin pyörimistilaa Þ rotaatiospektri 8
5 .4 YKSIKÖISTÄ Spektroskopioissa mitataan mm. absorboituvan kvantin energiaa: hc E =, yksikkö Js cm J l cm s = Elektronispektroskopioissa yksikkö on ev -9 ev =, J Infrapunaspektroskopiassa käytetään aaltolukua n = / l (yksikkö cm - ). Yhteys energiaan on E = hcn. Mikroaaltospektroskopian suure on taajuus n (yksikkö tavallisesti MHz = 0 6 Hz). Pätee E = hn. Taajuus ja aaltoluku kytkeytyvät toisiinsa relaatiolla n = cn. Nykyinen mittaustarkkuus huomioiden muunnoksissa on käytettävä valonnopeutta täydellä tarkkuudella. Esimerkki: Muunna aaltoluvuiksi (cm - ) taajuus 9,7483 GHz. Ratkaisu: 9 n 9, s n = = = 0,3569 cm - c, cm s 9 VÄRÄHTELEVÄT MOLEKYYLIT Born-Oppenheimer-approksimaatio mahdollistaa värähdysliikkeen tarkastelun erillään elektronisesta liikkeestä. Kun lisäksi värähdysliikkeen ja pyörimisliikkeen kytkevä Coriolis-vuorovaikutus approksimoidaan nollaksi (jota se lähes onkin), voimme keskittyä pelkästään molekyylin värähtelyihin.. KAKSIATOMISET MOLEKYYLIT Kaksiatomiset molekyylit itsessään muodostavat tärkeän joukon molekyylien maailmassa. Lisäksi niiden tarkastelu luo mallin, pohjaa ja terminologiaa moniatomisten molekyylien käsittelylle. Kuvassa alla on esitetty B-O-approksimaation mukainen -atominen molekyyli värähtelemässä: r e = tasapainotilan sidospituus x= r- r e = poikkeama tasapainosta 0
6 Jos värähdysamplitudi on pieni, ts. poikkeama tasapainosta on pieni, niin palauttava voima f on lineaarinen (Hooken laki): f =-kx ja värähtelijä on ns. harmoninen värähtelijä. Potentiaalienergiaksi saadaan V ( x) = kx ja kvanttimekaaninen Schrödingerin yhtälö on muotoa missä Ĥyv = Evyv, ˆ h H =- + V( x) m x on ns. Hamiltonin operaattori. Schrödingerin yhtälö antaa värähdysenergioiksi ( ) Ev = hn v +, missä v = 0,,, K on ns. värähdyskvanttiluku ja n on värähdystaajuus, jolle pätee k n = p m, missä mm m = m+ m on ns. redusoitu massa. Mielenkiintoinen havainto on, että kvanttimekaanisen värähtelijän taajuus on sama kuin vastaavan klassillisen värähtelijän taajuus. Atomien massat ilmoitetaan tavallisesti atomimassayksiköissä u, joka on -7 u =, kg = m( C) Esimerkki: Laske 0 B H molekyylin redusoitu massa kilogrammoina viiden numeron tarkkuudella, kun 0 m ( B) = 0,09 u ja m ( H) =,00783 u. Ratkaisu: m m = = m( B) + m( H) 0,09 +, ( B) m( H) 0,09, u = 0,95665 u Huom!» m( H) = -7 0,95665, kg = -7,505 0 kg Huom! Tässä m» m( H), koska raskas 0 B ei juurikaan liiku ja käytännössä H on se joka värähtelee.
7 Kuvassa alla on esitetty -atomisen molekyylin harmonisen mallin mukainen värähdysenergiatasokaavio, johon on sisällytetty kolme alinta värähdysenergiaa. Samaan kuvaan on piirretty myös molekyylin potentiaalienergia sidospituuden funktiona: 3 Kun värähdysenergiat ilmoitetaan aaltolukuina, puhutaan värähdystermiarvoista: Ev G( v) = = we( v + ) hc Epäharmonisuus Kun värähdysenergia kasvaa, "jousen" venymä kasvaa eikä palauttava voima f ole enää lineaarinen Þ epäharmonisuus molekyyli voi jopa hajota (dissosiaatio) 4 Kannattaa huomata, että - molekyylillä alin värähdysenergia ei ole nolla vaan ns. nollapiste-energia hn - energiaspektri eli energiatasojakauma on tasavälinen välein hn Aikaisemmin totesimme, että taajuuden ja aaltoluvun välillä vallitsee relaatio n = cn. Tähän nojautuen värähdysspektroskopiassa kirjoitetaan hn = hcwe (siis n = cwe ) missä w on ns. värähdysaaltoluku. e Energiaväli tihenee kohti dissosiaatiota: G( v) = w ( v + )- x ( v + ) + y ( v + ) e e e missä x e, y e,... ovat ns. epäharmonisuusvakioita. Huomaa "-"-merkki, joten x e > 0.
8 Esimerkki: H -molekyylille on mitattu seuraavat värähdysvakiot: w e = 440, cm -, x e =,3 cm - ja y e = 0,8 cm -. Laske a) voimavakio k b) värähdystermiarvo kolmelle alimmalle värähdystilalle ja niissä epäharmonisuuden osuus %:na 5 b) Värähdystermiarvo on G( v) = w ( v + )- x ( v + ) + y ( v + ) josta lasketaan: v G( v) 3 e e e - x ( v + ) + y ( v + ) % e 3 e 0 70,38-30,3,4 633,58-70,3 4,3 057,38-745,63 7,3 6 Ratkaisu: k a) h hc c k ( c ) p m Redusoitu massa, kun m ( H) =,0078 u, on n = we Þ n = we = Þ = p we m ( H) m( H) m ( H) 0,50390 m = m m( H) + m( H) = = = 0,50390, kg ja lisäksi cm cw e =, , cm s 4 =,394 0 s Voimavakioksi laskemme 0 - kg k = =» ( pcwe ) m 575,07 s N 575 m u Havaitaan: - energiaspektri ei ole enää tasavälinen - epäharmonisuuden osuus kasvaa siirryttäessä energiassa ylemmäksi Dissosiaatioenergia mitataan joko - tasapainotilan suhteen: De - tai nollapiste-energian suhteen: D0 Määrittäminen:. Mitataan erotuksia D G = G( v + ) -G( v) 3 3 = we( v + ) - xe( v + ) - we( v + ) + xe( v + ) 9 = we - x ( 3 ) e v + v + 4-v -v - 4 = w - x (v+ ) = w - x ( v + ) e e e e
9 . Graafinen esitys: 3. D 0 max å = pinta-ala = DG v v= 0 4. Maksimiarvo värähdyskvanttiluvulle ( v max ) saadaan olettamalla, että maksimissa pätee erotus G( v + ) - G( v ) = 0. ` Esimerkki: Määritä H -molekyylin dissosiaatioenergia D 0 approksimaatiotasolla: - ì we = 440, cm í - î x e =,3 cm Ratkaisu: Lasketaan ensin v max : D G= we - xe( v + ) = 0 we 440, Þ vmax = - = - = 7,4 = 7,3 x e 7 ja sitten integroidaan (approksimoi summaa): 7 D0 = ò[ we - xe( v + )] dv e v xe ( v v) 7 we xe(7 7) 0 0 = w - + = =35640,5 cm Muutetaan tulos (oikeaksi) energiaksi: - D0 = hc 35640,5 cm cm = 6,66 0 Js, ,5cm s ,080 0 J = 7,080 0 J =» 4,4 ev -9,60 0 J/eV (oikea arvo vedylle on 4,48)
10 . MONIATOMISET MOLEKYYLIT -atomisella molekyylillä (esim. CO) on vain yksi värähdysmuoto, joka on ns. venytys: 9 3-atominen CO -molekyyli on lineaarinen ja sillä on neljä värähdysmuotoa: 0 CO-molekyylillä värähdysaaltoluku on w» 43 cm - 3-atominen H O-molekyyli on ei-lineaarinen ja sillä on kolme värähdysmuotoa: Nimet: n, n ja n 3 Kuvaus: n : symmetrinen venytys w» 3657 cm - n : taivutus w» 595 cm - n : antisymmetrinen venytys w 3» 3759 cm - 3 Hahmota värähdysmuodot. Ohje: Atomeiden liikkuessa massakeskipiste pysyy paikoillaan. Nimet: n, n ja n 3 Värähdyksillä n a ja n b on symmetrian perusteella täsmälleen sama energia (sama värähdysaaltoluku) eikä niitä koskaan voida havaita erillisinä toisistaan. Sanotaan, että n -värähdys on kahdesti degeneroitunut. Kuvaus: n : symmetrinen venytys w» 390 cm - n : degeneroitunut taivutus w» 667 cm - n : antisymmetrinen venytys w 3» 350 cm - 3 Huom! Hiilidioksidin antisymmetrinen venytys on kasvihuoneilmiön yksi päätekijöistä.
11 Yleisesti N-atomisen molekyylin värähdysmuotojen lukumäärä lasketaan kaavasta: 3N - 6 ei-lineaarisilla molekyyleillä 3N - 5 lineaarisilla molekyyleillä Mistä tulee? N atomia Þ 3N vapausastetta (liike-energiaa x-, y- ja z-suunnissa), joista - 3 menee molekyylin liikkumiseen kokonaisuudessaan (x-, y- ja z-suunnissa) ja - 3 menee pyörimiseen ei-lineaarisilla ja - menee pyörimiseen lineaarisilla molekyyleillä (akselin ympäri pyörimiseen ei oleteta sisältyvän kineettistä energiaa) Näin värähtelylle jää yllämainitut 3N - 6 ja 3N -5 Esimerkiksi asetyleenimolekyyli C H on lineaarinen H- Cº C- H ja siinä on N = 4 atomia. Näin värähdysmuotoja on kaiken kaikkiaan 3N - 5= 7 kpl. Asetyleenimolekyylin värähdysmuodot on esitetty seuraavalla sivulla. Kuvaus: n : symmetrinen CH-venytys n : CC-venytys n 3: antisymmetrinen CH-venytys n 4: trans-taivutus (degeneroitunut) n : cis-taivutus (degeneroitunut) 5
12 Normaalikoordinaatit ja -muodot: 3 Värähdystermiarvot 4 -atomisessa: - yksi värähdysmuoto: venytys - yksi värähdyskoordinaatti, joka on sidoksen venytys x= r-re N-atomisessa - 3N- 6 (tai 3N - 5) värähdysmuotoa - 3N- 6 (tai 3N - 5) värähdyskoordinaattia, jotka ovat sidosten venytysten ja sidoskulmien taivutusten lineaarikombinaatioita. Kun lineaarikombinaatiot on valittu siten, että eri värähdysmuodot ovat toisistaan riippumattomia, värähdyskoordinaatit ovat ns. normaalikoordinaatteja Q. Esimerkiksi vesimolekyylissä H O n- värähdysmuotoa vastaa normaalikoordinaatti Q n - värähdysmuotoa vastaa normaalikoordinaatti Q n3- värähdysmuotoa vastaa normaalikoordinaatti Q3 Tällöin värähdysmuodot ovat ns. normaalimuotoja tai normaalivärähdysmuotoja. Normaalivärähdysmuodot ovat toisistaan riippumattomia. Värähdysenergian (-termiarvon) kannalta tämä tarkoittaa seuraavaa: Yhden normaalimuodon n i termiarvo on samaa muotoa kuin kaksiatomisella molekyylillä, ts. G( v ) = w ( v + ), i i i missä w i ja v i ovat tähän nimenomaiseen muotoon liittyvät värähdysaaltoluku ja värähdyskvanttiluku. Kaikkien normaalimuotojen yhdessä muodostama värähdystermiarvo on sitten summa 3N-6(5) 3 K = å wi i + i= G( v, v, v, ) ( v ), missä siis summa käy yli molekyylin kaikkien normaalimuotojen. Esimerkiksi H O-molekyylille G( v, v, v ) = w ( v + ) + w ( v + ) + w ( v + ), missä w = 3657 cm - ja v = 0,,, K w = 595 cm - ja v = 0,,, K w 3 = 3759 cm - ja v3 = 0,,, K
13 5 Värähdysten epäharmonisuus sekoittaa jossakin määrin värähdysmuotoja toisiinsa. Kun epäharmonisuus otetaan huomioon, termiarvot on kirjoitettava muodossa: å å G( K, v, K) = w ( v + ) + x ( v + )( v + ) i i i ij i j i i j missä i ja j juoksevat yli värähdysmuotojen ja epäharmonisuuden osuudessa summaus on rajoitettu. Esimerkiksi H O-molekyylillä on olemassa vain epäharmonisuusvakiot: x x x3 x x 3 6 x 33 Jokainen normaalimuoto "nousee" tasavälisesti toisistaan riippumattomasti. Lisänä kaksiatomiseen verrattuna kaaviossa esiintyy ns. kombinaatiotiloja, joilla useita eri värähdysmuotoja on saman aikaisesti virittynyt. Esimerkiksi tilan ( v, v, v 3) = (0,,) termiarvo on w(0 + ) + w( + ) + w3( + ) 3 3 = » 9860 cm -
14 3 PYÖRIVÄT MOLEKYYLIT Molekyylin pyörimiseen liittyvä energia on huomattavasti pienempi kuin värähdysenergia: E = E 3. KAKSIATOMISET JA LINEAARISET MOLEKYYLIT A) Jäykkä pyörijä - sidos venymätön (jäykkä) Pyörivän kappaleen kvanttimekaniikka: h E = r J( J ) 8p I +, missä J = 0,,, K on ns. rotaatiokvanttiluku ja I on molekyylin hitausmomentti. Kaksiatomisella: I = mr, missä mm m = on redusoitu massa m + m r v 7 Rotaatiotermiarvo aaltolukuina ( n = E / hc) Er h F( J) = J( J ) hc = 8p ci + eli F( J) = BJ( J + ), missä h B = 8p ci on ns. rotaatiovakio (yksikkö cm - ). Rotaatiotermiarvo annetaan usein myös taajuusyksiköissä ( n = cn ), jolloin muoto on sama F( J) = BJ( J + ), mutta rotaatiovakio lasketaan kaavasta (yksikkö Hz) h B = 8p I. Rotaatioenergiatasokaavio: 8 Moniatomisella (lineaarisella) I = å mr, missä i i i m i) etäisyys massa- missä r i on atomin i (massa keskipisteestä.
15 Kannattaa huomata, että - alin rotaatioenergia on nolla, ts. molekyyli ei pyöri ollenkaan (ei ole nollapisteenergiaa). - energiaspektri ei ole tasavälinen vaan väli kasvaa tasaisesti J:n kasvaessa Esimerkki: C H-molekyylin sidospituus on r (CH) =,99Å. Laske molekyylin rotaatiovakio ja kolme alinta rotaatiotilaa aaltolukuina, taajuuksina, jouleina ja elektronivoltteina. Massat: m ( H) =,0078 u ja m ( C) = u. 9 ja edelleen rotaatiovakio h B = 8p ci -34 6,66 0 Js = p, cm/s,936 0 kg m - Js = 4,458 cm»4,46 cm - æ kgm ö J kgm ç = s è ø Taajuusyksiköissä ( n = cn ) h - 0 cm B= c= 4,458 cm, p ci s = 433,44 0 9» 433,4 GHz s 30 Ratkaisu: Lasketaan ensin redusoitu massa m( H) m( C),0078 m = = u = 0,997 u m( H) + m( C), = = ,997, kg, kg» m( H), Huom! Sitten hitausmomentti - - I = mr =, kg (,99 0 m) -47 =,936 0 kg m 7 0 Kolme alinta energiatilaa: - - J F J / cm F J / GHz E J /0 J F J / mev ,9 866,9 5,744 3,586 86, ,3 0,76 - Tässä EJ (Jouleina) = hcfj(cm )
16 B) Ei-jäykkä pyörijä - sidoksena jousi: - kvanttiluvun J kasvaessa kasvava pyörimisnopeus (-energia) venyttää jousta Þ keskipakoisvääristymä Otetaan huomioon termiarvossa korjaustermeinä 3 3 F( J) = BJ( J + ) - DJ ( J + ) + HJ ( J + ) +K missä D, H... ovat ns. keskipakoisvääristymävakioita 3 Lasketaan: F(J) / GHz J jäykkä ei-jäykkä erotus % 500, ,678-0,048 0, ,60 743,8-6,3 0, , 03309,6-84,6,8 Keskipakoisvääristymä alentaa energioita sitä enemmän mitä suurempi J on. 3 Esimerkki: H 79 Br-molekyylin rotaatiovakio on B = 50,36 GHz ja keskipakoisvääristymävakio D = 0,44 MHz. Laske termiarvot J =, 0 ja 0 ja tutki keskipakoisvääristymän osuutta. Ratkaisu: Termiarvot ovat a) jäykässä mallissa F( J) = BJ( J + ), missä B = 50,36 GHz ja b) ei-jäykässä mallissa F( J) = BJ( J + ) - DJ ( J + ) -3 missä B = 50,36 GHz ja D = 0,44 0 GHz 3. EI-LINEAARISET MOLEKYYLIT Molekyylien luokittelu Pyörivän molekyylin klassillinen kineettinen energia on muotoa L L x y Lz Er = + +, Ix Iy Ix missä L x, L y ja L z ovat pyörimiseen liittyvän liikemäärämomentin komponentit ja I x, I y ja I z ovat molekyylin päähitausmomentit pääakselistossa ( xyz.,, ) Pyörimisominaisuudet määräytyvät hitausmomenttien keskinäisistä suhteista ja molekyylit luokitellaan hitausmomenttien mukaan.
17 Sopimus: Akselit ( xyz,, ) korvataan akseleilla ( abc,, ) siten, että hitausmomentit ovat suuruusjärjestyksessä I I I. a b c Esimerkiksi vesimolekyylillä 33 Luokittelu:. Lineaariset molekyylit (linear molecules) I = I ja I = 0. Esim. HCN a b c 34 Hitausmomentti x-akselin ympäri pyörimisessä on I x =,8 uå. Vastaavasti y- ja z-akseleiden ympäri pyörimisessä I y = 0,6 uå ja I z =, uå. Näin siis tässä erikoistapauksessa I = I I I x y z = I = I Rotaatiovakiot näissä pyörimisissa määritellään kuten -atomisella (yksiköissä cm - ): h A = p ci, h B = p ci ja h C = p ci 8 a ja aina pätee A³ B³ C. c a b 8 b 8 c. Pitkulaiset symmetriset hyrrät (prolate symmetric tops) I < I = I. Esim. CH 3 Cl a b c 3. Kiekkomaiset symmetriset hyrrät (oblate symmetric tops) I = I < I. Esim. BF 3 a b c 4. Pallohyrrät (spherical tops) I = I = I. Esim. SF 6 a b c 5. Asymmetriset hyrrät (asymmetric tops) I < I < I. Esim. H O a b c
18 Symmetrisen hyrrän rotaatioenergia Pitkulaiset: Ia < Ib = Ic eli A> B= C. Esim. CH 3 I Kiekkomaiset: Ia = Ib < Ic eli A= B> C. Esim. Bentseeni Rotaatiotermiarvot: FJK (, ) = BJJ ( + ) + ( A- BK ) pitkulainen FJK (, ) = BJJ ( + ) + ( C- BK ) kiekkomainen Kvanttiluvut J = 0,,K K = 0,, K, J. Aina siis J ³ K. Symmetrisen hyrrän rotaatiotermiarvot on kätevä "paketoida" K-kvanttiluvun mukaan. Annetulla K:n arvolla J ³ K ja energiatasokaaviolla on lineaarisen molekyylin kaavion rakenne lisättynä vakiotermillä ( A- BK ) > 0 tai ( C- BK ) < 0. Energiatasokaaviot ovat: Jokaista K:n arvoa vastaa "lineaarisen näköinen" J- rakenne siten, että ensimmäinen J = K. Pitkulaisella J-rakenne "nousee" K:n kasvaessa, koska ( A- B) > 0. Vastaavasti kiekkomaisen J-rakenne "laskee" K:n kasvaessa, koska ( C- B) < 0.
19 Esimerkki: Metyylijodidimolekyylin (CH 3 I) rotaatiovakiot ovat A = 5,734 cm - ja B = 0,50 cm -. Laske rotaatiotermikaavio ulottaen se J:n arvoon 4. Ratkaisu: FJK (, ) = BJJ ( + ) + ( A-BK ) = 5,734 J( J + ) + 4,93 K J K=0 K= K= K=3 K= ,35 5, ,04 35,96 50, ,08 67,00 8,77 06,4-4 03,5 08,4 3, 47,8 8, 37 4 FIR- JA MW-SPEKTROSKOPIA FIR = Far InfraRed (kaukainen infrapuna) MW = MicroWave (mikroaalto) Näillä tekniikoilla mitataan rotaatiospektrejä. Kun FIR- tai MW-kvantti absorboituu (tai emittoituu) molekyyli siirtyy rotaatioenergiatilasta toiseen. Oleellista spektrin synnyssä: - valintasäännöt (sallitut siirtymät) - siirtymän intensiteetti Tarkastellaan jatkossa absorptiospektrejä KAKSIATOMISET JA LINEAARISET MOLEKYYLIT Rotaatiotermiarvot: F( J) = BJ( J + ) - DJ ( J + ) Valintasäännöt: D J = J' - J'' =+ J ' on ylemmän tilan J J '' on alemman tilan J Lisäksi: Molekyylillä on oltava pysyvä dipolimomentti p
20 Esim. Symmetrisellä F molekyylillä p = 0 eikä sillä ole rotaatiospektriä. Samoin O, N, CO, HCCH, Esim. HF-molekyylillä p ¹ 0 ja sillä on rotaatiospektri. Miltä spektri näyttää? Lasketaan spektriviivojen A) paikat ja B) suhteelliset intensiteetit. A) Spektriviivojen paikat Absorptiospektri syntyy valintasäännöllä D J =+, joten spektriviivojen aaltoluvut n eli paikat aaltolukuasteikolla saadaan laskemalla erotus n ( J) = F( J + ) -F( J) = B( J + )( J + ) - BJ( J + ) = B( J + )[ J + -J] = B( J + ) = BJ + B Huomaa, että spektriviivojen aaltoluvut lasketaan siirtymän alatilan kvanttiluvun funktiona. Spektri taajuusasteikolla saadaan, kun rotaatiovakio B kirjoitetaan taajuusyksiköissä. Alin siirtymä on n ( J = 0) on kohdassa B ja seuraavat aina B :n välein.
21 Esimerkki Molekyylin C 6 O rotaatiovakio on 57,64 GHz. Laske rotaatiospektriviivan J = 4 3 paikka taajuusasteikolla ja aaltolukuasteikoilla. Ratkaisu: n ( J = 3) = F(4) - F(3) = B(3 + ) = 46, GHz 9 - n (3) 46, 0 s n (3) = = = 5,38 cm c, cm s Spektri: 4 B) Suhteelliset intensiteetit - määräytyvät ensimmäisessä approksimaatiossa lähtötilan suhteellisesta miehityksestä Boltzmannin jakauma: Energiatilan J miehitys N J suhteessa alimman tilan J = 0 miehitykseen N 0 saadaan laskemalla N { E ( J) - E (0)} J = (J + )exp - r r N kt 0 Tässä k on Boltzmannin vakio, T lämpötila ja kerroin (J + ) tulee rotaatiotilojen degeneraatiosta (ei käsitellä nyt). Alin rotaatioenergia on nolla ja tilan J vastaava lasketaan Er ( J ) = hcf( J ) = hcbj ( J + ). Saadaan siis: N { ( ) } J hcbj J + - = (J + )exp -, jos [ B] = cm N0 kt N { ( ) } J hbj J + = (J + ) exp -, jos [ B ] = Hz N kt 0 4 5,38 cm - vastaa aallonpituutta l = / n =0,650 mm. Useimmilla molekyylillä rotaatiospektriviivat sijaitsevat mikroaalto-/millimetriaaltoalueella.
22 Esimerkki: H 79 Br molekyylillä B = 50GHz. Laske J = 0 tilan miehitys suhteessa tilan J = 0 miehitykseen lämpötiloissa 73 K (0 C) ja 373 K (00 C). Ratkaisu: N { ( ) } J hbj J + = (J + ) exp -. Kun J = 0, saadaan N0 kt -34 ì h= 6,66 0 J s N { } 0 hb ï 9 - = exp - 0, missäíb = 50 0 s N0 kt ï - - îk =, J K Lämpötilassa T = 73K N0-4,834 = e = 0,67 N 0 Lämpötilassa T = 373K N0-3,538 = e = 0,60 N SYMMETRISET HYRRÄT - Myös symmetrisillä hyrrillä rotaatiospektrin olemassaolo vaatii nollasta poikkeavan dipolimomentin. Esim. Pitkulaisella CH 3 I:llä on dipolimomentti (pitkin akselia), mutta kiekkomaisella (hyvin symmetrisellä) bentseenillä ei ole. Spektri voidaan konstruoida soveltamalla valintasääntöjä D J =+ D K = 0 rotaatiotermiarvoihin FJK (, ) = BJJ ( + ) + ( A- BK ) (pitkulainen) FJK (, ) = BJJ ( + ) + ( C- BK ) (kiekkomainen) 44 Lämpötilan kasvaessa molekyylit siirtyvät (molekyylien jakauma siirtyy) korkeammille energioille. Havaitaan spektrin intensiteettijakauman siirtymisenä. (Spektristä voidaan määrittää lämpötila)
23 Lasketaan esimerkiksi pitkulaiselle: n ( J, K) = F( J +, K) -F( J, K) = BJ ( + )( J+ ) + ( A-BK ) - BJJ ( + ) + ( A-BK ) = BJ ( + )[ J+ - J] = BJ ( + ). 45 Todellisuudessa keskipakoisvääristymä rikkoo yksinkertaisen spektrirakenteen. Annetussa J-viivassa K- komponentit eivät ole täsmälleen päällekkäin vaan viiva "silpoutuu" ns. K-rakenteeksi: 46 Siirtymät eivät sekoita eri K -paketteja toisiinsa ja spektri näyttää (tässä approksimaatiossa) yksinkertaiselta lineaarisen molekyylin spektriltä. Alla esim. CH 3 D-molekyylin rotaatiospektri: Jokainen spektriviiva sisältää monta komponenttia eri K:n arvoilla. Seuraavalla sivulla on esitetty kuva artikkelista: High Resolution FTIR spectra of AsD 3 in the cm - region. The ground, v = and v 4 = states by H. Bürger et al. in Molecular Physics, 98, (000). Ylemmässä kuvassa kuvan keskellä näkyy siirtymän J = 4 3 K -rakenne värähdysperustilassa. Suurin K -komponentti on K = 3. Kuvassa näkyy vastaava siirtymä myös virittyneissä värähdystiloissa v = ja v 4 =. Värähdystila v 4 = on kahdesti degeneroitunut, joten K -rakenne on edellä esitettyä teoriaa monimutkaisempi.
24 47 48 Alemmassa kuvassa nähdään siirtymän J = 8 7 kaikki K - komponentit. 4.3 ROTAATIOSPEKTRIT VIRITTYNEISSÄ VÄRÄHDYSTILOISSA Molekyylin jokaiseen värähdystilaan liittyy edellä tarkastellun kaltainen rotaatioenergiatasorakenne. Tavallisesti vain alin värähdystila ( v = 0) on oleellisesti miehitetty, joten rotaatiospektrit syntyvät molekyylin värähdysperustilassa. Värähdystilan v miehitys suhteessa värähdysperustilaan v = 0 lasketaan Boltzmannin jakaumasta: 0 { [ ( v) - (0)]} { w } exp v N exp hc G G hc v = - = - N kt kt ja joillakin molekyyleillä myös ylemmät värähdystilat miehittyvät jonkin verran. Pallohyrrillä dipolimomentti» 0 eikä rotaatiospektrejä havaita (tai hyvin heikkoina, keskipakoisvääristymä) Asymmetrisillä hyrrillä spektrit monimutkaisia. Esim. I molekyylillä w = 5 cm - ja lämpötilassa T = 93K (0 C) hc 3 4,906 0 cm 5cm,0548 kt w - - = = ja suhteelliset miehitykset ovat: v = 0 Nv / N 0 =,00 v = Nv / N 0 = 0,35 v = Nv / N 0 = 0, jne...
25 Usein rotaatiospektrissä näkyy myös vastaavat spektrit ylemmissä värähdystiloissa. Alla esimerkkejä ROTAATIOSPEKTREISTÄ SAATAVIA TULOKSIA Molekyylistä: - rotaatiovakio Þ hitausmomentti Þ rakenne 50 - keskipakoisvääristymävakio Þ tietoa voimakentästä (jousivakio k) - dipolimomentti - ym: ydinspinit ja tietoa kvadrupolaaristen ydinten elektronisesta ympäristöstä, molekyylimallien kvanttimekaniikan tutkimusta, kokeellista informaatiota ns. ab initio-laskuja varten, perustutkimusta Yleensä: - Rotaatiospektrien avulla on löydetty suuri määrä molekyylejä interstellaarisesta avaruudesta. - Monien lasereiden toiminta perustuu molekyylien rotaatiotasojen välisiin siirtymiin.
26 5 MIR-SPEKTROSKOPIA 5 5. KAKSIATOMISET MOLEKYYLIT 5 MIR = Middle InfraRed (keski-infrapuna) Tavallisten (pienten) molekyylien värähdysenergiatasojen väliset siirtymät sattuvat keski-infrapunaalueelle. Myös suurempien molekyylien ns. ryhmävärähtelyt ovat tällä alueella: Värähdyssiirtymä (absorptio) harmonisessa approksimaatiossa D v =+ ja lisäksi molekyylin dipolimomentin täytyy muuttua. Voimakkain siirtymä (miehityksestä johtuen) on v = 0, joka on ns. perusvärähdyssiirtymä. Sitten nopeasti heiketen ns. kuumat siirtymät (kuumat vyöt) v =, v = 3,... Lisäksi epäharmonisuus tuo mukanaan (heikohkoja) ns. ylivärähdyssiirtymiä D v =+, + 3,... Värähdyssiirtymän aaltoluku w 0 = G( v') -G( v ''), D v = v' -v'' Keski-infrapuna-alueen spektroskopia on värähdysspektroskopiaa eli ns. infrapunaspektroskopiaa. rotaatiohieno- Jokaiseen värähdyssiirtymään liittyy rakenne valintasäännöllä D J =±
27 Kun D J =+, siirtymä on R -haaran siirtymä Kun D J =-, siirtymä on P -haaran siirtymä 53 Spektri: 54 Merkinnät: n P( J) = PJ ( ) n R( J) = RJ ( ) Mielenkiintoinen huomio on, että itse värähdyssiirtymän aaltoluvulla w 0 ei ole siirtymää ollenkaan. Oikea esimerkki: R -haaran siirtymien aaltoluvut: RJ ( ) = w0 + BJ ( + )( J+ ) - BJJ ( + ) = w0 + B( J + )( J + - J), = w0 + BJ + B, J = 0,,,3,... P -haaran siirtymien aaltoluvut: P( J) = w0 + B( J -) J - BJ( J + ) = w0 + BJ( J --J - ), = w 0 - BJ, J =,,3,...
28 Esimerkki: H 35 Cl-spektristä havaitaan viivojen R() ja P (3) väliksi 3 cm -. Laske B -vakio. Ratkaisu: R() - P(3) = w0 + 4B+ B-( w0-6 B) = B = 3 cm - Þ B = 0,3 cm - 55 KOMBINAATIOEROTUKSET - spektrianalyysin työkalu A) Ylätilan ( v ') analyysi 56 Edellä rotaatiovakio pidettiin samana, kun siirryttiin värähdystilalta toiselle. Todellisuudessa se muuttuu hieman ja kirjoitetaan Bv = Be - a( v + ), missä a on pieni ns. rotaatio-vibraatio-vuorovaikutusvakio (Coriolis-vakio) ja B e = tasapainotilan B (hypoteettinen) B 0 = värähdysperustilan B B = värähdystilan v = vakio B jne... Erotus R( J) - P( J) = B( J + )( J + ) -B( J -) J = B ( J + J + J + - J + J) = B(4J + ) = 4 B( J + ) sisältää vain ylätilan B -vakion. Mitataan spektristä erotuksia RJ ( )- PJ ( ) ja "piirretään" ne ( J + ):n funktiona: Jos B -vakion muutos otetaan huomioon, esimerkiksi siirtymässä v = 0 saadaan R( J) = w + B( J + )( J + ) - B J( J + ) 0 0 P( J) = w + B ( J -) J - B J( J + ) 0 0
29 B) Alatilan ( v '') analyysi LINEAARISET MOLEKYYLIT 58 Erotus RJ ( -) - PJ ( + ) = B0( J+ )( J+ ) -B0( J-) J = 4 B0 ( J + ) sisältää vain alatilan vakion, joka saadaan: Kaksi tyyppiä:. Paralleelit eli pitkittäiset vyöt - dipolimomentti muuttuu akselin suunnassa - venytysvärähdykset - valintasäännöt D J =± Þ P- ja R-haarat - spektrit kuten -atomisilla Kun B ja B 0 tunnetaan: 3 ìb = Be - a ìa = B0 -B í Þ í îb0 = Be - a îbe = (3 B0 -B) Edelleen B e Þ r e Tasapainotilan (e) sidospituus on tärkeä, koska se on riippumaton isotooppisubstituutiosta. Esim. r e on sama H 35 Cl:llä ja H 35 Cl:llä.
30 . Kohtisuorat vyöt - dipolimomentti muuttuu akselia vastaan kohtisuorassa suunnassa - taivutusvärähdykset - valintasääntöjen D J =± lisäksi havaitaan siirtymiä D J = 0 Þ P- ja R-haarat ja lisäksi ns. Q-haara - Q-haara näkyy terävänä piikkirykelmänä P- ja R- haarojen välissä, paikassa w SYMMETRISET HYRRÄT Termiarvot: FJK (, ) = BJJ ( + ) + ( A- BK ) (pitkulainen) FJK (, ) = BJJ ( + ) + ( C- BK ) (kiekkomainen) Spektrit rakentuvat lineaarisen molekyylin spektrin näköisistä "ali"spektreistä. Yksi alispektri (ns. K-alivyö) vastaa aina yhtä K:n arvoa. 60 Kaksi tyyppiä:. Paralleelit eli pitkittäiset vyöt - dipolimomentti muuttuu akselin suunnassa. Kohtisuorat vyöt - dipolimomentti muuttuu akselia vastaan kohtisuorassa suunnassa
31 Paralleeli: 6 Kohtisuora: 6
32 Kuva : Resoluutio on cm - ja vain Q-haarat erottuvat tasavälisenä piikkisarjana. Huomaa spinstatistiikka. Kun K = 3p niin Q-haarat ovat vahvoja. Helpottaa nimeämisessä NIR-SPEKTROSKOPIA NIR = Near InfraRed (lähi-infrapuna). Sähkömagneettisen spektrin infrapuna-alue on tapana jakaa kolmeen osaan: kaukainen(fir)-, keski(mir)- ja lähi(nir)-infrapuna-alue: 64 Kuva : Spektriä Q -haaran R Q 9 alueelta resoluutiolla cm -. R-haara R R 9 alkaa voimakkaana. Auttaa nimeämisessä. FIR: cm - MIR: cm - NIR: cm - <=> nm <=> nm <=> nm Alueiden rajat eivät ole täsmällisiä ja eri kirjallisuuslähteissä ne saattavat olla hieman eri kohdissa. Kuva 3: Yksityiskohta R Q9 -haarasta J -nimeämisineen. Ensimmäiset J -viivat ovat silpoutuneet ylihienorakenteen takia. Molekyylien rotaatiospektrit havaitaan tyypillisesti FIR-alueella (Luku 4) ja perusvärähdysvyöt ja tyypilliset ryhmävärähtelyt MIR-alueelle (Luku 5). Lähi-infrapunaspektroskopia (NIRS) perustuu puolestaan molekyylien korkeiden kombinaatiovöiden ja ylivärähdysvöiden havaitsemiseen. Kuvassa on esitetty vesimolekyylin värähdysenergiatasokaavio (Luku 3), johon on MIR-alueella havaittavien perusvärähdysvöiden n, n ja n 3 lisäksi on merkitty yksi NIR-alueelle sijoittuva ylivärähdysvyö.
33 65 66 Ylivärähdys- ja kombinaatiovöitä on hyvin tiheässä (lkm/cm - ), joten käytännössä yksittäisiä vöitä ei pystytä erottamaan toisistaan vaan ne sulautuvat yhdeksi kokonaisuudeksi absorptiospektrissä. Esimerkki veden ja eräiden muiden molekyylien NIRspektristä on seuraavalla sivulla. Huomaa, että vaakaakseli on nanometreinä. NIR-spektroskopiaa sovelletaan mm. elintarviketeollisuudessa näytteen aineosien pitoisuuksien määrittämiseen. Vesi-, proteiini-, rasva- ja hiilihydraattimolekyylit sisältävät sidoksia, joiden ylivärähdys- ja kombinaatiovöitä voidaan havaita NIR-alueella esimerkiksi absorptiospektroskopian keinoin. Ylivärähdys- ja kombinaatiosiirtymät ( D v i > ) ovat heikkoja, joten NIR-spektroskopia ei ole erityisen herkkä menetelmä. Suuri etu on kuitenkin se, että näytteen esikäsittely ei ole tarpeen ja analyysit ovat yksinkertaisia ja nopeita. Myös useiden aineosien mittaaminen samanaikaisesti on mahdollista.
34 7 RAMAN-SPEKTROSKOPIA Värähdys- ja rotaatiospektrejä voidaan tutkia paitsi havaitsemalla suoraan energiaeroja D Ev ja D Er myös ns. Raman-spektreistä. Raman-spektroskopia ei perustu absorptioon tai emissioon vaan sirontaan. Viritysvalo menee suurimmaksi osaksi näytteestä läpi, mutta pieni osa siroaa. Sironneesta valosta pääosa on ns. Rayleigh-sironnutta, jossa aallonpituus (taajuus n 0) ei muutu. Tapahtuu myös Raman-sirontaa: - Stokes-Raman-sironta l > l0 ( n < n0) - Anti-Stokes-Raman-sironta l < l0 ( n > n0) 67 Raman-sironneessa valossa havaitaan rotaatio(rot)- ja värähdys(vib)-spektrit kuvan mukaisesti: Stokes- ja anti-stokes puolella nähdään samat spektrit toistensa peilikuvina laser-viivan (Rayleigh-sironnut) suhteen, kuitenkin siten, että Stokes-spektrit ovat vahvempia kuin anti-stokes-spektrit. Siirtymät eivät tapahdu suoraan lähtö- ja lopputilojen välillä, kuten absorptio-spektroskopiassa vaan "kiertävät" ns. virtuaalisten tilojen kautta. Loppujen lopuksi kuitenkin efektiivisesti alku- ja lopputilat ovat samoja kuin absorptiospektroskopiassa. Tehtävä: Pohdi viereisen kuvan perusteella miksi Anti-Stokes siirtymät ovat heikkoja. 68
35 KAKSIATOMISTEN JA LINEAARISTEN MOLEKYYLIEN ROTAATIO-RAMAN-SPEKTRIT Rotaatiotermiarvot: F( J) = BJ( J + ) Valintasäännöt : D J = J' - J'' =± Lisäksi: molekyylin polarisoituvuuden on oltava anisotrooppista. Säteily polarisoi molekyyliä, ts. pyrkii erottamaan negatiivisia ja positiivisia varauksia toisistaan. Molekyylin polarisoituvuus mittaa sitä määrää mihin asti molekyyliä voidaan polarisoida. Rotaatio-Ramanspektri voi olla olemassa, jos polarisoituvuus on anisotrooppista. Näin on kaikilla molekyyleillä paitsi pallohyrrillä. Efektiiviset D J =± siirtymät on esitetty seuraavan sivun kuvassa. Lasketaan aaltoluvut: F( J + ) -F( J) = B( J + )( J + 3) - BJ( J + ) = B J + J + -J -J [ 5 6 ] = 4BJ + 6B Stokes-viivoille n = n0 -(4BJ + 6 B) ja anti-stokes-viivoille n = n0 + (4BJ + 6 B) Näissä n 0 =laserin aaltoluku (Rayleigh-sironta) J =alemman tilan J (siirtymässä) Ensimmäinen spektriviiva sekä Stokes- että anti- Stokes-spektrissä on 6B:n etäisyydellä laserviivasta ja sitten viivat esiintyvät 4B:n välein.
36 Esim. N -molekyylin Raman-rotaatiospektri 7 7. KAKSIATOMISTEN MOLEKYYLIEN VÄRÄHDYS-RAMAN-SPEKTRIT 7 - laser HeNe l = 63.8 nm - intensiteetit miehitysten mukaiset (. approksimaatio) - anti-stokes-puoli (vasen) vähän heikompi - spektriin merkitty siirtymän lähtötilan kvanttiluku Raman-spektroskopia täydentää absorptio(emissio)- spektroskopiaa. Esimerkiksi symmetrisillä molekyyleillä, kuten N, O, HCCH, NCCN,..., ei ole dipolimomenttia eikä siten absorptio(emissio)-rotaatiospektriä. Näiden rotaatioenergiatiloja voidaan kuitenkin tutkia Raman-spektreillä, jollaiset niillä on. - Raman-sironta on ylipäätään heikkoa - värähdystilan muutokseen liittyvä sironta on erityisen heikkoa. - kaasufaasin värähdys-raman-spektroskopia teknisesti vaikeaa - kuitenkin se on tärkeä menetelmä symmetrisillä - atomisilla molekyyleillä, joiden dipolimomentti ei muutu värähdyssiirtymässä eikä niillä ole absorptiospektriä. Raman-spektrin syntymisen ehtona on polarisoituvuuden muutos värähdystilan muuttuessa. Värähdystilojen välisten efektiivisten siirtymien valintasäännöt samat kuin absorptiospektroskopiassa ja myös nyt siirtymä v = -0 on tärkein. Anti-Stokes-spektri syntyy efektiivisesti värähdyssiirtymästä v = 0, joten sitä ei käytännössä havaita. Stokes-siirtymä on v = 0 ja se havaitaan.
37 Värähdyssiirtymään liittyviä rotaatiosiirtymiä hallitsee valintasäännöt D J = 0, ±, ja niiden mukaisesti spektrissä havaitaan haarat: O-haara: D J =- Q-haara: D J = 0 S-haara: D J =+ 73 O-haara: O( J) = ( n - w ) + B( J -)( J -) - BJ( J + ) 0 0 = ( n0 -w0) - B(J -) Ensimmäinen viiva: O () (huom!) Q-haara: Q( J) = ( n0 - w0) + BJ( J + ) - BJ( J + ) = ( n0 -w0) Ensimmäinen viiva: Q(0) 74 S-haara: S( J) = ( n - w ) + B( J + )( J + 3) - BJ( J + ) 0 0 = ( n0 - w0) + B(J + 3) Ensimmäinen viiva: S(0) Lasketaan siirtymien aaltoluvut. Ensin on huomattava, että Raman-spektri ei ole värähdysaaltoluvun w 0 ympäristössä infrapuna-alueella, vaan lähellä laserin aaltolukua n 0 (jopa näkyvällä alueella), tarkemmin paikassa n0 - w0. Tässä approksimaatiossa ( B0 = B = B) Q-haaran viivat ovat kaikki ( n0 - w0) : ssa, S -haara avautuu 4B:n välein ylöspäin ja O-haara 4B:n välein alaspäin:
38 75 8 KOKEELLISISTA MENETELMISTÄ INFRAPUNA-ABSORPTIOSPEKTROSKOPIA Huomaa, että aaltolukuasteikko on annettu D n : n avulla, jolloin spektri keskittyy w 0 :n ympäristöön. Lähde: kuuma kappale, säteilee Planckin lain mukaan kaikkia aallonpituuksia kaukaisessa infrapunassa säteilyä vain vähän ja lisäksi ilmakehän vesi absorboi Þ teknisesti vaativaa (mittaukset tehtävä tyhjiössä) Ilmaisin: -puolijohdedetektorit (nestetyppijäähdytys) - kaukaisessa infrapunassa bolometri (neste-he-jäähdytys)
39 Dispersiivinen elementti: - prisma (mitä suurempi sen parempi erotuskyky) - hila (mitä leveämpi sen parempi erotuskyky) - interferometri (Fourier-spektroskopia) Fourier-spektrometri: MIKROAALTOSPEKTROSKOPIA - kokeellinen perusta on. maailmansodan aikaisessa tutkan kehityksessä Lähde: Elektroninen laite ns. klystron putki, jonka tyypillinen taajuusalue on 5 75 GHz eli aallonpituuksina l» cm 3 mm. Korkeampia taajuuksia saadaan tuottamalla epälineaarisilla elementeillä klystronvärähtelyjen harmonisia ylivärähdyksiä. 78 Aalto etenee metalliputkessa (aaltojohteessa) lähteestä ilmaisimella. Näytesäiliö on ikkunoilla eristetty osa aaltojohdetta. Dispersiivinen elementti: ei tarvita, klystron putki tuottaa hyvin monokromaattista säteilyä, jonka taajuutta voidaan säätää. Ilmaisin: - kärkidiodi (point contact diode, tasasuuntauskidediodi) - bolometri, jäähdytettynä neste-he:llä
40 8.3 RAMAN-SPEKTROSKOPIA Luonnollinen leveys (Heisenbergin epätarkkuus) Ei voida vaikuttaa, mutta on pieni edellisten rinnalla. 80 Erotuskyky (resoluutio): l R =, D l missä D l on pienin aallonpituusero, joka vielä voidaan erottaa aalonpituudella l. Laser fokusoidaan näytteeseen ja sironnut valo ohjataan peilien tehostuksella tavalliseen spektrometriin ja mitataan spektri. 8.4 SPEKTRIVIIVAN LEVEYS - vaikuttaa instrumentti (instrumenttifunktio), joka usein voidaan "hyvällä" mittauksella eliminoida. Vaikuttamaan jää luonnon omat rajat:. Painelevenemä (törmäykset). Voidaan vähentää pienentämällä näytekaasun painetta.. Doppler-levenemä (molekyylien liike). Voidaan vähentää alentamalla lämpötilaa. Aaltolukuina: dn Dl n = Þ =- ÞD n = - D l = l dl l l l eli l l n R = = = Dl l Dl Dn
Infrapunaspektroskopia
 ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
PHYS-C0240 Materiaalifysiikka (5op), kevät 2016
 PHYS-C0240 Materiaalifysiikka (5op), kevät 2016 Prof. Martti Puska Emppu Salonen Tomi Ketolainen Ville Vierimaa Luento 7: Hilavärähtelyt tiistai 12.4.2016 Aiheet tänään Hilavärähtelyt: johdanto Harmoninen
PHYS-C0240 Materiaalifysiikka (5op), kevät 2016 Prof. Martti Puska Emppu Salonen Tomi Ketolainen Ville Vierimaa Luento 7: Hilavärähtelyt tiistai 12.4.2016 Aiheet tänään Hilavärähtelyt: johdanto Harmoninen
MIKKELIN LUKIO SPEKTROMETRIA. NOT-tiedekoulu La Palma
 MIKKELIN LUKIO SPEKTROMETRIA NOT-tiedekoulu La Palma Kasper Honkanen, Ilona Arola, Lotta Loponen, Helmi-Tuulia Korpijärvi ja Anastasia Koivikko 20.11.2011 Ryhmämme työ käsittelee spektrometriaa ja sen
MIKKELIN LUKIO SPEKTROMETRIA NOT-tiedekoulu La Palma Kasper Honkanen, Ilona Arola, Lotta Loponen, Helmi-Tuulia Korpijärvi ja Anastasia Koivikko 20.11.2011 Ryhmämme työ käsittelee spektrometriaa ja sen
1240eV nm. 410nm. Kun kappaleet saatetaan kontaktiin jännite-ero on yhtä suuri kuin työfunktioiden erotus ΔV =
 S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
Mustan kappaleen säteily
 Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
FYSA230/2 SPEKTROMETRI, HILA JA PRISMA
 FYSA230/2 SPEKTROMETRI, HILA JA PRISMA 1 JOHDANTO Työssä tutustutaan hila- ja prismaspektrometreihin, joiden avulla tutkitaan valon taipumista hilassa ja taittumista prismassa. Samalla tutustutaan eräiden
FYSA230/2 SPEKTROMETRI, HILA JA PRISMA 1 JOHDANTO Työssä tutustutaan hila- ja prismaspektrometreihin, joiden avulla tutkitaan valon taipumista hilassa ja taittumista prismassa. Samalla tutustutaan eräiden
, m s ) täytetään alimmasta energiatilasta alkaen. Alkuaineet joiden uloimmalla elektronikuorella on samat kvanttiluvut n,
 S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
Kvantittuminen. E = hf f on säteilyn taajuus h on Planckin vakio h = 6, Js = 4, evs. Planckin kvanttihypoteesi
 Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 8 Vaimennettu värähtely Elävässä elämässä heilureiden ja muiden värähtelijöiden liike sammuu ennemmin tai myöhemmin. Vastusvoimien takia värähtelijän
Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 8 Vaimennettu värähtely Elävässä elämässä heilureiden ja muiden värähtelijöiden liike sammuu ennemmin tai myöhemmin. Vastusvoimien takia värähtelijän
a) Jos törmäysten määrä sekunnissa on f = s 1 ja jokainen törmäys deaktivoi virityksen, niin viritystilan keskimääräinen elinikä on
 KEMA225 syksy 2016 Demo 6 Malliratkaisut 1. Törmäyksistä johtuva viivan levenemä on muotoa δe = h τ, (1) jossa τ on viritystilan keskimääräinen elinaika. Tämä tulos löytyy luentoslaideista ja Atkinsista
KEMA225 syksy 2016 Demo 6 Malliratkaisut 1. Törmäyksistä johtuva viivan levenemä on muotoa δe = h τ, (1) jossa τ on viritystilan keskimääräinen elinaika. Tämä tulos löytyy luentoslaideista ja Atkinsista
SPEKTROMETRI, HILA JA PRISMA
 FYSA234/K2 SPEKTROMETRI, HILA JA PRISMA 1 Johdanto Kvanttimekaniikan mukaan atomi voi olla vain tietyissä, määrätyissä energiatiloissa. Perustilassa, jossa atomi normaalisti on, energia on pienimmillään.
FYSA234/K2 SPEKTROMETRI, HILA JA PRISMA 1 Johdanto Kvanttimekaniikan mukaan atomi voi olla vain tietyissä, määrätyissä energiatiloissa. Perustilassa, jossa atomi normaalisti on, energia on pienimmillään.
Luku 14: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Wien R-J /home/heikki/cele2008_2010/musta_kappale_approksimaatio Wed Mar 13 15:33:
 1.2 T=12000 K 10 2 T=12000 K 1.0 Wien R-J 10 0 Wien R-J B λ (10 15 W/m 3 /sterad) 0.8 0.6 0.4 B λ (10 15 W/m 3 /sterad) 10-2 10-4 10-6 10-8 0.2 10-10 0.0 0 200 400 600 800 1000 nm 10-12 10 0 10 1 10 2
1.2 T=12000 K 10 2 T=12000 K 1.0 Wien R-J 10 0 Wien R-J B λ (10 15 W/m 3 /sterad) 0.8 0.6 0.4 B λ (10 15 W/m 3 /sterad) 10-2 10-4 10-6 10-8 0.2 10-10 0.0 0 200 400 600 800 1000 nm 10-12 10 0 10 1 10 2
Luku 13: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia
 Luku 13: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia Yleisiä piirteitä Puhdas rotaatiospektri 2-atomisen molekyylin värähtely moniatomisten molekyylien värähtely 1 Tarkastellaan sähkömagneettisen
Luku 13: Molekyylispektroskopia 1 rotaatio- ja värähdysspektroskopia Yleisiä piirteitä Puhdas rotaatiospektri 2-atomisen molekyylin värähtely moniatomisten molekyylien värähtely 1 Tarkastellaan sähkömagneettisen
3.1 Varhaiset atomimallit (1/3)
 + 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
+ 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
Kvanttifysiikan perusteet 2017
 Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
ö ø Ilmaääneneristävyys [db] 60 6 mm Taajuus [Hz]
![ö ø Ilmaääneneristävyys [db] 60 6 mm Taajuus [Hz] ö ø Ilmaääneneristävyys [db] 60 6 mm Taajuus [Hz]](/thumbs/29/13235625.jpg) Aalto-yliopisto. ELEC-E564. Meluntorjunta L. Laskuharjoituksien -5 ratkaisut... a) Johda normaalitulokulman massalaki lg(m )-4 yhtälöstä (.6.). ½p. b) Laske ilmaääneneristävyys massalain avulla 6 ja 3
Aalto-yliopisto. ELEC-E564. Meluntorjunta L. Laskuharjoituksien -5 ratkaisut... a) Johda normaalitulokulman massalaki lg(m )-4 yhtälöstä (.6.). ½p. b) Laske ilmaääneneristävyys massalain avulla 6 ja 3
LIITE 11A: VALOSÄHKÖINEN ILMIÖ
 LIITE 11A: VALOSÄHKÖINEN ILMIÖ Valosähköisellä ilmiöllä ymmärretään tässä oppikirjamaisesti sitä, että kun virtapiirissä ja tyhjiölampussa olevan anodi-katodi yhdistelmän katodia säteilytetään fotoneilla,
LIITE 11A: VALOSÄHKÖINEN ILMIÖ Valosähköisellä ilmiöllä ymmärretään tässä oppikirjamaisesti sitä, että kun virtapiirissä ja tyhjiölampussa olevan anodi-katodi yhdistelmän katodia säteilytetään fotoneilla,
n=5 n=4 M-sarja n=3 L-sarja n=2 Lisäys: K-sarjan hienorakenne K-sarja n=1
 10.1 RÖNTGENSPEKTRI Kun kiihdytetyt elektronit törmäävät anodiin, syntyy jatkuvaa säteilyä sekä anodimateriaalille ominaista säteilyä (spektrin terävät piikit). Atomin uloimpien elektronien poistamiseen
10.1 RÖNTGENSPEKTRI Kun kiihdytetyt elektronit törmäävät anodiin, syntyy jatkuvaa säteilyä sekä anodimateriaalille ominaista säteilyä (spektrin terävät piikit). Atomin uloimpien elektronien poistamiseen
Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori!
 6.1 Työ Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori! Siirtymä s = r 2 r 1 Kun voiman kohteena olevaa kappaletta voidaan kuvata
6.1 Työ Voima F tekee työtä W vaikuttaessaan kappaleeseen, joka siirtyy paikasta r 1 paikkaan r 2. Työ on skalaarisuure, EI vektori! Siirtymä s = r 2 r 1 Kun voiman kohteena olevaa kappaletta voidaan kuvata
MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI
 sivu 1/5 MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI Kohderyhmä: Kesto: Tavoitteet: Toteutus: Peruskoulu / lukio 15 min. Työn tavoitteena on havainnollistaa
sivu 1/5 MIKSI ERI AINEET NÄYTTÄVÄT TIETYN VÄRISILTÄ? ELINTARVIKEVÄRIEN NÄKYVÄN AALLONPITUUDEN SPEKTRI Kohderyhmä: Kesto: Tavoitteet: Toteutus: Peruskoulu / lukio 15 min. Työn tavoitteena on havainnollistaa
Fysiikka 8. Aine ja säteily
 Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Ekvipartitioperiaatteen mukaisesti jokaiseen efektiiviseen vapausasteeseen liittyy (1 / 2)kT energiaa molekyyliä kohden.
 . Hiilidioksidiolekyyli CO tiedetään lineaariseksi a) Mitkä ovat eteneisliikkeen, pyöriisliikkeen ja värähtelyn suuriat ekvipartitioperiaatteen ukaiset läpöenergiat olekyyliä kohden, kun kaikki vapausasteet
. Hiilidioksidiolekyyli CO tiedetään lineaariseksi a) Mitkä ovat eteneisliikkeen, pyöriisliikkeen ja värähtelyn suuriat ekvipartitioperiaatteen ukaiset läpöenergiat olekyyliä kohden, kun kaikki vapausasteet
Nyt n = 1. Tästä ratkaistaan kuopan leveys L ja saadaan sijoittamalla elektronin massa ja vakiot
 S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
Luento 10: Työ, energia ja teho. Johdanto Työ ja kineettinen energia Teho
 Luento 10: Työ, energia ja teho Johdanto Työ ja kineettinen energia Teho 1 / 23 Luennon sisältö Johdanto Työ ja kineettinen energia Teho 2 / 23 Johdanto Energia suure, joka voidaan muuttaa muodosta toiseen,
Luento 10: Työ, energia ja teho Johdanto Työ ja kineettinen energia Teho 1 / 23 Luennon sisältö Johdanto Työ ja kineettinen energia Teho 2 / 23 Johdanto Energia suure, joka voidaan muuttaa muodosta toiseen,
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering, Micro- and Nanosciences Laboratory. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
11. MOLEKYYLIT. Kvanttimekaniikka on käyttökelpoinen molekyyleille, jos se pystyy selittämään atomien välisten sidosten syntymisen.
 11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
Luento 13: Periodinen liike. Johdanto Harmoninen värähtely Esimerkkejä F t F r
 Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä θ F t m g F r 1 / 27 Luennon sisältö Johdanto Harmoninen värähtely Esimerkkejä 2 / 27 Johdanto Tarkastellaan jaksollista liikettä (periodic
Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä θ F t m g F r 1 / 27 Luennon sisältö Johdanto Harmoninen värähtely Esimerkkejä 2 / 27 Johdanto Tarkastellaan jaksollista liikettä (periodic
S-108-2110 OPTIIKKA 1/10 Laboratoriotyö: Polarisaatio POLARISAATIO. Laboratoriotyö
 S-108-2110 OPTIIKKA 1/10 POLARISAATIO Laboratoriotyö S-108-2110 OPTIIKKA 2/10 SISÄLLYSLUETTELO 1 Polarisaatio...3 2 Työn suoritus...6 2.1 Työvälineet...6 2.2 Mittaukset...6 2.2.1 Malus:in laki...6 2.2.2
S-108-2110 OPTIIKKA 1/10 POLARISAATIO Laboratoriotyö S-108-2110 OPTIIKKA 2/10 SISÄLLYSLUETTELO 1 Polarisaatio...3 2 Työn suoritus...6 2.1 Työvälineet...6 2.2 Mittaukset...6 2.2.1 Malus:in laki...6 2.2.2
FYSIIKAN LABORATORIOTYÖT 2 HILA JA PRISMA
 FYSIIKAN LABORATORIOTYÖT HILA JA PRISMA MIKKO LAINE 9. toukokuuta 05. Johdanto Tässä työssä muodostamme lasiprisman dispersiokäyrän ja määritämme työn tekijän silmän herkkyysrajan punaiselle valolle. Lisäksi
FYSIIKAN LABORATORIOTYÖT HILA JA PRISMA MIKKO LAINE 9. toukokuuta 05. Johdanto Tässä työssä muodostamme lasiprisman dispersiokäyrän ja määritämme työn tekijän silmän herkkyysrajan punaiselle valolle. Lisäksi
Infrapunaspektroskopia
 ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
ultravioletti näkyvä valo Infrapunaspektroskopia IHMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Kertausta sähkömagneettisesta säteilystä Sekä IR-spektroskopia että NMR-spektroskopia käyttävät sähkömagneettista
Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen)
 Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen Vapaaseen hiukkaseen ei vaikuta voimia, joten U(x = 0. Vapaan hiukkasen energia on sen liike-energia eli E=p /m. Koska hiukkasella on määrätty energia,
Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen Vapaaseen hiukkaseen ei vaikuta voimia, joten U(x = 0. Vapaan hiukkasen energia on sen liike-energia eli E=p /m. Koska hiukkasella on määrätty energia,
Luku 13: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
766334A Ydin- ja hiukkasfysiikka
 1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
Erityinen suhteellisuusteoria (Harris luku 2)
 Erityinen suhteellisuusteoria (Harris luku 2) Yliopistonlehtori, TkT Sami Kujala Mikro- ja nanotekniikan laitos Kevät 2016 Ajan ja pituuden suhteellisuus Relativistinen työ ja kokonaisenergia SMG-aaltojen
Erityinen suhteellisuusteoria (Harris luku 2) Yliopistonlehtori, TkT Sami Kujala Mikro- ja nanotekniikan laitos Kevät 2016 Ajan ja pituuden suhteellisuus Relativistinen työ ja kokonaisenergia SMG-aaltojen
12. Eristeet Vapaa atomi. Muodostuva sähköinen dipolimomentti on p =! " 0 E loc (12.4)
 12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa
 Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 7 Harmonisen värähdysliikkeen energia Jousen potentiaalienergia on U k( x ) missä k on jousivakio ja Dx on poikkeama tasapainosta. Valitaan
Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 7 Harmonisen värähdysliikkeen energia Jousen potentiaalienergia on U k( x ) missä k on jousivakio ja Dx on poikkeama tasapainosta. Valitaan
Osallistumislomakkeen viimeinen palautuspäivä on maanantai
 Jakso : Materiaalihiukkasten aaltoluonne. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 3 ja hyvin myös peruskurssitasoisista kirjoista. Seuraavat videot demonstroivat vaihe- ja ryhmänopeutta:
Jakso : Materiaalihiukkasten aaltoluonne. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 3 ja hyvin myös peruskurssitasoisista kirjoista. Seuraavat videot demonstroivat vaihe- ja ryhmänopeutta:
on radan suuntaiseen komponentti eli tangenttikomponentti ja on radan kaarevuuskeskipisteeseen osoittavaan komponentti. (ks. kuva 1).
 H E I L U R I T 1) Matemaattinen heiluri = painottoman langan päässä heilahteleva massapiste (ks. kuva1) kuva 1. - heilurin pituus l - tasapainoasema O - ääriasemat A ja B - heilahduskulma - heilahdusaika
H E I L U R I T 1) Matemaattinen heiluri = painottoman langan päässä heilahteleva massapiste (ks. kuva1) kuva 1. - heilurin pituus l - tasapainoasema O - ääriasemat A ja B - heilahduskulma - heilahdusaika
23 VALON POLARISAATIO 23.1 Johdanto. 23.2 Valon polarisointi ja polarisaation havaitseminen
 3 VALON POLARISAATIO 3.1 Johdanto Mawellin htälöiden avulla voidaan johtaa aaltohtälö sähkömagneettisen säteiln etenemiselle väliaineessa. Mawellin htälöiden ratkaisusta seuraa aina, että valo on poikittaista
3 VALON POLARISAATIO 3.1 Johdanto Mawellin htälöiden avulla voidaan johtaa aaltohtälö sähkömagneettisen säteiln etenemiselle väliaineessa. Mawellin htälöiden ratkaisusta seuraa aina, että valo on poikittaista
2. Fotonit, elektronit ja atomit
 Luento 4 2. Fotonit, elektronit ja atomit Valon kvanttiteoria; fotoni Valosähköinen ilmiö ja sen kvanttiselitys Valon emissio ja absorptio Säteilyn spektri; atomin energiatasot Atomin rakenne Niels Bohrin
Luento 4 2. Fotonit, elektronit ja atomit Valon kvanttiteoria; fotoni Valosähköinen ilmiö ja sen kvanttiselitys Valon emissio ja absorptio Säteilyn spektri; atomin energiatasot Atomin rakenne Niels Bohrin
Luku 8. Mekaanisen energian säilyminen. Konservatiiviset ja eikonservatiiviset. Potentiaalienergia Voima ja potentiaalienergia.
 Luku 8 Mekaanisen energian säilyminen Konservatiiviset ja eikonservatiiviset voimat Potentiaalienergia Voima ja potentiaalienergia Mekaanisen energian säilyminen Teho Tavoitteet: Erottaa konservatiivinen
Luku 8 Mekaanisen energian säilyminen Konservatiiviset ja eikonservatiiviset voimat Potentiaalienergia Voima ja potentiaalienergia Mekaanisen energian säilyminen Teho Tavoitteet: Erottaa konservatiivinen
Voima ja potentiaalienergia II Energian kvantittuminen
 Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
Perusopintojen Laboratoriotöiden Työselostus 1
 Perusopintojen Laboratoriotöiden Työselostus 1 Kalle Hyvönen Työ tehty 1. joulukuuta 008, Palautettu 30. tammikuuta 009 1 Assistentti: Mika Torkkeli Tiivistelmä Laboratoriossa tehdyssä ensimmäisessä kokeessa
Perusopintojen Laboratoriotöiden Työselostus 1 Kalle Hyvönen Työ tehty 1. joulukuuta 008, Palautettu 30. tammikuuta 009 1 Assistentti: Mika Torkkeli Tiivistelmä Laboratoriossa tehdyssä ensimmäisessä kokeessa
Aaltojen heijastuminen ja taittuminen
 Luku 11 Aaltojen heijastuminen ja taittuminen Tässä luvussa käsitellään sähkömagneettisten aaltojen heijastumista ja taittumista väliaineiden rajapinnalla. Rajoitutaan monokromaattisiin aaltoihin ja oletetaan
Luku 11 Aaltojen heijastuminen ja taittuminen Tässä luvussa käsitellään sähkömagneettisten aaltojen heijastumista ja taittumista väliaineiden rajapinnalla. Rajoitutaan monokromaattisiin aaltoihin ja oletetaan
H7 Malliratkaisut - Tehtävä 1
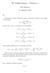 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
YLEINEN AALTOLIIKEOPPI
 YLEINEN AALTOLIIKEOPPI KEVÄT 2017 1 Saana-Maija Huttula (saana.huttula@oulu.fi) Maanantai Tiistai Keskiviikko Torstai Perjantai Vk 8 Luento 1 Mekaaniset aallot 1 Luento 2 Mekaaniset aallot 2 Ääni ja kuuleminen
YLEINEN AALTOLIIKEOPPI KEVÄT 2017 1 Saana-Maija Huttula (saana.huttula@oulu.fi) Maanantai Tiistai Keskiviikko Torstai Perjantai Vk 8 Luento 1 Mekaaniset aallot 1 Luento 2 Mekaaniset aallot 2 Ääni ja kuuleminen
Työn tavoitteita. 1 Teoriaa
 FYSP103 / K3 BRAGGIN DIFFRAKTIO Työn tavoitteita havainnollistaa röntgendiffraktion periaatetta konkreettisen laitteiston avulla ja kerrata luennoilla läpikäytyä teoriatietoa Röntgendiffraktio on tärkeä
FYSP103 / K3 BRAGGIN DIFFRAKTIO Työn tavoitteita havainnollistaa röntgendiffraktion periaatetta konkreettisen laitteiston avulla ja kerrata luennoilla läpikäytyä teoriatietoa Röntgendiffraktio on tärkeä
Aaltoliike ajan suhteen:
 Aaltoliike Aaltoliike on etenevää värähtelyä Värähdysliikkeen jaksonaika T on yhteen värähdykseen kuluva aika Värähtelyn taajuus on sekunnissa tapahtuvien värähdysten lukumäärä Taajuuden ƒ yksikkö Hz (hertsi,
Aaltoliike Aaltoliike on etenevää värähtelyä Värähdysliikkeen jaksonaika T on yhteen värähdykseen kuluva aika Värähtelyn taajuus on sekunnissa tapahtuvien värähdysten lukumäärä Taajuuden ƒ yksikkö Hz (hertsi,
d sinα Fysiikan laboratoriotyöohje Tietotekniikan koulutusohjelma OAMK Tekniikan yksikkö TYÖ 8: SPEKTROMETRITYÖ I Optinen hila
 Fysiikan laboratoriotyöohje Tietotekniikan koulutusohjelma OAMK Tekniikan yksikkö TYÖ 8: SPEKTROMETRITYÖ I Optinen hila Optisessa hilassa on hyvin suuri määrä yhdensuuntaisia, toisistaan yhtä kaukana olevia
Fysiikan laboratoriotyöohje Tietotekniikan koulutusohjelma OAMK Tekniikan yksikkö TYÖ 8: SPEKTROMETRITYÖ I Optinen hila Optisessa hilassa on hyvin suuri määrä yhdensuuntaisia, toisistaan yhtä kaukana olevia
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys102 Syksy 2009 Jukka Maalampi LUENTO 12 Aallot kahdessa ja kolmessa ulottuvuudessa Toistaiseksi on tarkasteltu aaltoja, jotka etenevät yhteen suuntaan. Yleisempiä tapauksia ovat
Mekaniikan jatkokurssi Fys102 Syksy 2009 Jukka Maalampi LUENTO 12 Aallot kahdessa ja kolmessa ulottuvuudessa Toistaiseksi on tarkasteltu aaltoja, jotka etenevät yhteen suuntaan. Yleisempiä tapauksia ovat
5.10. HIUKKANEN POTENTIAALIKUOPASSA
 5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
4 ev OY/MFP R Materiaalifysiikan perusteet P Ratkaisut 6, Kevät 2017
 OY/MFP R6 017 Materiaalifysiikan perusteet 514P Ratkaisut 6, Kevät 017 1. Koska kuvitteellisten materiaalien hila on pkk-hila, niiden käänteishila on tkk-hila ja Brillouin-koppi on Kuvan 1.1 mukainen.
OY/MFP R6 017 Materiaalifysiikan perusteet 514P Ratkaisut 6, Kevät 017 1. Koska kuvitteellisten materiaalien hila on pkk-hila, niiden käänteishila on tkk-hila ja Brillouin-koppi on Kuvan 1.1 mukainen.
Atomien rakenteesta. Tapio Hansson
 Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Aikaerotteinen spektroskopia valokemian tutkimuksessa
 Aikaerotteinen spektroskopia valokemian tutkimuksessa TkT Marja Niemi Tampereen teknillinen yliopisto Kemian ja biotekniikan laitos 23.4.2012 Suomalainen Tiedeakatemia, Nuorten klubi DI 2002, TTKK Materiaalitekniikan
Aikaerotteinen spektroskopia valokemian tutkimuksessa TkT Marja Niemi Tampereen teknillinen yliopisto Kemian ja biotekniikan laitos 23.4.2012 Suomalainen Tiedeakatemia, Nuorten klubi DI 2002, TTKK Materiaalitekniikan
Fysiikan laboratoriotyöt 2, osa 2 ATOMIN SPEKTRI
 Fysiikan laitos, kevät 2009 Fysiikan laboratoriotyöt 2, osa 2 ATOMIN SPEKTRI Valon diffraktioon perustuvia hilaspektrometrejä käytetään yleisesti valon aallonpituuden määrittämiseen. Tätä prosessia kutsutaan
Fysiikan laitos, kevät 2009 Fysiikan laboratoriotyöt 2, osa 2 ATOMIN SPEKTRI Valon diffraktioon perustuvia hilaspektrometrejä käytetään yleisesti valon aallonpituuden määrittämiseen. Tätä prosessia kutsutaan
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
Oikeat vastaukset: Tehtävän tarkkuus on kolme numeroa. Sulamiseen tarvittavat lämmöt sekä teräksen suurin mahdollinen luovutettu lämpö:
 A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
12. Eristeet Vapaa atomi
 12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
12. Eristeet Eristeiden tyypillisiä piirteitä ovat kovalenttiset sidokset (tai vahvat ionisidokset) ja siitä seuraavat mekaaniset ja sähköiset ominaisuudet. Makroskooppisen ulkoisen sähkökentän E läsnäollessa
Luento 11: Periodinen liike
 Luento 11: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä Laskettuja esimerkkejä ~F t m~g ~F r Konseptitesti 1 Tehtävänanto Kuvassa on jouseen kytketyn massan sijainti ajan funktiona. Kuvaile
Luento 11: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä Laskettuja esimerkkejä ~F t m~g ~F r Konseptitesti 1 Tehtävänanto Kuvassa on jouseen kytketyn massan sijainti ajan funktiona. Kuvaile
Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2011 Insinöörivalinnan fysiikan koe 1.6.2011, malliratkaisut
 A1 Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2011 Täydennä kuhunkin kohtaan yhtälöstä puuttuva suure tai vakio alla olevasta taulukosta. Anna vastauksena kuhunkin kohtaan ainoastaan
A1 Diplomi-insinöörien ja arkkitehtien yhteisvalinta - dia-valinta 2011 Täydennä kuhunkin kohtaan yhtälöstä puuttuva suure tai vakio alla olevasta taulukosta. Anna vastauksena kuhunkin kohtaan ainoastaan
Radioastronomia harjoitustyö; vedyn 21cm spektriviiva
 Radioastronomia harjoitustyö; vedyn 21cm spektriviiva Tässä työssä tehdään spektriviivahavainto atomaarisen vedyn 21cm siirtymästä käyttäen yllä olevassa kuvassa olevaa Observatorion SRT (Small Radio Telescope)
Radioastronomia harjoitustyö; vedyn 21cm spektriviiva Tässä työssä tehdään spektriviivahavainto atomaarisen vedyn 21cm siirtymästä käyttäen yllä olevassa kuvassa olevaa Observatorion SRT (Small Radio Telescope)
Fysikaalisen kemian syventävät työt CCl 4 -molekyylin Ramanspektroskopia
 Fysikaalisen kemian syventävät työt CCl 4 -molekyylin Ramanspektroskopia Tiina Kiviniemi 11. huhtikuuta 2008 1 Johdanto Tämän työn tarkoituksena on tutustua käytännön Ramanspektroskopiaan sekä molekyylien
Fysikaalisen kemian syventävät työt CCl 4 -molekyylin Ramanspektroskopia Tiina Kiviniemi 11. huhtikuuta 2008 1 Johdanto Tämän työn tarkoituksena on tutustua käytännön Ramanspektroskopiaan sekä molekyylien
Fysiikan valintakoe klo 9-12
 Fysiikan valintakoe 2.5.208 klo 9-2. Koripalloilija heittää vapaaheiton. Hän lähettää pallon liikkeelle korkeudelta,83 m alkuvauhdilla 7,53 m/s kulmassa 43,2 vaakatason yläpuolella. Pallon lähtöpisteen
Fysiikan valintakoe 2.5.208 klo 9-2. Koripalloilija heittää vapaaheiton. Hän lähettää pallon liikkeelle korkeudelta,83 m alkuvauhdilla 7,53 m/s kulmassa 43,2 vaakatason yläpuolella. Pallon lähtöpisteen
Jakso 6: Värähdysliikkeet Tämän jakson tehtävät on näytettävä viimeistään torstaina
 Jakso 6: Värähdysliikkeet Tämän jakson tehtävät on näytettävä viimeistään torstaina 31.5.2012. T 6.1 (pakollinen): Massa on kiinnitetty pystysuoran jouseen. Massaa poikkeutetaan niin, että se alkaa värähdellä.
Jakso 6: Värähdysliikkeet Tämän jakson tehtävät on näytettävä viimeistään torstaina 31.5.2012. T 6.1 (pakollinen): Massa on kiinnitetty pystysuoran jouseen. Massaa poikkeutetaan niin, että se alkaa värähdellä.
Luento 13: Periodinen liike
 Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä Laskettuja esimerkkejä ~F t m~g ~F r ELEC-A3110 Mekaniikka (5 op) Sami Kujala Syksy 2016 Mikro- ja nanotekniikan laitos Ajankohtaista
Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä Laskettuja esimerkkejä ~F t m~g ~F r ELEC-A3110 Mekaniikka (5 op) Sami Kujala Syksy 2016 Mikro- ja nanotekniikan laitos Ajankohtaista
FYSA220/K2 (FYS222/K2) Vaimeneva värähtely
 FYSA/K (FYS/K) Vaimeneva värähtely Työssä tutkitaan vaimenevaa sähköistä värähysliikettä. Erityisesti pyritään havainnollistamaan kelan inuktanssin, konensaattorin kapasitanssin ja ohmisen vastuksen suuruuksien
FYSA/K (FYS/K) Vaimeneva värähtely Työssä tutkitaan vaimenevaa sähköistä värähysliikettä. Erityisesti pyritään havainnollistamaan kelan inuktanssin, konensaattorin kapasitanssin ja ohmisen vastuksen suuruuksien
Lataa ilmaiseksi mafyvalmennus.fi/mafynetti. Valmistaudu pitkän- tai lyhyen matematiikan kirjoituksiin ilmaiseksi Mafynetti-ohjelmalla!
 Miten opit parhaiten? Valmistaudu pitkän- tai lyhyen matematiikan kirjoituksiin ilmaiseksi Mafynetti-ohjelmalla! n Harjoittelu tehdään aktiivisesti tehtäviä ratkomalla. Tehtävät kattavat kaikki yo-kokeessa
Miten opit parhaiten? Valmistaudu pitkän- tai lyhyen matematiikan kirjoituksiin ilmaiseksi Mafynetti-ohjelmalla! n Harjoittelu tehdään aktiivisesti tehtäviä ratkomalla. Tehtävät kattavat kaikki yo-kokeessa
J 2 = J 2 x + J 2 y + J 2 z.
 FYSA5 Kvanttimekaniikka I, Osa B.. tentti: 4 tehtävää, 4 tuntia. Tarkastellaan pyörimismääräoperaattoria J, jonka komponentit toteuttavat kommutaatiorelaatiot [J x, J y ] = i hj z, [J y, J z ] = i hj x,
FYSA5 Kvanttimekaniikka I, Osa B.. tentti: 4 tehtävää, 4 tuntia. Tarkastellaan pyörimismääräoperaattoria J, jonka komponentit toteuttavat kommutaatiorelaatiot [J x, J y ] = i hj z, [J y, J z ] = i hj x,
YHDEN RAON DIFFRAKTIO. Laskuharjoitustehtävä harjoituksessa 11.
 YHDEN RAON DIFFRAKTIO Laskuharjoitustehtävä harjoituksessa 11. Vanha tenttitehtävä Kapean raon Fraunhoferin diffraktiokuvion irradianssijakauma saadaan lausekkeesta æsin b ö I = I0 ç b è ø, missä b = 1
YHDEN RAON DIFFRAKTIO Laskuharjoitustehtävä harjoituksessa 11. Vanha tenttitehtävä Kapean raon Fraunhoferin diffraktiokuvion irradianssijakauma saadaan lausekkeesta æsin b ö I = I0 ç b è ø, missä b = 1
Mikroskooppisten kohteiden
 Mikroskooppisten kohteiden lämpötilamittaukset itt t Maksim Shpak Planckin laki I BB ( λ T ) = 2hc λ, 5 2 1 hc λ e λkt 11 I ( λ, T ) = ε ( λ, T ) I ( λ T ) m BB, 0 < ε
Mikroskooppisten kohteiden lämpötilamittaukset itt t Maksim Shpak Planckin laki I BB ( λ T ) = 2hc λ, 5 2 1 hc λ e λkt 11 I ( λ, T ) = ε ( λ, T ) I ( λ T ) m BB, 0 < ε
S Fysiikka III (EST) (6 op) 1. välikoe
 S-114.1327 Fysiikka III (EST) (6 op) 1. välikoe 1.3.21 Ilkka Tittonen 1. Vastaa seuraaviin kysymyksiin perustellusti, mutta ytimekkäästi (esim. 5-1 lausetta) (2p per kohta). a) Mikä on sidottu tila? Anna
S-114.1327 Fysiikka III (EST) (6 op) 1. välikoe 1.3.21 Ilkka Tittonen 1. Vastaa seuraaviin kysymyksiin perustellusti, mutta ytimekkäästi (esim. 5-1 lausetta) (2p per kohta). a) Mikä on sidottu tila? Anna
2.1 Ääni aaltoliikkeenä
 2. Ääni Äänen tutkimusta kutsutaan akustiikaksi. Akustiikassa tutkitaan äänen tuottamista, äänen ominaisuuksia, soittimia, musiikkia, puhetta, äänen etenemistä ja kuulemisen fysiologiaa. Ääni kuljettaa
2. Ääni Äänen tutkimusta kutsutaan akustiikaksi. Akustiikassa tutkitaan äänen tuottamista, äänen ominaisuuksia, soittimia, musiikkia, puhetta, äänen etenemistä ja kuulemisen fysiologiaa. Ääni kuljettaa
KJR-C1001 Statiikka ja dynamiikka. Luento Susanna Hurme
 KJR-C1001 Statiikka ja dynamiikka Luento 24.3.2016 Susanna Hurme Rotaatioliikkeen liike-energia, teho ja energiaperiaate (Kirjan luku 18) Osaamistavoitteet Ymmärtää, miten liike-energia määritetään kiinteän
KJR-C1001 Statiikka ja dynamiikka Luento 24.3.2016 Susanna Hurme Rotaatioliikkeen liike-energia, teho ja energiaperiaate (Kirjan luku 18) Osaamistavoitteet Ymmärtää, miten liike-energia määritetään kiinteän
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys12 Kevät 21 Jukka Maalampi LUENTO 11 Mekaaninen aaltoliike alto = avaruudessa etenevä järjestäytynyt häiriö. alto altoja on kahdenlaisia: Poikittainen aalto - poikkeamat kohtisuorassa
Mekaniikan jatkokurssi Fys12 Kevät 21 Jukka Maalampi LUENTO 11 Mekaaninen aaltoliike alto = avaruudessa etenevä järjestäytynyt häiriö. alto altoja on kahdenlaisia: Poikittainen aalto - poikkeamat kohtisuorassa
FUNKTIONAALIANALYYSIN PERUSKURSSI 1. 0. Johdanto
 FUNKTIONAALIANALYYSIN PERUSKURSSI 1. Johdanto Funktionaalianalyysissa tutkitaan muun muassa ääretönulotteisten vektoriavaruuksien, ja erityisesti täydellisten normiavaruuksien eli Banach avaruuksien ominaisuuksia.
FUNKTIONAALIANALYYSIN PERUSKURSSI 1. Johdanto Funktionaalianalyysissa tutkitaan muun muassa ääretönulotteisten vektoriavaruuksien, ja erityisesti täydellisten normiavaruuksien eli Banach avaruuksien ominaisuuksia.
Luvun 10 laskuesimerkit
 Luvun 10 laskuesimerkit Esimerkki 10.1 Tee-se-itse putkimies ei saa vesiputken kiinnitystä auki putkipihdeillään, joten hän päättää lisätä vääntömomenttia jatkamalla pihtien vartta siihen tiukasti sopivalla
Luvun 10 laskuesimerkit Esimerkki 10.1 Tee-se-itse putkimies ei saa vesiputken kiinnitystä auki putkipihdeillään, joten hän päättää lisätä vääntömomenttia jatkamalla pihtien vartta siihen tiukasti sopivalla
3 Ääni ja kuulo. Ihmiskorva aistii paineen vaihteluita, joten yleensä äänestä puhuttaessa määritellään ääniaalto paineen vaihteluiden kautta.
 3 Ääni ja kuulo 1 Mekaanisista aalloista ääni on ihmisen kannalta tärkein. Ääni on pitkittäistä aaltoliikettä, eli ilman (tai muun väliaineen) hiukkaset värähtelevät suuntaan joka on sama kuin aallon etenemissuunta.
3 Ääni ja kuulo 1 Mekaanisista aalloista ääni on ihmisen kannalta tärkein. Ääni on pitkittäistä aaltoliikettä, eli ilman (tai muun väliaineen) hiukkaset värähtelevät suuntaan joka on sama kuin aallon etenemissuunta.
E p1 = 1 e 2. e 2. E p2 = 1. Vuorovaikutusenergian kolme ensimmäistä termiä on siis
 763343A IINTEÄN AINEEN FYSIIA Ratkaisut 3 evät 2017 1. Tehtävä: CsCl muodostuu Cs + - ja Cl -ioneista, jotka asettuvat tilakeskeisen rakenteen vuoropaikoille (kuva). Laske tämän rakenteen Madelungin vakion
763343A IINTEÄN AINEEN FYSIIA Ratkaisut 3 evät 2017 1. Tehtävä: CsCl muodostuu Cs + - ja Cl -ioneista, jotka asettuvat tilakeskeisen rakenteen vuoropaikoille (kuva). Laske tämän rakenteen Madelungin vakion
S Fysiikka III (Est), 2 VK Malliratkaisut (Arvosteluperusteita täydennetään vielä)
 S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
Z 1 = Np i. 2. Sähkömagneettisen kentän värähdysliikkeen energia on samaa muotoa kuin molekyylin värähdysliikkeen energia, p 2
 766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
766328A Termofysiikka Harjoitus no., ratkaisut (syyslukukausi 24). Klassisen ideaalikaasun partitiofunktio on luentojen mukaan Z N! [Z (T, V )] N, (9.) missä yksihiukkaspartitiofunktio Z (T, V ) r e βɛr.
VALON DIFFRAKTIO YHDESSÄ JA KAHDESSA RAOSSA
 1 VALON DIFFRAKTIO YHDESSÄ JA KAHDESSA RAOSSA MOTIVOINTI Tutustutaan laservalon käyttöön aaltooptiikan mittauksissa. Tutkitaan laservalon käyttäytymistä yhden ja kahden kapean raon takana. Määritetään
1 VALON DIFFRAKTIO YHDESSÄ JA KAHDESSA RAOSSA MOTIVOINTI Tutustutaan laservalon käyttöön aaltooptiikan mittauksissa. Tutkitaan laservalon käyttäytymistä yhden ja kahden kapean raon takana. Määritetään
Fysiikan perusteet. Työ, energia ja energian säilyminen. Antti Haarto 20.09.2011. www.turkuamk.fi
 Fysiikan perusteet Työ, energia ja energian säilyminen Antti Haarto 0.09.0 Voiman tekemä työ Voiman F tekemä työ W määritellään kuljetun matkan s ja matkan suuntaisen voiman komponentin tulona. Yksikkö:
Fysiikan perusteet Työ, energia ja energian säilyminen Antti Haarto 0.09.0 Voiman tekemä työ Voiman F tekemä työ W määritellään kuljetun matkan s ja matkan suuntaisen voiman komponentin tulona. Yksikkö:
Luku 9: Atomien rakenne ja spektrit. https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
 Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
W el = W = 1 2 kx2 1
 7.2 Elastinen potentiaalienergia Paitsi gravitaatioon, myös materiaalien deformaatioon (muodonmuutoksiin) liittyy systeemin rakenneosasten keskinäisiin paikkoihin liittyvää potentiaalienergiaa Elastinen
7.2 Elastinen potentiaalienergia Paitsi gravitaatioon, myös materiaalien deformaatioon (muodonmuutoksiin) liittyy systeemin rakenneosasten keskinäisiin paikkoihin liittyvää potentiaalienergiaa Elastinen
Shrödingerin yhtälön johto
 Shrödingerin yhtälön johto Tomi Parviainen 4. maaliskuuta 2018 Sisältö 1 Schrödingerin yhtälön johto tasaisessa liikkeessä olevalle elektronille 1 2 Schrödingerin yhtälöstä aaltoyhtälöön kiihtyvässä liikkeessä
Shrödingerin yhtälön johto Tomi Parviainen 4. maaliskuuta 2018 Sisältö 1 Schrödingerin yhtälön johto tasaisessa liikkeessä olevalle elektronille 1 2 Schrödingerin yhtälöstä aaltoyhtälöön kiihtyvässä liikkeessä
Korkeammat derivaatat
 Korkeammat derivaatat Jo kerran derivoitu funk6o voidaan derivoida uudelleen. d! df(x) $ dx " # dx % & = d2 f(x) = f''(x) = f (2) (x) dx 2 Yleisemmin merkitään: d n f(x) dx n = f (n) (x) Esimerkki: 2-
Korkeammat derivaatat Jo kerran derivoitu funk6o voidaan derivoida uudelleen. d! df(x) $ dx " # dx % & = d2 f(x) = f''(x) = f (2) (x) dx 2 Yleisemmin merkitään: d n f(x) dx n = f (n) (x) Esimerkki: 2-
FYSA2031/K2 SPEKTROMETRI, HILA JA PRISMA
 FYSA2031/K2 SPEKTROMETRI, HILA JA PRISMA 1 Johdanto Kvanttimekaniikan mukaan atomi voi olla vain tietyissä, määrätyissä energiatiloissa. Perustilassa, jossa atomi normaalisti on, energia on pienimmillään.
FYSA2031/K2 SPEKTROMETRI, HILA JA PRISMA 1 Johdanto Kvanttimekaniikan mukaan atomi voi olla vain tietyissä, määrätyissä energiatiloissa. Perustilassa, jossa atomi normaalisti on, energia on pienimmillään.
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 1 Jäykän kappaleen pyöriminen Knight, Ch 1 Jäykkä kappale = kappale, jonka koko ja muoto eivät muutu liikkeen aikana. Jäykkä kappale on malli.
Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 1 Jäykän kappaleen pyöriminen Knight, Ch 1 Jäykkä kappale = kappale, jonka koko ja muoto eivät muutu liikkeen aikana. Jäykkä kappale on malli.
Aaltojen heijastuminen ja taittuminen
 Luku 11 Aaltojen heijastuminen ja taittuminen Tässä luvussa käsitellään sähkömagneettisten aaltojen heijastumista ja taittumista väliaineiden rajapinnalla. Rajoitutaan monokromaattisiin aaltoihin ja oletetaan
Luku 11 Aaltojen heijastuminen ja taittuminen Tässä luvussa käsitellään sähkömagneettisten aaltojen heijastumista ja taittumista väliaineiden rajapinnalla. Rajoitutaan monokromaattisiin aaltoihin ja oletetaan
Puolijohteet. luku 7(-7.3)
 Puolijohteet luku 7(-7.3) Metallit vs. eristeet/puolijohteet Energia-aukko ja johtavuus gap size (ev) InSb 0.18 InAs 0.36 Ge 0.67 Si 1.11 GaAs 1.43 SiC 2.3 diamond 5.5 MgF2 11 Valenssivyö Johtavuusvyö
Puolijohteet luku 7(-7.3) Metallit vs. eristeet/puolijohteet Energia-aukko ja johtavuus gap size (ev) InSb 0.18 InAs 0.36 Ge 0.67 Si 1.11 GaAs 1.43 SiC 2.3 diamond 5.5 MgF2 11 Valenssivyö Johtavuusvyö
Luento 8 6.3.2015. Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit
 Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Ydin- ja hiukkasfysiikka: Harjoitus 1 Ratkaisut 1
 Ydin- ja hiukkasfysiikka: Harjoitus Ratkaisut Tehtävä i) Isotoopeilla on sama määrä protoneja, eli sama järjestysluku Z, mutta eri massaluku A. Tässä isotooppeja keskenään ovat 9 30 3 0 4Be ja 4 Be, 4Si,
Ydin- ja hiukkasfysiikka: Harjoitus Ratkaisut Tehtävä i) Isotoopeilla on sama määrä protoneja, eli sama järjestysluku Z, mutta eri massaluku A. Tässä isotooppeja keskenään ovat 9 30 3 0 4Be ja 4 Be, 4Si,
1. Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta
 766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
Havaitsevan tähtitieteen peruskurssi I. Spektroskopia. Jyri Lehtinen. kevät Helsingin yliopisto, Fysiikan laitos
 Spektroskopia Helsingin yliopisto, Fysiikan laitos kevät 2013 8. Spektroskopia Peruskäsitteet Spektroskoopin rakenne Spektrometrian käyttö Havainnot ja redusointi Spektropolarimetria 8. Yleistä spektroskopiasta
Spektroskopia Helsingin yliopisto, Fysiikan laitos kevät 2013 8. Spektroskopia Peruskäsitteet Spektroskoopin rakenne Spektrometrian käyttö Havainnot ja redusointi Spektropolarimetria 8. Yleistä spektroskopiasta
Infrapunaspektroskopiaa - Lisää IR-spektrien tulkintaa
 1(8) Infrapunaspektroskopiaa - Lisää IR-spektrien tulkintaa Alkaanien spektrit Alkaanien spektreille on ominaisia C H venytys ja taivutus. C C venytys ja taivutus -piikit ovat joko liian heikkoja tai aallonpituudeltaan
1(8) Infrapunaspektroskopiaa - Lisää IR-spektrien tulkintaa Alkaanien spektrit Alkaanien spektreille on ominaisia C H venytys ja taivutus. C C venytys ja taivutus -piikit ovat joko liian heikkoja tai aallonpituudeltaan
pääkiertoakseli #$%%ä 2C 2 C 2!"
 Tehtävä 1 Määritä seuraavien molekyylien pisteryhmät: (a) H 3 N H 3 N l o l NH 3 + NH 3 urataan lohkokaaviota: lineaari!"!" suuri symmetria 2s v #$%%ä 2v!" pääkiertoakseli #$%%ä 2 2 2!" s h Vastaavasti:
Tehtävä 1 Määritä seuraavien molekyylien pisteryhmät: (a) H 3 N H 3 N l o l NH 3 + NH 3 urataan lohkokaaviota: lineaari!"!" suuri symmetria 2s v #$%%ä 2v!" pääkiertoakseli #$%%ä 2 2 2!" s h Vastaavasti:
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Syksy 009 Jukka Maalampi LUENTO 1 Jäykän kappaleen pyöriminen Knight, Ch 1 Jäykkä kappale = kappale, jonka koko ja muoto eivät muutu liikkeen aikana. Jäykkä kappale on malli.
Mekaniikan jatkokurssi Fys10 Syksy 009 Jukka Maalampi LUENTO 1 Jäykän kappaleen pyöriminen Knight, Ch 1 Jäykkä kappale = kappale, jonka koko ja muoto eivät muutu liikkeen aikana. Jäykkä kappale on malli.
