KATSAUS. Pahanlaatuisten veritautien geenihoito. Kimmo Porkka
|
|
|
- Kirsi-Kaisa Majanlahti
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 KATSAUS Pahanlaatuisten veritautien geenihoito Kimmo Porkka Geenihoito on asteittain tulossa osaksi pahanlaatuisten kasvainten hoitovalikoimaa. Kliinisiä sovelluksia on vielä vähän, mutta teknologian ja tietämyksen nopea kehitys avannee lähivuosina merkittävästi uusia mahdollisuuksia syövän hoitoon. Syövän geenivirheet tunnetaan puutteellisesti, eikä niiden laaja korjaus ole vielä mahdollista. Siksi luontevin geenihoitostrategia on toistaiseksi joko kohdesolun tuhoamiseen perustuva»itsemurhageenihoito» tai elimistön oman immuunivasteen tehostaminen. Pahanlaatuiset veritaudit ovat otollinen geenihoidon kohde, koska kohdekudos luuydin tai perifeerinen veri on suhteellisen helposti saavutettavissa ja lähes kaikki pahanlaatuiset solut voidaan ainakin teoreettisesti saavuttaa veriteitse. Geenihoito ei vielä pitkään aikaan korvaa solunsalpaajatai sädehoitoa, vaan se on näiden tehostaja ja kohdentaja. T a u l u k k o 1. Käynnissä olevia kliinisiä geenihoitotutkimuksia, tilanne toukokuussa 1998 (Wiley Gene Therapy Web site, lupa tietojen käyttöön saatu kustantajalta.) Tutkimuksia Potilaita n % n % Monogeeniset taudit Syöpätaudit Infektiotaudit Muut sairaudet Geenimerkintä Yhteensä Geenihoidon ensimmäiset sovellukset olivat yhden geenin virheen aiheuttamien tautien kuten adenosiinideaminaasin puutteen hoidossa (Blaese ym. 1995). Nykyisin vilkkain tutkimus kohdistuu kuitenkin monitekijäisten tautien geenihoitoon, ja erityisesti syöpätaudit ovat olleet suosiossa (taulukko 1). Tämä on yllättävää, sillä vaikka syövän genetiikasta opitaan päivittäin uutta, on patogeneesin kannalta keskeisten kysymysten ratkaisu vielä pääosin avoin (taulukko 2). Ilman tietoa onkogeneesin perimmäisistä saloista yksittäisten geenimutaatioiden korjaus ei ole mielekästä. Kaikkien syöpäsolujen useampien geenivirheiden samanaikainen korjaus on nykytekniikalla vielä mahdotonta. Syövän geenihoitoon on kuitenkin kehitetty vaihtoehtoisia menettelytapoja, joiden avulla voidaan odottaa lähitulevaisuudessa päästävän merkittäviin hoitosovelluksiin. Pahanlaatuiset veritaudit ovat otollinen geenihoidon kohde monestakin syystä. Kohdekudos eli luuydin, perifeerinen veri tai imukudos on melko helposti saavutettavissa. Veritautien molekulaarisesta patogeneesista on poikkeuksellisen paljon tietoa, kuten 9;22-translokaation merkityksestä kroonisen myelooisen leukemian synnyssä (bcr-abl-fuusiogeeni) tai c-myc-proto-onkogeenin aktivoitumisesta 8;14- tai 8;22-translokaation seurauksena Burkittin lymfoomassa. Luuytimen tai perifeeristen kantasolujen keruu ja käsittely, mitä moni geenihoitostrategia edellyttää, Duodecim 1998; 114:
2 T a u l u k k o 2. Eräitä syövän patogeneesin ratkaisemattomia kysymyksiä geenihoidon kannalta. Onko syövän synnyn kannalta keskeiset mutaatiot löydetty? Onko perättäisten mutaatioiden ajallinen esiintyminen aina samanlainen tietyssä tuumorityypissä? Onko yksittäisen tuumorin kaikissa syöpäsoluissa samat keskeiset geenivirheet? Genotyyppi vs fenotyyppi: onko histologiselta kuvaltaan samanlaisilla kasvaimilla samanlainen geneettinen tausta? Onko syöpäsolujen keskeistenkään mutaatioiden korjaus pysyvää (geneettinen epästabiilius)? on rutiinimaista toimintaa verisyöpiä hoitavissa keskuksissa. Onkin oletettavaa, että geeninsiirron ensimmäiset käytännön sovellukset ovat juuri veritautien hoidossa. Jo nyt geeninsiirto on käypää hoitoa muutamassa harvinaisessa periytyvässä veritaudissa, ADA-puutostaudissa ja kroonisessa granulomatoottisessa sairaudessa (CGD) (Blaese ym. 1995, Weil ym. 1997). Hematologisissa syövissä nykyisin käytettävissä oleva hoito on hyväksyttävän toksisuuden äärirajoilla, ja silloinkin hoitotulos on usein huono, etenkin aikuisilla. Siksi uusien joko tarkemmin taudin syyhyn vaikuttavien tai täsmällisemmin kohdennettujen hoitomuotojen tarve on suuri. Geenihoitoa käsitteleviä yleiskatsauksia on viime vuosina ilmestynyt useita (Pettersson ja Palotie 1988, Ulmanen ja Sariola 1993, Brenner 1996, Ylä-Herttuala ym. 1996, Braun ym. 1997, Roth ja Cristiano 1997). Tässä kirjoituksessa esitetään lyhyesti geenihoidon nykytila ja keskitytään geeninsiirron sovellusmahdollisuuksiin hematologisten syöpien hoidossa. Vaikka syövän geenihoidosta on käynnissä useita kymmeniä tutkimuksia, ei tuloksia juuri vielä ole julkaistu. Siksi tämän artikkelin sisältö painottuu geenihoidon teoreettisiin näkökulmiin ja julkaistuihin eläinkokeisiin. Geenihoidon peruskäsitteitä Geenihoidolla tarkoitetaan kohdesolun joko syöpäsolun tai syövän patogeneesiin osallistuvan solun perimän muokkaamista niin, että saadaan aikaan toivottu hoitovaikutus. Geenihoidon piiriin luetaan usein myös RNA-synteesin estoon perustuva pienten DNA-jaksojen (oligonukleotidien) tai ribotsyymien käyttö syövän hoidossa, ja tämä onkin lupaava tutkimusalue. Keskityn tässä katsauksessa kuitenkin geenihoidon sovelluksiin, joissa siirtogeeni viedään kohdesoluun pääasiassa virusvektorien avulla. Geenihoidon kulku ja keskeisimmät käsitteet on esitetty kuvassa 1, ja jäljempänä on lyhyt yleiskatsaus hoidon perusteista. Strategiat. Syövän geenihoito on totuttu jakamaan korjaavaan ja sytotoksiseen geenihoitoon ja elimistön omaa puolustusvastetta tehostavaan geenihoitoon (immunogeenihoito). Käytännön rajoitusten vuoksi valtaosa nykyisistä geenihoitotutkimuksista perustuu kahteen jälkimmäiseen strategiaan tai niiden yhdistelmään. Tulevaisuuden kannalta uusien geenihoitomuotojen kehittely on keskeisellä sijalla, sillä mikään nykyisistä strategioista ei yksinään ole osoittautunut tarpeeksi tehokkaaksi laajoja kliinisiä sovelluksia ajatellen. Teoreettisen tiedon ja teknisen taidon kehittyessä eri hoitovaihtoehtojen määrä kasvaa, mihin pääosin perustuvat myös geenihoitoon kohdistuvat suuret toiveet. Geeninkuljettimet (vektorit). Geeninsiirron ongelmat keskittyvät vektoreiden ympärille. Lähes kaikille vektoreille yhteisiä rajoituksia ovat sattumanvarainen integraatio genomiin (insertionaalisen mutageneesin vaara), huono kapasiteetti (vain yksi siirtogeeni kerrallaan; käytettävä cdna-molekyyliä natiivin DNA:n sijaan) ja vaatimaton transduktio- eli geeninsiirtoteho (keskimäärin 1 5 % tutkimuksen ja viruksen mukaan). Valtaosa ihmisillä tehdyistä geenihoitokokeiluista on tehty virusvektoreilla, pääosin inaktivoiduilla adeno- ja retroviruksilla. Näistä ainoastaan retrovirukset integroituvat pysyvästi genomiin, mikä on esimerkiksi kantasolugeeninsiirron ehdoton edellytys. Retrovirukset eivät transfektoi muita kuin jakautuvia soluja, mikä on luonnollisesti suuri haitta ajatellen hyvin harvakseltaan jos lainkaan jakautuvia soluja, kuten neuroneita tai primitiivisiä kantasoluja. Lisäksi retrovirusten kapasiteetti on huono (siirtogeeni < emäsparia), niiden saavutettavissa oleva pitoisuus (10 7 ) on liian pieni suuria tuumoreita ajatellen, eikä niiden laaja tuotanto ole helppoa (ongelmana on 1276 K. Porkka
3 Tuotantosolulinja (retrovirukset) Pääsy kudokseen Sitoutuminen Sytoplasminen kuljetus Ekspressio Toiminta TUMA DNA KOHDE- SOLU GEENIHOITO Siirtogeenin valinta Siirtovektorin tuotto Pääsy kohdekudokseen Kohdesolun transfektio Transduktio Ekspressio (vakaa, terapeuttisella tasolla) K u v a 1. Geenihoidon peruskäsitteet. replikaatiokykyisten virusten ilmaantuminen tuottajasolulinjaan). Retroviruksia tuottavien pakkaussolujen käyttö pelkän retroviruksen asemesta on tehokas keino suurentaa paikallista viruspartikkelipitoisuutta. Adenovirukset infektoivat monentyyppisiä soluja riippumatta niiden mitoottisesta aktiivisuudesta. Adenovektoreiden tuotto on helpompaa ja saavutettavissa olevat pitoisuudet (>10 11 ) ovat suurempia kuin retroviruksilla. Adenovirus ei kuitenkaan integroidu kohdesolun genomiin, ja täten sen vaikutus on vain lyhytaikainen ja vaatii toistuvan annon. Ongelmana uudelleen annossa in vivo on vektoriin kohdistuvan immuunivasteen muodostuminen, joka nopeasti inaktivoi viruksen. Toisaalta pyrittäessä sytotoksiseen vaikutukseen ei lyhyt vaikutusaika välttämättä ole käytön este. Myös adenoviruksen kuljetuskapasiteetti on pieni. Mielenkiintoinen adenovirusvariantti ONYX-015 (Onyx Pharmaceuticals, Richmond, USA), josta E1B-geeni on poistettu, replikoituu ainoastaan syöpäsoluissa, joissa kasvunrajoitegeeni p53 on viallinen tai puuttuu. Näin on mahdollista kohdistaa viruksen sytotoksinen vaikutus ainoastaan syöpäsoluihin ja tehostaa hoitoa (Heise ym. 1997). Muita mahdollisesti tulevaisuudessa laajempaan käyttöön tulevia vektoreita ovat herpesvirukset, AAV (adenoassociated virus) sekä lehmänrokko- ja bakulovirukset. Retrovirusten alalaji lentivirukset, kuten HIV- 1 tai visnavirus, olisivat ideaalisia vektoreita, koska ne infektoivat tehokkaasti ja pysyvästi myös jakautumattomia soluja (Naldini ym. 1996). Turvallisuusseikat ovat kuitenkin toistaiseksi estäneet HI-virusten käyttöönoton geeninsiirroissa (Emerman 1996). Eräs mahdollisuus olisi käyttää muiden lajien lentiviruksia, joilla on tarkka tropismi ja joiden rakenne tunnetaan hyvin. Lupaavia tuloksia on äskettäin saatu mm. kissan immuunikatoviruksesta (FIV), jonka promoottorialuetta muokkaamalla on saatu tehokas transduktio jakautuviin, jakautumattomiin ja postmitoottisiin ihmissoluihin (Poeschla ym. 1998). Vaikka eri virusten rakenteesta tiedetään jo paljon ja ns. villin tyypin viruksen esiintyminen tuotantosolulinjoissa pystytään tehokkaasti estämään, virusten käyttöön liittyy yhä vaaratekijöitä (mm. rekombinaatio in vivo, insertiomutageneesi). Tämän vuoksi ei-viraalisten vektorien kehitys jatkuu vilkkaana. Yleisimmin käytettyjä ei-viraalisia vektoreita ovat liposomit, molekylaariset konjugaatit ja paljas (naked) DNA mekaanisesti annettuna (elektroporaatio,»gene gun»). Liposomien lipidi- DNA-kompleksi kykenee kuljettamaan siirtogeenin useisiin solutyyppeihin. Sen kapasiteetti on hyvin suuri, jopa kymmeniä kokonaisia geenejä, mutta haittapuolena on erittäin heikkotehoinen Pahanlaatuisten veritautien geenihoito 1277
4 transduktio, joka lisäksi tapahtuu ainoastaan paikallisesti antokohdassa. Liposomeilla on kuitenkin käyttöä ex vivo geeninsiirtokokeissa ja paikallisesti in vivo annettavassa hoidossa (esim. rokotteet). Proteiini-DNA-konjugaatit ovat mielenkiintoisia vektoritulokkaita (»synteettisiä viruksia»), joita on jo kaupallisestikin saatavilla (Directin, Saphorin). Kohdennus syöpäsoluun. Syöpäsolun kuolemaan ei sen geenivirheiden korjaukseen perustuva geenihoitostrategia vaikuttaa toteuttamiskelpoiselta, ja siksi vaaditaan kykyä transfektoida tarkasti vain kohdesoluja. Kohdennus voidaan saavuttaa useammalla tasolla: vektoria muokkaamalla, kudosspesifisillä promoottoreilla, muuttamalla antotapaa ja käyttämällä hyväksi immunoreseptoreja. Useilla viruksilla on luontaisesti kudoshakuisuutta: mm. adenovirukset infektoivat mieluiten keuhkojen epiteelisoluja. Virusten pintaproteiineja muuttamalla voidaan päästä tarkempaan kohdennukseen käyttämällä hyväksi syöpäsoluspesifisiä reseptoreja. Vain syövälle ominaisia reseptoreja tunnetaan kuitenkin hyvin rajallisesti, mutta esimerkiksi fibroblastikasvutekijä (bfgf) on osoittautunut tehokkaaksi ligandiksi syöpäsolujen pinnalla usein yliekspressoituneelle FGF-reseptorille (FGFR-1; Wang ja Becker 1997). Syöpäspesifisten promoottoreiden löytäminen on myös osoittautunut vaikeaksi. Syövän geenihoitotutkimuksissa yleisimmin käytetty promoottori on sytomegaloviruspromoottori, joka aktivoituu pääosin vain nopeasti jakautuvissa soluissa. Se on myös eräs voimakkaimmista tunnetuista promoottoreista. Sytotoksisia tai tuumoriin infiltroivia lymfosyytteja (TIL) voidaan ohjata spesifisesti tuumorisoluihin ekspressoimalla niissä tuumoriantigeeneja tunnistavia reseptoreja, kuten MART-1-melanooma-antigeenia tunnistavia reseptoreja Jurkat-soluissa (Cole ym. 1995). Genominen kohdennus. Geenihoidon tehokkuutta ja turvallisuutta ajatellen kohdennusta tarvitaan myös DNA-tasolla. Nykyisin käytössä olevat vektorit liittävät siirtogeenin sattumanvaraisesti genomiin. Teoreettisesti on hyvinkin mahdollista, että integraatio tapahtuu kohtaan, joka aiheuttaa onkogeeniaktivaation. Koska siirtogeeni ainoastaan lisätään genomiin, jatkuu mutatoituneen geenin toiminta ennallaan, ja jos sen vaikutus on dominantti, ei terveen siirtogeenin lisäys korjaa tilannetta. Muokkaamaton AAV integroituu tarkasti kromosomin 19 tiettyyn kohtaan. Kuitenkin rekombinantti AAV vektorina, josta on poistettu useita viraalisia proteiineja, näyttää menettävän paikkaspesifisen integraatiokykynsä (Halbert ym. 1995). Etenkin kantasolugeenihoidossa, jossa samasta solusta syntyy usean linjan erilaistuneita soluja, genominen kohdennus olisi tärkeää. Viallisten geenisekvenssien korjaaminen terveillä homologisen rekombinaation avulla, mikä on osoittautunut käyttökelpoiseksi ratkaisuksi mm. poistogeenisiä eläimiä tuotettaessa, ei toistaiseksi ole riittävän tehokas menetelmä nykyisellä vektoritekniikalla (Yanez ja Porter 1998). Äskettäin Krenin työryhmä raportoi lupaavasta vaihtoehtoisesta menetelmästä, jossa aiheutetaan kimeerisillä RNA/DNA-oligonukleotideilla hyytymistekijä IX:n mutaatio rotan maksasoluihin (Kren ym. 1998). Mutageneesi onnistui sekä in vitro että in vivo noin 40 %:ssa geenikopioista ja vähensi koagulaatioaktiivisuutta 50 %. Tämäntasoinen geenivirheen korjaus riittäisi parantamaan useita monogeenisia sairauksia, mikäli tekniset edellytykset viallisten solujen saavuttamiseksi täyttyvät. Kantasolugeeninsiirto Sairauden korjaavan geenin siirto hematopoieettiseen kantasoluun on tavoitelluin ja ideaalisin geenihoidon muoto. Se antaisi mahdollisuuden hoitaa laajaa joukkoa sairauksia, myös monia muita kuin veritauteja (useita monogeenisia sairauksia sekä autoimmuuni- ja infektiotauteja). Monessa pahanlaatuisessa veritaudissa, kuten myelodysplastisessa syndroomassa, epäillään perusgeenivirheen olevan jo kantasolussa ja siksi korjaava geenihoito on mahdollista vain kantasolutasolla. Mikäli pysyvä integraatio ja ekspressio saavutettaisiin, olisi mahdollista tuottaa lähes loputtomasti erilaistuneita soluja, joissa olisi siirretty geeni. Kantasolugeeninsiirroissa on vektoreina käytetty lähes yksinomaan retroviruksia, koska pysyvää integraatiota ei muilla yleisesti käytössä olevilla virusvektoreilla voida saavuttaa. Ensimmäiset tulokset yli kymmenen vuotta sitten hiirillä teh K. Porkka
5 dyissä kantasolugeeninsiirroista olivat hyvin lupaavia; pysyvä geeninsiirto pluripotentteihin soluihin saatiin helposti aikaan (Williams ym. 1984, Dick ym. 1985). Suuremmilla eläimillä, kuten koirilla ja apinoilla sekä ihmisillä transduktio onnistui korkeintaan alle prosentin teholla, jos laisinkaan (Chu ym. 1998). Kantasoluja on luuytimessä hyvin vähän, noin yksi sataatuhatta mononukleaarista solua kohden. Niiden tunnistaminen on myös vaikeaa, koska todellisen pluripotentin kantasolun spesifistä pinta-antigeenirakennetta ei täysin tunneta. Valitsemalla luuytimestä soluja, jotka ilmentävät CD34- antigeenia ja ovat negatiivisia muiden linjaspesifisten antigeenien suhteen, voidaan kantasolusaalis rikastaa kertaiseksi, mikä olisi riittävä määrä geeninsiirtosovelluksiin. Suurin osa näistä kantasoluista on kuitenkin lepotilassa ja täten huonosti tavoitettavissa retrovirusvektoreilla. Geeninsiirron tehokkuutta on voitu parantaa käyttämällä»kasvutekijäkoktaileja» (eri sytokiineja), stroomasoluja ja pitkäaikaisia luuydinviljelyjä, mutta useimmissa aikuisilla tehdyissä tutkimuksissa siirtogeeni on ollut osoitettavissa vain alle 1 %:ssa veren tai luuytimen soluista vuoden kuluttua muokatun kantasolusiirteen palautuksesta (Chu ym. 1998). On todennäköistä, että nykyisin tunnetut kantasolujen jakautumista stimuloivat tekijät aikaansaavat myös kantasolun erilaistumisen, jolloin geenihoitoa ajatellen tärkeä kantasolujen pluripotenttisuus häviää. Jostain syystä tulokset ovat olleet lapsilla parempia, sillä siirtogeeni on ollut havaittavissa useissa solulinjoissa jopa 42 kuukauden kuluttua kantasolujen palautuksesta (Brenner ym. 1993). Lupaavia tuloksia on saatu myös käyttämällä uudentyyppisiä adenovirusvektoreita (Frey ym. 1998) tai lentiviruksia (Naldini ym. 1996). Hoitosovelluksia ajatellen suurin ongelma on edelleenkin puutteellinen kyky tunnistaa ja infektoida pysyvästi ja riittävällä terapeuttisella tasolla luuytimen tai veren primitiivisiä kantasoluja. Napaveren solut ovat kiintoisa tulokas kantasolugeeniterapiaan (Cairo ja Wagner 1997). Syntymän yhteydessä kerätty napaveri sisältää runsaasti pluripotentteja kantasoluja, ja napaverta onkin käytetty menestyksekkäästi allogeenisen luuytimensiirron kantasolulähteenä lapsilla. Geeninsiirto onnistuu paremmin napaveren kantasoluihin kuin vastaaviin soluihin lasten tai aikuisten luuytimessä. Kliinisiä tutkimuksia on meneillään napaverigeeninsiirron käytöstä muun muassa ADA-puutostaudin hoidossa (Kohn ym. 1995). Syöpärokotteet Kiinnostus syöpärokotteisiin on lisääntynyt uudelleen viime vuosina, kun elimistön immunivasteen säätelytekijöistä on saatu lisää tietoa. Syöpärokotuksen tavoitteena on kehittää kasvainta kohtaan aktiivinen, systeeminen puolustusvaste, joka pystyisi spesifisesti estämään metastaaseja ja muodostaisi pitkäaikaisen immunologisen muistin tuumorirelapsin varalle. Koska vain syövälle ominaisia antigeeneja tunnetaan melko vähän, eräs ratkaisu on ollut käyttää tuumorikudosta sinänsä rokotteena. Muokkaamaton tuumorikudos stimuloi kuitenkin useimmiten hyvin heikosti elimistön puolustusjärjestelmää, ja siksi immunogeenisuutta on pyritty parantamaan siirtämällä tuumorisoluihin sytokiineja (esimerkiksi IL-2, IL-4, IL-7, IL-12, gammainterferoni, lymfotaktiini, G-CSF, GM-CSF) tai ns. kostimuloivia molekyylejä (B7.1, B7.2) ex vivo ja käyttämällä näin modifioituja kasvainsoluja rokotteena itse syöpää kohtaan (Gilboa 1996). Kostimulaattorien puute solukalvon pinnalla näyttäisi olevan keskeinen tekijä juuri leukemiasolujen huonossa immunogeenisuudessa, sillä toisin kuin monissa kiinteissä kasvaimissa leukemiasoluissa ovat muut T-soluaktivaatiossa tarpeelliset tekijät (luokan I MHCantigeenit ja soluadheesiomolekyylit, Hirano ym. 1996). Immuunivasteen muodostumiselle on keskeistä tuumorispesifisten T-solujen aktivaatio (usein sekä CD4+T-solut ja CD8+-T-solut) sekä tehostunut antigeenipresentaatio joko dendriittisolujen tai itse tuumorisolujen avulla. Käytännön ongelmaksi on usein muodostunut riittävän tuumorisolumäärän saanti rokotteen valmistusta varten (»antigen dose»). Kasvainsolujen viljely, joka on edellytys geeninsiirtoon elimistön ulkopuolella, on usein vaikeaa tai mahdotonta. Hematologiset syövät soveltuvatkin näistä syistä hyvin syöpärokotteen valmistukseen: diagnoosivaiheessa Pahanlaatuisten veritautien geenihoito 1279
6 suurtenkaan tuumorisolumäärien saanti luuytimestä, perifeerisestä verestä tai imusolmukkeista ei ole ongelmallista, ja esimerkiksi leukeemisten blastien viljely onnistuu jo kohtalaisen hyvin. Eläinkokeissa on lisäksi todettu, että ns. viereisvaikutus näyttäisi toimivan myös rokotteissa, sillä tehokas immuunivaste on saatu syntymään myös sekoittamalla rokotteessa tuumorisoluja ja ei-maligneja soluja, jotka erittävät geeninsiirron vaikutuksesta sytokiineja (Golumbek ym. 1991). Jo nyt olisi useimmissa verisyöpiä hoitavissa keskuksissa valmiudet tuumorisolujen keräykseen ja säilöntään sekä sytokiinilähteinä toimivien solujen valmistukseen, ja kyseinen strategia olisi toteutettavissa nykyisten geeninsiirtomahdollisuuksien puitteissa. Erityisen lupaavia tuloksia on saatu kostimulaattori B7.1:n siirrosta myelooisiin blasteihin (AML). Kokeellisessa hiirimallissa saatiin aikaan 5 6 kuukautta kestänyt immuniteetti muokkaamattomia AML-soluja kohtaan yhdellä kertainfuusiolla AML-soluja, joihin oli siirretty B7.1- cdna (Dunussi-Joannopoulos ym. 1996). Taudin alkuvaiheessa annettuna B7.1-posititiivinen AML-solurokote aikaansai pysyvän remission silloin, kun tuumorimassa oli suhteellisen pieni. Saman työryhmän tuoreessa raportissa paras immunisaatioteho saatiin aikaan käyttämällä siirtogeeninä GM-CSF-geeniä. Se oli tehokas myös niillä hiirillä, joiden tuumorikuorma oli suuri (Dunussi-Joannopoulos ym. 1998). On mahdollista, että parempaan lopputulokseen päästäisiin käyttämällä kahden geenin samanaikaista siirtoa (sytokiini+kostimulaattori), mihin uusimmat polysistroniset vektorit antaisivatkin mahdollisuuden (Gallardo ym. 1997). Äskettäin Hirstin työryhmä onnistui siirtämään kymmenen aikuispotilaan AML-blasteihin MPSV-retrovirusvektorilla B7.1-kostimulaattorin ja selektoimaan solut niin, että % blasteista ilmensi siirrettyä geeniä (Hirst ym. 1997). Muokatut solut saivat aikaan vahvan T-soluvasteen (sekä CD4+ ja CD8+), mikä vahvisti hiirillä saatuja tuloksia ja antoi lähtökohdan ihmisillä tehtäviin rokotetutkimuksiin. Tämän strategian soveltuvuus leukemiapotilaiden hoitoon varmistuu 1 2 vuoden kuluttua ja samaa menettelytapaa käytetään myös muissa verisyövissä. On todennäköistä, että syöpärokotus tai muu immunoterapia on tehokkaimmillaan ns. minimitaudin hoidossa eli silloin, kun syöpäsolujen määrä elimistössä on hyvin pieni. Siksi tuntuisi luontevalta yhdistää rokotus solunsalpaajahoitoon, jonka tehtävänä olisi raivata suurin tautimassa pois. Useat solunsalpaajat, kuten syklofosfamidi, saavat aikaan syvän immunosuppression, joka taas saattaa olla tehokkaan tuumori-immunisaation esteenä rokotusta ajatellen. Eri solunsalpaajien immunosuppressiiviset ominaisuudet kuitenkin vaihtelevat, ja esimerkiksi doksorubisiinilla on todettu olevan jopa immunostimulatorisia vaikutuksia (Macubbin ym. 1992). Useissa kroonisissa veritaudeissa, kuten myeloomassa ja follikulaarisessa lymfoomassa, sitkeä lääkeresistentti minimitauti on keskeinen ongelma, jolloin onnistuneesta tuumorispesifisestä immunisaatiosta saattaisi olla merkittävää hyötyä. Lääkeherkkyyden muokkaus Tehokasta solunsalpaajahoitoa rajoittaa usein hematologinen toksisuus. Hoidon intensiivisyyttä on pyritty parantamaan siirtämällä lääkeresistenssigeenejä luuytimen kantasoluihin. Yleisimmin käytetty geeni on MDR1, jonka geenituote P-glykoproteiini toimii solukalvopumppuna poistaen solusta mm. veteen liukenemattomia solunsalpaajia. Luuytimessä sijaitsevat hematologiset syövät eivät ehkä ole kaikkein otollisin lääkeresistenssigeenihoidon kohde, sillä vaarana on siirtogeenin joutuminen kantasolujen lisäksi myös pahanlaatuisiin soluihin. On myös edelleen epäselvää, kuinka suuri lisäys hoitotehoon saataisiin nykyisiä annoksia suurentamalla, kuinka tehokkaan suojan P-glykoproteiinin lisääminen kantasoluun antaisi, ja kuinka pian ongelmaksi muodostuisi ei-hematologisiin kudoksiin kohdistuva kestämätön toksisuus. Jo nyt hoidon intensiivisyys tuntuu olevan lähellä suurinta siedettyä annosta ja aiheuttaa merkittäviä haittoja niin lyhyellä (sytopeniat ongelmineen, alopesia, limakalvovauriot) kuin pitkällä aikavälillä (hedelmättömyys, sekundaarisyövät), joten houkutus lisätä solunsalpaajaannoksia ei ole kovin suuri K. Porkka
7 Gansikloviiri (GCV) Ei-toksista Helppo annostelu HSV Tymidiinikinaasi Fosforyloitunut GCV Toksista Ei läpäise solukalvoa K u v a 2.»Itsemurhageenihoito»: herpes simplex -viruksen tymidiinikinaasi (HSV-TK) ja gansikloviiri. Sytotoksinen geenihoito:»itsemurhageenit» Koska syövän kaikkien geenivirheiden korjaaminen on toistaiseksi mahdotonta, on luontevinta käyttää geenihoitostrategiaa, jonka tavoitteena on syöpäsolun kuolema. Eräs varhaisimmista ehdotuksista on ns. itsemurhageenihoito, jossa syöpäsoluihin siirretään entsyymigeeni (suicide gene), joka muuttaa ei-toksisen aihiolääkkeen toksiseksi metaboliitiksi solun sisällä (Freeman ym. 1996). Tämän hoidon keskeinen edellytys on luonnollisesti kohdennus ainoastaan pahanlaatuiseen soluun. Siihen onkin keksitty useita eri tapoja, mutta ainoastaan syövälle spesifiseen kohdennukseen ei ole vielä päästy. Klassinen ja edelleen yleisimmin käytetty»itsemurhageeni» on herpes simplex -viruksen tymidiinikinaasientsyymi (HSV-TK). Se fosforyloi gansikloviirin solukalvoja läpäisemättömäksi trifosfaatiksi, joka estää DNA-polymeraasin toiminnan ja siten aiheuttaa solukuoleman (kuva 2). Gansikloviiri on yleisesti käytössä oleva viruslääke, joka on varsin hyvin siedetty. Koska HSV- TK-geenihoidon kohteena on DNA-polymeraasi, joka toimii ainoastaan solun jakautuessa, hoito on mahdollista kohdentaa vain syöpäsoluihin ympäristössä, jossa muita jakautuvia soluja on vähän tai ei ollenkaan. Pahanlaatuisten glioomien hoito tällä strategialla on aloitettu myös Suomessa (Puumalainen ym. 1997), ja alustavat vaiheen II hoitotulokset vaikuttavat lupaavilta, joskin pysyvät tulokset ovat toistaiseksi harvinaisia (Berger ym. 1997). Nykyisellä vektoritekniikalla voidaan infektoida vain pieni osa kasvainsoluista, mikä on merkittävä haitta syövän parantavaa hoitoa ajatellen.»itsemurhageenihoidossa» on kuitenkin huomattu, että kasvaimissa voidaan saada aikaan huomattava regressio, vaikka vain pieni osa kasvainsoluista saisi siirtogeenin. Kyseistä ilmiötä nimitetään viereisvaikutukseksi (bystander effect). Siinä gansikloviiri-infuusion jälkeen kuolevat HSV- TK-positiiviset solut muuttuvat toksisiksi viereisille soluille (kuva 3). On arvioitu, että merkittävään hoitovasteeseen riittäisi vain 5 10 %:n geeninsiirtotehokkuus, joka on nykyisilläkin vektoreilla saavutettavissa. Viereisvaikutuksen mekanismit ovat edelleen pääosin avoimia, mutta sekä elimistön immuunivasteella että soluseinämän aukkojen kautta kulkevilla paikallisilla toksisilla metaboliiteilla on merkitystä (Dilber ja Smith 1997, Freeman ym. 1997). Systeemisen tuumorispesifisen immuunivasteen muodostuminen voisi selittää myös ns. etävaikutusilmiön (distant bystander), jossa myös anatomisesti eri paikoissa sijaitsevat, geneettisesti muokkaamattomat tuumorisolut kuolevat siirtogeenin saaneen kudoksen myötä (Dilber ym. 1996, Kianmanesh ym. 1997).»Itsemurhageenejä» onkin liitetty syöpärokotetutkimuksiin tuumorin immunogeenisuuden tehostamiseksi (Santodonato ym. 1997). HSV-TK ei ole optimaalinen»itsemurhageeni» veritaudeissa, joissa gansikloviirilla on tärkeä osuus CMV-infektioiden hoidossa. Myös useita muita»itsemurhageenien» käyttösovelluksia on kehitetty (taulukko 3). Erityisen lupaavalta siirtogeeniltä vaikuttaa sytosiinideaminaasigeeni (CD), jonka geenituote muokkaa aihiolääke 5- fluorosytosiinin aktiiviseksi solunsalpaajaksi 5- fluorourasiiliksi. CD-pohjainen»itsemurhageenihoito» vaikuttaa jonkin verran tehokkaammalta kuin HSV-TK/gansikloviirihoito (Rogers ym. 1996). Pahanlaatuisten veritautien geenihoito 1281
8 MEKANISMEJA Soluvälitteinen immuunivaste (tuumoritaakka pienempi) Tuumorin verenkierron häiriö Apoptoottisten rakkuloiden kuljetus Metaboliittien siirtyminen solusta soluun (gap-junktiot) Etävaikutus (distant bystander effect)? Tuumori/kudos 2 Tuumori/kudos 1 Immuunivaste TK+ TK+ TNF, IL-1, IL-6 K u v a 3. Viereisvaikutus (bystander effect)»itsemurhageenihoidossa». TK = tymidiinikinaasigeeni, TNF = tuumorinekroositekijä Autologisissa eli potilaan omalla luuytimellä tehtävissä kantasolusiirroissa ongelmana ovat usein siirteessä olevat jäännöstuumorisolut, jotka geenimerkintätutkimusten perusteella ovat vähintäänkin osasyyllisiä taudin uusiutumiseen intensiivihoidon jälkeen (Brenner ym. 1993).»Itsemurhageenin» siirto ex vivo luuydinsiirteen tuumorisoluihin ja aihiolääkkeen anto siirteen palautuksen jälkeen saattaisi olla hyvin tehokas tapa taata mahdollisimman puhdas kantasolusiirre ja estää osalla potilaista taudin uusiutuminen. Kohdennus vain tuumorisoluihin olisi erityisen tärkeää, koska siirtogeenin vienti pluripotentteihin kantasoluihin estäisi täysin aihiolääkkeen käytön. Käänteishyljinnän esto Allogeenisen luuytimensiirron jälkeen keskeisin sairastuvuuden ja kuolleisuuden aiheuttaja perustaudin uusiutumista lukuun ottamatta on akuutti ja krooninen käänteishyljintä (GVHD). Siinä luovuttajan T-lymfosyytit hyökkäävät saajan kudosta vastaan, mikä voi näkyä ihottumana, maksavauriona, ripulina tai verenkuvan muutoksina. Käänteishyljintä ja sen hoidoksi käytetty voimakas immunosuppressiivinen lääkitys johtaa pahimmillaan monielinvaurioon ja potilaan kuolemaan. Tiedetään myös, että luovuttajan lymfosyyteillä on keskeinen osuus luuydinsiirteen tarttumisessa, saajan infektioimmuniteetin muodostumisessa ja perustaudin kurissapidossa»graftversus-leukemia»-efektin (GVL) avulla, mikä on ehkä tärkein seikka. On edelleen epäselvää, välittyvätkö GVHD- ja GVL samojen efektorisolujen kautta, vai voitaisiinko nämä kaksi hoidon hyödyn kannalta vastakkaista reaktiota erottaa toisistaan. On havaittu viitteitä siitä, että luovuttajien lymfosyyttien kokonaismäärällä on merkitystä; GVL voidaan aikaansaada pienemmällä lymfosyyttimäärällä kuin GVHD (Mckinnon ym. 1995). Kysymys on hyvin ajankohtainen, sillä luovuttajien lymfosyyttien siirto on osoittautunut tehokkaaksi luuytimensiirron jälkeen relapsoituneen kroonisen myelooisen leukemian sekä muiden verisyöpien hoidossa (Mckinnon ym. 1997). Tämän vuoksi käänteishyljintä, joka aiemmin on ollut lähes väistämätön komplikaatio lymfosyyttisiirroissa, on tärkeätä estää. Lymfosyyttisiirto luovuttajilta on myös tärkeä hoito Epstein Barrin viruksen aiheuttamassa vaikeassa nopeasti etenevässä lymfoproliferatiivisessa sairaudessa (Papadopoulos ym. 1998). Tähän mennessä ehkä kliinisesti merkittävin potilailla tehty veritauteihin liittyvä geenihoitotutkimus on milanolaisen Claudio Bordignonin työryhmän tutkimus käänteishyljinnän hallinnasta»itsemurhageenien» avulla (Bonini ym. 1997). Kyseisessä aineistossa oli mukana kahdeksan T- soludepletoidun luuytimensiirron jälkeen relap K. Porkka
9 T a u l u k k o 3.»Itsemurhageenejä» Geeni Metabolia Sytotoksinen Viereisvaikutus HSV1-TK GCV GCV-TP Kyllä Kyllä CD 5-FC 5-FU Kyllä Kyllä XGPRT 6-TX 6-TX-TP Kyllä? VZV-TK AraM AraM-MP Kyllä? DeoD MeP-dr 6-MeP Kyllä Kyllä β-glukosidaasi Amygdaliini syanidi?? β-laktamaasi Vinka-kefalosporiini vinka-alkaloidi?? TetR Tetrasykliini TetR-VP16 Kyllä? CPG2 CMDA kloorimetiini Kyllä Kyllä NR CB1954 kloorimetiini Kyllä Kyllä CYP2B1 Syklofosfamidi toksiset metaboliitit Kyllä Kyllä Ifosfamidi toksiset metaboliitit Kyllä Kyllä HSV1-TK = herpes simplex -viruksen tymidiinikinaasi, GCV = gansikloviiri, GCV-TP = gansikloviiritrifosfaatti, CD = sytosiinideaminaasi, 5-FC = 5-fluorosytosiini, 5-FU = 5-fluorourasiili, XGPRT = ksantiini-guaniinifosforibosyylitransferaasi, 6-TX = 6-tioksantiini, 6-TX-TP = 6-tioksantiinitrifosfaatti, VZV-TK = varicella-zosterviruksen tymidiinikinaasi, AraM = 6-metoksipuriiniarabinonukleosidi, AraM-MP = 6-metoksipuriiniarabinonukleosidimonofosfaatti, MeP-dr = 6-metyylipuriini-2 -deoksiribonukleosidi, MeP = 6-metyylipuriini, TetR = bakteeriperäinen Tet-repressoriproteiini, VP16 = etoposidi,.cpg2 = karboksipeptidaasi G2, NR = E. coli -bakteerin nitroreduktaasi, CYP2B1 = eräs sytokromi P-450 -entsyymi. soitunutta potilasta, jotka saivat lymfosyyttisiirron tautirelapsin hoidoksi samalta sukulaisluovuttajalta, jolta luuydinsiirre oli alun pitäen saatu. Luovuttajan lymfosyytteihin siirrettiin ex vivo retrovirusvektorilla HSV-TK-»itsemurhageeni» ja ns. reportterigeeni, jonka avulla siirtogeenin saaneet lymfosyytit voitiin erottaa. Geeninsiirto onnistui hyvin; vain yhdellä potilaalla ei havaittu toimivaa siirtogeenia lymfosyyttisiirron jälkeen. Muilla potilailla geneettisesti muokattuja lymfosyyttejä havaittiin yli vuoden ajan niin perifeerisessä veressä kuin luuytimessä. Geeninsiirto ei näyttänyt häiritsevän lymfosyyttien toimintaa, sillä tuumorin vastainen vaikutus voitiin havaita viidellä potilaalla. Kolmelle potilaalle kehittyi käänteishyljintä; kahdella se saatiin hallintaan pelkällä gansikloviiri-infuusiolla, joka nopeasti hävitti verenkierrosta siirtogeenin saaneet lymfosyytit. Vaste oli hyvin nopea: kaikki käänteishyljinnän merkit hävisivät 1 2 vuorokaudessa, eikä haittavaikutuksia todettu. Tämä poikkeaa nykyisestä GVHD:n hoidosta, jossa käytetään jättiannoksia metyyliprednisolonia, antilymfosyyttiglobuliinia ja muita hyvin immunosuppressiivisia lääkkeitä, joiden sivuvaikutukset ovat huomattavia ja teho usein riittämätön. Koska GVL näyttäisi ilmaantuvan pienemmällä lymfosyyttimäärällä kuin GVHD, antaisi kuvattu»itsemurhageenihoito» mahdollisuuden tärkeimmän tautia kurissa pitävän ominaisuuden säilyttämiseen aihiolääkkeen annosta säätelemällä. Vaikka Bordignonin työryhmän potilasaineisto oli hyvin pieni, tulokset olivat johdonmukaisia ja rohkaisevia, ja ne osoittivat, että geenihoitoa voidaan jo soveltaa kliiniseen työhön. Tutkimus on herättänyt myös kritiikkiä, koska potilaskokeisiin ryhdyttiin melko vähäisellä koe-eläinpohjaisella näytöllä (Sadelain ja Luzzatto 1997). Hiirimallilla tehty vastaavanlainen tutkimus vahvisti strategian toimivuuden (Cohen ym. 1997). Mikäli tulokset saadaan toistettua laajemmissa sarjoissa, on käänteishyljintää vastaan käytettävissä tehokas ase, jolla olisi huomattava merkitys etenkin muilta kuin sukulaisluovuttajilta tehtävissä kantasolusiirroissa. Kyseistä strategiaa voidaan tulevaisuudessa parantaa käyttämällä tehokkaampia siirtogeenejä sekä tarkoitukseen paremmin sopivia vektoreita. Tällöin immuunivasteen muokkaukseen avautuu kiehtovia uusia mahdollisuuksia ajatellen niin perustutkimusta kuin kliinisiä hoitosovelluksia (Gallardo ym. 1997). Pahanlaatuisten veritautien geenihoito 1283
10 Tulevaisuudennäkymiä Yhdistäminen tavanomaiseen syövän hoitoon. Geenihoidon rajoitteiden lähinnä huonon geeninsiirtotehon ja puutteellisen kohdistuksen johdosta on epätodennäköistä, että geenihoito syrjäyttäisi syövän tavanomaisen hoidon lähivuosien aikana. Toistaiseksi on tehty vain hyvin vähän tutkimuksia solunsalpaaja- tai sädehoidon tai molempien yhdistämisestä esimerkiksi immunogeeniterapiaan, jossa jälkimmäinen voisi olla hyvin tehokas minimitaudin kurissapitäjä. Kohdennus geneettisesti stabiiliin soluun. Kaikkien pahanlaatuisten kasvainten kasvu ja metastasointi on riippuvainen verisuonten uudismuodostuksesta eli angiogeneesistä (Folkman 1990). Angiogeneesin estoon on viime vuosina löytynyt hyviä lääkkeitä, joilla on ollut eläinkokeissa poikkeuksellisen hyvä teho eri tyyppisiin kasvaimiin (Boehm ym. 1997, O Reilly ym. 1997). Myös verisyöpien etenemisessä angiogeneesillä näyttäisi olevan merkittävä osuus (Perez-Atayde ym. 1997). Angiogeneesin systeeminen esto ei tunnu mielekkäältä, sillä monet tunnetut ja osin myös tuntemattomat fysiologiset toiminnat ovat riippuvaisia angiogeneesistä. Geenihoito vaikuttaa lupaavalta tavalta kohdentaa angiogeneesin esto vain tuumorisoluihin tai niiden läheisyyteen (Kong ja Crystal 1998). Koska hoidon kohde, endoteelisolu, on geneettisesti stabiili ei-maligni solu, on resistenssin kehittyminen hoidolle hyvin epätodennäköistä. Tämä on merkittävä etu, sillä syöpäsolun kaikkien geenivirheidenkään korjaus ei välttämättä takaa pysyvää vaikutusta syöpään olennaisesti liittyvän geneettisen epästabiiliuden takia. Perimmäiset syyt tähän epästabiiliuteen ovat tuntemattomia. Geenihoitotutkimuksiin on tähän mennessä otettu vain pitkälle edennyttä, metastasoitunutta syöpää sairastavia potilaita, mikä on osasyy melko vaatimattomiin hoitotuloksiin. Kuten muussakin syövän hoidossa, on oletettavaa, että geenihoito tehoaa parhaiten silloin, kun syöpäsoluja on vielä kohtalaisen vähän. Geenihoitoa voidaan kuvitella käytettävän myös ehkäisevästi, esimerkiksi estämään premalignin muutoksen kehittymisen pahanlaatuiseksi ja invasiiviseksi syöväksi tai estämään periytyvien syöpämuotojen geeniekspressiota. Geenihoidon tulevaisuus vaikuttaakin lupaavalta; koeputkissa ja eläimillä tehtävistä geeninsiirtotutkimuksista ollaan siirtymässä potilastutkimuksiin ja hoitokokeiluihin. Lähivuosien aikana myös pahanlaatuisten veritautien hoito hyötynee geeninsiirron sovelluksista. Kirjallisuutta al-lebban Z S, Henry J M, Jones J B, ym. Increased efficiency of gene transfer with retroviral vectors in neonatal hematopoietic progenitor cells. Exp Hematol 1990; 18: Berger M, Prados M, Van Gilder J, ym. Phase II trial of GLI 328 HSV-TK gene therapy in recurrent glioblastoma (abstract). Gene Therapy of Cancer VI, San Diego, California, November 20 22, Blaese R M, Culver K W, Miller A D, ym. T lymphocyte-directed gene therapy for ADA- SCID: initial trial results after 4 years. Science 1995; 270: Boehm T, Folkman J, Browder T, M S O Reilly. Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance. Nature 1997; 390: Bonini C, Ferrari G, Verzeletti S, ym. HSV-TK gene transfer into donor lymphocytes for control of allogeneic graft-versusleukemia. Science 1997; 276: Braun S E, Chen K, Battiwalla M, Cornetta K. Gene therapy strategies for leukemia. Mol Med Today 1997; 3: Brenner M K. Gene transfer in haematological malignancy. Ann Med 1996; 28: Brenner M K, Rill D R, Moen R C, ym. Gene-marking to trace origin of relapse after autologous bone-marrow transplantation. Lancet 1993; 341: Cairo M S, Wagner J E. Placental and/or umbilical cord blood: an alternative source of hematopoietic stem cells for transplantation. Blood 1997; 90: Chu P, Lutzko C, Stewart A K, Dube I D. Retrovirus-mediated gene transfer into human hematopoietic stem cells. J Molec Med 1998; 76: Cohen J L, Boyer O, Salomon B, ym. Prevention of graft-versushost disease in mice using a suicide gene expressed in T lymphocytes. Blood 1997; 89: Cole D J, Weil D P, Shilyansky J, ym. Characterization of the functional specificity of a cloned T-cell receptor heterodimer recognizing the MART-1 melanoma antigen. Cancer Res 1995; 55: Dick J, Magli M, Huszar D, ym. Introduction of a selectable gene into primitive stem cells capable of long term reconstitution of hematopoietic system of W/Wv mice. Cell 1985; 42: Dilber M S, Abedi M R, Bjorkstrand B, ym. Suicide gene therapy for plasma cell tumors. Blood 1996; 88: Dilber M S, Smith C I. Suicide genes and bystander killing: local and distant effects. Gene Ther 1997; 4: Dunussi-Joannopoulos K, Dranoff G, Weinstein H J, ym. Gene immunotherapy in murine acute myeloid leukemia: granulocyte-macrophage colony-stimulating factor tumor cell vaccines elicit more potent antitumor immunity compared with B7 family and other cytokine vaccines. Blood 1998; 91: Dunussi-Joannopoulos K, Weinstein H J, Nickerson P W, ym. Irradiated B7-1 transduced primary acute myelogenous leukemia 1284 K. Porkka
11 (AML) cells can be used as therapeutic vaccines in murine AML. Blood 1996; 87: Elonen E. Solunsalpaajaresistenssi. Duodecim 1998: (painossa). Emerman M. From curse to cure. HIV for gene therapy? Nature Biotech 1996; 14: Folkman J. What is the evidence that tumors are angiogenesis dependent? J Natl Cancer Inst 1990; 82: 4 6. Freeman S M, Ramesh R, Marrogi A J. Immune system in suicidegene therapy. Lancet 1997; 349: 2 3. Freeman S M, Whartenby K A, Freeman J L, ym. In situ use of suicide genes for cancer therapy. Semin Oncol 1996; 23: Frey B, Hackett N, Bergelson J, ym. High-efficiency gene transfer into ex vivo expanded human hematopoietic progenitors and precursor cells by adenovirus vectors. Blood 1998; 91: Gallardo H F, Tan C, Ory D, Sadelain M. Recombinant retroviruses pseudotyped with the vesicular stomatitis virus G glycoprotein mediate both stable gene transfer and pseudotransduction in human peripheral blood lymphocytes. Blood 1997(a); 90: Gallardo H F, Tan C, Sadelain M. The internal ribosomal entry site of the encephalomyocarditis virus enables reliable coexpression of two transgenes in human primary T lymphocytes. Gene Ther 1997(b); 4: Ghazal P, Lubon H, Fleckenstein B, Henninghausen L. Binding of transcription factors and creation of a large nucleoprotein complex on the human cytomegalovirus enhancer. Proc Nat Acad Sci 1987; 84: Gilboa E. Immunotherapy of cancer with genetically modified tumor vaccines. Semin Oncol 1996; 23: Golumbek P T, Lazenby A J, Levitsky H I, ym. Treatment of established renal cancer by tumor cells engineered to secrete interleukin-4. Science 1991; 254: Halbert C, Aleksander I, Wolgamot G, Miller A. Adeno-associated virus vectors transduce primary cells much less efficiently than immortalized cells. J Virol 1995; 69: Heise C, Sampson-Johannes A, Williams A, ym. ONYX-015, an E1B gene-attenuated adenovirus, causes tumor-specific cytolysis and antitumoral efficacy that can be augmented by standard chemotherapeutic agents. Nature Med 1997; 3: Hirano N, Takahashi T, Takahashi T, ym. Expression of costimulatory molecules in human leukemias. Leukemia 1996; 10: Hirst W J, Buggins A, Darling D, ym. Enhanced immune costimulatory activity of primary acute myeloid leukaemia blasts after retrovirus-mediated gene transfer of B7.1. Gene Ther 1997; 4: Kianmanesh A R, Perrin H, Panis Y, ym. A distant bystander effect of suicide gene therapy regression of nontransduced tumors together with a distant transduced tumor. Hum Gene Ther 1997; 8: Kohn D B, Weinberg K I, Nolta J A, ym. Engraftment of genemodified umbilical cord blood cells in neonates with adenosine deaminase deficiency. Nature Med 1995; 1: Kong H L, Crystal R G. Gene therapy strategies for tumor antiangiogenesis. J Natl Cancer Inst 1998; 90: Kren B, Bandyopadhyay P, Steer C. In vivo site-directed mutagenesis of the factor IX gene by chimeric RNA/DNA oligonucleotides. Nature Med 1998; 4: Maccubbin D, Wing K, Mace K, ym. Adriamycin-induced modulation of host defenses in tumor-bearing mice. Cancer Res 1992; 52: Mackinnon S. Donor leukocyte infusions. Baillieres Clin Haematol 1997; 10: Mackinnon S, Papadopoulos E B, Carabasi M H, ym. Adoptive immunotherapy evaluating escalating doses of donor leukocytes for relapse of chronic myeloid leukemia after bone marrow transplantation: separation of graft-versus-leukemia responses from graft-versus-host disease. Blood 1995; 86: Naldini L, Blomer U, Gallay P, ym. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science 1996; 272: O Reilly M, Boehm T, Shing Y, ym. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth. Cell 1997; 88: Papadopoulos E B, Ladanyi M, Emanuel D, ym. Infusions of donor leukocytes to treat Epstein Barr virus-associated lymphoproliferative disorders after allogeneic bone marrow transplantation. New Engl J Med 1994; 330: Perez-Atayde A R, Sallan S E, Tedrow U, ym. Spectrum of tumor angiogenesis in the bone marrow of children with acute lymphoblastic leukemia. Am J Pathol 1997; 150: Pettersson R, Palotie L. Geeniterapia. Duodecim 1988; 104: Poeschla E, Wong-Staal F, Looney D. Efficient transduction of nondividing human cells by feline immunodeficiency virus lentiviral vectors. Nature Med 1998; 4: Puumalainen A-M, Vapaalahti M, Ylä-Herttuala S. Geeniterapian mahdollisuudet aivokasvainten hoidossa. Suom Lääkäril 1997; 52: Rogers R P, Ge J Q, Holley-Guthrie E, ym. Killing Epstein Barr virus-positive B lymphocytes by gene therapy: comparing the efficacy of cytosine deaminase and herpes simplex virus thymidine kinase. Hum Gene Ther 1996; 7: Roth J A, Cristiano R J. Gene therapy for cancer: what have we done and where are we going? J Natl Cancer Inst 1997; 89: Sadelain M, Luzzatto L. Immuno gene therapy comes into its own. Gene Ther 1997; 4: Santodonato L, G D A, Santini S M, ym. Local and systemic antitumor response after combined therapy of mouse metastatic tumors with tumor cells expressing IFN-alpha and HS- Vtk: perspectives for the generation of cancer vaccines. Gene Ther 1997; 4: Ulmanen I, Sariola H. Syövän geenihoito. Duodecim 1993; 109: Wang Y, Becker D. Antisense targeting of basic fibroblast growth factor and fibroblast growth factor receptor-1 in human melanomas blocks intratumoral amgiogenesis and tumor growth. Nat Med 1997; 3: Weil W M, Linton G F, Whiting-Theobald N, ym. Genetic correction of p67phox deficient chronic granulomatous disease using peripheral blood progenitor cells as a target for retrovirus mediated gene transfer. Blood 1997; 89: Williams D, Lemischka I, Nathan D, Mulligan R. Introduction of new genetic material into pluripotent hematopoietic stem cells of the mouse. Nature 1984; 310: Yanez R J, Porter A C G. Therapeutic gene targeting. Gene Ther 1998; 5: Ylä-Herttuala S, Ollikainen A, Vapaalahti M. Ihmisen geeniterapia. Duodecim 1996; 112: KIMMO PORKKA, dosentti, hematologian apulaislääkäri HYKS:n sisätautien klinikka, hematologian toimiala PL 340, HYKS kimmo.porkka@huch.fi Pahanlaatuisten veritautien geenihoito 1285
Conflict of interest: No! VH has no association with companies mentioned! VH has authored reviews on virus vectors in Suomen Lääkärilehti and
 Conflict of interest: No! VH has no association with companies mentioned! VH has authored reviews on virus vectors in Suomen Lääkärilehti and Duodecim, and a textbook chapter on viral gene therapy for
Conflict of interest: No! VH has no association with companies mentioned! VH has authored reviews on virus vectors in Suomen Lääkärilehti and Duodecim, and a textbook chapter on viral gene therapy for
Virus-mediated gene delivery for human gene therapy KURT NURMI
 Virus-mediated gene delivery for human gene therapy KURT NURMI 23.10.2017 Sisältö Lyhyesti geeniterapiasta, yleisimmistä virusvektoreista ja niiden ominaispiirteistä Kliininen käyttö ja ongelmat Johdanto
Virus-mediated gene delivery for human gene therapy KURT NURMI 23.10.2017 Sisältö Lyhyesti geeniterapiasta, yleisimmistä virusvektoreista ja niiden ominaispiirteistä Kliininen käyttö ja ongelmat Johdanto
Virukset lääketieteen apuvälineinä. Veijo Hukkanen, Veli-Matti Kähäri ja Timo Hyypiä
 Kuvat kertovat Veijo Hukkanen, Veli-Matti Kähäri ja Timo Hyypiä Virusten molekyylitasoinen tuntemus on tehnyt mahdolliseksi hyödyntää viruksia niiden luonnollisessa tehtävässä geenien kuljettimina eli
Kuvat kertovat Veijo Hukkanen, Veli-Matti Kähäri ja Timo Hyypiä Virusten molekyylitasoinen tuntemus on tehnyt mahdolliseksi hyödyntää viruksia niiden luonnollisessa tehtävässä geenien kuljettimina eli
KATSAUS. Soluterapia. Kari Remes
 KATSAUS Kari Remes on osa nykyaikaista hematologista hoitovalikoimaa. Se on nopeasti kehittyvä ala, jolla on paljon yhteyksiä solu- ja molekyylibiologiaan, virologiaan, immunologiaan sekä solulaskennan
KATSAUS Kari Remes on osa nykyaikaista hematologista hoitovalikoimaa. Se on nopeasti kehittyvä ala, jolla on paljon yhteyksiä solu- ja molekyylibiologiaan, virologiaan, immunologiaan sekä solulaskennan
Avainsanat: BI5 III Biotekniikan sovelluksia 9. Perimä ja terveys.
 Avainsanat: mutaatio Monitekijäinen sairaus Kromosomisairaus Sukupuu Suomalainen tautiperintö Geeniterapia Suora geeninsiirto Epäsuora geeninsiirto Kantasolut Totipotentti Pluripotentti Multipotentti Kudospankki
Avainsanat: mutaatio Monitekijäinen sairaus Kromosomisairaus Sukupuu Suomalainen tautiperintö Geeniterapia Suora geeninsiirto Epäsuora geeninsiirto Kantasolut Totipotentti Pluripotentti Multipotentti Kudospankki
Drug targeting to tumors: Principles, pitfalls and (pre-) cilinical progress
 Drug targeting to tumors: Principles, pitfalls and (pre-) cilinical progress Twan Lammers, Fabian Kiessling, Wim E. Hennik, Gert Storm Journal of Controlled Release 161: 175-187, 2012 Sampo Kurvonen 9.11.2017
Drug targeting to tumors: Principles, pitfalls and (pre-) cilinical progress Twan Lammers, Fabian Kiessling, Wim E. Hennik, Gert Storm Journal of Controlled Release 161: 175-187, 2012 Sampo Kurvonen 9.11.2017
IMMUUNIPUUTOKSET. Olli Vainio Turun yliopisto
 IMMUUNIPUUTOKSET Olli Vainio Turun yliopisto 130204 IMMUNOLOGIA Oppi kehon puolustusmekanismeista infektiota vastaan Immuunijärjestelmä = kudokset, solut ja molekyylit, jotka muodostavat vastustuskyvyn
IMMUUNIPUUTOKSET Olli Vainio Turun yliopisto 130204 IMMUNOLOGIA Oppi kehon puolustusmekanismeista infektiota vastaan Immuunijärjestelmä = kudokset, solut ja molekyylit, jotka muodostavat vastustuskyvyn
Etunimi: Henkilötunnus:
 Kokonaispisteet: Lue oheinen artikkeli ja vastaa kysymyksiin 1-25. Huomaa, että artikkelista ei löydy suoraan vastausta kaikkiin kysymyksiin, vaan sinun tulee myös tuntea ja selittää tarkemmin artikkelissa
Kokonaispisteet: Lue oheinen artikkeli ja vastaa kysymyksiin 1-25. Huomaa, että artikkelista ei löydy suoraan vastausta kaikkiin kysymyksiin, vaan sinun tulee myös tuntea ja selittää tarkemmin artikkelissa
MATTI ÄYRÄPÄÄN LUENTO
 Seppo Ylä-Herttuala MATTI ÄYRÄPÄÄN LUENTO Geenihoito Geeniterapia on potentiaalinen apu vaikeisiin sairauksiin, joihin ei ole olemassa vakiintunutta tehokasta hoitoa. Geenejä voidaan käyttää sekä yhden
Seppo Ylä-Herttuala MATTI ÄYRÄPÄÄN LUENTO Geenihoito Geeniterapia on potentiaalinen apu vaikeisiin sairauksiin, joihin ei ole olemassa vakiintunutta tehokasta hoitoa. Geenejä voidaan käyttää sekä yhden
BI4 IHMISEN BIOLOGIA
 BI4 IHMISEN BIOLOGIA IHMINEN ON TOIMIVA KOKONAISUUS Ihmisessä on noin 60 000 miljardia solua Solujen perusrakenne on samanlainen, mutta ne ovat erilaistuneet hoitamaan omia tehtäviään Solujen on oltava
BI4 IHMISEN BIOLOGIA IHMINEN ON TOIMIVA KOKONAISUUS Ihmisessä on noin 60 000 miljardia solua Solujen perusrakenne on samanlainen, mutta ne ovat erilaistuneet hoitamaan omia tehtäviään Solujen on oltava
Elimistö puolustautuu
 Elimistö puolustautuu Tautimikrobit (= patogeenit): Bakteerit (esim. kolera), virukset (esim. influenssa), alkueliöt (esim. malaria), eräät sienet (esim. silsa) Aiheuttavat infektiotaudin Miten elimistö
Elimistö puolustautuu Tautimikrobit (= patogeenit): Bakteerit (esim. kolera), virukset (esim. influenssa), alkueliöt (esim. malaria), eräät sienet (esim. silsa) Aiheuttavat infektiotaudin Miten elimistö
Immuunipuutokset. Olli Vainio OY Diagnostiikan laitos OYS Kliinisen mikrobiologian laboratorio 17.10.2008
 Immuunipuutokset Olli Vainio OY Diagnostiikan laitos OYS Kliinisen mikrobiologian laboratorio 17.10.2008 Immuunijärjestelm rjestelmän n toiminta Synnynnäinen immuniteetti (innate) Välitön n vaste (tunneissa)
Immuunipuutokset Olli Vainio OY Diagnostiikan laitos OYS Kliinisen mikrobiologian laboratorio 17.10.2008 Immuunijärjestelm rjestelmän n toiminta Synnynnäinen immuniteetti (innate) Välitön n vaste (tunneissa)
Autoimmuunitaudit: osa 1
 Autoimmuunitaudit: osa 1 Autoimmuunitaute tunnetaan yli 80. Ne ovat kroonisia sairauksia, joiden syntymekanismia eli patogeneesiä ei useimmissa tapauksissa ymmärretä. Tautien esiintyvyys vaihtelee maanosien,
Autoimmuunitaudit: osa 1 Autoimmuunitaute tunnetaan yli 80. Ne ovat kroonisia sairauksia, joiden syntymekanismia eli patogeneesiä ei useimmissa tapauksissa ymmärretä. Tautien esiintyvyys vaihtelee maanosien,
Geeniterapian mahdollisuudet munasarjasyövän hoidossa
 Katsaus Anna Kanerva ja Akseli Hemminki Geeniterapian mahdollisuudet munasarjasyövän hoidossa Geeniterapia on lupaava kokeellinen hoito moniin sairauksiin, jotka eivät reagoi nykyisiin hoitoihin. Vastikään
Katsaus Anna Kanerva ja Akseli Hemminki Geeniterapian mahdollisuudet munasarjasyövän hoidossa Geeniterapia on lupaava kokeellinen hoito moniin sairauksiin, jotka eivät reagoi nykyisiin hoitoihin. Vastikään
Elimistö puolustautuu
 Elimistö puolustautuu Tautimikrobit (= patogeenit): Bakteerit (esim. kolera), virukset (esim. influenssa), alkueliöt (esim. malaria), eräät sienet (esim. silsa) Aiheuttavat infektiotaudin Mistä taudinaiheuttajat
Elimistö puolustautuu Tautimikrobit (= patogeenit): Bakteerit (esim. kolera), virukset (esim. influenssa), alkueliöt (esim. malaria), eräät sienet (esim. silsa) Aiheuttavat infektiotaudin Mistä taudinaiheuttajat
Syöpähoitojen kehitys haja- Pirkko Kellokumpu-Lehtinen Säde- ja kasvainhoidon professori, ylilääkäri, TaY/TAYS 19.02.2008
 Syöpähoitojen kehitys haja- ammunnasta täsmäosumiin Pirkko Kellokumpu-Lehtinen Säde- ja kasvainhoidon professori, ylilääkäri, TaY/TAYS 19.02.2008 Haasteet Syöpämäärien lisäys/väestön vanheminen Ennaltaehkäisy/seulonnat
Syöpähoitojen kehitys haja- ammunnasta täsmäosumiin Pirkko Kellokumpu-Lehtinen Säde- ja kasvainhoidon professori, ylilääkäri, TaY/TAYS 19.02.2008 Haasteet Syöpämäärien lisäys/väestön vanheminen Ennaltaehkäisy/seulonnat
Nanoteknologian mahdollisuudet lääkesovelluksissa
 Nanoteknologian mahdollisuudet lääkesovelluksissa Marjo Yliperttula 1,3 ja Arto Urtti 1,2 1 Farmaseuttisten biotieteiden osasto, Lääketutkimuksen keskus, Farmasian tiedekunta, Helsingin Yliopisto, Helsinki;
Nanoteknologian mahdollisuudet lääkesovelluksissa Marjo Yliperttula 1,3 ja Arto Urtti 1,2 1 Farmaseuttisten biotieteiden osasto, Lääketutkimuksen keskus, Farmasian tiedekunta, Helsingin Yliopisto, Helsinki;
Biologian tehtävien vastaukset ja selitykset
 Biologian tehtävien vastaukset ja selitykset Ilmainen lääkiksen harjoituspääsykoe, kevät 2017 Tehtävä 2. (20 p) A. 1. EPÄTOSI. Ks. s. 4. Menetelmää käytetään geenitekniikassa geenien muokkaamisessa. 2.
Biologian tehtävien vastaukset ja selitykset Ilmainen lääkiksen harjoituspääsykoe, kevät 2017 Tehtävä 2. (20 p) A. 1. EPÄTOSI. Ks. s. 4. Menetelmää käytetään geenitekniikassa geenien muokkaamisessa. 2.
Läpimurto ms-taudin hoidossa?
 Läpimurto ms-taudin hoidossa? Läpimurto ms-taudin hoidossa? Kansainvälisen tutkijaryhmän kliiniset kokeet uudella lääkkeellä antoivat lupaavia tuloksia sekä aaltoilevan- että ensisijaisesti etenevän ms-taudin
Läpimurto ms-taudin hoidossa? Läpimurto ms-taudin hoidossa? Kansainvälisen tutkijaryhmän kliiniset kokeet uudella lääkkeellä antoivat lupaavia tuloksia sekä aaltoilevan- että ensisijaisesti etenevän ms-taudin
Geenisakset (CRISPR)- Geeniterapian vallankumousko? BMOL Juha Partanen
 Geenisakset (CRISPR)- Geeniterapian vallankumousko? BMOL 19.11.2016 Juha Partanen Geenisakset 2 2 N A T U R E V O L 5 2 2 4 J U N E 2 0 1 5 Sisältö Geenimuokkaus: historiallinen perspektiivi Geenisakset
Geenisakset (CRISPR)- Geeniterapian vallankumousko? BMOL 19.11.2016 Juha Partanen Geenisakset 2 2 N A T U R E V O L 5 2 2 4 J U N E 2 0 1 5 Sisältö Geenimuokkaus: historiallinen perspektiivi Geenisakset
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Syövän lääkkeet muuttuvat eläviksi CAR-Tsolut
 Page 1 of 7 JULKAISTU NUMEROSSA 3/2018 BIOLOGISET LÄÄKKEET Syövän lääkkeet muuttuvat eläviksi CAR-Tsolut tulevat Olli Tenhunen, Piia Rannanheimo, Heli Suila / Kirjoitettu 12.11.2018 / Julkaistu 13.11.2018
Page 1 of 7 JULKAISTU NUMEROSSA 3/2018 BIOLOGISET LÄÄKKEET Syövän lääkkeet muuttuvat eläviksi CAR-Tsolut tulevat Olli Tenhunen, Piia Rannanheimo, Heli Suila / Kirjoitettu 12.11.2018 / Julkaistu 13.11.2018
KandiakatemiA Kandiklinikka
 Kandiklinikka Kandit vastaavat Immunologia Luonnollinen ja hankittu immuniteetti IMMUNOLOGIA Ihmisen immuniteetti pohjautuu luonnolliseen ja hankittuun immuniteettiin. Immunologiasta vastaa lymfaattiset
Kandiklinikka Kandit vastaavat Immunologia Luonnollinen ja hankittu immuniteetti IMMUNOLOGIA Ihmisen immuniteetti pohjautuu luonnolliseen ja hankittuun immuniteettiin. Immunologiasta vastaa lymfaattiset
Miten rokottaminen suojaa yksilöä ja rokotuskattavuus väestöä Merit Melin Rokotusohjelmayksikkö
 Miten rokottaminen suojaa yksilöä ja rokotuskattavuus väestöä Merit Melin Rokotusohjelmayksikkö 1 ESITYKSEN SISÄLTÖ Miten rokottaminen suojaa yksilöä? Immuunijärjestelmä Taudinaiheuttajilta suojaavan immuniteetin
Miten rokottaminen suojaa yksilöä ja rokotuskattavuus väestöä Merit Melin Rokotusohjelmayksikkö 1 ESITYKSEN SISÄLTÖ Miten rokottaminen suojaa yksilöä? Immuunijärjestelmä Taudinaiheuttajilta suojaavan immuniteetin
Adenovirukset syövän hoidossa
 Katsaus TANJA HAKKARAINEN, ANNA KANERVA JA AKSELI HEMMINKI Syöpä on yleinen sairaus. Vuonna 2002 siihen arvioitiin kuolleen noin seitsemän miljoonaa ihmistä. Diagnosointimenetelmien ja hoitomuotojen kehityksestä
Katsaus TANJA HAKKARAINEN, ANNA KANERVA JA AKSELI HEMMINKI Syöpä on yleinen sairaus. Vuonna 2002 siihen arvioitiin kuolleen noin seitsemän miljoonaa ihmistä. Diagnosointimenetelmien ja hoitomuotojen kehityksestä
Epigeneettinen säätely ja genomin leimautuminen. Tiina Immonen BLL Biokemia ja kehitysbiologia
 Epigeneettinen säätely ja genomin leimautuminen Tiina Immonen BLL Biokemia ja kehitysbiologia 21.1.2014 Epigeneettinen säätely Epigenetic: may be used for anything to do with development, but nowadays
Epigeneettinen säätely ja genomin leimautuminen Tiina Immonen BLL Biokemia ja kehitysbiologia 21.1.2014 Epigeneettinen säätely Epigenetic: may be used for anything to do with development, but nowadays
Oligonukleotidi-lääkevalmisteet ja niiden turvallisuuden tutkiminen - Sic!
 Page 1 of 5 JULKAISTU NUMEROSSA 3-4/2017 EX TEMPORE Oligonukleotidi-lääkevalmisteet ja niiden turvallisuuden tutkiminen Enni-Kaisa Mustonen / Kirjoitettu 18.12.2017 / Julkaistu Oligonukleotidit ovat nukleotideista
Page 1 of 5 JULKAISTU NUMEROSSA 3-4/2017 EX TEMPORE Oligonukleotidi-lääkevalmisteet ja niiden turvallisuuden tutkiminen Enni-Kaisa Mustonen / Kirjoitettu 18.12.2017 / Julkaistu Oligonukleotidit ovat nukleotideista
Säteilyvaikutuksen synty. Erikoistuvien lääkärien päivät 25 26.1.2013 Kuopio
 Säteilyvaikutuksen synty Erikoistuvien lääkärien päivät 25 26.1.2013 Kuopio Säteilyn ja biologisen materian vuorovaikutus Koska ihmisestä 70% on vettä, todennäköisin (ja tärkein) säteilyn ja biologisen
Säteilyvaikutuksen synty Erikoistuvien lääkärien päivät 25 26.1.2013 Kuopio Säteilyn ja biologisen materian vuorovaikutus Koska ihmisestä 70% on vettä, todennäköisin (ja tärkein) säteilyn ja biologisen
Suomalaista bioteknologiaa kansainväliseen lääkehoitoon. FIT Biotech Oy toimitusjohtaja Kalevi Reijonen Osakesäästäjien Keskusliitto 28.10.
 Suomalaista bioteknologiaa kansainväliseen lääkehoitoon. FIT Biotech Oy toimitusjohtaja Kalevi Reijonen Osakesäästäjien Keskusliitto 28.10.2015 Tärkeää tietoa Tämä esitys saattaa sisältää tulevaisuutta
Suomalaista bioteknologiaa kansainväliseen lääkehoitoon. FIT Biotech Oy toimitusjohtaja Kalevi Reijonen Osakesäästäjien Keskusliitto 28.10.2015 Tärkeää tietoa Tämä esitys saattaa sisältää tulevaisuutta
Kantasolututkimuksen etiikasta - uusimmat näkymät. Timo Tuuri HUS, Naistenklinikka Biomedicum kantasolukeskus
 Kantasolututkimuksen etiikasta - uusimmat näkymät Timo Tuuri HUS, Naistenklinikka Biomedicum kantasolukeskus Kantasolut A) Kyky jakautua itsensä kaltaisiksi soluiksi (uusiutumiskyky) B) Kyky erilaistua
Kantasolututkimuksen etiikasta - uusimmat näkymät Timo Tuuri HUS, Naistenklinikka Biomedicum kantasolukeskus Kantasolut A) Kyky jakautua itsensä kaltaisiksi soluiksi (uusiutumiskyky) B) Kyky erilaistua
Tiedote ja suostumuslomake onkolyyttistä virushoitoa harkitsevalle
 Onkolyyttiset virukset ovat kokeellinen syövän hoitomuoto, jonka turvallisuutta ja tehoa on tutkittu tuhansissa syöpäpotilaissa. Yleensä hoidot ovat olleet hyvin siedettyjä, ja monet potilaat ovat hyötyneet
Onkolyyttiset virukset ovat kokeellinen syövän hoitomuoto, jonka turvallisuutta ja tehoa on tutkittu tuhansissa syöpäpotilaissa. Yleensä hoidot ovat olleet hyvin siedettyjä, ja monet potilaat ovat hyötyneet
 Hoitotehoa ennustavat RAS-merkkiaineet Tärkeä apuväline kolorektaalisyövän lääkehoidon valinnassa Tämän esitteen tarkoitus Tämä esite auttaa ymmärtämään paremmin kolorektaalisyövän erilaisia lääkehoitovaihtoehtoja.
Hoitotehoa ennustavat RAS-merkkiaineet Tärkeä apuväline kolorektaalisyövän lääkehoidon valinnassa Tämän esitteen tarkoitus Tämä esite auttaa ymmärtämään paremmin kolorektaalisyövän erilaisia lääkehoitovaihtoehtoja.
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
KATSAUS. Suuriannoshoidon ja kantasolusiirtojen aiheet. Tapani Ruutu
 KATSAUS Suuriannoshoidon ja kantasolusiirtojen aiheet Tapani Ruutu Kantasolusiirron avulla voidaan lisätä pahanlaatuisen veritaudin solunsalpaaja- ja sädehoidon voimakkuutta ja suurentaa taudin paranemistodennäköisyyttä.
KATSAUS Suuriannoshoidon ja kantasolusiirtojen aiheet Tapani Ruutu Kantasolusiirron avulla voidaan lisätä pahanlaatuisen veritaudin solunsalpaaja- ja sädehoidon voimakkuutta ja suurentaa taudin paranemistodennäköisyyttä.
11. Elimistö puolustautuu
 11. Elimistö puolustautuu Taudinaiheuttajat Tautimikrobit (= patogeenit): Bakteerit (esim. kolera), virukset (esim. influenssa), alkueliöt (esim. malaria), eräät sienet (esim. silsa) Aiheuttavat infektiotaudin
11. Elimistö puolustautuu Taudinaiheuttajat Tautimikrobit (= patogeenit): Bakteerit (esim. kolera), virukset (esim. influenssa), alkueliöt (esim. malaria), eräät sienet (esim. silsa) Aiheuttavat infektiotaudin
LYMFOSYTOOSIT SANOIN JA KUVIN. Pentti Mäntymaa TAYS, Laboratoriokeskus
 LYMFOSYTOOSIT SANOIN JA KUVIN Pentti Mäntymaa TAYS, Laboratoriokeskus Lymfosytoosin määritelmä veren lymfosyyttien määrä >3.5 x 10 9 /l lymfosyyttien kohonnut %-osuus erittelyjakaumassa voi johtua joko
LYMFOSYTOOSIT SANOIN JA KUVIN Pentti Mäntymaa TAYS, Laboratoriokeskus Lymfosytoosin määritelmä veren lymfosyyttien määrä >3.5 x 10 9 /l lymfosyyttien kohonnut %-osuus erittelyjakaumassa voi johtua joko
Epigeneettinen säätely ja genomin leimautuminen. Tiina Immonen Medicum, Biokemia ja kehitysbiologia
 Epigeneettinen säätely ja genomin leimautuminen Tiina Immonen Medicum, Biokemia ja kehitysbiologia 12.12.2017 Epigenetic inheritance: A heritable alteration in a cell s or organism s phenotype that does
Epigeneettinen säätely ja genomin leimautuminen Tiina Immonen Medicum, Biokemia ja kehitysbiologia 12.12.2017 Epigenetic inheritance: A heritable alteration in a cell s or organism s phenotype that does
Miten geenitestin tulos muuttaa syövän hoitoa?
 ChemBio Helsingin Messukeskus 27.-29.05.2009 Miten geenitestin tulos muuttaa syövän hoitoa? Kristiina Aittomäki, dos. ylilääkäri HYKS Perinnöllisyyslääketieteen yksikkö Genomin tutkiminen FISH Sekvensointi
ChemBio Helsingin Messukeskus 27.-29.05.2009 Miten geenitestin tulos muuttaa syövän hoitoa? Kristiina Aittomäki, dos. ylilääkäri HYKS Perinnöllisyyslääketieteen yksikkö Genomin tutkiminen FISH Sekvensointi
BI4 IHMISEN BIOLOGIA
 BI4 IHMISEN BIOLOGIA MITÄ ROKOTUKSIA? Muistatko mitä rokotuksia olet saanut ja minkä viimeiseksi? Miten huolehdit koulun jälkeen rokotuksistasi? Mikrobit uhkaavat elimistöä Mikrobit voivat olla bakteereita,
BI4 IHMISEN BIOLOGIA MITÄ ROKOTUKSIA? Muistatko mitä rokotuksia olet saanut ja minkä viimeiseksi? Miten huolehdit koulun jälkeen rokotuksistasi? Mikrobit uhkaavat elimistöä Mikrobit voivat olla bakteereita,
Farmasian tutkimuksen tulevaisuuden näkymiä. Arto Urtti Lääketutkimuksen keskus Farmasian tiedekunta Helsingin yliopisto
 Farmasian tutkimuksen tulevaisuuden näkymiä Arto Urtti Lääketutkimuksen keskus Farmasian tiedekunta Helsingin yliopisto Auttaako lääkehoito? 10 potilasta 3 saa avun 3 ottaa lääkkeen miten sattuu - ei se
Farmasian tutkimuksen tulevaisuuden näkymiä Arto Urtti Lääketutkimuksen keskus Farmasian tiedekunta Helsingin yliopisto Auttaako lääkehoito? 10 potilasta 3 saa avun 3 ottaa lääkkeen miten sattuu - ei se
Tyypin 1 diabeteksen tulevaisuuden hoitomahdollisuudet. Timo Otonkoski HYKS lastenklinikka Biomedicumin kantasolukeskus
 Tyypin 1 diabeteksen tulevaisuuden hoitomahdollisuudet Timo Otonkoski HYKS lastenklinikka Biomedicumin kantasolukeskus Sisältö T1D hoidon kehittyminen Toiminnallinen beetasolumassa ja sen tutkiminen Toiminnallisen
Tyypin 1 diabeteksen tulevaisuuden hoitomahdollisuudet Timo Otonkoski HYKS lastenklinikka Biomedicumin kantasolukeskus Sisältö T1D hoidon kehittyminen Toiminnallinen beetasolumassa ja sen tutkiminen Toiminnallisen
Viime vuosisadan alkupuolella arveltiin, että
 Elin- ja kudossiirrot Kimmo Porkka ovat tulossa kliinisen käyttöön. Jo nyt hematopoieettisten kantasolujen siirto on monien veritautien käypää hoitoa. Jopa 80 % potilaista paranee näiden siirtojen avulla
Elin- ja kudossiirrot Kimmo Porkka ovat tulossa kliinisen käyttöön. Jo nyt hematopoieettisten kantasolujen siirto on monien veritautien käypää hoitoa. Jopa 80 % potilaista paranee näiden siirtojen avulla
Biologia. Pakolliset kurssit. 1. Eliömaailma (BI1)
 Biologia Pakolliset kurssit 1. Eliömaailma (BI1) tuntee elämän tunnusmerkit ja perusedellytykset sekä tietää, miten elämän ilmiöitä tutkitaan ymmärtää, mitä luonnon monimuotoisuus biosysteemien eri tasoilla
Biologia Pakolliset kurssit 1. Eliömaailma (BI1) tuntee elämän tunnusmerkit ja perusedellytykset sekä tietää, miten elämän ilmiöitä tutkitaan ymmärtää, mitä luonnon monimuotoisuus biosysteemien eri tasoilla
FIT Biotech Oy - Innovatiivisia lääkehoitoja. Tieteellinen johtaja Santeri Kiviluoto, Fil. tri, KTK
 FIT Biotech Oy - Innovatiivisia lääkehoitoja Tieteellinen johtaja Santeri Kiviluoto, Fil. tri, KTK Tärkeää tietoa Tämä esitys saattaa sisältää tulevaisuutta koskevia lausumia, arvioita ja laskelmia Yhtiöstä
FIT Biotech Oy - Innovatiivisia lääkehoitoja Tieteellinen johtaja Santeri Kiviluoto, Fil. tri, KTK Tärkeää tietoa Tämä esitys saattaa sisältää tulevaisuutta koskevia lausumia, arvioita ja laskelmia Yhtiöstä
Koonneet: Mervi Taskinen Jaana Vettenranta Kim Vettenranta (vastuuhenkilö)
 Koonneet: Mervi Taskinen Jaana Vettenranta Kim Vettenranta (vastuuhenkilö) SISÄLLYS Käytetyt lyhenteet... 2 Yksikön esittely... 3 Konventionaalinen syöpähoito... 3 1. Yleiset tunnusluvut... 3 2. Leukemiat...
Koonneet: Mervi Taskinen Jaana Vettenranta Kim Vettenranta (vastuuhenkilö) SISÄLLYS Käytetyt lyhenteet... 2 Yksikön esittely... 3 Konventionaalinen syöpähoito... 3 1. Yleiset tunnusluvut... 3 2. Leukemiat...
Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
Kipu. Oleg Kambur. Geneettisillä tekijöillä suuri merkitys Yksittäisiä geenejä on löydetty vain vähän COMT 23.6.2015
 Katekoli-O-metyylitransferaasi ja kipu Oleg Kambur Kipu Geneettisillä tekijöillä suuri merkitys Yksittäisiä geenejä on löydetty vain vähän COMT 1 Katekoli-O-metyylitransferaasi (COMT) proteiini tuotetaan
Katekoli-O-metyylitransferaasi ja kipu Oleg Kambur Kipu Geneettisillä tekijöillä suuri merkitys Yksittäisiä geenejä on löydetty vain vähän COMT 1 Katekoli-O-metyylitransferaasi (COMT) proteiini tuotetaan
Veren kantasolujen määrää alentavan hoidon (myeloablatiivisen hoidon) jälkeen luuytimensiirron saaneet potilaat
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Neupogenia voidaan käyttää: - lisäämään veren valkosolujen määrää solunsalpaajahoidon jälkeen infektioiden ehkäisemiseksi. - lisäämään
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Neupogenia voidaan käyttää: - lisäämään veren valkosolujen määrää solunsalpaajahoidon jälkeen infektioiden ehkäisemiseksi. - lisäämään
PÄIVI RUOKONIEMI LT, kliinisen farmakologian ja lääkehoidon erikoislääkäri Ylilääkäri, Fimea
 TIIA TALVITIE FM Tiedottaja, Fimea PÄIVI RUOKONIEMI LT, kliinisen farmakologian ja lääkehoidon erikoislääkäri Ylilääkäri, Fimea Syövän lääkehoitojen kehittäminen vaatii KOKO ALAN DIALOGIA Täsmälääkkeet
TIIA TALVITIE FM Tiedottaja, Fimea PÄIVI RUOKONIEMI LT, kliinisen farmakologian ja lääkehoidon erikoislääkäri Ylilääkäri, Fimea Syövän lääkehoitojen kehittäminen vaatii KOKO ALAN DIALOGIA Täsmälääkkeet
Endoteelisolut. Kantasolut ja solujen erilaistuminen. Kantasolun määritelmä. Angiogenesis. Hapentarve ohjaa kapillaarien kasvua.
 Endoteelisolut Kantasolut ja solujen erilaistuminen Alberts et al. 2002 luku 22 Eri kudosten kantasoluja muodostavat verisuonet säätelevät vaihtoa verisuonten ja ympäröivien kudosten välillä endoteelisoluista
Endoteelisolut Kantasolut ja solujen erilaistuminen Alberts et al. 2002 luku 22 Eri kudosten kantasoluja muodostavat verisuonet säätelevät vaihtoa verisuonten ja ympäröivien kudosten välillä endoteelisoluista
Valtakunnallinen koulutuskoordinaattori: dosentti Päivi Lähteenmäki. Koulutusohjelman vastuuhenkilö ja kuulustelija: Dosentti Päivi Lähteenmäki
 LASTENHEMATOLOGIAN JA -ONKOLOGIAN LISÄKOULUTUSOHJELMA Valtakunnallinen koulutuskoordinaattori: dosentti Päivi Lähteenmäki Koulutusohjelman vastuuhenkilö ja kuulustelija: Dosentti Päivi Lähteenmäki Koulutusohjelman
LASTENHEMATOLOGIAN JA -ONKOLOGIAN LISÄKOULUTUSOHJELMA Valtakunnallinen koulutuskoordinaattori: dosentti Päivi Lähteenmäki Koulutusohjelman vastuuhenkilö ja kuulustelija: Dosentti Päivi Lähteenmäki Koulutusohjelman
Narkolepsian immunologiaa ja Pandemrixiin liittyvät tutkimkset
 Narkolepsian immunologiaa ja Pandemrixiin liittyvät tutkimkset Outi Vaarala, Immuunivasteyksikön päällikkö, THL Narkolepsian kulku - autoimmuunihypoteesiin perustuva malli Hypokretiinia Tuottavat neuronit
Narkolepsian immunologiaa ja Pandemrixiin liittyvät tutkimkset Outi Vaarala, Immuunivasteyksikön päällikkö, THL Narkolepsian kulku - autoimmuunihypoteesiin perustuva malli Hypokretiinia Tuottavat neuronit
Virukset tunnetaan parhaiten taudinaiheuttajina, mutta. Virukset lääketieteen apuna. lääketiede. Katsausartikkeli. Tärkein tieto.
 & Laajempi versio artikkelista julkaistaan lehden internet-sivuilla www.laakarilehti.fi > Sisällysluettelot > 12-13/2008. lääketiede Katsausartikkeli Veijo Hukkanen, Kirsi Harila Virukset lääketieteen
& Laajempi versio artikkelista julkaistaan lehden internet-sivuilla www.laakarilehti.fi > Sisällysluettelot > 12-13/2008. lääketiede Katsausartikkeli Veijo Hukkanen, Kirsi Harila Virukset lääketieteen
Geenitekniikan perusmenetelmät
 Loppukurssikoe To klo 14-16 2 osiota: monivalintatehtäväosio ja kirjallinen osio, jossa vastataan kahteen kysymykseen viidestä. Koe on auki klo 14.05-16. Voit tehdä sen oppitunnilla, jolloin saat tarvittaessa
Loppukurssikoe To klo 14-16 2 osiota: monivalintatehtäväosio ja kirjallinen osio, jossa vastataan kahteen kysymykseen viidestä. Koe on auki klo 14.05-16. Voit tehdä sen oppitunnilla, jolloin saat tarvittaessa
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 11.5.2016 Fludarabin Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Vaikka kroonisen lymfaattisen leukemian (KLL) esiintyvyys
11.5.2016 Fludarabin Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Vaikka kroonisen lymfaattisen leukemian (KLL) esiintyvyys
Plasmasolukasvaimet (hematologin näkökulmasta) Eeva-Riitta Savolainen LKT, dos Os.ylilääkäri
 Plasmasolukasvaimet (hematologin näkökulmasta) Eeva-Riitta Savolainen LKT, dos Os.ylilääkäri Monoklonaaliset gammapatiat (plasmasolutaudit) Plasmasolumyelooma Merkitykseltään epäselvä monoklonaalinen gammapatia
Plasmasolukasvaimet (hematologin näkökulmasta) Eeva-Riitta Savolainen LKT, dos Os.ylilääkäri Monoklonaaliset gammapatiat (plasmasolutaudit) Plasmasolumyelooma Merkitykseltään epäselvä monoklonaalinen gammapatia
TIETOA ETURAUHASSYÖPÄPOTILAAN SOLUNSALPAAJAHOIDOSTA
 TIETOA ETURAUHASSYÖPÄPOTILAAN SOLUNSALPAAJAHOIDOSTA TOSIASIOITA USKOMUSTEN TAKANA HARVINAISET SAIRAUDET I MS-TAUTI I ONKOLOGIA I IMMUNOLOGIA 1 LUKIJALLE Eturauhassyöpä on Suomessa miesten yleisin syöpä.
TIETOA ETURAUHASSYÖPÄPOTILAAN SOLUNSALPAAJAHOIDOSTA TOSIASIOITA USKOMUSTEN TAKANA HARVINAISET SAIRAUDET I MS-TAUTI I ONKOLOGIA I IMMUNOLOGIA 1 LUKIJALLE Eturauhassyöpä on Suomessa miesten yleisin syöpä.
IMMUUNIJÄRJESTELMÄN KEHITYS Petteri Arstila (2011)
 1 IMMUUNIJÄRJESTELMÄN KEHITYS Petteri Arstila (2011) Immuunipuolustukseen osallistuvien solujen kehitys jakautuu kahteen päälinjaan, myeloidiseen ja lymfoidiseen, jotka molemmat saavat alkunsa hematopoieettisista
1 IMMUUNIJÄRJESTELMÄN KEHITYS Petteri Arstila (2011) Immuunipuolustukseen osallistuvien solujen kehitys jakautuu kahteen päälinjaan, myeloidiseen ja lymfoidiseen, jotka molemmat saavat alkunsa hematopoieettisista
Granulosyyttikasvutekijöiden käyttöaiheet. Erkki Elonen
 LÄÄKEVAAKA Granulosyyttikasvutekijöiden käyttöaiheet Erkki Elonen Vaikea neutropenia altistaa vaarallisille infektioille. Granulosyyttikasvutekijät ovat parantaneet granulosytopeniapotilaiden elämänlaatua
LÄÄKEVAAKA Granulosyyttikasvutekijöiden käyttöaiheet Erkki Elonen Vaikea neutropenia altistaa vaarallisille infektioille. Granulosyyttikasvutekijät ovat parantaneet granulosytopeniapotilaiden elämänlaatua
Neuroendokriinisten syöpien lääkehoito
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2015 TEEMAT Neuroendokriinisten syöpien lääkehoito Maija Tarkkanen / Kirjoitettu 16.6.2015 / Julkaistu 13.11.2015 Neuroendokriinisten (NE) syöpien ilmaantuvuus lisääntyy,
Page 1 of 5 JULKAISTU NUMEROSSA 3/2015 TEEMAT Neuroendokriinisten syöpien lääkehoito Maija Tarkkanen / Kirjoitettu 16.6.2015 / Julkaistu 13.11.2015 Neuroendokriinisten (NE) syöpien ilmaantuvuus lisääntyy,
ATMP-valmisteet ja Fimean rooli ATMP-valvonnassa Suomessa ja EU:ssa
 ATMP-valmisteet ja Fimean rooli ATMP-valvonnassa Suomessa ja EU:ssa Heli Suila, FT Erikoistutkija, BIO-jaosto Farmaseuttis-biologinen-yksikkö Lääkevalmisteiden arviointi Fimea Pitkälle kehitetyn terapian
ATMP-valmisteet ja Fimean rooli ATMP-valvonnassa Suomessa ja EU:ssa Heli Suila, FT Erikoistutkija, BIO-jaosto Farmaseuttis-biologinen-yksikkö Lääkevalmisteiden arviointi Fimea Pitkälle kehitetyn terapian
Antibody-Drug conjugates: Basic consepts, examples and future perspectives
 Antibody-Drug conjugates: Basic consepts, examples and future perspectives Giulio Casi and Dario Neri Journal of Controlled Release 161:422-428, 2012 Esityksen sisältö Vasta-ainekonjugaatin (antibody-drug
Antibody-Drug conjugates: Basic consepts, examples and future perspectives Giulio Casi and Dario Neri Journal of Controlled Release 161:422-428, 2012 Esityksen sisältö Vasta-ainekonjugaatin (antibody-drug
Syöpä. Ihmisen keho muodostuu miljardeista soluista. Vaikka. EGF-kasvutekijä. reseptori. tuma. dna
 Ihmisen keho muodostuu miljardeista soluista. Vaikka nämä solut ovat tietyssä mielessä meidän omiamme, ne polveutuvat itsenäisistä yksisoluisista elämänmuodoista, jotka ovat säilyttäneet monia itsenäisen
Ihmisen keho muodostuu miljardeista soluista. Vaikka nämä solut ovat tietyssä mielessä meidän omiamme, ne polveutuvat itsenäisistä yksisoluisista elämänmuodoista, jotka ovat säilyttäneet monia itsenäisen
Clinical impact of serum proteins on drug delivery Felix Kratz, Bakheet Elsadek Journal of Controlled Release 161 (2012)
 Clinical impact of serum proteins on drug delivery Felix Kratz, Bakheet Elsadek Journal of Controlled Release 161 (2012) 429 445 Sampo Kurvonen 25.10.2017 Sisältö Plasmaproteiineista Albumiini Transferriini
Clinical impact of serum proteins on drug delivery Felix Kratz, Bakheet Elsadek Journal of Controlled Release 161 (2012) 429 445 Sampo Kurvonen 25.10.2017 Sisältö Plasmaproteiineista Albumiini Transferriini
Seminoman hoito ja seuranta. S. Jyrkkiö
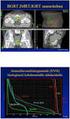 Seminoman hoito ja seuranta S. Jyrkkiö 17.4.2015 Kivessyöpä yleistyy Pohjoismaissa Seminoman ja non-seminoomien yleisyys Pohjoismaissa Kuolleisuus kivessyöpään Pohjoismaissa Kivessyöpä 5 v OSS Kivestuumoreiden
Seminoman hoito ja seuranta S. Jyrkkiö 17.4.2015 Kivessyöpä yleistyy Pohjoismaissa Seminoman ja non-seminoomien yleisyys Pohjoismaissa Kuolleisuus kivessyöpään Pohjoismaissa Kivessyöpä 5 v OSS Kivestuumoreiden
- Jakautuvat kahteen selvästi erottuvaan luokkaan,
 Syöpä, osa II Syöpäkriittiset geenit - Geenejä, joiden mutaatiot usein havaitaan syöpien kanssa korreloituneena - Jakautuvat kahteen selvästi erottuvaan luokkaan, - dominoiviin onkogeeneihin - resessiivisiin
Syöpä, osa II Syöpäkriittiset geenit - Geenejä, joiden mutaatiot usein havaitaan syöpien kanssa korreloituneena - Jakautuvat kahteen selvästi erottuvaan luokkaan, - dominoiviin onkogeeneihin - resessiivisiin
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Pitkälle kehittyneet terapiatuotteet. Paula Salmikangas Lääkelaitos
 Pitkälle kehittyneet terapiatuotteet Paula Salmikangas Lääkelaitos Pitkälle kehittyneet terapiatuotteet (Advanced Therapy Medicinal Products) geeniterapiatuotteet soluterapiatuotteet kudosmuokkaustuotteet
Pitkälle kehittyneet terapiatuotteet Paula Salmikangas Lääkelaitos Pitkälle kehittyneet terapiatuotteet (Advanced Therapy Medicinal Products) geeniterapiatuotteet soluterapiatuotteet kudosmuokkaustuotteet
, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos. 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
ISLABin kantasolulaboratorio Autologisia kantasolusiirteitä intensiivihoidon tueksi
 ISLABin kantasolulaboratorio Autologisia kantasolusiirteitä intensiivihoidon tueksi Eija Mahlamäki erikoislääkäri Itä-Suomen laboratoriokeskuksen liikelaitoskuntayhtymä 23.10.2013 Hematopoieettisten kantasolujen
ISLABin kantasolulaboratorio Autologisia kantasolusiirteitä intensiivihoidon tueksi Eija Mahlamäki erikoislääkäri Itä-Suomen laboratoriokeskuksen liikelaitoskuntayhtymä 23.10.2013 Hematopoieettisten kantasolujen
Biopankit miksi ja millä ehdoilla?
 Suomalaisen Tiedeakatemian 100 v-symposium, Helsinki 4.9.2008 Biopankit miksi ja millä ehdoilla? Juha Kere Karolinska Institutet, Stockholm, Sverige ja Helsingin yliopisto Tautien tutkimus Geeni/ valkuaisaine
Suomalaisen Tiedeakatemian 100 v-symposium, Helsinki 4.9.2008 Biopankit miksi ja millä ehdoilla? Juha Kere Karolinska Institutet, Stockholm, Sverige ja Helsingin yliopisto Tautien tutkimus Geeni/ valkuaisaine
Koonneet: Mervi Taskinen Jaana Vettenranta Kim Vettenranta (vastuuhenkilö)
 Koonneet: Mervi Taskinen Jaana Vettenranta Kim Vettenranta (vastuuhenkilö) SISÄLLYS Käytetyt lyhenteet... Yksikön esittely... Kansainväliset/pohjoismaiset tutkimus- ja hoito-ohjelmat, joissa olemme jo
Koonneet: Mervi Taskinen Jaana Vettenranta Kim Vettenranta (vastuuhenkilö) SISÄLLYS Käytetyt lyhenteet... Yksikön esittely... Kansainväliset/pohjoismaiset tutkimus- ja hoito-ohjelmat, joissa olemme jo
Peittyvä periytyminen. Potilasopas. Kuvat: Rebecca J Kent www.rebeccajkent.com rebecca@rebeccajkent.com
 12 Peittyvä periytyminen Muokattu allamainittujen instanssien julkaisemista vihkosista, heidän laatustandardiensa mukaan: Guy's and St Thomas' Hospital, London, United Kingdom; and the London IDEAS Genetic
12 Peittyvä periytyminen Muokattu allamainittujen instanssien julkaisemista vihkosista, heidän laatustandardiensa mukaan: Guy's and St Thomas' Hospital, London, United Kingdom; and the London IDEAS Genetic
Uusia mahdollisuuksia FoundationOne CDx. keystocancer.fi
 Uusia mahdollisuuksia FoundationOne CDx keystocancer.fi FI/FMI/1810/0067 Lokakuu 2018 FoundationOne CDx -geeniprofilointi FoundationOne CDx on kattava geeniprofilointipalvelu, jossa tutkitaan syöpäkasvaimen
Uusia mahdollisuuksia FoundationOne CDx keystocancer.fi FI/FMI/1810/0067 Lokakuu 2018 FoundationOne CDx -geeniprofilointi FoundationOne CDx on kattava geeniprofilointipalvelu, jossa tutkitaan syöpäkasvaimen
tulehduksellisten suolistosairauksien yhteydessä
 ADACOLUMN -HOITO tulehduksellisten suolistosairauksien yhteydessä www.adacolumn.net SISÄLTÖ Maha-suolikanava...4 Haavainen paksusuolitulehdus...6 Crohnin tauti...8 Elimistön puolustusjärjestelmä ja IBD...10
ADACOLUMN -HOITO tulehduksellisten suolistosairauksien yhteydessä www.adacolumn.net SISÄLTÖ Maha-suolikanava...4 Haavainen paksusuolitulehdus...6 Crohnin tauti...8 Elimistön puolustusjärjestelmä ja IBD...10
Allogeenisten kantasolujensiirtojen kehityssuunnat ja niiden heijastuminen Turun siirtokeskuksen toimintaan ja tuloksiin
 Katsaus KARI REMES, SINI LUOMA, TOIVO T. SALMI, TARJA-TERTTU PELLINIEMI, MAIJA ITÄLÄ, MARJUT KAUPPILA, JUKKA NIKOSKELAINEN, MERVI PUTKONEN, VELI KAIRISTO, ALLAN RAJAMÄKI, ANRI TIENHAARA, SEPPO PYRHÖNEN
Katsaus KARI REMES, SINI LUOMA, TOIVO T. SALMI, TARJA-TERTTU PELLINIEMI, MAIJA ITÄLÄ, MARJUT KAUPPILA, JUKKA NIKOSKELAINEN, MERVI PUTKONEN, VELI KAIRISTO, ALLAN RAJAMÄKI, ANRI TIENHAARA, SEPPO PYRHÖNEN
Liite I. Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle
 Liite I Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle 1 Tieteelliset päätelmät Ottaen huomioon arviointiraportin, jonka lääketurvallisuuden riskinarviointikomitea (PRAC)
Liite I Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle 1 Tieteelliset päätelmät Ottaen huomioon arviointiraportin, jonka lääketurvallisuuden riskinarviointikomitea (PRAC)
kertomus 2 Hematologi Aino Lepän
 Toiminta015 kertomus 2 skus e k ä p ö y S S HYK a Hematologi talo Aino Lepän SISÄLLYS Toiminta 2 Toiminnan tulokset 5 Laadunhallinta ja potilasturvallisuus 7 Kehittämisprojektit 8 Käynnissä olevat tutkimukset
Toiminta015 kertomus 2 skus e k ä p ö y S S HYK a Hematologi talo Aino Lepän SISÄLLYS Toiminta 2 Toiminnan tulokset 5 Laadunhallinta ja potilasturvallisuus 7 Kehittämisprojektit 8 Käynnissä olevat tutkimukset
Toksikologian perusteita ja toksisuuden arviointi
 Toksikologia Toksikologian perusteita ja toksisuuden arviointi Pekka Rauhala 2012 Oppi vieraiden aineiden haitallisista vaikutuksista eläviin organismeihin Paracelsus (1493-1541): Ei ole myrkytöntä ainetta,
Toksikologia Toksikologian perusteita ja toksisuuden arviointi Pekka Rauhala 2012 Oppi vieraiden aineiden haitallisista vaikutuksista eläviin organismeihin Paracelsus (1493-1541): Ei ole myrkytöntä ainetta,
? LUCA (Last universal common ancestor) 3.5 miljardia v.
 Mitä elämä on? - Geneettinen ohjelma, joka kykenee muuttamaan ainehiukkaset ja molekyylit järjestyneeksi itseään replikoivaksi kokonaisuudeksi. (= geneettistä antientropiaa) ? LUCA (Last universal common
Mitä elämä on? - Geneettinen ohjelma, joka kykenee muuttamaan ainehiukkaset ja molekyylit järjestyneeksi itseään replikoivaksi kokonaisuudeksi. (= geneettistä antientropiaa) ? LUCA (Last universal common
Hyötyosuus. ANNOS ja sen merkitys lääkehoidossa? Farmakokinetiikan perusteita. Solukalvon läpäisy. Alkureitin metabolia
 Neurofarmakologia Farmakologian perusteiden kertausta Pekka Rauhala Syksy 2012 Koulu, Mervaala & Tuomisto, 8. painos, 2012 Kappaleet 11-30 (pois kappale 18) tai vastaavat asiat muista oppikirjoista n.
Neurofarmakologia Farmakologian perusteiden kertausta Pekka Rauhala Syksy 2012 Koulu, Mervaala & Tuomisto, 8. painos, 2012 Kappaleet 11-30 (pois kappale 18) tai vastaavat asiat muista oppikirjoista n.
SPR Veripalvelu. Soluterapian haasteet. Saara Laitinen, Solututkimuslaboratorio, Tutkimus ja tuotekehitys. www.veripalvelu.fi. www.veripalvelu.
 SPR Veripalvelu Soluterapian haasteet Saara Laitinen, Solututkimuslaboratorio, Tutkimus ja tuotekehitys 1 1 11 1 Joka vuosi SPR Veripalvelu: 270.000 verenluovutusta 70-90 välitettyä kantasolusiirrettä
SPR Veripalvelu Soluterapian haasteet Saara Laitinen, Solututkimuslaboratorio, Tutkimus ja tuotekehitys 1 1 11 1 Joka vuosi SPR Veripalvelu: 270.000 verenluovutusta 70-90 välitettyä kantasolusiirrettä
DNA RNA proteiinit transkriptio prosessointi translaatio regulaatio
 CELL 411-- replikaatio repair mitoosi meioosi fertilisaatio rekombinaatio repair mendelistinen genetiikka DNA-huusholli Geenien toiminta molekyyligenetiikka DNA RNA proteiinit transkriptio prosessointi
CELL 411-- replikaatio repair mitoosi meioosi fertilisaatio rekombinaatio repair mendelistinen genetiikka DNA-huusholli Geenien toiminta molekyyligenetiikka DNA RNA proteiinit transkriptio prosessointi
KANTASOLUT, KANTASOLUREKISTERI JA KANTASOLUJEN KÄYTTÖ TÄNÄÄN
 KANTASOLUT, KANTASOLUREKISTERI JA KANTASOLUJEN KÄYTTÖ TÄNÄÄN Matti Korhonen, dos, ylilääkäri Solupalvelut, Veripalvelu 12.2.2016 Sisältö monikykyiset ja aikuisen kantasolut (ks. kantasoluluento, googlaa
KANTASOLUT, KANTASOLUREKISTERI JA KANTASOLUJEN KÄYTTÖ TÄNÄÄN Matti Korhonen, dos, ylilääkäri Solupalvelut, Veripalvelu 12.2.2016 Sisältö monikykyiset ja aikuisen kantasolut (ks. kantasoluluento, googlaa
vauriotyypit Figure 5-17.mhc.restriktio 9/24/14 Autoimmuniteetti Kudosvaurion mekanismit Petteri Arstila Haartman-instituutti Patogeeniset mekanismit
 vauriotyypit Kudosvaurion mekanismit Autoimmuniteetti Petteri Arstila Haartman-instituutti Antigeenin tunnistus HLA:ssa pitää sisällään autoimmuniteetin riskin: jokaisella on autoreaktiivisia lymfosyyttejä
vauriotyypit Kudosvaurion mekanismit Autoimmuniteetti Petteri Arstila Haartman-instituutti Antigeenin tunnistus HLA:ssa pitää sisällään autoimmuniteetin riskin: jokaisella on autoreaktiivisia lymfosyyttejä
TUKIMATERIAALI IMMUNOHISTOKEMIAL- LISISTA CD-VÄRJÄYKSISTÄ
 TUKIMATERIAALI IMMUNOHISTOKEMIAL- LISISTA CD-VÄRJÄYKSISTÄ Iina Puuppo Viktoria Pälvi Opinnäytetyö Lokakuu 2015 Bioanalytiikka 2 SISÄLLYS JOHDANTO... 3 Novocastra TM Liquid Mouse Monoclonal Antibody CD10...
TUKIMATERIAALI IMMUNOHISTOKEMIAL- LISISTA CD-VÄRJÄYKSISTÄ Iina Puuppo Viktoria Pälvi Opinnäytetyö Lokakuu 2015 Bioanalytiikka 2 SISÄLLYS JOHDANTO... 3 Novocastra TM Liquid Mouse Monoclonal Antibody CD10...
ips ips ips Olle Lindvall ips ips
 1 173 Olle Lindvall 2002 ips ips ips ips ips 1) ips 2) 3) 4) 1) (Oki et al.: Stem Cells 30: 1120-1133, 2012; Falk et al.: PLoS One 7:e29597) ips ips 2) 1) 1 6 4% (PFA) (Mine et al.: Neurosurgery64: 741-753,
1 173 Olle Lindvall 2002 ips ips ips ips ips 1) ips 2) 3) 4) 1) (Oki et al.: Stem Cells 30: 1120-1133, 2012; Falk et al.: PLoS One 7:e29597) ips ips 2) 1) 1 6 4% (PFA) (Mine et al.: Neurosurgery64: 741-753,
Tulehdus ja karsinogeneesi. Tulehduksen osuus syövän synnyssä. Tulehdus ja karsinogeneesi. Tulehdus ja karsinogeneesi. Tulehdus ja karsinogeneesi
 Tulehduksen osuus syövän synnyssä Ari Ristimäki, professori Patologia Helsingin yliopisto esiasteissa ja useissa eri syöpäkasvaintyypeissä. 1 A Mantovani, et al. NATURE Vol 454 24 July 2008 Figure 15.22d
Tulehduksen osuus syövän synnyssä Ari Ristimäki, professori Patologia Helsingin yliopisto esiasteissa ja useissa eri syöpäkasvaintyypeissä. 1 A Mantovani, et al. NATURE Vol 454 24 July 2008 Figure 15.22d
LIITE EMEAN TIETEELLISET JOHTOPÄÄTÖKSET JA HYLKÄYSPERUSTEET
 LIITE EMEAN TIETEELLISET JOHTOPÄÄTÖKSET JA HYLKÄYSPERUSTEET LÄÄKEVALMISTEKOMITEAN () 19. HEINÄKUUTA 2007 ANTAMAN VALMISTETTA NIMELTÄ NATALIZUMAB ELAN PHARMA KOSKEVAN LAUSUNNON UUDELLEENARVIOINTI Heinäkuussa
LIITE EMEAN TIETEELLISET JOHTOPÄÄTÖKSET JA HYLKÄYSPERUSTEET LÄÄKEVALMISTEKOMITEAN () 19. HEINÄKUUTA 2007 ANTAMAN VALMISTETTA NIMELTÄ NATALIZUMAB ELAN PHARMA KOSKEVAN LAUSUNNON UUDELLEENARVIOINTI Heinäkuussa
Pienryhmä 3 immuunipuolustus, ratkaisut
 Pienryhmä 3 immuunipuolustus, ratkaisut 1. Biologian yo 2013 mukailtu. Merkitse onko väittämä oikein vai väärin, Korjaa väärien väittämien virheet ja perustele korjauksesi. a. Syöjäsolut vastaavat elimistön
Pienryhmä 3 immuunipuolustus, ratkaisut 1. Biologian yo 2013 mukailtu. Merkitse onko väittämä oikein vai väärin, Korjaa väärien väittämien virheet ja perustele korjauksesi. a. Syöjäsolut vastaavat elimistön
Soluhoitovalmisteet ja määräys yksittäisten potilaiden hoidosta. matti korhonen 12.1.2010
 Soluhoitovalmisteet ja määräys yksittäisten potilaiden hoidosta matti korhonen 12.1.2010 Sisältö Veripalvelu ja uudet soluhoidot määräys nostaa rimaa eri tyyppiset soluhoidot määräyksen soveltaminen 'Yksittäisen
Soluhoitovalmisteet ja määräys yksittäisten potilaiden hoidosta matti korhonen 12.1.2010 Sisältö Veripalvelu ja uudet soluhoidot määräys nostaa rimaa eri tyyppiset soluhoidot määräyksen soveltaminen 'Yksittäisen
Kissa: Leikkauksen jälkeisen kivun lievitys kohdun ja munasarjojen poistoleikkauksen sekä pienten pehmytkudoskirurgisten toimenpiteiden jälkeen.
 1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
Immuunijärjestelmä tunnistaa ja torjuu tehokkaasti
 KATSAUS Matti Korhonen, Mikko Keränen, Kim Vettenranta, Sirpa Leppä, Seppo Ylä-Herttuala ja Kimmo Porkka Syövän immunologinen täsmähoito geneettisesti muokatuilla T-soluilla Immuunijärjestelmä tunnistaa
KATSAUS Matti Korhonen, Mikko Keränen, Kim Vettenranta, Sirpa Leppä, Seppo Ylä-Herttuala ja Kimmo Porkka Syövän immunologinen täsmähoito geneettisesti muokatuilla T-soluilla Immuunijärjestelmä tunnistaa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
Ihmisen varaosat. Studia Generalia Lahtiensis 22.03.2011 Kimmo Kontula, HY:n vararehtori Sisätautiopin professori
 Ihmisen varaosat Studia Generalia Lahtiensis 22.03.2011 Kimmo Kontula, HY:n vararehtori Sisätautiopin professori Daidalos ja Ikaros C.P. Landon 1799 Pyhä Kosmas ja Pyhä Damian (t 287 jkr) suorittamassa
Ihmisen varaosat Studia Generalia Lahtiensis 22.03.2011 Kimmo Kontula, HY:n vararehtori Sisätautiopin professori Daidalos ja Ikaros C.P. Landon 1799 Pyhä Kosmas ja Pyhä Damian (t 287 jkr) suorittamassa
Lasten immuunipuutokset. Merja Helminen Lasten infektiolääkäri TaYS lastenklinikka 2004
 Lasten immuunipuutokset Merja Helminen Lasten infektiolääkäri TaYS lastenklinikka 2004 Mikä on poikkeava infektioherkkyys lapsella? Sairausjaksot ikäryhmittäin päiväkotilapsilla Pönkä ym. 1994 Ikä (v)
Lasten immuunipuutokset Merja Helminen Lasten infektiolääkäri TaYS lastenklinikka 2004 Mikä on poikkeava infektioherkkyys lapsella? Sairausjaksot ikäryhmittäin päiväkotilapsilla Pönkä ym. 1994 Ikä (v)
NOPEAKASVUISET B SOLUB NON HODGKIN LYMFOOMAT. Tampere 4. 5. 2006 derström
 NOPEAKASVUISET B SOLUB NON HODGKIN LYMFOOMAT Tampere 4. 5. 2006 Karl Ove SöderstrS derström B solujen erilaistuminen Nopeakasvuiset B solub lymfoomat Diffuusi suurisoluinen B solub lymfooma Manttelisolu
NOPEAKASVUISET B SOLUB NON HODGKIN LYMFOOMAT Tampere 4. 5. 2006 Karl Ove SöderstrS derström B solujen erilaistuminen Nopeakasvuiset B solub lymfoomat Diffuusi suurisoluinen B solub lymfooma Manttelisolu
