Kvanttimekaaninen atomimalli
|
|
|
- Ville-Veikko Virtanen
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Kvanttimekaaninen atomimalli
2 Kvanttimekaaninen atomimalli Rakenne: Pääkuori Alakuori Orbitaalit Elektronit sijaitsevat ydintä ympäröivässä energiapilvessä tietyillä energiatiloilla (pääkuoret). Elektronien energia on kvantittunut (vain tietyt energian arvot mahdollisia) Ympyränmuotoisten ratojen sijaan elektronit sijaitsevat atomiorbitaaleilla, jotka kuvaavat sitä avaruuden osaa, josta elektroni todennäköisemmin löytyy (Huom! voi siis löytyä muualtakin)
3
4
5 Orbitaalit saavat kolmiulotteisia muotoja neljän eri kvanttiluvun perusteella: 1) Pääkvanttiluku (n) Pääkuoren järjestysnumero (vertaa kuorimalli) Mahdolliset arvot: 1, 2, 3, 4, Kuvaa elektronin keskimääräistä energiaa 2) Sivukvanttiluku (l) Määrää orbitaalin muodon s, p, d, f => Atomiorbitaaleja kuvaavat merkinnät: 1s, 2s, 2p, 3s, 3p, 3d n:llä pääkuorella on n kpl alakuoria Esim. Kun n=3, alakuoria on 3kpl, jotka ovat 3s, 3p, 3d
6 3) Magneettinen kvanttiluku (m l ) Määrää orbitaalin avaruudellisen sijainnin ja alakuoren orbitaalien lukumäärän Merkitään: p x, p y, p z, d xy, d yz, d xz jne. Esim. 4) Spinkvanttiluku (s) Lähin vastine todellisuuteen: elektronin pyöriminen akselinsa ympäri (todellisuudessa aivan tästä ei ole kyse) Mahdolliset arvot: s=-½ s=½
7 NELJÄN ENSIMMÄISEN ELEKTRONIKUOREN KVANTTILUVUT n, l ja m l
8 Kvanttimekaanisessa atomimallissa atomin elektronirakenne määräytyy kolmen säännön perusteella. Usein näitä sääntöjä havainnollistetaan laatikkomallilla, joissa elektronia kuvataan nuolella, elektronin spiniä nuolen suunnalla ja orbitaalia laatikolla.
9 1) Energiaminimiperiaate (eli täyttymisjärjestys) Elektronit ovat ytimen ympärillä siten, että niiden energia on mahdollisimman pieni.
10 2) Hundin sääntö Orbitaaleille, joilla on sama energia (esim. 3kpl 2p orbitaalia), asettuu aina ensin yksi elektroni, joilla on sama spini. Esim. 8 O
11 Toisin sanoen. Huhdin säännön mukaan seuraavat tilanteet eivät ole mahdollisia.
12 3) Paulin kieltosääntö Samalla orbitaalilla voi olla enintään kaksi elektronia joilla on eri spini. ts. tilanne ei ole mahdollinen
13
14 Esim. Kirjoita rauta-atomin elektronirakenne a) Kvanttimekaanisen atommimallin avulla b) Havainnollista elektronirakennetta laatikkomallilla. Ratk. a) Raudalle z = 26, joten täyttymisjärjestyksen mukaan elektronirakenne on 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
15 Sama laatikkomallilla 3d 4s 3p 3s 2p 2s 1s
16 Muutokset atomin elektronirakenteessa
17 Jalokaasut jaksollisen järjestelmän ryhmä 18 uloimmalla elektronikuorella on kahdeksan elektronia (oktetti) => elektronirakenne s 2 p 6 (eli täydet s- ja p-orbitaalit) Jalokaasujen elektronirakenne on energeettisesti hyvin edullinen. => Muiden alkuaineiden atomit pyrkivät jalokaasujen elektronirakenteeseen joko luovuttamalla tai vastaanottamalla elektreja
18 Atomi voi vastaanottaa tai luovuttaa energiaa Vastaanottaminen: Kun atomiin tuodaan energiaa (valoa tai lämpöä), elektronit virittyvät eli siirtyvät korkeammille energiatasoille Luovuttaminen: Viritystilan purkautuessa atomista vapautuu energiaa sähkömagneettisena säteilynä (esim. valona). Sähkömagneettinen säteilyn aallonpituudet
19 Viritystilan purkautumista käytetään hyväksi tunnistettaessa alkuaineita liekkikokeiden avulla
20 Ionin muodostuminen Jos ulkoelektronit saavat riittävästi energiaa, ne irtoavat kokonaan. => muodostuu positiivinen ioni Ionisoitumisenergia Enegriamäärä (kj/mol), joka tarvitaan irrottamaan elektroni kaasumaisesta alkuaineatomista tai ionista. Kasvaa siirryttäessä jaksossa oikealle, koska kasvava ydinvaraus vetää samalla kuorella olevia elektroneja voimakkaammin puoleensa. Pienenee siirryttäessä ryhmässä alaspäin, koska ulkoelektronit ovat kauempana ytimestä.
21 Alkuaineen ensimmäinen ionisoitumisenergia järjestysluvun funktiona
22 Elektroniaffiniteetti Energiamäärä (kj/mol), joka sitoutuu tai vapautuu kun elektroni Positiivinen luku: Energiaa sitoutuu Negatiivinen luku: Energiaa vapautuu
23 Ionin koko Alkuperäisen atomiin verrattuna Positiivinen ioni on pienempi, koska ydin vetää voimakkaammin puoleensa jäljelle jääneitä elektroneja Negatiivinen ioni on suurempi, koska elektronien määrän kasvaessa niiden välinen hylkimisvoima on suurempi
24 Jaksollinen järjestelmä
25 Alkuaineen ovat jaksollisessa järjestelmässä kasvavan järjestysluvun mukaisesti. Vaakarivit: jaksoja Pystyrivit: ryhmiä
26 Jaksot Saman jakson alkuaineilla on elektroneja yhtä monella elektronikuorella Ryhmät Ryhmät jaetaan pääryhmiin (1-2 ja 13-18) ja sivuryhmiin (3-12). Saman pääryhmän alkuaineilla on yhtä monta ulkoelektronia => samanlaiset kemialliset ominaisuudet.
27 Pääryhmiin kuuluvien atomien ulkoelektronien lukumäärän näkee ryhmän numerosta.
28 Ryhmät (jatkuu) Sivuryhmiin kuuluvan aineen elektronirakennetta ei voi ennustaa ryhmän numeron perusteella Saman sivuryhmän aineilla ei välttämättä samanlaisia kemiallisia ominaisuuksia.
29 Jaksollinen järjestelmä voidaan jakaa lohkoiksi viimeisenä täyttyvän orbitaalin mukaan.
30 Sivuryhmien metallit Monet sivuryhmien metallit tärkeitä teollisuudelle Titaani, kromi, rauta, kupari Useita hapetuslukuja (poikkeus Zn, Sc) Tärkeitä katalyyttejä Esim. rauta ammoniakin valmistuksessa nikkeli, palladium ja platina rasvahappojen hydrauksessa
31 Siirtymäalkuaineet Alkuaineita, jotka muodostavat ainakin yhden positiivisen ionin, jolla on osittain täyttynyt d-orbitaali Esim. 4. jaksossa Ti, V, Cr, Mn, Fe, Co, Ni, Cu Elektronit voivat siirtyä saman kuoren d-orbitaalilta toiselle tai ulommalle tyhjälle p-orbitaalille(orbitaalien täyttymissäännöt)
32 Siirtymäalkuaineet Kaikilla värillisiä yhdisteitä muodostavilla ioneilla osittain täyttynyt d-orbitaali. Elektroni voi virittyä (Näkyvän valon energia riittää)
33 Siirtymäalkuaineet Muodostavat kompleksiyhdisteitä
34 Kompleksiyhdisteet Kompleksiyhdisteessä keskusatomina toimiva metalliioni sitoo tietyn määrän ligandeja. Ligandit voivat olla Ioneja, OH - Molekyylejä, H 2 O, HN 3, CO Sitoutuvien ligandienlkm riippuu keskusatomista (koordinaatioluku) Kompleksit: KTS. MAOL Komplekseilla tyypillisiä värejä (riippuvat hapetusluvusta & ligandeista). Värit MAOLissa.
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014
 Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli
 KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
MUUTOKSET ELEKTRONI- RAKENTEESSA
 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
elektroni = -varautunut tosi pieni hiukkanen nukleoni = protoni/neutroni
 3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Kemian syventävät kurssit
 Kemian syventävät kurssit KE2 Kemian mikromaailma aineen rakenteen ja ominaisuuksien selittäminen KE3 Reaktiot ja energia laskuja ja reaktiotyyppejä KE4 Metallit ja materiaalit sähkökemiaa: esimerkiksi
Kemian syventävät kurssit KE2 Kemian mikromaailma aineen rakenteen ja ominaisuuksien selittäminen KE3 Reaktiot ja energia laskuja ja reaktiotyyppejä KE4 Metallit ja materiaalit sähkökemiaa: esimerkiksi
Siirtymämetallien erityisominaisuuksia
 Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
3.1 Varhaiset atomimallit (1/3)
 + 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
+ 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kvanttimekaaninen atomimalli. "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman
 Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
9. JAKSOLLINEN JÄRJESTELMÄ
 9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
Atomien rakenteesta. Tapio Hansson
 Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Atomien rakenteesta Tapio Hansson Ykköskurssista jo muistamme... Atomin käsite on peräisin antiikin Kreikasta. Demokritos päätteli alunperin, että jatkuva aine ei voi koostua äärettömän pienistä alkeisosasista
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Jaksollinen järjestelmä
 Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Luku 9: Atomien rakenne ja spektrit. https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
 Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Lukion kemia 6 Kemian kokonaiskuva 1.teema
 Lukion kemia 6 Kemian kokonaiskuva 1.teema Kuva: The International Society for the Philosophy of Chemistry (ISPC) - Lehti: Hyle Kurssin sisältö Ylioppilaskirjoitukset Tehtävien jakautuminen Tehtävien luonne
Lukion kemia 6 Kemian kokonaiskuva 1.teema Kuva: The International Society for the Philosophy of Chemistry (ISPC) - Lehti: Hyle Kurssin sisältö Ylioppilaskirjoitukset Tehtävien jakautuminen Tehtävien luonne
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
Jakso 8: Monielektroniset atomit
 Jakso 8: Monielektroniset atomit Näytä tai palauta tämän jakson tehtävät viimeistään tiistaina 9.6.2015. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 6 ja 7. Suunnilleen samat asiat ovat
Jakso 8: Monielektroniset atomit Näytä tai palauta tämän jakson tehtävät viimeistään tiistaina 9.6.2015. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 6 ja 7. Suunnilleen samat asiat ovat
Käsitteitä. Hapetusluku = kuvitteellinen varaus, jonka atomi saa elektronin siirtyessä
 Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
2. Maitohapon CH3 CH(OH) COOH molekyylissä
 1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
EPÄORGAANINEN KEMIA HARJOITUKSIA. Jaksollinen järjestelmä
 EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
1. Materiaalien rakenne
 1. Materiaalien rakenne 1.1 Johdanto 1. Luento 2.11.2010 1.1 Johdanto Materiaalit voidaan luokitella useilla eri tavoilla Kemiallisen sidoksen mukaan: metallit, keraamit, polymeerit Käytön mukaan: komposiitit,
1. Materiaalien rakenne 1.1 Johdanto 1. Luento 2.11.2010 1.1 Johdanto Materiaalit voidaan luokitella useilla eri tavoilla Kemiallisen sidoksen mukaan: metallit, keraamit, polymeerit Käytön mukaan: komposiitit,
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
8. MONIELEKTRONISET ATOMIT
 8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017
 CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
766334A Ydin- ja hiukkasfysiikka
 1 766334A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 4 Juhani Lounila Oulun yliopisto, Fysiikan laitos, 01 6 Radioaktiivisuus Kuva 1 esittää radioaktiivisen aineen ydinten lukumäärää
1 766334A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 4 Juhani Lounila Oulun yliopisto, Fysiikan laitos, 01 6 Radioaktiivisuus Kuva 1 esittää radioaktiivisen aineen ydinten lukumäärää
JAKSOLLINEN JÄRJESTELMÄ
 JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
OPETTAJAN OPAS. Sisällys Opettajalle 3 Kurssisuunnitelma 5 Tenttisuunnitelma 6 Kemikaaliluettelo 7
 PETTAJAN PAS Sisällys pettajalle 3 Kurssisuunnitelma 5 Tenttisuunnitelma 6 Kemikaaliluettelo 7 1. Atomin rakenne 8 1.1 Atomin rakenne 1.2 Elektronin eneria Työ 5 Mistä elektroni todennäköisesti löytyy?
PETTAJAN PAS Sisällys pettajalle 3 Kurssisuunnitelma 5 Tenttisuunnitelma 6 Kemikaaliluettelo 7 1. Atomin rakenne 8 1.1 Atomin rakenne 1.2 Elektronin eneria Työ 5 Mistä elektroni todennäköisesti löytyy?
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
S Fysiikka III (Est) 2 VK
 S-37 Fysiikka III (Est) VK 500 Tarkastellaan vedyn p energiatasoa a) Mikä on tämän tason energia Bohrin mallissa? b) Oletetaan että spinratavuorovaikutus voidaan jättää huomiotta Kirjoita kaikki tähän
S-37 Fysiikka III (Est) VK 500 Tarkastellaan vedyn p energiatasoa a) Mikä on tämän tason energia Bohrin mallissa? b) Oletetaan että spinratavuorovaikutus voidaan jättää huomiotta Kirjoita kaikki tähän
Atomin elektronikonfiguraatiot (1)
 Atomin elektronikonfiguraatiot (1) Atomiin sidotun elektronin tilaa kuvataan neljällä kvanttiluvulla: n pääkvattiluku - aaltofunktion eli orbitaalin energia, keskimääräinen etäisyys ytimestä, saa arvot
Atomin elektronikonfiguraatiot (1) Atomiin sidotun elektronin tilaa kuvataan neljällä kvanttiluvulla: n pääkvattiluku - aaltofunktion eli orbitaalin energia, keskimääräinen etäisyys ytimestä, saa arvot
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
luku2 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen
 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
KERTAUSTA 1.-KURSSISTA
 KERTAUSTA 1.-KURSSISTA Atomin rakenne 1. Atomin päärakenneosat ovat elektronit, protonit ja neutronit. 2. Positiivisesti varautuneet protonit ja varauksettomat neutronit muodostavat atomin ytimen. 3. Negatiivisesti
KERTAUSTA 1.-KURSSISTA Atomin rakenne 1. Atomin päärakenneosat ovat elektronit, protonit ja neutronit. 2. Positiivisesti varautuneet protonit ja varauksettomat neutronit muodostavat atomin ytimen. 3. Negatiivisesti
Atomi. Aineen perusyksikkö
 Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Arto Liljeblad Susanna Pehkonen Tuula Sorjonen Kirsi-Maria Vakkilainen Sini Virtanen
 YO Kemia Arto Liljeblad Susanna Pehkonen Tuula Sorjonen Kirsi-Maria Vakkilainen Sini Virtanen Sanoma Pro Oy Helsinki Sisällysluettelo Kirjan käyttäjälle... 4 Osa 1 Kemian ylioppilaskoe... 5 Osa 2 Jakso
YO Kemia Arto Liljeblad Susanna Pehkonen Tuula Sorjonen Kirsi-Maria Vakkilainen Sini Virtanen Sanoma Pro Oy Helsinki Sisällysluettelo Kirjan käyttäjälle... 4 Osa 1 Kemian ylioppilaskoe... 5 Osa 2 Jakso
Rakennusalan kemia 5 op
 Rakennusalan kemia 5 op Moodle - työtila: Rakennusalan kemia R501RL14 (päiväopetus) avain: kemia Oppimateriaali: Materiaalit Moodlessa MaoL:n taulukot: kemian sivut - samat taulukot löytyvät Moodlesta
Rakennusalan kemia 5 op Moodle - työtila: Rakennusalan kemia R501RL14 (päiväopetus) avain: kemia Oppimateriaali: Materiaalit Moodlessa MaoL:n taulukot: kemian sivut - samat taulukot löytyvät Moodlesta
766334A Ydin- ja hiukkasfysiikka
 1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Työ 6/s.174-175 Tutustu työn 6 työohjeeseen, siten että osaat toimia sujuvasti sen mukaan ja kysyä asioista joita et ymmärtänyt/osaa
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Työ 6/s.174-175 Tutustu työn 6 työohjeeseen, siten että osaat toimia sujuvasti sen mukaan ja kysyä asioista joita et ymmärtänyt/osaa
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiinteiden'materiaalien'magnee-set'ominaisuudet'
 Kiinteiden'materiaalien'magnee-set'ominaisuudet' Peruskäsite:' Yhdisteessäelektronien orbtaaliliike ja spinvaiku7avatmagnee:siin ominaisuuksiin(spininvaikutuson merki7ävämpi) ' Diamagne6smi' Kaikkiorbitaalittäysinmiehite7yjätai
Kiinteiden'materiaalien'magnee-set'ominaisuudet' Peruskäsite:' Yhdisteessäelektronien orbtaaliliike ja spinvaiku7avatmagnee:siin ominaisuuksiin(spininvaikutuson merki7ävämpi) ' Diamagne6smi' Kaikkiorbitaalittäysinmiehite7yjätai
Johdantoa/Kertausta. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Luku 14: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Kvantittuminen. E = hf f on säteilyn taajuus h on Planckin vakio h = 6, Js = 4, evs. Planckin kvanttihypoteesi
 Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Kvantittuminen Planckin kvanttihypoteesi Kappale vastaanottaa ja luovuttaa säteilyä vain tietyn suuruisina energia-annoksina eli kvantteina Kappaleen emittoima säteily ei ole jatkuvaa (kvantittuminen)
Metallit materiaaleina. kappale 4
 Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Luku 10: Atomien rakenne ja spektrit. Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit
 Luku 10: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit 1 n 1 = 3 n 1 = 4 n 1 = 2 n 1 =1 Vetyatomin spektri koostuu viivoista Viivojen sijainti
Luku 10: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit 1 n 1 = 3 n 1 = 4 n 1 = 2 n 1 =1 Vetyatomin spektri koostuu viivoista Viivojen sijainti
TASASUUNTAUS JA PUOLIJOHTEET
 TASASUUNTAUS JA PUOLIJOHTEET (YO-K06+13, YO-K09+13, YO-K05-11,..) Tasasuuntaus Vaihtovirran suunta muuttuu jaksollisesti. Tasasuuntaus muuttaa sähkövirran kulkemaan yhteen suuntaan. Tasasuuntaus toteutetaan
TASASUUNTAUS JA PUOLIJOHTEET (YO-K06+13, YO-K09+13, YO-K05-11,..) Tasasuuntaus Vaihtovirran suunta muuttuu jaksollisesti. Tasasuuntaus muuttaa sähkövirran kulkemaan yhteen suuntaan. Tasasuuntaus toteutetaan
Nyt n = 1. Tästä ratkaistaan kuopan leveys L ja saadaan sijoittamalla elektronin massa ja vakiot
 S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
Luento 1: Sisältö. Vyörakenteen muodostuminen Molekyyliorbitaalien muodostuminen Atomiketju Energia-aukko
 Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Liitetaulukko 1/11. Tutkittujen materiaalien kokonaispitoisuudet KOTIMAINEN MB-JÄTE <1MM SAKSAN MB- JÄTE <1MM POHJAKUONA <10MM
 Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Epäyhtälön molemmille puolille voidaan lisätä sama luku: kaikilla reaaliluvuilla a, b ja c on voimassa a < b a + c < b + c ja a b a + c b + c.
 Epäyhtälö Kahden lausekkeen A ja B välisiä järjestysrelaatioita A < B, A B, A > B ja A B nimitetään epäyhtälöiksi. Esimerkiksi 2 < 6, 9 10, 5 > a + + 2 ja ( + 1) 2 2 + 2 ovat epäyhtälöitä. Epäyhtälössä
Epäyhtälö Kahden lausekkeen A ja B välisiä järjestysrelaatioita A < B, A B, A > B ja A B nimitetään epäyhtälöiksi. Esimerkiksi 2 < 6, 9 10, 5 > a + + 2 ja ( + 1) 2 2 + 2 ovat epäyhtälöitä. Epäyhtälössä
Firan vesilaitos. Laitosanalyysit. Lkm keski- maksimi Lkm keski- maksimi
 Laitosanalyysit Firan vesilaitos Lämpötila C 3 8,3 8,4 4 8,4 9 ph-luku 3 6,5 6,5 4 7,9 8,1 Alkaliteetti mmol/l 3 0,53 0,59 4 1 1,1 Happi 3 2,8 4 4 11,4 11,7 Hiilidioksidi 3 23,7 25 4 1 1,9 Rauta Fe 3
Laitosanalyysit Firan vesilaitos Lämpötila C 3 8,3 8,4 4 8,4 9 ph-luku 3 6,5 6,5 4 7,9 8,1 Alkaliteetti mmol/l 3 0,53 0,59 4 1 1,1 Happi 3 2,8 4 4 11,4 11,7 Hiilidioksidi 3 23,7 25 4 1 1,9 Rauta Fe 3
Sähkökemiaa. Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio
 Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio Hapettuminen ja pelkistyminen 1. Hapetin ja pelkistin 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi
Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio Hapettuminen ja pelkistyminen 1. Hapetin ja pelkistin 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi
Luento5 8. Atomifysiikka
 Atomifysiikka Luento5 8 54 Kvanttimekaniikan avulla ymmärrämme atomin rakenteen ja toiminnan. Laser on yksi esimerkki atomien ja valon kvanttimekaniikasta. Luennon tavoite: Oppia ymmärtämään atomin rakenne
Atomifysiikka Luento5 8 54 Kvanttimekaniikan avulla ymmärrämme atomin rakenteen ja toiminnan. Laser on yksi esimerkki atomien ja valon kvanttimekaniikasta. Luennon tavoite: Oppia ymmärtämään atomin rakenne
Jaksollinen järjestelmä
 Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Fysiikan, kemian, matematiikan ja tietotekniikan kilpailu lukiolaisille
 Fysiikan, kemian, matematiikan ja tietotekniikan kilpailu lukiolaisille 25.1.2018 Kemian tehtävät Kirjoita nimesi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin
Fysiikan, kemian, matematiikan ja tietotekniikan kilpailu lukiolaisille 25.1.2018 Kemian tehtävät Kirjoita nimesi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin
Lkm keski- maksimi Lkm keski- maksimi. Lkm keski- maksimi Lkm keski- maksimi
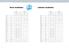 Firan vesilaitos Lahelan vesilaitos Lämpötila C 12 9,5 14,4 12 7,9 8,5 ph-luku 12 6,6 6,7 12 8,0 8,1 Alkaliteetti mmol/l 12 0,5 0,5 12 1,1 1,1 Happi mg/l 12 4,2 5,3 12 11,5 13,2 Hiilidioksidi mg/l 12 21
Firan vesilaitos Lahelan vesilaitos Lämpötila C 12 9,5 14,4 12 7,9 8,5 ph-luku 12 6,6 6,7 12 8,0 8,1 Alkaliteetti mmol/l 12 0,5 0,5 12 1,1 1,1 Happi mg/l 12 4,2 5,3 12 11,5 13,2 Hiilidioksidi mg/l 12 21
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
1. ELEKTRONIEN ENERGIA
 1. ELEKTRONIEN ENERGIA Pääkvanttiluku Bohrin atomimallin mukaan elektronit asettuvat atomissa energiatasoille n=1,2,3,4,... (ns. päätasot) Tason järjestyslukua kutsutaan pääkvanttiluvuksi n. Mitä kauempana
1. ELEKTRONIEN ENERGIA Pääkvanttiluku Bohrin atomimallin mukaan elektronit asettuvat atomissa energiatasoille n=1,2,3,4,... (ns. päätasot) Tason järjestyslukua kutsutaan pääkvanttiluvuksi n. Mitä kauempana
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
, m s ) täytetään alimmasta energiatilasta alkaen. Alkuaineet joiden uloimmalla elektronikuorella on samat kvanttiluvut n,
 S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
Kiinteiden materiaalien magneettiset ominaisuudet
 Kiinteiden materiaalien magneettiset ominaisuudet Peruskäsite: Yhdisteessä elektronien orbtaaliliike ja spin vaikuttavat magneettisiin ominaisuuksiin (spinin vaikutus on merkittävämpi) Diamagnetismi Kaikki
Kiinteiden materiaalien magneettiset ominaisuudet Peruskäsite: Yhdisteessä elektronien orbtaaliliike ja spin vaikuttavat magneettisiin ominaisuuksiin (spinin vaikutus on merkittävämpi) Diamagnetismi Kaikki
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Atomin ydin. Z = varausluku (järjestysluku) = protonien määrä N = neutroniluku A = massaluku (nukleoniluku) A = Z + N
 Atomin ydin ytimen rakenneosia, protoneja (p + ) ja neutroneja (n) kutsutaan nukleoneiksi Z = varausluku (järjestysluku) = protonien määrä N = neutroniluku A = massaluku (nukleoniluku) A = Z + N saman
Atomin ydin ytimen rakenneosia, protoneja (p + ) ja neutroneja (n) kutsutaan nukleoneiksi Z = varausluku (järjestysluku) = protonien määrä N = neutroniluku A = massaluku (nukleoniluku) A = Z + N saman
Atomimallit. Tapio Hansson
 Atomimallit Tapio Hansson Atomin käsite Atomin käsite on peräisin antiikin Kreikasta. Filosofi Demokritos päätteli (n. 400 eaa.), että äärellisen maailman tulee koostua äärellisistä, jakamattomista hiukkasista
Atomimallit Tapio Hansson Atomin käsite Atomin käsite on peräisin antiikin Kreikasta. Filosofi Demokritos päätteli (n. 400 eaa.), että äärellisen maailman tulee koostua äärellisistä, jakamattomista hiukkasista
Sisältö. Magnetismin fysikaaliset perusteet. Diamagnetismi. Paramagnetismi. Magnetismin lajit Yksiköt. Petriina Paturi. Vapaat ionit Atomijoukot
 Sisältö Fysiikan laitos Turun yliopisto 8.11.2007 1 2 3 4 Paramagnetismi Diamagnetismi Atomeilla magneettinen momentti Ei pysyvää kokonaismomenttia χ = C/T = Curien laki M = χb, χ 10 4 10 5 Valtaosa puhtaista
Sisältö Fysiikan laitos Turun yliopisto 8.11.2007 1 2 3 4 Paramagnetismi Diamagnetismi Atomeilla magneettinen momentti Ei pysyvää kokonaismomenttia χ = C/T = Curien laki M = χb, χ 10 4 10 5 Valtaosa puhtaista
17VV VV Veden lämpötila 14,2 12,7 14,2 13,9 C Esikäsittely, suodatus (0,45 µm) ok ok ok ok L. ph 7,1 6,9 7,1 7,1 RA2000¹ L
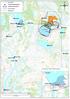 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
17VV VV 01021
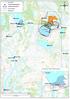 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
8. MONIELEKTRONISET ATOMIT
 8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
Luku 13: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
PUOLIJOHTEISTA. Yleistä
 39 PUOLIJOHTEISTA Yleistä Pyrittäessä löytämään syy kiinteiden aineiden erilaiseen sähkön johtavuuteen joudutaan perehtymään aineen kidehilassa olevien atomien elektronisiin energiatiloihin. Seuraavassa
39 PUOLIJOHTEISTA Yleistä Pyrittäessä löytämään syy kiinteiden aineiden erilaiseen sähkön johtavuuteen joudutaan perehtymään aineen kidehilassa olevien atomien elektronisiin energiatiloihin. Seuraavassa
n=5 n=4 M-sarja n=3 L-sarja n=2 Lisäys: K-sarjan hienorakenne K-sarja n=1
 10.1 RÖNTGENSPEKTRI Kun kiihdytetyt elektronit törmäävät anodiin, syntyy jatkuvaa säteilyä sekä anodimateriaalille ominaista säteilyä (spektrin terävät piikit). Atomin uloimpien elektronien poistamiseen
10.1 RÖNTGENSPEKTRI Kun kiihdytetyt elektronit törmäävät anodiin, syntyy jatkuvaa säteilyä sekä anodimateriaalille ominaista säteilyä (spektrin terävät piikit). Atomin uloimpien elektronien poistamiseen
Fysiikka 8. Aine ja säteily
 Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Fysiikka 8 Aine ja säteily Sähkömagneettinen säteily James Clerk Maxwell esitti v. 1864 sähkövarauksen ja sähkövirran sekä sähkö- ja magneettikentän välisiä riippuvuuksia kuvaavan teorian. Maxwellin teorian
Sähkökemia. Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali
 Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
