FIN_2 KOKEELLINEN OSUUS. Making science together!
|
|
|
- Joonas Haapasalo
- 6 vuotta sitten
- Katselukertoja:
Transkriptio
1 KOKEELLINEN OSUUS Making science together!
2 Yleiset ohjeet Tämä kokeellisen osuuden kirjanen sisältää 28 sivua. Ennen kuin kokeellinen osuus alkaa, annetaan Read (lue) komento. Sinulla on 15 minuuttia aika lukea tehtävävihkonen läpi. Voit ainoastaan lukea tänä aikana; älä kirjoita tai käytä laskinta. Voit alkaa työskennellä heti kun Startkomento annetaan. Sinulla on tästä hetkestä 5 tuntia aikaa kokeen suorittamiseen. Voit tehdä tehtävät haluamassasi järjestyksessä, mutta on suositeltavaa aloittaa tehtävästä P1. Kaikki tulokset ja vastaukset tulee kirjoittaa selkeästi kuulakärkikynällä kunkin tehtävän vastauslaatikoon. Laatikoiden ulkopuolelle kirjoitettuja vastauksia ei arvostella. Jos tarvitset suttupaperia, käytä kokeen sivujen kääntöpuolia. Muista, että mitään mikä on kirjoitettu vastausalueiden ulkopuolelle ei arvostella. Virallinen englanninkielinen versio tehtävävihkosta on saatavilla pyynnöstä ja se on ainoastaan selkeyttämistä varten. Jos haluat poistua laboratoriosta (vessaan, syömään tai juomaan), nosta asianmukainen kortti, jolloin laboratorioassistentti tulee saattamaan sinut. Työpisteiden yläpuolella olevia hyllyjä ei saa käyttää kokeen aikana tasapuolisuuden vuoksi. Sinun tulee noudattaa IChO:n säännöissä annettuja turvallisuusohjeita. Turvallisuusohjeiden rikkomisesta saa vain yhden varoituksen laboratorioassistentilta. Minkä tahansa turvallisuusohjeen rikkominen ensimmäisen varoituksen saamisen jälkeen johtaa poistamiseesi laboratoriosta ja kokeellisen osuuden pisteiden menetykseen. Kemikaalit ja laboratoriotarvikkeet voidaan tarvittaessa korvata uusilla ilman pisteiden menetystä ensimmäisen vahingon osalta, ellei toisin ole ilmoitettu. Kustakin seuraavasta kerrasta seuraa yhden pisteen vähennys kokeellisen osuuden 40 pisteestä. Laboratorioassistentti antaa varoituksen, kun koeaikaa on jäljellä enää 30 minuuttia. Työskentely tulee lopettaa heti, kun Stopkomento annetaan. Komennon noudattamatta jättämisestä, eli työskentelyn tai kirjoittamisen jatkamisesta edelleen yli minuutilla seuraa kokeellisen osuuden hylkäys. Stopkomennon antamisen jälkeen laboratorioassistentti allekirjoittaa vastauslomakkeesi. Kun molemmat, sinä ja laboratorioassistentti, olette allekirjoittaneet kokeen, laita tämä koevihkonen kirjekuoreen ja anna se arvosteltavaksi yhdessä tuotteesi ja ohutlevykromatografialevyjesi (TLClevyjesi) kanssa. Laboratorion säännöt ja turvallisuus Laboratoriotakkia tulee käyttää ja se täytyy pitää napitettuna ylös asti. Kenkien täytyy peittää jalkaterät ja kantapäät kokonaan. Suojalaseja tulee käyttää aina laboratoriossa työskennellessä. Piilolinssien käyttö ei ole sallittua. Syöminen ja juominen laboratoriossa on kielletty. Purkan syöminen ei myöskään ole sallittua. Työskentele ainoastaan määrätyllä alueella. Pidä oma työpisteesi ja yleiset tilat siistinä. Ylimääräiset kokeet, joita ei löydy vihkosta, ovat kiellettyjä. Myöskään vihkossa olevia kokeita ei tule muokata. Pipetointi suulla on kielletty. Pipetit täytetään aina pumpetin avulla. Siivoa läikkyneet kemikaalit ja rikkinäinen lasitavara välittömästi sekä työpöydältä että lattialta. Kaikki jäte tulee hävittää asianmukaisesti kontaminaation ja henkilövahinkojen välttämiseksi. Vesiliuokset voidaan kaataa viemäriin. Orgaaninen jäte tulee hävittää laittamalla se kannelliseen merkittyyn purkkiin. 51st IChO Practical Exam 2
3 Fysikaaliset vakiot ja kaavat Tässä vihkosessa oletetaan, että kaikkien veteen liuenneiden spesiesten aktiivisuuksia voidaan hyvin approksimoida konsentraatioilla yksiköissä mol/l. Edelleen kaavojen ja lausekkeiden yksinkertaistamiseksi standardikonsentraatiota c = 1 mol/l ei merkitä. Avogadron vakio: Yleinen kaasuvakio: Standardipaine: Ilmakehän paine: Celsiusasteikon nollakohta: Faradayn vakio: Watti: Kilowattitunti: Planckin vakio: Valonnopeus tyhjiössä: Alkeisvaraus: Sähköteho: Tehon hyötysuhde: Planckin ja Einsteinin yhteys: Ideaalikaasun tilanyhtälö: Gibbsin energia: Reaktioosamäärä Q reaktiolle a A(aq) + b B(aq) = c C(aq) + d D(aq): N A = 6, /mol R = 8,314 J/(mol K) p = 1 bar = 10 5 Pa P atm = 1 atm = 1,013 bar = 1, Pa 273,15 K F = 9, C/mol 1 W = 1 J/s 1 kwh = 3, J h = J s c = m/s e = C P = ΔE I η = P havaittu/p käytetty E = hc/λ pv = nrt G = H TS Δ rg = RT lnk Δ rg = n F E cell Δ rg = Δ rg + RT lnq Q = [C]c [D] d [A] a [B] b Hendersonin ja Hasselbalchin yhtälö: ph = pk a + log [A ] [AH] Nernstin yhtälö: E = E o RT zf lnq jossa Q on pelkistyspuolireaktion reaktioosamäärä Lambertin ja Beerin laki: Integroidut nopeuslait: Nollas kertaluku: Ensimmäinen kertaluku: Toinen kertaluku: Ensimmäisen kertaluvun prosessin puoliintumisaika: lämpötilassa T = 298 K, RT ln10 0,059 V F A = εlc [A] = [A] 0 kt ln[a] = ln[a] 0 kt 1 [A] = 1 + kt [A] 0 t 1/2 = ln2 k Lukumääräkeskimääräinen moolimassa M n: M ( = N M N Massakeskimääräinen moolimassa M w: M. = N / M N M Polydispersiteettiindeksi I p: I p = M w M n Huomio Molaarisen konsentraation yksikkö on joko "M" tai "mol/l": 1 M = 1 mol/l 1 mm = 10 3 mol/l 1 µm = 10 6 mol/l 51st IChO Practical Exam 3
4 51st IChO Practical Exam 4 Jaksollinen järjestelmä H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc 44 Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 85 At 86 Rn 87 Fr 88 Ra Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg 112 Cn 113 Nh 114 Fl 115 Mc 116 Lv 117 Ts 118 Og 57 La Ce Pr Nd Pm 62 Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac 90 Th Pa U Np 94 Pu 95 Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101 Md 102 No 103 Lr
5 Definition of GHS statements The GHS hazard statements (Hphrases) associated with the materials used are indicated in the problems. Their meanings are as follows. Physical hazards H225 Highly flammable liquid and vapor. H226 Flammable liquid and vapor. H228 Flammable solid. H271 May cause fire or explosion; strong oxidizer. H272 May intensify fire; oxidizer. H290 May be corrosive to metals. Health hazards H301 Toxic if swallowed. H302 Harmful if swallowed. H304 May be fatal if swallowed and enters airways. H311 Toxic in contact with skin. H312 Harmful in contact with skin. H314 Causes severe skin burns and eye damage. H315 Causes skin irritation. H317 May cause an allergic skin reaction. H318 Causes serious eye damage. H319 Causes serious eye irritation. H331 Toxic if inhaled. H332 Harmful if inhaled. H333 May be harmful if inhaled. H334 May cause allergy or asthma symptoms or breathing difficulties if inhaled. H335 May cause respiratory irritation. H336 May cause drowsiness or dizziness. H351 Suspected of causing cancer. H361 Suspected of damaging fertility or the unborn child. H371 May cause damage to organs. H372 Causes damage to organs through prolonged or repeated exposure. H373 May cause damage to organs through prolonged or repeated exposure. Environmental hazards H400 Very toxic to aquatic life. H402 Harmful to aquatic life. H410 Very toxic to aquatic life with longlasting effects. H411 Toxic to aquatic life with longlasting effects. H412 Harmful to aquatic life with longlasting effects. 51st IChO Practical Exam 5
6 Kemikaalit Kaikkiin tehtäviin Kemikaalit Merkitty tekstillä GHS hazard statements Ionivaihdettua vettä: Ruiskupullossa (työpisteellä) Muovipullossa (työpisteella) Deionized Water Not hazardous Muovikanisterisssa (vetokaapissa) Etanolia ruiskupullossa Ethanol H225, H319 Valkoviininäyte, 300 ml tummassa muovipullossa Wine sample H225, H319 Tehtävään P1 Kemikaalit Merkitty tekstillä GHS hazard statements 4nitrobentsaldehydi, 1,51 g tummassa lasivialissa 4nitrobenzaldehyde H317, H319 Eluentti A, 20 ml lasivialissa Eluent A H225, H290, H304, H314, Eluentti B, 20 ml lasivialissa Oxone (kaliumperoksimonosulfaatti), 7,87 g muovipullossa Näyte 4nitrobentsaldehydiä TLC:tä varten Eluent B Oxone TLC standard H319, H336, H410 H225, H290, H304, H314, H319, H336, H410 H314 H317, H319 Tehtävään P2 Kemikaalit Merkitty tekstillä GHS hazard statements 1 M kaliumtiosyanaattiliuos, 20 ml muovipullossa KSCN 1 M H302+H312+H332, H412 0,00200 M kaliumtiosyanaattiliuos, 60 ml muovipullossa KSCN M Not hazardous 1 M perkloorihappoliuos, 10 ml muovipullossa HClO4 H290, H315, H319 0,00200 M rauta(iii)liuos, 80 ml muovipullossa Fe(III) M Not hazardous 0, M rauta(iii)liuos, 80 ml muovipullossa Fe(III) M Not hazardous 0,3% vetyperoksidiliuos, 3 ml tummassa lasipullossa H2O2 Not hazardous 51st IChO Practical Exam 6
7 Tehtävään P3 Kemikaalit Merkitty tekstillä GHS hazard statements 0,01 M jodiliuos, 200 ml tummassa muovipullossa I2 H372 0,03 M natriumtiosulfaattiliuos, 200 ml muovipullossa Na2S2O3 Not hazardous 1 M NaOHliuos, 55 ml muovipullossa NaOH H290, H314 2,5 M rikkihappoliuos, 80 ml muovipullossa H2SO4 H290, H315, H319 0,5 M kaliumjodidiliuos, 25 ml muovipullossa KI H372 Kaliumjodaatti, noin 100 mg (tarkka massa lukee etiketissä), lasivialissa KIO3 H272, H315, H319, H335 Tärkkelysliuos, 25 ml muovipullossa Starch Not hazardous 51st IChO Practical Exam 7
8 Välineet Kaikkia tehtäviä varten Henkilökohtaiset välineet Lukumäärä Pumpetti 1 Suojalasit 1 1 l muovipullo orgaaniselle jätteelle, merkitty tekstillä Organic waste 1 Paperipyyhkeitä 15 arkkia Puhdistusliinat 30 arkkia Spaatteli (iso) 1 Spaatteli (pieni) 1 Sekuntikello 1 Lyijykynä 1 Kumi 1 Musta kuulakärkikynä 1 Tussi lasitavaralle 1 Viivain 1 Yhteiset välineet UVlamppu TLC:n katselua varten Kolorimetri Kumihanskat Jääämpäri Lukumäärä 2 per laboratorio 5 per laboratorio Kaiki koot (S, M, L, XL) saatavilta laboratorioassistentilta pyydettäessä 1 per laboratorio Tehtävään P1 Henkilökohtaiset välineet Lukumäärä Statiivi, jossa on: 1 Pieni koura 2 Iso koura 1 Hioksellinen erlenmeyerkolvi, 100 ml 1 Hioksellinen erlenmeyerkolvi, 50 ml 1 Pystyjäähdytin 1 Kuumentava sekoitin 1 Kiteytysmalja 1 Sekoitusmagneetti 1 Imupullo 1 Büchnersuppilo kumiadapterilla 1 Minigrippussi, jossa kolme suodatinpaperia 1 Petrimalja 1 TLCkammio tekstillä TLC elution chamber 1 Minigrippussi, jossa 3 TLClevyä (joissa fluoresenssi 1 indikaattoria) merkittyinä kilpailijatunnuksella TLCkapillaarit (petrimaljassa) 4 Muovipinsetit 1 Lasisauva 1 Mittalasi, 25 ml 1 Dekantterilasi, 150 ml 2 Muovinen kiinteänaineen suppilo 1 Kertakäyttöinen muovipipetti 2 Tumma, korkillinen 1,5 ml:n lasiviali TLCnäytteelle, merkittynä kirjaimilla C ja R 51st IChO Practical Exam 8 2
9 Etukäteen punnittu tumma lasiviali korkilla, 10 ml, merkittynä kilpailijatunnuksella 1 Magneettinen sekoitusmagneetin poistaja 1 Tehtävään P2 Henkilökohtaiset välineet Lukumäärä Täyspipetti, 10 ml 1 Mittapipetti, 10 ml 3 Mittapipetti, 5 ml 3 Koeputkiteline 1 Koeputki 15 Koeputken korkki 7 Kolorimetrin kyvetti, kyvetin leveys 1,0 cm 2 Dekantterilasi, 100 ml 2 Kertakäyttöinen muovipipetti 15 Tehtävään P3 Henkilökohtaiset välineet Lukumäärä Statiivi byretinpidikkeellä 1 Byretti, 25 ml 1 Lasisuppilo 1 Erlenmeyerkolvi, 100 ml 3 Erlenmeyerkolvi, 250 ml 3 Dekantterilasi, 150 ml 1 Dekantterilasi, 100 ml 2 Mittapullo, 100 ml, korkilla 1 Täyspipetti, 50 ml 1 Täyspipetti, 25 ml 1 Täyspipetti, 20 ml 1 Mittalasi, 25 ml 1 Mittalasi, 10 ml 1 Mittalasi, 5 ml 1 Kertakäyttöinen muovipipetti 3 Parafilmi 20 arkkia 51st IChO Practical Exam 9
10 Tehtävä P1 13% kokonaispistemäärästä Kysymys Saanto Puhtaus TLC P1.1 P1.2 Yhteensä Pisteitä Saadut pisteet Tehtävä P1. Nitrobentsaldehydin hapetuksen vihertäminen Vuosikymmenten ajan kemistit ovat yrittäneet korvata hapetusprosessien haitalliset reagenssit vaarallisen jätteen vähentämiseksi. Tässä tehtävässä hapettimeksi on valittu kaliumperoksimonosulfaatti, koska se tuottaa vain vaarattomia ja saastuttamattomia sulfaattisuoloja. Reagenssi on annettu kauppanimellään Oxone. Lisäksi reaktio suoritetaan vesietanoliseoksessa, jotka molemmat luokitellaan vihreiksi liuottimiksi. Tehtäväsi on hapettaa 4nitrobentsaldehydi, uudelleenkiteyttää tuote, vertailla TLCeluentteja ja tarkastaa tuotteen puhtaus TLC:n avulla. Huomio: Etanolijäte ja eluentti täytyy hävittää kaatamalla ne "Organic Waste" merkittyyn pulloon. Työn suoritus I. 4Nitrobentsaldehydin hapetus 1. Sekoita 20 ml vettä ja 5 ml etanolia. 2. Laita sekoitusmagneetti 100 ml:n hiokselliseen erlenmeyerkolviin. 3. Siirrä ennaltapunnittu 1,51 g 4nitrobentsaldehydiä erlenmeyerkolviin. Lisää valmistamasi vesietanoliseos kokonaan. Kiinnitä erlenmeyerkolvi kouralla statiiviin. Käynnistä sekoitus, sitten lisää ennaltapunnittu 7,87 g Oxonea. 4. Kiinnitä pallojäähdytin löysäämällä suuri koura ja asettamalla hiokset kohdalleen (katso Kuva 1). Nosta HELPkorttisi. Assistentti tulee avaamaan vesikierron ja laittamaan lämmityksen päälle. 5. Lämmitä reaktioseosta niin, että se kevyesti refluksoituu (n. 1 pisara tiivistyy per sekunti) 45 minuutin ajan. Lämpölevyn merkinnän pitäisi täsmätä sopivaan refluksointilämpötilaan. Suuri koura Pieni koura Kuva 1. Refluksointilaitteisto 51st IChO Practical Exam 10
11 6. Sammuta lämmitys. Poista lämpölevy ja anna reaktioseoksen jäähtyä 10 minuuttia. Aseta sitten erlenmeyerkolvi jäävesiseoksella täytettyyn kiteytysmaljaan. Anna seoksen jäähtyä toiset 10 minuuttia. 7. Kasaa imusuodatuslaitteisto (katso Kuva 2) käyttäen Büchnersuppiloa, suodatinpaperia ja imupulloa, joka on kiinnitetty pienellä kouralla statiiviin. Nosta HELPkorttisi. Assistentti tulee näyttämään miten imupullosi yhdistetään imuun. Büchnersuppilo Suodatinpaperi Kumikartio Pieni koura Kuva 2. Imusuodatuslaitteisto 8. Kastele suodatinpaperi vedellä ja varmista, että se peittää kaikki suppilon reiät. 9. Kaada raakatuotesuspensio Büchnersuppiloon ja avaa imu. Pese kiinteää tuotetta huolellisesti ionivaihdetulla vedellä (ainakin 4 20 ml). 10. Anna ilman virrata saostuman läpi 5 minuuttia. Irrota imuletku. Käytä pientä spaattelia siirtääksesi spaattelinkärjellisen raakatuotetta tummaan 1,5 ml:n vialiin, merkitty C. Sulje viali ja säästä se osioon III. 11. Siirrä kaikki jäljelle jäänyt kiinteä aine 50 ml:n hiokselliseen erlenmeyerkolviin. 12. Hävitä suodos Organic waste pulloon, pese imupullo ja Büchnersuppilo etanolilla ja vedellä. Käytä Organic waste pulloa etanolijätteen keräämiseen. Imu II. Tuotteen uudelleenkiteyttäminen 13. Sekoita 9 ml vettä ja 21 ml etanolia. 14. Suorita raakatuotteen uudelleenkiteyttäminen 50 ml:n hioksellisessa erlenmeyerkolvissa sopivalla määrällä vesietanoliseosta käyttäen samaa refluksointilaitteistoa (katso Kuva 1). Nosta HELPkorttisi. Assistentti tulee avaamaan vesikierron ja laittamaan lämmityksen päälle. Lisää liuotinta jäähdyttimen yläpäästä. 15. Kun tuote on kiteytynyt, kerää kiinteä aine kuten edellä (kohdasta I.7 kohtaan I.10). Käytä pientä spaattelia siirtääksesi spaattelinkärjellisen uudelleenkiteytettyä tuotetta 1,5 ml:n tummaan vialiin, merkitty R. Sulje viali ja säästä se osioon III. 16. Siirrä puhdistettu tuote ennaltapunnittuun vialiin, joka on merkitty kilpailijatunnuksellasi. Sulje viali. 51st IChO Practical Exam 11
12 17. Hävitä suodos Organic waste pulloon ja nosta HELPkorttisi. Assistentti tulee sammuttamaan vesikierron. III. TLCanalyysi 1. Valmistele eluutiokammio. Laita eluutiokammion pohjalle noin 0,5 cm korkeuteen asti eluenttia A. Peitä kammio petrimaljalla. Odota hetki, että eluenttia haihtuu kammiossa kyllästäen kammion ilman eluentilla. 2. Valmistele näytteesi. Sinulle on annettu 4nitrobentsaldehydinäyte pienessä tummassa vialissa, jossa on merkintä TLC standard (merkitään S TLClevyllä). Olet säästänyt pienen näytteen raakatuotetta (viali C) ja uudelleenkiteytettyä tuotetta (viali R). Lisää noin 1 ml etanolia kuhunkin vialiin näytteiden liuottamiseksi. 3. Valmistele TLClevysi. Piirrä lyijykynällä varovasti aloitusviiva (1 cm levyn alareunasta) ja merkitse paikat 3 näytteellesi. Merkitse ne kirjaimin S (lähtöaine), C (raakatuote) ja R (uudelleenkiteytetty tuote) kuten on esitetty Kuvassa 3. Kirjoita kilpailijatunnuksesi levyn vasempaan yläkulmaan. Kirjoita käytetty eluentti levyn oikeaan yläkulmaan (ensin Eluent A, sitten Eluent B). Aplikoi kolme näytettä levylle käyttäen kapillaariputkia. Kuva 3. TLClevyn valmistelu 4. Suorita TLCanalyysi. Aseta TLClevy pinseteillä eluutiokammioon ja peitä kammio petrimaljalla. Anna eluentin nousta noin 1 cm päähän levyn yläreunasta. Nosta levy pinseteillä, merkitse lyijykynällä eluentin saavuttama raja ja anna levyn kuivua. 5. Merkitse TLClevyyn täplät. Aseta TLClevy UVlampun alle, joka on yhteisellä pöydällä. Ympyröi kaikki näkyvät täplät lyijykynällä. 6. Hävitä eluentti kaatamalla se Organic waste pulloon. 7. Toista kohdat 1, 3, 4, 5 ja 6 eluentilla B. 8. Aseta levysi kilpailijatunnuksellasi merkittyyn minigrippussiin. 51st IChO Practical Exam 12
13 TLCanalyysisi tulokset. (täydennä kuvat tuloksillasi). Voit käyttää näitä piirroksia apuna vastatessasi analyysiä koskeviin kysymyksiin. Piirroksia ei arvostella. Kokeen lopuksi laboratorioassistentti kerää seuraavat asiat: Lasiviali merkittynä kilpailijatunnuksellasi sisältäen uudelleenkiteytetyn tuotteen; TLClevyt A ja B minigrippussissa merkittynä kilpailijatunnuksellasi. Palautetut asiat Uudelleenkiteytetty tuote TLClevy A TLClevy B Allekirjoitukset Kilpailija Assistentti 51st IChO Practical Exam 13
14 Kysymykset 1. Esitä orgaanisen lopputuotteen rakenne, kun 4nitrobentsaldehydi ja Oxone reagoivat. 2. Vastaa TLCanalyysisi perusteella seuraaviin kysymyksiin. Kumpi eluentti on parempi reaktion etenemisen seuraamiseen? A B Raakatuote (C) sisältää jäämiä 4nitrobentsaldehydistä. Oikein Väärin Uudelleenkiteytetty tuote (R) sisältää jäämiä 4nitrobentsaldehydistä. Oikein Väärin 51st IChO Practical Exam 14
15 Tehtävä P2 14% kokonaispisteistä Kysymys Kalibrointi Raudan Stoikiometrian P2.1 P2.2 P2.3 määritys määritys P2.4 P2.5 Yhteensä Pisteitä Saadut pisteet Tehtävä P2. Viinin rautakausi Rauta on alkuaine, jota löytyy viinistä luonnollisesti. Kun sen konsentraatio ylittää 1015 mg litrassa, rauta(ii):n hapettuminen rauta(iii):ksi saattaa johtaa laadun heikkenemiseen saostumien muodostumisen vuoksi. Siksi on tärkeää määrittää viinin rautapitoisuus sen tuotannon aikana. Koska raudan konsentraatio on hyvin pieni, raudan määrittämiseksi käytetään rauta(iii):n värillistä kompleksia tiosyanaattiligandin SCN kanssa spektrofotometrisillä mittauksilla. Tehtäväsi on määrittää raudan kokonaiskonsentraatio annetusta valkoviinistä käyttäen spektrofotometriaa sekä määrittää tiosyanaattirauta(iii)kompleksin stoikiometria. VAROITUS Tässä tehtävässä sinulle annetaan kaksi rauta(iii)liuosta sekä kaksi kaliumtiosyanaattiliuosta, joilla on eri konsentraatiot. Ole hyvin tarkkana, ettet sekoita niitä. Kun liuokset ovat valmiita spektrofotometrisiin mittauksiin, mittaa absorbanssi viimeistään yksi tunti tiosyanaattiliuoksen lisäämisen jälkeen. Kun tarvitset kolorimetriä, nosta HELPkorttisi. Laboratorioassistentti antaa sinulle merkityn kolorimetrin. Tämä kolorimetri on omassa käytössäsi enintään 15 minuuttia. Laboratorioassistentti ottaa sen takaisin heti, kun olet lopettanut tai kun 15 minuuttia on kulunut. Jos yhtään kolorimetriä ei ole vapaana kyseisellä hetkellä, sinut lisätään odotuslistaan. Kolorimetrin käyttöohjeet on esitetty seuraavalla sivulla. Voit pyytää kolorimetriä vain kolmesti tässä tehtävässä. 51st IChO Practical Exam 15
16 Kolorimetrin käyttöohjeet Absorbanssi/transmittanssitila Näyttö Aallonpituuden valinta Kyvetin suunnan näyttäjä Valintapyörä Kyvettisäiliö OKpainike Kytke kolorimetri seinään. Tarkista, että Absorbance on korostettu. Jos ei ole, käännä valintapyörää, kunnes katkoviiva ilmestyy Absorbance kohdan ympärille ja paina sitten OKpainiketta. Käännä valintapyörää, kunnes katkoviiva ilmestyy halutun aallonpituuden ympärille (470 nm). Paina OKpainiketta. Aseta kyvettisäiliöön kyvetti, jossa on noin 3 cm:n korkeuteen nollausliuosta. Ole huolellinen valitaksesi kyvetille oikean suunnan (katso kyvetin suunnan näyttäjää kolorimetrissä, säde on keltaisen nuolen suuntaisesti, katso alla olevaa kuvaa), ja painaaksesi kyvetin alas pohjaan asti. Sulje kansi. Käännä valintapyörää, kunnes katkoviiva ilmestyy Absorbance kohdan ympärille ja paina sitten OKpainiketta. Valintapyörää käyttäen korosta Calibration ja paina sitten OKpainiketta. Odota kunnes näytöllä lukee 0.00 (tai 0.00). Aseta laitteeseen kyvetti, jossa on analyysiliuosta noin 3 cm:n korkeuteen asti. Sulje kansi. Lue absorbanssin arvo. Kyvetti Kyvettisäiliö Kyvetin suunnan näyttäjä 51st IChO Practical Exam 16
17 I. Viinin rautapitoisuuden määritys Tässä osassa tarvitset 0, M rauta(iii)liuoksen sekä 1 M kaliumtiosyanaattiliuoksen. Työn suoritus 1. Valmistele 6 koeputkea laittamalla jokaiseen putkeen tarvittavat tilavuudet annettuja liuoksia, kuten alla olevassa taulukossa on kuvattu. Koeputki # , M rauta(iii)liuos 1 M perkloorihappoliuos 1,0 ml 2,0 ml 4,0 ml 6,0 ml 1,0 ml 1,0 ml 1,0 ml 1,0 ml 1,0 ml 1,0 ml Viini 10,0 ml 10,0 ml Vetyperoksidiliuos 0,5 ml 0,5 ml Ionivaihdettu vesi 9,5 ml 8,5 ml 6,5 ml 4,5 ml 1,0 ml 2. Laita koeputkiin korkit ja homogenisoi liuokset. 3. Lisää 1,0 ml 1 M kaliumtiosyanaattiliuosta koeputkiin 1, 2 3, 4 ja 5. Älä lisää koeputkeen 6. Laita koeputkiin korkit ja homogenisoi liuokset. 4. Kun kaikki koeputket ovat valmiita, nosta HELPkorttisi saadaksesi kolorimetrin laboratorioassistentilta. 5. Valmistele kolorimetri edellä olevan ohjeen mukaan (katso sivu 16). Aseta aallonpituus 470 nm:iin. Käytä nollaukseen ionivaihdettua vettä. 6. Mittaa jokaisen koeputken absorbanssi (1:stä 6:een) tällä aallonpituudella. Kirjoita tulokset seuraavaan taulukkoon. Nosta HELPkorttisi palauttaaksesi kolorimetrin. Koeputki # Absorbanssi (470 nm:ssä) Fe 3+ :n analyyttinen konsentraatio koeputkessa c(fe 3+ ) / µm Kolorimetrin koodi 51st IChO Practical Exam 17
18 Kysymykset 1. Piirrä kuvaaja koeputkien 1 4 absorbansseista A liuoksessa olevan Fe 3+ :n analyyttisen konsentraation funktiona. Seuraavassa taulukossa rastita datasta ne koeputket, jotka otat huomioon kalibraatiosuoraa laatiessasi. Koeputki # Kalibraatiosuoran laatimisessa käytetyt absorbanssiarvot 2. Käyttäen edeltävää kuvaajaa ja valitsemaasi dataa, piirrä kalibraatiosuora edeltävään kuvaajaan ja määritä Fe 3+ :n analyyttinen konsentraatio (yksikkönä µmol/l) koeputkessa 5. c(fe 3+ )KOEPUTKI 5 = µmol/l Jos et osannut laskea c(fe 3+ ):ta, voit käyttää arvoa c(fe 3+ ) = 50 µmol/l tehtävän loppuosassa. 51st IChO Practical Exam 18
19 3. Laske raudan massakonsentraatio tutkitussa viinissä (mg per litra). cm(rauta) = mg/l 51st IChO Practical Exam 19
20 II. Kompleksin stoikiometrian määritys Tässä osassa tarvitset 0,00200 M rauta(iii)liuoksen ja 0,00200 M kaliumtiosyanaattiliuoksen. Työn suoritus Tämän tehtävän osassa I käytimme rauta(iii)tiosyanaattikompleksin väriä määrittääksemme raudan konsentraation viininäytteessä. Tämän tehtävän osassa II pyritään selvittämään [Fea(SCN)b] (3a b)+ kompleksin stoikiometria (veden koordinaatiota ei ole näytetty). Kompleksissa a ja b ovat kokonaislukuja, joiden arvot eivät ole suurempia kuin 3. Tähän osaan sinulle annetaan seuraavat vesiliuokset: 0,00200 M rauta(iii)liuos (tehty jo valmiiksi happamaksi) (80 ml) 0,00200 M kaliumtiosyanaattiliuos (80 ml) Sinulla on myös koeputket (varustettuna korkeilla, jotka voit pestä ja kuivata), mittapipettejä, spektrofotometrin kyvetti, kolorimetri (pyynnöstä) sekä kaikki muu paikallasi oleva laboratoriotavara, jonka ajattelet olevan hyödyksi. 1. Täytä seuraavan taulukon kaksi ensimmäistä riviä sellaisilla tilavuusarvoilla, joiden avulla pystyt määrittämään kompleksin stoikiometrian spektrofotometrisillä mittauksilla. Sinun ei tarvitse täyttää kaikkia sarakkeita. Laske kolmannelle riville rauta(iii):n mooliosuus jokaisessa koeputkessa käyttäen seuraavaa yhtälöä. V 89(:::) x(fe 45 ) = V 89(:::) + V <=>? Koeputki # ,00200 M rauta(iii)liuoksen tilavuus VFe(III) / ml 0,00200 M kaliumsyanaattiliuoksen tilavuus VSCN / ml Rauta(III):n mooliosuus x(fe 3+ ) Absorbanssi (470 nm:ssä) Kolorimetrin koodi 2. Valmistele koeputket. Kun kaikki koeputket ovat valmiit, nosta HELPkorttisi saadaksesi kolorimetrin laboratorioassistentilta. 3. Valmistele kolorimetri kuten edellä (sivu 16). Aseta aallonpituus 470 nm:iin. Käytä kolorimetrin nollaukseen ionivaihdettua vettä. 4. Määritä jokaisen koeputken absorbanssi tällä aallonpituudella. Kirjoita tulokset edelliseen taulukkoon. 51st IChO Practical Exam 20
21 Kysymykset 4. Piirrä kuvaaja koeputkien absorbansseista A rauta(iii):n mooliosuuden x(fe 3+ ) funktiona. 5. Määritä [(Fe)a(SCN)b] (3a b)+ kompleksin stoikiometria tekemiesi kokeiden tulosten perusteella. a = b = 51st IChO Practical Exam 21
22 Tehtävä P3 13% kokonaispistemäärästä Kysymys Titraus Titraus Titraus I II III P3.1 P3.2 P3.3 P3.4 P3.5 Yhteensä Pisteitä Saadut pisteet Tehtävä P3. Viiniä säilytettäväksi Rikkidioksidia, SO 2, käytetään viineissä säilöntäaineena. Kun SO 2:a lisätään viiniin, se voi reagoida veden kanssa bisulfiittiioneiksi, HSO 3, ja protoneiksi, H +. Bisulfiitti voi edelleen muuttua toisen protonin irtoamisella sulfiitiksi, SO 3 2. SO 2 + H 2O = H + + HSO 3 HSO 3 = H + + SO 3 2 Rikkidioksidin nämä kolme eri muotoa vedessä voivat reagoida viinien kemikaalien kuten asetaldehydin, pigmenttien, sokereiden jne. kanssa muodostaen tuotteita P. Rikkidioksidin kokonaiskonsentraatio on "vapaiden" muotojen (SO 2, HSO 3 ja SO 3 2 ) ja P:n konsentraatioiden summa. Säilöntäainekonsentraatio on säännelty, koska sulfiitti ja rikkidioksidi voivat olla haitallisia joillekin ihmisille. EU:ssa suurin sallittu rikkidioksidipitoisuus on punaviineissä 100 mg/l ja valko ja roséviineissä 150 ml/l. Tehtäväsi on määrittää annetun valkoviinin kokonaisrikkidioksidikonsentraatio jodometrisellä titrauksella. Työn suoritus I. Natriumtiosulfaattiliuoksen standardointi 1. Sinulle on annettu noin 100 mg näyte puhdasta kaliumjodaattia, KIO3. Tarkka massa lukee vialin etiketissä. Kirjoita massa alla olevaan taulukkoon. 2. Valmista 100 ml kaliumjodaattiliuosta 100 ml:n mittapulloon käyttäen kiinteä kaliumjodaattinäyte kokonaan ja ionivaihdettua vettä. Tätä liuosta merkitään S. 3. Lisää 100 ml erlenmeyerkolviin: täyspipetillä 20 ml liuosta S; 5 ml:n mittalasilla 5 ml kaliumjodidiliuosta (0,5 M); 10 ml:n mittalasilla 10 ml rikkihappoliuosta (2,5 M). 4. Sekoita erlenmeyerkolvia, peitä se parafilmillä ja pidä sitä kaapissa ainakin viisi minuuttia. 5. Täytä byretti natriumtiosulfaattiliuoksella dekantterilasia käyttäen. Titraa erlenmeyerkolvin sisältö jatkuvasti sekoittaen. Kun liuos on muuttunut vaaleankeltaiseksi, lisää kymmenen pisaraa tärkkelysliuosta ja jatka titrausta, kunnes liuos muuttuu värittömäksi. Kirjoita kulutus V1 alla olevaan taulukkoon. 6. Toista vaiheita 35 tarpeen mukaan. 51st IChO Practical Exam 22
23 Kaliumjodaatin massa (kirjoita tähän vialissa lukeva arvo) Analyysinumero V1 / ml Laskuissa käytettävä arvo V1 / ml II. Jodiliuoksen standardointi 1. Siirrä täyspipetillä 25 ml jodiliuosta (merkitty "I2") 100 ml erlenmeyerkolviin. 2. Titraa erlenmeyerkolvin sisältö natriumtiosulfaattiliuoksella. Kun liuos on muuttunut vaaleankeltaiseksi, lisää kymmenen pisaraa tärkkelysliuosta ja jatka titrausta, kunnes liuos muuttuu värittömäksi. Kirjoita kulutus V2 alla olevaan taulukkoon. 3. Toista vaiheita 12 tarpeen mukaan. Analyysi numero V2 / ml Laskuissa käytettävä arvo V2 / ml 51st IChO Practical Exam 23
24 III. Kokonaisrikkidioksidin määritys 1. Siirrä täyspipetillä 50 ml viiniä 250 ml erlenmeyerkolviin. 2. Lisää 25 ml:n mittalasilla 12 ml natriumhydroksidiliuosta (1 M). Peitä kolvi parafilmillä, sekoita sisältöä hetki ja anna kolvin sitten seistä ainakin 20 minuuttia. 3. Lisää muovisilla kertakäyttömittapipeteillä 5 ml rikkihappoliuosta (2,5 M) ja noin 2 ml tärkkelysliuosta. 4. Titraa erlenmeyerkolvin sisältö byretissä olevalla jodiliuoksella, kunnes tumma väri ilmestyy ja säilyy ainakin 15 sekuntia. Kirjoita kulutus V3 alla olevaan taulukkoon. 5. Toista vaiheita 14 tarpeen mukaan. Analyysinumero V3 / ml Laskuissa käytettävä arvo V3 / ml 51st IChO Practical Exam 24
25 Kysymykset 1. Laadi ja tasapainota kaikkien natriumtiosulfaattiliuoksen standardoinnissa tapahtuvien reaktioiden reaktioyhtälöt. 2. Laske natriumtiosulfaattiliuoksen molaarinen konsentraatio. Kaliumjodaatin moolimassa on M(KIO3) = 214,0 g/mol. c(s2o3 2 ) = mol/l Ellet osannut laskea c(s2o3 2 ):a, voit käyttää seuraavissa kohdissa arvoa c(s2o3 2 ) = 0,0500 mol/l 51st IChO Practical Exam 25
26 3. Laske jodiliuoksen molaarinen konsentraatio. c(i2) = mol/l Ellet osannut laskea c(i2):a, voit käyttää seuraavissa kohdissa arvoa c(i2) = 0,00700 mol/l. 4. Kirjoita jodin I2 ja rikkidioksidin SO2 välisen reaktion reaktioyhtälö olettaen että rikkidioksidi hapettuu sulfaattiioniksi SO st IChO Practical Exam 26
27 5. Laske rikkidioksidin kokonaismassakonsentraatio viinissä (mg per litra). Rikkidioksidin moolimassa on M(SO2) = 64,1 g/mol. cm(so2) = mg/l 51st IChO Practical Exam 27
28 ANNETUT VÄLINEET JA REAGENSSIT Vahingon numero Kilpailijan allekirjoitus Laboratorioassistentin allekirjoitus 1 (ei rangaistusta) st IChO Practical Exam 28
Määräys STUK SY/1/ (34)
 Määräys SY/1/2018 4 (34) LIITE 1 Taulukko 1. Vapaarajat ja vapauttamisrajat, joita voidaan soveltaa kiinteiden materiaalien vapauttamiseen määrästä riippumatta. Osa1. Keinotekoiset radionuklidit Radionuklidi
Määräys SY/1/2018 4 (34) LIITE 1 Taulukko 1. Vapaarajat ja vapauttamisrajat, joita voidaan soveltaa kiinteiden materiaalien vapauttamiseen määrästä riippumatta. Osa1. Keinotekoiset radionuklidit Radionuklidi
Säteilyturvakeskuksen määräys turvallisuusluvasta ja valvonnasta vapauttamisesta
 1 (33) LUONNOS 2 -MÄÄRÄYS STUK SY/1/2017 Säteilyturvakeskuksen määräys turvallisuusluvasta ja valvonnasta vapauttamisesta Säteilyturvakeskuksen päätöksen mukaisesti määrätään säteilylain ( / ) 49 :n 3
1 (33) LUONNOS 2 -MÄÄRÄYS STUK SY/1/2017 Säteilyturvakeskuksen määräys turvallisuusluvasta ja valvonnasta vapauttamisesta Säteilyturvakeskuksen päätöksen mukaisesti määrätään säteilylain ( / ) 49 :n 3
Kemiaa tekemällä välineitä ja työmenetelmiä
 Opiskelijalle 1/4 Kemiaa tekemällä välineitä ja työmenetelmiä Ennen työn aloittamista huomioi seuraavaa Tarkista, että sinulla on kaikki tarvittavat aineet ja välineet. Kirjaa tulokset oikealla tarkkuudella
Opiskelijalle 1/4 Kemiaa tekemällä välineitä ja työmenetelmiä Ennen työn aloittamista huomioi seuraavaa Tarkista, että sinulla on kaikki tarvittavat aineet ja välineet. Kirjaa tulokset oikealla tarkkuudella
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
50 th IChO 2018 KOKEELLISET TEHTÄVÄT BACK TO WHERE IT ALL BEGAN. 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC
 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu KOKEELLISET TEHTÄVÄT Maa: Suomi Nimi kuten passissa: Kilpailijatunnus: Kieli: Suomi 50 th IChO 2018 International Chemistry
19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu KOKEELLISET TEHTÄVÄT Maa: Suomi Nimi kuten passissa: Kilpailijatunnus: Kieli: Suomi 50 th IChO 2018 International Chemistry
AMMATTIKORKEAKOULUJEN TEKNIIKAN JA LIIKENTEEN VALINTAKOE
 TEHTÄVÄOSA 4..005 AMMATTKORKEAKOULUJEN TEKNKAN JA LKENTEEN VALNTAKOE YLESOHJETA Tehtävien suoritusaika on h 45 min. Osio (Tekstin ymmärtäminen) Osiossa on valintatehtävää. Tämän osion maksimipistemäärä
TEHTÄVÄOSA 4..005 AMMATTKORKEAKOULUJEN TEKNKAN JA LKENTEEN VALNTAKOE YLESOHJETA Tehtävien suoritusaika on h 45 min. Osio (Tekstin ymmärtäminen) Osiossa on valintatehtävää. Tämän osion maksimipistemäärä
LÄÄKETEHTAAN UUMENISSA
 LÄÄKETEHTAAN UUMENISSA KOHDERYHMÄ: Soveltuu lukion KE1- ja KE3-kurssille. KESTO: n. 1h MOTIVAATIO: Työskentelet lääketehtaan laadunvalvontalaboratoriossa. Tuotantolinjalta on juuri valmistunut erä aspiriinivalmistetta.
LÄÄKETEHTAAN UUMENISSA KOHDERYHMÄ: Soveltuu lukion KE1- ja KE3-kurssille. KESTO: n. 1h MOTIVAATIO: Työskentelet lääketehtaan laadunvalvontalaboratoriossa. Tuotantolinjalta on juuri valmistunut erä aspiriinivalmistetta.
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
FOSFORIPITOISUUS PESUAINEESSA
 FOSFORIPITOISUUS PESUAINEESSA TAUSTAA Pehmeä vesi on hyvän pesutuloksen edellytys. Tavallisissa pesupulvereissa fosfori esiintyy polyfosfaattina, joka suhteellisen nopeasti hydrolisoituu vedessä ortofosfaatiksi.
FOSFORIPITOISUUS PESUAINEESSA TAUSTAA Pehmeä vesi on hyvän pesutuloksen edellytys. Tavallisissa pesupulvereissa fosfori esiintyy polyfosfaattina, joka suhteellisen nopeasti hydrolisoituu vedessä ortofosfaatiksi.
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Kokeellinen osa. "Bonding the World with Chemistry" 49 th INTERNATIONAL CHEMISTRY OLYMPIAD Nakhon Pathom, Thaimaa
 Kokeellinen osa "Bonding the World with Chemistry" 49 th INTERNATIONAL CHEMISTRY OLYMPIAD Nakhon Pathom, Thaimaa Kokeellinen osa (suomenkielinen käännös), 49. IChO 2017, Thaimaa 1 Yleiset ohjeet. o Sivut:
Kokeellinen osa "Bonding the World with Chemistry" 49 th INTERNATIONAL CHEMISTRY OLYMPIAD Nakhon Pathom, Thaimaa Kokeellinen osa (suomenkielinen käännös), 49. IChO 2017, Thaimaa 1 Yleiset ohjeet. o Sivut:
ROMUMETALLIA OSTAMASSA (OSA 1)
 ROMUMETALLIA OSTAMASSA (OSA 1) Johdanto Kupari on metalli, jota käytetään esimerkiksi sähköjohtojen, tietokoneiden ja putkiston valmistamisessa. Korkean kysynnän vuoksi kupari on melko kallista. Kuparipitoisen
ROMUMETALLIA OSTAMASSA (OSA 1) Johdanto Kupari on metalli, jota käytetään esimerkiksi sähköjohtojen, tietokoneiden ja putkiston valmistamisessa. Korkean kysynnän vuoksi kupari on melko kallista. Kuparipitoisen
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
KALIUMPERMANGANAATIN KULUTUS
 sivu 1/6 Kohderyhmä: Työ on suunniteltu lukiolaisille Aika: n. 1h + laskut KALIUMPERMANGANAATIN KULUTUS TAUSTATIEDOT tarkoitaa veden sisältämien kemiallisesti hapettuvien orgaanisten aineiden määrää. Koeolosuhteissa
sivu 1/6 Kohderyhmä: Työ on suunniteltu lukiolaisille Aika: n. 1h + laskut KALIUMPERMANGANAATIN KULUTUS TAUSTATIEDOT tarkoitaa veden sisältämien kemiallisesti hapettuvien orgaanisten aineiden määrää. Koeolosuhteissa
Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 11.6. 2014 klo 10-13
 1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 11.6. 2014 klo 10-13 Yleiset ohjeet 1. Tarkasta, että tehtäväpaperinipussa ovat kaikki sivut 1-11 2. Kirjoita nimesi ja syntymäaikasi
1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 11.6. 2014 klo 10-13 Yleiset ohjeet 1. Tarkasta, että tehtäväpaperinipussa ovat kaikki sivut 1-11 2. Kirjoita nimesi ja syntymäaikasi
TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU
 Oulun Seudun Ammattiopisto Raportti Page 1 of 6 Turkka Sunnari & Janika Pietilä 23.1.2016 TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU PERIAATE/MENETELMÄ Työssä valmistetaan
Oulun Seudun Ammattiopisto Raportti Page 1 of 6 Turkka Sunnari & Janika Pietilä 23.1.2016 TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU PERIAATE/MENETELMÄ Työssä valmistetaan
Syntymäaika: 2. Kirjoita nimesi ja syntymäaikasi kaikkiin sivuille 1 ja 3-11 merkittyihin kohtiin.
 1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 15.6. 2011 klo 9-12 Nimi: Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-12. 2. Kirjoita nimesi
1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 15.6. 2011 klo 9-12 Nimi: Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-12. 2. Kirjoita nimesi
Vinkkejä opettajille ja odotetut tulokset SIVU 1
 Vinkkejä opettajille ja odotetut tulokset SIVU 1 Konteksti palautetaan oppilaiden mieliin käymällä Osan 1 johdanto uudelleen läpi. Kysymysten 1 ja 2 tarkoituksena on arvioida ovatko oppilaat ymmärtäneet
Vinkkejä opettajille ja odotetut tulokset SIVU 1 Konteksti palautetaan oppilaiden mieliin käymällä Osan 1 johdanto uudelleen läpi. Kysymysten 1 ja 2 tarkoituksena on arvioida ovatko oppilaat ymmärtäneet
Spektrofotometria ja spektroskopia
 11 KÄYTÄNNÖN ESIMERKKEJÄ INSTRUMENTTIANALYTIIKASTA Lisätehtävät Spektrofotometria ja spektroskopia Esimerkki 1. Mikä on transmittanssi T ja transmittanssiprosentti %T, kun absorbanssi A on 0, 1 ja 2. josta
11 KÄYTÄNNÖN ESIMERKKEJÄ INSTRUMENTTIANALYTIIKASTA Lisätehtävät Spektrofotometria ja spektroskopia Esimerkki 1. Mikä on transmittanssi T ja transmittanssiprosentti %T, kun absorbanssi A on 0, 1 ja 2. josta
FOSFORIPITOISUUS PESUAINEESSA
 FOSFORIPITOISUUS PESUAINEESSA KOHDERYHMÄ: Työ soveltuu yläkouluun kurssille elollinen luonto ja yhteiskunta. Lukiossa työ soveltuu parhaiten kurssille KE4. KESTO: Työ kestää n.1-2h MOTIVAATIO: Vaatteita
FOSFORIPITOISUUS PESUAINEESSA KOHDERYHMÄ: Työ soveltuu yläkouluun kurssille elollinen luonto ja yhteiskunta. Lukiossa työ soveltuu parhaiten kurssille KE4. KESTO: Työ kestää n.1-2h MOTIVAATIO: Vaatteita
1 Tehtävät. 2 Teoria. rauta(ii)ioneiksi ja rauta(ii)ionien hapettaminen kaliumpermanganaattiliuoksella.
 1 Tehtävät Edellisellä työkerralla oli valmistettu rauta(ii)oksalaattia epäorgaanisen synteesin avulla. Tätä sakkaa tarkasteltiin seuraavalla kerralla. Tällä työ kerralla ensin valmistettiin kaliumpermanganaatti-
1 Tehtävät Edellisellä työkerralla oli valmistettu rauta(ii)oksalaattia epäorgaanisen synteesin avulla. Tätä sakkaa tarkasteltiin seuraavalla kerralla. Tällä työ kerralla ensin valmistettiin kaliumpermanganaatti-
SIPSEISSÄKÖ RASVAA? KOKEELLINEN TYÖ: PERUNALASTUJA VAI JUUSTONAKSUJA? Tämän työn tavoite on vertailla eri sipsilaatuja ja erottaa sipsistä rasva.
 SIPSEISSÄKÖ RASVAA? TAUSTAA Saamme rasvaa joka päivä ja monissa muodoissa. Osa rasvasta on välttämätöntä, koska elimistömme tarvitsee rasvaa elintoimintojemme ylläpitoon. Saamme hyvin paljon rasvaa piilossa
SIPSEISSÄKÖ RASVAA? TAUSTAA Saamme rasvaa joka päivä ja monissa muodoissa. Osa rasvasta on välttämätöntä, koska elimistömme tarvitsee rasvaa elintoimintojemme ylläpitoon. Saamme hyvin paljon rasvaa piilossa
Liitetaulukko 1/11. Tutkittujen materiaalien kokonaispitoisuudet KOTIMAINEN MB-JÄTE <1MM SAKSAN MB- JÄTE <1MM POHJAKUONA <10MM
 Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
MAIDON PROTEIININ MÄÄRÄN SELVITTÄMINEN (OSA 1)
 MAIDON PROTEIININ MÄÄRÄN SELVITTÄMINEN (OSA 1) Johdanto Maito on tärkeä eläinproteiinin lähde monille ihmisille. Maidon laatu ja sen sisältämät proteiinit riippuvat useista tekijöistä ja esimerkiksi meijereiden
MAIDON PROTEIININ MÄÄRÄN SELVITTÄMINEN (OSA 1) Johdanto Maito on tärkeä eläinproteiinin lähde monille ihmisille. Maidon laatu ja sen sisältämät proteiinit riippuvat useista tekijöistä ja esimerkiksi meijereiden
Päähaku, kemian kandiohjelma Valintakoe klo
 Päähaku, kemian kandiohjelma Valintakoe 10.5.2019 klo 10.00 13.00 Kirjoita henkilö- ja yhteystietosi tekstaamalla. Kirjoita nimesi latinalaisilla kirjaimilla (abcd...), älä esimerkiksi kyrillisillä kirjaimilla
Päähaku, kemian kandiohjelma Valintakoe 10.5.2019 klo 10.00 13.00 Kirjoita henkilö- ja yhteystietosi tekstaamalla. Kirjoita nimesi latinalaisilla kirjaimilla (abcd...), älä esimerkiksi kyrillisillä kirjaimilla
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Rasvattoman maidon laktoosipitoisuuden määritys entsymaattisesti
 Rasvattoman maidon laktoosipitoisuuden määritys entsymaattisesti 1. Työn periaate Esikäsitellyn näyteliuoksen sisältämä laktoosi hajotetaan (hydrolysoidaan) entsymaattisesti D-glukoosiksi ja D-galaktoosiksi
Rasvattoman maidon laktoosipitoisuuden määritys entsymaattisesti 1. Työn periaate Esikäsitellyn näyteliuoksen sisältämä laktoosi hajotetaan (hydrolysoidaan) entsymaattisesti D-glukoosiksi ja D-galaktoosiksi
TKK, TTY, LTY, OY, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 31.5.2006
 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta.
 Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
5 LIUOKSEN PITOISUUS Lisätehtävät
 LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
ENNAKKOTEHTÄVIÄ Mitkä ruoka-aineet sisältävät valkuaisaineita eli proteiineja? Missä yhteyksissä olet törmännyt sanaan proteiini tai valkuaisaine?
 TÄS ON PROTSKUU! TAUSTAA Proteiinit kuuluvat perusravintoaineisiin ja nautit päivittäin niitä sisältäviä ruokia. Mitkä ruoka-aineet sisältävät proteiineja ja mihin niitä oikein tarvitaan? ENNAKKOTEHTÄVIÄ
TÄS ON PROTSKUU! TAUSTAA Proteiinit kuuluvat perusravintoaineisiin ja nautit päivittäin niitä sisältäviä ruokia. Mitkä ruoka-aineet sisältävät proteiineja ja mihin niitä oikein tarvitaan? ENNAKKOTEHTÄVIÄ
Kemian opetuksen keskus Helsingin yliopisto Veden kovuus Oppilaan ohje. Veden kovuus
 Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
Liuenneen silikaatin spektrofotometrinen määritys
 Liuenneen silikaatin spektrofotometrinen määritys 1. Työn periaate Liuenneen silikaatin määritys perustuu keltaisen silikomolybdeenihapon muodostumiseen. Keltainen kompleksi pelkistetään oksaalihapolla
Liuenneen silikaatin spektrofotometrinen määritys 1. Työn periaate Liuenneen silikaatin määritys perustuu keltaisen silikomolybdeenihapon muodostumiseen. Keltainen kompleksi pelkistetään oksaalihapolla
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Eksimeerin muodostuminen
 Fysikaalisen kemian Syventävät-laboratoriotyöt Eksimeerin muodostuminen 02-2010 Työn suoritus Valmista pyreenistä C 16 H 10 (molekyylimassa M = 202,25 g/mol) 1*10-2 M liuos metyylisykloheksaaniin.
Fysikaalisen kemian Syventävät-laboratoriotyöt Eksimeerin muodostuminen 02-2010 Työn suoritus Valmista pyreenistä C 16 H 10 (molekyylimassa M = 202,25 g/mol) 1*10-2 M liuos metyylisykloheksaaniin.
TÄS ON PROTSKUU! PROTEIINIEN KEMIAA
 sivu 1/8 TÄS ON PROTSKUU! PROTEIINIEN KEMIAA LUOKKA-ASTE/KURSSI TAUSTA Työ soveltuu peruskoulun yläasteelle ja lukioon. Työn tavoite on tutustua proteiinien kokeellisiin tunnistusmenetelmiin. POHDITTAVAKSI
sivu 1/8 TÄS ON PROTSKUU! PROTEIINIEN KEMIAA LUOKKA-ASTE/KURSSI TAUSTA Työ soveltuu peruskoulun yläasteelle ja lukioon. Työn tavoite on tutustua proteiinien kokeellisiin tunnistusmenetelmiin. POHDITTAVAKSI
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA
 sivu 1/6 KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää myös yläkoululaisille, kunhan
sivu 1/6 KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää myös yläkoululaisille, kunhan
α-amylaasi α-amylaasin eristäminen syljestä ja spesifisen aktiivisuuden määritys. Johdanto Tärkkelys Oligosakkaridit Maltoosi + glukoosi
 n eristäminen syljestä ja spesifisen aktiivisuuden määritys. Johdanto Työssä eristetään ja puhdistetaan merkittävä ja laajalti käytetty teollisuusentsyymi syljestä. pilkkoo tärkkelystä ensin oligosakkarideiksi
n eristäminen syljestä ja spesifisen aktiivisuuden määritys. Johdanto Työssä eristetään ja puhdistetaan merkittävä ja laajalti käytetty teollisuusentsyymi syljestä. pilkkoo tärkkelystä ensin oligosakkarideiksi
Alumiinista alunaa TAUSTAA
 KOHDERYHMÄ: Työ soveltuu yläkouluun tai lukion kursseille KE3 ja KE4. Teorian laajuus riippuu siitä mille kohderyhmälle työ vedetään. KESTO: Noin 1-1,5h. Kesto riippuu siitä, tehdäänkö tuotteelle imusuodatus
KOHDERYHMÄ: Työ soveltuu yläkouluun tai lukion kursseille KE3 ja KE4. Teorian laajuus riippuu siitä mille kohderyhmälle työ vedetään. KESTO: Noin 1-1,5h. Kesto riippuu siitä, tehdäänkö tuotteelle imusuodatus
c) Tasapainota seuraava happamassa liuoksessa tapahtuva hapetus-pelkistysreaktio:
 HTKK, TTY, LTY, OY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 26.05.2004 1. a) Kun natriumfosfaatin (Na 3 PO 4 ) ja kalsiumkloridin (CaCl 2 ) vesiliuokset sekoitetaan keske- nään, muodostuu
HTKK, TTY, LTY, OY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 26.05.2004 1. a) Kun natriumfosfaatin (Na 3 PO 4 ) ja kalsiumkloridin (CaCl 2 ) vesiliuokset sekoitetaan keske- nään, muodostuu
SIPSEISSÄKÖ RASVAA? KOKEELLINEN TYÖ: PERUNALASTUJA VAI JUUSTONAKSUJA?
 SIPSEISSÄKÖ RASVAA? TAUSTAA Saamme rasvaa joka päivä ja monissa muodoissa. Osa rasvasta on välttämätöntä, koska elimistömme tarvitsee rasvaa elintoimintojemme ylläpitoon. Saamme hyvin paljon rasvaa piilossa
SIPSEISSÄKÖ RASVAA? TAUSTAA Saamme rasvaa joka päivä ja monissa muodoissa. Osa rasvasta on välttämätöntä, koska elimistömme tarvitsee rasvaa elintoimintojemme ylläpitoon. Saamme hyvin paljon rasvaa piilossa
TÄS ON PROTSKUU! Missä yhteyksissä olet törmännyt sanaan proteiini tai valkuaisaine?
 TÄS ON PROTSKUU! KOHDERYHMÄ: Työ soveltuu parhaiten yläkouluun kurssille elollinen luonto ja yhteiskunta, sekä lukioon kurssille KE1. KESTO: Työ koostuu kahdesta osasta: n. 30 min/osa. MOTIVAATIO: Mitä
TÄS ON PROTSKUU! KOHDERYHMÄ: Työ soveltuu parhaiten yläkouluun kurssille elollinen luonto ja yhteiskunta, sekä lukioon kurssille KE1. KESTO: Työ koostuu kahdesta osasta: n. 30 min/osa. MOTIVAATIO: Mitä
Syntymäaika. 2. Kirjoita nimesi ja syntymäaikasi kaikkiin sivuille 1 ja 4-14 merkittyihin kohtiin.
 1 Jyväskylän yliopiston kemian valintakoe Keskiviikkona 5.6.2019 klo 10-13 Yleiset ohjeet 1. Tarkasta, että tehtäväpaperinipussa on kaikki sivut 1-14. 2. Kirjoita nimesi ja syntymäaikasi kaikkiin sivuille
1 Jyväskylän yliopiston kemian valintakoe Keskiviikkona 5.6.2019 klo 10-13 Yleiset ohjeet 1. Tarkasta, että tehtäväpaperinipussa on kaikki sivut 1-14. 2. Kirjoita nimesi ja syntymäaikasi kaikkiin sivuille
Helsingin, Jyväskylän, Oulun ja Turun yliopistojen kemian valintakoe Tiistaina 25.5. 2010 klo 9-12
 1 Helsingin, Jyväskylän, Oulun ja Turun yliopistojen kemian valintakoe Tiistaina 25.5. 2010 klo 9-12 Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-13. 2. Kirjoita nimesi ja
1 Helsingin, Jyväskylän, Oulun ja Turun yliopistojen kemian valintakoe Tiistaina 25.5. 2010 klo 9-12 Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-13. 2. Kirjoita nimesi ja
ENERGIAA TÄRKKELYKSESTÄ! NELJÄ TUTKIMUSTA
 sivu 1/8 ENERGIAA TÄRKKELYKSESTÄ! NELJÄ TUTKIMUSTA TAUSTA Nautit päivittäin tärkkelystä sisältäviä ruoka-aineita. Oletko koskaan pohtinut mitä tärkkelykselle tapahtuu elimistössäsi? Mitkä ruoka-aineet
sivu 1/8 ENERGIAA TÄRKKELYKSESTÄ! NELJÄ TUTKIMUSTA TAUSTA Nautit päivittäin tärkkelystä sisältäviä ruoka-aineita. Oletko koskaan pohtinut mitä tärkkelykselle tapahtuu elimistössäsi? Mitkä ruoka-aineet
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Limsan sokeripitoisuus
 KOHDERYHMÄ: Työn kohderyhmänä ovat lukiolaiset ja työ sopii tehtäväksi esimerkiksi työkurssilla tai kurssilla KE1. KESTO: N. 45 60 min. Työn kesto riippuu ryhmän koosta. MOTIVAATIO: Sinun tehtäväsi on
KOHDERYHMÄ: Työn kohderyhmänä ovat lukiolaiset ja työ sopii tehtäväksi esimerkiksi työkurssilla tai kurssilla KE1. KESTO: N. 45 60 min. Työn kesto riippuu ryhmän koosta. MOTIVAATIO: Sinun tehtäväsi on
b) Laske prosentteina, paljonko sydämen keskimääräinen teho muuttuu suhteessa tilanteeseen ennen saunomista. Käytä laskussa SI-yksiköitä.
 Lääketieteellisten alojen valintakokeen 009 esimerkkitehtäviä Tehtävä 4 8 pistettä Aineistossa mainitussa tutkimuksessa mukana olleilla suomalaisilla aikuisilla sydämen keskimääräinen minuuttitilavuus
Lääketieteellisten alojen valintakokeen 009 esimerkkitehtäviä Tehtävä 4 8 pistettä Aineistossa mainitussa tutkimuksessa mukana olleilla suomalaisilla aikuisilla sydämen keskimääräinen minuuttitilavuus
17VV VV 01021
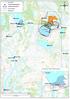 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
sulfatiatsoli meripihkahappoanhydridi eli dihydro-2,5- furaanidioni etanoli (EtaxA, 99 %)
 ANTIBIOOTTISYNTEESI TAUSTAA Olet kesätöissä lääketehtaalla. Lääkefirman kemistit ovat kehittäneet antibiootin, sulfiatsolin, joka estää bakteerien foolihapon synteesiä. Foolihappoa tarvitaan esimerkiksi
ANTIBIOOTTISYNTEESI TAUSTAA Olet kesätöissä lääketehtaalla. Lääkefirman kemistit ovat kehittäneet antibiootin, sulfiatsolin, joka estää bakteerien foolihapon synteesiä. Foolihappoa tarvitaan esimerkiksi
KOHDERYHMÄ KESTO: MOTIVAATIO: TAVOITE: AVAINSANAT: - TAUSTAA
 ANTIBIOOTTISYNTEESI KOHDERYHMÄ: Työ soveltuu ensisijaisesti lukiolaisille. Lukiossa työn voi toteuttaa kurssilla KE3 tai työkurssilla. KESTO: Työ kestää 90 min (refluksointi 60min) (120 min tislauksen
ANTIBIOOTTISYNTEESI KOHDERYHMÄ: Työ soveltuu ensisijaisesti lukiolaisille. Lukiossa työn voi toteuttaa kurssilla KE3 tai työkurssilla. KESTO: Työ kestää 90 min (refluksointi 60min) (120 min tislauksen
ENERGIAA! ASTE/KURSSI AIKA 1/5
 1/5 ASTE/KURSSI Yläasteelle ja lukioon elintarvikkeiden kemian yhteydessä. Sopii myös alaasteryhmille opettajan avustaessa poltossa, sekä laskuissa. AIKA n. ½ tuntia ENERGIAA! Vertaa vaahtokarkin ja cashewpähkinän
1/5 ASTE/KURSSI Yläasteelle ja lukioon elintarvikkeiden kemian yhteydessä. Sopii myös alaasteryhmille opettajan avustaessa poltossa, sekä laskuissa. AIKA n. ½ tuntia ENERGIAA! Vertaa vaahtokarkin ja cashewpähkinän
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA
 SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää
ENERGIAA TÄRKKELYKSESTÄ
 ENERGIAA TÄRKKELYKSESTÄ TAUSTA Nautit päivittäin tärkkelystä sisältäviä ruoka-aineita. Oletko koskaan pohtinut mitä tärkkelykselle tapahtuu elimistössäsi? Mitkä ruoka-aineet sisältävät tärkkelystä ja kuinka
ENERGIAA TÄRKKELYKSESTÄ TAUSTA Nautit päivittäin tärkkelystä sisältäviä ruoka-aineita. Oletko koskaan pohtinut mitä tärkkelykselle tapahtuu elimistössäsi? Mitkä ruoka-aineet sisältävät tärkkelystä ja kuinka
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
Ohjeita opettajille ja odotetut tulokset
 Ohjeita opettajille ja odotetut tulokset SIVU 1 Aktiviteetti alkaa toimintaan johdattelulla. Tarkoituksena on luoda konteksti oppilaiden tutkimukselle ja tutkimusta ohjaavalle kysymykselle (Boldattuna
Ohjeita opettajille ja odotetut tulokset SIVU 1 Aktiviteetti alkaa toimintaan johdattelulla. Tarkoituksena on luoda konteksti oppilaiden tutkimukselle ja tutkimusta ohjaavalle kysymykselle (Boldattuna
Ohjeita opettamiseen ja odotettavissa olevat tulokset SIVU 1
 Ohjeita opettamiseen ja odotettavissa olevat tulokset SIVU 1 Toiminta aloitetaan johdattelulla. Tarkoituksena on rakentaa konteksti oppilaiden tutkimukselle ja kysymykselle (Boldattuna oppilaiden työohjeessa),
Ohjeita opettamiseen ja odotettavissa olevat tulokset SIVU 1 Toiminta aloitetaan johdattelulla. Tarkoituksena on rakentaa konteksti oppilaiden tutkimukselle ja kysymykselle (Boldattuna oppilaiden työohjeessa),
Helsingin, Jyväskylän, Oulun ja Turun yliopistojen kemian valintakoe tiistaina 26.5.2009 klo 9-12
 1 Helsingin, Jyväskylän, ulun ja Turun yliopistojen kemian valintakoe tiistaina 26.5.2009 klo 9-12 Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa on kaikki sivut 1-11. 2. Kirjoita nimesi ja syntymäaikasi
1 Helsingin, Jyväskylän, ulun ja Turun yliopistojen kemian valintakoe tiistaina 26.5.2009 klo 9-12 Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa on kaikki sivut 1-11. 2. Kirjoita nimesi ja syntymäaikasi
vetyteknologia Polttokennon tyhjäkäyntijännite 1 DEE-54020 Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
a) Piirrä hahmotelma varjostimelle muodostuvan diffraktiokuvion maksimeista 1, 2 ja 3.
 Ohjeita: Tee jokainen tehtävä siististi omalle sivulleen/sivuilleen. Merkitse jos tehtävä jatkuu seuraavalle konseptille. Kirjoita ratkaisuihin näkyviin tarvittavat välivaiheet ja perustele lyhyesti käyttämästi
Ohjeita: Tee jokainen tehtävä siististi omalle sivulleen/sivuilleen. Merkitse jos tehtävä jatkuu seuraavalle konseptille. Kirjoita ratkaisuihin näkyviin tarvittavat välivaiheet ja perustele lyhyesti käyttämästi
17VV VV Veden lämpötila 14,2 12,7 14,2 13,9 C Esikäsittely, suodatus (0,45 µm) ok ok ok ok L. ph 7,1 6,9 7,1 7,1 RA2000¹ L
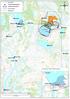 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
SÄTEILYN KÄYTÖN VAPAUTTAMINEN TURVALLISUUSLUVASTA
 OHJE ST 1.5 / 12.9.2013 SÄTEILYN KÄYTÖN VAPAUTTAMINEN TURVALLISUUSLUVASTA 1 Yleistä 3 2 Säteilyturvakeskuksen päätöksellä vapautettu säteilyn käyttö 3 2.1 Yleiset vaatimukset 3 2.2 Turvallisuusluvasta
OHJE ST 1.5 / 12.9.2013 SÄTEILYN KÄYTÖN VAPAUTTAMINEN TURVALLISUUSLUVASTA 1 Yleistä 3 2 Säteilyturvakeskuksen päätöksellä vapautettu säteilyn käyttö 3 2.1 Yleiset vaatimukset 3 2.2 Turvallisuusluvasta
Lukion kemia 3, Reaktiot ja energia. Leena Piiroinen Luento 2 2015
 Lukion kemia 3, Reaktiot ja energia Leena Piiroinen Luento 2 2015 Reaktioyhtälöön liittyviä laskuja 1. Reaktioyhtälön kertoimet ja tuotteiden määrä 2. Lähtöaineiden riittävyys 3. Reaktiosarjat 4. Seoslaskut
Lukion kemia 3, Reaktiot ja energia Leena Piiroinen Luento 2 2015 Reaktioyhtälöön liittyviä laskuja 1. Reaktioyhtälön kertoimet ja tuotteiden määrä 2. Lähtöaineiden riittävyys 3. Reaktiosarjat 4. Seoslaskut
joka voidaan määrittää esim. värinmuutosta seuraamalla tai lukemalla
 REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
 Raportti Sivu 1 (7) K1301600 2BQWOKQ8N98 Vahanen Oy Projekti TT 1099 Kyösti Nieminen Tilausnumero Sisäänkirjattu 2013-11-13 Linnoitustie 5 Raportoitu 2013-11-21 02600 ESPOO Materiaalin analysointi Asiakkaan
Raportti Sivu 1 (7) K1301600 2BQWOKQ8N98 Vahanen Oy Projekti TT 1099 Kyösti Nieminen Tilausnumero Sisäänkirjattu 2013-11-13 Linnoitustie 5 Raportoitu 2013-11-21 02600 ESPOO Materiaalin analysointi Asiakkaan
JAKSOLLINEN JÄRJESTELMÄ
 JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
2CHEM-A1210 Kemiallinen reaktio Kevät 2017 Laskuharjoitus 7.
 HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
Neutraloituminen = suolan muodostus
 REAKTIOT JA TASAPAINO, KE5 Neutraloituminen = suolan muodostus Taustaa: Tähän asti ollaan tarkasteltu happojen ja emästen vesiliuoksia erikseen, mutta nyt tarkastellaan mitä tapahtuu, kun happo ja emäs
REAKTIOT JA TASAPAINO, KE5 Neutraloituminen = suolan muodostus Taustaa: Tähän asti ollaan tarkasteltu happojen ja emästen vesiliuoksia erikseen, mutta nyt tarkastellaan mitä tapahtuu, kun happo ja emäs
ICP-OES JA ICP-MS TEKNIIKAT PIENTEN METALLIPITOISUUKSIEN MÄÄRITYKSESSÄ. Matti Niemelä, Oulun yliopisto, kemian laitos
 ICP-OES JA ICP-MS TEKNIIKAT PIENTEN METALLIPITOISUUKSIEN MÄÄRITYKSESSÄ Matti Niemelä, Oulun yliopisto, kemian laitos Oulun yliopisto - Kemian laitos Laitoksen tiedealat Epäorgaaninen kemia Fysikaalinen
ICP-OES JA ICP-MS TEKNIIKAT PIENTEN METALLIPITOISUUKSIEN MÄÄRITYKSESSÄ Matti Niemelä, Oulun yliopisto, kemian laitos Oulun yliopisto - Kemian laitos Laitoksen tiedealat Epäorgaaninen kemia Fysikaalinen
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA
 SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA Työskentelet metallinkierrätyslaitoksella. Asiakas tuo kierrätyslaitokselle 1200 kilogramman erän kellertävää metallimateriaalia, joka on löytynyt purettavasta
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA Työskentelet metallinkierrätyslaitoksella. Asiakas tuo kierrätyslaitokselle 1200 kilogramman erän kellertävää metallimateriaalia, joka on löytynyt purettavasta
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
Tekniikan valintakokeen laskutehtävät (osio 3): Vastaa kukin tehtävä erilliselle vastauspaperille vastaukselle varattuun kohtaan
 Tekniikan valintakokeen laskutehtävät (osio 3): Vastaa kukin tehtävä erilliselle vastauspaperille vastaukselle varattuun kohtaan 1. Kolmiossa yksi kulma on 60 ja tämän viereisten sivujen suhde 1 : 3. Laske
Tekniikan valintakokeen laskutehtävät (osio 3): Vastaa kukin tehtävä erilliselle vastauspaperille vastaukselle varattuun kohtaan 1. Kolmiossa yksi kulma on 60 ja tämän viereisten sivujen suhde 1 : 3. Laske
Mark Summary. Taitaja2015. Skill Number 604 Skill Laborantti. Competitor Name
 Summary Skill Number 604 Skill Laborantti ing Scheme Lock 04-05-2015 16:18:54 Final Lock 07-05-2015 13:26:03 Criterion Criterion Description s Day 1 Day 2 Day 3 Day 4 Total Award A Elintarvikeanalytiikka
Summary Skill Number 604 Skill Laborantti ing Scheme Lock 04-05-2015 16:18:54 Final Lock 07-05-2015 13:26:03 Criterion Criterion Description s Day 1 Day 2 Day 3 Day 4 Total Award A Elintarvikeanalytiikka
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Lyhyt käyttöohje Cafitesse 400
 Lyhyt käyttöohje Cafitesse 400 stop BREWING heißes wasser B-2264 empty low temperature empty Käyttöohje Cafitesse 400 - LED-merkkivalot LED (vihreä) LED (keltainen) LED (punainen) LED (punainen) stop BREWING
Lyhyt käyttöohje Cafitesse 400 stop BREWING heißes wasser B-2264 empty low temperature empty Käyttöohje Cafitesse 400 - LED-merkkivalot LED (vihreä) LED (keltainen) LED (punainen) LED (punainen) stop BREWING
Tehtävä 1 2 3 4 5 6 7 8 9 Pisteet yhteensä
 1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 12.6. 2013 klo 10-13 Yleiset ohjeet 1. Tarkasta, että tehtäväpaperinipussa ovat kaikki sivut 1-13 2. Kirjoita nimesi ja syntymäaikasi
1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 12.6. 2013 klo 10-13 Yleiset ohjeet 1. Tarkasta, että tehtäväpaperinipussa ovat kaikki sivut 1-13 2. Kirjoita nimesi ja syntymäaikasi
CHEM-A1200 kurssin laboratoriotöiden tulosten yhteenveto syksy 2016
 CHEM-A1200 kurssin laboratoriotöiden tulosten yhteenveto syksy 2016 Näyte Sundown Naturals Vaikuttava aine on kuivattu ferrosulfaatti FeSO 4. Valmistajan mukaan yksi tabletti sisältää 202 mg kuivaa ferrosulfaattia
CHEM-A1200 kurssin laboratoriotöiden tulosten yhteenveto syksy 2016 Näyte Sundown Naturals Vaikuttava aine on kuivattu ferrosulfaatti FeSO 4. Valmistajan mukaan yksi tabletti sisältää 202 mg kuivaa ferrosulfaattia
Osio 1. Laskutehtävät
 Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
0. perusmääritelmiä. Lukutyypit Laskusäännöt Laskujärjestys
 Lukutyypit Laskusäännöt Laskujärjestys 0. perusmääritelmiä Luonnolliset luvut (N): 1, 2, 3, 4 Kokonaisluvut (Z):... 4, 3, 2, 1, 0, 1, 2, 3, 4... RaFonaaliluvut (Q): kaikki luvut, jotka voidaan esihää kahden
Lukutyypit Laskusäännöt Laskujärjestys 0. perusmääritelmiä Luonnolliset luvut (N): 1, 2, 3, 4 Kokonaisluvut (Z):... 4, 3, 2, 1, 0, 1, 2, 3, 4... RaFonaaliluvut (Q): kaikki luvut, jotka voidaan esihää kahden
PULLEAT JA VALTAVAT VAAHTOKARKIT
 sivu 1/6 PULLEAT JA VALTAVAT VAAHTOKARKIT LUOKKA-ASTE/KURSSI Soveltuu ala-asteelle, mutta myös yläkouluun syvemmällä teoriataustalla. ARVIOTU AIKA n. 1 tunti TAUSTA Ilma on kaasua. Se on yksi kolmesta
sivu 1/6 PULLEAT JA VALTAVAT VAAHTOKARKIT LUOKKA-ASTE/KURSSI Soveltuu ala-asteelle, mutta myös yläkouluun syvemmällä teoriataustalla. ARVIOTU AIKA n. 1 tunti TAUSTA Ilma on kaasua. Se on yksi kolmesta
www.ruukki.com MINERAALI- TUOTTEET Kierrätys ja Mineraalituotteet
 www.ruukki.com MINERAALI- TUOTTEET Kierrätys ja Mineraalituotteet Masuunihiekka stabiloinnit (sideaineena) pehmeikkörakenteet sidekivien alusrakenteet putkijohtokaivannot salaojan ympärystäytöt alapohjan
www.ruukki.com MINERAALI- TUOTTEET Kierrätys ja Mineraalituotteet Masuunihiekka stabiloinnit (sideaineena) pehmeikkörakenteet sidekivien alusrakenteet putkijohtokaivannot salaojan ympärystäytöt alapohjan
Myös normaali sadevesi on hieman hapanta (ph n.5,6) johtuen ilman hiilidioksidista, joka liuetessaan veteen muodostaa hiilihappoa.
 sivu 1/5 Kohderyhmä: Aika: Työ sopii sekä yläasteelle, että lukion biologiaan ja kemiaan käsiteltäessä ympäristön happamoitumista. Lukion kemiassa aihetta voi myös käsitellä typen ja rikin oksideista puhuttaessa.
sivu 1/5 Kohderyhmä: Aika: Työ sopii sekä yläasteelle, että lukion biologiaan ja kemiaan käsiteltäessä ympäristön happamoitumista. Lukion kemiassa aihetta voi myös käsitellä typen ja rikin oksideista puhuttaessa.
MAALIEN KEMIAA, TUTKIMUKSELLISUUTTA YLÄKOULUUN JA TOISELLE ASTEELLE
 MAALIEN KEMIAA, TUTKIMUKSELLISUUTTA YLÄKOULUUN JA TOISELLE ASTEELLE Riitta Latvasto 1 & Päivi Riikonen 1 1 Kemian opettajankoulutusyksikkö, Helsingin yliopisto Aihe: Tässä laboratoriotyössä tutustutaan
MAALIEN KEMIAA, TUTKIMUKSELLISUUTTA YLÄKOULUUN JA TOISELLE ASTEELLE Riitta Latvasto 1 & Päivi Riikonen 1 1 Kemian opettajankoulutusyksikkö, Helsingin yliopisto Aihe: Tässä laboratoriotyössä tutustutaan
BIOMUOVIA TÄRKKELYKSESTÄ
 BIOMUOVIA TÄRKKELYKSESTÄ KOHDERYHMÄ: Soveltuu peruskoulun 9.luokan kemian osioon Orgaaninen kemia. KESTO: 45 60 min. Kemian opetuksen keskus MOTIVAATIO: Muovituotteet kerääntyvät helposti luontoon ja saastuttavat
BIOMUOVIA TÄRKKELYKSESTÄ KOHDERYHMÄ: Soveltuu peruskoulun 9.luokan kemian osioon Orgaaninen kemia. KESTO: 45 60 min. Kemian opetuksen keskus MOTIVAATIO: Muovituotteet kerääntyvät helposti luontoon ja saastuttavat
REAKTIOT JA ENERGIA, KE3. Kaasut
 Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Kaasut REAKTIOT JA ENERGIA, KE3 Kaasu on yksi aineen olomuodosta. Kaasujen käyttäytymistä kokeellisesti tutkimalla on päädytty yksinkertaiseen malliin, ns. ideaalikaasuun. Määritelmä: Ideaalikaasu on yksinkertainen
Juha Siitonen Jyväskylän yliopisto. Syntetiikan töitä
 Juha Siitonen Jyväskylän yliopisto Syntetiikan töitä Orgaanisen kemian työmenetelmistä Reuksointi Reuksointi käsittää reaktioseoksen keittämisen palautusjäähdyttimen alla niin, että höyrystyvät reagenssit
Juha Siitonen Jyväskylän yliopisto Syntetiikan töitä Orgaanisen kemian työmenetelmistä Reuksointi Reuksointi käsittää reaktioseoksen keittämisen palautusjäähdyttimen alla niin, että höyrystyvät reagenssit
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Oppikirjan tehtävien ratkaisut
 Oppikirjan tehtävien ratkaisut Liukoisuustulon käyttö 10. a) Selitä, mitä eroa on käsitteillä liukoisuus ja liukoisuustulo. b) Lyijy(II)bromidin PbBr liukoisuus on 1,0 10 mol/dm. Laske lyijy(ii)bromidin
Oppikirjan tehtävien ratkaisut Liukoisuustulon käyttö 10. a) Selitä, mitä eroa on käsitteillä liukoisuus ja liukoisuustulo. b) Lyijy(II)bromidin PbBr liukoisuus on 1,0 10 mol/dm. Laske lyijy(ii)bromidin
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt
 KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
KEMS448 Fysikaalisen kemian syventävät harjoitustyöt Jakaantumislaki 1 Teoriaa 1.1 Jakaantumiskerroin ja assosioituminen Kaksi toisiinsa sekoittumatonta nestettä ovat rajapintansa välityksellä kosketuksissa
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
0. perusmääritelmiä. Lukutyypit Laskusäännöt Laskujärjestys
 0. perusmääritelmiä Lukutyypit Laskusäännöt Laskujärjestys Luonnolliset luvut (N): 1, 2, 3, 4 Kokonaisluvut (Z):... 4, 3, 2, 1, 0, 1, 2, 3, 4... RaConaaliluvut (Q): kaikki luvut, jotka voidaan esieää kahden
0. perusmääritelmiä Lukutyypit Laskusäännöt Laskujärjestys Luonnolliset luvut (N): 1, 2, 3, 4 Kokonaisluvut (Z):... 4, 3, 2, 1, 0, 1, 2, 3, 4... RaConaaliluvut (Q): kaikki luvut, jotka voidaan esieää kahden
 Työn toteutus Lisää pullosta kolmeen koeputkeen 1 2 cm:n kerros suolahappoa. Pudota ensimmäiseen koeputkeen kuparinaula, toiseen sinkkirae ja kolmanteen magnesiumnauhan pala. Tulosten käsittely Mikä aine
Työn toteutus Lisää pullosta kolmeen koeputkeen 1 2 cm:n kerros suolahappoa. Pudota ensimmäiseen koeputkeen kuparinaula, toiseen sinkkirae ja kolmanteen magnesiumnauhan pala. Tulosten käsittely Mikä aine
Helsingin yliopisto/tampereen yliopisto Henkilötunnus - Biokemian/bioteknologian valintakoe Etunimet Tehtävä 5 Pisteet / 20
 Helsingin yliopisto/tampereen yliopisto Henkilötunnus - Biokemian/bioteknologian valintakoe Sukunimi 24.5.2006 Etunimet Tehtävä 5 Pisteet / 20 Glukoosidehydrogenaasientsyymi katalysoi glukoosin oksidaatiota
Helsingin yliopisto/tampereen yliopisto Henkilötunnus - Biokemian/bioteknologian valintakoe Sukunimi 24.5.2006 Etunimet Tehtävä 5 Pisteet / 20 Glukoosidehydrogenaasientsyymi katalysoi glukoosin oksidaatiota
KESKIPITKIÄ ANALYYSEJÄ
 KESKIPITKIÄ ANALYYSEJÄ versio 2 Jaakko Lohenoja 2009 Alkusanat Tähän tekstiin on koottu muutama useamman vaiheen sisältävä harjoitustyö, joiden suorittamiseen kuluu yli puoli tuntia. Harjoitustyöt ovat
KESKIPITKIÄ ANALYYSEJÄ versio 2 Jaakko Lohenoja 2009 Alkusanat Tähän tekstiin on koottu muutama useamman vaiheen sisältävä harjoitustyö, joiden suorittamiseen kuluu yli puoli tuntia. Harjoitustyöt ovat
