Luku 21. Kemiallisten reaktioiden nopeus
|
|
|
- Hilkka Korhonen
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Luku 21. Kemiallisten reaktioiden nopeus Reaktiokinetiikka tarkastelee reaktioiden nopeuksia (vrt. termodynamiikka) reaktionopeus = konsentraation muutos aikayksikössä Tarkastellaan yksinkertaista tasapainoreaktiota: 2HI (g) H 2 (g) + I 2 (g) jos on havaittu esim. että [HI (g)] pienenee 0.5 M ajassa t = 100 s HI:n hajoamisnopeus = H 2 :n muodostumisnopeus = 0.5 mol l /100s = 5x10 3 mol ls 2.5x10 3 mol ls 1
2 2
3 Kemiallisen reaktion nopeus ei ole vakio (1. poikkeus) ts. v = v(t) tämä johtuu konsentraatioiden muuttumisesta reaktion aikana Alkunopeus on suurin v 0 = v(t = 0) Hetkellinen nopeus (millä tahan ajanhetkellä) voidaan laskea reaktion nopeuslain avulla [ ] A + B C v A = d A ;häviämisnopeus v B = d [ B ] ;häviämisnopeus v C = d [ C ] ;muodostumisnopeus Koska ainetta ei häviä eikä synny: d [ A ] = d [ B ] = d C [ ] 3
4 A + 2B 3C + D d [ D] = 1 3 d [ C] = d [ A ] = 1 2 d [ B] Reaktionopeus yleisesti komponentille J: v = 1 d[ J] ν J ν J = J:n stoikio- metrinen kerroin reaktiossa Reaktionopeus riippuu reaktioon osallistuvien aineiden konsentraatioista, ts. v = f ([A],[B],...) Tätä riippuvuutta kuvataan reaktion kertaluvulla useimmille reaktioille on havaittu riippuvuus: v = k[ A] a [ B] b... k = reaktionopeusvakio a = reaktion kertaluku aineen A suhteen b= reaktion kertaluku aineen B suhteen a+b+... on reaktion kokonaiskertaluku 4
5 Huom! Reaktion kertaluku on kokeellisesti määritettävä suure eikä sitä voi päätellä reaktion stoikiometriasta!! Seuraavassa tarkastelemme erilaisten reaktioiden nopeuslakeja. Yksinkertaisin niistä on unimolekulaarinen reaktio: A B v = d [ A ] = d [ B ] Jos tälle reaktiolle on havaittu, että nopeus riippuu lineaarisesti [A]:sta v = d [ A ] = d [ B ] = k[ A] 5
6 Tarkastellaan lähtöaineen A häviämistä: [ ] [ A] = k d A [ ] [ A] d A " ln$ # = k [ A] % A ' = kt & [ ] 0 [A] t ln [A] = -k t [A] 0 0 [ A] = [ A] 0 e kt 1. kertaluvun reaktion nopeuslain integroitu muoto [A] pienenee eksponentiaalisesti. Eksponenttifunktion jyrkkyyden määrää reaktionopeusvakio k 6
7 7
8 Miten tuoteen B konsentraatio kasvaa 1. kertaluvun reaktiossa? Kaikilla ajanhetkillä t pätee: [B] = [A] 0 - [A] eli [A] = [A] 0 - [B] sijoitetaan: [ A] 0 [ B] = [ A] 0 e kt [ B] = [ A] 0 ( 1 e kt ) [B] Huomaa, että 1. kertaluvun reaktion nopeusvakion k yksikkö = 1/s eikä siinä esiinny konsentraatiota [A] t 1.kertaluvun reaktion kinetiikkaa voidaan seurata minkä tahansa tahansa konsentraatiosta riippuvan suureen (ph, johtokyky, absorbanssi jne) avulla eikä absoluuttista konsentraatiota tarvita nopeusvakion ratkaisemiseksi 8
9 Määrittelemme reaktion puoliajan t 1/2 ajaksi mikä kuluu reaktion edettyä puoleen (lähtöaineen konsentraatio pienenee puoleen). 1. kertaluvun reaktiolle tämä saadaan yksinkertaisesti sijoittamalla: [ A] = 1 A 2 [ ] 0 = [ A] 0 e kt 1/2 t 1/ 2 = ln2 k 1 k 1. kertalavun reaktion puoliaika on vakio! ts. riippumaton konsentraatioista 1. Kertaluvun reaktion puoliaika on käytännöllinen suure ja sen avulla voidaan määrittää mm. reaktionopeusvakion arvo 9
10 Reaktionopeusvakion arvon määrittäminen 1. kertaluvulle: Tarkastellaan esimerkkireaktiota CH 3 N 2 CH 3 (g) CH 3 CH 3 (g) + N 2 (g) Tämän 1. kertaluvun reaktion edistymistä on seurattu mittaamalla atsometanin osapaine ajan funktiona t/s p/10-2 Torr Koska 1. kertaluvun reaktiolle pätee: muodostamme pisteparit ln(p/p 0 ),t " ln$ # [ A] % A ' = kt & [ ] 0 t/s ln(p/p 0 ) ln(p/p0) y = x R= 1 kulmakertoimesta saamme reaktionopeusvakion arvon k = 3.6 x /s t 10
11 Tarkastellaan reaktiota: A + B C Jos reaktionopeus noudattaa konsentraatioriippuvuutta: v = d [ A ] = d [ B ] on kyseessä 2. kertaluvun reaktio = d [ C ] = k[ A] [ B] Jos em. reaktio suoritetaan olosuhteissa jossa toista reagenssia (esim. B) on ylimäärin, ts. [B] [B] 0 = vakio v = k ' [ A];k'= k B [ ] 0 Tässä tapauksessa ko. reaktion on pseudo 1. kertaluvun reaktio Monesti olosuhteita valitsemalla reaktion kertalukua voidaan laskea, jolloin kinetiikan käsittely yksinkertaistuu Menetelmää kutsutaan isolaatiomenetelmäksi 11
12 Reaktion kertaluku voidaan määrittää monella tavalla. Yksi näistä perustuu alkukonsentraatioiden varioimiseen ja alkunopeuden mittaamiseen alkunopeus: a v 0 = k[ A] 0 [ ] 0 logv 0 = log k + alog A mitataan v 0 eri [A] 0 arvoilla ja piirretään suora leikkauspiste = log k kulmakerroin = a log v 0 log [A] 0 12
13 Tarkastellaan esimerkkireaktiota 2I (g) + Ar (g) I 2 (g) + Ar (g) Reaktion alkunopeus on mitattu useilla alkukonsentraatioilla: [ I ] 0 /10-5 mol L v 0 /mol L -1 s -1 a) 8.70 x x x x10-2 b) 4.35x x x x10-1 c)8.69x x x x10-1 a)-c) liittyvät argonin alkukonsentraatioon: a) [Ar] 0 = 1.0 mmol L -1 b) [Ar] 0 = 5.0 mmol L-1 c) [Ar] 0 = 10.0 mmol L -1 Kertaluvut jodin ja argonin suhteen saadaan esittämällä log v 0 vs. log [I] 0 kullekin Ar konsentraatiolle ja log v 0 vs. log [Ar] 0 kullekin I konsentraatiolle 13
14 Suorien kulmakertoimet ovat 2 ja 1 v 0 = k I 2 [ ] 0 [ Ar] 0 14
15 Toisen kertaluvun reaktio Esimerkiksi: d[ A] [ A] = k 2 2A B d[ A] [ A] [ A] 0 = k[ A] 2 t d[ A] [ A] = k [ A] 1 = kt [ A] 0 [ A] = [ A] 0 1+ A [ ] 0 kt huomaa k:n yksikkö = dm 3 mol -1 s -1 15
16 Ratkaistaan puoliaika t 1/2 : t 1/ 2 = 1 A [ ] 0 k [ A] = 1 A 2 [ ] 0 = Toinen tyyppi 2. kertaluvun reaktiosta: A + B tuotteet [ A] 0 1+ A [ ] 0 kt 1/ 2 vakio (vrt. 1. kertaluku) d[ A] = k[ A] [ B] alkukonsentraatiot [A] 0 ja [B] 0, muutos = x [A]=[A] 0 - x [B]=[B] 0 - x d[ A] ([ ] 0 x) = d A = dx = k ([ A ] 0 x) B ([ ] 0 x) Integroinnin yksityiskohdat on esitetty opppikirjassa 16
17 tulokseksi saadaan: kt = 1 [ B] 0 A # [ ln A ] 0 [ B] [ ] % 0 [ B] 0 [ A] $ & ( ' Kuvassa on verrattu 1. ja 2. kertaluvun reaktioiden edistymistä siten, että vertailtavilla reaktioilla on sama alkunopeus toisen kertaluvun reaktio hidastuu nopeammin 17
18 Tarkastellaan esimerkkinä di-isopropyyliformiaatin (dipf) metanolyysireaktion kinetiikkaa oheisen mittausaineiston puitteissa. Määritämme kertaluvun ja nopeusvakion suuruuden t/min [dipf] menetelmänä on kokeilla miten hyvin tämä mittausdata sopii 1. ja 2. kertaluvun kinetiikkaan Aloitetaan 1. kertaluvusta, jolloin ln[dipf] vs aika tulisi olla suora. Muodostetaan pisteparit: t/min ln[dipf] ,
19 ln [] y = e-05x R= Havaitsemme, että pisteparit muodostavat hyvän suoran. Reaktio on 1. kertalukua ja sen nopeusvakio saadaan kulmakertoimesta: 1 k=4.55x10-5 s t (s) 19
20 Voimme vielä tarkistaa miten hyvin mittauspisteet sopisivat 2. kertaluvun kinetiikkaan: 1 [ A] 1 = kt [ A] 0 muodostamme pisteparit 1/[dipf],t t/min /[dipf] y = e-05x R= /[dipf] paljon huonompi sovitus, joten reaktio ei ole toista kertalukua t (s) 20
21 Useimpien kemiallisten reaktioiden nopeus riippuu lämpötilasta. Lähes kaikissa tapauksissa reaktionopeus kasvaa lämpötilan kasvaessa Kokeellisesti on havaittu, että reaktionopeusvakion lämpötilariippuvuus noudattaa varsin hyvin Arrheniuksen yhtälöä: lnk = ln A E a RT A = ns. pre-eksponentiaalitekijä (frekvenssitekijä) E a = reaktion aktivointienergia Arrheniuksen yhtälö pätee sekä eksotermisille että endotermisille reaktioille. Aktivoitumisenergia voidaan määrittää mittaamalla reaktionopeusvakion arvo useassa eri lämpötilassa 21
22 aktivoitu kompleksi 22
23 Asetaldehydin hajoamista (2. kertaluvun reaktio) on seurattu lämpötilan funktiona: T/K k/ L mol -1 s -1 muodostetaan pisteparit 1/T,lnk ja sijoitetaan ne koordinaatistoon: suoran kulmakerroin = -2,27x10 4 =E a /R leikkauspiste = 27.7 = lna E a = 189 kj mol -1 A = e 27.7 L mol -1 s -1 = 1.1x10 12 L mol -1 s -1 23
24 Tasapainoreaktiot A B B A v = k [A] v = k [B] d[a] = k[a] + k'[b] Jos alussa on vain A:ta läsnä [A] 0 = [A] + [B] d[a] = k[a] + k' [A] 0 [A] +k')t k'+ke (k Diff. yhtälön ratkaisuna saadaan: [ A] = [A] 0 k + k' Pitkän ajan kuluttua (t ) [ A] = k' k + k' [A] 0 [ B] = [A] 0 [A] = ( ) = (k + k')[a] + k'[a] 0 e (k +k')t 0 k k + k' [A] 0 tasapainokonsentraatiot 24
25 Määrittelemme tasapainovakion K: K = B A [ ] = k [ ] k' Tärkeä tulos, joka yhdistää kinetiikan termodynamiikkaan vrt. ΔG 0 = RT lnk 25
26 Nesteiden sekoittuminen on varsin hidas prosessi (10-3 s) Voidaanko nopeaa kinetiikkaa tutkia liuoksissa? esim. H + + OH - H 2 O t 1/2 = 10-6 s Relaksaatiomenetelmissä kemiallista tasapainoa häiritäään esim. nopealla lämpötilamuutoksella, ja mitataan aika joka kuluu uuteen tasapainoon asettumiseen. Tätä aikaa kutsutaan relaksaatioajaksi. Relaksaatioajalla on yhteys nopeusvakioihin. Menetelmä soveltuu nopeiden reaktioiden tutkimiseen. k a Tarkastellaan tasapainoreaktiota A B k b d[a] (1) tasapainossa = 0 k a '[A]' eq = k b '[B]' eq Lämpötila muutetaan nopeasti T 1 T 2 nopeusvakiot muuttuvat välittömästi k a k a ; k b k b T = T 1 Lämpötilahyppy- kokeessa tarkastellaan muutosta näiden tasa- painojen välillä (2) uusi tasapaino k a [A] eq = k b [B] eq 26
27 (1) (2) k a '[A]' eq = k b '[B]' eq T = T 2 k a ; k b k a [A] eq = k b [B] eq [A] = x + [A] eq [B] = [B] eq x T = T 1 T = T 2 (x = poikkeama) Relaksaation aikana: d[a] = k a ( x + [A] eq ) + k b ( x + [B] eq ) sijoittamalla yhtäsuuruus d[a] x x 0 = (k a + k b )x = dx dx x = (k + k ) a b k a [A] eq = k b [B] eq t " ln x % $ ' = k a + k b # x 0 & 0 (poikkeaman muutosnopeus) ( )t x = x 0 e t(k a +k b ) = x 0 e t /τ 27
28 Systeemi relaksoituu eksponentiaalissti uuteen tasapainoon. Suuretta ( ) kutsutaan relaksaatioajaksi. τ =1/ k a + k b Huom! Relaksaatioajan lauseke riippuu kertaluvusta. Em. esimerkissä oletimme 1. kertaluvun molempiin suuntiin k a '[A]' eq = k b '[B]' eq x 0 x = x 0 e k a [A] eq = k b [B] eq t=0 t=τ mittaamalla τ saadaan k a + k b tasapainovakiosta K = k a /k b 28
29 Esimerkki H 2 O (l) k 1 k 2 H + (aq) + OH - (aq) τ = 37 µs k 1 = 1. kertalukua k 2 = 2. kertalukua pk w = d[h 2 O] = k 1 [H 2 O] + k 2 [H + ][OH ] relaksaatioajalle voidaan johtaa lauseke: tasapainotilanteessa k 1 [H 2 O] = k 2 [H + ][OH ] k 1 = [H + ][OH ] = K W k 2 [H 2 O] [H 2 O] = K 1 τ = k 1 + k 2 [H + ] + [OH ] ( ) [H 2 O]=56 mol/dm 3 K W = sijoittamalla saamme K = 1.8 x k 1 :n k 2 :n ja K:n relaatio: k 1 = k 2 K 29
30 1 τ = k K mol 2 dm + k [H ( ] + [OH ]) ( ) mol = k 2 K + K W 1/ 2 + K W 1/ 2 k 2 = 1 τ mol dm 3 k 1 = k 2 K mol dm 3 = s 1 dm = 2.0 mol k 2 dm 3 = dm 3 mol s 30
31 Alkeisreaktiot (elementary reactions) 1. Tapahtuvat suoraan yhdessä vaiheessa siten, että välituotteita ei havaita 2. Lähes kaikki reaktiot koostuvat joukosta peräkkäisiä alkeisreaktioita 3. Alkeisreaktion molekulaarisuus tarkoittaa ko. alkeisreaktioon osallistuvien molekyylien lukumäärää unimolekulaarinen alkeisreaktio H 2 + Br 2 HBr + Br bimolekulaarinen alkeisreaktio 31
32 Reaktion kertaluku on aina kokeellisesti määritettävä ominaisuus. Molekulaarisuus viittaa aina alkeisreaktion mekanismiin. Alkeisreaktion nopeuslaki voidaan päätellä suoraan reaktioyhtälöstä: A tuoteet A + B tuoteet d[a] d[a] = k[a] = k[a][b] Se, että jokin reaktio noudattaa 2. kertaluvun kinetiikkaa ei välttämättä tarkoita sitä, että kyseessä on A + B tuoteet tyypin alkeisreaktio 32
33 Tarkastellaan seuraavaksi peräkkäisiä alkeisreaktioita: A k a " " I k " b P d[a] = k a [A] d[i] = k a [A] k b [I] d[p] = k b [I] Jos oletamme, että alussa (t=0) on vain A:ta ([A] 0 ): [A] = [A] 0 e k a t kinetiikkaa kuvaavat diff. yhtälöt d[i] [I] = = k a [A] 0 e k a t k b [I] jos [I] 0 = 0 niin tämä ratkeaa: k a k b k a e k t a e k b t ( )[A] 0 33
34 Reunaehdosta [A] + [I] + [P] = [A] 0 [P] = [A] 0 - [A] - [I] # = 1+ k ae k b t k b e k a t $ % k b k a & ' ( [A] 0 34
35 Tapauksessa jossa k b >> k a, jokainen syntynyt I molekyyli muuttuu välittömästi P:ksi. nyt e k b t << e k a t ja k b k a k b [P] 1 e k a t ( ) A [ ] 0 Näissä olosuhteissa tuotteen muodostumisnopeus riippuu nopeudesta, jolla välituote I muodostuu. Tämä jälkimmäistä vaihetta hitaampi prosessi on reaktio- nopeuden määräävä vaihe. Peräkkäisten reaktioiden käsittelyä voidaan olennaisesti yksinkertaistaa, jos voidaan olettaa vältuotteiden häviävän likimain samalla nopeudella kun niitä muodostuu. Tätä oletusta kutsutaan steady state (vakiotila) approksimaatioksi 35
36 d[i] A = k a [A] k b [B] = 0 [I] = k a [A] k b k a " I k " b P Nyt tuotteen muodostumisnopeus saa yksinkertaisen muodon: d[p] = k b [I] = k a [A] = k a [A] 0 e k a t [P ] 0 d[p] = t 0 [P] = -[A] 0 k a [A] 0 e k a t 0 t ( ) e k a t = [A] 0 1 e k a t 36
37 Konsentraatioiden käyttäytyminen steady-state tilanteessa 37
38 Etutasapaino Tarkastellaan seuraavia peräkkäisiä reaktioita: A + B k a k a I k b P hidas vaihe nopea vaihe k a >>k b Tasapainotilanteessa K = Tuotteen muodostumiselle: merkitään k = k b K d[p] [I] [A][B] = k a k a ' d[p] = k b [I] = k b K[A][B] = k[a][b] havaitaan siis toisen kertaluvun kinetiikkaa 38
39 Termiset unimolekulaariset reaktiot Unimolekulaaristen reaktioiden kinetiikka silsältää useita mielenkiintoisia kysymyksiä, joihin ei aina ole ollut vastausta: 1. Miten molekyyli saa energian, jolla ylittää aktivoitumisenergia? - aluksi uskottiin ns. säteilyhypoteesiin 2. Jos molekyyli saa energiansa kahden molekyylin törmäyksessä, niin miten on mahdollista, että reaktio noudattaa 1. kertaluvun kinetiikkaa? 3. Mistä johtuu, että reaktion kertaluku riippuu konsentraatiosta? Lindemann ja Hinschelwood esittivät toimivan mekanismin 1921: Mallissa reaktio jaetaan aktivoitumiseen, sammumiseen ja reaktioon 39
40 Unimolekulaarinen reaktio A tuotteet aktivoituminen: A + A A* + A d[a*] = k a [A] 2 aktivoituminen sammuminen sammuminen: A + A* A + A d[a*] = k a '[A][A*] reaktio reaktio: A* P (tuotteet) d[a*] = k b [A*] Jos oletamme, että steady state tilanteen energisoidulle molekyylille A*: d[a*] = k a [A] 2 k a '[A][A*] k b [A*] = 0 40
41 Nyt voimme kirjoittaa A*:n steady state konsentraation: [A*] = k a [A] 2 k b + k a '[A] d[p] = k b [A*] = k a k b [A]2 k b + k a '[A] Tarkastellaa tuotteen muodotumista eri olosuhteissa kaasutilaisessa reaktiossa: 1. A:n paine on alhainen - alhaisessa paineessa on todennäköistä, että aktivoinut molekyyli A* reagoi ennen kuin se törmää uudelleen ja sammuu, ts. k b >>k a [A] d[p] k a [A] 2 reaktionopeuden määrää aktivoituminen (2. kertaluku) 2. A:n paine on korkea - törmäystaajuus on korkea, joten on todennäköistä, että A* sammuu ennen reaktiota, ts. k a [A] >> k b d[p] k k a b [A] = k[a] 41 k a ' (1. kertaluku)
42 Johdimme tuotteen muodostumiselle: d[p] = k[a] missä k = k a k b [A] k b + k a '[A] k:n lauseke voidaan muovata muotoon: 1 k = k ' a + k a k b 1 k a [A] Sitä noudattaako tutkittava reaktio L-H mekanismia voidan testata jos esitetään 1/k (mitattu nopeusvakio) 1/[A]:n (tai 1/p A :n) funtiona, jolloin L-H mekanismin mukaan pitäisi muodostua suora 42
43 L-H mallin ennuste esimerkkinä CHD=CHD:n isomerisoituminen 43
44 Tarkastellaan lopuksi aktivoitumisenergiaa reaktiolle, jossa esiintyy ns. etutasapaino (kuten esim. Lindemann-Hinschelwood mekanismi): A + A k a k a A* +A k b P Tilanteessa, jossa virittyneen molekyylin A* sammuminen on nopeampaa kuin itse reaktio kirjoitimme: d[p] k ak b k a ' [A] = k[a] sovelletaan Arrheniuksen yhtälöä nopeusvakioille: k = k a k b k a ' ( ) A b e E a (b)/ RT ( ) = A a e E a (a )/ RT ( A' a e E a ' (a )/ RT ) = A a A b A a ' e {E a (a )+E a (b ) E a ' (a )} / RT ' E a = E a (a) + E a (b) E a (a) 44
45 E a (a) + E a (b) > E a ' (a) positiivinen aktivoitumisenergia; reaktionopeus kasvaa lämpötilan kasvaessa E a (a) + E a (b) < E a ' (a) negatiivinen aktivoitumisenergia; reaktio hidastuu lämpötilan kasvaessa E a > 0 E a < 0 45
Luku 8. Reaktiokinetiikka
 Luku 8 Reaktiokinetiikka 234 8.1 Reaktion nopeus Reaktiokinetiikka tarkastelee reaktioiden nopeuksia (vrt. termodynamiikka) reaktionopeus = konsentraation muutos aikayksikössä Tarkastellaan yksinkertaista
Luku 8 Reaktiokinetiikka 234 8.1 Reaktion nopeus Reaktiokinetiikka tarkastelee reaktioiden nopeuksia (vrt. termodynamiikka) reaktionopeus = konsentraation muutos aikayksikössä Tarkastellaan yksinkertaista
Teddy 10. harjoituksen malliratkaisu syksy 2011
 Teddy. harjoituksen malliratkaisu syksy 2. Tarkastellaan reaktioketjua k O 3 O2 +O () O 2 +O k O 3 (2) O 3 +O k 2 O 2 +O 2 (3) Vakiotilaolettamuksen mukaan välituotteen konsentraatio pysyy vakiona lyhyen
Teddy. harjoituksen malliratkaisu syksy 2. Tarkastellaan reaktioketjua k O 3 O2 +O () O 2 +O k O 3 (2) O 3 +O k 2 O 2 +O 2 (3) Vakiotilaolettamuksen mukaan välituotteen konsentraatio pysyy vakiona lyhyen
CHEM-A1110 Virtaukset ja reaktorit. Laskuharjoitus 9/2016. Energiataseet
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 9/2016 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa D406 Energiataseet Tehtävä 1. Adiabaattisen virtausreaktorin
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 9/2016 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa D406 Energiataseet Tehtävä 1. Adiabaattisen virtausreaktorin
Luku 2. Kemiallisen reaktion tasapaino
 Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
Tasapainotilaan vaikuttavia tekijöitä
 REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
Teddy 2. välikoe kevät 2008
 Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 2. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
KEMA221 2009 KEMIALLINEN TASAPAINO ATKINS LUKU 7
 KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
KEMIALLINEN TASAPAINO Määritelmiä Kemiallinen reaktio A B pyrkii kohti tasapainoa. Yleisessä tapauksessa saavutetaan tasapainoa vastaava reaktioseos, jossa on läsnä sekä lähtöaineita että tuotteita: A
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
f (28) L(28) = f (27) + f (27)(28 27) = = (28 27) 2 = 1 2 f (x) = x 2
 BMA581 - Differentiaalilaskenta ja sovellukset Harjoitus 4, Syksy 15 1. (a) Olisiko virhe likimain.5, ja arvio antaa siis liian suuren arvon. (b) Esim (1,1.5) tai (,.5). Funktion toinen derivaatta saa
BMA581 - Differentiaalilaskenta ja sovellukset Harjoitus 4, Syksy 15 1. (a) Olisiko virhe likimain.5, ja arvio antaa siis liian suuren arvon. (b) Esim (1,1.5) tai (,.5). Funktion toinen derivaatta saa
Esimerkiksi ammoniakin valmistus typestä ja vedystä on tyypillinen teollinen tasapainoreaktio.
 REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin?
 Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
MAB3 - Harjoitustehtävien ratkaisut:
 MAB3 - Harjoitustehtävien ratkaisut: 1 Funktio 1.1 Piirretään koordinaatistoakselit ja sijoitetaan pisteet: 1 1. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä.
MAB3 - Harjoitustehtävien ratkaisut: 1 Funktio 1.1 Piirretään koordinaatistoakselit ja sijoitetaan pisteet: 1 1. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä.
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
2. Viikko. CDH: luvut (s ). Matematiikka on fysiikan kieli ja differentiaaliyhtälöt sen yleisin murre.
 2. Viikko Keskeiset asiat ja tavoitteet: 1. Peruskäsitteet: kertaluku, lineaarisuus, homogeenisuus. 2. Separoituvan diff. yhtälön ratkaisu, 3. Lineaarisen 1. kl yhtälön ratkaisu, CDH: luvut 19.1.-19.4.
2. Viikko Keskeiset asiat ja tavoitteet: 1. Peruskäsitteet: kertaluku, lineaarisuus, homogeenisuus. 2. Separoituvan diff. yhtälön ratkaisu, 3. Lineaarisen 1. kl yhtälön ratkaisu, CDH: luvut 19.1.-19.4.
MAB3 - Harjoitustehtävien ratkaisut:
 MAB - Harjoitustehtävien ratkaisut: Funktio. Piirretään koordinaatistoakselit ja sijoitetaan pisteet:. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä. Funktiolla
MAB - Harjoitustehtävien ratkaisut: Funktio. Piirretään koordinaatistoakselit ja sijoitetaan pisteet:. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä. Funktiolla
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden KEMIAN KOE 22.3.2013 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten piirteiden ja sisältöjen luonnehdinta ei sido ylioppilastutkintolautakunnan arvostelua.
Ylioppilastutkintolautakunta S tudentexamensnämnden KEMIAN KOE 22.3.2013 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten piirteiden ja sisältöjen luonnehdinta ei sido ylioppilastutkintolautakunnan arvostelua.
on hidastuvaa. Hidastuvuus eli negatiivinen kiihtyvyys saadaan laskevan suoran kulmakertoimesta, joka on siis
 Fys1, moniste 2 Vastauksia Tehtävä 1 N ewtonin ensimmäisen lain mukaan pallo jatkaa suoraviivaista liikettä kun kourun siihen kohdistama tukivoima (tässä tapauksessa ympyräradalla pitävä voima) lakkaa
Fys1, moniste 2 Vastauksia Tehtävä 1 N ewtonin ensimmäisen lain mukaan pallo jatkaa suoraviivaista liikettä kun kourun siihen kohdistama tukivoima (tässä tapauksessa ympyräradalla pitävä voima) lakkaa
Nopeus, kiihtyvyys ja liikemäärä Vektorit
 Nopeus, kiihtyvyys ja liikemäärä Vektorit Luento 2 https://geom.mathstat.helsinki.fi/moodle/course/view.php?id=360 Luennon tavoitteet: Vektorit tutuiksi Koordinaatiston valinta Vauhdin ja nopeuden ero
Nopeus, kiihtyvyys ja liikemäärä Vektorit Luento 2 https://geom.mathstat.helsinki.fi/moodle/course/view.php?id=360 Luennon tavoitteet: Vektorit tutuiksi Koordinaatiston valinta Vauhdin ja nopeuden ero
Veden ionitulo ja autoprotolyysi TASAPAINO, KE5
 REAKTIOT JA Veden ionitulo ja autoprotolyysi TASAPAINO, KE5 Kun hapot ja emäkset protolysoituvat, vesiliuokseen muodostuu joko oksoniumioneja tai hydroksidi-ioneja. Määritelmä: Oksoniumionit H 3 O + aiheuttavat
REAKTIOT JA Veden ionitulo ja autoprotolyysi TASAPAINO, KE5 Kun hapot ja emäkset protolysoituvat, vesiliuokseen muodostuu joko oksoniumioneja tai hydroksidi-ioneja. Määritelmä: Oksoniumionit H 3 O + aiheuttavat
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I
 Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Eksponenttifunktio ja Logaritmit, L3b
 ja Logaritmit, L3b eksponentti-funktio Eksponentti-funktio Linkkejä kurssi8, / Etälukio (edu.) kurssi8, logaritmifunktio / Etälukio (edu.) Potenssifunktio y = f (x) = 2 Vakiofunktion y = a kuvaaja on vaakasuora
ja Logaritmit, L3b eksponentti-funktio Eksponentti-funktio Linkkejä kurssi8, / Etälukio (edu.) kurssi8, logaritmifunktio / Etälukio (edu.) Potenssifunktio y = f (x) = 2 Vakiofunktion y = a kuvaaja on vaakasuora
Luku 5: Diffuusio kiinteissä aineissa
 Luku 5: Diffuusio kiinteissä aineissa Käsiteltävät aiheet... Mitä on diffuusio? Miksi sillä on tärkeä merkitys erilaisissa käsittelyissä? Miten diffuusionopeutta voidaan ennustaa? Miten diffuusio riippuu
Luku 5: Diffuusio kiinteissä aineissa Käsiteltävät aiheet... Mitä on diffuusio? Miksi sillä on tärkeä merkitys erilaisissa käsittelyissä? Miten diffuusionopeutta voidaan ennustaa? Miten diffuusio riippuu
Tekijä Pitkä matematiikka
 Tekijä Pitkä matematiikka 5..017 110 Valitaan suoralta kaksi pistettä ja piirretään apukolmio, josta koordinaattien muutokset voidaan lukea. Vaakasuoran suoran kulmakerroin on nolla. y Suoran a kulmakerroin
Tekijä Pitkä matematiikka 5..017 110 Valitaan suoralta kaksi pistettä ja piirretään apukolmio, josta koordinaattien muutokset voidaan lukea. Vaakasuoran suoran kulmakerroin on nolla. y Suoran a kulmakerroin
IV. TASAINEN SUPPENEMINEN. f(x) = lim. jokaista ε > 0 ja x A kohti n ε,x N s.e. n n
 IV. TASAINEN SUPPENEMINEN IV.. Funktiojonon tasainen suppeneminen Olkoon A R joukko ja f n : A R funktio, n =, 2, 3,..., jolloin jokaisella x A muodostuu lukujono f x, f 2 x,.... Jos tämä jono suppenee
IV. TASAINEN SUPPENEMINEN IV.. Funktiojonon tasainen suppeneminen Olkoon A R joukko ja f n : A R funktio, n =, 2, 3,..., jolloin jokaisella x A muodostuu lukujono f x, f 2 x,.... Jos tämä jono suppenee
Oikeat vastaukset: Tehtävän tarkkuus on kolme numeroa. Sulamiseen tarvittavat lämmöt sekä teräksen suurin mahdollinen luovutettu lämpö:
 A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
CHEM-C2230 Pintakemia. Työ 2: Etikkahapon adsorptio aktiivihiileen. Työohje
 CHEM-C2230 Pintakemia Tö 2: Etikkahapon orptio aktiivihiileen Töohje 1 Johdanto Kaasun ja kiinteän aineen rajapinnalla tapahtuu leensä kaasun orptiota. Mös liuoksissa tapahtuu usein liuenneen aineen orptiota
CHEM-C2230 Pintakemia Tö 2: Etikkahapon orptio aktiivihiileen Töohje 1 Johdanto Kaasun ja kiinteän aineen rajapinnalla tapahtuu leensä kaasun orptiota. Mös liuoksissa tapahtuu usein liuenneen aineen orptiota
Luvun 8 laskuesimerkit
 Luvun 8 laskuesimerkit Esimerkki 8.1 Heität pallon, jonka massa on 0.40 kg seinään. Pallo osuu seinään horisontaalisella nopeudella 30 m/s ja kimpoaa takaisin niin ikään horisontaalisesti nopeudella 20
Luvun 8 laskuesimerkit Esimerkki 8.1 Heität pallon, jonka massa on 0.40 kg seinään. Pallo osuu seinään horisontaalisella nopeudella 30 m/s ja kimpoaa takaisin niin ikään horisontaalisesti nopeudella 20
2 Yhtälöitä ja epäyhtälöitä
 2 Yhtälöitä ja epäyhtälöitä 2.1 Ensimmäisen asteen yhtälö ja epäyhtälö Muuttujan x ensimmäisen asteen yhtälöksi sanotaan yhtälöä, joka voidaan kirjoittaa muotoon ax + b = 0, missä vakiot a ja b ovat reaalilukuja
2 Yhtälöitä ja epäyhtälöitä 2.1 Ensimmäisen asteen yhtälö ja epäyhtälö Muuttujan x ensimmäisen asteen yhtälöksi sanotaan yhtälöä, joka voidaan kirjoittaa muotoon ax + b = 0, missä vakiot a ja b ovat reaalilukuja
KOTITEKOINEN PALOSAMMUTIN (OSA 1)
 KOTITEKOINEN PALOSAMMUTIN (OSA 1) Johdanto Monet palosammuttimet, kuten kuvassa esitetty käsisammutin, käyttävät hiilidioksidia. Jotta hiilidioksidisammutin olisi tehokas, sen täytyy vapauttaa hiilidioksidia
KOTITEKOINEN PALOSAMMUTIN (OSA 1) Johdanto Monet palosammuttimet, kuten kuvassa esitetty käsisammutin, käyttävät hiilidioksidia. Jotta hiilidioksidisammutin olisi tehokas, sen täytyy vapauttaa hiilidioksidia
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
Hiilen ja vedyn reaktioita (1)
 Hiilen ja vedyn reaktioita (1) Hiilivetyjen tuotanto alkaa joko säteilevällä yhdistymisellä tai protoninvaihtoreaktiolla C + + H 2 CH + 2 + hν C + H + 3 CH+ + H 2 Huom. Reaktio C + + H 2 CH + + H on endoterminen,
Hiilen ja vedyn reaktioita (1) Hiilivetyjen tuotanto alkaa joko säteilevällä yhdistymisellä tai protoninvaihtoreaktiolla C + + H 2 CH + 2 + hν C + H + 3 CH+ + H 2 Huom. Reaktio C + + H 2 CH + + H on endoterminen,
KJR-C1001 Statiikka ja dynamiikka. Luento Susanna Hurme
 KJR-C1001 Statiikka ja dynamiikka Luento 15.3.2016 Susanna Hurme Päivän aihe: Translaatioliikkeen kinematiikka: asema, nopeus ja kiihtyvyys (Kirjan luvut 12.1-12.5, 16.1 ja 16.2) Osaamistavoitteet Ymmärtää
KJR-C1001 Statiikka ja dynamiikka Luento 15.3.2016 Susanna Hurme Päivän aihe: Translaatioliikkeen kinematiikka: asema, nopeus ja kiihtyvyys (Kirjan luvut 12.1-12.5, 16.1 ja 16.2) Osaamistavoitteet Ymmärtää
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
3 = Lisäksi z(4, 9) = = 21, joten kysytty lineaarinen approksimaatio on. L(x,y) =
 BM20A5810 Differentiaalilaskenta ja sovellukset Harjoitus 6, Syksy 2016 1. (a) Olkoon z = z(x,y) = yx 1/2 + y 1/2. Muodosta z:lle lineaarinen approksimaatio L(x,y) siten että approksimaation ja z:n arvot
BM20A5810 Differentiaalilaskenta ja sovellukset Harjoitus 6, Syksy 2016 1. (a) Olkoon z = z(x,y) = yx 1/2 + y 1/2. Muodosta z:lle lineaarinen approksimaatio L(x,y) siten että approksimaation ja z:n arvot
Mustan kappaleen säteily
 Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Mustan kappaleen säteily Musta kappale on ideaalisen säteilijän malli, joka absorboi (imee itseensä) kaiken siihen osuvan säteilyn. Se ei lainkaan heijasta eikä sirota siihen osuvaa säteilyä, vaan emittoi
Luento 8 6.3.2015. Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit
 Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Differentiaali- ja integraalilaskenta 1 Ratkaisut 5. viikolle /
 MS-A8 Differentiaali- ja integraalilaskenta, V/7 Differentiaali- ja integraalilaskenta Ratkaisut 5. viikolle / 9..5. Integroimismenetelmät Tehtävä : Laske osittaisintegroinnin avulla a) π x sin(x) dx,
MS-A8 Differentiaali- ja integraalilaskenta, V/7 Differentiaali- ja integraalilaskenta Ratkaisut 5. viikolle / 9..5. Integroimismenetelmät Tehtävä : Laske osittaisintegroinnin avulla a) π x sin(x) dx,
H7 Malliratkaisut - Tehtävä 1
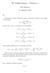 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
Juuri 12 Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty
 Juuri Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty 7.5.08 Kertaus K. a) Polynomi P() = + 8 on jaollinen polynomilla Q() =, jos = on polynomin P nollakohta, eli P() = 0. P() = + 8 = 54 08 +
Juuri Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty 7.5.08 Kertaus K. a) Polynomi P() = + 8 on jaollinen polynomilla Q() =, jos = on polynomin P nollakohta, eli P() = 0. P() = + 8 = 54 08 +
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta Insinöörivalinnan kemian koe MALLIRATKAISUT
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT 1 a) Vaihtoehto B on oikein. Elektronit sijoittuvat atomiorbitaaleille kasvavan
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT 1 a) Vaihtoehto B on oikein. Elektronit sijoittuvat atomiorbitaaleille kasvavan
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
vetyteknologia Polttokennon tyhjäkäyntijännite 1 DEE-54020 Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
DEE-5400 olttokennot ja vetyteknologia olttokennon tyhjäkäyntijännite 1 DEE-5400 Risto Mikkonen 1.1.014 g:n määrittäminen olttokennon toiminta perustuu Gibbsin vapaan energian muutokseen. ( G = TS) Ideaalitapauksessa
Käy vastaamassa kyselyyn kurssin pedanet-sivulla (TÄRKEÄ ensi vuotta ajatellen) Kurssin suorittaminen ja arviointi: vähintään 50 tehtävää tehtynä
 Käy vastaamassa kyselyyn kurssin pedanet-sivulla (TÄRKEÄ ensi vuotta ajatellen) Kurssin suorittaminen ja arviointi: vähintään 50 tehtävää tehtynä (vihkon palautus kokeeseen tullessa) Koe Mahdolliset testit
Käy vastaamassa kyselyyn kurssin pedanet-sivulla (TÄRKEÄ ensi vuotta ajatellen) Kurssin suorittaminen ja arviointi: vähintään 50 tehtävää tehtynä (vihkon palautus kokeeseen tullessa) Koe Mahdolliset testit
Luoki?elua: tavallinen vs osi?ais. Osa 11. Differen0aaliyhtälöt. Luoki?elua: kertaluku. Luoki?elua: lineaarisuus 4/13/13
 4/3/3 Osa. Differen0aaliyhtälöt Differen0aaliyhtälö = yhtälö jossa esiintyy jonkin funk0on derivaa?a. Esim: dx = x2 f x + f xy 2 2m d 2 ψ = Eψ dx 2 Luoki?elua: tavallinen vs osi?ais Differen0aaliyhtälöt
4/3/3 Osa. Differen0aaliyhtälöt Differen0aaliyhtälö = yhtälö jossa esiintyy jonkin funk0on derivaa?a. Esim: dx = x2 f x + f xy 2 2m d 2 ψ = Eψ dx 2 Luoki?elua: tavallinen vs osi?ais Differen0aaliyhtälöt
Termodynamiikka. Fysiikka III 2007. Ilkka Tittonen & Jukka Tulkki
 Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
Termodynamiikka Fysiikka III 2007 Ilkka Tittonen & Jukka Tulkki Tilanyhtälö paine vakio tilavuus vakio Ideaalikaasun N p= kt pinta V Yleinen aineen p= f V T pinta (, ) Isotermit ja isobaarit Vakiolämpötilakäyrät
Integrointialgoritmit molekyylidynamiikassa
 Integrointialgoritmit molekyylidynamiikassa Markus Ovaska 28.11.2008 Esitelmän kulku MD-simulaatiot yleisesti Integrointialgoritmit: mitä integroidaan ja miten? Esimerkkejä eri algoritmeista Hyvän algoritmin
Integrointialgoritmit molekyylidynamiikassa Markus Ovaska 28.11.2008 Esitelmän kulku MD-simulaatiot yleisesti Integrointialgoritmit: mitä integroidaan ja miten? Esimerkkejä eri algoritmeista Hyvän algoritmin
Mekaniikan jatkokurssi Fys102
 Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 8 Vaimennettu värähtely Elävässä elämässä heilureiden ja muiden värähtelijöiden liike sammuu ennemmin tai myöhemmin. Vastusvoimien takia värähtelijän
Mekaniikan jatkokurssi Fys10 Kevät 010 Jukka Maalampi LUENTO 8 Vaimennettu värähtely Elävässä elämässä heilureiden ja muiden värähtelijöiden liike sammuu ennemmin tai myöhemmin. Vastusvoimien takia värähtelijän
3 Eksponentiaalinen malli
 Eksponentiaalinen malli Eksponentiaalinen kasvaminen ja väheneminen 6. Kulunut aika (h) Bakteerien määrä 0 80 0 60 0 0 7 7 0 0 0 6. 90 % 0,90 Pienennöksiä (kpl) Piirroksen korkeus (cm) 0,90 6,0, 0,90 6,0,06,
Eksponentiaalinen malli Eksponentiaalinen kasvaminen ja väheneminen 6. Kulunut aika (h) Bakteerien määrä 0 80 0 60 0 0 7 7 0 0 0 6. 90 % 0,90 Pienennöksiä (kpl) Piirroksen korkeus (cm) 0,90 6,0, 0,90 6,0,06,
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2½ p. = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT JA PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT JA PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
Lisä,etopake3 2: ra,onaalifunk,on integroin,
 9/20/ Lisä,etopake 2: ra,onaalifunk,on integroin, Ra,onaalifunk,o: kahden polynomin P(x) ja Q(x) osamäärä. Esim. x 2 x + 2 tai x5 +6x x- Ra,onaalifunk,o voidaan aina integroida, ja tähän löytyy kajava
9/20/ Lisä,etopake 2: ra,onaalifunk,on integroin, Ra,onaalifunk,o: kahden polynomin P(x) ja Q(x) osamäärä. Esim. x 2 x + 2 tai x5 +6x x- Ra,onaalifunk,o voidaan aina integroida, ja tähän löytyy kajava
SAIPPUALIUOKSEN SÄHKÖKEMIA 09-2009 JOHDANTO
 SAIPPUALIUOKSEN SÄHKÖKEMIA 09-009 JOHDANTO 1 lainaus ja kuvat lähteestä: Työssä tutkitaan johtokyky- ja ph-mittauksilla tavallisen palasaippuan kemiallista koostumusta ja misellien ja aggregaattien muodostumista
SAIPPUALIUOKSEN SÄHKÖKEMIA 09-009 JOHDANTO 1 lainaus ja kuvat lähteestä: Työssä tutkitaan johtokyky- ja ph-mittauksilla tavallisen palasaippuan kemiallista koostumusta ja misellien ja aggregaattien muodostumista
FYSA220/K2 (FYS222/K2) Vaimeneva värähtely
 FYSA/K (FYS/K) Vaimeneva värähtely Työssä tutkitaan vaimenevaa sähköistä värähysliikettä. Erityisesti pyritään havainnollistamaan kelan inuktanssin, konensaattorin kapasitanssin ja ohmisen vastuksen suuruuksien
FYSA/K (FYS/K) Vaimeneva värähtely Työssä tutkitaan vaimenevaa sähköistä värähysliikettä. Erityisesti pyritään havainnollistamaan kelan inuktanssin, konensaattorin kapasitanssin ja ohmisen vastuksen suuruuksien
Luento 2: Liikkeen kuvausta
 Luento 2: Liikkeen kuvausta Suoraviivainen liike integrointi Kinematiikkaa yhdessä dimensiossa Luennon sisältö Suoraviivainen liike integrointi Kinematiikkaa yhdessä dimensiossa Liikkeen ratkaisu kiihtyvyydestä
Luento 2: Liikkeen kuvausta Suoraviivainen liike integrointi Kinematiikkaa yhdessä dimensiossa Luennon sisältö Suoraviivainen liike integrointi Kinematiikkaa yhdessä dimensiossa Liikkeen ratkaisu kiihtyvyydestä
- Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka: kappaleiden liike)
 KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
(b) Tunnista a-kohdassa saadusta riippuvuudesta virtausmekaniikassa yleisesti käytössä olevat dimensiottomat parametrit.
 Tehtävä 1 Oletetaan, että ruiskutussuuttimen nestepisaroiden halkaisija d riippuu suuttimen halkaisijasta D, suihkun nopeudesta V sekä nesteen tiheydestä ρ, viskositeetista µ ja pintajännityksestä σ. (a)
Tehtävä 1 Oletetaan, että ruiskutussuuttimen nestepisaroiden halkaisija d riippuu suuttimen halkaisijasta D, suihkun nopeudesta V sekä nesteen tiheydestä ρ, viskositeetista µ ja pintajännityksestä σ. (a)
TKK, TTY, LTY, OY, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 31.5.2006
 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
 KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
KULJETUSSUUREET Kuljetussuureilla tai -ominaisuuksilla tarkoitetaan kaasumaisen, nestemäisen tai kiinteän väliaineen kykyä siirtää ainetta, energiaa, tai jotain muuta fysikaalista ominaisuutta paikasta
f(x, y) = x 2 y 2 f(0, t) = t 2 < 0 < t 2 = f(t, 0) kaikilla t 0.
 Ääriarvon laatu Jatkuvasti derivoituvan funktion f lokaali ääriarvokohta (x 0, y 0 ) on aina kriittinen piste (ts. f x (x, y) = f y (x, y) = 0, kun x = x 0 ja y = y 0 ), mutta kriittinen piste ei ole aina
Ääriarvon laatu Jatkuvasti derivoituvan funktion f lokaali ääriarvokohta (x 0, y 0 ) on aina kriittinen piste (ts. f x (x, y) = f y (x, y) = 0, kun x = x 0 ja y = y 0 ), mutta kriittinen piste ei ole aina
Sähkökemian perusteita, osa 1
 Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut
 Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
Astrokemia Kevät 2011 Harjoitus 1, Massavaikutuksen laki, Ratkaisut 1 a Kaasuseoksen komponentin i vapaa energia voidaan kirjoittaa F i (N,T,V = ln Z i (T,V missä on ko hiukkasten lukumäärä tilavuudessa
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
Funktion määrittely (1/2)
 Funktion määrittely (1/2) Funktio f : A B on sääntö, joka liittää jokaiseen joukon A alkioon a täsmälleen yhden B:n alkion b. Merkitään b = f (a). Tässä A = M f on f :n määrittelyjoukko, B on f :n maalijoukko.
Funktion määrittely (1/2) Funktio f : A B on sääntö, joka liittää jokaiseen joukon A alkioon a täsmälleen yhden B:n alkion b. Merkitään b = f (a). Tässä A = M f on f :n määrittelyjoukko, B on f :n maalijoukko.
Määritelmät. Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin
 Hapot ja emäkset Määritelmät Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin Happo-emäsreaktioita kutsutaan tästä johtuen protoninsiirto eli protolyysi reaktioiksi Protolyysi Happo Emäs Emäs
Hapot ja emäkset Määritelmät Happo = luovuttaa protonin H + Emäs = vastaanottaa protonin Happo-emäsreaktioita kutsutaan tästä johtuen protoninsiirto eli protolyysi reaktioiksi Protolyysi Happo Emäs Emäs
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
2.2.1 Ratkaiseminen arvausta sovittamalla
 2.2.1 Ratkaiseminen arvausta sovittamalla Esimerkki: lomitusjärjestäminen (edellä) Yleistys: Ratkaistava T (1) c T (n) g(t (1),..., T (n 1), n) missä g on n ensimmäisen parametrin suhteen kasvava. (Ratkaisu
2.2.1 Ratkaiseminen arvausta sovittamalla Esimerkki: lomitusjärjestäminen (edellä) Yleistys: Ratkaistava T (1) c T (n) g(t (1),..., T (n 1), n) missä g on n ensimmäisen parametrin suhteen kasvava. (Ratkaisu
HALLIN ILMIÖ 1. TUTKITTAVAN ILMIÖN TEORIAA
 1 ALLIN ILMIÖ MOTIVOINTI allin ilmiötyössä tarkastellaan johteen varauksenkuljettajiin liittyviä suureita Työssä nähdään kuinka all-kiteeseen generoituu all-jännite allin ilmiön tutkimiseen soveltuvalla
1 ALLIN ILMIÖ MOTIVOINTI allin ilmiötyössä tarkastellaan johteen varauksenkuljettajiin liittyviä suureita Työssä nähdään kuinka all-kiteeseen generoituu all-jännite allin ilmiön tutkimiseen soveltuvalla
Fysiikan perusteet. Liikkeet. Antti Haarto 22.05.2012. www.turkuamk.fi
 Fysiikan perusteet Liikkeet Antti Haarto.5.1 Suureita Aika: tunnus t, yksikkö: sekunti s Paikka: tunnus x, y, r, ; yksikkö: metri m Paikka on ektorisuure Suoraiiaisessa liikkeessä kappaleen paikka (asema)
Fysiikan perusteet Liikkeet Antti Haarto.5.1 Suureita Aika: tunnus t, yksikkö: sekunti s Paikka: tunnus x, y, r, ; yksikkö: metri m Paikka on ektorisuure Suoraiiaisessa liikkeessä kappaleen paikka (asema)
Normaaliryhmä. Toisen kertaluvun normaaliryhmä on yleistä muotoa
 Normaaliryhmä Toisen kertaluvun normaaliryhmä on yleistä muotoa x = u(t,x,y), y t I, = v(t,x,y), Funktiot u = u(t,x,y), t I ja v = v(t,x,y), t I ovat tunnettuja Toisen kertaluvun normaaliryhmän ratkaisu
Normaaliryhmä Toisen kertaluvun normaaliryhmä on yleistä muotoa x = u(t,x,y), y t I, = v(t,x,y), Funktiot u = u(t,x,y), t I ja v = v(t,x,y), t I ovat tunnettuja Toisen kertaluvun normaaliryhmän ratkaisu
Numeeriset menetelmät TIEA381. Luento 12. Kirsi Valjus. Jyväskylän yliopisto. Luento 12 () Numeeriset menetelmät / 33
 Numeeriset menetelmät TIEA381 Luento 12 Kirsi Valjus Jyväskylän yliopisto Luento 12 () Numeeriset menetelmät 25.4.2013 1 / 33 Luennon 2 sisältö Tavallisten differentiaaliyhtälöiden numeriikasta Rungen
Numeeriset menetelmät TIEA381 Luento 12 Kirsi Valjus Jyväskylän yliopisto Luento 12 () Numeeriset menetelmät 25.4.2013 1 / 33 Luennon 2 sisältö Tavallisten differentiaaliyhtälöiden numeriikasta Rungen
2. kl:n DY:t. Lause. Yleisesti yhtälöllä ẍ = f(ẋ, x, t) on (sopivin oletuksin) aina olemassa 1-käs. ratkaisu. (ẋ dx/dt, ẍ d 2 x/dt 2.
 2. kl:n DY:t Yleisesti yhtälöllä ẍ = f(ẋ, x, t) on (sopivin oletuksin) aina olemassa 1-käs. ratkaisu. (ẋ dx/dt, ẍ d 2 x/dt 2.) Lause Olkoon f(x 2, x 1, t) funktio, ja oletetaan, että f, f/ x 1 ja f/ x
2. kl:n DY:t Yleisesti yhtälöllä ẍ = f(ẋ, x, t) on (sopivin oletuksin) aina olemassa 1-käs. ratkaisu. (ẋ dx/dt, ẍ d 2 x/dt 2.) Lause Olkoon f(x 2, x 1, t) funktio, ja oletetaan, että f, f/ x 1 ja f/ x
1. Arvioi kummalla seuraavista hyödykkeistä on hintajoustavampi kysyntä
 0 5 Nauris 10 15 20 MIKROTALOUSTIEDE A31C00100 Kevät 2017 HARJOITUKSET II Palautus 24.1.2017 klo 16:15 mennessä suoraan luennoitsijalle (esim. harjoitusten alussa) tai sähköpostitse (riku.buri@aalto.fi).
0 5 Nauris 10 15 20 MIKROTALOUSTIEDE A31C00100 Kevät 2017 HARJOITUKSET II Palautus 24.1.2017 klo 16:15 mennessä suoraan luennoitsijalle (esim. harjoitusten alussa) tai sähköpostitse (riku.buri@aalto.fi).
Osa 11. Differen-aaliyhtälöt
 Osa 11. Differen-aaliyhtälöt Differen-aaliyhtälö = yhtälö jossa esiintyy jonkin funk-on derivaa
Osa 11. Differen-aaliyhtälöt Differen-aaliyhtälö = yhtälö jossa esiintyy jonkin funk-on derivaa
2CHEM-A1210 Kemiallinen reaktio Kevät 2017 Laskuharjoitus 7.
 HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
Luento 13: Periodinen liike. Johdanto Harmoninen värähtely Esimerkkejä F t F r
 Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä θ F t m g F r 1 / 27 Luennon sisältö Johdanto Harmoninen värähtely Esimerkkejä 2 / 27 Johdanto Tarkastellaan jaksollista liikettä (periodic
Luento 13: Periodinen liike Johdanto Harmoninen värähtely Esimerkkejä θ F t m g F r 1 / 27 Luennon sisältö Johdanto Harmoninen värähtely Esimerkkejä 2 / 27 Johdanto Tarkastellaan jaksollista liikettä (periodic
Tarkastellaan tilannetta, jossa kappale B on levossa ennen törmäystä: v B1x = 0:
 8.4 Elastiset törmäykset Liike-energia ja liikemäärä säilyvät elastisissa törmäyksissä Vain konservatiiviset voimat vaikuttavat 1D-tilanteessa kappaleiden A ja B törmäykselle: 1 2 m Av 2 A1x + 1 2 m Bv
8.4 Elastiset törmäykset Liike-energia ja liikemäärä säilyvät elastisissa törmäyksissä Vain konservatiiviset voimat vaikuttavat 1D-tilanteessa kappaleiden A ja B törmäykselle: 1 2 m Av 2 A1x + 1 2 m Bv
kolminkertaisesti tehtäviä tavallisiin harjoituksiin verrattuna, voi sen kokonaan tekemällä saada suunnilleen kolmen tavallisen harjoituksen edestä
 Matematiikkaa kemisteille, kevät 2013 Ylimääräisiä laskuharjoituksia Tällä laskuharjoituksella voi korottaa laskuharjoituspisteitään, mikäli niitä ei ole riittävästi kurssin läpäisemiseen, tai vaihtoehtoisesti
Matematiikkaa kemisteille, kevät 2013 Ylimääräisiä laskuharjoituksia Tällä laskuharjoituksella voi korottaa laskuharjoituspisteitään, mikäli niitä ei ole riittävästi kurssin läpäisemiseen, tai vaihtoehtoisesti
joka voidaan määrittää esim. värinmuutosta seuraamalla tai lukemalla
 REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
on radan suuntaiseen komponentti eli tangenttikomponentti ja on radan kaarevuuskeskipisteeseen osoittavaan komponentti. (ks. kuva 1).
 H E I L U R I T 1) Matemaattinen heiluri = painottoman langan päässä heilahteleva massapiste (ks. kuva1) kuva 1. - heilurin pituus l - tasapainoasema O - ääriasemat A ja B - heilahduskulma - heilahdusaika
H E I L U R I T 1) Matemaattinen heiluri = painottoman langan päässä heilahteleva massapiste (ks. kuva1) kuva 1. - heilurin pituus l - tasapainoasema O - ääriasemat A ja B - heilahduskulma - heilahdusaika
AMMATTIKORKEAKOULUJEN TEKNIIKAN VALINTAKOE
 AMMATTIKORKEAKOULUJEN TEKNIIKAN VALINTAKOE OHJEITA Valintakokeessa on kaksi osaa: TEHTÄVÄOSA: Ongelmanratkaisu VASTAUSOSA: Ongelmanratkaisu ja Tekstikoe HUOMIOI SEURAAVAA: 1. TEHTÄVÄOSAN tehtävään 7 ja
AMMATTIKORKEAKOULUJEN TEKNIIKAN VALINTAKOE OHJEITA Valintakokeessa on kaksi osaa: TEHTÄVÄOSA: Ongelmanratkaisu VASTAUSOSA: Ongelmanratkaisu ja Tekstikoe HUOMIOI SEURAAVAA: 1. TEHTÄVÄOSAN tehtävään 7 ja
1.1 Funktion määritelmä
 1.1 Funktion määritelmä Tämän kappaleen otsikoksi valittu funktio on hyvä esimerkki matemaattisesta käsitteestä, johon usein jopa tietämättämme törmäämme arkielämässä. Tutkiessamme erilaisia Jos joukkojen
1.1 Funktion määritelmä Tämän kappaleen otsikoksi valittu funktio on hyvä esimerkki matemaattisesta käsitteestä, johon usein jopa tietämättämme törmäämme arkielämässä. Tutkiessamme erilaisia Jos joukkojen
Talousmatematiikan perusteet: Luento 7. Derivointisääntöjä Yhdistetyn funktion, tulon ja osamäärän derivointi Suhteellinen muutosnopeus ja jousto
 Talousmatematiikan perusteet: Luento 7 Derivointisääntöjä Yhdistetyn funktion, tulon ja osamäärän derivointi Suhteellinen muutosnopeus ja jousto Viime luennolla Funktion Derivaatta f (x) kuvaa funktion
Talousmatematiikan perusteet: Luento 7 Derivointisääntöjä Yhdistetyn funktion, tulon ja osamäärän derivointi Suhteellinen muutosnopeus ja jousto Viime luennolla Funktion Derivaatta f (x) kuvaa funktion
Kahden suoran leikkauspiste ja välinen kulma (suoraparvia)
 Kahden suoran leikkauspiste ja välinen kulma (suoraparvia) Piste x 0, y 0 on suoralla, jos sen koordinaatit toteuttavat suoran yhtälön. Esimerkki Olkoon suora 2x + y + 8 = 0 y = 2x 8. Piste 5,2 ei ole
Kahden suoran leikkauspiste ja välinen kulma (suoraparvia) Piste x 0, y 0 on suoralla, jos sen koordinaatit toteuttavat suoran yhtälön. Esimerkki Olkoon suora 2x + y + 8 = 0 y = 2x 8. Piste 5,2 ei ole
f(x) f(y) x y f f(x) f(y) (x) = lim
 Y1 (Matematiikka I) Haastavampia lisätehtäviä Syksy 1 1. Funktio h määritellään seuraavasti. Kuvan astiaan lasketaan vettä tasaisella nopeudella 1 l/min. Astia on muodoltaan katkaistu suora ympyräkartio,
Y1 (Matematiikka I) Haastavampia lisätehtäviä Syksy 1 1. Funktio h määritellään seuraavasti. Kuvan astiaan lasketaan vettä tasaisella nopeudella 1 l/min. Astia on muodoltaan katkaistu suora ympyräkartio,
MEI Kontinuumimekaniikka
 MEI-55300 Kontinuumimekaniikka 1 MEI-55300 Kontinuumimekaniikka 3. harjoitus matemaattiset peruskäsitteet, kinematiikkaa Ratkaisut T 1: Olkoon x 1, x 2, x 3 (tai x, y, z) suorakulmainen karteesinen koordinaatisto
MEI-55300 Kontinuumimekaniikka 1 MEI-55300 Kontinuumimekaniikka 3. harjoitus matemaattiset peruskäsitteet, kinematiikkaa Ratkaisut T 1: Olkoon x 1, x 2, x 3 (tai x, y, z) suorakulmainen karteesinen koordinaatisto
= 9 = 3 2 = 2( ) = = 2
 Ratkaisut 1.1. (a) + 5 +5 5 4 5 15 15 (b) 5 5 5 5 15 16 15 (c) 100 99 5 100 99 5 4 5 5 4 (d) 100 99 5 100 ( ) 5 1 99 100 4 99 5 1.. (a) ( 100 99 5 ) ( ( 4 ( ) ) 4 1 ( ) ) 4 9 4 16 (b) 100 99 ( 5 ) 1 100
Ratkaisut 1.1. (a) + 5 +5 5 4 5 15 15 (b) 5 5 5 5 15 16 15 (c) 100 99 5 100 99 5 4 5 5 4 (d) 100 99 5 100 ( ) 5 1 99 100 4 99 5 1.. (a) ( 100 99 5 ) ( ( 4 ( ) ) 4 1 ( ) ) 4 9 4 16 (b) 100 99 ( 5 ) 1 100
MS-A0107 Differentiaali- ja integraalilaskenta 1 (CHEM)
 MS-A17 Differentiaali- ja integraalilaskenta 1 CHEM) Laskuharjoitus 4lv, kevät 16 1. Tehtävä: Laske cos x dx a) osittaisintegroinnilla, b) soveltamalla sopivaa trigonometrian kaavaa. Ratkaisu: a) Osittaisintegroinnin
MS-A17 Differentiaali- ja integraalilaskenta 1 CHEM) Laskuharjoitus 4lv, kevät 16 1. Tehtävä: Laske cos x dx a) osittaisintegroinnilla, b) soveltamalla sopivaa trigonometrian kaavaa. Ratkaisu: a) Osittaisintegroinnin
1 Komparatiivinen statiikka ja implisiittifunktiolause
 Taloustieteen matemaattiset menetelmät 27 materiaali 4 Komparatiivinen statiikka ja implisiittifunktiolause. Johdanto Jo opiskeltu antaa nyt valmiu tutkia taloudellisia malleja Kiinnostava malli voi olla
Taloustieteen matemaattiset menetelmät 27 materiaali 4 Komparatiivinen statiikka ja implisiittifunktiolause. Johdanto Jo opiskeltu antaa nyt valmiu tutkia taloudellisia malleja Kiinnostava malli voi olla
LIITE 1 VIRHEEN ARVIOINNISTA
 1 Mihin tarvitset virheen arviointia? Mittaustuloksiin sisältyy aina virhettä, vaikka mittauslaite olisi miten uudenaikainen tai kallis tahansa ja mittaaja olisi alansa huippututkija Tästä johtuen mittaustuloksista
1 Mihin tarvitset virheen arviointia? Mittaustuloksiin sisältyy aina virhettä, vaikka mittauslaite olisi miten uudenaikainen tai kallis tahansa ja mittaaja olisi alansa huippututkija Tästä johtuen mittaustuloksista
LIITE 1 VIRHEEN ARVIOINNISTA
 1 LIITE 1 VIRHEEN ARVIOINNISTA Mihin tarvitset virheen arviointia? Mittaustulokset ovat aina todellisten luonnonvakioiden ja tutkimuskohdetta kuvaavien suureiden likiarvoja, vaikka mittauslaite olisi miten
1 LIITE 1 VIRHEEN ARVIOINNISTA Mihin tarvitset virheen arviointia? Mittaustulokset ovat aina todellisten luonnonvakioiden ja tutkimuskohdetta kuvaavien suureiden likiarvoja, vaikka mittauslaite olisi miten
LASKENNALLISEN TIETEEN OHJELMATYÖ: Diffuusion Monte Carlo -simulointi yksiulotteisessa systeemissä
 LASKENNALLISEN TIETEEN OHJELMATYÖ: Diffuusion Monte Carlo -simulointi yksiulotteisessa systeemissä. Diffuusio yksiulotteisessa epäjärjestäytyneessä hilassa E J ii, J ii, + 0 E b, i E i i i i+ x Kuva.:
LASKENNALLISEN TIETEEN OHJELMATYÖ: Diffuusion Monte Carlo -simulointi yksiulotteisessa systeemissä. Diffuusio yksiulotteisessa epäjärjestäytyneessä hilassa E J ii, J ii, + 0 E b, i E i i i i+ x Kuva.:
1.1 Homogeeninen kemiallinen tasapaino
 1.1 Homogeeninen kemiallinen tasapaino 1. a) Mitä tarkoittaa käsite kemiallinen tasapaino? b) Miten kemiallinen tasapaino ilmaistaan reaktioyhtälössä? c) Mistä tekijöistä tasapainossa olevan reaktioseoksen
1.1 Homogeeninen kemiallinen tasapaino 1. a) Mitä tarkoittaa käsite kemiallinen tasapaino? b) Miten kemiallinen tasapaino ilmaistaan reaktioyhtälössä? c) Mistä tekijöistä tasapainossa olevan reaktioseoksen
KE Prosessien perusteet
 KE-40.2500 Prosessien perusteet Tentiss2i saa kiiyttia1 materiaalina vain fysikaalisen kemian taulukoita kirjaa sek?i kemian laitetekniikan taulukoita ja piinoksia kirjaa' TENTT 10.3.20088-13. 1. Selit8
KE-40.2500 Prosessien perusteet Tentiss2i saa kiiyttia1 materiaalina vain fysikaalisen kemian taulukoita kirjaa sek?i kemian laitetekniikan taulukoita ja piinoksia kirjaa' TENTT 10.3.20088-13. 1. Selit8
