Minna Lempinen NISÄKÄSSOLUJEN KASVATUS BIOREAKTORISSA
|
|
|
- Kari Lehtonen
- 6 vuotta sitten
- Katselukertoja:
Transkriptio
1 Minna Lempinen NISÄKÄSSOLUJEN KASVATUS BIOREAKTORISSA
2 NISÄKÄSSOLUJEN KASVATUS BIOREAKTORISSA Minna Lempinen Opinnäytetyö Kevät 2016 Energiatekniikan koulutusohjelma Oulun ammattikorkeakoulu
3 TIIVISTELMÄ Oulun ammattikorkeakoulu Energiatekniikan koulutusohjelma, laboratorio- ja ympäristöala Tekijä: Minna Lempinen Opinnäytetyön nimi: Nisäkässolujen kasvatus bioreaktorissa Työn ohjaaja: Eija Hakala Työn valmistumislukukausi ja vuosi: Kevät 2016 Sivumäärä: liitettä Työ tehtiin Oulun yliopistolle Biokemian ja molekyylilääketieteen tiedekunnalle. Opinnäytetyön aiheena oli nisäkässolujen kasvatus bioreaktorissa. Työn tavoitteena oli ottaa käyttöön eläinsolujen kasvatukseen tarkoitettu bioreaktori. Työhön kuului CHO-solujen ja HeLa-solujen ylläpito ja jakaminen sekä parametrien määritys nisäkässolukasvatuksille bioreaktorissa. Työ aloitettiin tutustumalla bioreaktorin toimintaan. Bioreaktorille tehtiin testiajot ennen solukasvatusten aloittamista. Olennainen osa työtä oli myös eläinsolujen käsittelyn oppiminen, soluviljely ja eläinsolujen ylläpito. Työssä tehtiin yksi bioreaktorikasvatus CHO-soluille ja yksi kasvatus HeLa-soluille. CHO-solujen kasvatus bioreaktorilla ei tässä työssä onnistunut. Onnistuneita tuloksia ei saatu muun muassa kontaminoitumisen vuoksi. HeLa-soluille tehtiin 10 vuorokauden kasvatus, jonka aikana osa soluista kerättiin pois bioreaktorista ja säilöttiin. Kasvatus HeLa-soluilla lähti hyvin käyntiin, mutta loppujen lopuksi prosessi jouduttiin pysäyttämään hiivasolukontaminaation vuoksi. Asiasanat: bioreaktori, CHO-solu, HeLa-solu, nisäkässolu, soluviljely 3
4 ABSTRACT Oulu University of Applied Sciences Degree Programme in Energy Technology (BSc), option of laboratory and environment Author: Minna Lempinen Title of thesis: Cultivation of Mammalian Cells in Bioreactor Supervisor: Eija Hakala Term and year when the thesis was submitted: Spring 2016 Pages: appendices Subject of this thesis was cultivation of mammalian cells in bioreactor. The aim of the thesis was commissioning of the bioreactor, which was intended for high density animal cell culturing. Part of this thesis was maintenance and propagation of CHO- and HeLa-cells. Determination of parameters for mammalian cell cultivation in bioreactor was also an important part of the job. Working part was started by familiarizing with operation of the bioreactor. Before starting bioreactor culture with cells, test drives were done. Essential part of this thesis was to learn to handle mammalian cells, their propagation and maintenance as well as to determine how dense cell cultures can be obtained by using the bioreactor. In this thesis one bioreactor culture for CHO-cells and one for HeLa-cells were completed. In this thesis bioreactor culture with CHO-cells did not succeed. The main reason for this was contamination. Culturing of with HeLa-cells succeeded better. During HeLa-cell cultivation, a portion of HeLa-cells were harvested and frozen. Bioreactor culturing with HeLa-cells started very well, but at the end of 10 day growth period, culture was terminated because of yeast contamination and overgrowth. Keywords: bioreactor, cell culture, CHO-cell, HeLa-cell, mammalian cell, 4
5 ALKULAUSE Työ tehtiin Oulun yliopistolle Biokemian ja molekyylilääketieteen tiedekunnalle. Oulun yliopistolla työn ohjaajana toimi Tuomo Glumoff. Myös Sakari Kellokumpu Oulun yliopistolta oli tiiviisti mukana opinnäytetyössä. Oulun ammattikorkeakoululta ohjaavana opettajana toimi Eija Hakala. Kiitos tästä mahdollisuudesta opinnäytetyön valvojalle Tuomo Glumoffille. Kiitos Sakari Kellokummulle avusta opinnäytetyön aikana. Kiitos soluviljelyyn perehdyttämisestä ja kaikesta saamastani avusta myös muulle työryhmälle, johon kuuluivat Deborah Harrus, Antti Hassinen, Fawzi Khoder Agha, Elham Khosrowabadi ja Imran Qadir. Lisäksi kiitokset Johanna Veijolalle perehdyttämisestä bioreaktorin käyttöön sekä Jussi Tuusalle ja Helmut Pospiechille ohjeista HeLasolujen suspensiokasvatukseen. Yleisesti haluan kiittää koko Oulun yliopiston Biokemian ja molekyylilääketieteen tiedekunnan henkilökuntaa kaikesta saamastani avusta opinnäytetyön aikana. Opinnäytetyön aikana olen oppinut paljon ja saanut ammatillista varmuutta. Opinnäytetyöprosessi on antanut paljon. Uuden oppiminen on myös vaatinut paljon aikaa ja voimavaroja. Ilman perheeni ja lähimmäisteni tukea prosessi olisi ollut moninkertaisesti haastavampaa. Erityisesti kiitos puolisolleni korvaamattomasta tuesta ja kannustuksesta kuluneen kevään aikana. Oulussa Minna Lempinen 5
6 SISÄLLYS TIIVISTELMÄ 3 ABSTRACT 4 ALKULAUSE 5 SISÄLLYS 6 SANASTO 8 1 JOHDANTO 11 2 BIOREAKTORI Ilmastusmoduuli Peristalttiset pumput Sekoittaja Lämpötilan säätö ph-sensori Happisensori UniVessel -kasvatussäiliö Poistoilmanjäähdytin 19 3 BIOREAKTORIN TESTIAJOT ph-sensorin kalibrointi Happisensorin kalibrointi ph-säädön testaus Säiliön autoklavointi 24 4 SOLUVILJELY Liuosten valmistus soluviljelyyn Solujen ylläpito ja jakaminen 28 5 BIOREAKTORIKASVATUS CHO-SOLUILLA Ensimmäinen kasvatus Solujen esivalmistelu ensimmäiseen kasvatukseen CHO-solujen lisäys ja kasvatus bioreaktorissa Ensimmäisen kasvatuksen lopetus CHO-solujen kasvatus suspensiossa 38 6 BIOREAKTORIKASVATUS HELA-SOLUILLA Suspensiokasvatus 41 6
7 6.2 Bioreaktorin valmistelu ja HeLa-solujen siirto bioreaktoriin HeLa-solujen bioreaktorikasvatus 46 7 POHDINTAA TYÖN AIKANA KOHDATUISTA HAASTEISTA 48 8 YHTEENVETO 52 LÄHTEET 54 LIITTEET 55 Liite 1 CHO-solujen bioreaktorikasvatuksen trendikuvaajat ph-arvolle, happiarvolle, lämpötilalle ja sekoitukselle Liite 2 Ohjeita Hela-solujen suspensiokasvatukseen Liite 3 HeLa-solujen bioreaktorikasvatuksen trendikuvaajat ph-arvolle, lämpötilalle ja sekoitukselle 7
8 SANASTO Air Overlay Air Sparger Autoklavointi CHO-solut DMEM Bioreaktorin ilmavirtaus, joka menee säiliön sisälle ilmatilaan. Mahdollisuus asettaa arvo prosentteina %. Bioreaktorin ilmavirtaus, joka menee säiliön nestepinnan alapuolelle. Voidaan asettaa arvo ccm. Autoklavointi eli lämminsterilointi tarkoittaa korkeassa lämpötilassa ylipaineessa tapahtuvaa sterilointia. Autoklavoimalla voidaan steriloida materiaaleja ja liuoksia, jotka kestävät korkeita lämpötiloja ja vesihöyryä. Autoklavointiin käytettävää laitetta kutsutaan autoklaaviksi. Useat soluviljelyssä tarvittavat välineet, kuten pipetinkärjet, steriloidaan autoklavoimalla. Chinese hamster ovary cells, hamsterin munasarjasoluista peräisin oleva solulinja. Peruselatusaineliuos soluille. Liuos sisältää solun kasvuun tarvittavia suoloja, aminohappoja, glukoosia ja vitamiineja. DMEM-liuoksia on saatavilla eri koostumuksilla eri tarkoituksiin. DMEM tulee sanoista Dulbecco s modified Eagle's medium. Fetal Bovine Serum (FBS) Naudan sikiöstä peräisin oleva seerumi, joka sisältää paljon soluille hyödyllisiä kasvutekijöitä. Seerumi sisältää proteiinien osia, jotka edesauttavat solujen kasvua. Käytetään soluviljelyssä solujen kasvun edistämiseksi. Markkinoilla seerumia on saatavilla useilta eri valmistajilta. 8
9 HeLa-solut Kontaminoituminen Medium PBS-liuos Henrietta Lacksin kohdunkaulansyövästä peräisin olevia soluja, joista käytetään nimitystä HeLa-solut. Soluja on käytetty laboratoriotutkimuksiin maailmanlaajuisesti. Kontaminoitumisella eläinsoluviljelyssä tarkoitetaan bakteerien, homeiden ja hiivojen ilmaantumista haluttuun solukasvustoon. Kontaminaatio on aina haitallinen ja solukasvusto on lopetettava. Solujen kasvatusliuos, joka sisältää solujen kasvun kannalta tärkeitä ravintoaineita. Medium valmistetaan aina käyttökohteen mukaisesti. Tässä työssä medium tehtiin lisäämällä DMEM-liuokseen Fetal Bovine - seerumia ja penisilliini-streptomysiiniä. Voidaan käyttää myös nimityksiä kasvatusmedium, kasvatusliuos tai ravinneliuos. Soluviljelyssä käytetty fosfaattiperustainen suolaliuos. Liuos on isotoninen ja myrkytön useimmille soluille. Voidaan käyttää solujen pesuun tai soluille käytettävien liuosten laimennukseen. Markkinoilla PBS-liuosta on saatavilla eri valmistajilta. Penicillin-Streptomycin Kaupallinen antibioottiliuos, joka sisältää penisilliini- ja streptomysiini-antibiootteja. Käytetään paljon soluviljelyssä suojaamaan soluja ei-toivotuilta bakteereilta. Penisilliini-streptomysiini tehoaa gram-positiivisia ja gramnegatiivisia bakteereja vastaan, mutta ei estä hiivojen tai homeiden kasvua. Resuspensointi Liuoksen sekoittaminen pipetillä niin, että liuosta nostetaan varovasti pipettiin ja lasketaan alas. Esimerkiksi sentrifugiputkessa oleva solupelletti resuspensoidaan mediumiin pipetoimalla mediumia edestakaisin pipetillä 9
10 hellävaraisesti muutaman kerran. Näin pohjalla oleva solupelletti hajoaa ja solut sekoittuvat mediumiin. rpm Suspensiokasvatus Trypsiini-EDTA Pyörimisnopeus, kierrosta minuutissa. Solujen kasvatus ilman tarttumispintaa nesteessä eli suspensiossa. Yleensä solut tarvitsevat tarttumispinnan jakautuakseen, mutta esim. syöpäsolut jakautuvat ilman kiinnittymistä. Trypsiini-EDTA-liuosta käytetään solujen irrottamiseen kasvualustalta. Trypsiini toimii irrottaen sidoksia joilla solut ovat kiinnittyneet alustaan. Jotkin proteiinit, joiden avulla solut ovat kiinnittyneet alustaansa, tarvitsevat toimiakseen kalsiumia. Nämä proteiinit saadaan irrotettua käyttämällä kalsiumia kelatoivaa EDTA:ta irrotukseen. Trypsiini-EDTA käsittelyn on oltava nopea, sillä liian pitkä vaikutusaika voi tappaa solut. Trypsiini- EDTA:n vaikutus voidaan pysäyttää lisäämällä soluille Fetal Bovine -seerumia sisältävää mediumia. 10
11 1 JOHDANTO Tämä opinnäytetyö tehdään Oulun yliopistolle biokemian ja molekyylilääketieteen tiedekunnalle. Työ tehdään tutkimusryhmälle, joka tutkii glykosylaation molekyylimekanismeja ja glykosylaation yhteyttä ihmisten sairauksiin, muun muassa syöpään. Tiedekunnan käyttöön tarkoitettu bioreaktori on ostettu vuonna Bioreaktori on ollut käyttämättömänä, ja tämän opinnäytetyön tavoitteena on ottaa bioreaktori käyttöön ja tehdä sillä nisäkässolukasvatuksia. Bioreaktorikasvatuksilla nisäkässoluja voidaan tuottaa riittävän isoja määriä proteiinien puhdistamista varten. Työssä määritetään parametreja nisäkässolukasvatuksiin bioreaktorilla. Bioreaktorikasvatuksissa käytetään hamsterin solulinjasta peräisin olevia CHO-soluja ja ihmisen kohdunkaulasyövästä peräisin olevia HeLa-soluja. Bioreaktorilla kasvatettuja soluja käytetään työryhmän tutkimuksissa. Bioreaktorikasvatuksilla on mahdollista kasvattaa suurempia määriä soluja kuin solujen kasvatuksessa maljalla. Nisäkässolut ovat kuitenkin vaativia kasvattaa ilman tarttumispintaa ja nisäkässolukasvatuksia bioreaktorissa on tiettävästi tehty melko vähän. Solut ovat hyvin herkkiä kontaminaatiolle, mikä lisää työn haastavuutta. Työskenneltäessä syöpäsolujen kanssa on myös kiinnitettävä erityistä huomiota työturvallisuuteen. Työn valvojana Oulun yliopistolla toimii Tuomo Glumoff. Ohjaavana opettajana Oulun ammattikorkeakoulusta toimii Eija Hakala. 11
12 2 BIOREAKTORI Työssä käytettiin Biotech Sartorius Stedim BIOSTAT B CC Single - bioreaktoria, johon kuuluu UniVessel -säiliö. Säiliön työskentelytilavuus on 1 litra. BIOSTAT B CC -bioreaktori on suunniteltu mikro-organismien ja eläinsolujen viljelyyn. Laite koostuu ohjausyksiköstä, neljästä peristalttisesta pumpusta, lämpötilan kontrollointimoduuleista, ilmastusmoduuleista, UniVessel -säiliöstä ja kolmilapaisesta sekoittajasta johon kuuluu irrotettava moottori. Bioreaktorin mittaus- ja ohjausjärjestelmän avulla voidaan kontrolloida, mitata ja seurata kasvatuksen eri parametreja, kuten lämpötilaa, ph- ja po2-arvoja. Kuvassa 1 on bioreaktorin ohjausyksikkö. Ohjausyksikön osat on numeroitu kuvassa 2. Osat on nimetty taulukkoon 1. (1, s ) KUVA 1 Bioreaktorin ohjausyksikkö (1, s. 26) 12
13 KUVA 2 Bioreaktorin ohjausyksikön osat numeroituna (1, s. 27) TAULUKKO 1 Kuvassa 2 numeroidut bioreaktorin ohjausyksikön osat nimettynä Osan numero kuvassa 2 Osan nimi 1 Operaattorin näyttö (kosketusnäyttö) 2 Pääkytkin 3 Virtaussäädin (rotametri) 3a 3b 3c 3d 3e Air Overlay Air Sparger O2 Sparger N2 Sparger CO2 Sparger 4 USB-liitäntä 5 Peristalttinen pumppu 13
14 2.1 Ilmastusmoduuli Bioreaktorin ilmastusmoduuleja käytetään kaasujen lisäämiseen säiliöön. Ilmastusmoduuleissa on paikka ilmansyötölle, typpi- ja happikaasujen syötöille ja hiilidioksidin syötölle. Kaikki kaasut lisätään reaktoriin kasvatusliuokseen Sparger -linjaston kautta. Ilmaa on lisäksi mahdollista lisätä myös säiliön sisälle ilmatilaan Overlay -linjaston kautta. Kaasujen virtausnopeutta voidaan säätää vaihtelevan alueen virtausmittarilla tai massavirtaussäätäjällä. (1, s. 30.) 2.2 Peristalttiset pumput Bioreaktorin ohjausyksikön etuosassa on neljä peristalttista pumppua, joiden avulla on mahdollista lisätä esimerkiksi happo- ja emäsliuosta, ravinteita ja vaahdonestoainetta säiliön sisälle. Liuosten syöttö tapahtuu silikoniletkujen avulla. Syötön voi kytkeä päälle ohjausyksiköstä, jolloin myös virtausnopeudelle asetetaan arvo yksikössä ml/min. Ohjausyksikön avulla voidaan sitoa esimerkiksi vaahdonestoaineen syöttö vaahtosensoriin. Tällöin laite lisää automaattisesti vaahdonestoainetta, mikäli säiliössä on liikaa vaahtoa. Samoin happo- ja emäsliuoksien sekä hiilidioksidin syöttö voidaan sitoa ph-arvoon. (1, s. 33.) 2.3 Sekoittaja Bioreaktorin säiliön sisällä on kolmilapainen sekoittaja. Kuvassa 3 on säiliön kansi irrotettuna säiliöstä. Kuvassa näkyy kanteen kiinnitettynä kolmilapainen sekoittaja, kaasunajoputki ja lämpötila-anturin tasku. Sekoittajaan kiinnitetään erillinen moottori säiliön ulkopuolelta. 14
15 KUVA 3 Kolmilapainen sekoittaja, lämpötilamittarin tasku ja kaasunajoputki Kuvassa 4 on sekoittajan moottori ja kuvassa 5 sekoittajan moottoria ollaan kiinnittämässä säiliön kanteen. Moottorin teho on 200 W ja suurin mahdollinen sekoitusnopeus on 2000 kierrosta minuutissa. Sekoittajan moottori on kytketty ohjausyksikköön ja sekoittajaa ohjataan ohjausyksikön avulla. (1, s. 36.) 15
16 KUVA 4 Sekoittajan mooottori (1, s. 36) KUVA 5 Sekoittajan moottorin kiinnitys (1, s. 57) 2.4 Lämpötilan säätö Laitteeseen on kytketty vesikierto, jonka avulla säädellään lämpötilaa. Vesikiertoa varten kudosvahvisteiset silikoniletkut on kytketty ohjausyksikköön, jonka 16
17 sisässä on vastukset veden lämmittämistä varten. Säiliötä ympäröi vaippa, jonka sisällä kulkee lämminvesikierto. Säiliön kannessa poistoilmanjäähdyttimeen on kytketty jäähdytysvesikierto. Lämpötilan mittaamiseen käytetään laitteeseen kuuluvaa lämpötila-anturia. Lämpötila-anturia varten säiliössä on erillinen tasku, johon lämpötila-anturi asennetaan säiliön steriloinnin jälkeen. Lämpötila-anturi ei ole suoraan kosketuksissa kasvatusliuoksen kanssa eikä sitä tarvitse steriloida. Pienin mahdollinen lämpötila säiliön sisällä on 8 C. Jos reaktorilla halutaan tehdä prosesseja tätä alhaisimmissa lämpötiloissa, on bioreaktoriin kytkettävä ulkoinen jäähdytysjärjestelmä. 2.5 ph-sensori Tässä työssä bioreaktorissa käytettiin Hamiltonin process-ph EASYFEM PLUS VP160 -ph-sensoria. Sensoria säilytettiin pakkauksen mukana tulleessa säilytysliuoksessa tai KCl-liuoksessa, jonka konsentraatio on 3 mol/l. ph-sensorin kuivumista on vältettävä. Mikäli sensori kuitenkin pääsee kuivumaan, voidaan se regeneroida upottamalla 10 minuutiksi NaOH-liuokseen, sitten 10 minuutiksi HCl-liuokseen ja lopuksi vähintään 15 minuutiksi säilytysliuokseen. Regeneroitiin käytetään NaOH- ja HCl-liuoksia, joiden konsentraatiot ovat 0,1 1 mol/l. (2.) ph-sensorin kalibrointiin käytettiin kaupallisia ph-kalibrointiliuoksia. Zero Value kalibroitiin käyttämällä ph 7 -kalibrointiliuosta, jolle jännitteen suositusarvo on mv. Slope Value kalibroitiin käyttämällä ph 4 -kalibrointiliuosta. Kalibroinnit ph-sensorille suoritettiin ennen säiliön autoklavointia. ph-sensori autoklavoitiin säiliön mukana ja se voidaan autoklavoida noin 30 kertaa. Autoklavoinnin jälkeen ph-mittari yhdistettiin ohjausyksikköön. (1, s. 122.) Ohjausyksiköstä asetettiin ph:lle tavoitearvo. Jos ph nousee liian korkealle, laite lisää happoliuosta tai vaihtoehtoisesti hiilidioksidia, mikäli happoliuosta ei käytetä. Mikäli ph laskee liian alas, laite lisää emäsliuosta, jos emäsliuos on käytössä. Laitteen testiajoissa kokeiltiin happo- ja emäsliuosten lisäystä, mutta kasvatusten aikana ei käytetty happo- ja emäsliuoksia. Kasvatusten ajan happo ja emäs- 17
18 liuoksia ei ollut kytketty laitteeseen ja ne suljettiin ohjausyksiköstä Main - valikosta. 2.6 Happisensori Bioreaktorissa käytettiin Hamilton OxyFerm TM O 2 FDA VP160 happisensoria, joka autoklavoitiin säiliön mukana. Sensori kestää noin 30 autoklavointikertaa. Ohjeiden mukaan happisensorin kalibrointiin tulisi käyttää typpi- ja happikaasuja. Tässä työssä bioreaktoriin ei ollut kytketty typpi- ja happilinjastoja. 0- prosenttinen happi mitattiin säiliöstä autoklavoinnin jälkeen jolloin säiliön tila oli mahdollisimman vähähappinen. 100-prosenttinen happi mitattiin säiliön nesteestä, kun sitä oli ilmastettu runsaasti. 2.7 UniVessel -kasvatussäiliö Bioreaktorin kasvatussäiliönä käytettiin kuvassa 6 olevaa lasista UniVessel - kasvatussäiliötä. Säiliön suurin työskentelytilavuus on 1 litra ja pienin työskentelytilavuus on 0,4 litraa. Säiliöön yhdistettäviä osia ovat poistoilmanjäähdytin, lämpötila-anturi, ph-sensori, happisensori, vaahtoanturi, sekoittaja ja sekoittajan moottori sekä silikoniletkuilla yhdistetyt suodattimet meno- ja tuloilmalle. (3, s ) 18
19 KUVA 6 UniVessel -kasvatussäiliö (3, s. 1) Säiliöön voidaan yhdistää 250 millilitran lasipullot happo- ja emäsliuoksen tai vaahdonestoaineen syöttöä varten. Pulloille on oma teline, joka kiinnitetään säiliön kylkeen jolloin autoklavointi on helpompaa. Liuosten syöttö tapahtuu silikoniletkujen kautta. Lisäksi säiliöön voitiin asettaa erillinen näytteenotin. (3, s ) 2.8 Poistoilmanjäähdytin Bioreaktorissa jäähdytys tapahtuu vesikierrolla varustetulla poistoilmanjäähdyttimellä, joka on kuvassa 7. Poistoilmanjäähdyttimessä kiertää jäähdytysvesi, jonka reaktori syöttää jäähdyttimeen tasaisella virtausnopeudella. Jäähdytysveden lämpötila riippuu säiliölle asetetusta lämpötila-arvosta. Jäähdytysvesikierto poistoilmanjäähdyttimeen on kytketty kudosvahvisteisilla silikoniletkuilla, jotka on varustettu pikaliittimillä. (3, s ) 19
20 KUVA 7 Poistoilmanjäähdytin (3, s. 65) Poistoilman kosteus tiivistyy poistoilmanjäähdyttimen sisäputkeen, jonka ulkopuolella jäähdytysvesi kiertää. Poistoilmanjäähdytin alentaa poistoilman kosteutta, vähentää suodattimen tukkeutumisriskiä ja kosteuden haihtumista. Jos jäähdyttimeen liitetty ulostulosuodatin on tukkeutunut, sisäinen paine voi kasvaa, ja tämä voi aiheuttaa haittaa kasvatukselle tai turvallisuusvaaran. Poistoilmanjäähdytin oli kiinnitetty säiliön kanteen ja se autoklavoitiin säiliön mukana. (3, s ) 20
21 3 BIOREAKTORIN TESTIAJOT Ennen solukasvatuksien aloittamista bioreaktorille tehtiin testiajoja. Testiajoissa ei käytetty soluja ja liuoksena käytettiin steriiliä PBS-puskuriliuosta ja biokarbonaattipitoista vesiliuosta. Testiajojen aikana opeteltiin bioreaktorin säätöjen asettamista ja sensoreiden kalibrointia. Bioreaktorihuoneen tasot, kaapistot ja laminaarikaappi puhdistettiin perusteellisesti. Laitteen toimintaperiaatteeseen tutustuttiin lukemalla sen ohjekirjoja. Käytön aloituksessa oli mukana Oulun yliopiston tutkija Johanna Veijola, joka oli tehnyt bioreaktorikasvatuksia bakteerisoluille. Tässä työssä käytettävä reaktori on tarkoitettu eläinsolukasvatuksille ja se on varustettu hiilidioksidin syötöllä. Nisäkässolukasvatuksia bioreaktorilla ei ollut ennen tehty Oulun yliopistolla. Säiliön kansi kiinnitettiin paikalleen ja bioreaktori käynnistettiin pääkytkimestä. Sekoittajan moottori kiinnitettiin sekoittajaan. Sekoittajaa testattiin asettamalla sille eri nopeuksia ohjausyksiköstä. ph- ja happisensorit otettiin pakkauksistaan ja yhdistettiin ohjausyksikköön. Koska ph- ja happisensorit on hyvä pitää koko ajan nesteessä, lisättiin bioreaktoriin 500 ml PBS-puskuriliuosta. ph- ja happisensoreille oli omat portit säiliön kannessa, joiden kautta ne asetettiin säiliöön. Vaahtosensori yhdistettiin ohjausyksikköön ja asetettiin paikalleen säiliöön. Lämpötila-anturi kytkettiin ohjausyksikköön ja asetettiin lämpötila-anturille tarkoitettuun taskuun. Overlay ja Sparger -kaasulinjastot yhdistettiin silikoniletkuilla ohjausyksiköstä säiliöön. Silikoniletkuihin asetettiin suodattimet ja letkunkiristimet. Poistoilmanjäähdyttimeen asetettiin suodatin silikoniletkun avulla. Jäähdyttimeen liitettiin jäähdytysvesikierto. Myös säiliön vaipan ympäri kulkeva lämminvesikierto yhdistettiin. Vesikierrot liitettiin kudosvahvisteisella letkulla. Bioreaktorin testauksen aikana sitä ei autoklavoitu, sillä sensoreita ei haluttu kuluttaa turhaan. Ennen jokaista kasvatusta bioreaktorin säiliö steriloitiin autoklavoimalla. Kasvatusten jälkeen tehtiin jäteautoklaavaus ja sen jälkeen säiliö ja sen osat puhdistettiin. Jotta sensorit eivät kuivuisi, säiliö autoklavoitiin aina niin, että sinne oli lisätty nestettä. 21
22 Testauksessa PBS-liuoksella reaktoria pidettiin päällä useiden vuorokausien ajan ja olosuhteita muunneltiin ja tarkkailtiin. Vesikierto käynnistettiin ja testattiin lämpötilaa. Lämpötilaksi asetettiin 37 C. Kun laite alkoi lämmittää säiliötä, ohjausyksikössä oleva termostaatti lämpeni 50 C:seen asti. Tarkkailtiin, että säiliön lämpötila ei ylitä 37 C:ta, sillä ylemmät lämpötilat voivat olla soluille tappavia. Säiliön lämpötila ei kuitenkaan ylittänyt annettua arvoa ja ohjausyksikön sisäinen termostaatti laski nopeasti lämpötilaa heti, kun säiliön tavoitelämpötila lähestyi. Kun säiliön lämpötila oli noussut asetettuun arvoon, lämpötila pysyi tasaisena. 3.1 ph-sensorin kalibrointi Sensori kalibroitiin käyttämällä kaupallisia ph 4 ja ph 7 -puskuriliuoksia. Taulukkoon 2 on koottu ph-sensorin kalibroinnin mittaustulokset. Ohjekirjan mukaan suositus Zero Value -arvolle on sensorista riippuen -30 mv 30 mv (1, s. 118). Kalibroinnissa saadut mittaustulokset ph 7 -puskurille ovat suositusarvojen sisällä. TAULUKKO 2 ph-mittarin kalibroinnin mittaustulokset Pvm Zero Value, ph 7 (mv) Slope Value ph 4 (mv) , ,2 177, ,2 183, , Happisensorin kalibrointi Ohjeiden mukaan 0-prosenttinen happi kalibroidaan lisäämällä säiliöön paljon typpeä ja 100-prosenttinen happi kalibroidaan lisäämällä säiliöön happea. Tässä työssä ei käytetty typpi- ja happikaasuja. Happisensorin 0-arvo kalibroitiin autoklavoinnin jälkeen, jolloin säiliössä olisi mahdollisimman vähähappinen tila. 22
23 100-prosenttisen happiarvon kalibrointi tehtiin lisäämällä reaktoriin runsaasti ilmaa ja sekoitusta. Suositeltava kalibrointiarvo 0-prosenttiselle hapelle on 0 10 na prosenttiselle hapelle suositeltava kalibrointiarvo oli noin 60 na. Happisensorin tuli olla kytkettynä ohjausyksikköön 2 tuntia ennen kalibrointia. (1, s ) Bioreaktorin testauksen aikana happisensori kalibrointia kokeiltiin niin, että 0- prosenttinen happiarvo mitattiin autoklavoidusta vedestä, johon oli lisätty typpikaasua 15 minuutin ajan. 100-prosenttinen happi mitattiin autoklavoidusta vedestä, johon oli lisätty paineilmaa 15 minuutin ajan. Tätä kalibrointia varten happisensori piti irrottaa säiliöstä. Happisensoria ei voitu kuitenkaan kalibroida tällä tavalla solukasvatuksissa, sillä happisensoria ei voida irrottaa säiliöstä autoklavoinnin jälkeen kontaminaatioriskin vuoksi. Taulukkoon 3 on koottu happisensorin kalibroinnin mittaustulokset. Arvot mitattiin vedestä, jota oli typetetty ja hapetettu. Saadut arvot eivät ole suositusarvojen puitteissa. Tämä johtunee siitä, että puhtaita typpi- ja happikaasuja ei lisätty tiiviiseen säiliöön ohjeiden mukaan. TAULUKKO 3 Happisensorin kalibroinnin mittaustulokset Pvm 100 % (na) 0 % (na) ,0 29, ,4 29, ,5 25, ,5 25,5 3.3 ph-säädön testaus ph-säädön testausta varten happo- ja emäslinjastot kytkettiin säiliöön. Happoliuoksena käytettiin HCl-liuosta jonka konsentraatio oli 0,5 mol/l. Emäsliuoksena käytettiin NaOH-liuosta, jonka konsentraatio oli 0,5 mol/l. Happo- ja emäsliuos- 23
24 ten syöttö tapahtui silikoniletkun avulla peristalttisen pumpun kautta. Ohjausyksiköstä voitiin säätää liuosten virtausnopeutta. Ohjausyksikön kautta pumput kalibroitiin. Säätöjä testattiin asettamalla eri ph-arvoja, jolloin laite automaattisesti lisäsi säiliöön joko happoa tai emästä tavoitearvojen mukaan. Kun haponsyöttö kytkettiin pois päältä, laite lisäsi hiilidioksidia alentaakseen ph:ta. PBS-puskuriliuoksella hiilidioksidi ei vaikuttanut ph-arvoon, joten testiliuos vaihdettiin biokarbonaatti-pitoiseen vesiliuokseen, joka oli enemmän solukasvatuksissa käytettävän mediumin kaltainen. Liuos valmistettiin liuottamalla veteen kaliumkloridia, natriumvetykarbonaattia, natriumdivetyfosfaattia ja natriumkloridia. Liuoksessa käytettiin samoja ainemääriä, joita soluviljelyssä käytetty DMEM-liuos sisälsi, ja ne on esitetty taulukossa 4. (4.) TAULUKKO 4 Bikarbonaattipitoisen vesiliuoksen reagenssien ainemäärät (4) Reagenssin nimi Ainemäärä mm Natirumvetykarbonaatti, NaHCO 3 44,05 Natriumdivetyfosfaatti NaH 2 PO 4 0,92 Kaliumkloridi, KCl 5,33 Natirumkloridi, NaCl 110,34 ph-arvon alentaminen hiilidioksidilla onnistui, kun käytettiin valmistettua bikarbonaattipitoista liuosta. Hiilidioksidin virtausnopeutena oli tehdasasetuksena 8 l/min. Hiilidioksidin virtausnopeudeksi asetettiin 0,1 l/min. ph-arvon säätöä hiilidioksidin avulla kokeiltiin myös pienemmällä virtausnopeudella, ja se onnistui hyvin. 3.4 Säiliön autoklavointi Nisäkäskasvatuksille tarvittiin ehdottoman steriilit kasvatusolosuhteet, sillä epäpuhtaudet voivat olla haitaksi soluille ja johtaa kasvatuksen epäonnistumiseen. Sterilointi säiliölle tehtiin autoklavoimalla. 24
25 Ennen kasvatusta säiliölle tehtiin puhdasautoklaavaus, jolla varmistettiin puhtaat olosuhteet kasvatukselle. Kasvatuksen jälkeen solujätteet steriloitiin autoklavoimalla, koska työssä käytettiin transformoituja ja syöpäsoluja, jotka luokitellaan biologisiksi vaaratekijöiksi. Myös valmistajan ohjeet velvoittivat jätteiden autoklavointiin. Jäteautoklavoinnin jälkeen säiliö avattiin ja puhdistettiin pesemällä ja harjaamalla. Kuvassa 8 säiliön puhdistus on parhaillaan käynnissä. Puhdistuksen jälkeen säiliö steriloitiin uudelleen autoklavoimalla, jonka jälkeen se oli valmis seuraavalle kasvatukselle. Autoklavointi tehtiin yliopiston välinehuollossa ja sen suoritti välinehuollon henkilöstö. Bioreaktorin käyttäjän tehtävänä oli valmistella säiliö autoklavointia varten. (1, s ; 3, s ) KUVA 8 Säiliön puhdistusta Autoklavointia varten säiliö kytkettiin irti ohjausyksiköstä. Ennen säiliön irrottamista tarkistettiin, että vesikierto ja ilman- ja hiilidioksidinsyöttö oli suljettu. Säiliön kannessa olevaan poistoilmanjäähdyttimeen oli kytketty suodatin silikoniletkun avulla. Autoklavoinnin ajaksi poistoilmanjäähdyttimen silikoniletkua ei saanut sulkea. Mikäli letku tai suodatin on tukossa, säiliöön kertyy painetta ja lasisäiliö voi räjähtää. Autoklavoinnin aikana poistoilmanjäähdytin ja siihen liitetty suodatin varmistivat steriilin paineentasauksen säiliössä. Ennen autoklavointia varmistettiin, että poistoilman letku on auki eikä sitä ole suljettu kiristimin. Poistoilman suodattimen tuli olla ehjä, kuiva ja puhdas. Suodatin testattiin ruiskulla 25
26 puskemalla ilmaa suodattimen läpi. Mikäli ilma ei kulkenut suodattimen läpi, oli suodatin tukossa ja se piti vaihtaa uuteen. Työn aikana selvisi, että suodattimien kunto kannattaa testata myös autoklavoinnin jälkeen. (1, s ; 3, s ) Ennen autoklavointia tarkistettiin, että kaasujen syöttöletkujen suodattimet olivat kunnossa. Kaasujen syöttöletkut suljettiin autoklavoinnin ajaksi kiristimillä, millä vältettiin nesteen nouseminen suodattimeen autoklavoinnin aikana. ph-, happi- ja vaahtosensorin kytkentäjohdot ohjausyksikköön kytkettiin irti. Sensorien päät suojattiin autoklavoinnin ajaksi alumiinifoliolla. Lämpötilamittari irrotettiin säiliöstä ja sen paikka suojattiin foliolla. Poistoilmanjäähdyttimestä irrotettiin jäähdytysvesiletkut. Säiliön sivuilta kytkettiin irti lämmitysvesiletkut. Mikäli happo- ja emäslinjastot olivat käytössä ja ne haluttiin autoklavoida säiliön mukana, niiden kytkennät tarkastettiin. Kaikki osat tarkistettiin ja kiristettiin käsin. Puhdasautoklaavauksessa säiliön kansi peitettiin foliolla. Näin pyrittiin pitämään säiliön kansi mahdollisimman puhtaana autoklavoinnin jälkeenkin. Säiliössä tuli olla nestettä aina autoklavoinnin aikana. Autoklavointia ei voida tehdä kasvatusmediumin kanssa, koska sen sisältämät kasvutekijät saostuvat jo 50 C:ssa. Tämän vuoksi autoklavointi tehtiin yleensä lisäämällä säiliöön bioreaktorin testauksessa valmistettua biokarbonaattipitoista liuosta. Säiliön kuljettaminen ja siirteleminen tehtiin turvallisesti ja varovaisuutta noudattaen. Kuljetuksen ajaksi säiliö siirrettiin sille tarkoitettuun metallikaukaloon ja kuljetukseen käytettiin työkaluvaunuja. Autoklavoinnin jälkeen tarkistettiin, että säiliön osat olivat ehjiä ja etteivät kiristykset olleet löystyneet. Kaasujen syöttöletkujen kiristykset löysättiin. Säiliö ja sen osat yhdistettiin ohjausyksikköön ja liitokset kytkettiin takaisin paikoilleen. 26
27 4 SOLUVILJELY Solujen kasvattamista laboratorio-olosuhteissa kutsutaan soluviljelyksi. Tällöin solujen kasvuympäristön ph, ravinteet ja lämpötila on säädelty. (5.) Soluja on mahdollista kasvattaa kiinteällä alustalla ja suspensiossa. Suspensiossa soluilla ei ole kasvualustaa vaan ne kasvavat kasvatusliuoksessa. Suspensiokasvatuksissa saadaan suurempia solumääriä kuin kasvatuksissa solumaljoilla. Eläinsolulinjojen suspensiokasvatuksessa on omat haasteensa, sillä monet eläinsolulinjat eivät kykene kasvamaan ilman kiinnitysalustaa. Lisäksi eläinsolut, erityisesti nisäkässolut, ovat herkempiä rikkoutumaan ja kasvavat hitaammin kuin esimerkiksi bakteerisolut (5). Nisäkässolut jakautuvat keskimäärin kerran vuorokaudessa. Tässä työssä soluja kasvatettiin aluksi kiinteällä alustalla soluviljelymaljoissa. Bioreaktorikasvatuksen tavoite oli saada nisäkässolut kasvamaan onnistuneesti suspensiossa bioreaktorissa. 4.1 Liuosten valmistus soluviljelyyn Kasvatusliuosta eli kasvatusmediumia käytettiin solujen kasvatuksessa. Liuos sisältää ravinteita joita solut tarvitset jakautuakseen. Kasvatusliuos valmistettiin liuottamalla 445 ml DMEM-elatusaineliuokseen 50 ml Fetal Bovine -seerumia ja 5 ml penisilliini-streptomysiiniä. Työssä käytettiin Gibcon DMEM(1x)+Glutamax TM -elatusaineliuosta, Gibcon Fetal Bovine -seerumia ja Sigma Aldrichin soluviljelyyn tarkoitettua Penisillini-Streptomysiini-seosta. (6.) PBS-liuosta käytettiin solujen pesemiseen solujen jakamisen yhteydessä. PBSliuos valmistettiin lisäämällä 270 ml:aan autoklavoitua vettä 30 ml Gibcon 10xPBS-puskuriliuosta. (6.) Kasvaessaan solumaljoilla solut kiinnittyvät maljan pohjaan. Solujen jakamisen yhteydessä solut piti kuitenkin saada irrotettua maljan pohjalta, jotta ne voitiin siirtää uuteen maljaan ja jakaa useille eri maljoille. Solujen irrottamiseen maljan 27
28 pohjalta käytettiin Sigma Aldrichin Trypsiini-EDTA-liuosta, joka laimennettiin PBS-liuoksella. (5; 6.) 4.2 Solujen ylläpito ja jakaminen CHO-solut ovat peräisin hamsterin solulinjasta, ja niitä käytetään paljon biologisissa ja lääketieteellisissä tutkimuksissa. Koko opinnäytetyön ajan CHO-soluja ylläpidettiin ja jaettiin. Solujen ylläpito tarkoittaa sitä, että solut pidettiin elinvoimaisina, niiden jakautumista seurattiin ja niille annettiin ravinteita riittävän usein. Kun soluviljelymalja kasvoi täyteen, se täytyi jakaa. Solumaljan jakamisväli oli yleensä 2 4 vuorokautta. Mikäli solumaljaa ei jaeta tarpeeksi usein, maljat kasvavat täyteen soluja, jolloin soluilta loppuu elintila ja ravinteet ja ne alkavat kuolla. Solumalja tarkistettiin päivittäin mikroskoopilla, ja kun maljasta noin 80 % oli täynnä soluja, se oli valmis jaettavaksi. (6.) CHO K1 -soluampulli haettiin nestetyppisäiliöstä ja sitä lämmitettiin hetki +37 C:n lämpöisessä vesihauteessa. Soluampulliin lisättiin 2 ml kasvatusmediumia ja se jaettiin kolmelle steriilille soluviljelymaljalle. Työssä käytettiin soluviljelymaljoja, joiden halkaisija oli 9 cm. Maljaa huljutettiin varovasti, jotta solut levittäytyvät koko maljalle. Maljoja tarkasteltiin mikroskoopilla ja havaittiin, että solut olivat levittäytyneet koko maljalle, ja ne siirrettiin kasvatukseen hiilidioksidiinkubaattoriin. Työssä käytettiin hiilidioksidi-inkubaattoria, jossa lämpötila oli +37 C ja hiilidioksidipitoisuus 5 %. Solujen annettiin kasvaa maljalla 2 3 vuorokautta. Seuraavana päivänä solumaljoja tarkasteltiin mikroskoopilla ja havaittiin, että solut olivat alkaneet jakautua onnistuneesti. Soluja kasvoi pienissä rykelmissä ympäri maljaa. Suurin osa soluista oli kiinnittynyt pohjaan, mutta jotkin solut eivät olleet kiinnittyneet vaan kelluivat kasvatusliuoksessa. Kasvatusmediumin havaittiin olevan solumaljoissa punaista. Jos kasvatusmedium vaihtaa värinsä keltaiseksi, on maljassa tapahtunut happamoitumista, jolloin malja on voinut kasvaa liian täyteen soluja. Mikäli mediumin väri vaihtuu violetiksi, on se merkki emäksisyydestä ja johtuu useimmiten homekontaminaatiosta tai liian korkeasta hiilidioksidipitoisuudesta inkubaattorissa. 28
29 Jotta solut saisivat lisää ravintoaineita, maljoilta poistettiin vanha kasvatusmedium ja uutta mediumia lisättiin 10 ml. Solumaljat siirrettiin takaisin hiilidioksidiinkubaattoriin. Solumaljoja tarkasteltiin päivittäin mikroskoopilla. Kun solut olivat kasvaneet kolme vuorokautta, havaittiin, että maljat olivat kasvaneet melkein täyteen ja ne voitiin jakaa. Maljoilta poistettiin vanha kasvatusliuos ja solut pestiin kaksi kertaa PBSliuoksella. Maljoille lisättiin 2 ml Trypsiini-EDTA-liuosta ja maljoja inkuboitiin hiilidioksidi-inkubaattorissa 5 10 minuuttia. Solut siirrettiin 15 ml:n sentrifugiputkiin, joihin lisättiin 2 ml kasvatusliuosta. Sentrifugiputkia sentrifugoitiin 4 minuutin ajan. Työssä käytettiin sentrifugia, jolle oli asetettu nopeudeksi 800 rpm ja lämpötilaksi +22 C. Tyypillinen sentrifugointiaika oli 4 minuuttia. Sentrifugoinnin jälkeen solut olivat painuneet sentrifugiputken pohjalle ja yllä oleva kasvatusliuos pipetoitiin pois varoen. Sentrifugiputkiin lisättiin 2 ml kasvatusmediumia, johon putken pohjassa oleva solunappi resuspensoitiin. (6.) Soluja sisältävää mediumia pipetoitiin 1 ml steriilille soluviljelymaljalle. Maljoja tehtiin kolme kappaletta ja jokaiseen lisättiin 8 ml kasvatusmediumia. Solumaljat siirrettiin kasvamaan hiilidioksidi-inkubaattoriin. Maljoja seurattiin päivittäin. Kun solut olivat jakaantuneet tarpeeksi, ne jaettiin jälleen samaan tapaan. Kuvassa 8 on kolme soluviljelymaljaa, joissa on CHO-soluja ja 8 ml mediumia. CHOsolujen lisäksi työssä käytettiin HeLa-soluja, joiden ylläpito ja jakaminen tehtiin kuten edellä kuvattiin. KUVA 9 CHO-solumaljoja 29
30 5 BIOREAKTORIKASVATUS CHO-SOLUILLA Ensimmäinen bioreaktorikasvatus tehtiin CHO K1-soluilla. Soluja oli kasvatettu maljoilla, joista ne siirrettiin kasvamaan bioreaktoriin suspensioon. Kasvatuksissa ei käytetty vaahtoamista estäviä aineita, sillä vaahdonestoaineista voi olla nisäkässoluille enemmän haittaa kuin hyötyä. Tämän vuoksi myöskään vaahtoanturia ei kasvatuksissa käytetty. Ensimmäiset kasvatukset haluttiin pitää mahdollisimman yksinkertaisina. Vaahtoanturia ja vaahdonestoaineita voidaan kokeilla myöhemmissä kasvatuksissa, mikäli ensimmäiset kasvatukset saadaan sujumaan hyvin. 5.1 Ensimmäinen kasvatus Autoklavoinnin jälkeen ph- ja happisensori yhdistettiin ohjausyksikköön. Happisensori kalibroitiin, kun se oli ollut yhdistettynä ohjausyksikköön kaksi tuntia. Happisensorille kalibroitiin arvot 0-prosenttiselle ja 100-prosenttiselle hapelle. 0- prosenttinen happiarvo kalibroitiin säiliön sisällä olevasta liuoksesta autoklavoinnin jälkeen ilman että sekoitus tai ilmavirtaukset olivat päällä. Tällöin oletettiin säiliössä olevan mahdollisimman vähähappinen tila. 100-prosenttinen happiarvo kalibrointiin niin, että ennen mittausta bioreaktorille asetettiin puoleksi tunniksi seuraavat arvot: sekoitus 700 rpm Air Overlay 100% Air Sparger 225 ccm lämpötila +37 C. Näin saatiin mahdollisimman runsashappinen tila bioreaktoriin. Taulukossa 5 on esitetty happisensorin kalibrointitulokset. 30
31 TAULUKKO 5 Happisensorin kalibrointitulokset Kalibroitu happiarvo Tulos 0% happi 46,8 na 100% happi 77,8 na Reaktorissa oleva liuos poistettiin pipetoimalla ja sinne lisättiin 500 ml kasvatusliuosta. Ennen solujen lisäämistä säiliöön olosuhteiden tulee olla mahdollisimman hyvät ja otolliset solujen kasvulle. Säiliön lämpötilaksi asetettiin sama lämpötila, jota soluille käytetään koko kasvatuksen ajan eli +37 C. Kasvatusmediumin annettiin lämmetä kaksi tuntia ennen solujen lisäystä. Air Spargerille asetettiin arvo 225 ccm ja Air Overlaylle 100 % ja sekoitusnopeudeksi asetettiin 500 rpm. Näin olosuhteet saatiin mahdollisimman happipitoisiksi soluja varten. Kuvassa 10 bioreaktori on valmiina solujen lisäystä varten ja mediumin lämmitys ja ilmastus on parhaillaan käynnissä. Juuri ennen solujen lisäystä bioreaktorin ohjausyksiköstä reaktorille asetettiin taulukon 6 mukaiset arvot eri parametreille. Taulukon 6 arvoja käytettiin koko kasvatuksen ajan. 31
32 KUVA 10 Mediumin lämmitystä ennen solujen lisäystä TAULUKKO 6 CHO-solujen kasvatuksessa bioreaktorille asetetut arvot Asetettu arvo Rajat Sekoitus 100 rpm rpm Air Overlay 50 % 0% 100% Air Sparger 50 cmm ccm ph 7,3 7,2 7,5 Lämpötila 37 C 36,5 C 37,5 C Happipitoisuus 95 % % 32
33 Hiilidioksidin lisäys riippui kasvatusliuoksen ph:n arvosta. Kasvatuksessa ei käytetty happo- tai emäsliuoksia happamuuden säätöön vaan happamuutta säädettiin hiilidioksidin avulla. Mikäli ph ylitti arvon 7,3, reaktori lisäsi säiliöön hiilidioksidia, jonka avulla ph-arvo aleni Solujen esivalmistelu ensimmäiseen kasvatukseen Kaksi vuorokautta ennen reaktorikasvatuksen aloitusta CHO-solut jaettiin 12 solumaljalle. Ennen kuin sentrifugoidut solut siirrettiin maljoille, niistä otettiin 10 mikrolitran näytteet solutiheyden määritystä varten. Solut jaettiin 12 solumaljalle niin, että jokaiselle maljalle lisättiin 0,5 ml mediumia, johon solut olivat resuspensoitu. Solutiheydet mitattiin jokaiselle maljalle. Tulokset on esitetty taulukossa 7. Keskimäärin yhdellä maljalla oli 3 miljoonaa solua. Elävien solujen prosentti oli jokaisessa näytteessä korkea, yli 90 %. TAULUKKO 7 Maljojen solutiheydet ennen jakamista Solutiheys /ml Eläviä Solujen yhteismäärä maljalla Malja 1 2,47 x % 4,94 x 10 6 Malja 1 2,29 x % 4,58 x10 6 Malja 2 1,44 x % 2,88 x 10 6 Malja 2 1,30 x % 2,6 x 10 6 Malja 3 1,00 x % 2,00 x 10 6 Malja 3 6,45 x % 12,9 x 10 5 Keskiarvo 1,52 x % 3,03 x
34 5.1.2 CHO-solujen lisäys ja kasvatus bioreaktorissa Soluja oli kasvatettu 12 maljalla hiilidioksidikaapissa 2 vuorokautta. Vanha kasvatusliuos poistettiin, solut pestiin kaksi kertaa PBS-liuoksella ja irrotettiin pohjasta Trypsiini-EDTA-liuoksella. Solut siirrettiin sentrifugiputkiin, joihin lisättiin 2 ml kasvatusliuosta. Putkia sentrifugoitiin 4 minuutin ajan, jolloin solut painuivat putken pohjaan solunapiksi. Solujen yllä oleva neste poistettiin varovasti ja putkiin lisättiin 2 ml kasvatusliuosta. Neljä putkea valittiin satunnaisesti ja niistä otettiin 10 mikrolitran näyte solutiheyden määritystä varten. Mittaustulokset on esitetty taulukossa 8. Tuloksille laskettiin keskiarvot ja keskihajonta. Mitatuista solutiheyksistä havaittiin, että suurimmalla osalla maljoista elävien solujen määrä oli hyvä. Pienin prosentti eläville soluille oli 38 %. Tätä lukuun ottamatta muiden maljojen osuus eläville soluille oli %. Mittaustulosten perusteella yhdellä maljalla olisi keskimäärin solua. Bioreaktorikasvatukseen käytettäviä solumaljoja oli 11 kappaletta, jolloin soluja lisättiin reaktoriin noin 7 miljoonaa. Yksi solumalja säästettiin jatkokasvatusta varten. 34
35 TAULUKKO 8 Maljoilta mitatut solutiheydet ennen solujen siirtämistä reaktoriin Solutiheys / ml Eläviä Solujen yhteismäärä maljalla Malja1 3,64 x % 7,28 x10 5 Malja 1 2,76 x % 5,52 x10 5 Malja 2 1,29 x % 2,58 x10 5 Malja 2 1,88 x % 3,76 x10 5 Malja 3 4,11 x % 8,22 x10 5 Malja 3 4,63 x % 9,26 x10 5 Malja 4 5,75 x % 11,5 x10 5 Malja 4 5,81 x % 3,81 x10 5 Keskiarvo 3,73 x % 6,49 x 10 5 Yhden sentrifugiputken solut jaettiin normaaliin tapaan soluviljelymaljalle. Muiden putkien solut lisättiin bioreaktoriin, jossa kasvatusliuosta oli lämmitetty ja ilmavirtaus oli kytketty päälle kahden tunnin ajaksi. Tavoitteena oli kasvattaa soluja reaktorissa noin 10 päivää tai siihen asti kunnes solutiheys on tarpeeksi korkea. Kasvatuksesta otettiin näytteitä säännöllisesti ja kasvatukseen lisättiin joka toinen päivä 100 ml kasvatusmediumia, jotta solut saivat säännöllisesti lisää ravintoaineita kasvaakseen. Näytteenoton ajaksi sekoittaja suljettiin ja säiliössä olevaa mediumia resuspensoitiin pipetillä, jotta solut olisivat mahdollisimman hyvin sekoittuneita. Reaktorista otettiin 10 ml:n näyte, joka sentrifugoitiin. Solut painuivat sentrifugiputken pohjaan, ja päällä oleva liuos pipetoitiin varovasti pois. Putken pohjalla oleva solunappi resuspensoitiin 1 ml:aan mediumia. Tästä otettiin edelleen 10 mikro- 35
36 litran näyte solutiheyden määritystä varten. Ensimmäisinä päivinä mitatut solutiheydet on koottu taulukkoon 9. Toisena päivänä otetuissa näytteissä elävien solujen prosenttiosuus oli pienentynyt. Solulaskuri näytti välillä jopa elävien solujen prosentiksi 0 %. Kasvatuksesta otettiin uudet näytteet ja näytemäärää päätettiin muuttaa. 1 ml:n näytteen sijasta otettiin 10 ml:n näyte. Elävien solujen prosentit olivat parempia, mutta solutiheyden oletettiin olevan suurempi. TAULUKKO 9 CHO-bioreaktorikasvatuksesta mitatut solutiheydet Kasvatus käynnissä, vuorokautta Näytteen suuruus (ml) Mittaustulosten keskiarvo, solutiheys / ml Keskihajonta Eläviä soluja (%) Solujen määrä säiliössä 1 1 1,32 x ,1 x ,6 x ,91 x ,4 x ,6 x ,68 x ,4 x ,0 x 10 6 Kolmantena vuorokautena säiliöön lisättiin 100 ml mediumia. Lisäyksen jälkeen kasvatuksesta otettiin näyte. Mitatut solutiheydet on koottu taulukkoon 10. Tulosten perusteella soluja olisi 10 millilitran näytteessä keskimäärin 8, , jolloin niitä olisi 600 millilitran kasvatuksessa noin 5,4 miljoonaa. Soluja odotettiin olevan kasvatuksessa moninkertaisesti enemmän, joten tulos on heikko. Mittaustulosten perusteella ei voida sanoa, että solumäärä olisi lisääntynyt. Koska CHO-solut ovat tottuneet kasvamaan tartuntapinnoilla, voi olla, että reaktorissakin ne ovat painuneet säiliön reunoille tai pohjaan, jolloin niitä ei saada näytteeseen. Kasvaminen ilman tarttumispintaa voi olla soluille shokki, joten saattaa olla, että vie muutaman vuorokauden ennen kuin ne lähtevät kunnolla kasvamaan. Jotta muutos solumäärässä olisi paremmin havaittavissa, päätettiin että seuraava näyte otetaan vasta 5 vuorokauden kuluttua. 36
37 TAULUKKO 10 Mitatut solutiheydet mediumin lisäyksen jälkeen Kasvatus käynnissä, vuorokautta Näytteen suuruus (ml) Mittaustulosten keskiarvo, solutiheys / ml Keskihajonta Eläviä soluja (%) Solujen määrä säiliössä ,95 x x ,4 x Ensimmäisen kasvatuksen lopetus Kasvatuksen kuudentena päivänä säiliöön lisättiin 200 ml tuoretta mediumia. Kun kasvatus oli ollut käynnissä 8 vuorokautta, havaittiin, että säiliössä oleva medium oli muuttunut sameaksi. Mediumista otettiin näyte ja sitä tutkittiin mikroskoopilla. Kasvatusliuoksen havaittiin kontaminoituneen. Ensimmäinen bioreaktorikasvatus lopetettiin ja kontaminoituneet solut hävitettiin. Ensimmäisessä bioreaktorikasvatuksessa ei saatu havaintoja siitä, että CHOsolut olisivat lähteneet kasvamaan bioreaktorissa. Tuloksia voi vääristää ongelmat näytteenotossa ja solulaskurin kanssa. Muutaman päivän jälkeen kasvatuksen aloittamisesta näytteenottomäärää piti muuttaa, sillä edustavaa näytettä oli vaikea ottaa 600 millilitran kasvatuksesta. Vaikka säiliössä onkin koko ajan sekoitus päällä, on silti mahdollista, että solut ovat painuneet reaktorin pohjalle tai seinämille, jolloin niistä on vaikea saada näytettä. Loppujen lopuksi kasvatus keskeytettiin bakteerikontaminaation vuoksi. Voi myös olla, että olosuhteet eivät olleet oikeat CHO-soluille. Saattaa olla, että kasvatuksessa käytettiin herkille nisäkässoluille liian korkeita säätöjä. Sekoittajan nopeus on saattanut olla liian suuri, mikä voi vaurioittaa soluja. Nesteeseen menevä ilma- ja hiilidioksidivirtaus on myös voinut olla liian voimakas ja se on saattanut rikkoa soluja. Kasvatuksesta otettiin liitteenä 1 oleva tuloste, jossa näkyy trendikuvaaja lämpötilalle, sekoitukselle, happiprosentille ja ph:lle. Liitteessä 1 muuttujille on merkitty oma asteikkonsa jokaiselle parametrille erikseen. Sekoitusnopeudelle on punainen trendiviiva, happiarvolla vaaleansininen, ph-arvolla vihreä ja lämpöti- 37
38 lalla tumman sininen trendiviiva. Kuvaajasta nähdään, että lämpötila oli pysynyt kasvatuksen ajan tasaisena. ph oli pysynyt asetetuissa rajoissa (ph 7,3 7,4). Happiprosentti oli kasvatuksen alussa yli 100 %, joten happisensorin 100- prosenttinen arvo jouduttiin kalibroimaan uudestaan kasvatuksen ollessa käynnissä. Tämän jälkeen happiprosentti pysyi noin 90 prosentissa. Sekoitus vaihteli välillä rpm. Sekoitukseen vaikutti kaasujen lisäys ja happiarvo, joiden vuoksi sekoitusnopeus vaihteli paljon kasvatuksen aikana. 5.2 CHO-solujen kasvatus suspensiossa Toista bioreaktorikasvatusta varten CHO-solujen kasvatus päätettiin aloittaa pullokasvatuksella suspensiossa. Kasvatukseen käytettiin 1000 ml:n lasista pulloa. Koska solujen haluttiin kasvavan suspensiossa kiinnittymättä mihinkään tartuntapintaan, soluja sekoitettiin koko ajan magneettisekoittajalla. Kasvatus tehtiin hiilidioksidikaapissa, jossa hiilidioksidipitoisuus oli 5 % ja lämpötila +37 C. Kasvatuspullo autoklavoitiin ennen kasvatuksen aloittamista. Sekoittamiseen käytettävä magneettisekoittaja puhdistettiin 70-prosenttisella etanolilla ja magneetti autoklavoitiin. Solujen suspensiokasvatukseen käytettävään pulloon lisättiin 100 ml mediumia. Mediumia oli lämmitetty +37 C:n lämminvesihauteessa 30 minuuttia. CHO-soluja oli kasvatettu soluviljelymaljoilla 3 vuorokautta. Vanha kasvatusliuos poistettiin maljoilta ja solut pestiin kaksi kertaa PBS-liuoksella. Maljoille lisättiin 2 ml trypsiini-edta-liuosta solujen irrottamiseksi pohjasta. Maljat siirrettiin hiilidioksidi-inkubaattoriin 5 10 minuutiksi. Mikroskoopin avulla tarkistettiin, että solut olivat irronneet pohjasta trypsiini-edta:n vaikutuksesta. Pipetin avulla siirrettiin maljoilla olevat solut sentrifugiputkiin ja niihin lisättiin 2 ml kasvatusmediumia. Putkia sentrifugoitiin 4 minuutin ajan. Sentrifugoinnin jälkeen poistettiin varovasti medium sentrifugiputkesta solunapin päältä. Tämän jälkeen lisättiin sentrifugiputkiin 2 ml mediumia, johon solut resuspensoitiin. Kahdesta sentrifugiputkesta mitattiin solutiheydet. Molemmille mittauksille tehtiin myös rinnakkaiset mittaukset. Mittaustulokset on koottu taulukkoon 11. Ha- 38
39 vaittiin, että elävien solujen prosenttiosuus oli hyvä. Mikroskoopilla maljoja tarkasteltaessa huomattiin, että joissain maljoissa kasvoi enemmän soluja kuin toisissa. Solutiheydet voivat vaihdella paljonkin maljojen välillä. TAULUKKO 11 CHO-solujen solutiheydet ennen suspensiokasvatusta Solutiheys millilitrassa Eläviä (%) Malja 1 2,64 x % Malja 1 2,70 x % Malja 2 5,57 x % Malja 2 5,10 x % Keskiarvo 4,00 x % Sentrifugiputkissa olevat 11 maljan solut siirrettiin kasvatuspulloon, johon oli lisätty lämmitettyä mediumia 100 ml. Pullon suu suljettiin alumiinifoliolla löyhästi ja se siirrettiin hiilidioksidikaappiin. Sekoitusnopeudeksi asetettiin 150 rpm. Puolen tunnin kuluttua kasvatuspullosta otettiin näyte ja mitattiin solutiheys. Mittaustulokset on koottu taulukkoon 12. Näytteiden solutiheyksissä mitatut arvot vaihtelivat paljon, samoin elävien solujen prosenttiosuus. Mittaustuloksiin vaikuttaa näytteenottokohta. Solut eivät välttämättä ole sekoittuneet tasaisesti kasvatuspullossa. Pullon toiselta reunalta otetussa näytteessä voi solutiheys vaihdella verrattuna toiselta reunalta otettuun näytteeseen. Lisäksi 100 millilitran kasvatuksesta voi olla vaikeaa saada edustavaa 2 millilitran näytettä. Näytteenottoliuskalle näytettä lisätään vain 10 mikrolitraa, joten solujen nappaaminen juuri tuohon 10 mikrolitraan voi olla haastavaa. 39
40 TAULUKKO 12 Mittaustulokset CHO-solujen suspensiokasvatuksen aloituspäivänä Näytemäärä (ml) Keskimääräinen solutiheys /ml Näytteiden keskihajonta Eläviä (%) Solujen määrä pullossa 2 9,24 x ,5 x ,5 4,7 x 10 6 Havaittiin, että elävien solujen prosenttiosuus oli laskenut verrattuna maljalta otettuun näytteeseen. Todennäköisesti soluja kuolee pipetoinnin ja sentrifugoinnin aikana, mikä vaikuttaa mittaustuloksiin. Lisäksi magneettisekoitus voi rikkoa soluja. Sekoitusta pienennettiin asettamalla sekoitusnopeudeksi 100 rpm. Solujen annettiin kasvaa suspensiokasvatuksessa 3 vuorokautta. Turhaa näytteenottoa haluttiin välttää kontaminaatioriskin vuoksi. Kolmen vuorokauden kuluttua kasvatuksen aloittamisesta havaittiin, että medium kasvatuspullossa oli muuttunut jälleen sameaksi. Kasvatuspullosta otettiin muutaman millilitran näyte viljelymaljalle ja tarkasteltiin näytettä mikroskoopilla. Havaittiin, että suspensiokasvatus oli kontaminoitunut. Suspensiokasvatus lopetettiin ja kasvatuksessa käytetty inkubaattori pestiin ja sen osat autoklavoitiin. Kontaminaatioon vaikuttavat monet asiat, ja on mahdoton tietää, mistä kontaminaatio on loppujen lopuksi tullut. Yksi kontaminaatiotekijä saattoi olla hiilidioksidi-inkubaattorin puhdistus. Vaikka inkubaattori puhdistettiin päällisin puolin ennen kasvatuksen aloittamista, olisi sen autoklavointi ja kokonaisvaltainen puhdistus ennen kasvatuksen aloittamista ollut paikallaan. Lisäksi bioreaktorihuone on yhteydessä tiedekunnan yleiseen laitehuoneeseen, jossa lähes päivittäin käsitellään bakteeri- ja hiivanäytteitä. 40
41 6 BIOREAKTORIKASVATUS HELA-SOLUILLA Koska bioreaktorikasvatusta tai pullokasvatusta CHO-soluilla ei saatu onnistumaan, päätettiin kokeilla kasvatusta HeLa-soluilla. Työssä käytettyä HeLa S3- solukantaa oli kasvatettu aiemminkin suspensiossa. Tämän vuoksi oletettiin, että HeLa S3 -solut kasvaisivat helpommin suspensiossa kuin CHO K1 -solut, jotka olivat tottuneet kasvamaan kiinni tarttumispinnassa. Yksi työn suurimmista haasteista oli saada herkät nisäkässolut kasvamaan onnistuneesti suspensiossa. Ennen HeLa-solujen lisäystä bioreaktoriin aloitettiin suspensiokasvatus kasvatuspullossa hiilidoksidi-inkubaattorissa. Näin saatiin selville, kasvavatko solut lainkaan suspensiossa. Lisäksi bioreaktorin puhdistus, autoklavointi ja mittarien kalibrointi ja asennus oli suuritöinen prosessi. Kasvatuksen aloittaminen suspensiossa pullossa säästi resursseja. Suspensiokasvatukseen saatiin ohjeita ja neuvoja myös muilta työryhmiltä. Opinnäytetyön liitteessä 2 on Helmut Pospiechilta saadut työohjeet HeLasolujen suspensiokasvatukseen. Tässä opinnäytetyössä työohjeita käytettiin apuna soveltaen. 6.1 Suspensiokasvatus Nestetyppisäiliöstä haettiin soluampulli joka sisälsi HeLa S3 -solukantaa. Soluampullissa oli noin 10 miljoonaa solua. Solut oli säilötty nestetyppeen elokuussa Soluampullia lämmitettiin varovasti käyttämällä sitä noin minuutin ajan vesihauteessa. Ampullin sisältö resuspensoitiin huoneenlämpöiseen kasvatusmediumiin. Ampullissa olevat solut, jotka olivat sekoittuneet kasvatusmediumiin, lisättiin kasvatuspulloon, johon oli lisätty 250 ml mediumia. Kasvatuspulloon laitettiin steriili magneetti. Pullo suljettiin löyhästi alumiinifoliolla, jotta solut saivat happea. Kasvatuspullo siirrettiin hiilidioksidi-inkubaattooriin, jossa hiilidioksidipitoisuus oli 5 % ja lämpötila +37 C. Kasvatuspullon alla oli magneettisekoittaja ja sekoitusnopeudeksi asetettiin noin 100 rpm. Kuvassa 11 solut on lisätty kasvatuspulloon ja pullo on asetettu hiilidioksidi-inkubaattoriin. 41
42 KUVA 11 HeLa-solujen suspensiokasvatus hiilidioksidi-inkubaattorissa Kasvatuksen alussa pyrittiin kasvatuksesta ottamaan näyte päivittäin. Aloituspäivänä otettiin näyte, jotta tulosta voitiin vertailla myöhempien päivien näytteeseen. Solut jaettiin kolmantena kasvatuspäivänä. Puolet kasvatuspullon mediumista otettiin pois. Solut sentrifugoitiin sentrifugiputken pohjaan ja säilöttiin. Kasvatuspulloon lisättiin lämmitettyä mediumia saman verran kuin sieltä oli otettu pois. Ennen ensimmäistä jakamista mitattujen solutiheyksien tuloksista lasketut keskiarvot, keskihajonnat ja solujen kokonaismäärä pullossa on koottu taulukkoon 13. Päivää ennen jakamista solujen elävyysprosentti oli parempi kuin aiempina päivinä. Solutiheys kasvoi päivittäin. 42
43 TAULUKKO 13 Mitatut solutiheydet HeLa-solujen pullokasvatuksessa Kasvatus käynnissä, vuorokautta Näytemäärä (ml) Mittaustulos, soluja / ml Näytteiden keskihajonta Eläviä (%) Solujen määrä pullossa 0 1 2,7 x ,7 x ,8 x ,6 x ,3 x x ,8 x ,5 x x 10 6 Solujen jakamisen jälkeen otettiin solutiheysnäyte. Elävien solujen prosenttiosuus oli pieni, mutta jakamisella saattoi olla vaikutusta asiaan. Näyte solutiheyden määritystä varten otettiin harvemmin, sillä havaittiin, että solut olivat lähteneet jakautumaan ennen ensimmäistä jakamista. Seuraavat jakamiset tehtiin kasvatuksen 6., 7. ja 10. päivä. Elävien solujen prosenttiosuuden havaittiin olevan pieni aina jakamisen jälkeen. Solutiheydet kuitenkin pääsääntöisesti kasvoivat päivittäin. Mittaustuloksille laskettiin keskiarvot, keskihajonnat ja solujen kokonaismäärä pullossa. Solutiheydet on koottu taulukkoihin 14 ja 15. TAULUKKO 14 HeLa-solujen pullokasvatuksesta mitatut solutiheydet ensimmäisen jakamisen jälkeen Kasvatus käynnissä, vuorokautta Näytemäärä (ml) Mittaustulos, soluja /ml Näytteiden keskihajonta Eläviä (%) Solujen määrä pullossa 4 1 7,7 x ,2 x x ,9 x ,0 x x
44 TAULUKKO 15 HeLa-solujen pullokasvatuksesta mitatut solutiheydet toisen jakamisen jälkeen Kasvatus käynnissä, vuorokautta Näytemäärä (ml) Mittaustulos, soluja / ml Näytteiden keskihajonta Eläviä (%) Solujen määrä pullossa 7 1 2,7 x ,3 x ,7 x ,6 x ,5 x x10 6 Suspensiokasvatus pullossa onnistui HeLa-soluilla. Seuraavaksi solut voitiin siirtää bioreaktorikasvatukseen. 6.2 Bioreaktorin valmistelu ja HeLa-solujen siirto bioreaktoriin Bioreaktorille oli tehty edellisen kasvatuksen jälkeen autoklavoinnit ja puhdistus. Laitteelle tehtiin tarvittavat kytkennät ja muut toimenpiteet kuten CHO-solujen kasvatuksessa. ph- ja happisensorien kalibrointitulokset on koottu taulukkoon 16 ja taulukkoon 17. TAULUKKO 16 Ennen kasvatusta kalibroitu ph-sensori Arvo Käytetty ph puskuri mv Zero point ph 7-1,3 Slope point ph 4 173,3 44
45 TAULUKKO 17 Happisensorin kalibrointitulokset Arvo Tulos (na) 100% happi 76,2 0% happi 55,5 HeLa-solujen suspensiokasvatus hiilidioksidi-inkubaattorissa onnistui, joten solut voitiin siirtää bioreaktoriin. Bioreaktorin säiliöön oli lisätty kasvatusmediumi kaksi tuntia ennen solujen lisäystä. Solut lisättiin pipetoimalla ne suspensiokasvatuspullosta säiliöön. Kasvatus aloitettiin niin, että säiliössä oli 600 millilitraa kasvatusmediumia soluineen. HeLa-solujen kasvatuksessa ei pidetty happimittaria aktiivisena. Happimittarille ei asetettu mitään arvoa, eikä happimittaria ollut aktivoitu ohjausyksiköstä. Happimittarin mittaamaa dataa ei tallentunut, mutta happimittari oli kuitenkin paikallaan säiliössä ja sen mittaamaa prosenttiarvoa hapelle voitiin seurata reaaliajassa ohjausyksikön näytöltä. Muille parametreille asetetut arvot HeLa-solujen kasvatukseen on koottu taulukkoon 18. TAULUKKO 18 HeLa-solujen bioreaktorikasvatuksessa käytetyt säädöt Asetettu arvo Rajat Sekoitus 75 rpm rpm Ilma, Overlay 20 % 0%-100% Ilma, Sparger 5 ccm 0-45ccm ph 7,3 7,2-7,4 Lämpötila 37 C 36,5 C - 38 C 45
46 6.3 HeLa-solujen bioreaktorikasvatus Kasvatuksen aloituspäivänä otettiin kasvatuksesta 10 millilitran näyte. Mitatuista tuloksista laskettiin keskiarvo, keskihajonta ja solujen määrä koko kasvatuksessa. Tulokset on koottu taulukkoon 19. Liiallista näytteenottoa kasvatuksen aikana haluttiin välttää, sillä näytteenoton aikana oli aina kontaminaatiovaara. HeLasoluja oli jo kasvatettu suspensiossa pullossa, joten arvioitiin solujen sopiva jakamisväli. Ensimmäinen solujen jakaminen tehtiin, kun kasvatus oli ollut käynnissä 4 vuorokautta. Ennen jakamista säiliöstä otettiin kaksi 10 millilitran näytettä solutiheyksien määritystä varten. Säiliöstä otettiin pois 500 millilitraa solumediumia ja sinne lisättiin saman verran lämmitettyä tuoretta mediumia. Solut sentrifugoitiin sentrifugiputkien pohjaan ja ne pakastettiin. TAULUKKO 19 HeLa-solujen bioreaktorikasvatuksesta mitattujen solutiheyksien tulokset Kasvatus Näytemäärä Mittaustulos, Näytteiden Eläviä Solujen käynnissä, (ml) soluja / ml keskihajonta (%) määrä vuorokautta säiliössä ,4 x ,3 x ,0 x ,2 x ,3 x ,2 x10 6 Seuraavan kerran solut oli tarkoitus jakaa kasvatuksen 10. päivänä. Näytettä otettaessa huomattiin että säiliössä oleva medium oli samea. Mediumin väri oli hieman oranssi. Näiden syiden vuoksi epäiltiin, että kasvatus oli kontaminoitunut. Kasvatuksesta otettiin kaksi 10 millilitran näytettä joista määritettiin solutiheydet. Taulukossa 20 on näytteiden mittaustuloksista lasketut keskiarvot, keskihajonta ja soluen määrä säiliössä. Solutiheydet olivat kasvaneet huimasti edellisiin mittauksiin verrattuna. Myös elävien solujen määrä oli suuri. Solujen kokoa tarkasteltaessa huomattiin, että elävät solut olivat kooltaan melko pieniä. Näytettä otettiin solumaljalle ja sitä tarkasteltiin mikroskoopilla. Näytteessä ha- 46
47 vaittiin olevan HeLa-solujen lisäksi myös hiivasoluja. Kasvatusliuos oli siten kontaminoitunut. Kasvatus keskeytettiin ja säiliö autoklavoitiin ja puhdistettiin. Kontaminoituneet solut hävitettiin. TAULUKKO 20 Mitatut solutiheydet, tuloksiin vaikuttaa kontaminaatio Kasvatus Näytemäärä Mittaustulos, Näytteiden Eläviä Solujen käynnissä, (ml) soluja / ml keskihajonta (%) määrä vuorokautta säiliössä ,22 x ,1 x ,3 x 10 8 Liitteessä 3 ovat HeLa-solukasvatuksen trendikuvaaja. Kuvaajassa on omat trendiviivat sekoitukselle, lämpötilalle ja ph:lle. Liitteessä 3 reunaan on merkitty asteikot jokaiselle parametrille erikseen. Sekoitukselle on vaalean sininen trendiviiva, ph-arvolle tumman sininen ja lämpötilalle vihreä. Kuvaajasta nähdään, että sekoitus ja lämpötila olivat pysyneet tasaisena koko kasvatuksen ajan. pharvo vaihteli tasaisesti 7,2 7,4. 47
48 7 POHDINTAA TYÖN AIKANA KOHDATUISTA HAASTEISTA Bioreaktorikasvatukset sekä CHO-soluilla että HeLa-soluilla lopetettiin kontaminoitumisen vuoksi. Suurin ongelma työssä oli kontaminaatiot, jotka aiheutuivat ilmeisesti hiivasoluista. Kasvatusmediumiin oli lisätty penisilliinistreptomysiiniä antibiootiksi. Antibiootit suojaavat nisäkässoluja joiltain bakteereilta, mutta hiivasoluihin ne eivät tehoa. Työryhmän käytettävissä oleva työhuone, laboratorio- ja soluviljelytilat sijaitsivat rakennuksen 2. kerroksessa. Bioreaktorihuone sijaitsi 3. kerroksessa. Kerroksien välillä liikkumista oli siis paljon. 3. kerroksessa sijaitsi lisäksi laboratoriotiloja, joissa käsiteltiin hiivasoluja. Näin ollen bioreaktorin käyttäjä tai muut henkilöt voivat tahattomasti vaatteissaan kuljettaa kontaminaatiotekijöitä bioreaktorihuoneeseen. Hiivasolut leviävät erittäin helposti ja kasvavat nopeammin kuin nisäkässolut. Bioreaktorihuoneen lähellä sijaitsevat tilat, joissa hiivasoluja käsitellään, voivat olla syy kasvatuksien kontaminaatioille. CHO-bioreaktorikasvatuksen jälkeen kiinnitettiin erityistä huomiota suojavaatteisiin. Bioreaktorihuoneessa työskentelyä varten oli oma laboratoriotakki, suojakäsineet ja -lasit. Samoin soluviljelylaboratoriossa oli omat suojavarusteet, jotka oli tarkoitettu käytettäväksi vain soluviljelyssä. Varusteiden ja välineiden kuljetusta kerroksesta toiseen vältettiin. On mahdotonta sanoa, mistä kontaminaatiot loppujen lopuksi aiheutuivat. Tulevaisuutta ajatellen voisi kuitenkin olla paikallaan harkita bioreaktorin siirtämistä pois hiivasolulaboratorioiden läheisyydestä. Tämän opinnäytetyön päätyttyä bioreaktori päätettiinkin siirtää tiedekunnan soluviljelytiloihin, joihin on pääsy vain erityisluvalla. Solutiheydet työssä määritettiin solulaskurilla. Solulaskuriin asetetaan näytteenottoliuska, jonka molemmissa päissä on näytettä. Solulaskuri laskee automaattisesti solujen määrän ja prosenttiosuuden. Työn aikana huomattiin, että kun solulaskurin tarkennusta säädettiin käsin, saatiin parempia tuloksia solutiheydelle kuin automaattisella tarkennuksella. Välillä solulaskuri ei tunnistanut soluja ollenkaan, ja se näytti elävien solujen määräksi 0 %. Mikroskoopilla näy- 48
49 tettä tarkasteltaessa kuitenkin soluja oli havaittavissa. Lisäksi rinnakkaiset näytteet saattoivat poiketa kovastikin toisistaan. Solulaskurin säätöjä muuttamalla olisi voitu saada paremmat tulokset niin solutiheyksistä kuin prosenttiosuuksistakin. Tämä olisi kuitenkin vaatinut solulaskuriin perehtymistä eikä siihen ollut tässä opinnäytetyössä aikaa. Myös näytemäärät vaikuttivat solutiheyksiin. Kun 600 millilitran kasvatuksesta otetaan 5 millilitran näyte, ei näyte välttämättä ole kovin edustava. Solutiheys laimeni paljon maljalta suspensioon siirrettäessä ja soluja saattoi olla niin vähän, ettei niitä saatu napattua näytteeseen. Alhainen solumäärä voi olla osasyy tulosten vaihteluun eri mittausten välillä. Toinen tekijä, joka voi vaikuttaa haitallisesti määritystuloksiin, oli solulaskuriin asetetut perusasetukset, joita ei ollut optimoitu käytettyjen solujen kokoon perustuen. Näytteen käsittelyssä soluille aiheutuu paljon mekaanista stressiä. Esimerkiksi pipetointi ja sentrifugointi voi rikkoa soluja ja vaikuttaa elävien solujen osuuteen. Tällöin saatu mittaustulos ei kerro todellista tilannetta bioreaktorissa. Tämän vuoksi elävien solujen prosenttiosuutta ei pidetty niin tärkeänä kuin solujen kokonaismäärää. Mittaustuloksia kannattaakin tarkastella kriittisesti, ja työn aikana niihin suhtauduttiin lähinnä suuntaa antavina. Vastaisuudessa näytteenoton ja solutiheyden määrittämistä voitaisiin kehittää ja parantaa. Paras tapa löytyy vain kokeilemalla. Bioreaktoriin on saatavana näytteenotin, joka voidaan autoklavoida bioreaktorin säiliön mukana. Toisella bioreaktoreja käyttävällä työryhmällä näytteenotin ei kuitenkaan ollut toiminut toivotulla tavalla. Lisäksi oli epäselvää, miten näyte saadaan otettua steriilisti näytteenottimella. Näytteen ottaminen pipetillä steriilin pipetinkärjen avulla vaikutti parhaimmalta ja yksinkertaisimmalta tavalta ottaa näyte. Kasvatukset haluttiin pitää mahdollisimman yksinkertaisina, sillä ei haluttu ottaa riskiä, että kasvatus epäonnistuu. Suunnitelmissa oli, että mikäli saadaan tehtyä useita onnistuneita kasvatuksia, voidaan kasvatuksissa kokeilla eri komponentteja, kuten näytteenotinta, happo- ja emässyöttöä tai vaahtosensoria. Tässä työssä näytteenotinta ei ehditty ottaa käyttöön. 49
50 Oman aikansa vei bioreaktorin käytön oppiminen. Laitteessa oli paljon osia, ja kasvatukset sisälsivät monia työvaiheita. Kasvatuksissa käytettävä säiliö oli tilavuudeltaan 1 litra, joten säiliön kansi oli pieni, kanteen kiinnitettäviä osia oli paljon ja liikkumavaraa oli vähän. Sensoreiden ja muiden osien ruuvaaminen kanteen vaatikin sorminäppäryyttä ja opettelua. Työssä käytettiin koko ajan suojavarusteita ja suojakäsinein ruuvien käsikiristys ja silikoniletkujen yhdistäminen suodattimiin oli välillä työlästä. Samaan aikaan kuitenkin säiliön kanteen koskemista yritettiin välttää, jotta siihen ei pääsisi epäpuhtauksia. Saattaa kuitenkin olla, että tässä yhteydessä säiliön kanteen tai muihin osiin on päässyt kontaminaatiotekijöitä. Kannen kautta haitalliset epäpuhtaudet ovat voineet siirtyä reaktoriin esimerkiksi näytteenoton yhteydessä. Oikeanlaisella kasvatusmediumilla voidaan saada parempia tuloksia. Työssä käytettiin Gibcon DMEM (1x) + Glutamax TM -kasvatusmediumia. Medium sisälsi kalsiumia, joka auttaa soluja takertumaan pintaan. Kun soluja kasvatetaan maljoilla, on niiden takertuminen kiinteään pintaan toivottavaa, koska tällöin solut kasvavat helpommin. Bioreaktorikasvatuksissa solujen kuitenkin haluttiin nimenomaan kasvavan tarttumatta pintaan. Kalsiumin vaikutus voidaan kumota esimerkiksi lisäämällä mediumiin kalsium-ioneja sitovaa EGTA:ta eli etyleeniglykolitetraetikkahappoa. Lisäksi markkinoilla voi olla erikseen suspensiokasvatuksiin kehitettyjä mediumeja. Kokeilemalla ja asiaan perehtymällä voidaan löytää parhaiten sopiva medium nisäkässolujen bioreaktorikasvatuksiin. Työssä käytettiin Gibcon DMEM (1x) + Glutamax TM -mediumia, koska se oli työryhmällä yleisesti käytössä ja hyväksi havaittu. Tässä opinnäytetyössä kasvatuksia ei kokeiltu eri kasvatusmediumeilla, koska opinnäytetyöhön käytettävä aika on rajallinen. Kasvatusmediumin vaihtamisesta kesken työn saattaisi aiheuttaa enemmän haittaa kuin hyötyä. Tulevaisuudessa bioreaktoria on tarkoitus käyttää solujen kasvatuksessa enenevässä määrin, ja silloin tavoitteena on testata erilaisten kasvatusliuosten vaikutusta solujen kasvuun. Bioreaktorikasvatuksissa sekoitus, kaasujen syöttö mediumiin ja vaahtoaminen voivat aiheuttaa solujen rikkoutumista. Markkinoilla on saatavilla erilaisia soluja 50
51 suojaavia aineita. Myös vaahdonestoaineita bioreaktorikasvatuksiin on olemassa. Ei kuitenkaan ole tiedossa, voiko näitä aineita käyttää nisäkässolukasvatuksissa. Herkät nisäkässolut saattavat reagoida odottamattomalla tavalla muutoksiin. Asiaan perehtymällä ja kokeilemalla voidaan löytää juuri käytettävälle solulinjalle sopivat aineet, jolloin voidaan päästä bioreaktorikasvatuksissa yhä suurempiin solutiheyksiin. 51
52 8 YHTEENVETO Työssä otettiin käyttöön bioreaktori onnistuneesti. Laitteelle tehtiin testiajot ja sitä opittiin käyttämään ja säätämään. Laitteessa oli paljon osia ja parametreja, joiden käyttöön perehtyminen ja oikea säätäminen veivät aikaa. Testiajojen aikana sain hyvää käyttökokemusta laitteesta. Tämä auttaa laitteen käyttöönottoa myös jatkossa. Onnistuneita CHO-solukasvatuksia bioreaktorilla työssä ei saatu tehtyä, vaikka sitä sinnikkäästi yritettiin. Ensimmäisessä kasvatuksessa solujen kasvaminen liuoksessa oli epävarmaa. Loppujen lopuksi kasvatus keskeytettiin kontaminaation vuoksi. Ensimmäisessä bioreaktorikasvatuksessa ei saatu selviä merkkejä siitä, että CHO-solut olisivat lähteneet jakautumaan kasvatuksen aikana. Saattaa olla, että kasvatuksessa käytettiin herkille nisäkässoluille sopimattomia säätöarvoja. CHO-solulinja voi olla ominaisuuksiltaan sellainen, että se kasvaa vain kosketuspinnoilla. Kasvatettavia soluja päätettiin opinnäytetyön aikana vaihtaa. Suspensiokasvatuksia pullossa ihmisen HeLa-soluille oli aiemminkin tehty, joten myös reaktorikasvatuksen onnistumiselle on hyvät edellytykset. HeLa-soluja esikasvatettiin pullossa ennen bioreaktoriin lisäystä. Suspensiokasvatus pullossa sujui onnistuneesti ja solut siirrettiin bioreaktoriin. Osa soluista kuitenkin kuoli ilmeisesti magneettisauvasta aiheutuvan mekaanisen rasituksen vuoksi. Bioreaktorissa HeLa-solut kasvoivat hyvin, ja osa soluista ehdittiin kerätä ennen kontaminoitumista. CHO-solujen bioreaktorikasvatukseen verrattuna HeLa-solujen bioreaktorikasvatus oli onnistuneempi. Työssä saatiin selkeitä merkkejä siitä, että HeLa-solut kasvavat bioreaktorissa. Opinnäytetyön suurimpana saavutuksena pidän sitä, että HeLa-solut saatiin kasvamaan bioreaktorissa ja soluja jopa kerättiin kasvatuksesta. Nisäkässolukasvatukset bioreaktorissa ovat tuore ja ajankohtainen aihe. Tulevaisuudessa menetelmä voi olla tärkeä työväline lääketieteellisiä ja biologisia tutkimuksia tekeville laboratorioille. Tässä opinnäytetyössä nisäkässolujen bioreaktorikasvatukset saatiin hyvin alulle, ja siitä on hyvä jatkaa. Työn aikana il- 52
53 meni paljon työtä viivyttäviä haasteita, joita ei osattu vielä työn suunnitteluvaiheessa ottaa huomioon. Opinnäytetyön tavoitteet kuitenkin saavutettiin niin hyvin, kun ne opinnäytetyöhön käytettävien resurssien puitteissa voitiin saavuttaa. 53
54 LÄHTEET 1. Operating Manual BIOSTAT B, Vers Sartoriuos Stedim Biotech GmbH. Goettingen, Germany. 2. Operating Instructions for ph and Redox electrodes for process applications Hamilton Bonaduz AG. Bonaduz, Switzerland. 3. Operating Manual UniVessel, Version Sartorius Stedim Biotech GmbH. Goettingen, Germany. 4. Technical Resources DMEM, high glucose, GlutaMAX(T) Thermo Fisher Scientific. Saatavissa: Hakupäivä Solubiologia: Soluviljely Solunetti. Saatavissa: Hakupäivä Hassinen, Antti - Kokkonen, Nina - Reini, Kaarina - Rivinoja, Antti - Paakkola, Teija A Cell Biology, practical part. Opintojakson oppimateriaali. Oulu: Department of Biochemistry, University of Oulu 54
55 CHO-SOLUJEN BIOREAKTORIKASVATUKSEN TRENDIKUVAAJAT ph- ARVOLLE, HAPPIARVOLLE, LÄMPÖTILALLE JA SEKOITUKSELLE LIITE 1
56 OHJEITA HELA-SOLUJEN SUSPENSIOKASVATUKSEEN LIITE 2/1
57 OHJEITA HELA-SOLUJEN SUSPENSIOKASVATUKSEEN LIITE 2/2
58 OHJEITA HELA-SOLUJEN SUSPENSIOKASVATUKSEEN LIITE 2/3
59 OHJEITA HELA-SOLUJEN SUSPENSIOKASVATUKSEEN LIITE 2/4
60 OHJEITA HELA-SOLUJEN SUSPENSIOKASVATUKSEEN LIITE 2/5
61 OHJEITA HELA-SOLUJEN SUSPENSIOKASVATUKSEEN LIITE 2/6
TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU
 Oulun Seudun Ammattiopisto Raportti Page 1 of 6 Turkka Sunnari & Janika Pietilä 23.1.2016 TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU PERIAATE/MENETELMÄ Työssä valmistetaan
Oulun Seudun Ammattiopisto Raportti Page 1 of 6 Turkka Sunnari & Janika Pietilä 23.1.2016 TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU PERIAATE/MENETELMÄ Työssä valmistetaan
Original Elche antimicrobi TM desinfiointiaineen testaus Legionella lajeille
 Original Elche antimicrobi TM desinfiointiaineen testaus Legionella lajeille Tutkimusraportti 145606 10.3.2006 Sivu 1:6 Sisällysluettelo 1. YHTEYSTIEDOT... 3 2. TESTATTAVAT LEGIONELLA-LAJIT... 3 3. TESTAUSMENETELMÄT...
Original Elche antimicrobi TM desinfiointiaineen testaus Legionella lajeille Tutkimusraportti 145606 10.3.2006 Sivu 1:6 Sisällysluettelo 1. YHTEYSTIEDOT... 3 2. TESTATTAVAT LEGIONELLA-LAJIT... 3 3. TESTAUSMENETELMÄT...
Mark Summary Form. Tulospalvelu. Competitor No Competitor Name Member
 Summary Form Skill Number 604 Skill Laborantti Criterion Criterion Description s Day 1 Day 2 Day 3 Day 4 Total Award A B C Elintarvikevalvonta Elintarvikevalvonta ja tutkimus Lääketurvallisuus 35.00 40.00
Summary Form Skill Number 604 Skill Laborantti Criterion Criterion Description s Day 1 Day 2 Day 3 Day 4 Total Award A B C Elintarvikevalvonta Elintarvikevalvonta ja tutkimus Lääketurvallisuus 35.00 40.00
dekantterilaseja eri kokoja, esim. 100 ml, 300 ml tiivis, kannellinen lasipurkki
 Vastuuhenkilö Tiina Ritvanen Sivu/sivut 1 / 5 1 Soveltamisala Tämä menetelmä on tarkoitettu lihan ph:n mittaamiseen lihantarkastuksen yhteydessä. Menetelmää ei ole validoitu käyttöön Evirassa. 2 Periaate
Vastuuhenkilö Tiina Ritvanen Sivu/sivut 1 / 5 1 Soveltamisala Tämä menetelmä on tarkoitettu lihan ph:n mittaamiseen lihantarkastuksen yhteydessä. Menetelmää ei ole validoitu käyttöön Evirassa. 2 Periaate
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
ASPIRIININ MÄÄRÄN MITTAUS VALOKUVAAMALLA
 ASPIRIININ MÄÄRÄN MITTAUS VALOKUVAAMALLA Jaakko Lohenoja 2009 Johdanto Asetyylisalisyylihapon määrä voidaan mitata spektrofotometrisesti hydrolysoimalla asetyylisalisyylihappo salisyylihapoksi ja muodostamalla
ASPIRIININ MÄÄRÄN MITTAUS VALOKUVAAMALLA Jaakko Lohenoja 2009 Johdanto Asetyylisalisyylihapon määrä voidaan mitata spektrofotometrisesti hydrolysoimalla asetyylisalisyylihappo salisyylihapoksi ja muodostamalla
Laboratorioraportti 3
 KON-C3004 Kone-ja rakennustekniikan laboratoriotyöt Laboratorioraportti 3 Laboratorioharjoitus 1B: Ruuvijohde Ryhmä S: Pekka Vartiainen 427971 Jari Villanen 69830F Anssi Petäjä 433978 Mittaustilanne Harjoituksessa
KON-C3004 Kone-ja rakennustekniikan laboratoriotyöt Laboratorioraportti 3 Laboratorioharjoitus 1B: Ruuvijohde Ryhmä S: Pekka Vartiainen 427971 Jari Villanen 69830F Anssi Petäjä 433978 Mittaustilanne Harjoituksessa
VOC-näytteen ottaminen FLEC-laitteella
 AO06 1/3 VOC-näytteen ottaminen FLEC-laitteella Valmistelut Tarkista, että sinulla on kaikki tarvittavat välineet näytteenottoa varten: FLEC-kupu 1 puhaltava pumppu (violetti väri) 2 imevää pumppua (sininen
AO06 1/3 VOC-näytteen ottaminen FLEC-laitteella Valmistelut Tarkista, että sinulla on kaikki tarvittavat välineet näytteenottoa varten: FLEC-kupu 1 puhaltava pumppu (violetti väri) 2 imevää pumppua (sininen
Käyttöohje HI98127 / HI98128. Pietiko Oy Tykistökatu 4 B 310(ElektroCity) 20520 Turku, puh (02) 2514402, fax (02) 2510015 www.pietiko.
 HI98127 / Tekniset tiedot Mittausalue HI98127-2,0...16,0 ph -2,00...16,00 ph Lämpötila -5...+60 C Resoluutio HI98127 0,1 ph 0,01 ph Lämpötila 0,1 C Tarkkuus HI98127 ± 0,1 ph ± 0,001 ph Lämpötila ± 0,5
HI98127 / Tekniset tiedot Mittausalue HI98127-2,0...16,0 ph -2,00...16,00 ph Lämpötila -5...+60 C Resoluutio HI98127 0,1 ph 0,01 ph Lämpötila 0,1 C Tarkkuus HI98127 ± 0,1 ph ± 0,001 ph Lämpötila ± 0,5
AIR-MIX-RUISKUN PERUSKÄYTTÖ
 AIR-MIX-RUISKUN PERUSKÄYTTÖ 1. Ruiskun pesu ennen käyttöönottoa 2. Maalin lisäys ja maalaus 3. Ruiskunpesu maalauksen jälkeen RUISKUN KÄYTTÖ MAALAUKSISSA Air-Mix-ruiskua käytetään lähinnä kalusteovien
AIR-MIX-RUISKUN PERUSKÄYTTÖ 1. Ruiskun pesu ennen käyttöönottoa 2. Maalin lisäys ja maalaus 3. Ruiskunpesu maalauksen jälkeen RUISKUN KÄYTTÖ MAALAUKSISSA Air-Mix-ruiskua käytetään lähinnä kalusteovien
VOC-näytteen ottaminen FLEC-laitteella
 AO06 Sivu 1 / 5 VOC-näytteen ottaminen FLEC-laitteella Valmistelut Tarkista, että sinulla on kaikki tarvittavat välineet näytteenottoa varten: FLEC-kupu 1 puhaltava pumppu (violetti väri) 2 imevää pumppua
AO06 Sivu 1 / 5 VOC-näytteen ottaminen FLEC-laitteella Valmistelut Tarkista, että sinulla on kaikki tarvittavat välineet näytteenottoa varten: FLEC-kupu 1 puhaltava pumppu (violetti väri) 2 imevää pumppua
MAATALOUDEN TUTKIMUSKESKUS MAANTUTKIMUS LAITOS. Tiedote N:o 8 1979. MAAN ph-mittausmenetelmien VERTAILU. Tauno Tares
 MAATALOUDEN TUTKIMUSKESKUS MAANTUTKIMUS LAITOS Tiedote N:o 8 1979 MAAN ph-mittausmenetelmien VERTAILU Tauno Tares Maatalouden -tutkimuskeskus MAANTUTKIMUSLAITOS PL 18, 01301 Vantaa 30 Tiedote N:o 8 1979
MAATALOUDEN TUTKIMUSKESKUS MAANTUTKIMUS LAITOS Tiedote N:o 8 1979 MAAN ph-mittausmenetelmien VERTAILU Tauno Tares Maatalouden -tutkimuskeskus MAANTUTKIMUSLAITOS PL 18, 01301 Vantaa 30 Tiedote N:o 8 1979
ANALYYSIT kuiva-aine (TS), orgaaninen kuiva-aine (VS), biometaanintuottopotentiaali (BMP)
 TULOSRAPORTTI TILAAJA Jukka Piirala ANALYYSIT kuiva-aine (TS), orgaaninen kuiva-aine (VS), biometaanintuottopotentiaali (BMP) AIKA JA PAIKKA MTT Jokioinen 25.9.2013.-30.5.2014 Maa- ja elintarviketalouden
TULOSRAPORTTI TILAAJA Jukka Piirala ANALYYSIT kuiva-aine (TS), orgaaninen kuiva-aine (VS), biometaanintuottopotentiaali (BMP) AIKA JA PAIKKA MTT Jokioinen 25.9.2013.-30.5.2014 Maa- ja elintarviketalouden
Ohjeita opetukseen ja odotettavissa olevat tulokset
 Ohjeita opetukseen ja odotettavissa olevat tulokset Ensimmäinen sivu on työskentelyyn orientoiva johdatteluvaihe, jossa annetaan jotain tietoja ongelmista, joita happamat sateet aiheuttavat. Lisäksi esitetään
Ohjeita opetukseen ja odotettavissa olevat tulokset Ensimmäinen sivu on työskentelyyn orientoiva johdatteluvaihe, jossa annetaan jotain tietoja ongelmista, joita happamat sateet aiheuttavat. Lisäksi esitetään
VOC NÄYTTEENOTTO FLEC LAITTEELLA (sovellettu NT BUILD 484 STANDARDISTA)
 Sivu 1 (5) VOC NÄYTTEENOTTO FLEC LAITTEELLA (sovellettu NT BUILD 484 STANDARDISTA) HUOMIOT Laitteen tiiveyttä voi parantaa asettamalla FLEC:n päälle painoja. Jos epäilet, että mitatun pinnan emissio on
Sivu 1 (5) VOC NÄYTTEENOTTO FLEC LAITTEELLA (sovellettu NT BUILD 484 STANDARDISTA) HUOMIOT Laitteen tiiveyttä voi parantaa asettamalla FLEC:n päälle painoja. Jos epäilet, että mitatun pinnan emissio on
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
1 Tehtävät. 2 Teoria. rauta(ii)ioneiksi ja rauta(ii)ionien hapettaminen kaliumpermanganaattiliuoksella.
 1 Tehtävät Edellisellä työkerralla oli valmistettu rauta(ii)oksalaattia epäorgaanisen synteesin avulla. Tätä sakkaa tarkasteltiin seuraavalla kerralla. Tällä työ kerralla ensin valmistettiin kaliumpermanganaatti-
1 Tehtävät Edellisellä työkerralla oli valmistettu rauta(ii)oksalaattia epäorgaanisen synteesin avulla. Tätä sakkaa tarkasteltiin seuraavalla kerralla. Tällä työ kerralla ensin valmistettiin kaliumpermanganaatti-
VOC-näytteen ottaminen FLEC-laitteella
 Sivu 1 / 5 VOC-näytteen ottaminen FLEC-laitteella Valmistelut Tarkista, että sinulla on kaikki tarvittavat välineet näytteenottoa varten: FLEC-kupu 1 puhaltava pumppu (violetti väri) 2 imevää pumppua (sininen
Sivu 1 / 5 VOC-näytteen ottaminen FLEC-laitteella Valmistelut Tarkista, että sinulla on kaikki tarvittavat välineet näytteenottoa varten: FLEC-kupu 1 puhaltava pumppu (violetti väri) 2 imevää pumppua (sininen
Kemian opetuksen keskus Helsingin yliopisto Veden kovuus Oppilaan ohje. Veden kovuus
 Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
OAMK TEKNIIKAN YKSIKKÖ MITTAUSTEKNIIKAN LABORATORIO
 OAMK TEKNIIKAN YKSIKKÖ MITTAUSTEKNIIKAN LABORATORIO Työ 5 ph-lähettimen konfigurointi ja kalibrointi 2012 Tero Hietanen ja Heikki Kurki 1 JOHDANTO Työssä tutustutaan nykyaikaiseen teollisuuden yleisesti
OAMK TEKNIIKAN YKSIKKÖ MITTAUSTEKNIIKAN LABORATORIO Työ 5 ph-lähettimen konfigurointi ja kalibrointi 2012 Tero Hietanen ja Heikki Kurki 1 JOHDANTO Työssä tutustutaan nykyaikaiseen teollisuuden yleisesti
Kemiaa tekemällä välineitä ja työmenetelmiä
 Opiskelijalle 1/4 Kemiaa tekemällä välineitä ja työmenetelmiä Ennen työn aloittamista huomioi seuraavaa Tarkista, että sinulla on kaikki tarvittavat aineet ja välineet. Kirjaa tulokset oikealla tarkkuudella
Opiskelijalle 1/4 Kemiaa tekemällä välineitä ja työmenetelmiä Ennen työn aloittamista huomioi seuraavaa Tarkista, että sinulla on kaikki tarvittavat aineet ja välineet. Kirjaa tulokset oikealla tarkkuudella
Sairaalahygienia- ja infektiontorjuntayksikkö/mr 23.1.2014
 Sairaalahygienia- ja infektiontorjuntayksikkö/mr 23.1.2014 TAIPUISIEN TÄHYSTIMIEN PUHDISTUS JA DESINFEKTIO Taipuisien tähystimien puhdistus tulee aloittaa välittömästi käytön jälkeen. Työntekijän suojavaatetuksena
Sairaalahygienia- ja infektiontorjuntayksikkö/mr 23.1.2014 TAIPUISIEN TÄHYSTIMIEN PUHDISTUS JA DESINFEKTIO Taipuisien tähystimien puhdistus tulee aloittaa välittömästi käytön jälkeen. Työntekijän suojavaatetuksena
JÄTEHUOLLON ERIKOISTYÖ
 Jari-Jussi Syrjä 1200715 JÄTEHUOLLON ERIKOISTYÖ Typpioksiduulin mittaus GASMET-monikaasuanalysaattorilla Tekniikka ja Liikenne 2013 1. Johdanto Erikoistyön tavoitteena selvittää Vaasan ammattikorkeakoulun
Jari-Jussi Syrjä 1200715 JÄTEHUOLLON ERIKOISTYÖ Typpioksiduulin mittaus GASMET-monikaasuanalysaattorilla Tekniikka ja Liikenne 2013 1. Johdanto Erikoistyön tavoitteena selvittää Vaasan ammattikorkeakoulun
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Penicillium brevicompactum sienen entsyymiaktiivisuuden säilyminen ympäristönäytteissä
 Sisäilmastoseminaari 2014 Helsingin Messukeskus 13.3.2014 Penicillium brevicompactum sienen entsyymiaktiivisuuden säilyminen ympäristönäytteissä Salmela A, Moisa J, Reponen T, Pasanen P Ympäristötieteen
Sisäilmastoseminaari 2014 Helsingin Messukeskus 13.3.2014 Penicillium brevicompactum sienen entsyymiaktiivisuuden säilyminen ympäristönäytteissä Salmela A, Moisa J, Reponen T, Pasanen P Ympäristötieteen
Sekoitinsarja Käyttöohje
 Sekoitinsarja Käyttöohje Lue ohjekirja huolellisesti ennen laitteen käyttöönottoa. Käytä laitetta vain käyttöohjeen mukaisesti. Säilytä ohjekirja lukemiseksi tulevaisuudessa. TURVALLISUUS Laite ei ole
Sekoitinsarja Käyttöohje Lue ohjekirja huolellisesti ennen laitteen käyttöönottoa. Käytä laitetta vain käyttöohjeen mukaisesti. Säilytä ohjekirja lukemiseksi tulevaisuudessa. TURVALLISUUS Laite ei ole
Aineopintojen laboratoriotyöt 1. Veden ominaislämpökapasiteetti
 Aineopintojen laboratoriotyöt 1 Veden ominaislämpökapasiteetti Aki Kutvonen Op.nmr 013185860 assistentti: Marko Peura työ tehty 19.9.008 palautettu 6.10.008 Sisällysluettelo Tiivistelmä...3 Johdanto...3
Aineopintojen laboratoriotyöt 1 Veden ominaislämpökapasiteetti Aki Kutvonen Op.nmr 013185860 assistentti: Marko Peura työ tehty 19.9.008 palautettu 6.10.008 Sisällysluettelo Tiivistelmä...3 Johdanto...3
WintEVE Sähköauton talvitestit
 2013 WintEVE Sähköauton talvitestit J.Heikkilä Centria 5/13/2013 1 Sisältö Reitti 1 (42.3km) -2 C -5 C lämpötilassa, 10.1.2013, 14:08:28 14:59:37... 2 Reitti 1 (42.3km) -14 C -17 C lämpötilassa, 11.1.2013,
2013 WintEVE Sähköauton talvitestit J.Heikkilä Centria 5/13/2013 1 Sisältö Reitti 1 (42.3km) -2 C -5 C lämpötilassa, 10.1.2013, 14:08:28 14:59:37... 2 Reitti 1 (42.3km) -14 C -17 C lämpötilassa, 11.1.2013,
LÄÄKETEHTAAN UUMENISSA
 LÄÄKETEHTAAN UUMENISSA KOHDERYHMÄ: Soveltuu lukion KE1- ja KE3-kurssille. KESTO: n. 1h MOTIVAATIO: Työskentelet lääketehtaan laadunvalvontalaboratoriossa. Tuotantolinjalta on juuri valmistunut erä aspiriinivalmistetta.
LÄÄKETEHTAAN UUMENISSA KOHDERYHMÄ: Soveltuu lukion KE1- ja KE3-kurssille. KESTO: n. 1h MOTIVAATIO: Työskentelet lääketehtaan laadunvalvontalaboratoriossa. Tuotantolinjalta on juuri valmistunut erä aspiriinivalmistetta.
Jäähdytysnesteen ulostulo ulkoiselle lämmitykselle
 Moottorin jäähdytysnesteellä voidaan lämmittää ulkoisia elementtejä. Tällaisia ovat mm. umpikorit, nosturiohjaamot ja säilytyslaatikot. Lämpö otetaan sylinteriryhmän virtauksesta ja se palautetaan jäähdyttimen
Moottorin jäähdytysnesteellä voidaan lämmittää ulkoisia elementtejä. Tällaisia ovat mm. umpikorit, nosturiohjaamot ja säilytyslaatikot. Lämpö otetaan sylinteriryhmän virtauksesta ja se palautetaan jäähdyttimen
Aurinkolämmitin XP2. Käyttöopas FI
 Aurinkolämmitin XP2 Käyttöopas FI ID-KOODI: M-1631.2013 ID-KOODI: M-1633.2013 Swim & Fun Scandinavia info@swim-fun.com www.swim-fun.com Sivu 1 Sisällysluettelo 1. Turvallisuusohjeet 2 2. Laitteen toimintatapa
Aurinkolämmitin XP2 Käyttöopas FI ID-KOODI: M-1631.2013 ID-KOODI: M-1633.2013 Swim & Fun Scandinavia info@swim-fun.com www.swim-fun.com Sivu 1 Sisällysluettelo 1. Turvallisuusohjeet 2 2. Laitteen toimintatapa
5$32577, 1 (8) Kokeen aikana vaihteisto sijaitsi tasalämpöisessä hallissa.
 5$32577, 1 (8) 5967(&12/2*
5$32577, 1 (8) 5967(&12/2*
LABORATORIOTYÖ: AGAROOSIGEELIELEKTROFOREESI
 LABORATORIOTYÖ: AGAROOSIGEELIELEKTROFOREESI Agaroosigeelielektroforeesi (AGE) on yksinkertainen ja tehokas menetelmä erikokoisten DNAjaksojen erottamiseen, tunnistamiseen ja puhdistamiseen. Eri valmistajien
LABORATORIOTYÖ: AGAROOSIGEELIELEKTROFOREESI Agaroosigeelielektroforeesi (AGE) on yksinkertainen ja tehokas menetelmä erikokoisten DNAjaksojen erottamiseen, tunnistamiseen ja puhdistamiseen. Eri valmistajien
HI ja HI ph/ec/tds/ C Mittarit
 Käyttöohje 1 HI9811-5 ja HI9812-5 ph/ec/tds/ C Mittarit Käyttöohje Sisällysluettelo Käyttöohje 2 Yleistä...3 Laitteen käyttö...4 Alkuvalmistelut...4 ph-mittaus...4 EC/TDS-mittaus...4 Lämpötilamittaus...5
Käyttöohje 1 HI9811-5 ja HI9812-5 ph/ec/tds/ C Mittarit Käyttöohje Sisällysluettelo Käyttöohje 2 Yleistä...3 Laitteen käyttö...4 Alkuvalmistelut...4 ph-mittaus...4 EC/TDS-mittaus...4 Lämpötilamittaus...5
Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta.
 Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Testata kalkinhajottajan toimivuutta laboratorio-olosuhteissa.
 TUTKIMUSSELOSTUS NRO PRO 463/02 1 (4) Tilaaja Oy Metro Therm Ab Kuutamokatu 8A Karri Siren 02210 ESPOO ja Nordkalk Oyj Abp Jari Laakkonen Tytyri 08100 Lohja Tilaus Käsittelijä Kohde Tehtävä Palaveri 24.3.2002
TUTKIMUSSELOSTUS NRO PRO 463/02 1 (4) Tilaaja Oy Metro Therm Ab Kuutamokatu 8A Karri Siren 02210 ESPOO ja Nordkalk Oyj Abp Jari Laakkonen Tytyri 08100 Lohja Tilaus Käsittelijä Kohde Tehtävä Palaveri 24.3.2002
Talon valmistumisvuosi 1999 Asuinpinta-ala 441m2. Asuntoja 6
 Lattialämmitetyn rivitalon perusparannus 2015 Talon valmistumisvuosi 1999 Asuinpinta-ala 441m2. Asuntoja 6 Maakaasukattila Lattialämmitys. Putkipituus tuntematon. Ilmanvaihto koneellinen. Ei lämmön talteenottoa.
Lattialämmitetyn rivitalon perusparannus 2015 Talon valmistumisvuosi 1999 Asuinpinta-ala 441m2. Asuntoja 6 Maakaasukattila Lattialämmitys. Putkipituus tuntematon. Ilmanvaihto koneellinen. Ei lämmön talteenottoa.
Vedenlaadun ja virtaaman mittaus Teuron-, Ormi- ja Pohjoistenjoessa syksyllä 2011. Mittausraportti
 1 L U O D E C O N S U L T I N G O Y 1 3 9 2 2-4 HÄMEENLINNAN KAUPUNK I Vedenlaadun ja virtaaman mittaus Teuron-, Ormi- ja Pohjoistenjoessa syksyllä 211 Mittausraportti Mikko Kiirikki Luode Consulting Oy
1 L U O D E C O N S U L T I N G O Y 1 3 9 2 2-4 HÄMEENLINNAN KAUPUNK I Vedenlaadun ja virtaaman mittaus Teuron-, Ormi- ja Pohjoistenjoessa syksyllä 211 Mittausraportti Mikko Kiirikki Luode Consulting Oy
FX-korkeapainekäsipumpun käyttöohje. Copyright c 2012-2013 Eräliike Riistamaa Oy
 FX-korkeapainekäsipumpun käyttöohje Copyright c 2012-2013 Eräliike Riistamaa Oy 1 Johdanto FX-pumppu on suunniteltu, valmistettu ja testattu FX Airguns AB:ssä Ruotsissa. Pumpuissa käytetyt kaksi eri järjestelmää
FX-korkeapainekäsipumpun käyttöohje Copyright c 2012-2013 Eräliike Riistamaa Oy 1 Johdanto FX-pumppu on suunniteltu, valmistettu ja testattu FX Airguns AB:ssä Ruotsissa. Pumpuissa käytetyt kaksi eri järjestelmää
Vinkkejä opettajille ja odotetut tulokset SIVU 1
 Vinkkejä opettajille ja odotetut tulokset SIVU 1 Konteksti palautetaan oppilaiden mieliin käymällä Osan 1 johdanto uudelleen läpi. Kysymysten 1 ja 2 tarkoituksena on arvioida ovatko oppilaat ymmärtäneet
Vinkkejä opettajille ja odotetut tulokset SIVU 1 Konteksti palautetaan oppilaiden mieliin käymällä Osan 1 johdanto uudelleen läpi. Kysymysten 1 ja 2 tarkoituksena on arvioida ovatko oppilaat ymmärtäneet
www.laboline.fi Höyrysterilointi ja sen seuranta gke Kemialliset indikaattorit Biologiset indikaattorit Dokumentaatio
 Höyrysterilointi ja sen seuranta gke Kemialliset indikaattorit Biologiset indikaattorit Dokumentaatio johdanto Välinehuolto Eräs syy terveydenhoidon kasvaneisiin infektioriskeihin on rakenteeltaan monimutkaiset
Höyrysterilointi ja sen seuranta gke Kemialliset indikaattorit Biologiset indikaattorit Dokumentaatio johdanto Välinehuolto Eräs syy terveydenhoidon kasvaneisiin infektioriskeihin on rakenteeltaan monimutkaiset
KÄYTTÄJÄN OPAS. Yksityiskohtainen käyttöoppaasi. BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten
 KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
POHDITTAVAKSI ENNEN TYÖTÄ
 MUSTIKKATRIO KOHDERYHMÄ: Työ voidaan suorittaa kaikenikäisten kanssa, jolloin teoria sovelletaan osaamistasoon. KESTO: n. 1h MOTIVAATIO: Arkipäivän ruokakemian ilmiöiden tarkastelu uudessa kontekstissa.
MUSTIKKATRIO KOHDERYHMÄ: Työ voidaan suorittaa kaikenikäisten kanssa, jolloin teoria sovelletaan osaamistasoon. KESTO: n. 1h MOTIVAATIO: Arkipäivän ruokakemian ilmiöiden tarkastelu uudessa kontekstissa.
Joni Heikkilä WINTEVE SÄHKÖAUTON TALVITESTIT
 Joni Heikkilä C WINTEVE SÄHKÖAUTON TALVITESTIT C, Centria tutkimus ja kehitys - forskning och utveckling, 13 Joni Heikkilä WINTEVE SÄHKÖAUTON TALVITESTIT Centria ammattikorkeakoulu 2013 1 JULKAISIJA: Centria
Joni Heikkilä C WINTEVE SÄHKÖAUTON TALVITESTIT C, Centria tutkimus ja kehitys - forskning och utveckling, 13 Joni Heikkilä WINTEVE SÄHKÖAUTON TALVITESTIT Centria ammattikorkeakoulu 2013 1 JULKAISIJA: Centria
Roth Touchline viilennysjärjestelmän asennusopas
 Roth Touchline viilennysjärjestelmän asennusopas Living full of energy /7 Roth Touchline ohjausjärjestelmällä on mahdollista asettaa usealle eri tavoille, toimiakseen viilennysjärjestelmän kanssa. Järjestelmällä
Roth Touchline viilennysjärjestelmän asennusopas Living full of energy /7 Roth Touchline ohjausjärjestelmällä on mahdollista asettaa usealle eri tavoille, toimiakseen viilennysjärjestelmän kanssa. Järjestelmällä
KALKINPOISTOAINEET JA IHOMME
 KALKINPOISTOAINEET JA IHOMME Martta asuu kaupungissa, jossa vesijohtovesi on kovaa 1. Yksi kovan veden Martalle aiheuttama ongelma ovat kalkkisaostumat (kalsiumkarbonaattisaostumat), joita syntyy kylpyhuoneeseen
KALKINPOISTOAINEET JA IHOMME Martta asuu kaupungissa, jossa vesijohtovesi on kovaa 1. Yksi kovan veden Martalle aiheuttama ongelma ovat kalkkisaostumat (kalsiumkarbonaattisaostumat), joita syntyy kylpyhuoneeseen
5 LIUOKSEN PITOISUUS Lisätehtävät
 LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
joka voidaan määrittää esim. värinmuutosta seuraamalla tai lukemalla
 REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
Jussi Klemola 3D- KEITTIÖSUUNNITTELUOHJELMAN KÄYTTÖÖNOTTO
 Jussi Klemola 3D- KEITTIÖSUUNNITTELUOHJELMAN KÄYTTÖÖNOTTO Opinnäytetyö KESKI-POHJANMAAN AMMATTIKORKEAKOULU Puutekniikan koulutusohjelma Toukokuu 2009 TIIVISTELMÄ OPINNÄYTETYÖSTÄ Yksikkö Aika Ylivieska
Jussi Klemola 3D- KEITTIÖSUUNNITTELUOHJELMAN KÄYTTÖÖNOTTO Opinnäytetyö KESKI-POHJANMAAN AMMATTIKORKEAKOULU Puutekniikan koulutusohjelma Toukokuu 2009 TIIVISTELMÄ OPINNÄYTETYÖSTÄ Yksikkö Aika Ylivieska
Kirjoittaja: tutkija Jyrki Kouki, TTS tutkimus
 TUTKIMUSRAPORTTI 13.03.2009 Mittauksia hormittomalla takalla ( Type: HW Biotakka, tuotekehitysversio) Tilaaja: OY H & C Westerlund AB Kirjoittaja: tutkija Jyrki Kouki, TTS tutkimus 2 SISÄLLYSLUETTELO sivu
TUTKIMUSRAPORTTI 13.03.2009 Mittauksia hormittomalla takalla ( Type: HW Biotakka, tuotekehitysversio) Tilaaja: OY H & C Westerlund AB Kirjoittaja: tutkija Jyrki Kouki, TTS tutkimus 2 SISÄLLYSLUETTELO sivu
Sideaineen talteenoton, haihdutuksen ja tunkeuma-arvon tutkiminen vanhasta päällysteestä. SFS-EN 12697-3
 Sideaineen talteenoton, haihdutuksen ja tunkeuma-arvon tutkiminen vanhasta päällysteestä. SFS-EN 12697-3 1 Johdanto Tutkimus käsittelee testausmenetelmästandardin SFS-EN 12697-3 Bitumin talteenotto, haihdutusmenetelmää.
Sideaineen talteenoton, haihdutuksen ja tunkeuma-arvon tutkiminen vanhasta päällysteestä. SFS-EN 12697-3 1 Johdanto Tutkimus käsittelee testausmenetelmästandardin SFS-EN 12697-3 Bitumin talteenotto, haihdutusmenetelmää.
HIILIVOIMA JA HAPPAMAT SATEET
 Johdanto HIILIVOIMA JA HAPPAMAT SATEET Happosateesta alettiin huolestua 1960- luvulla. Pohjois- Euroopassa, Yhdysvalloissa ja Kanadassa havaittiin järvieliöiden kuolevan ja metsien vahingoittuvan happosateiden
Johdanto HIILIVOIMA JA HAPPAMAT SATEET Happosateesta alettiin huolestua 1960- luvulla. Pohjois- Euroopassa, Yhdysvalloissa ja Kanadassa havaittiin järvieliöiden kuolevan ja metsien vahingoittuvan happosateiden
α-amylaasi α-amylaasin eristäminen syljestä ja spesifisen aktiivisuuden määritys. Johdanto Tärkkelys Oligosakkaridit Maltoosi + glukoosi
 n eristäminen syljestä ja spesifisen aktiivisuuden määritys. Johdanto Työssä eristetään ja puhdistetaan merkittävä ja laajalti käytetty teollisuusentsyymi syljestä. pilkkoo tärkkelystä ensin oligosakkarideiksi
n eristäminen syljestä ja spesifisen aktiivisuuden määritys. Johdanto Työssä eristetään ja puhdistetaan merkittävä ja laajalti käytetty teollisuusentsyymi syljestä. pilkkoo tärkkelystä ensin oligosakkarideiksi
Osasto: Materiaalin käsittely, Rikkihapon annostelu agglomeraattiin kuljettimella
 1/6 Osasto: Projekti: TK Materiaalin käsittely, Rikkihapon annostelu agglomeraattiin kuljettimella Pvm. 17.12.2015 jatkettu 7.4.2016 Tekijä: Ville Heikkinen, Matti Okkonen, Herkko Kylli Asiakirja: Tulokset
1/6 Osasto: Projekti: TK Materiaalin käsittely, Rikkihapon annostelu agglomeraattiin kuljettimella Pvm. 17.12.2015 jatkettu 7.4.2016 Tekijä: Ville Heikkinen, Matti Okkonen, Herkko Kylli Asiakirja: Tulokset
Movair AF 170. Käyttöohje. Korvent Oy Vanha Nurmijärventie 116 01730 VANTAA FINLAND
 Movair AF 170 Käyttöohje Korvent Oy Vanha Nurmijärventie 116 01730 VANTAA FINLAND Sisällysluettelo Yleistä... 3 Varoitus!... 3 Laitteen käyttö ja suodattimien vaihto... 4 Alipaineistajan käyttö... 4 Suodattimien
Movair AF 170 Käyttöohje Korvent Oy Vanha Nurmijärventie 116 01730 VANTAA FINLAND Sisällysluettelo Yleistä... 3 Varoitus!... 3 Laitteen käyttö ja suodattimien vaihto... 4 Alipaineistajan käyttö... 4 Suodattimien
KAIKO-STEELCO US 300 ONTELOISTEN INSTRUMENTTIEN DESINFIOIVA PESULAITE
 KAIKO-STEELCO US 300 ONTELOISTEN INSTRUMENTTIEN DESINFIOIVA PESULAITE STEELCO US 300 LAITTEEN OMINAISUUDET JA EDUT KÄYTTÄJÄLLE: Adapterit kaiken kokoisille onteloisille instrumenteille; nopea ja luotettava
KAIKO-STEELCO US 300 ONTELOISTEN INSTRUMENTTIEN DESINFIOIVA PESULAITE STEELCO US 300 LAITTEEN OMINAISUUDET JA EDUT KÄYTTÄJÄLLE: Adapterit kaiken kokoisille onteloisille instrumenteille; nopea ja luotettava
LEGO EV3 Datalogging mittauksia
 LEGO EV3 Datalogging mittauksia Tehtäväkortit 19.2017 Energiamittari/ Tehtäväkortti / 2017Innokas 1 Ledin palamisajan määrittäminen Generaattorin kytkeminen Kytke generaattori energiamittarin sisääntuloon
LEGO EV3 Datalogging mittauksia Tehtäväkortit 19.2017 Energiamittari/ Tehtäväkortti / 2017Innokas 1 Ledin palamisajan määrittäminen Generaattorin kytkeminen Kytke generaattori energiamittarin sisääntuloon
Suomi. turvallisuus. selitykset
 2 BLX50 series Suomi Taita auki etusivun kuvitukset Tehosekoittimen avulla voit valmistaa esimerkiksi keittoja, juomia, pateita, majoneesia ja korppujauhoja, jauhaa keksejä tai pähkinöitä ja murskata
2 BLX50 series Suomi Taita auki etusivun kuvitukset Tehosekoittimen avulla voit valmistaa esimerkiksi keittoja, juomia, pateita, majoneesia ja korppujauhoja, jauhaa keksejä tai pähkinöitä ja murskata
Käyttöohje, ohjauspaneeli Balboa TP600
 Käyttöohje, ohjauspaneeli Balboa TP600 Tälle ohjauspaneelille on mahdollista saada wifi-ohjaus, kysy lisää huolto@allastarvike.fi Näppäimien nimet voivat vaihdella valmistajan ja mallin mukaan. Altaan
Käyttöohje, ohjauspaneeli Balboa TP600 Tälle ohjauspaneelille on mahdollista saada wifi-ohjaus, kysy lisää huolto@allastarvike.fi Näppäimien nimet voivat vaihdella valmistajan ja mallin mukaan. Altaan
29. Annossekoittimet. 29.1 Kollerisekoitin. Raimo Keskinen Pekka Niemi - Tampereen ammattiopisto
 29. Annossekoittimet Raimo Keskinen Pekka Niemi - Tampereen ammattiopisto 29.1 Kollerisekoitin Kollerisekoitin kuuluu annossekoittimiin. Se on valimosekoittimista vanhin; sen toimintaperiaate on tunnettu
29. Annossekoittimet Raimo Keskinen Pekka Niemi - Tampereen ammattiopisto 29.1 Kollerisekoitin Kollerisekoitin kuuluu annossekoittimiin. Se on valimosekoittimista vanhin; sen toimintaperiaate on tunnettu
FYSIIKAN LABORAATIOTYÖ 4 LÄMMÖNJOHTAVUUDEN, LÄMMÖNLÄPÄISYKERTOI- MEN JA LÄMMÖNSIIRTYMISKERTOIMEN MÄÄRITYS
 FYSIIKAN LABORAATIOTYÖ 4 LÄMMÖNJOHTAVUUDEN, LÄMMÖNLÄPÄISYKERTOI- MEN JA LÄMMÖNSIIRTYMISKERTOIMEN MÄÄRITYS Työselostuksen laatija: Tommi Tauriainen Luokka: TTE7SNC Ohjaaja: Ari Korhonen Työn tekopvm: 28.03.2008
FYSIIKAN LABORAATIOTYÖ 4 LÄMMÖNJOHTAVUUDEN, LÄMMÖNLÄPÄISYKERTOI- MEN JA LÄMMÖNSIIRTYMISKERTOIMEN MÄÄRITYS Työselostuksen laatija: Tommi Tauriainen Luokka: TTE7SNC Ohjaaja: Ari Korhonen Työn tekopvm: 28.03.2008
Vitocal 200 pikaohje asennusliikkeelle
 Vitocal 200 pikaohje asennusliikkeelle Perustietoa Lämpöpumput vaativat minimivirtauksen ja lämpötilaeron toimiakseen, huomioi tämä suunnittelussa ja asennuksessa. Minimivirtaukset lämmityspiirissä:
Vitocal 200 pikaohje asennusliikkeelle Perustietoa Lämpöpumput vaativat minimivirtauksen ja lämpötilaeron toimiakseen, huomioi tämä suunnittelussa ja asennuksessa. Minimivirtaukset lämmityspiirissä:
Sähköiset ohjausyksiköt
 Sähköiset ohjausyksiköt Ohjausyksiköt toimivat jatkuvalla 12 voltin jännitteellä traktoreissa, kylvö-, istutus- ja korjuukoneissa, ruiskuissa, jne. Yksiköissä automaattinen tai manuaalinen määrän säätö,
Sähköiset ohjausyksiköt Ohjausyksiköt toimivat jatkuvalla 12 voltin jännitteellä traktoreissa, kylvö-, istutus- ja korjuukoneissa, ruiskuissa, jne. Yksiköissä automaattinen tai manuaalinen määrän säätö,
Johdanto. I. TARKKUUS Menetelmä
 Accu-Chek Aviva -järjestelmän luotettavuus ja tarkkuus Johdanto Järjestelmän tarkkuus on vahvistettu ISO 15197:2003 -standardin mukaisesti. Ulkopuolinen diabetesklinikka toimitti diabeetikoilta otetut
Accu-Chek Aviva -järjestelmän luotettavuus ja tarkkuus Johdanto Järjestelmän tarkkuus on vahvistettu ISO 15197:2003 -standardin mukaisesti. Ulkopuolinen diabetesklinikka toimitti diabeetikoilta otetut
A.I.V.-HAPONSEKOITIN. malli D
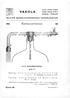 VAKOLA Postios. Helsinki RukkIla Puhelin Helsinki 84 78 12 Rautatieas. Pitäjänmäki VALTION MAATALOUSKONEIDEN TUTKIMUSLAITOS 1955 Koetusselostus 180 A.I.V.-HAPONSEKOITIN malli D Ilmoittaja: Insinööritoimisto
VAKOLA Postios. Helsinki RukkIla Puhelin Helsinki 84 78 12 Rautatieas. Pitäjänmäki VALTION MAATALOUSKONEIDEN TUTKIMUSLAITOS 1955 Koetusselostus 180 A.I.V.-HAPONSEKOITIN malli D Ilmoittaja: Insinööritoimisto
MAIDON PROTEIININ MÄÄRÄN SELVITTÄMINEN (OSA 1)
 MAIDON PROTEIININ MÄÄRÄN SELVITTÄMINEN (OSA 1) Johdanto Maito on tärkeä eläinproteiinin lähde monille ihmisille. Maidon laatu ja sen sisältämät proteiinit riippuvat useista tekijöistä ja esimerkiksi meijereiden
MAIDON PROTEIININ MÄÄRÄN SELVITTÄMINEN (OSA 1) Johdanto Maito on tärkeä eläinproteiinin lähde monille ihmisille. Maidon laatu ja sen sisältämät proteiinit riippuvat useista tekijöistä ja esimerkiksi meijereiden
PIKAKÄYTTÖOHJE V S&A Matintupa
 PIKAKÄYTTÖOHJE V1.0 2007 S&A Matintupa MITTALAITE; PAINIKKEET, PORTIT, OSAT PAIKALLINEN portti (local, L) PÄÄPORTTI (master, M) LCD NÄYTTÖ PÄÄTETUNNISTIN VIRTAKYTKIN FUNKTIONÄPPÄIN Jännitteen syöttö VAHVISTUS/
PIKAKÄYTTÖOHJE V1.0 2007 S&A Matintupa MITTALAITE; PAINIKKEET, PORTIT, OSAT PAIKALLINEN portti (local, L) PÄÄPORTTI (master, M) LCD NÄYTTÖ PÄÄTETUNNISTIN VIRTAKYTKIN FUNKTIONÄPPÄIN Jännitteen syöttö VAHVISTUS/
Käyttöohje. Tiiveystesteri
 Tiiveystesteri 1. Tiiveystesteri ja lisätarvikkeet 2. Laitteiston liittäminen yli- ja alapaineen mittausta varten 3. Asetukset 4. Mittaus 5. Tekniset tiedot Ilmanvaihdon yleismittari Swema 3000MD yhdessä
Tiiveystesteri 1. Tiiveystesteri ja lisätarvikkeet 2. Laitteiston liittäminen yli- ja alapaineen mittausta varten 3. Asetukset 4. Mittaus 5. Tekniset tiedot Ilmanvaihdon yleismittari Swema 3000MD yhdessä
Imuyksikkö - moottoriteho 750 W - max. ilmamäärä 2210 m 3 /h - max. alipaine 920 Pa - jännite 230 V - virta 5.2 A - imyksikön paino n.
 KÄYTTÖ- JA HUOLTO-OHJEET Perehdy tähän ohjekirjaan huolellisesti ennen kuin asennat, käytät tai huollat EXTOR 2300 imuria. Tämän ohjekirjan ohjeita tulee noudattaa. TEKNINEN ERITTELY EXTOR 2300 imuri:
KÄYTTÖ- JA HUOLTO-OHJEET Perehdy tähän ohjekirjaan huolellisesti ennen kuin asennat, käytät tai huollat EXTOR 2300 imuria. Tämän ohjekirjan ohjeita tulee noudattaa. TEKNINEN ERITTELY EXTOR 2300 imuri:
Tips for teachers and expected results
 Tips for teachers and expected results Työskentely aloitetaan JOHDANNOLLA, jonka aikana annetaan tietoa vatsahappoihin liittyvistä ongelmista ja antasideista. Lisäksi esitetään kysymys, joka ohjaa oppilaiden
Tips for teachers and expected results Työskentely aloitetaan JOHDANNOLLA, jonka aikana annetaan tietoa vatsahappoihin liittyvistä ongelmista ja antasideista. Lisäksi esitetään kysymys, joka ohjaa oppilaiden
Hygieniavaatimukset kauneushoitoloissa ja ihon läpäisevissä toimenpiteissä
 Hygieniavaatimukset kauneushoitoloissa ja ihon läpäisevissä toimenpiteissä Ympäristöterveydenhuollon alueelliset koulutuspäivät 09.09.2014 Oulu Päivi Aalto Esityksen sisältö Taudinaiheuttajat ja tartuntariskit
Hygieniavaatimukset kauneushoitoloissa ja ihon läpäisevissä toimenpiteissä Ympäristöterveydenhuollon alueelliset koulutuspäivät 09.09.2014 Oulu Päivi Aalto Esityksen sisältö Taudinaiheuttajat ja tartuntariskit
1 JOHDANTO 3 2 LÄHTÖTIEDOT JA MENETELMÄT 4
 Karri Kauppila KOTKAN JA HAMINAN TUULIVOIMALOIDEN MELUMITTAUKSET 21.08.2013 Melumittausraportti 2013 SISÄLLYS 1 JOHDANTO 3 2 LÄHTÖTIEDOT JA MENETELMÄT 4 2.1 Summan mittauspisteet 4 2.2 Mäkelänkankaan mittauspisteet
Karri Kauppila KOTKAN JA HAMINAN TUULIVOIMALOIDEN MELUMITTAUKSET 21.08.2013 Melumittausraportti 2013 SISÄLLYS 1 JOHDANTO 3 2 LÄHTÖTIEDOT JA MENETELMÄT 4 2.1 Summan mittauspisteet 4 2.2 Mäkelänkankaan mittauspisteet
Seokset ja liuokset. 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen
 Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
UUTISKIRJE 1/2017. Alla tiivistelmä vuoden 2017 välinehuoltajayhdistyksen koulutuspäivien luennostani.
 UUTISKIRJE 1/2017 B i o l o g i n e n i n d i k a a t t o r i Vuoden 2017 ensimmäinen uutiskirje käsittelee toivottua aihetta, eli miten ja milloin biologisia indikaattoreita käytetään höyrysterilointilaitteiden
UUTISKIRJE 1/2017 B i o l o g i n e n i n d i k a a t t o r i Vuoden 2017 ensimmäinen uutiskirje käsittelee toivottua aihetta, eli miten ja milloin biologisia indikaattoreita käytetään höyrysterilointilaitteiden
Top Analytica Oy Ab. XRF Laite, menetelmät ja mahdollisuudet Teemu Paunikallio
 XRF Laite, menetelmät ja mahdollisuudet Teemu Paunikallio Röntgenfluoresenssi Röntgensäteilyllä irroitetaan näytteen atomien sisäkuorilta (yleensä K ja L kuorilta) elektroneja. Syntyneen vakanssin paikkaa
XRF Laite, menetelmät ja mahdollisuudet Teemu Paunikallio Röntgenfluoresenssi Röntgensäteilyllä irroitetaan näytteen atomien sisäkuorilta (yleensä K ja L kuorilta) elektroneja. Syntyneen vakanssin paikkaa
TESTAUSSELOSTE Nro VTT-S Pro Clima Acrylat Solid liiman tartuntakokeet
 TESTAUSSELOSTE Nro VTT-S-25-14.9. Pro Clima Acrylat Solid liiman tartuntakokeet Tilaaja: Redi-Talot Oy TESTAUSSELOSTE NRO VTT-S-25-1 (5) Tilaaja Redi-Talot Oy Jarmo Puronlahti Yrittäjäntie 23 18 KLAUKKALA
TESTAUSSELOSTE Nro VTT-S-25-14.9. Pro Clima Acrylat Solid liiman tartuntakokeet Tilaaja: Redi-Talot Oy TESTAUSSELOSTE NRO VTT-S-25-1 (5) Tilaaja Redi-Talot Oy Jarmo Puronlahti Yrittäjäntie 23 18 KLAUKKALA
Asennusruuvien proheesiotesti
 Raportti nro: 2016-20 Tilaaja: Kingi Oy Tarjous: 2016-189 Tekijät: Tiina Vuorio, Petri Fabrin Julkaisupvm: 27.4.2016 Tiedostonimi: 2016-20_asennusruuvien_proheesiotesti.pdf Tilaajan edustaja: Jorma Kinnunen
Raportti nro: 2016-20 Tilaaja: Kingi Oy Tarjous: 2016-189 Tekijät: Tiina Vuorio, Petri Fabrin Julkaisupvm: 27.4.2016 Tiedostonimi: 2016-20_asennusruuvien_proheesiotesti.pdf Tilaajan edustaja: Jorma Kinnunen
Uponor Push 23A Pumppu- ja sekoitusryhmä
 L at t i a l ä m m i t y s U P O N O R P U S H 2 3 A Pumppu- ja sekoitusryhmä 04 2010 5042 Lattialämmityksen pumppu- ja sekoitusryhmä on pumppu- ja sekoitusryhmä, joka on tarkoitettu käytettäväksi Uponor-lattialämmitysjärjestelmän
L at t i a l ä m m i t y s U P O N O R P U S H 2 3 A Pumppu- ja sekoitusryhmä 04 2010 5042 Lattialämmityksen pumppu- ja sekoitusryhmä on pumppu- ja sekoitusryhmä, joka on tarkoitettu käytettäväksi Uponor-lattialämmitysjärjestelmän
EXTOR 2300A asbesti-imuri alipaineistukseen
 KÄYTTÖ- JA HUOLTO-OHJEET Perehdy tähän ohjeeseen huolellisesti ennen kuin asennat, käytät tai huollat EXTOR 2300A asbesti-imuria. Näitä ohjeita tulee noudattaa. TEKNINEN ERITTELY EXTOR 2300A asbesti-imuri
KÄYTTÖ- JA HUOLTO-OHJEET Perehdy tähän ohjeeseen huolellisesti ennen kuin asennat, käytät tai huollat EXTOR 2300A asbesti-imuria. Näitä ohjeita tulee noudattaa. TEKNINEN ERITTELY EXTOR 2300A asbesti-imuri
"THE FLOW" TIIVISTENESTELAITTEEN ASENNUS-, KÄYTTÖ-, JA HUOLTO-OHJE APP / APT PUMPULLE, SOVITE (T 02)
 THE FLOW TECHNO TFT OY KORVENKYLÄNTIE 10 P.O. BOX 50 40951 MUURAME, FINLAND TEL: +358-14-3722113 FAX: +358-14-3722012 E-mail: flowtechno@flowtechno.com TIIVISTENESTELAITE: TFT W02 A F Sivu: 1/7 Korvaa:
THE FLOW TECHNO TFT OY KORVENKYLÄNTIE 10 P.O. BOX 50 40951 MUURAME, FINLAND TEL: +358-14-3722113 FAX: +358-14-3722012 E-mail: flowtechno@flowtechno.com TIIVISTENESTELAITE: TFT W02 A F Sivu: 1/7 Korvaa:
RVS-TECNOLOGYN KOKEILU HAMMASVAIHTEESSA
 RAPORTTI 1 (8) RVS-TECNOLOGYN KOKEILU HAMMASVAIHTEESSA 1. Yleistä Kokeilukohteena oli koulutuskäytössä oleva yksiportainen vinohampainen hammasvaihde, jonka välityssuhde on 2.7 Vaihdetta kuormitettiin
RAPORTTI 1 (8) RVS-TECNOLOGYN KOKEILU HAMMASVAIHTEESSA 1. Yleistä Kokeilukohteena oli koulutuskäytössä oleva yksiportainen vinohampainen hammasvaihde, jonka välityssuhde on 2.7 Vaihdetta kuormitettiin
Käyttöohje Eurovac Blue Line 1000 sarjan imuri
 Käyttöohje Eurovac Blue Line 1000 sarjan imuri Tämä ohjekirja sisältää kaikki tiedot joita tarvitset laitteen asianmukaiseen käyttöön. Lue ohjekirja huolellisesti läpi ennen laitteen käyttöä ja huomioi
Käyttöohje Eurovac Blue Line 1000 sarjan imuri Tämä ohjekirja sisältää kaikki tiedot joita tarvitset laitteen asianmukaiseen käyttöön. Lue ohjekirja huolellisesti läpi ennen laitteen käyttöä ja huomioi
Liuenneen silikaatin spektrofotometrinen määritys
 Liuenneen silikaatin spektrofotometrinen määritys 1. Työn periaate Liuenneen silikaatin määritys perustuu keltaisen silikomolybdeenihapon muodostumiseen. Keltainen kompleksi pelkistetään oksaalihapolla
Liuenneen silikaatin spektrofotometrinen määritys 1. Työn periaate Liuenneen silikaatin määritys perustuu keltaisen silikomolybdeenihapon muodostumiseen. Keltainen kompleksi pelkistetään oksaalihapolla
FOSFORIPITOISUUS PESUAINEESSA
 FOSFORIPITOISUUS PESUAINEESSA TAUSTAA Pehmeä vesi on hyvän pesutuloksen edellytys. Tavallisissa pesupulvereissa fosfori esiintyy polyfosfaattina, joka suhteellisen nopeasti hydrolisoituu vedessä ortofosfaatiksi.
FOSFORIPITOISUUS PESUAINEESSA TAUSTAA Pehmeä vesi on hyvän pesutuloksen edellytys. Tavallisissa pesupulvereissa fosfori esiintyy polyfosfaattina, joka suhteellisen nopeasti hydrolisoituu vedessä ortofosfaatiksi.
energiatehottomista komponenteista tai turhasta käyntiajasta
 LUT laboratorio- ato o ja mittauspalvelut ut Esimerkkinä energiatehokkuus -> keskeinen keino ilmastomuutoksen hallinnassa Euroopan sähkönkulutuksesta n. 15 % kuluu pumppusovelluksissa On arvioitu, että
LUT laboratorio- ato o ja mittauspalvelut ut Esimerkkinä energiatehokkuus -> keskeinen keino ilmastomuutoksen hallinnassa Euroopan sähkönkulutuksesta n. 15 % kuluu pumppusovelluksissa On arvioitu, että
ALKOHOLIPITOISUUDEN MÄÄRITYS OLUESTA KAASUKROMATOGRAFIL- LA
 (1) ALKOHOLIPITOISUUDEN MÄÄRITYS OLUESTA KAASUKROMATOGRAFIL- LA 1. Standardiliuosten teko etanolista Arvioi, mikä on näytteen alkoholipitoisuus Valitse sen mukaan 3-4 standardiliuosta, jotka ovat näytteen
(1) ALKOHOLIPITOISUUDEN MÄÄRITYS OLUESTA KAASUKROMATOGRAFIL- LA 1. Standardiliuosten teko etanolista Arvioi, mikä on näytteen alkoholipitoisuus Valitse sen mukaan 3-4 standardiliuosta, jotka ovat näytteen
Kannettavat Monitoimimittarit
 Kannettavat Monitoimimittarit Malli ph/cond 340i ph/oxi 340i Multi 340i Multi 350i ProfiLine 197i ph/mv-, ORP- ja johtokykymittauksiin ph/mv-, ORP- ja liuenneen hapen (DO) mittari ph/mv-, liuenneen hapen-(do)
Kannettavat Monitoimimittarit Malli ph/cond 340i ph/oxi 340i Multi 340i Multi 350i ProfiLine 197i ph/mv-, ORP- ja johtokykymittauksiin ph/mv-, ORP- ja liuenneen hapen (DO) mittari ph/mv-, liuenneen hapen-(do)
b) Laske prosentteina, paljonko sydämen keskimääräinen teho muuttuu suhteessa tilanteeseen ennen saunomista. Käytä laskussa SI-yksiköitä.
 Lääketieteellisten alojen valintakokeen 009 esimerkkitehtäviä Tehtävä 4 8 pistettä Aineistossa mainitussa tutkimuksessa mukana olleilla suomalaisilla aikuisilla sydämen keskimääräinen minuuttitilavuus
Lääketieteellisten alojen valintakokeen 009 esimerkkitehtäviä Tehtävä 4 8 pistettä Aineistossa mainitussa tutkimuksessa mukana olleilla suomalaisilla aikuisilla sydämen keskimääräinen minuuttitilavuus
Rasvattoman maidon laktoosipitoisuuden määritys entsymaattisesti
 Rasvattoman maidon laktoosipitoisuuden määritys entsymaattisesti 1. Työn periaate Esikäsitellyn näyteliuoksen sisältämä laktoosi hajotetaan (hydrolysoidaan) entsymaattisesti D-glukoosiksi ja D-galaktoosiksi
Rasvattoman maidon laktoosipitoisuuden määritys entsymaattisesti 1. Työn periaate Esikäsitellyn näyteliuoksen sisältämä laktoosi hajotetaan (hydrolysoidaan) entsymaattisesti D-glukoosiksi ja D-galaktoosiksi
Lego Mindstorms NXT. OPH oppimisympäristöjen kehittämishanke 2011-2013. (C) 2012 Oppimiskeskus Innokas! All Rights Reserved 1
 Lego Mindstorms NXT OPH oppimisympäristöjen kehittämishanke 2011-2013 (C) 2012 Oppimiskeskus Innokas! All Rights Reserved 1 Anturi- ja moottoriportit A B C 1 2 3 4 (C) 2012 Oppimiskeskus Innokas! All Rights
Lego Mindstorms NXT OPH oppimisympäristöjen kehittämishanke 2011-2013 (C) 2012 Oppimiskeskus Innokas! All Rights Reserved 1 Anturi- ja moottoriportit A B C 1 2 3 4 (C) 2012 Oppimiskeskus Innokas! All Rights
Malli ZB06-25A LUE KAIKKI KÄYTTÖOHJEET ENNEN PÖLYNIMURIN KÄYTTÖÄ. KÄYTÄ VAIN OHJEIDEN MUKAISESTI.
 Malli ZB06-25A T Ä R K E Ä Ä T U R V A L L I S U U S T I E T O A LUE KAIKKI KÄYTTÖOHJEET ENNEN PÖLYNIMURIN KÄYTTÖÄ. KÄYTÄ VAIN OHJEIDEN MUKAISESTI. KÄYTTÖOHJE SISÄLTÖ TÄRKEITÄ TURVATOIMIA... 1-3 MUISTIINPANOJA:
Malli ZB06-25A T Ä R K E Ä Ä T U R V A L L I S U U S T I E T O A LUE KAIKKI KÄYTTÖOHJEET ENNEN PÖLYNIMURIN KÄYTTÖÄ. KÄYTÄ VAIN OHJEIDEN MUKAISESTI. KÄYTTÖOHJE SISÄLTÖ TÄRKEITÄ TURVATOIMIA... 1-3 MUISTIINPANOJA:
Toimintaperiaate: 2. Kytke virta vastaanottimeen käyttämällä virtalaitetta, jossa on merkintä "horsealarm receiver only".
 Toimintaperiaate: 1. Kytke virta toistimeen käyttämällä virtalaitetta, jossa on merkintä "RadioLink only". Kun virta on kytketty toistimeen, laitteen vihreä valo välähtää. 2. Kytke virta vastaanottimeen
Toimintaperiaate: 1. Kytke virta toistimeen käyttämällä virtalaitetta, jossa on merkintä "RadioLink only". Kun virta on kytketty toistimeen, laitteen vihreä valo välähtää. 2. Kytke virta vastaanottimeen
LUE KÄYTTÖOHJE KOKONAISUUDESSAAN ENNEN LAITTEEN KÄYTTÖÄ SÄILYTÄ NÄMÄ OHJEET
 TÄMÄ SISÄLTYY: Tuulettimen Virtapainike nopeuden merkkivalot Takasäleikkö EA I SK KE NEN I HA AL KO RK Etusäleikkö Vesisäiliö Tuulettimen nopeuspainike Valopainike USB-johto USB-virta-adapteri LUE KÄYTTÖOHJE
TÄMÄ SISÄLTYY: Tuulettimen Virtapainike nopeuden merkkivalot Takasäleikkö EA I SK KE NEN I HA AL KO RK Etusäleikkö Vesisäiliö Tuulettimen nopeuspainike Valopainike USB-johto USB-virta-adapteri LUE KÄYTTÖOHJE
33. Valimohiekkojen kuljetuslaitteet
 33. Valimohiekkojen kuljetuslaitteet Raimo Keskinen Pekka Niemi - Tampereen ammattiopisto 33.1 Hihnakuljettimet Hihnakuljettimet ovat yleisimpiä valimohiekkojen siirtoon käytettävissä kuljetintyypeistä.
33. Valimohiekkojen kuljetuslaitteet Raimo Keskinen Pekka Niemi - Tampereen ammattiopisto 33.1 Hihnakuljettimet Hihnakuljettimet ovat yleisimpiä valimohiekkojen siirtoon käytettävissä kuljetintyypeistä.
OPINPOLKU 5 BIODIESELIN VALMISTAMINEN
 Oulun Seudun Ammattiopisto Page 1 of 8 Turkka Sunnari & Pekka Veijola OPINPOLKU 5 BIODIESELIN VALMISTAMINEN PERIAATE/MENETELMÄ 70 L raakaöljyä pumpataan reaktoriin, jossa se esilämmitetään n. 60 C. Öljyn
Oulun Seudun Ammattiopisto Page 1 of 8 Turkka Sunnari & Pekka Veijola OPINPOLKU 5 BIODIESELIN VALMISTAMINEN PERIAATE/MENETELMÄ 70 L raakaöljyä pumpataan reaktoriin, jossa se esilämmitetään n. 60 C. Öljyn
FI 10 KÄYTTÖ. 650 mm min.
 OHJEET JA SUOSITUKSET Nämä käyttöohjeet koskevat useita tuuletintyyppejä. On mahdollista, että tekstissä on yksityiskohtia, jotka eivät koske valitsemaasi tuuletinta. ASENNUS Valmistaja ei vastaa virheellisestä
OHJEET JA SUOSITUKSET Nämä käyttöohjeet koskevat useita tuuletintyyppejä. On mahdollista, että tekstissä on yksityiskohtia, jotka eivät koske valitsemaasi tuuletinta. ASENNUS Valmistaja ei vastaa virheellisestä
1. Nimeä kuvaan nuolien osoittamat reitit/tavat, joiden kautta haitalliset aineet voivat päästä elimistöön.
 KOTITEHTÄVÄ 1 Biokemian menetelmät I syksy 2015 Opiskelijanumero: Kotitehtäviä saa miettiä ryhminä, mutta jokainen opiskelija palauttaa oman itsenäisesti käsin kirjoitetun vastauksen tehtäviin. Kotitehtävästä
KOTITEHTÄVÄ 1 Biokemian menetelmät I syksy 2015 Opiskelijanumero: Kotitehtäviä saa miettiä ryhminä, mutta jokainen opiskelija palauttaa oman itsenäisesti käsin kirjoitetun vastauksen tehtäviin. Kotitehtävästä
PK-yrityksen kokemuksia KaivosVV:stä ja mitä
 PK-yrityksen kokemuksia KaivosVV:stä ja mitä olemme tehneet sen aikana SanOx Ltd, Jukka Hakola, Commercial Director Jukka.hakola@sansox.fi +358 40 500 1123 DOUBLE WINNER OF EU INNOVATION AWARD 2014 OxTube,
PK-yrityksen kokemuksia KaivosVV:stä ja mitä olemme tehneet sen aikana SanOx Ltd, Jukka Hakola, Commercial Director Jukka.hakola@sansox.fi +358 40 500 1123 DOUBLE WINNER OF EU INNOVATION AWARD 2014 OxTube,
ROMUMETALLIA OSTAMASSA (OSA 1)
 ROMUMETALLIA OSTAMASSA (OSA 1) Johdanto Kupari on metalli, jota käytetään esimerkiksi sähköjohtojen, tietokoneiden ja putkiston valmistamisessa. Korkean kysynnän vuoksi kupari on melko kallista. Kuparipitoisen
ROMUMETALLIA OSTAMASSA (OSA 1) Johdanto Kupari on metalli, jota käytetään esimerkiksi sähköjohtojen, tietokoneiden ja putkiston valmistamisessa. Korkean kysynnän vuoksi kupari on melko kallista. Kuparipitoisen
