JULKAISUSARJA 13/2016 PEMBROLITSUMABI PD-L1-POSITIIVISEN EI-PIENISOLUISEN KEUHKOSYÖVÄN HOIDOSSA. Arviointikooste
|
|
|
- Tarja Lahti
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 JULKAISUSARJA 13/2016 PEMBROLITSUMABI PD-L1-POSITIIVISEN EI-PIENISOLUISEN KEUHKOSYÖVÄN HOIDOSSA Arviointikooste
2 PEMBROLITSUMABI PD-L1- POSITIIVISEN EI-PIENISOLUISEN KEUHKOSYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 13/2016 Julkaisuajankohta lokakuu 2016 Lääkealan turvallisuus- ja kehittämiskeskus Fimea 2016 Julkaisija Lääkealan turvallisuus- ja kehittämiskeskus Fimea Postiosoite: PL 55, FIMEA Puh. vaihde: Jakelutiedot ISBN ISSN-L ISSN (painettu) ISSN (verkkojulkaisu) ARVIOINTIRYHMÄ Ulla Härkönen LL, TtM, MPH, tutkijalääkäri Lääkehoitojen arviointi -prosessi, Lääkealan turvallisuus- ja kehittämiskeskus Fimea Ei arviointiin liittyviä sidonnaisuuksia. Vesa Kiviniemi FL, tilastotieteilijä Lääkehoitojen arviointi -prosessi, Lääkealan turvallisuus- ja kehittämiskeskus Fimea Ei arviointiin liittyviä sidonnaisuuksia. Tuomas Oravilahti FM, proviisori, lääketaloustieteilijä Lääkehoitojen arviointi -prosessi, Lääkealan turvallisuus- ja kehittämiskeskus Fimea Ei arviointiin liittyviä sidonnaisuuksia. 2
3 SISÄLLYSLUETTELO TIIVISTELMÄ... 4 RESUMÉ... 5 ABSTRACT ARVIOINNIN TAVOITE PEMBROLITSUMABIN HOIDOLLISET VAIKUTUKSET Pembrolitsumbi-tutkimukset ja niiden keskeiset tulokset Vertailu nivolumabi-hoitoon Turvallisuus KUSTANNUKSET POHDINTA Hoidon vaikutukset Kustannukset ja annosteluun liittyvät näkökulmat Epäsuoraan nivolumabi-vertailuun liittyvät epävarmuustekijät KEYNOTE-010 -tulosten sovellettavuutta rajoittavat tekijät Johtopäätökset LÄHTEET
4 TIIVISTELMÄ Härkönen U, Kiviniemi V, Oravilahti T. Pembrolitsumabi PD-L1-positiivisen eipienisoluisen keuhkosyövän hoidossa. Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Fimea kehittää, arvioi ja informoi -julkaisusarja 13/ s. ISBN Tämän arvioinnin tavoitteena oli verrata pembrolitsumabia nivolumabiin PD-L1-positiivisen ei-pienisoluisen keuhkosyövän hoidossa. Arvioinnissa tarkasteltiin eroja hoitojen vaikutuksissa sekä kustannuksissa. Pembrolitsumabin ja nivolumabin vertailua PD-L1-positiivisen ei-pienisoluisen keuhkosyövän hoidossa vaikeuttaa tutkimusasetelmien merkittävä erilaisuus. Siltä osin kuin vertailu on epäsuorasti mahdollista, ei ole näyttöä siitä, että nämä PD-1-vasta-aineet poikkeaisivat teholtaan tai turvallisuusprofiililtaan merkittävästi toisistaan. Näin ollen hoidon valinta voisi toistaiseksi perustua esimerkiksi todellisiin kustannuksiin ja hoidon toteuttamiseen liittyviin seikkoihin käyttö-aiheen mukaiset rajaukset huomioiden. 4
5 RESUMÉ Härkönen U, Kiviniemi V, Oravilahti T. Pembrolizumab i behandling av PD-L1- positiv icke-småcellig lungcancer. Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea. Publikationsserien Fimea utvecklar, utvärderar och informerar 13/ s. ISBN Målet med denna utvärdering är att jämföra pembrolizumab med nivolumab i behandling av PD-L1-positiv icke-småcellig lungcancer. Utvärderingen granskar skillnader i effekterna och kostnaderna mellan dessa behandlingar. Jämförelsen av pembrolizumab och nivolumab i behandlingen av PD-L1-positiv ickesmåcellig lungcancer försvåras emellertid av en betydande skillnad i forskningsuppställningen. Till den del en jämförelse indirekt är möjlig, finns det inga belägg för att dessa PD-1- antikroppar betydligt skulle avvika från varandra i fråga om effekt eller säkerhetsprofil. Valet av behandling kunde således tillsvidare grunda sig på t.ex. de faktiska kostnaderna och faktorer som ansluter sig till genomförandet av behandlingen med beaktande av begränsningarna avseende indikation. 5
6 ABSTRACT Härkönen U, Kiviniemi V, Oravilahti T. Pembrolizumab in the treatment of PD- L1 positive non-small-cell lung cancer. Finnish Medicines Agency Fimea. Serial Publication Fimea Develops, Assesses and Informs 13/ p. ISBN The purpose of this assessment is to compare pembrolizumab with nivolumab in the treatment of PD-L1 positive non-small-cell lung cancer. The focus is in exploring differences in the therapeutic effects and costs of these two treatments. The comparison between pembrolizumab and nivolumab in the treatment of PD-L1 positive non-small-cell lung cancer is challenging due to differences in clinical study designs. As far as indirect comparison is possible to conduct, there is no evidence that these two PD-1 antibodies have significantly different efficacy or safety profile. Therefore, the choice of treatment can be based for example on actual costs or administration of the treatment while taking into account the limitations of therapeutic indications. 6
7 1 ARVIOINNIN TAVOITE Keuhkosyöpä on eniten kuolleisuutta aiheuttava syöpä Suomessa (Suomen Syöpärekisteri 2016). Keuhkosyövän diagnostiikka on kehittynyt huomattavasti viimeisen kymmenen vuoden aikana, ja nykyisin hoito pyritään kohdentamaan mahdollisimman tarkasti kasvaimen ominaisuuksien mukaan. Suurin osa (noin %) kaikista keuhkosyövistä on eipienisoluisia (non-small-cell lung cancer, NSCLC) (Reck ym. 2014). Pembrolitsumabi on PD-1-vasta-aineiden ryhmään kuuluva monoklonaalinen vasta-aine, joka sai vuonna 2015 EU-alueella myyntiluvan edenneen melanooman hoitoon. Elokuussa 2016 käyttöaihe laajentui aikuisten potilaiden paikallisesti edenneen tai metastasoituneen eipienisoluisen keuhkosyövän hoitoon. Lisäksi keuhkosyövän hoidossa edellytyksenä on, että kasvain ilmentää PD-L1-ligandia ja potilaat ovat saaneet aiemmin ainakin yhtä solunsalpaajahoitoa. Hoidon aloituksen edellytyksenä on myös, että potilaat, joiden kasvaimessa on EGFR- tai ALK-positiivisia mutaatioita, ovat aiemmin saaneet tällaisiin mutaatioihin hyväksyttyä hoitoa. (Valmisteyhteenveto, pembrolitsumabi) Tämän arvioinnin tarkoituksena on arvioida pembrolitsumabin hoidollisia ja taloudellisia vaikutuksia ei-pienisoluisen keuhkosyövän hoidossa, käyttöaiheen mukaisessa potilaspopulaatiossa (taulukko 1). Ei-pienisoluisen keuhkosyövän hoitoon on olemassa useita lääkkeellisiä hoitovaihtoehtoja. Tässä arvioinnissa keskitytään lähinnä vertailemaan pembrolitsumabia toiseen PD-1-vasta-aineeseen nivolumabiin. Fimea on aiemmin julkaissut arviointiraportin, joka käsitteli nivolumabin hoidollisia ja taloudellisia vaikutuksia ei-pienisoluisen keuhkosyövän hoidossa (Härkönen ym. 2016). Taulukko 1. Väestö Arviointiaiheen määrittely ja rajaus. Aikuiset potilaat, joilla on paikallisesti edennyt tai metastasoinut ei-pienisoluinen keuhkosyöpä, ja kasvain ilmentää PD-L1-ligandia*. Lisäksi edellytyksenä on, että potilaat ovat saaneet aiemmin ainakin yhtä solunsalpaajahoitoa ja että potilaat, joiden kasvaimessa on EGFR- tai ALK-positiivisia mutaatioita, ovat aiemmin saaneet tällaisiin mutaatioihin hyväksyttyä hoitoa. Arvioitava lääkehoito Vertailuhoito Alaryhmät: - levyepiteeliperäinen syöpä - ei-levyepiteeliperäinen syöpä (adenokarsinooma) Pembrolitsumabi Nivolumabi Lopputulokset Kokonaiselossaoloaika (OS) Elossaoloaika ennen taudin etenemistä (PFS) 12 kuukauden elossaoloaika Objektiivisesti arvioitu hoitovaste (ORR) Hoidon haittavaikutukset Kustannukset *Tässä arvioinnissa PD-L1-ilmentymisen rajana on 1 %. Toisin sanoen, sellaiset kasvaimet, joissa PD-L1-ilmentymisen tason on vähintään 1 %, määritellään PD-L1-positiivisiksi. 7
8 2 PEMBROLITSUMABIN HOIDOLLISET VAIKUTUKSET 2.1 Pembrolitsumbi-tutkimukset ja niiden keskeiset tulokset Pembrolitsumabin vaikutuksia ja turvallisuutta kuvaavia tuloksia on julkaistu yhdestä faasin II/III satunnaistetusta tutkimuksesta (Herbst ym. 2016). Tämän KEYNOTE-010 -tutkimuksen aineisto koostui potilaista, jotka sairastivat edennyttä ei-pienisoluista keuhkosyöpää. Suurin osa kasvaimista (70 %) oli ei-levyepiteeliperäisiä, 21 % oli levyepiteeliperäisiä ja 8 %:n histologia oli muu tai tuntematon. Kaikki kasvaimet olivat PD-L1-positiivisia 1. Potilaat olivat aiemmin saaneet platinapohjaista kemoterapiaa, ja mikäli kasvain oli EGFR- tai ALKpositiivinen, heitä oli hoidettu myös asianmukaisella tyrosiinikinaasi-inhibiittorilla. KEYNOTE tutkimuksen ensisijaiset tulosmuuttujat olivat kokonaiselossaoloaika (OS) sekä elossaoloaika ennen taudin etenemistä (PFS). Molempia mitattiin erikseen koko tutkimuspopulaatiossa (TPS 1 %) sekä potilailla, joilla kasvaimen PD-L1-pitoisuus oli hyvin suuri (TPS 50 %). Potilaat satunnaistettiin saamaan kolmen viikon välein pembrolitsumabia 2 mg/kg (n = 345), pembrolitsumabia 10 mg/kg (n = 236) tai dosetakselia (n = 343). Hoidon keston mediaani oli molemmissa pembrolitsumabi-ryhmissä 3,5 kuukautta ja dosetakseli-ryhmässä 2,0 kuukautta. Pembrolitsumabi-ryhmän (2 mg/kg) potilaista 40 % ja dosetakseli-ryhmän potilaista 44 % sai jatkohoitona jotain antineoplastista hoitoa tutkimuslääkkeen jälkeen. Tavallisimpia jatkohoitoja pembrolitsumabi-ryhmässä (2 mg/kg) olivat dosetakseli (24 %), erlotinibi (8 %), gemsitabiini (5 %) ja pemetreksedi (5 %). Dosetakseli-ryhmän potilaat saivat useimmiten jatkohoitona erlotinibia (10 %), nivolumabia (9 %) tai gemsitabiinia (9 %). Ei-pienisoluisen keuhkosyövän hoitoa kohdennettaessa on nykykäsityksen mukaan yhä tärkeämpää erottaa toisistaan taudin histologiset ja immunohistokemialliset alatyypit (Mali ym. 2013, Travis ym. 2015). KEYNOTE-010 -tutkimuksen tulokset on kuitenkin raportoitu pääasiassa siten, ettei tuloksia ole eroteltu taudin histologian mukaan käyttöaiheen mukaisella pembrolitsumabin annostellulla (2 mg/kg). Tässä arvioinnissa keskitytään tarkastelemaan vain käyttöaiheen mukaisesti annostellun pembrolitsumabi-hoidon (2 mg/kg) tuloksia verrattuna dosetakseli-hoitoon. KEYNOTE-010 -tutkimuksen keskeiset tulokset on esitetty taulukossa 2. 1 tumour proportion score (TPS) 1 % eli PD-L1-ilmentyminen (ekspressio) havaittiin vähintään yhdessä prosentissa kasvainsoluja. 8
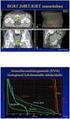
9 Taulukko 2. KEYNOTE-010 -tutkimuksen keskeiset tulokset pembrolitsumabin käyttöaiheen mukaisella annostelulla (2 mg/kg), taudin histologian mukaisissa alaryhmissä. Tulokset on raportoitu potilasjoukosta, jossa kasvaimen PD-L1- ilmentymisen taso on vähintään 1 %. (EPAR 2016, Herbst ym. 2016). Levyepiteeliperäinen ja ei-levyepiteeliperäinen 3 NSCLC, yhdistetyt tulokset (n = 678) Levyepiteeliperäinen NSCLC (n = 142) Ei-levyepiteeliperäinen 3 NSCLC (n = 481) Pembrolitsumabi 2 mg/kg Dosetakseli OS-mediaani (kk) 10,4 8,5 PFS-mediaani (kk) 3,9 4,0 12 kk:n elossaolo-osuus 43 % 35 % ORR 18 % 9 % OS - - OS - - Pembrolitsumabi vs. dosetakseli HR tai RR (95 %:n LV) 0,71 1 (0,58 0,88) 0,88 1 (0,74 1,05) 1,25 2 (1,03 1,51) 1,93 2 (1,30 2,88) 0,88 1 (0,55 1,39) 0,67 1 (0,52 0,87) OS: kokonaiselossaoloaika; PFS: elossaoloaika ennen taudin etenemistä; ORR: objektiivisesti arvioitu hoitovaste (hoitovasteen saavuttaneiden potilaiden osuus); NSCLC: ei-pienisoluinen keuhkosyöpä; LV: luottamusväli; -: tieto ei saatavilla. 1 Hasardisuhde (HR): HR < 1 tarkoittaa, että pembrolitsumabin vaikutus on dosetakselin vaikutusta suotuisampi. 2 Riskisuhde (RR): RR > 1 tarkoittaa, että pembrolitsumabin vaikutus on dosetakselin vaikutusta suotuisampi. 3 Ei-levyepiteeliperäisellä syövällä tarkoitetaan tässä yhteydessä adenokarsinoomaa. 2.2 Vertailu nivolumabi-hoitoon Pembrolitsumabin ja nivolumabin välisessä epäsuorassa vertailussa ei todettu eroa kokonaiselossaoloajassa levyepiteeliperäisen tai ei-levyepiteeliperäisen ei-pienisoluisen keuhkosyövän hoidossa potilailla, joiden kasvaimen PD-L1-ilmentymisen taso on vähintään 1 % (kuvio 1). Kuvio 1. Pembrolitsumabin ja nivolumabin välinen epäsuora vertailu keuhkojen eipienisoluisen levyepiteelisyövän (vasemmalla) ja adenokarsinooman (oikealla) hoidossa. Kuviossa on esitetty kokonaiselossaoloajan hasardisuhteet (95 %:n luottamusvälit). *CheckMate 057 -tutkimuksessa 7 %:lla (n = 41) kokonaispopulaatiosta kasvaimen histologia oli muu kuin adenokarsinooma. 1 nivolumabi vs. dosetakseli; 2 pembrolitsumabi vs. dosetakseli; 3 nivolumabi vs. pembrolitsumabi. Epäsuora vertailu tehtiin EUnetHTA-verkoston suosituksen mukaisesti Bucherin menetelmällä (Bucher ym. 1997, EUnetHTA 2015). Vertailu perustuu levyepiteeliperäisen syövän osalta CheckMate 017 -tutkimukseen (Brahmer ym. 2015) ja ei-levyepiteeliperäisen syövän osalta CheckMate 057 -tutkimukseen (Borghaei ym. 2015), joissa molemmissa nivolumabin vertailuhoitona oli dosetakseli. Pembrolitsumabin ja nivolumabin välisessä epäsuorassa vertailussa käytettiin lopputulosmuuttujana kokonaiselossaoloaikaa, joka oli ensisijainen tulosmuuttuja KEYNOTE-010-, CheckMate 017- ja CheckMate 057 -tutkimuksissa. Muiden muuttujien osalta epäsuoran vertailun tekeminen ei ollut mahdollista, koska tarvittavia tuloksia ei ollut käytössä pembrolitsumabista käyttöaiheen mukaisella annostuksella (2 mg/kg) taudin histologian mukaisissa alaryhmissä. 9
10 Levyepiteeliperäiseen syöpään liittyen epäsuora vertailu perustuu pembrolitsumabin osalta KEYNOTE-010 -tutkimuksen alaryhmäanalyysiin (n = 142), jossa kasvaimen histologia oli levyepiteelisyöpä, PD-L1-ilmentymisen taso vähintään 1 % ja pembrolitsumabin annos 2 mg/kg. Näitä kokonaiselossaoloajan tuloksia verrattiin nivolumabia koskevan CheckMate 017 -tutkimuksen alaryhmäanalyysiin (n = 119), jossa kasvaimen histologia oli levyepiteelisyöpä ja PD-L1-ilmentymisen taso vähintään 1 %. CheckMate 017 -tutkimuksessa kasvaimen PD-L1-ilmentymisen taso ei vaikuttanut OS-tulokseen. Tutkimuksen ITT-populaatiossa 2 kokonaiselossaoloajan hasardisuhde oli 0,59 (95 %:n LV 0,44 0,79) ja PD-L1-positiivisten 3 kasvainten alaryhmässä 0,69 (95 %:n LV 0,45 1,05). Ei-levyepiteeliperäisen syövän osalta epäsuora vertailu perustuu KEYNOTE tutkimuksen alaryhmäanalyysiin (n = 471), jossa kasvaimen histologia oli adenokarsinooma, PD-L1-ilmentymisen taso vähintään 1 % ja pembrolitsumabin annos 2 mg/kg. Kokonaiselossaoloajan tuloksia verrattiin CheckMate 057 -tutkimuksen alaryhmäanalyysiin (n = 246), jossa kasvaimen PD-L1-ilmentymisen taso oli vähintään 1 % ja suurin osa kasvaimista oli adenokarsinoomia (tutkimuksen kokonaispopulaatiossa 7 % (n = 41) kasvaimista oli histologialtaan muita kuin adenokarsinoomia). CheckMate 057 -tutkimuksessa kasvaimen PD-L1-ilmentyminen vaikutti kokonaiselossaoloaikaan, ja hoidon suotuisa vaikutus oli nähtävissä lähinnä vain PD-L1-positiivisilla kasvaimilla (Härkönen ym. 2016). Tässä esitettyyn epäsuoraan vertailuun liittyy lukuisia epävarmuustekijöitä, joita on tarkemmin käsitelty pohdinnan yhteydessä (ks. kohta 4.3). 2.3 Turvallisuus KEYNOTE-010 -tutkimuksessa pemrolitsumabi-hoitoon (2 mg/kg) liittyi vähemmän vakavia (asteen 3 5) haittavaikutuksia kuin dosetakseli-hoitoon (13 % vs. 35 %). Kuolemaan johtaneita haittoja oli pembrolitsumabi-ryhmässä (2 mg/kg) kolme 4 ja dosetakseli-ryhmässä viisi 5. Myös hoidon keskeyttäminen hoitoon liittyvien haittavaikutusten vuoksi oli harvinaisempaa pembrolitsumabi-ryhmässä (4 %) kuin dosetakseli-ryhmässä (10 %). Tavallisimpia pembrolitsumabi-hoitoon (2 mg/kg) liittyviä haittavaikutuksia olivat alentunut ruokahalu (14 %), uupumus (14 %), pahoinvointi (11 %), ihottuma (9 %) ja ripuli (7 %). Erityisen kiinnostuksen kohteena olivat mahdolliset immunologiset haitat, joista tavallisimpia pembrolitsumabiryhmän (2 mg/kg) potilailla olivat kilpirauhasen vajaatoiminta (8 %), pneumoniitti (5 %) ja kilpirauhasen liikatoiminta (4 %). (Herbst ym. 2016) Myös CheckMate 017- ja CheckMate 057 -tutkimuksissa tavallisimmat nivolumabi-hoitoon liittyvät haittavaikutukset olivat samankaltaisia ja niiden yleisyys samaa suuruusluokkaa kuin pembrolitsumabin haittavaikutuksilla KEYNOTE-010 -tutkimuksessa. Nivolumabi-hoidon turvallisuusprofiilia on kuvattu tarkemmin aiemmassa arviointiraportissa (Härkönen ym. 2016). Immunologisiin hoitoihin (pembrolitsumabi- ja nivolumabihoito) liittyy immuunivälitteisiä haittavaikutuksia, jotka voivat ilmaantua hoidon aikana tai kuukausien kuluttua hoidon päättymisen jälkeen. Pembrolitsumabin ja nivolumabin valmisteyhteenvedoissa on kuvattu toimintaohjeet tilanteisiin, joissa immuunivälitteisiä haittavaikutuksia ilmenee. 2 hoitoaieanalyysin mukainen tutkimusväestö (ITT = intention to treat) 3 PD-L1-ilmentymisen taso vähintään 1 % 4 kaksi pneumoniittia ja yksi pneumonia 5 akuutti sydämen vajaatoiminta, kuivuminen (dehydraatio), kuumeinen neutropenia, interstitiaalinen keuhkosairaus ja hengitystieinfektio 10
11 3 KUSTANNUKSET Tässä osiossa on lyhyesti vertailtu pembrolitsumabi- ja nivolumabi-hoidon kustannuksia. Perusanalyysissa käytettiin seuraavia oletuksia: Potilaan paino on 73 kg (Härkönen ym. 2016) Yhden annostelukerran kustannukset ovat 307,36 euroa (Härkönen ym. 2016) Hoidon kokonaiskesto on keskimäärin kuusi kuukautta (vrt. Härkönen ym. 2016) Lääkkeiden hintoina käytetään verottomia tukkuhintoja, ja mahdollisia sairaaloille myönnettäviä alennuksia ei huomioida laskelmassa Pembrolitsumabia on saatavilla yhdessä pakkauskoossa 50 mg, jonka veroton tukkuhinta on 1783,00 euroa. Nivolumabia on saatavilla kahta pakkauskokoa 40 mg ja 100 mg. Näiden pakkausten verottomat tukkuhinnat ovat 591,20 euroa ja 1478,00 euroa. Esimerkkipotilaan (73 kg) yhteen annostelukertaan tarvitaan kolme pakkausta pembrolitsumabia (2 mg/kg), ja annostelu tapahtuu kolmen viikon välein. Vastaavasti nivolumabi-hoidossa edullisin kombinaatio 73 kg painavalle potilaalle saavutetaan käyttämällä yksi 100 mg:n pakkaus ja kolme 40 mg:n pakkausta yhtä annostelukertaa kohti. Nivolumabia annostellaan 3 mg/kg kahden viikon välein. Taulukossa 3 on kuvattu hoidon kokonaiskustannukset pembrolitsumabi- ja nivolumabi-hoidossa. Laskelmassa ei huomioitu mahdollisia sairaalakohtaisia alennuksia lääkkeiden hinnoissa. Taulukko 3. Lääke Pembrolitsumabi- ja nivolumabi-hoidon kokonaiskustannukset potilasta kohden, kun potilaan paino on 73 kg. hoidon kesto (kk) Lääkekustannukset ( ) Annostelukustannukset ( ) Kokonaiskustannukset ( ) Pembrolitsumabi Nivolumabi Perusanalyysin mukaiset potilaskohtaiset kokonaiskustannukset ovat suuruusluokaltaan hyvin samankaltaiset pembrolitsumabi- ja nivolumabi-hoidoissa. Nivolumabi-hoidossa tulee enemmän annostelukertoja ja yksi infuusio kestää pidempään. Toisaalta pembrolitsumabin lääkekustannukset ovat hieman nivolumabia suuremmat. Kokonaisuudessaan sekä pembrolitsumabi- että nivolumabi-hoidon keskimääräisiin kustannuksiin vaikuttavat erityisesti hoidon kesto ja potilaan paino. Käytännössä hoidon keskimääräisessä kestossa ei oleteta olevan merkittäviä eroja pembrolitsumabi- ja nivolumabi-hoidon välillä. Saatavilla olevien pakkauskokojen vuoksi pembrolitsumabi- ja nivolumabi-hoitojen kokonaiskustannusten erotukseen voi vaikuttaa merkittävästi potilaan paino. Kuviossa 2 on esitetty pembrolitsumabi- ja nivolumabi-hoidon kustannukset (lääke- ja annostelukustannukset) potilaan painon funktiona. Molemmilla lääkkeillä kuusi kuukautta kestävän hoidon kustannukset vaihtelevat noin ja euron välillä, potilaan painosta riippuen. Pembrolitsumabi-hoidon kustannukset ovat kuitenkin tietyillä potilaan painoilla nivolumabi-hoitoa suuremmat. Esimerkiksi 65 kg painavalla potilaalla kuuden kuukauden hoidon kustannukset ovat noin euroa suuremmat ja 85 kg painavalla potilaalla kustannusten ero on noin euroa, mikäli valmisteyhteenvetojen mukaisia annostuksia noudatetaan täsmällisesti ja ylijäävää osuutta ei voida hyödyntää muiden potilaiden hoidossa. 11
12 Kuvio 2. Pembrolitsumabi- ja nivolumabi-hoidon kustannukset (lääke- ja annostelukustannukset) potilaan painon funktiona. Hoidon kestoksi on oletettu kuusi kuukautta. 12
13 4 POHDINTA 4.1 Hoidon vaikutukset Käyttöaiheen mukaisesti annosteltuna (2 mg/kg) pembrolitsumabin on osoitettu pidentävän kokonaiselossaoloajan (OS) mediaania 1,9 kuukaudella dosetakseliin verrattuna. Vaikutuksessa elossaoloaikaan ennen taudin etenemistä (PFS) ei ollut eroa dosetakseliin verrattuna. PFS ei kuitenkaan ole optimaalinen tulosmuuttuja arvioitaessa immunologisten hoitojen tehoa. Immuunivasteen muuntajilla (kuten pembrolitsumabilla ja nivolumabilla) hoitovaste voi tulla esiin hitaasti, ja hoidon todellinen hyöty saattaa näkyä vasta 1 2 vuoden kuluttua hoidon aloituksesta lisääntyneenä elossaolevien potilaiden osuutena (Koivunen ym. 2016). Elossaoloaikaa koskevia tuloksia tulkittaessa on huomioitava, että KEYNOTE tutkimuksessa 41 % potilaista sai tutkimuslääkkeen lisäksi jatkohoitona muuta systeemistä syöpähoitoa. Jatkohoitoa saaneiden potilaiden osuus oli samaa suuruusluokkaa myös nivolumabi-hoitoon liittyen (CheckMate 017- ja CheckMate 057 -tutkimuksissa noin %). Pembrolitsumabi- ja nivolumabi-hoidon haittavaikutukset ovat jokseenkin samanlaisia ja niiden yleisyys on samaa suuruusluokkaa. 4.2 Kustannukset ja annosteluun liittyvät näkökulmat Kuuden kuukauden pembrolitsumabi-hoidon kustannukset (lääke- ja annostelukustannukset) ovat 73 kg -painoista potilasta kohden noin euroa ja nivolumabihoidon kustannukset noin euroa. Pembrolitsumabista on saatavilla vain yksi pakkauskoko ja nivolumabista kaksi eri pakkauskokoa. Tämä vaikuttaa lääkehävikin määrään, ja tietyillä potilaan painoilla pembrolitsumabi-hoidon kustannukset ovat nivolumabi-hoidon kustannuksia suuremmat. Pembrolitsumabi annostellaan 30 minuutin infuusiona kolmen viikon välein ja nivolumabi 60 minuutin infuusiona kahden viikon välein. Näin ollen pembrolitsumabin lyhyempi annosteluaika ja pidempi annosteluväli voi olla potilaan näkökulmasta parempi. 4.3 Epäsuoraan nivolumabi-vertailuun liittyvät epävarmuustekijät Pembrolitsumabin ja nivolumabin välisessä epäsuorassa vertailussa ei todettu eroa kokonaiselossaoloajassa potilailla, joiden kasvaimessa PD-L1-ilmentymisen tason on vähintään 1 %. Muiden muuttujien osalta epäsuoraa vertailua ei ollut mahdollista tehdä. Epäsuoraan vertailuun liittyy useita epävarmuustekijöitä, jotka liittyvät erityisesti eroihin tutkimusväestöissä. Levyepiteeliperäisen syövän osalta CheckMate 017 -tutkimuksessa oli mukana vain toisen linjan hoitoa saavia potilaita, mutta KEYNOTE-010 -tutkimuksessa myös myöhempien hoitolinjojen potilaita. KEYNOTE-010 -tutkimuksessa ja te 057 -tutkimuksessa ei-levyepiteeliperäisen syövän määrittelyt poikkesivat toisistaan. KEYNOTE-010 -tutkimuksessa vanhimmat potilaat olivat 70-vuotiaita, mutta CheckMate 017- ja CheckMate 057 -tutkimuksissa oli mukana myös iäkkäämpiä potilaita. Myös erot tutkimusasetelmissa vaikeuttavat epäsuoran vertailun tulosten tulkintaa. Lisäksi epäsuoran vertailun tulokset perustuvat alaryhmäanalyyseihin sekä KEYNOTE-010 -tutkimuksen että molempien CheckMate -tutkimusten osalta. 4.4 KEYNOTE-010 -tulosten sovellettavuutta rajoittavat tekijät Ei-pienisoluisen keuhkosyövän hoitoa kohdennettaessa on nykykäsityksen mukaan yhä tärkeämpää erottaa toisistaan taudin histologiset ja immunohistokemialliset alatyypit (Mali ym. 2013, Travis ym. 2015). KEYNOTE-010 -tutkimuksessa oli mukana sekä levyepiteeliperäisiä että ei-levyepiteeliperäisiä kasvaimia, mutta tuloksia ei pääasiassa ole raportoitu histologisten alaryhmien mukaisesti. Joissakin alaryhmäanalyyseissä tulokset on raportoitu taudin histologian mukaan, mutta tällöin pembrolitsumabi-annosryhmät 2 mg/kg ja 10 mg/kg on yhdistetty. Julkaistua tietoa on siis erittäin rajallisesti saatavilla pembrolitsumabin vaikutuksista ja 13
14 turvallisuudesta histologisissa alaryhmissä (levyepiteeliperäinen ja ei-levyepiteeliperäinen syöpä) valmisteyhteenvedon mukaisella hoitoannoksella (2 mg/kg). KEYNOTE-010 -tutkimuksessa ei ollut mukana yli 70-vuotiaita potilaita eikä potilaita, joiden suorituskyky on alentunut (ECOG > 1). Tämä tulee huomioida hoitoon soveltuvien potilaiden valinnassa. Suomessa yli kolmannes (36 %) uusista keuhkosyövistä todetaan henkilöillä, jotka ovat 75-vuotiaita tai vanhempia (Suomen Syöpärekisteri 2016). Keuhkosyöpäpotilaiden suorituskyvystä ei ole tarkkaa tietoa, mutta todennäköisesti suorituskyky on hyvä vain pienellä osalla potilaista, jotka saavat toisen linjan hoitoa. Vastaavan kaltaisia rajoitteita liittyy myös CheckMate 017- ja CheckMate 057 -tutkimuksiin. KEYNOTE-010 -tutkimuksessa oli mukana vain potilaita, joiden kasvaimessa PD-L1-ilmentymisen taso on vähintään 1 %. Käyttöaihe on myös rajattu tämän mukaisesti. PD-L1-markkerin testaaminen ei tiettävästi ole Suomessa vielä rutiininomainen käytäntö. Olisi syytä pohtia, miten PD-L1-markkerin testaaminen järjestetään Suomessa luotettavasti ja kustannustehokkaasti diagnostiikkaan liittyvänä käytäntönä. 4.5 Johtopäätökset Tällä hetkellä pembrolitsumabin ja nivolumabin vertailua ei-pienisoluisen keuhkosyövän hoidossa vaikeuttaa tutkimusasetelmien merkittävä erilaisuus. Myös erot niiden virallisissa käyttöaiheissa selittyvät suurelta osin erilaisilla tutkimusasetelmilla ja kliinisten tutkimusohjelmien tavoitteiden erilaisuudella. Siltä osin kuin pembrolitsumabin ja nivolumabin vertailu on epäsuorasti mahdollista, ei ole näyttöä siitä, että nämä PD-1-vasta-aineet poikkeaisivat teholtaan tai turvallisuusprofiililtaan merkittävästi toisistaan. Näin ollen hoidon valinta voisi perustua esimerkiksi todellisiin kustannuksiin ja hoidon toteuttamiseen liittyviin seikkoihin käyttöaiheen mukaiset rajaukset huomioiden. 14
15 LÄHTEET Borghaei H, Paz-Ares L, Horn L ym. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373(17): Brahmer J, Reckamp KL, Baas P ym. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373(2): Bucher HC, Guyatt GH, Griffith LE, ym. The Results of Direct and Indirect Treatment Comparisons in Meta-Analysis of Randomized Controlled Trials. J Clin Epidemiol 1997;50(6): European Medicines Agency. Extension of indication variation assessment report, _Variation/human/003820/WC pdf [siteerattu ]. Tekstiviite (EPAR 2016) European network for Health Technology Assessment (EUnetHTA) Guideline. Comparators & Comparisons: Direct and indirect comparisons. Adapted version (2015) based on Comparators & Comparisons: Direct and indirect comparisons February Direct%20and%20indirect%20comparisons_Amended%20JA1%20Guideline_Final%20Nov% pdf [siteerattu ]. Tekstiviite (EUnetHTA 2015) Herbst RS, Baas P, Kim DW ym. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016 Apr 9;387(10027): Härkönen U, Kiviniemi V, Oravilahti T ym. Nivolumabi ei-pienisoluisen keuhkosyövän hoidossa. Lääkealan turvallisuusja kehittämiskeskus Fimea. Fimea kehittää, arvioi ja informoi -julkaisusarja 6/ s, 2. korjattu painos. [siteerattu ] Koivunen J, Knuuttila A, Mali P. Levinneen keuhkosyövän nykyaikainen lääkehoito mitä totunnaisten solunsalpaajien lisäksi? Duodecim 2016;132: Mali P. Keuhkosyövän patologia ja molekyylibiologia. Kirjassa Joensuu H, Roberts PJ, Kellokumpu-Lehtinen P-L ym. (toim.) Syöpätaudit. Kustannus Oy Duodecim 2013, s Reck M, Popat S, Reinmuth N ym. Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2014;25(Supplement 3): iii27 iii39. Suomen Syöpärekisteri, päivitetty [siteerattu ] Travis WD, Brambilla E, Nicholson AG ym. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol Sep;10(9): Valmisteyhteenveto, nivolumabi (Opdivo ), _Product_Information/human/003985/WC pdf [siteerattu ] Valmisteyhteenveto, pembrolitsumabi (Keytruda ), _Product_Information/human/003820/WC pdf [siteerattu ] 15
16 Lääkealan turvallisuus- ja kehittämiskeskus Säkerhets- och utvecklingscentret för läkemedelsområdet Finnish Medicines Agency PL 55, FIMEA Käyntiosoitteet: Helsinki, Mannerheimintie 103b Mannerheimintie 166, Helsinki (Valvontalaboratorio) Microkatu 1, Kuopio
JULKAISUSARJA 7/2017 ATETSOLITSUMABI EI- PIENISOLUISEN KEUHKOSYÖ- VÄN TOISEN LINJAN HOIDOS- SA. Uusien sairaalalääkkeiden nopea arviointi
 JULKAISUSARJA 7/2017 ATETSOLITSUMABI EI- PIENISOLUISEN KEUHKOSYÖ- VÄN TOISEN LINJAN HOIDOS- SA Uusien sairaalalääkkeiden nopea arviointi ATETSOLITSUMABI EI- PIENISOLUISEN KEUHKOSYÖVÄN TOISEN LINJAN HOIDOSSA
JULKAISUSARJA 7/2017 ATETSOLITSUMABI EI- PIENISOLUISEN KEUHKOSYÖ- VÄN TOISEN LINJAN HOIDOS- SA Uusien sairaalalääkkeiden nopea arviointi ATETSOLITSUMABI EI- PIENISOLUISEN KEUHKOSYÖVÄN TOISEN LINJAN HOIDOSSA
Keuhkosyövän uudet lääkkeet
 Keuhkosyövän uudet lääkkeet Jarkko Ahvonen Syöpätautien erikoislääkäri Tampereen yliopistollinen sairaala Sidonnaisuudet Asiantuntijapalkkio Boehringer Ingelheim, Bristol-Myers Squibb, Lilly, MSD, Roche
Keuhkosyövän uudet lääkkeet Jarkko Ahvonen Syöpätautien erikoislääkäri Tampereen yliopistollinen sairaala Sidonnaisuudet Asiantuntijapalkkio Boehringer Ingelheim, Bristol-Myers Squibb, Lilly, MSD, Roche
JULKAISUSARJA 6/2017 PEMBROLITSUMABI PD-L1- POSITIIVISEN EI- PIENISOLUISEN KEUHKOSYÖ- VÄN ENSILINJAN HOIDOSSA
 JULKAISUSARJA 6/2017 PEMBROLITSUMABI PD-L1- POSITIIVISEN EI- PIENISOLUISEN KEUHKOSYÖ- VÄN ENSILINJAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi PEMBROLITSUMABI PD-L1- POSITIIVISEN EI-PIENISOLUISEN
JULKAISUSARJA 6/2017 PEMBROLITSUMABI PD-L1- POSITIIVISEN EI- PIENISOLUISEN KEUHKOSYÖ- VÄN ENSILINJAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi PEMBROLITSUMABI PD-L1- POSITIIVISEN EI-PIENISOLUISEN
JULKAISUSARJA 6/2016 NIVOLUMABI EI- PIENISOLUISEN KEUHKO- SYÖVÄN HOIDOSSA
 JULKAISUSARJA 6/2016 NIVOLUMABI EI- PIENISOLUISEN KEUHKO- SYÖVÄN HOIDOSSA NIVOLUMABI EI-PIENISOLUISEN KEUHKOSYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 6/2016 Lääkealan turvallisuus-
JULKAISUSARJA 6/2016 NIVOLUMABI EI- PIENISOLUISEN KEUHKO- SYÖVÄN HOIDOSSA NIVOLUMABI EI-PIENISOLUISEN KEUHKOSYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 6/2016 Lääkealan turvallisuus-
JULKAISUSARJA 4/2016 PD-1- JA PD-L1-VASTA-AINEET. Uudet mahdolliset käyttöaiheet ja käyttöönoton kustannukset lähivuosina
 JULKAISUSARJA 4/2016 PD-1- JA PD-L1-VASTA-AINEET Uudet mahdolliset käyttöaiheet ja käyttöönoton kustannukset lähivuosina PD-1- JA PD-L1-VASTA-AINEET. UUDET MAHDOLLISET KÄYTTÖAIHEET JA KÄYTTÖÖNOTON KUSTANNUKSET
JULKAISUSARJA 4/2016 PD-1- JA PD-L1-VASTA-AINEET Uudet mahdolliset käyttöaiheet ja käyttöönoton kustannukset lähivuosina PD-1- JA PD-L1-VASTA-AINEET. UUDET MAHDOLLISET KÄYTTÖAIHEET JA KÄYTTÖÖNOTON KUSTANNUKSET
Tärkeä lääketurvatiedote terveydenhuollon ammattilaisille. RAS-villityyppistatuksen (KRAS- ja NRAS-statuksen
 Tärkeä lääketurvatiedote terveydenhuollon ammattilaisille. RAS-villityyppistatuksen (KRAS- ja NRAS-statuksen eksoneissa 2, 3 ja 4) varmistaminen on tärkeää ennen Erbitux (setuksimabi) -hoidon aloittamista
Tärkeä lääketurvatiedote terveydenhuollon ammattilaisille. RAS-villityyppistatuksen (KRAS- ja NRAS-statuksen eksoneissa 2, 3 ja 4) varmistaminen on tärkeää ennen Erbitux (setuksimabi) -hoidon aloittamista
Durvalumabi ei-pienisoluisen keuhkosyövän hoidossa kemosädehoidon jälkeen
 versio 13.3.2019 Palveluvalikoimaneuvoston suositus Durvalumabi ei-pienisoluisen keuhkosyövän hoidossa kemosädehoidon jälkeen Durvalumabi kuuluu kansalliseen palveluvalikoimaan paikallisesti edenneen,
versio 13.3.2019 Palveluvalikoimaneuvoston suositus Durvalumabi ei-pienisoluisen keuhkosyövän hoidossa kemosädehoidon jälkeen Durvalumabi kuuluu kansalliseen palveluvalikoimaan paikallisesti edenneen,
Hoidollisen ja taloudellisen arvon arviointi tukee lääkehoitoja koskevaa päätöksenteko...
 Page 1 of 4 JULKAISTU NUMEROSSA 1/2016 TEEMAT Hoidollisen ja taloudellisen arvon arviointi tukee lääkehoitoja koskevaa päätöksentekoa Piia Rannanheimo, Ulla Härkönen, Vesa Kiviniemi / Kirjoitettu 21.2.2016
Page 1 of 4 JULKAISTU NUMEROSSA 1/2016 TEEMAT Hoidollisen ja taloudellisen arvon arviointi tukee lääkehoitoja koskevaa päätöksentekoa Piia Rannanheimo, Ulla Härkönen, Vesa Kiviniemi / Kirjoitettu 21.2.2016
JULKAISUSARJA 5/2015 PD-1-VASTA-AINEET EDENNEEN MELANOOMAN HOIDOSSA
 JULKAISUSARJA 5/2015 PD-1-VASTA-AINEET EDENNEEN MELANOOMAN HOIDOSSA PD-1-VASTA-AINEET EDENNEEN MELANOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 5/2015 Lääkealan turvallisuus- ja kehittämiskeskus
JULKAISUSARJA 5/2015 PD-1-VASTA-AINEET EDENNEEN MELANOOMAN HOIDOSSA PD-1-VASTA-AINEET EDENNEEN MELANOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 5/2015 Lääkealan turvallisuus- ja kehittämiskeskus
JULKAISUSARJA 5/2016 NIVOLUMABI EDENNEEN MUNUAISSYÖVÄN HOIDOSSA
 JULKAISUSARJA 5/2016 NIVOLUMABI EDENNEEN MUNUAISSYÖVÄN HOIDOSSA NIVOLUMABI EDENNEEN MUNUAISSYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 5/2016 Lääkealan turvallisuus- ja kehittämiskeskus
JULKAISUSARJA 5/2016 NIVOLUMABI EDENNEEN MUNUAISSYÖVÄN HOIDOSSA NIVOLUMABI EDENNEEN MUNUAISSYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 5/2016 Lääkealan turvallisuus- ja kehittämiskeskus
JULKAISUSARJA 4/2018. Atetsolitsumabi, nivolumabi ja pembrolitsumabi uroteelikarsinooman hoidossa. Arviointikooste
 JULKAISUSARJA 4/2018 Atetsolitsumabi, nivolumabi ja pembrolitsumabi uroteelikarsinooman hoidossa Arviointikooste ATETSOLITSUMABI, NIVOLUMABI JA PEMBROLISTUMABI UROTEELIKARSINOOMAN HOIDOSSA - ARVIOINTIKOOSTE
JULKAISUSARJA 4/2018 Atetsolitsumabi, nivolumabi ja pembrolitsumabi uroteelikarsinooman hoidossa Arviointikooste ATETSOLITSUMABI, NIVOLUMABI JA PEMBROLISTUMABI UROTEELIKARSINOOMAN HOIDOSSA - ARVIOINTIKOOSTE
Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän
 versio 27.6.2018 Palveluvalikoimaneuvoston perustelumuistio ja perusteet neuvostolle suosituksen antamiseksi Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa
versio 27.6.2018 Palveluvalikoimaneuvoston perustelumuistio ja perusteet neuvostolle suosituksen antamiseksi Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa
Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän
 Hyväksytty Palkon kokouksessa 4.9.2018 Palveluvalikoimaneuvoston perustelumuistio Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa Hyväksytty Palkon kokouksessa
Hyväksytty Palkon kokouksessa 4.9.2018 Palveluvalikoimaneuvoston perustelumuistio Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa Hyväksytty Palkon kokouksessa
Levinneen keuhkosyövän nykyaikainen lääkehoito mitä totunnaisten solunsalpaajien lisäksi?
 KATSAUS TEEMA Jussi Koivunen, Aija Knuuttila ja Pekka Mali Levinneen keuhkosyövän nykyaikainen lääkehoito mitä totunnaisten solunsalpaajien lisäksi? Ei-pienisoluisen keuhkosyövän hoitoon on tullut viime
KATSAUS TEEMA Jussi Koivunen, Aija Knuuttila ja Pekka Mali Levinneen keuhkosyövän nykyaikainen lääkehoito mitä totunnaisten solunsalpaajien lisäksi? Ei-pienisoluisen keuhkosyövän hoitoon on tullut viime
OPDIVO (nivolumabi) Immuunivälitteisten haittavaikutusten hoito-opas. Infuusiokonsentraatti, liuosta varten. Käyttöaiheet Melanooma 1
 OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaiheet Melanooma 1 OPDIVO (nivolumabi) monoterapiana on tarkoitettu aikuisten edenneen melanooman
OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaiheet Melanooma 1 OPDIVO (nivolumabi) monoterapiana on tarkoitettu aikuisten edenneen melanooman
JULKAISUSARJA 1/2018 NIVOLUMABI UROTEELIKARSINOOMAN HOIDOSSA. Uusien sairaalalääkkeiden nopea arviointi
 JULKAISUSARJA 1/2018 NIVOLUMABI UROTEELIKARSINOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi. NIVOLUMABI UROTEELIKARSINOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 1/2018
JULKAISUSARJA 1/2018 NIVOLUMABI UROTEELIKARSINOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi. NIVOLUMABI UROTEELIKARSINOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 1/2018
JULKAISUSARJA 3/2018 PEMBROLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA. Uusien sairaalalääkkeiden nopea arviointi
 JULKAISUSARJA 3/2018 PEMBROLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi PEMBROLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja
JULKAISUSARJA 3/2018 PEMBROLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi PEMBROLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja
JULKAISUSARJA 4/2015 RAMUSIRUMABI EDENNEEN MAHASYÖVÄN JA RUOKATORVI- MAHALAUKKURAJAN ADENOKARSINOOMAN HOIDOSSA
 JULKAISUSARJA 4/2015 RAMUSIRUMABI EDENNEEN MAHASYÖVÄN JA RUOKATORVI- MAHALAUKKURAJAN ADENOKARSINOOMAN HOIDOSSA RAMUSIRUMABI EDENNEEN MAHASYÖVÄN JA RUOKATORVI- MAHALAUKKURAJAN ADENOKARSINOOMAN HOIDOSSA
JULKAISUSARJA 4/2015 RAMUSIRUMABI EDENNEEN MAHASYÖVÄN JA RUOKATORVI- MAHALAUKKURAJAN ADENOKARSINOOMAN HOIDOSSA RAMUSIRUMABI EDENNEEN MAHASYÖVÄN JA RUOKATORVI- MAHALAUKKURAJAN ADENOKARSINOOMAN HOIDOSSA
Uusien sairaalalääkkeiden arviointi Fimeassa. Vesa Kiviniemi Fimea
 Uusien sairaalalääkkeiden arviointi Fimeassa Vesa Kiviniemi Fimea 29.9.2016 Arvioinnin ja arviointiprosessin taustaa Sairaalalääkkeille ei Suomessa toistaiseksi ole ollut keskitettyä tai yhtenäistä arviointiprosessia
Uusien sairaalalääkkeiden arviointi Fimeassa Vesa Kiviniemi Fimea 29.9.2016 Arvioinnin ja arviointiprosessin taustaa Sairaalalääkkeille ei Suomessa toistaiseksi ole ollut keskitettyä tai yhtenäistä arviointiprosessia
GIOTRIF (afatinibi) Monoterapiana paikallisesti edennyttä tai etäpesäkkeistä ei-pienisoluista keuhkosyöpää sairastaville aikuispotilaille
 GIOTRIF (afatinibi) Monoterapiana paikallisesti edennyttä tai etäpesäkkeistä ei-pienisoluista keuhkosyöpää sairastaville aikuispotilaille Joita ei ole aiemmin hoidettu epidermaalisen kasvutekijän reseptorin
GIOTRIF (afatinibi) Monoterapiana paikallisesti edennyttä tai etäpesäkkeistä ei-pienisoluista keuhkosyöpää sairastaville aikuispotilaille Joita ei ole aiemmin hoidettu epidermaalisen kasvutekijän reseptorin
Lääkkeiden taloudellinen arviointi Olli Pekka Ryynänen Itä Suomen yliopisto, Fimea
 Lääkkeiden taloudellinen arviointi Olli Pekka Ryynänen Itä Suomen yliopisto, Fimea Lääkevalmisteiden arviointi Onko lääke tehokas ja turvallinen; täyttääkö se laatuvaatimukset? Lääkehoitojen arviointi
Lääkkeiden taloudellinen arviointi Olli Pekka Ryynänen Itä Suomen yliopisto, Fimea Lääkevalmisteiden arviointi Onko lääke tehokas ja turvallinen; täyttääkö se laatuvaatimukset? Lääkehoitojen arviointi
Neuroendokriinisten syöpien lääkehoito
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2015 TEEMAT Neuroendokriinisten syöpien lääkehoito Maija Tarkkanen / Kirjoitettu 16.6.2015 / Julkaistu 13.11.2015 Neuroendokriinisten (NE) syöpien ilmaantuvuus lisääntyy,
Page 1 of 5 JULKAISTU NUMEROSSA 3/2015 TEEMAT Neuroendokriinisten syöpien lääkehoito Maija Tarkkanen / Kirjoitettu 16.6.2015 / Julkaistu 13.11.2015 Neuroendokriinisten (NE) syöpien ilmaantuvuus lisääntyy,
keuhkosyövän uusista hoitotutkimuksista Jussi Koivunen, el dos OYS/Syöpätaudit
 keuhkosyövän uusista hoitotutkimuksista Jussi Koivunen, el dos OYS/Syöpätaudit 30.8.2014 Sidonnaisuudet Taloudelliset riippuvuudet: Konsultointi: - Tutkimusrahoitus: - Osakkeet: - Honorariat: Eli Lilly,
keuhkosyövän uusista hoitotutkimuksista Jussi Koivunen, el dos OYS/Syöpätaudit 30.8.2014 Sidonnaisuudet Taloudelliset riippuvuudet: Konsultointi: - Tutkimusrahoitus: - Osakkeet: - Honorariat: Eli Lilly,
Fimean suositus lääkkeiden hoidollisen ja taloudellisen arvon arvioinnista. Hannes Enlund Tutkimuspäällikkö Fimea
 Fimean suositus lääkkeiden hoidollisen ja taloudellisen arvon arvioinnista Hannes Enlund Tutkimuspäällikkö Fimea hannes.enlund@fimea.fi Kysymyksiä joihin etsitään vastauksia? Onko uusi lääke A tehokkaampi
Fimean suositus lääkkeiden hoidollisen ja taloudellisen arvon arvioinnista Hannes Enlund Tutkimuspäällikkö Fimea hannes.enlund@fimea.fi Kysymyksiä joihin etsitään vastauksia? Onko uusi lääke A tehokkaampi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto
 1 (7) 5.2.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto Fimea ja arviointiylilääkärien verkosto
1 (7) 5.2.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto Fimea ja arviointiylilääkärien verkosto
JULKAISUSARJA 2/2018 ATETSOLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA. Uusien sairaalaläkkeiden nopea arviointi
 JULKAISUSARJA 2/2018 ATETSOLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Uusien sairaalaläkkeiden nopea arviointi ATETSOLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja
JULKAISUSARJA 2/2018 ATETSOLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Uusien sairaalaläkkeiden nopea arviointi ATETSOLITSUMABI UROTEELIKARSINOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja
JULKAISUSARJA 9/2016 NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO EDENNEEN MELANOOMAN HOIDOSSA. Uusien sairaalalääkkeiden nopea arviointi
 JULKAISUSARJA 9/2016 NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO EDENNEEN MELANOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO EDENNEEN MELANOOMAN HOIDOSSA
JULKAISUSARJA 9/2016 NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO EDENNEEN MELANOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO EDENNEEN MELANOOMAN HOIDOSSA
Noin neljäsosa EU:ssa uuden myyntiluvan saavista. Uusien syöpälääkkeiden vilkas kehitys haastaa myös MYYNTILUPA-ARVIOINNIN KEHITTYMÄÄN
 OLLI TENHUNEN LT, syöpätautien erikoislääkäri Ylilääkäri, Fimea Uusien syöpälääkkeiden vilkas kehitys haastaa myös MYYNTILUPA-ARVIOINNIN KEHITTYMÄÄN Jotta uusi syöpälääke pääsee markkinoille, edellytyksenä
OLLI TENHUNEN LT, syöpätautien erikoislääkäri Ylilääkäri, Fimea Uusien syöpälääkkeiden vilkas kehitys haastaa myös MYYNTILUPA-ARVIOINNIN KEHITTYMÄÄN Jotta uusi syöpälääke pääsee markkinoille, edellytyksenä
OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten. Immuunivälitteisten haittavaikutusten hoito-opas
 Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaiheet Melanooma 1 OPDIVO monoterapiana tai yhdistelmähoitona ipilimumabin kanssa on tarkoitettu aikuisten edenneen melanooman hoitoon (jota ei voida
Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaiheet Melanooma 1 OPDIVO monoterapiana tai yhdistelmähoitona ipilimumabin kanssa on tarkoitettu aikuisten edenneen melanooman hoitoon (jota ei voida
JULKAISUSARJA 6/2019 NIVOLUMABIN JA IPILIMU- MABIN YHDISTELMÄHOITO MUNUAISKARSINOOMAN ENSI- LINJAN HOIDOSSA. Uusien sairaalalääkkeiden arviointi
 JULKAISUSARJA 6/2019 NIVOLUMABIN JA IPILIMU- MABIN YHDISTELMÄHOITO MUNUAISKARSINOOMAN ENSI- LINJAN HOIDOSSA Uusien sairaalalääkkeiden arviointi NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO MUNUAISKARSINOOMAN
JULKAISUSARJA 6/2019 NIVOLUMABIN JA IPILIMU- MABIN YHDISTELMÄHOITO MUNUAISKARSINOOMAN ENSI- LINJAN HOIDOSSA Uusien sairaalalääkkeiden arviointi NIVOLUMABIN JA IPILIMUMABIN YHDISTELMÄHOITO MUNUAISKARSINOOMAN
Arviointien hyödyntäminen käytännön työssä Ayl Katariina Klintrup Syöpätautien ja hematologian vastuualue
 Arviointien hyödyntäminen käytännön työssä 19.9.2018 Ayl Katariina Klintrup Syöpätautien ja hematologian vastuualue 1 Uuden lääkkeen käyttöönotto Alle 35 000? Menettelytapa alle 35 000 kustannuksissa?
Arviointien hyödyntäminen käytännön työssä 19.9.2018 Ayl Katariina Klintrup Syöpätautien ja hematologian vastuualue 1 Uuden lääkkeen käyttöönotto Alle 35 000? Menettelytapa alle 35 000 kustannuksissa?
Opdivo 10 mg/ml infuusiokonsentraatti, liuosta varten, Bristol-Myers Squibb Pharma EEIG.
 Page 1 of 7 JULKAISTU NUMEROSSA 3/2015 UUTTA LÄÄKKEISTÄ Nivolumabi Päivi Ruokoniemi, Olli Tenhunen / Kirjoitettu 29.9.2015 / Julkaistu 2.10.2015 Opdivo 10 mg/ml infuusiokonsentraatti, liuosta varten, Bristol-Myers
Page 1 of 7 JULKAISTU NUMEROSSA 3/2015 UUTTA LÄÄKKEISTÄ Nivolumabi Päivi Ruokoniemi, Olli Tenhunen / Kirjoitettu 29.9.2015 / Julkaistu 2.10.2015 Opdivo 10 mg/ml infuusiokonsentraatti, liuosta varten, Bristol-Myers
KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman hoitoon.
 KEYTRUDA (pembrolitsumabi) Terveydenhuollon ammattilaiset Usein kysytyt kysymykset KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman
KEYTRUDA (pembrolitsumabi) Terveydenhuollon ammattilaiset Usein kysytyt kysymykset KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman
Julkisen yhteenvedon osiot
 Erlotinib STADA 25 mg, 100 mg ja 150 mg kalvopäällysteiset tabletit 17.3.2017, versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Erlotinib STADA 25 mg, 100 mg ja 150 mg kalvopäällysteiset tabletit 17.3.2017, versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Lääkehoitojen arviointi
 Lääkehoitojen arviointi Vesa Kiviniemi Arviointipäällikkö Fimea 23.2.2018 Sisältö Sairaalalääkkeiden arviointi Tausta ja tavoitteet Arvioinnin prosessi ja PALKOn suositukset Tulevaisuuden suunnitelmia
Lääkehoitojen arviointi Vesa Kiviniemi Arviointipäällikkö Fimea 23.2.2018 Sisältö Sairaalalääkkeiden arviointi Tausta ja tavoitteet Arvioinnin prosessi ja PALKOn suositukset Tulevaisuuden suunnitelmia
Keytruda 50 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos, Merck Sharp & Dohme Limited.
 Page 1 of 6 JULKAISTU NUMEROSSA 3/2015 UUTTA LÄÄKKEISTÄ Pembrolitsumabi Päivi Ruokoniemi, Olli Tenhunen / Kirjoitettu 29.9.2015 / Julkaistu 2.10.2015 Keytruda 50 mg kuiva-aine välikonsentraatiksi infuusionestettä
Page 1 of 6 JULKAISTU NUMEROSSA 3/2015 UUTTA LÄÄKKEISTÄ Pembrolitsumabi Päivi Ruokoniemi, Olli Tenhunen / Kirjoitettu 29.9.2015 / Julkaistu 2.10.2015 Keytruda 50 mg kuiva-aine välikonsentraatiksi infuusionestettä
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi. HTA-näkökulma Sote-tietojen sekundaarikäyttöön
 Lääkkeiden hoidollisen ja taloudellisen arvon arviointi HTA-näkökulma Sote-tietojen sekundaarikäyttöön Piia Rannanheimo (proviisori) Fimea, lääketaloustieteilijä 2010 --> Canadian Agency for Drugs and
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi HTA-näkökulma Sote-tietojen sekundaarikäyttöön Piia Rannanheimo (proviisori) Fimea, lääketaloustieteilijä 2010 --> Canadian Agency for Drugs and
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
Miten syövän hoidon hyötyä mitataan? Olli Tenhunen LT FIMEA/PPSHP
 Miten syövän hoidon hyötyä mitataan? Olli Tenhunen LT FIMEA/PPSHP Disclosures No interests in pharmaceutical industry Member of EMA Scientific Advice Working Party, Oncology Working Party, Committee for
Miten syövän hoidon hyötyä mitataan? Olli Tenhunen LT FIMEA/PPSHP Disclosures No interests in pharmaceutical industry Member of EMA Scientific Advice Working Party, Oncology Working Party, Committee for
Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN
 Ohje x.x.2017 6895/00.01.02/2016 x/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut
Ohje x.x.2017 6895/00.01.02/2016 x/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut
Lääkealan turvallisuus- ja kehittämiskeskuksen ohje HAITTAVAIKUTUSTEN ILMOITTAMINEN
 Ohje 27.2.2017 6895/00.01.02/2016 1/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje HAITTAVAIKUTUSTEN ILMOITTAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut henkilöt Voimassaoloaika
Ohje 27.2.2017 6895/00.01.02/2016 1/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje HAITTAVAIKUTUSTEN ILMOITTAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut henkilöt Voimassaoloaika
Uutta lääkkeistä: Vemurafenibi
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Vemurafenibi Kristiina Airola / Julkaistu 28.9.2012. Zelboraf 240 mg kalvopäällysteinen tabletti, Roche Registration Ltd. Zelboraf-valmistetta
Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Vemurafenibi Kristiina Airola / Julkaistu 28.9.2012. Zelboraf 240 mg kalvopäällysteinen tabletti, Roche Registration Ltd. Zelboraf-valmistetta
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
Vectibix (panitumumabi) levinneessä suolistosyövässä
 Vectibix (panitumumabi) levinneessä suolistosyövässä Opas potilaan ohjaukseen lääkärille ja hoitajalle HOITOHENKILÖKUNNALLE Ensikäynnille Sisältö Mikä lääke Vectibix on? Miten se annostellaan? Odotettavissa
Vectibix (panitumumabi) levinneessä suolistosyövässä Opas potilaan ohjaukseen lääkärille ja hoitajalle HOITOHENKILÖKUNNALLE Ensikäynnille Sisältö Mikä lääke Vectibix on? Miten se annostellaan? Odotettavissa
Benepali on ensimmäinen etanerseptin biosimilaari - Sic!
 Page 1 of 5 JULKAISTU NUMEROSSA 1/2016 BIOLOGISET LÄÄKKEET Benepali on ensimmäinen etanerseptin biosimilaari Taina Methuen, Niklas Ekman, Pekka Kurki / Kirjoitettu 22.4.2016 / Julkaistu 10.5.2016 Benepali
Page 1 of 5 JULKAISTU NUMEROSSA 1/2016 BIOLOGISET LÄÄKKEET Benepali on ensimmäinen etanerseptin biosimilaari Taina Methuen, Niklas Ekman, Pekka Kurki / Kirjoitettu 22.4.2016 / Julkaistu 10.5.2016 Benepali
Uutta lääkkeistä: Palbosiklibi
 Page 1 of 5 JULKAISTU NUMEROSSA 1/2017 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Palbosiklibi Annikka Kalliokoski / Kirjoitettu 25.1.2017 / Julkaistu Ibrance 75 mg, 100 mg, 125 mg kovat kapselit, Pfizer Limited
Page 1 of 5 JULKAISTU NUMEROSSA 1/2017 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Palbosiklibi Annikka Kalliokoski / Kirjoitettu 25.1.2017 / Julkaistu Ibrance 75 mg, 100 mg, 125 mg kovat kapselit, Pfizer Limited
JULKAISUSARJA 4/2017 DARATUMUMABI- YHDISTELMÄHOITO MULTIPPELIN MYELOOMAN HOIDOSSA. Uusien sairaalalääkkeiden nopea arviointi
 JULKAISUSARJA 4/2017 DARATUMUMABI- YHDISTELMÄHOITO MULTIPPELIN MYELOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi DARATUMUMABI- YHDISTELMÄHOITO MULTIPPELIN MYELOOMAN HOIDOSSA Fimea kehittää,
JULKAISUSARJA 4/2017 DARATUMUMABI- YHDISTELMÄHOITO MULTIPPELIN MYELOOMAN HOIDOSSA Uusien sairaalalääkkeiden nopea arviointi DARATUMUMABI- YHDISTELMÄHOITO MULTIPPELIN MYELOOMAN HOIDOSSA Fimea kehittää,
Gefitinibi ei-pienisoluisen keuhkosyövän täsmähoitona?
 Katsaus AIJA KNUUTTILA, EEVA-MAIJA KARJALAINEN, ANNAMARI ROUHOS JA PEKKA MALI Gefitinibi ei-pienisoluisen keuhkosyövän täsmähoitona? Levinneeseen tai paikallisesti edenneeseen, leikkaukseen soveltumattomaan,
Katsaus AIJA KNUUTTILA, EEVA-MAIJA KARJALAINEN, ANNAMARI ROUHOS JA PEKKA MALI Gefitinibi ei-pienisoluisen keuhkosyövän täsmähoitona? Levinneeseen tai paikallisesti edenneeseen, leikkaukseen soveltumattomaan,
(9) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI. 1 Arviointiprosessin tavoitteet
 4.10.2016 1 (9) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI 1 Arviointiprosessin tavoitteet Sairaalalääkkeiden nopean arvioinnin tavoitteena on: lisätä lääkkeen käyttöönottopäätöksissä tarvittavaa tietoa
4.10.2016 1 (9) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI 1 Arviointiprosessin tavoitteet Sairaalalääkkeiden nopean arvioinnin tavoitteena on: lisätä lääkkeen käyttöönottopäätöksissä tarvittavaa tietoa
JULKAISUSARJA 3/2015 TRASTUTSUMABIEMTANSIINI HER2-POSITIIVISEN RINTASYÖVÄN HOIDOSSA
 JULKAISUSARJA 3/2015 TRASTUTSUMABIEMTANSIINI HER2-POSITIIVISEN RINTASYÖVÄN HOIDOSSA TRASTUTSUMABIEMTANSIINI HER2-POSITIIVISEN RINTASYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 3/2015
JULKAISUSARJA 3/2015 TRASTUTSUMABIEMTANSIINI HER2-POSITIIVISEN RINTASYÖVÄN HOIDOSSA TRASTUTSUMABIEMTANSIINI HER2-POSITIIVISEN RINTASYÖVÄN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 3/2015
Biologisten lääkkeiden kustannukset
 Page 1 of 6 JULKAISTU NUMEROSSA 2/2012 LÄÄKEHOITOJEN ARVIOINTI Biologisten lääkkeiden kustannukset Tuomas Oravilahti, Vesa Kiviniemi, Karri Penttilä Reumasairauksien ja syöpien hoitoon tarkoitettujen lääkkeiden
Page 1 of 6 JULKAISTU NUMEROSSA 2/2012 LÄÄKEHOITOJEN ARVIOINTI Biologisten lääkkeiden kustannukset Tuomas Oravilahti, Vesa Kiviniemi, Karri Penttilä Reumasairauksien ja syöpien hoitoon tarkoitettujen lääkkeiden
Sanofin kommentit Fimean arviointiraporttiin Semiplimabi
 21.10.2019 Sanofin kommentit Fimean arviointiraporttiin Semiplimabi Semiplimabi on ainoa lääke, jolla on Europan lääkeviraston hyväksymä käyttöaihe edenneen ihon okasolusyövän hoidossa. Valmisteelle on
21.10.2019 Sanofin kommentit Fimean arviointiraporttiin Semiplimabi Semiplimabi on ainoa lääke, jolla on Europan lääkeviraston hyväksymä käyttöaihe edenneen ihon okasolusyövän hoidossa. Valmisteelle on
Fimean ja PALKOn yhteistyö lääkkeiden arvioinnissa
 Fimean ja PALKOn yhteistyö lääkkeiden arvioinnissa Vesa Kiviniemi Fimea 22.11.2016 Fimean ja PALKOn yhteistyöalueet Uusien sairaalalääkkeiden hoidollisen ja taloudellisen arvon arviointi sekä tähän liittyvä
Fimean ja PALKOn yhteistyö lääkkeiden arvioinnissa Vesa Kiviniemi Fimea 22.11.2016 Fimean ja PALKOn yhteistyöalueet Uusien sairaalalääkkeiden hoidollisen ja taloudellisen arvon arviointi sekä tähän liittyvä
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Tarceva 25 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 25 mg erlotinibia (erlotinibihydrokloridina).
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Tarceva 25 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 25 mg erlotinibia (erlotinibihydrokloridina).
Annikka Kalliokoski, Vesa Mustalammi / Kirjoitettu / Julkaistu
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2016 Reslitsumabi Annikka Kalliokoski, Vesa Mustalammi / Kirjoitettu 28.9.2016 / Julkaistu 7.11.2016 Cinqaero 10 mg/ml infuusiokonsentraatti, liuosta varten, Teva Pharmaceuticals
Page 1 of 5 JULKAISTU NUMEROSSA 3/2016 Reslitsumabi Annikka Kalliokoski, Vesa Mustalammi / Kirjoitettu 28.9.2016 / Julkaistu 7.11.2016 Cinqaero 10 mg/ml infuusiokonsentraatti, liuosta varten, Teva Pharmaceuticals
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi. Terveysfoorumi 2011 Piia Peura Lääketaloustieteilijä Piia.Peura@fimea.fi
 Lääkkeiden hoidollisen ja taloudellisen arvon arviointi Terveysfoorumi 2011 Piia Peura Lääketaloustieteilijä Piia.Peura@fimea.fi Arviointien tavoite Tuottaa tietoa lääkkeiden käyttöönottoon ja korvattavuuteen
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi Terveysfoorumi 2011 Piia Peura Lääketaloustieteilijä Piia.Peura@fimea.fi Arviointien tavoite Tuottaa tietoa lääkkeiden käyttöönottoon ja korvattavuuteen
MITÄ UUTTA SARKOOMIEN HOIDOSSA?
 MITÄ UUTTA SARKOOMIEN HOIDOSSA? O S A S T O N Y L I L Ä Ä K Ä R I M A I J A T A R K K A N E N H Y K S S Y Ö P Ä K E S K U S LUENNON SISÄLTÖ luu- ja pehmytkudossarkoomat ei pediatrisia tutkimuksia ei gynekologisia
MITÄ UUTTA SARKOOMIEN HOIDOSSA? O S A S T O N Y L I L Ä Ä K Ä R I M A I J A T A R K K A N E N H Y K S S Y Ö P Ä K E S K U S LUENNON SISÄLTÖ luu- ja pehmytkudossarkoomat ei pediatrisia tutkimuksia ei gynekologisia
Kenelle täsmähoitoja ja millä hinnalla?
 Kenelle täsmähoitoja ja millä hinnalla? Heikki Joensuu ylilääkäri, Syöpätautien klinikka, HYKS, ja professori, Lääketieteellinen tiedekunta, Helsingin yliopisto EUROCARE-4 tutkimus Syöpäpotilaiden eloonjääminen
Kenelle täsmähoitoja ja millä hinnalla? Heikki Joensuu ylilääkäri, Syöpätautien klinikka, HYKS, ja professori, Lääketieteellinen tiedekunta, Helsingin yliopisto EUROCARE-4 tutkimus Syöpäpotilaiden eloonjääminen
Molekyylidiagnostiikka keuhkosyövän hoidossa. Jussi Koivunen, el, dos. Syöpätautien ja sädehoidon klinikka/oys
 Molekyylidiagnostiikka keuhkosyövän hoidossa Jussi Koivunen, el, dos. Syöpätautien ja sädehoidon klinikka/oys Sidonnaisuudet Taloudelliset riippuvuudet: Konsultointi: - Tutkimusrahoitus: - Honorariat:
Molekyylidiagnostiikka keuhkosyövän hoidossa Jussi Koivunen, el, dos. Syöpätautien ja sädehoidon klinikka/oys Sidonnaisuudet Taloudelliset riippuvuudet: Konsultointi: - Tutkimusrahoitus: - Honorariat:
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
JULKAISUSARJA 2/2016 KARFILTSOMIBI UUSIUTUNEEN MULTIPPELIN MYELOOMAN HOIDOSSA
 JULKAISUSARJA 2/2016 KARFILTSOMIBI UUSIUTUNEEN MULTIPPELIN MYELOOMAN HOIDOSSA KARFILTSOMIBI UUSIUTUNEEN MULTIPPELIN MYELOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 2/2016 Lääkealan
JULKAISUSARJA 2/2016 KARFILTSOMIBI UUSIUTUNEEN MULTIPPELIN MYELOOMAN HOIDOSSA KARFILTSOMIBI UUSIUTUNEEN MULTIPPELIN MYELOOMAN HOIDOSSA Fimea kehittää, arvioi ja informoi -julkaisusarja 2/2016 Lääkealan
Opas terveydenhuollon ammattilaisille. Kadcyla (trastutsumabiemtansiini)
 Opas terveydenhuollon ammattilaisille Kadcyla (trastutsumabiemtansiini) Riskienhallintamateriaali, versio 3.0. Hyväksytty Fimeassa 20.11.2018 2 Riskienhallintamateriaali marraskuu 2018 VAROITUS: Riski
Opas terveydenhuollon ammattilaisille Kadcyla (trastutsumabiemtansiini) Riskienhallintamateriaali, versio 3.0. Hyväksytty Fimeassa 20.11.2018 2 Riskienhallintamateriaali marraskuu 2018 VAROITUS: Riski
Fimea kehittää, arvioi ja informoi
 Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Adaptiiviset lääkekokeet. Lääketieteellisen tutkimusetiikan seminaari Olli Tenhunen FIMEA, OYS/syöpätaudit ja hematologia
 Adaptiiviset lääkekokeet Lääketieteellisen tutkimusetiikan seminaari 1.12.2017 Olli Tenhunen FIMEA, OYS/syöpätaudit ja hematologia 2 Sisältöä Määritelmät Adaptiivisten tutkimusten keskeiset adaptaatiot
Adaptiiviset lääkekokeet Lääketieteellisen tutkimusetiikan seminaari 1.12.2017 Olli Tenhunen FIMEA, OYS/syöpätaudit ja hematologia 2 Sisältöä Määritelmät Adaptiivisten tutkimusten keskeiset adaptaatiot
OPDIVO (nivolumabi) Immuunivälitteisten haittavaikutusten hoito-opas. Infuusiokonsentraatti, liuosta varten. Käyttöaihe. Tärkeää turvallisuustietoa
 OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaihe OPDIVO (nivolumabi) monoterapiana on tarkoitettu aikuisten edenneen melanooman hoitoon
OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaihe OPDIVO (nivolumabi) monoterapiana on tarkoitettu aikuisten edenneen melanooman hoitoon
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PEMETREXED ORION ORION CORPORATION PÄIVÄMÄÄRÄ: 18.1.2016, VERSIO 1.1 VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Keuhkopussin
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PEMETREXED ORION ORION CORPORATION PÄIVÄMÄÄRÄ: 18.1.2016, VERSIO 1.1 VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Keuhkopussin
Uusien lääkehoitojen kustannusvaikuttavuus keuhkosyövän hoidossa
 TEEMA KEUHKOSYÖVÄN DIAGNOSTIIKKA JA HOITO KATSAUS Timo Purmonen, Soili Törmälehto ja Antti Jekunen Uusien lääkehoitojen kustannusvaikuttavuus keuhkosyövän hoidossa Keuhkosyöpä on yksi yleisimmistä syövistä
TEEMA KEUHKOSYÖVÄN DIAGNOSTIIKKA JA HOITO KATSAUS Timo Purmonen, Soili Törmälehto ja Antti Jekunen Uusien lääkehoitojen kustannusvaikuttavuus keuhkosyövän hoidossa Keuhkosyöpä on yksi yleisimmistä syövistä
Julkisen yhteenvedon osiot
 Pemetrexed STADA 25 mg/ml infuusiokonsentraatti, liuosta varten 7.5.2015, versio V1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Pemetrexed STADA 25 mg/ml infuusiokonsentraatti, liuosta varten 7.5.2015, versio V1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Benchmarking Controlled Trial - a novel concept covering all observational effectiveness studies
 Benchmarking Controlled Trial - a novel concept covering all observational effectiveness studies Antti Malmivaara, MD, PhD, Chief Physician Centre for Health and Social Economics National Institute for
Benchmarking Controlled Trial - a novel concept covering all observational effectiveness studies Antti Malmivaara, MD, PhD, Chief Physician Centre for Health and Social Economics National Institute for
Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
LÄÄKKEET IHMISILLE JA ELÄIMILLE VERI- JA KUDOSVALMISTEET LÄÄKEALAN TOIMIJOIDEN VALVONTA TUTKIMUS- JA KEHITTÄMIS- TEHTÄVÄT SEKÄ LÄÄKETIEDON TUOTTAMINEN
 Ylläpidämme ja parannamme väestön terveyttä VALVOMALLA JA KEHITTÄMÄLLÄ LÄÄKEALAA Valvomme ja kehitämme lääkealaa sekä edistämme lääkkeiden järkevää käyttöä väestön terveydeksi. Toimimme sosiaali- ja terveysministeriön
Ylläpidämme ja parannamme väestön terveyttä VALVOMALLA JA KEHITTÄMÄLLÄ LÄÄKEALAA Valvomme ja kehitämme lääkealaa sekä edistämme lääkkeiden järkevää käyttöä väestön terveydeksi. Toimimme sosiaali- ja terveysministeriön
Yksi kalvopäällysteinen tabletti sisältää 100 mg erlotinibia (erlotinibihydrokloridina).
 1. LÄÄKEVALMISTEEN NIMI Tarceva 1 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 1 mg erlotinibia (erlotinibihydrokloridina). Apuaineet,
1. LÄÄKEVALMISTEEN NIMI Tarceva 1 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 1 mg erlotinibia (erlotinibihydrokloridina). Apuaineet,
Uutta melanoomasta. Pia Vihinen TYKS/Syöpäklinikka. Tutkimukset kun epäilet melanooman leviämistä
 Uutta melanoomasta Pia Vihinen TYKS/Syöpäklinikka Tutkimukset kun epäilet melanooman leviämistä Vartalon TT tutkimus tai PET-TT Verikokeet; Hb, maksa-arvot, krea Korkea LDH huonon ennusteen merkki PAD:
Uutta melanoomasta Pia Vihinen TYKS/Syöpäklinikka Tutkimukset kun epäilet melanooman leviämistä Vartalon TT tutkimus tai PET-TT Verikokeet; Hb, maksa-arvot, krea Korkea LDH huonon ennusteen merkki PAD:
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pemetrexed Fresenius Kabi 100 mg ja 500 mg Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 29.3.2016, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon
Pemetrexed Fresenius Kabi 100 mg ja 500 mg Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 29.3.2016, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon
PET-tutkimusten vaikuttavuus ja kustannukset. Esko Vanninen palvelualuejohtaja Kuopion yliopistollinen sairaala
 PET-tutkimusten vaikuttavuus ja kustannukset Esko Vanninen palvelualuejohtaja Kuopion yliopistollinen sairaala ISI Web of Science: hakusana PET/CT N = 4974, 27.4.2010 Mihin diagnostisia menetelmiä tarvitaan?
PET-tutkimusten vaikuttavuus ja kustannukset Esko Vanninen palvelualuejohtaja Kuopion yliopistollinen sairaala ISI Web of Science: hakusana PET/CT N = 4974, 27.4.2010 Mihin diagnostisia menetelmiä tarvitaan?
Immuno-onkologiaa. Tiina Tuomisto-Huttunen, LT, eval KYS/Syöpäkeskus
 Immuno-onkologiaa Tiina Tuomisto-Huttunen, LT, eval KYS/Syöpäkeskus Sisältö tulehdus syövän synnyssä epäspesifi immunoterapia checkpoint inhibiittorit - vaikutusmekanismi - esimerkkejä eri syöpien hoidossa
Immuno-onkologiaa Tiina Tuomisto-Huttunen, LT, eval KYS/Syöpäkeskus Sisältö tulehdus syövän synnyssä epäspesifi immunoterapia checkpoint inhibiittorit - vaikutusmekanismi - esimerkkejä eri syöpien hoidossa
KEUHKOSYÖVÄN SEULONTA. Tiina Palva Dosentti, Syöpätautien ja sädehoidon erikoislääkäri, Väestövastuulääkäri, Kuhmoisten terveysasema
 KEUHKOSYÖVÄN SEULONTA Tiina Palva Dosentti, Syöpätautien ja sädehoidon erikoislääkäri, Väestövastuulääkäri, Kuhmoisten terveysasema Seulonta on tiettyyn väestöryhmään kohdistuva tutkimus, jolla pyritään
KEUHKOSYÖVÄN SEULONTA Tiina Palva Dosentti, Syöpätautien ja sädehoidon erikoislääkäri, Väestövastuulääkäri, Kuhmoisten terveysasema Seulonta on tiettyyn väestöryhmään kohdistuva tutkimus, jolla pyritään
Yksi kalvopäällysteinen tabletti sisältää 150 mg erlotinibia (erlotinibihydrokloridina).
 1. LÄÄKEVALMISTEEN NIMI Tarceva 15 mg kalvopäällysteiset tabletit. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 15 mg erlotinibia (erlotinibihydrokloridina). Apuaineet:
1. LÄÄKEVALMISTEEN NIMI Tarceva 15 mg kalvopäällysteiset tabletit. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 15 mg erlotinibia (erlotinibihydrokloridina). Apuaineet:
Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi
 20 mg/ml infuusiokonsentraatti, liuosta varten Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Terveydenhuollon ammattilainen Usein kysytyt kysymykset
20 mg/ml infuusiokonsentraatti, liuosta varten Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Terveydenhuollon ammattilainen Usein kysytyt kysymykset
Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto
 1 (10) 13.4.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto Fimea ja arviointiylilääkärien verkosto
1 (10) 13.4.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto Fimea ja arviointiylilääkärien verkosto
(11) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI. 1 Arviointiprosessin tavoitteet
 21.8.2017 1 (11) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI 1 Arviointiprosessin tavoitteet Sairaalalääkkeiden nopean arvioinnin tavoitteena on: lisätä lääkkeen käyttöönottopäätöksissä tarvittavaa tietoa
21.8.2017 1 (11) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI 1 Arviointiprosessin tavoitteet Sairaalalääkkeiden nopean arvioinnin tavoitteena on: lisätä lääkkeen käyttöönottopäätöksissä tarvittavaa tietoa
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
Mitä vaikuttavuusnäytöllä tehdään? Jorma Komulainen LT, dosentti Käypä hoito suositusten päätoimittaja
 Mitä vaikuttavuusnäytöllä tehdään? Jorma Komulainen LT, dosentti Käypä hoito suositusten päätoimittaja Sidonnaisuudet Käypä hoito päätoimittaja, Duodecim Palveluvalikoimaneuvoston pysyvä asiantuntija,
Mitä vaikuttavuusnäytöllä tehdään? Jorma Komulainen LT, dosentti Käypä hoito suositusten päätoimittaja Sidonnaisuudet Käypä hoito päätoimittaja, Duodecim Palveluvalikoimaneuvoston pysyvä asiantuntija,
Keuhkosyövän ennuste pysyy edelleen huonona
 Eija-Riitta Salomaa ja Maija Walta ALKUPERÄISTUTKIMUS Hoitotulokset Varsinais-Suomen sairaanhoitopiirissä 2004 2011 JOHDANTO. Uusista hoitokeinoista huolimatta keuhkosyövän ennuste on pysynyt huonona.
Eija-Riitta Salomaa ja Maija Walta ALKUPERÄISTUTKIMUS Hoitotulokset Varsinais-Suomen sairaanhoitopiirissä 2004 2011 JOHDANTO. Uusista hoitokeinoista huolimatta keuhkosyövän ennuste on pysynyt huonona.
Liite III Valmisteyhteenvetoon ja pakkausselosteeseen tehtävät muutokset
 Liite III Valmisteyhteenvetoon ja pakkausselosteeseen Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen jäsenvaltioiden
Liite III Valmisteyhteenvetoon ja pakkausselosteeseen Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen jäsenvaltioiden
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto
 1 (9) 2.7.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto 1 Arviointiprosessin suunnittelun
1 (9) 2.7.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto 1 Arviointiprosessin suunnittelun
JULKAISUSARJA 4/2013 EDENNEEN MUNUAISSYÖVÄN ENSILINJAN LÄÄKEHOIDOT. Arviointikooste
 JULKAISUSARJA 4/2013 EDENNEEN MUNUAISSYÖVÄN ENSILINJAN LÄÄKEHOIDOT Arviointikooste EDENNEEN MUNUAISSYÖVÄN ENSILINJAN LÄÄKEHOIDOT Arviointikooste Fimea kehittää, arvioi ja informoi -julkaisusarja 4/2013
JULKAISUSARJA 4/2013 EDENNEEN MUNUAISSYÖVÄN ENSILINJAN LÄÄKEHOIDOT Arviointikooste EDENNEEN MUNUAISSYÖVÄN ENSILINJAN LÄÄKEHOIDOT Arviointikooste Fimea kehittää, arvioi ja informoi -julkaisusarja 4/2013
LIITE III. Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin
 HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten. Immuunivälitteisten haittavaikutusten hoito-opas
 OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaiheet Melanooma 1 OPDIVO monoterapiana on tarkoitettu aikuisten edenneen melanooman hoitoon
OPDIVO (nivolumabi) Infuusiokonsentraatti, liuosta varten Immuunivälitteisten haittavaikutusten hoito-opas Käyttöaiheet Melanooma 1 OPDIVO monoterapiana on tarkoitettu aikuisten edenneen melanooman hoitoon
OBINUTUTSUMABI-LÄÄKE FOLLIKULAARISEN LYMFOOMAN ENSILINJAN HOIDOSSA
 Perustelumuistio Hyväksytty Palkon kokouksessa 18.12.2018 Palveluvalikoimaneuvoston perustelumuistio OBINUTUTSUMABI-LÄÄKE FOLLIKULAARISEN LYMFOOMAN ENSILINJAN HOIDOSSA Perustelumuistio Sisällys 1. Taustaa,
Perustelumuistio Hyväksytty Palkon kokouksessa 18.12.2018 Palveluvalikoimaneuvoston perustelumuistio OBINUTUTSUMABI-LÄÄKE FOLLIKULAARISEN LYMFOOMAN ENSILINJAN HOIDOSSA Perustelumuistio Sisällys 1. Taustaa,
Muuttuva diagnostiikka avain yksilöityyn hoitoon
 Muuttuva diagnostiikka avain yksilöityyn hoitoon Olli Carpén, Patologian professori, Turun yliopisto ja Patologian palvelualue, TYKS-SAPA liikelaitos ChemBio Finland 2013 EGENTLIGA HOSPITAL FINLANDS DISTRICT
Muuttuva diagnostiikka avain yksilöityyn hoitoon Olli Carpén, Patologian professori, Turun yliopisto ja Patologian palvelualue, TYKS-SAPA liikelaitos ChemBio Finland 2013 EGENTLIGA HOSPITAL FINLANDS DISTRICT
GLP myyntilupa-arvioijan näkökulmasta
 GLP myyntilupa-arvioijan näkökulmasta Fimean GLP-keskustelupäivä 2.9. 2015 Kuopio Pauliina Lehtolainen-Dalkilic FIMEA GLPn periaatteiden tarkoitus on edistää korkealaatuisia testaustuloksia Periaatteita,
GLP myyntilupa-arvioijan näkökulmasta Fimean GLP-keskustelupäivä 2.9. 2015 Kuopio Pauliina Lehtolainen-Dalkilic FIMEA GLPn periaatteiden tarkoitus on edistää korkealaatuisia testaustuloksia Periaatteita,
Fimea ja Moniammatillinen verkosto ikäihmisten lääkkeiden käytön järkeistämiseksi. Pertti Happonen
 Fimea ja Moniammatillinen verkosto ikäihmisten lääkkeiden käytön järkeistämiseksi Pertti Happonen valvoo ja kehittää lääkealaa väestön terveydeksi Organisaatio 31.8.2012 Ylijohtaja Sinikka Rajaniemi Strateginen
Fimea ja Moniammatillinen verkosto ikäihmisten lääkkeiden käytön järkeistämiseksi Pertti Happonen valvoo ja kehittää lääkealaa väestön terveydeksi Organisaatio 31.8.2012 Ylijohtaja Sinikka Rajaniemi Strateginen
Kliiniset lääketutkimukset yliopistosairaalan näkökulma. Lasse Viinikka 18.3.2014 Etiikan päivä 2014
 Kliiniset lääketutkimukset yliopistosairaalan näkökulma Lasse Viinikka 18.3.2014 Etiikan päivä 2014 Tutkimustyön merkitys potilashoidon kannalta parantaa asiantuntijuutta korkeatasoinen tutkija on alansa
Kliiniset lääketutkimukset yliopistosairaalan näkökulma Lasse Viinikka 18.3.2014 Etiikan päivä 2014 Tutkimustyön merkitys potilashoidon kannalta parantaa asiantuntijuutta korkeatasoinen tutkija on alansa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Pemetrexed Sandoz 100 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos Pemetrexed Sandoz 500 mg kuiva-aine välikonsentraatiksi infuusionestettä
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Pemetrexed Sandoz 100 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos Pemetrexed Sandoz 500 mg kuiva-aine välikonsentraatiksi infuusionestettä
