TUTKITTAVALLE ANNETTAVA TIEDOTE KLIINISESTÄ LÄÄKETUTKIMUKSESTA
|
|
|
- Aku Saarnio
- 6 vuotta sitten
- Katselukertoja:
Transkriptio
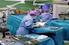
1 TUTKITTAVALLE ANNETTAVA TIEDOTE KLIINISESTÄ LÄÄKETUTKIMUKSESTA Tutkimuksen nimi Faasi I-II satunnaistettu, kaksoissokkoutettu, lumelääkkeellä kontrolloitu tutkimus, jossa arvioidaan katetrin välityksellä aivoihin annosteltavan lääkeaineen CDNF:n turvallisuutta ja siedettävyyttä idiopaattista edenneen vaiheen Parkinsonin tautia sairastavilla potilailla. Pyyntö osallistua tutkimukseen Teitä pyydetään mukaan tutkimukseen, jossa tutkitaan uutta hoitoa Parkinsonin tautiin. Tutkittava lääke on nimeltään CDNF, ja se on proteiinia sisältävä neste, joka annostellaan aivoihin käyttäen tutkittavaa lääkkeenantolaitetta. Lääkkeenantolaite asennetaan aivoihin kirurgisella robotilla ja kirurgisillatyökaluilla. Kirurginen robotti on kaupallinen tuote, mutta sen ohjaamiseen ja leikkauksen suunnitteluun tarvittavan ohjelmiston osat ovat osittain uusia. Tutkimuksessa käytettäviä kirurgisia työkaluja ei ole käytetty kliinisessä (hoidollisessa) työssä aikaisemmin. Olemme arvioineet, että soveltuisitte mukaan tutkimukseen, koska Teillä on todettu idiopaattinen edenneen vaiheen Parkinsonin tauti. Tämä tiedote kuvaa tutkimusta ja Teidän osuuttanne siinä. Tämän tiedotteen lisäksi saatte Lisätietoa tutkimukseen HP-CD-CL-2002 nimisen selosteen, jossa on lyhyesti kuvattu lääkkeenantolaite, tutkimuskäyntien sisältö sekä tutkimuksen aikana tehtävät arvioinnit. Osallistumisen vapaaehtoisuus Osallistuminen tähän tutkimukseen on täysin vapaaehtoista. Voitte keskeyttää osallistumisenne tutkimukseen koska tahansa syytä ilmoittamatta ilman, että se vaikuttaa mitenkään hoitoonne tai potilas-lääkärisuhteeseenne. Voitte myös peruuttaa suostumuksenne. Osallistumisenne keskeyttämisen tai suostumuksenne peruuttamisen jälkeen teistä kerättyjä henkilötietoja ja muita tietoja voidaan käsitellä osana tutkimusta, jos se on välttämätöntä lääkeaineen käyttötarkoituksen, ominaisuuksien, vaikutusten tai vaikuttavuuden selvittämiseksi tai arvioimiseksi tai lääkeaineen tehon ja turvallisuuden varmistamiseksi. Teidän ei tarvitse osallistua tähän tutkimukseen saadaksenne hoitoa. Lääkärinne kertoo Teille sairautenne hoitovaihtoehdoista. Tämän tutkimuksen aikana ette saa osallistua muihin kliinisiin lääketai lääkkeantolaitteiden tutkimuksiin. Lääkityksessänne saattaa olla lääkkeitä, joiden käyttö on kielletty tämän tutkimuksen aikana. Tutkijalääkärinne keskustelee lääkityksestänne yksityiskohtaisesti. Tutkijalääkäri tai tutkimuksen toimeksiantaja voivat joutua keskeyttämään osallistumisenne. Jos näin tapahtuu, kanssanne keskustellaan lopettamiseen liittyvistä syistä ja jatkotoimenpiteistä. Lukekaa rauhassa tämä tiedote. Jos Teillä on kysyttävää, voitte olla yhteydessä tutkijalääkäriin tai muuhun tutkimuksen henkilökuntaan. Jos päätätte osallistua tutkimukseen, pyydämme Teitä allekirjoittamaan liitteenä olevan suostumuslomakkeen. Tutkimuksen toteuttaja Tämän tutkimuksen toteuttavat neurologian erikoislääkäri Filip Scheperjans Helsingin ja Uudenmaan sairaanhoitopiiristä (HUS) ja Herantis Pharma Oyj, joka toimii tutkimuksen toimeksiantajana. Renishaw Plc toimii tutkimuksen toimeksiantajan yhteistyökumppanina ja TFS Oy toimii toimeksiantajan edustajana. Tutkimuksen rekisterinpitäjä on Herantis Pharma Oyj, joka vastaa tutkimuksen yhteydessä tapahtuvan henkilötietojen käsittelyn lainmukaisuudesta. Toimeksiantaja maksaa korvauksen tutkimuksen toteuttamisesta tutkijalääkärille ja muulle henkilökunnalle. 1/11
2 Tutkimuksen tausta ja tarkoitus Tämän kliinisen lääketutkimuksen tavoitteena on selvittää, onko uusi lääkeaine turvallinen ja siedetty hoitomuoto idiopaattisen Parkinsonin taudin hoidossa. Lisäksi tavoitteena on selvittää lääkkeenantolaitteen implantaation tarkkuutta, turvallisuutta ja toimintaa. Tutkittava lääkeaine, CDNF, on proteiini, jota löytyy myös luonnostaan kehosta. Tämä proteiini kuuluu hermokasvutekijöiden ryhmään. Eläinkokeissa CDNF:n on osoitettu ehkäisevän dopamiinihermosolujen kuolemaa ja rappeutumista, ja edistävän niiden uudistumista ja toiminnallista aktiivisuutta. Tämä voi johtaa hermosolujen tuhoutumisesta johtuvien sairauksien, kuten Parkinsonin taudin, tilojen paranemiseen. Koska elimistö ei kuljeta CDNF-proteiinia aivoihin, sitä ei voida antaa tablettina tai injektiona. Tässä tutkimuksessa CDNF annetaan käyttämällä laitetta, joka kiinnitetään aivoihin. Tutkimuksessa CDNF-valmistetta verrataan lumelääkkeeseen sen turvallisuuden ja siedettävyyden sekä uuden lääkkeenantolaitteen tutkimiseksi. Hermokasvutekijä CDNF:ää ei ole testattu ihmisillä aikaisemmin. Lääkkeenantolaitetta on käytetty yli 40 potilaalla aikaisemmin, mutta sillä ei vielä ole myyntilupaa. Kirurgisella robotilla on myyntilupa, mutta tutkimuksessa käytettäviä robotin ohjelmiston osia ja kirurgisia välineitä ei ole ollut hoidollisessa käytössä aikaisemmin, eikä niillä ole myyntilupaa. Lääkkeenantolaitteen toiminta testataan magneettikuvauksella ensimmäisen, lumelääkkeellä tehtävän infuusion, sekä kolmannen ja kuudennen hoitoinfuusion yhteydessä. Tutkimukseen pyydetään mukaan vuotiaita henkilöitä, jotka sairastavat idiopaattista edenneen vaiheen Parkinsonin tautia. Tutkimus- tai lumelääkettä annetaan 18:lle tutkimushenkilölle. Tutkimus suoritetaan Suomessa ja Ruotsissa. Suomessa tutkimukseen osallistuu 8-10 henkilöä. Tutkimusmenetelmät ja tutkimuksen toimenpiteet Tutkijalääkäri arvioi Teidän mahdollisuutenne osallistua tutkimukseen ja Teidän tulee täyttää tietyt osallistumisehdot. Jos ette täytä vaadittavia kriteereitä, Teille kerrotaan osallistumisen esteistä. Jatkossa saatte edelleen samaa terveydenhuollon hoitoa kuin normaalisti olisitte saaneet. Tutkimukseen osallistuminen kestää 10 kuukautta, ja sisältää 18 käyntiä (tai 19 käyntiä, jos tarvitsette ylimääräisen lumelääkeinfuusion tutkimuksen aikana). Kaksi kolmesta potilaasta saa CDNF-tutkimuslääkettä ja yksi kolmesta lumelääkettä. Teidät satunnaistetaan, ikään kuin arvotaan, johonkin tutkimusryhmistä. Te tai lääkärinne ette voi vaikuttaa mihin ryhmään teidät satunnaistetaan. Vasta tutkimuksen loputtua Te ja tutkijalääkärinne saatte tietää kumpaa lääkettä olette saaneet. Tarvittaessa, esimerkiksi henkeä uhkaavassa hätätilanteessa, tutkimuslääkärinne saa tiedon tässä tutkimuksessa saamastanne lääkityksestä. Tutkimuskäynnit sisältävät leikkauksen, jossa lääkkeenantolaitteen osat (neljä katetria ja korvan taakse asennettava portti) kiinnitetään aivoihin, enintään kahdeksan pään magneettikuvausta viiden käynnin aikana, kaksi PET-tutkimusta, selkäydinnesteen näytteenoton lannepistosta kahdella käynnillä sekä enintään neljä tietokonetomografiaa (CT). PET-tutkimukset suoritetaan PET-keskuksessa Turussa. Tämä käynti voi sisältää yöpymisen hotellissa asuinpaikastanne riippuen. Jos ensimmäisen infuusion aikana, käynnillä 6, huomataan, että katetri on tukossa, saatte lisätutkimuskäynnillä annoksen lumelääkkeettä katetrin avaamiseksi, ennen kuin teidät satunnaistetaan johonkin kolmesta tutkimuslääkeryhmästä.. Näiden käyntien aikana Teiltä otetaan verinäyte ja verenpainettanne ja sydämen lyöntitiheyttä mitataan useaan otteeseen ennen infuusiota, sen aikana ja infuusion jälkeen. Portti ja sitä ympäröivän ihon kunto arvioidaan. Teidän vointianne 2/11
3 tiedustellaan sekä kysytään onko lääkitykseenne tullut muutoksia edellisen käynnin jälkeen. Tutkimushenkilökunta on teihin yhteydessä puhelimitse 1-2 viikon kuluttua infuusion jälkeen ja tiedustelee vointianne (ellei teillä ole sovittuna tutkimuskäyntiä sairalaan tuona aikana). Leikkauksen jälkeen Teidän tulee olla sairaalassa arviolta neljän päivän ajan. Ensimmäisen ja toisen tutkimuslääkeannoksen jälkeen (käynnit 10 ja 11) Teidän tulee yöpyä klinikalla. Myös neljän muun tutkimuskäynnin yhteydessä Teidän tulee yöpyä klinikalla (käynnit 2, 9, 13 ja 17). Riippuen käyttämästänne Parkinsonin taudin lääkityksestä Teitä voidaan pyytää keskeyttämään lääkityksenne korkeintaan 24 tunnin ajaksi näiden neljän tutkimuskäynnin aikana. Teitä pyydetään myös olemaan ottamatta Parkinsonin taudin lääkkeitänne ennen PET-tutkimuksia (käynnit 8 ja 16). Tutkijalääkärinne keskustelee lääkityksestä kanssanne. Teidän vointianne tiedustellaan jokaisen käynnin yhteydessä sekä kysytään, onko lääkitykseenne tullut muutoksia. Teille tehdään lääkärintarkastus ja teiltä mitataan pulssi, verenpaine, kehon lämpötila ja teidät punnitaan. Teiltä otetaan sydänkäyrä (EKG) ja verinäyte. Leikkauksen jälkeen portti ja sitä ympäröivän ihon kunto arvioidaan. Ensimmäisellä käynnillä Teiltä otetaan verinäyte HIV-, hepatiitti B ja hepatiitti C tutkimuksia varten (Huom! Jos jokin näistä testeistä olisi positiivinen tartuntatautilaki edellyttää ilmoitusta Terveyden ja hyvinvoinnin laitokselle). Jos olette hedelmällisessä iässä oleva nainen, Teille tehdään raskaustesti virtsasta. Muutoksia Parkinsonin taudin oireissa seurataan useiden eri testien avulla, kuten potilaspäiväkirjalla, arviointitaulukoilla ja lomakkeilla sekä ranteessa kannettavan Parkinson s KinetiGraph Data Logger (PKG ) liikerekisteröintilaitteen avulla. PKG -laitetta pidetään ranteessa kuusi päivää ennen seulontakäyntiä, jokaista lääkkeenantokäyntiä ja tutkimuksen lopetuskäyntiä. Teitä pyydetään täyttämään potilaspäiväkirjaa kolmena peräkkäisenä päivänä ennen klinikkakäyntejä (seulontakäynti, kuusi lääkkeenantokäyntiä ja tutkimuksen lopetuskäynti). Päiväkirjaa täytetään jokaiselta 30 minuutilta kellon ympäri rastittamalla yksi neljästä vaihtoehdosta, jotka koskevat liikkumista ja unta. Unen ajalta tehkää merkinnät heti herättyänne. Saatte yhteensä kuusi tutkimus- tai lumelääkeannosta tutkimuksen aikana. Lumelääkkeellä (neste, joka ei sisällä vaikuttavaa ainetta) ei odoteta olevan mitään vaikutusta. Tutkimuslääkettä annetaan erisuuruisia annoksia tutkimuksen aikana. Kaikki potilaat jotka satunnaistetaan saamaan tutkimuslääkettä, saavat sitä ensin pienen annoksen (120 ug). Tutkimusryhmästä riippuen annosta nostetaan siten, että korkein annos on joko 400 ug (keskisuuri annos) tai 1200 ug (korkea annos). Ennen annoksen nostamista riippumaton asiantuntijaryhmä käy läpi Teistä tutkimuksen aikana kerätyt tutkimustulokset ja niiden perusteella arvioi annostason nostamisen turvallisuuden. Kaikkien hedelmällisessä iässä olevien naisten on käytettävä erittäin luotettavaa ehkäisyä tutkimuksen aikana sekä 30 päivää tutkimuksen päättymisen jälkeen. Tutkijalääkäri keskustelee tarvittaessa kanssanne käyttämästänne ehkäisymenetelmästä. Koska tutkimuslääkkeen vaikutusta sikiöön tai sen erittymistä rintamaitoon ei tunneta, raskaana olevat, imettävät tai raskautta suunnittelevat naiset eivät voi osallistua tähän tutkimukseen. Jos olette mies ja kumppaninne voi tulla raskaaksi, Teidän tulee käyttää kondomia. Saatte luovuttaa spermaa kolmen kuukauden jälkeen PET-tutkimuksesta. Teidän täytyy ilmoittaa lääkärillenne, jos kumppaninne tulee raskaaksi. Jos kumppaninne on hedelmällisessä iässä oleva nainen, hänen tulee käyttää erittäin luotettavaa ehkäisymenetelmää tutkimuksen aikana sekä kolmen kuukauden ajan viimeisestä PET-tutkimuksesta. Lääkärinne keskustelee tästä kanssanne. Jos tutkimukseen osallistumisenne päättyy portin ja lääkkeenantolaitteen istutusleikkauksen jälkeen, Teihin otetaan yhteyttä kolmen kuukauden välein. Teiltä tiedustellaan, onko Teillä ollut 3/11
4 terveysongelmia ja Teitä pyydetään ottamaan yhteyttä tutkimushenkilökuntaan aina, jos Teillä ilmenee lääkkeenantolaitteeseen liittyviä oireita tai ongelmia kuten päähän asennetun portin löystymistä, tai jos joudutte sairaalahoitoon. Oireita saattavat olla esimerkiksi ihotulehdus portin ympärillä, korkea kuume, niskan jäykkyys, voimakas normaalista poikkeava päänsärky, pahoinvointi ja oksentelu, epileptiset kohtaukset, keskittymisvaikeudet tai sekavuus. Ellei ongelmia tai oireita esiinny, seuranta jatkuu kunnes implantoitu lääkkeenantolaite ja portti on poistettu, tai osallistutte vapaaehtoisesti jatkotutkimukseen. Ellette osallistu jatkotutkimukseen, portti pidetään paikallaan noin kahdeksan kuukauden ajan ellei sen poistamiselle ole erityistä syytä. Jatkotutkimus on tällä hetkellä suunnitteluvaiheessa ja vaatii sekä Suomen lääkeviranomaisen että eettisen toimikunnan hyväksynnän ennen kuin se voi alkaa. Teitä pyydetään allekirjoittamaan erillinen suostumuslomake ennen kuin voitte osallistua jatkotutkimukseen. Tutkimuksen mahdolliset hyödyt On mahdollista, ettei tähän tutkimukseen osallistumisesta ole Teille hyötyä. Tutkimuksella saadaan kuitenkin lisätietoa tutkittavasta valmisteesta, CDNF:stä, sekä lääkkeenantolaitteesta Parkinsonin taudin hoidossa. Tämän tutkimuksen tulokset voivat auttaa Parkinsonin tautia sairastavia potilaita tulevaisuudessa. Saatte tietoa terveydentilastanne tutkimuksen aikana tehtävistä lääkärintarkastuksista ja laboratoriokokeista. Tutkimuksesta mahdollisesti aiheutuvat haitat ja epämukavuudet Implantaatioleikkauksen mahdolliset riskit Olette nukutettuna leikkauksen ja magneettikuvauksen aikana. Nukutus voi sisältää riskejä. Leikkaus voi aiheuttaa päänsärkyä, kuolion, turvotusta, verenvuotoa ja/tai tulehduksen aivoissa, päänahassa tai kallossa. Jos saatte tulehduksen Teille voi olla tarpeen antaa antibiootteja. Verenvuodosta aiheutuvia oireita voivat olla epileptinen kohtaus, halvaus, keskittymiskyvyn puute, muistin menetys, puheen voimakkuuden tai jonkin toisen aivotoiminnan menetys. Leikkauksen aikana aivokudos voi vahingoittua, joka voi johtaa aivohalvaukseen ja/tai kehon toisen puolen halvaantumiseen. Katetrit voidaan vahingossa asettaa eri kohtaan kuin on tarkoitettu ja tutkimuslääke voidaan vahingossa annostella väärään kohtaan. Ennen ensimmäistä tutkimuslääkkeen annostelua Teille tehdään tietokonetomografia, ja magneettikuvaus yhdessä lumelääke-infuusion kanssa, jotta katetrien toiminta ja sijainti aivoissa saadaan varmistettua. Jos katetrit ovat väärin asetetut Teille voidaan tehdä ylimääräinen leikkaus katetrien uudelleenasentamiseksi. Tutkimukseen osallistuvat neurokirurgit ovat korkeasti koulutettuja ja erittäin kokeneita aivoleikkausten ammattilaisia. Magneettikuvausta ja tietokonetomografiaa käytetään leikkauksen suunnittelussa ja leikkauksessa käytetään kirurgisia erikoistyökaluja, joilla vähennetään riskiä tehtäessä poraus kallonalaisiin aivojen kerroksiin. Verenvuotoriskiä ja aivojen vahingoittumista katetrien asentamisen seurauksena voidaan parhaiten arvioida vertaamalla kirurgiseen toimenpiteeseen, jossa aivoihin asennetaan syväaivostimulaattori. Parkinsonin tautia sairastavilla potilailla tehtyjen useiden aiempien kliinisten tutkimusten perusteella vakavan haittatapahtuman (esim. aivotoiminnan häiriö, aivojen märkäpesäke tai hemipareesi eli osittainen toispuolihalvaus) riski syväaivostimulaattorin kirurgisessa asennusleikkauksessa tai sen jälkeen on alle 2.4%. Yhdessäkään raportoidussa tapauksessa verenvuodosta ei ole aiheutunut pysyvää neurologista haittaa tai kuolemaa. Tässä tutkimuksessa käytettävä lääkkeenantolaite asennetaan potilaalle neurokirurgisessa toimenpiteessä, joka on samankaltainen syväaivostimulaattorin asennukseen verrattuna. Koska tämän tutkimuksen lääkkeenantolaitteessa on enemmän osia kuin syväaivostimulaattorissa, siihen liittyvän kokonaisriskin katsotaan olevan suurempi. Lääkkeenantolaitteen valmistajan aiemman kliinisen ja prekliinisen aineiston sekä tilastollisen laskelman perusteella lääkkeenantolaitteeseen liittyvän vakavan haittatapahtuman esiintymistodennäköisyys tässä tutkimuksessa on alle 13.4%. Näin ollen on perusteltua olettaa että 1-3 potilasta 18:sta tutkimukseen osallistuvasta potilaasta saa 4/11
5 lääkkeenantolaitteeseen liittyvän vakavan haittatapahtuman. Tällaiset vakavat haittatapahtumat voivat olla esim. neurologisia oireita liittyen aivojen sisälle asennettaviin laitteen osiin tai ihoreaktioita portin ympäristössä. Jos katetreja ei saada asennetuiksi oikeisiin kohtiin tai leikkauksen jälkeen aivoissanne havaitaan verenvuotoa, saattaa olla että ette sovellu tutkimus- tai lumelääkkeen annosteluun. Siinä tapauksessa portti poistetaan päästä kirurgisella toimenpiteellä ja ihoalue suljetaan. Muiden lääkkeenantolaitteeseen kuuluvien osien poistamista ei välttämättä tarvitse tehdä ellei lääkärinne katso sitä tarpeelliseksi turvallisuusseikkojen vuoksi, tai ellette itse pyydä koko lääkkeenantolaitteen poistamista päästänne. Lääkkeenantolaitteesta aiheutuvat mahdolliset haitat Portin muotoilu on samanlainen kuin luuankkuroidussa kuulokojeessa. Portti voi aiheuttaa tulehduksen ja ihoreaktioita ja se voi myös löystyä, mikä voi lisätä tulehduksen ja paikallisten ihoreaktioiden riskiä. Löystynyt portti voidaan uudelleenasentaa, mutta joissakin tapauksissa se saatetaan joutua poistamaan kokonaan. Ihon verenkierto lääkkeenantolaitteen kohdalla saattaa heikentyä, mikä voi aiheuttaa ihon ärsytystä ja rappeutumista. Teidän elimistö voi myös reagoida lääkkeenantolaitteessa käytettäviin materiaaleihin. Infektioriski aivoissa, päänahassa ja portin ympäristön ihossa on olemassa jokaisen lääkkeenannon yhteydessä. Paikallista infektiota voidaan hoitaa steroideilla ja/tai antibiooteilla. Infektioriskin vähentämiseksi tutkijoille ja muulle tutkimushenkilökunnalle opetetaan, kuinka tutkimuslääke infuusio annetaan. Jos katetri on osittain tukossa, tutkimuslääke voidaan annostella toisen, samalle aivojen alueelle tulevan katetrin avulla, jolloin lääkkeen infuusioaika kuitenkin kasvaa. Jos molemmat samalle aivojen alueelle tulevat katetrit ovat tukossa, lääkettä annostellaan vain toiseen aivokuorukkaan, jolloin kokonaislääkeannos puolitetaan alkuperäisestä määrästä On tärkeää, että portti puhdistetaan päivittäin. Teille annetaan portin hoito-ohjeet. PET tutkimuksesta aiheutuvat mahdolliset haitat Teille tehdään kaksi PET-tutkimusta. Tutkimuksen kesto on noin tunnin. Teidän tulee maata tutkimuspöydällä selällään paikoillaan tutkimusten aikana. Ennen tutkimusta Teille asennetaan yksilöllisesti muokattu kiinnituskypärä, joka auttaa pitämään päänne paikoillaan. Kypärä saattaa aiheuttaa päässä epämiellyttävää paineen tuntua. Sitä voidaan vähentää säätämäällä kypärän kireyttä. Henkilöillä, joilla on ahtaan paikan kammo (klaustrofobia), tutkimus voi aiheuttaa ahdistusta. Kyynärvarteenne asetetaan kanyyli, jonka kautta PET-merkkiainetta annostellaan ennen tutkimusta. Kanyylin asentaminen voi aiheuttaa kipua, turvotusta tai mustelmia pistoskohdassa. Tutkimus itsessään on kivuton. PET-tutkimuksessa käytettävät merkkiaineet ovat radioaktiivisia. Radioaktiivinen merkkiaine hajoaa nopeasti ja saamanne radioaktiivinen säteilyannos on pieni. Normaali altistuminen radioaktiiviselle aineelle Suomessa on keskimäärin 3,2 millisievertia (msv) vuodessa. Tässä tutkimuksessa kahden PETtutkimuksen aiheuttama altistus vastaa 7,4 msv:n säteilyä. Tämä vastaa keskimäärin 2 vuoden ja 4 kuukauden altistusta Suomessa asuvalle henkilölle. CDNF-lääkeaineesta aiheutuvat mahdolliset riskit ja haitat Tutkittavaa CDNF-lääkeainetta ei ole annettu ihmisille aikaisemmin. Siksi kaikki sivuvaikutukset eivät ole tiedossa. Kun eri lääkeaineita käytetään yhdessä, käytöstä voi aiheutua sivuvaikutuksia ja riskejä, joita ei voida ennustaa. Siksi on tärkeää, että kerrotte tutkimuksen lääkärille ja/tai hoitajalle välittömästi haitallisista oireista tutkimuksen aikana riippumatta siitä, liittyvätkö ne mielestänne tutkimuslääkkeeseen. CDNF:lla ei ole havaittu haittavaikutuksia eläinkokeissa. Muiden hermokasvutekijöiden käytöstä aiheutuneita haittoja ovat pistely tai kipu, Lhermitten oire 5/11
6 (sähköiskumaiset tuntemukset selässä tai raajoissa), ruokahalun puute, laihtuminen, pahoinvointi, oksentelu, alhainen veren natriumpitoisuus ja suoliston häiriöt (ripuli, ummetus). Tutkimuksen aikana Teidän tulee seurata tarkasti kokemianne sivuvaikutuksia. Muita mahdollisia riskejä tutkimuksen aikana Verinäytteet: verinäytteiden otto voi olla epämiellyttävää, kivuliasta ja saattaa aiheuttaa mustelmia, turvotusta tai tulehduksen. Verinäytteitä otetaan 14 kertaa, yhteensä noin 350 ml verta 10 kuukauden aikana. Määrä on verrattavissa yhdellä verenluovutuskerralla annettavaan 450 ml verimäärään. Lannepistolla otettava selkäydinnestenäyte (CSF): yleisin haittavaikutus on lievä päänsärky, joka voi kestää muutaman tunnin tai muutaman päivän. Päänsärky voi joissakin tapauksissa olla vakavampaa ja huimausta, niskajäykkyyttä tai surinaa korvissa voi myös esiintyä. Vain harvoin näytteenotto aiheuttaa merkittävää epämukavuutta. Selkäydinnestenäytteet otetaan kahdella käynnillä (käynti 9 ja 16) 10 ml kerrallaan. Magneettikuvaus (MRI): Teitä pyydetään makaamaan liikkumatta korkeintaan noin 40 minuuttia. Jos kärsitte suljetun paikan kammosta, kokemus ahtaassa tilassa voi olla epämiellyttävä. Kamera on meluisa ja voitte käyttää kuulosuojaimia kuvauksen aikana. Magneettikuvaukset suoritetaan viidellä käynnillä (käynnit 1, 3, 6, 13 ja 17). Mikäli kuvauksessa löydetään jotain poikkeavaa, se käsitellään tavanomaisen hoitokäytännön mukaisesti eli lääkäri arvioi, tarvitaanko jatkotutkimusta tai seurantaa. Mikäli löydöksen seurauksena arvioidaan, että potilaalle saattaisi aiheutua haittaa tutkimukseen osallistumisesta, osallistuminen saatetaan keskeyttää. Tietokoneavusteinen tomografia (CT): Teidät altistetaan pienelle määrälle säteilyä. Leikkauksen aikana suoritetaan kaksi tai korkeintaan kolme kuvausta. Kukin kuvaus altistaa säteilymäärälle, joka vastaa yhden vuoden säteilyaltistusta normaaleissa elinolosuhteissa. Parkinsonin taudin lääkityksen lopettaminen: PET kuvaukset (käynneillä 8 ja 16) sekä neljä tutkimuskäyntiä (arviointitaulukoiden täyttö käynneillä 2, 9, 13 ja 17) suoritetaan, kun olette ollut ilman normaalia Parkinsonin taudin lääkeannosta 10 tuntia tai kauemmin, riippuen käyttämästänne lääkityksestä. Tämä voi pahentaa Parkinsonin taudin oireita (niin sanottu off-vaihe). Saatte normaalin lääkeannoksen välittömästi tutkimusten jälkeen, mutta oireet voivat kestää muutaman tunnin ennen kuin tunnette olonne vakaaksi. Rajoitukset tutkimuksen aikana Koska ei ole olemassa tietoa siitä, miten portti reagoi saunassa, emme suosittele saunomista ennen kuin portti on poistettu. Haavojen parantumiseksi uimista tulee välttää ainakin kuuden viikon ajan leikkauksesta. Uiminen järvessä, joessa, meressä ja uima-altaassa sekä kylvyssä käyminen on sallittua, kun haavat ovat parantuneet. Sukeltaminen ei ole suositeltavaa. Teille annetaan ohjeet portin päällä pidettävän silikonitulpan käytöstä sekä siitä, miten portti pidetään puhtaana. On myös suositeltavaa, ettette aja tai käytä koneita 24 tunnin sisällä tutkimus- tai lumelääkkeen annostelusta. Tutkimuksen aikana voitte jatkaa Parkinsonin taudin lääkehoitoa muulloin kuin sitä on rajoitettu tutkimuskäyntien yhteydessä. On kuitenkin joitakin lääkkeitä, joiden käyttö tulee lopettaa ja joita Teidän ei pitäisi ottaa tutkimuksen aikana. Kertokaa lääkärillenne mitä lääkkeitä, rohdosvalmisteita ja vitamiineja käytätte. Käyntien 9, 12, 15 ja 17 yhteydessä Teitä pyydetään syömään vähärasvaista ruokaa kunnes käynnin viimeinen verinäyte on otettu. Esimerkkejä vähärasvaisesta aamiaisesta: leipä, vähärasvainen margariini, kinkku tai vähärasvainen juusto, vähärasvainen piimä, maito tai jogurtti, puuro ilman voita, tee tai kahvi (vähärasvaisella maidolla), hedelmä- tai kasvismehu, hedelmäsalaatti. Esimerkkejä 6/11
7 vähärasvaisesta lounaasta: kalkkuna, broileri, keitetty kala, riisi, peruna, pasta, vihannekset ja kasvikset, salaatti, kasviskastike. Välttäkää rasvaisia maitotuotteita kuten voi, rasvainen juusto, kerma, täysmaito, rasvainen jogurtti sekä pekonia, punaista lihaa, rasvaista kalaa (esim. lohi, makrilli), kermaisia kastikkeita, salaatinkastikkeita ja kananmunia. Tutkijalääkäri voi kertoa Teille muista mahdollisista haitoista Tutkimuslääkkeen käyttöön saattaa liittyä ennalta tuntemattomia riskejä. Jos tutkimuksen aikana saadaan turvallisuutenne kannalta oleellista uutta tietoa tutkimusvalmisteesta, tutkijalääkäri ottaa Teihin välittömästi yhteyttä ja keskustelee kanssanne siitä, haluatteko edelleen jatkaa tutkimuksessa. Veri- ja selkäydinnestenäytteiden (CSF) käsittely Suurin osa näytteistä, jotka otetaan tutkimuksen aikana ovat rutiininäytteitä. Nämä näytteet analysoidaan sairaalan laboratoriossa heti kun ne on otettu, minkä jälkeen ne tuhotaan. Veri- ja selkäydinnestenäytteistä analysoidaan, miten elimistönne reagoi tutkittavaan lääkeaineeseen ja miten lääkeaine leviää aivoista muualle elimistöön. Nämä näytteet lähetetään laboratorioihin Suomessa ja Qatarissa. Näytteitä säilytetään enintään viisi vuotta ja ne voidaan voidaan tuhota aikaisemminkin. Näytteet otetaan vain tämän tutkimuksen käyttöön. Näytteet merkitään yksilöllisillä koodeilla sekaannuksen estämiseksi. Näytteet voidaan jäljittää Teihin vain koodiavaimen avulla, johon ainoastaan tutkimuksen lääkärillä ja valtuutetulla tutkimushenkilökunnalla on pääsy. Teillä on oikeus pyytää näytteet tuhottavaksi ilman lisäselvityksiä. Tietojen luottamuksellisuus ja tietosuoja Tutkimukseen osallistuva henkilökunta on salassapitovelvollinen. Kaikki Teistä kerättävät tiedot ja Teiltä otetut näytteet käsitellään nimettöminä ja koodattuina siten, ettei henkilöllisyyttänne pystytä tunnistamaan tutkimukseen liittyvistä tutkimustuloksista, selvityksistä tai julkaisuista. Tutkimustuloksia ei välttämättä julkaista. Tutkimusrekisteriin talletetaan vain tutkimuksen tarkoituksen kannalta välttämättömiä henkilötietoja. Teidän nimeänne tai muita yksilöintitietojanne (syntymäaika, yhteystiedot jne.) ei anneta tutkimuksen toimeksiantajalle. Tutkimustuloksissa ja muissa asiakirjoissa Teihin viitataan vain tunnistekoodilla. Rekisteriä säilytetään Herantis Pharma Oyj:n ja Renishaw Plc:n toimesta Isossa-Britanniassa, Irlannissa, Ruotsissa ja Suomessa vähintään 15 vuotta. Siinä tapauksessa että koko tutkimusohjelma laitteen ja tutkimusvalmisteen osalta keskeytetään, kerättyä tietoa säilytetään vähintään kaksi vuotta. Tutkimusrekisteristä on laadittu henkilötietolain 10 :n mukainen rekisteriseloste, jonka saatte halutessanne nähtäväksi. Leikkauksen aikana Renishaw:n leikkaushenkilökunta on läsnä leikkaussalissa neurokirurgien apuna. Olette tällöin nukutettuna, joten ette tapaa heitä. Renishaw:n työntekijöitä saattaa olla avustamassa tutkimushenkilökuntaa myös lääkeinfuusioiden annon aikana. He saattavat nähdä henkilötietojanne, kuten nimenne, mutta henkilötietoja ei anneta heille kirjallisina. Teidät videoidaan osana sairautenne tilan arviointia. Videotallennetta käytetään varmentamistarkoituksessa, eikä sitä lähetetä tutkimusklinikan ulkopuolelle ilman erillistä suostumustanne. Ennen suostumuksenne kysymistä toimeksiantajan on hankittava videotallenteen siirtämiselle kirjallinen hyväksyntäasianomaiselta lääkeviranomaiselta ja eettiseltä toimikunnalta. Portin ympärillä oleva iho tarkastetaan ja valokuvataan leikausten jälkeen jokaisella tutkimuskäynnillä ihon paranemisprosessin arvioimiseksi. Valokuvat lähetetään lääkkeenantolaitteen valmistaja Renishaw:lle, mutta henkilöllisyytenne ei käy kuvista ilmi. 7/11
8 Terveydentilaanne koskevia ja tutkimuksen kannalta tarpeellisia tietoja voidaan luvallanne kerätä myös muista terveydenhuollon toimintayksiköistä. Tutkijalääkäri voi tällöin hankkia tarvitsemansa tiedot henkilötunnuksenne avulla. Teillä on oikeus tarkastaa nämä tiedot ja tarvittaessa pyytää niihin korjauksia. Suomessa lääkeviranomaisella (Lääkealan turvallisuus- ja kehittämiskeskus Fimea) on oikeus varmistaa, että tutkimustiedot on hankittu ja tutkimus toteutettu asianmukaisella tavalla. Suostumuksellanne myös ulkomaisilla lääkeviranomaisilla ja tutkimuksen toimeksiantajan edustajilla on oikeus tehdä tarkastuksia. Silloin tietoja käsitellään tutkijalääkärin valvonnassa ja vastuulla. Kaikissa tapauksissa tietojanne käsitellään luottamuksellisesti. Jos päätätte peruuttaa suostumuksenne tai osallistumisenne tutkimukseen keskeytyy jostain muusta syystä, keskeyttämiseen mennessä kerättyjä tietoja käytetään osana tutkimusaineistoa ja lääkkeen sekä lääkkeenantolaitteen turvallisuusarviointia. Koodattuja tutkimustietojanne ei poisteta tutkimuksesta lopettamisenne jälkeen. Elektronisesti tai paperiversiona talletettua tutkimustietoa käsittelevät ja säilyttävät Herantis Pharma, Renishaw ja TFS. Teistä kerättävää tietoa käytetään CDNF-tutkimuslääkkeen ja lääkkeenantolaitteen kehittämiseksi sekä viranomaishyväksynnän saamiseksi laitteelle. Tutkimustuloksista voidaan myös kertoa lääketieteellisissä julkaisuissa sekä esittää tieteellisissä kokouksissa. Tutkimuspotilaiden henkilöllisyyttä ei kuitenkaan koskaan paljasteta. Tietojanne voidaan myös luovuttaa muille yrityksille, jotka tekevät yhteistyötä toimeksiantajan kanssa, sekä muiden maiden viranomaisille. Tietojen vastaanottajat saattavat sijaita EU:ssa tai EU:n ulkopuolella maissa, joissa henkilötietojen käsittely ei ole samaa korkeaa turvatasoa kuin Suomessa. Näissäkin tapauksissa kaikkia osapuolia sitovat edellä mainitut salassapitovelvollisuudet. Tietojen mahdollinen luovuttaminen tapahtuu aina Henkilötietolain puitteissa (523/1999). Tämän tutkimuksen kuvaus on nähtävillä verkko-osoitteessa Tämä verkkosivusto ei sisällä tietoja, joista Teidät voitaisiin tunnistaa. Sivusto sisältää yhteenvedon tutkimuksen tuloksista. Voitte katsoa tätä sivustoa milloin tahansa. Tutkimuksen kustannukset ja taloudelliset selvitykset Tutkimuksen suorittava sairaala on saanut tutkimuksen toteutukseen Euroopan Unionin tutkimusrahoituksen. Tutkimuslääke ja tutkimukseen liittyvät toimenpiteet ovat Teille maksuttomia. Tutkimuskäynneistä aiheutuvat mahdolliset ansionmenetykset ja matkakustannukset korvataan todellisten kustannusten mukaan tositteiden perusteella. Tutkittavien vakuutusturva Jos tutkimuslääkkeestä tai tutkimuksen takia tehdystä toimenpiteestä aiheutuu Teille henkilövahinko, voitte hakea korvausta. Herantis Pharma ja Renishaw ovat vakuuttaneet Teidät tutkimuksen ajaksi ja viideksi vuodeksi tutkimuksen päättymisen jälkeen tutkimukseen osallistumisesta aiheutuvien vahinkojen varalta. Viiden vuoden jälkeen laitteeseen liittyvistä potilasvahingoista vastaa Renishaw ja lääkeaineeseen liittyvistä potilasvahingoista vastaa Herantis Pharma. Nykyisen vakutuuksenantajan kanssa on varmistettu, että vakuutusta voidaan jatkaa viiden vuoden jälkeen, ja Renishaw ja Herantis ovat sitoutuneet vakuutuksen jatkamiseen keskinäisellä kirjallisella sopimuksella. 8/11
9 Yllämainitun lisäksi tutkimuksen lääkeaineeseen liittyvät potilasvahingot kuuluvat Suomessa myös Lääkevahinkovakuutuksen piiriin, sillä Herantis Pharma on Suomen Lääkevahinkokorvausosuuskunnan jäsen. Ottakaa yhteys tutkimuksen lääkäriin, jos epäilette, että Teille on aiheutunut vahinkoa tutkimukseen osallistumisen seurauksena. Muusta syystä kuin tutkimuslääkkeestä ja/tai lääkkeenantolaitteesta aiheutuneista vahingoista haetaan korvausta potilasvakuutuksesta. Se korvaa potilasvahinkolain mukaisesti terveyden- ja sairaanhoidon yhteydessä aiheutuneita henkilövahinkoja laissa tarkemmin säädellyin edellytyksin. Potilasvakuutuskeskus huolehtii potilasvahinkojen korvauskäsittelystä. Tutkimuksen päättyminen Ennen tutkimuksen päättymistä tutkijalääkäri keskustelee kanssanne hoidostanne tutkimuksen jälkeen ja saatte häneltä informaatiota mahdollisimman hyvistä Parkinsonin taudin hoitovaihtoehdoista. Implantoitu laite, lukuun ottamatta päähän asennettua porttia, on tarkoitus jättää aivoihin tutkimuksen päättymisen jälkeen (myös jatkotutkimuksen jälkeen), ellei sen poistamiselle ole lääketieteellistä syytä tai ette pyydä sen poistamista. Implantoitu laite ei häiritse mahdollisia tulevia Parkinsonin taudin hoitoon liittyviä leikkauksia, esimerkiksi aivojen syvien osien sähköstimulaatioon (DBS) liittyvää elektrodien asennusta. Toimeksiantaja suunnittelee tekevänsä jatkotutkimuksia, kun tämä tutkimus on saatu päätökseen. Ensimmäinen, kuusi kuukautta kestävä jatkotutkimus on suunniteltu alkavaksi välittömästi tämän tutkimuksen jälkeen. Suunnitelman mukaan siinä annetaan kuusi annosta CDNF-valmistetta kaikille potilaille, jotka ovat olleet mukana tässä nyt kyseessä olevassa päätutkimuksessa loppuun asti. Lumelääkettä ei tulla käyttämään jatkotutkimuksessa. Toimeksiantaja sitoutuu tekemään jatkotutkimuksen, jos tässä ensimmäisessä tutkimuksessa ei esiinny sellaisia vakavia haittavaikutuksia, jotka estävät tutkimuslääkkeen käytön. Lääkeviranomainen, eettinen toimikunta tai tutkimuksen turvallisuutta valvova riippumaton toimikunta voi joko päättää päätutkimuksen ennenaikaisesta lopettamisesta tai päättää, että jatkotutkimusta ei voida aloittaa. Siksi tutkimuslääkkeen antamista tämän päätutkimuksen jälkeen ei voida millään tavalla taata ja se saattaa päättyä, vaikka olisitte saanut siitä merkittävää hyötyä. Lisäksi osana jatkotutkimuksia toteutetaan mukana olleiden pitkäaikaisseuranta. Jatkotutkimukset ovat tällä hetkellä suunnitteluvaiheessa ja vaativat hyväksynnän sekä Suomen lääkeviranomaiselta että eettiseltä toimikunnalta ennen niiden alkamista. Saatte tutkimuksista lisätietoa ja, mikäli haluatte osallistua, Teitä pyydetään allekirjoittamaan suostumuslomakkeet ennen jatkotutkimuksiin osallistumista. Lisätietoja Jos Teillä on kysyttävää tutkimuksesta, voitte olla yhteydessä tutkijalääkäriin tai muuhun tutkimuksen henkilökuntaan. Heidän kanssaan voitte keskustella kaikista tutkimuksen aikana mahdollisesti ilmenneistä haittavaikutuksista, epäilyttävistä oireista ja muista mieltänne askarruttavista asioista. Yhteystiedot: neurologian erikoislääkäri Filip Scheperjans, HYKS, Neurologian klinikka, Meilahden Kolmiosairaala, osasto K4A, Haartmaninkatu 4, Helsinki. s-posti: Tutkimushoitaja: Reeta Levo s-posti: Puhelin: /11
10 SUOSTUMUS LÄÄKETUTKIMUKSEEN Minua on pyydetty osallistumaan hermokasvutekijä CDNF:n turvallisuutta ja siedettävyyttä sekä uuden lääkkeenantolaitteen soveltuvuutta arvioivaan tutkimukseen idiopaattisen Parkinsonin taudin hoidossa (HP-CD-CL-2002, Herantis Pharma Oyj). Olen saanut, lukenut ja ymmärtänyt tutkimuksesta kertovan tiedotteen (versio ICF Finland 01MAR2018_06_Final). Tiedotteesta olen saanut riittävän selvityksen tutkimuksesta (Faasi I-II satunnaistettu, kaksoissokkoutettu, lumelääkkeellä kontrolloitu tutkimus, jossa arvioidaan katetrin välityksellä aivoihin annosteltavan lääkeaineen CDNF:n turvallisuutta ja siedettävyyttä idiopaattista edenneen vaiheen Parkinsonin tautia sairastavilla potilailla, HP-CD-CL-2002) ja sen yhteydessä suoritettavasta tietojen keräämisestä, käsittelystä ja luovuttamisesta. Tiedotteen sisältö on kerrottu minulle myös suullisesti ja olen saanut riittävän vastauksen kaikkiin tutkimusta koskeviin kysymyksiini. Tiedot antoi, / / 20. Minulla on ollut riittävästi aikaa harkita osallistumistani tutkimukseen. Minulle kerrotaan, mistä minua koskevia tietoja hankitaan. Annan luvan itseäni koskevien, tutkimuksen kannalta tarpeellisten tietojen keräämiseen Herantis Pharma Oyj:n tutkimusrekisteriin. Tietoja voidaan lääketutkimuksen sitä edellyttäessä pyytää niistä terveydenhoitopaikoista, joissa on potilastietojani. Tätä tarkoitusta varten lääkäri saa kirjata henkilötunnukseni sekä käyttää sitä tietojen saamiseksi. Annan suostumukseni videoimiseeni osana sairauteni tilan arviointia ja minulle on ilmoitettu, ettei tallennetta lähetetä tutkimusklinikan ulkopuolelle ilman erillistä suostumustani. Annan suostumukseni myös lääkkeenantolaitteeseen kuuluvan portin ympärillä olevasta ihosta otettujen valokuvien lähettämiselle Renishaw Plc:lle. Minulle on kerrottu, että Renishaw Plc:n leikkaushenkilökunta on läsnä leikkaussalissa neurokirurgien avustamiseksi sekä mahdollisesti avustamassa tutkimushenkilökuntaa lääkeinfuusioiden annon aikana. Kaikki minusta tutkimuksen aikana kerättävät tiedot valokuvat ja videotallenteet mukaan lukien käsitellään luottamuksellisina. Tutkimuksessa kerätyt tiedot koodataan siten, ettei henkilöllisyyden selvittäminen ole myöhemmin mahdollista ilman purkukoodia. Purkukoodi säilytetään suljettuna tutkijalääkärin arkistossa. Lääkevalvonnasta ja turvallisuudesta vastaavan viranomaisen, Suomessa Lääkealan turvallisuus- ja kehittämiskeskus Fimean edustajilla on oikeus varmistaa tutkimustietojen totuudenmukaisuus ja tutkimuksen asianmukainen suorittaminen. Tämä tapahtuu vertaamalla tutkimustietoja alkuperäisiin sairaskertomuksiini ja terveydentilaani koskeviin tietoihin. Annan varmistusoikeuden myös niiden muiden maiden lääkevalvonta- ja lääketurvallisuusviranomaisille, joissa lääkettä tullaan käyttämään. Annan vastaavan oikeuden myös Herantis Pharma Oyj:n, Renishaw Plc:n ja TFS International AB:n edustajille. Tällöin tietojen tarkastus tapahtuu tutkijalääkärin vastuulla ja valvonnassa. Kaikki edellä mainitut tahot ovat velvollisia pitämään tiedot salassa. Tässä tutkimuksessa kerättäviä tietoja voidaan käsitellä muualla kuin tiedot keränneen tutkijalääkärin tiloissa ja laitteissa, esimerkiksi Herantis Pharma Oyj tai Renishaw Plc voivat käsitellä tietoja. Tällöin tiedot ovat koodatussa muodossaan. Annan luvan siirtää tiedot tutkimuksen suorittamista varten Euroopan unionin alueella tai sen ulkopuolisiin maihin. Tutkimuksessa kerätyt tiedot voidaan tarvittaessa luovuttaa myös toisen yrityksen alkuperäistä tarkoitusta vastaavaan käyttöön esimerkiksi tilanteissa, joissa kaikki tai osa lääkkeen myöhemmästä kehitystyöstä tehdään toisessa yrityksessä. 10/11
11 Tässä lääketutkimuksessa kerättävä tieto voi olla hyödyksi myös selvitettäessä hermokasvutekijä CDNF:n uutta käyttötarkoitusta, josta tämän suostumuksen antamisen hetkellä ei ole tietoa. Hyväksyn, että minusta kerättäviä tietoja voidaan viranomaisen luvalla käyttää tällaiseen tarkoitukseen. Ymmärrän, että osallistumiseni tähän tutkimukseen on täysin vapaaehtoista. Olen myös tietoinen, että voin keskeyttää osallistumiseni tutkimukseen koska tahansa syytä ilmoittamatta ilman, että se vaikuttaa mitenkään hoitooni tai potilas-lääkärisuhteeseeni. Olen myös tietoinen siitä, että voin peruuttaa suostumukseni ja että osallistumiseni keskeyttämisen tai suostumuksen peruuttamisen jälkeen minusta kerättyjä henkilötietoja ja muita tietoja voidaan käsitellä osana tutkimusta, jos se on välttämätöntä lääkeaineen tai lääkkeenantolaitteen käyttötarkoituksen, ominaisuuksien, vaikutusten tai vaikuttavuuden selvittämiseksi tai arvioimiseksi tai niiden tehon ja turvallisuuden varmistamiseksi. Allekirjoituksellani vahvistan, että olen saanut tietoa tutkimuksesta sekä siitä aiheutuvasta säteilyaltistuksesta. Minulla on ollut mahdollisuus keskustella asiasta tutkimushenkilökunnan kanssa. Allekirjoituksellani vahvistan osallistumiseni tähän tutkimukseen ja suostun vapaaehtoisesti tutkimushenkilöksi. Allekirjoitus Päiväys Nimen selvennys Syntymäaika Osoite Suostumus vastaanotettu Tutkijalääkärin allekirjoitus Päiväys Nimen selvennys Alkuperäinen allekirjoitettu tutkimushenkilön suostumus sekä kopio tutkimushenkilötiedotteesta jäävät tutkijalääkärin arkistoon. Tutkimushenkilötiedote ja kopio allekirjoitetusta suostumuksesta annetaan tutkimushenkilölle. 11/11
TIEDOTE TUTKITTAVALLE JATKOTUTKIMUKSESTA
 TIEDOTE TUTKITTAVALLE JATKOTUTKIMUKSESTA Tutkittavan numero: Tutkimuksen nimi Satunnaistettu, kaksoissokkoutettu, useassa keskuksessa toteutettava jatkotutkimus, jossa arvioidaan CDNF-valmisteen turvallisuutta
TIEDOTE TUTKITTAVALLE JATKOTUTKIMUKSESTA Tutkittavan numero: Tutkimuksen nimi Satunnaistettu, kaksoissokkoutettu, useassa keskuksessa toteutettava jatkotutkimus, jossa arvioidaan CDNF-valmisteen turvallisuutta
Kliinisiä lääketutkimuksia koskeva tiedotemalli
 Tiedote tutkimuksesta 1(5) Kliinisiä lääketutkimuksia koskeva tiedotemalli Yleistä Mahdollista tutkittavaa puhutellaan yleensä teitittelemällä. Menettely kuitenkin vaihtelee kohderyhmän mukaan. Tiedote
Tiedote tutkimuksesta 1(5) Kliinisiä lääketutkimuksia koskeva tiedotemalli Yleistä Mahdollista tutkittavaa puhutellaan yleensä teitittelemällä. Menettely kuitenkin vaihtelee kohderyhmän mukaan. Tiedote
Tutkittavalle annettava selvitys kliinisestä lääketutkimuksesta ja suostumusmalli
 Tietoon perustuva suostumus 1(6) Tutkittavalle annettava selvitys kliinisestä lääketutkimuksesta ja suostumusmalli Yleistä Tutkittavaa rekrytoitaessa tulee hänelle antaa tietoon perustuvan suostumuksen
Tietoon perustuva suostumus 1(6) Tutkittavalle annettava selvitys kliinisestä lääketutkimuksesta ja suostumusmalli Yleistä Tutkittavaa rekrytoitaessa tulee hänelle antaa tietoon perustuvan suostumuksen
Tutkittavalle annettava tiedote kliinisen lääketutkimuksen yhteydessä tehtävästä geeni-/farmakogeneettisestä tutkimuksesta ja suostumusmalli
 Tietoon perustuva suostumus 1(6) Geenitutkimukset geeni /farmakogeneettiset tutkimukset Tutkittavalle annettava tiedote kliinisen lääketutkimuksen yhteydessä tehtävästä geeni/farmakogeneettisestä tutkimuksesta
Tietoon perustuva suostumus 1(6) Geenitutkimukset geeni /farmakogeneettiset tutkimukset Tutkittavalle annettava tiedote kliinisen lääketutkimuksen yhteydessä tehtävästä geeni/farmakogeneettisestä tutkimuksesta
ARVOISA VASTAANOTTAJA,
 ARVOISA VASTAANOTTAJA, Pyydämme Teitä osallistumaan tutkimukseen, jossa kartoitetaan gynekologisten laskeumaleikkausten menetelmiä, komplikaatioita ja vaikutusta elämänlaatuun Suomessa vuonna 2015. Tiedote
ARVOISA VASTAANOTTAJA, Pyydämme Teitä osallistumaan tutkimukseen, jossa kartoitetaan gynekologisten laskeumaleikkausten menetelmiä, komplikaatioita ja vaikutusta elämänlaatuun Suomessa vuonna 2015. Tiedote
Tutkittavalle annettava tiedote kliinisestä lääketutkimuksesta ja suostumusmalli
 Tietoon perustuva suostumus 1(7) Tutkittavalle annettava tiedote kliinisestä lääketutkimuksesta ja suostumusmalli Yleistä Tutkittavaa rekrytoitaessa tulee hänelle antaa tietoon perustuvan suostumuksen
Tietoon perustuva suostumus 1(7) Tutkittavalle annettava tiedote kliinisestä lääketutkimuksesta ja suostumusmalli Yleistä Tutkittavaa rekrytoitaessa tulee hänelle antaa tietoon perustuvan suostumuksen
NEMO-1 tutkimus. Tutkimustiedote vanhemmille. Tutkimuksen tausta ja tarkoitus i
 NEMO-1 tutkimus NEMO-1 tutkimus Vauvaanne pyydetään osallistumaan kansainväliseen NEMO1- monikeskustutkimukseen, jossa tutkitaan vastasyntyneen hapenpuutteesta johtuvan aivotoiminnan häiriöiden ja kouristusten
NEMO-1 tutkimus NEMO-1 tutkimus Vauvaanne pyydetään osallistumaan kansainväliseen NEMO1- monikeskustutkimukseen, jossa tutkitaan vastasyntyneen hapenpuutteesta johtuvan aivotoiminnan häiriöiden ja kouristusten
Tiedote tutkimuksesta nuorelle. Tiedote tutkimuksesta palveluntuottajalle. Suostumuslomake nuorelle. Suostumuslomake palveluntuottajalle.
 Marjo Romakkaniemi, Jari Lindh ja Merja Laitinen. Nuorten aikuisten osallisuus ja sosiaalinen kuntoutus Lapissa. Helsinki: Kela, Sosiaali- ja terveysturvan tutkimuksia 147, 2018. 127 s. ISBN 978-952-284-031-8
Marjo Romakkaniemi, Jari Lindh ja Merja Laitinen. Nuorten aikuisten osallisuus ja sosiaalinen kuntoutus Lapissa. Helsinki: Kela, Sosiaali- ja terveysturvan tutkimuksia 147, 2018. 127 s. ISBN 978-952-284-031-8
Suomalainen IPF-rekisteri FinnishIPF
 POTILAAN TIEDOTE Suomalainen IPF-rekisteri FinnishIPF Arvoisa potilas, Tiedustelemme halukkuuttanne osallistua seuraavassa esitettävään tutkimukseen. Tutkimuksen tausta Idiopaattiset keuhkoparenkyymisairaudet
POTILAAN TIEDOTE Suomalainen IPF-rekisteri FinnishIPF Arvoisa potilas, Tiedustelemme halukkuuttanne osallistua seuraavassa esitettävään tutkimukseen. Tutkimuksen tausta Idiopaattiset keuhkoparenkyymisairaudet
Tutkimuksen toteuttajat ja tilaaja Tämän tutkimuksen tilaaja eli toimeksiantaja on suomalainen lääkekehitysyritys Herantis Pharma.
 1 (6) TIEDOTE TUTKIMUKSESTA Kaksoissokkoutettu, lumelääkekontrolloitu, vaiheen 2 teho-, turvallisuus- ja siedettävyystutkimus imusolmukesiirtoleikkauksen yhteydessä annettavalla Lymfactintutkimusvalmisteella
1 (6) TIEDOTE TUTKIMUKSESTA Kaksoissokkoutettu, lumelääkekontrolloitu, vaiheen 2 teho-, turvallisuus- ja siedettävyystutkimus imusolmukesiirtoleikkauksen yhteydessä annettavalla Lymfactintutkimusvalmisteella
Teidän ei tarvitse osallistua tähän tutkimukseen saadaksenne hoitoa. Lääkärinne kertoo Teille sairautenne hoitovaihtoehdoista.
 1 (7) TIEDOTE TUTKIMUKSESTA Kaksoissokkoutettu, lumelääkekontrolloitu, vaiheen 2 teho-, turvallisuus- ja siedettävyystutkimus imusolmukesiirtoleikkauksen yhteydessä annettavalla Lymfactintutkimusvalmisteella
1 (7) TIEDOTE TUTKIMUKSESTA Kaksoissokkoutettu, lumelääkekontrolloitu, vaiheen 2 teho-, turvallisuus- ja siedettävyystutkimus imusolmukesiirtoleikkauksen yhteydessä annettavalla Lymfactintutkimusvalmisteella
Valtakunnallinen lääketieteellinen tutkimuseettinen toimikunta (TUKIJA)
 N:o 841 2787 Liitteet Liite 1 Valtakunnallinen lääketieteellinen tutkimuseettinen toimikunta (TUKIJA) ENNAKKOILMOITUS KLIINISESTÄ LÄÄKETUTKIMUKSESTA 1. Viranomainen täyttää Saapunut Diaari-/rekisterinumero
N:o 841 2787 Liitteet Liite 1 Valtakunnallinen lääketieteellinen tutkimuseettinen toimikunta (TUKIJA) ENNAKKOILMOITUS KLIINISESTÄ LÄÄKETUTKIMUKSESTA 1. Viranomainen täyttää Saapunut Diaari-/rekisterinumero
Tutkimuksesta vastaavan henkilön eettinen arvio tutkimussuunnitelmasta. Tapani Keränen TAYS
 eettinen arvio tutkimussuunnitelmasta Tapani Keränen TAYS eettinen arvio tutkimussuunnitelmasta: perusteet Tutkimuksesta vastaavan henkilön (TVH) tulee havaita ja arvioida tutkimukseen liittyvät eettiset
eettinen arvio tutkimussuunnitelmasta Tapani Keränen TAYS eettinen arvio tutkimussuunnitelmasta: perusteet Tutkimuksesta vastaavan henkilön (TVH) tulee havaita ja arvioida tutkimukseen liittyvät eettiset
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
TWIST: Liuotushoito tenekteplaasilla unen aikana sattuneessa aivoinfarktissa
 TUTKITTAVAN TIEDOTE TWIST: Liuotushoito tenekteplaasilla unen aikana sattuneessa aivoinfarktissa Tutkimuksen tausta ja tarkoitus Tämän tutkimuksen tarkoituksena on selvittää, parantaako tenekteplaasi (Metalyse
TUTKITTAVAN TIEDOTE TWIST: Liuotushoito tenekteplaasilla unen aikana sattuneessa aivoinfarktissa Tutkimuksen tausta ja tarkoitus Tämän tutkimuksen tarkoituksena on selvittää, parantaako tenekteplaasi (Metalyse
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Potilasopas TREVICTA
 Potilasopas TREVICTA Miten pitkävaikutteinen psykoosilääke toimii? Pitkävaikutteisella psykoosilääkkeellä saadaan vakaa veren lääkepitoisuus. Lääke vapautuu tasaisesti ja saavuttaa pitkäkestoisen vaikutuksen
Potilasopas TREVICTA Miten pitkävaikutteinen psykoosilääke toimii? Pitkävaikutteisella psykoosilääkkeellä saadaan vakaa veren lääkepitoisuus. Lääke vapautuu tasaisesti ja saavuttaa pitkäkestoisen vaikutuksen
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE. (alitretinoiini) Lääkärin materiaalit. Potilaan nimi.
 LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE (alitretinoiini) Lääkärin materiaalit Potilaan nimi alitretinoiini Lääkärin materiaalit Lääkärin tarkistuslista/vahvistuslomake
LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE (alitretinoiini) Lääkärin materiaalit Potilaan nimi alitretinoiini Lääkärin materiaalit Lääkärin tarkistuslista/vahvistuslomake
Lisätiedot Pyydämme Teitä tarvittaessa esittämään tutkimukseen liittyviä kysymyksiä tutkijalle/tutkimuksesta vastaavalle henkilölle.
 Tiedote tutkimuksesta 1 (5) TIEDOTE TUTKIMUKSESTA Tutkimusperustainen vaativaan erityiseen tukeen liittyvän osaamisen vahvistaminen opettajankoulutuksessa ja täydennyskoulutuksessa (TUVET) Pyyntö osallistua
Tiedote tutkimuksesta 1 (5) TIEDOTE TUTKIMUKSESTA Tutkimusperustainen vaativaan erityiseen tukeen liittyvän osaamisen vahvistaminen opettajankoulutuksessa ja täydennyskoulutuksessa (TUVET) Pyyntö osallistua
TWIST: Liuotushoito tenekteplaasilla unen aikana sattuneessa aivoinfarktissa
 OMAISEN TIEDOTE TWIST: Liuotushoito tenekteplaasilla unen aikana sattuneessa aivoinfarktissa Tutkimuksen tausta ja tarkoitus Tämän tutkimuksen tarkoituksena on selvittää, parantaako tenekteplaasi (Metalyse
OMAISEN TIEDOTE TWIST: Liuotushoito tenekteplaasilla unen aikana sattuneessa aivoinfarktissa Tutkimuksen tausta ja tarkoitus Tämän tutkimuksen tarkoituksena on selvittää, parantaako tenekteplaasi (Metalyse
Potilaan päiväkirja. Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi
 Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Suostumusmenettely käytännössä
 Suostumusmenettely käytännössä Janne Backman, professori ja ylilääkäri Kliininen farmakologia HY/HUSLAB 1 Rekrytoinnin yleisiä periaatteita Tutkimukseen osallistuminen on vapaaehtoista. Päätöksen tulee
Suostumusmenettely käytännössä Janne Backman, professori ja ylilääkäri Kliininen farmakologia HY/HUSLAB 1 Rekrytoinnin yleisiä periaatteita Tutkimukseen osallistuminen on vapaaehtoista. Päätöksen tulee
Narkolepsiaa sairastavien lasten ja nuorten sopeutumisvalmennuskurssia koskeva arviointitutkimus
 Liite S3: Suostumuslomakkeet Narkolepsiaa sairastavien lasten ja nuorten sopeutumisvalmennuskurssia koskeva arviointitutkimus Suostumuslomake tutkimukseen osallistumisesta / vanhemman/huoltajan lomake
Liite S3: Suostumuslomakkeet Narkolepsiaa sairastavien lasten ja nuorten sopeutumisvalmennuskurssia koskeva arviointitutkimus Suostumuslomake tutkimukseen osallistumisesta / vanhemman/huoltajan lomake
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma. (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Tutkittavan informointi ja suostumus
 Tutkittavan informointi ja suostumus yhdistettäessä tutkittavilta kerättyjä tietoja rekisteritietoihin Ylitarkastaja Raisa Leivonen Tietosuojavaltuutetun toimisto 9.12.2010 Kysy rekisteritutkimuksen luvista
Tutkittavan informointi ja suostumus yhdistettäessä tutkittavilta kerättyjä tietoja rekisteritietoihin Ylitarkastaja Raisa Leivonen Tietosuojavaltuutetun toimisto 9.12.2010 Kysy rekisteritutkimuksen luvista
TUTKIMUSLUPAHAKEMUS. Sosiaali- ja terveystoimi 1 (5) 1 TUTKIMUSLUVAN HAKIJA Nimi. Osoite. Tutkimuslaitos, oppilaitos tai muu organisaatio
 1 (5) Saapunut Kiertoon 1 TUTKIMUSLUVAN HAKIJA Osoite Puhelinnumero Sähköpostiosoite Suoritetut tutkinnot ja nykyinen koulutusala tai työtehtävä 2 TUTKIMUSRYHMÄN MUUT JÄSENET (tarvittaessa erillisellä
1 (5) Saapunut Kiertoon 1 TUTKIMUSLUVAN HAKIJA Osoite Puhelinnumero Sähköpostiosoite Suoritetut tutkinnot ja nykyinen koulutusala tai työtehtävä 2 TUTKIMUSRYHMÄN MUUT JÄSENET (tarvittaessa erillisellä
Tietoon perustuvaa suostumusta koskevat ohjeet
 Tietoon perustuvaa suostumusta koskevat ohjeet TUKIJAn seminaari 23.9.2014 Pääsihteeri Outi Konttinen TUKIJA 26.9.2014 Pääsihteeri Outi Konttinen 1 Lääketutkimusten sääntely Laki lääketieteellisestä tutkimuksesta
Tietoon perustuvaa suostumusta koskevat ohjeet TUKIJAn seminaari 23.9.2014 Pääsihteeri Outi Konttinen TUKIJA 26.9.2014 Pääsihteeri Outi Konttinen 1 Lääketutkimusten sääntely Laki lääketieteellisestä tutkimuksesta
Ajankohtaista tutkimusten viranomaisarvioinnissa
 Ajankohtaista tutkimusten viranomaisarvioinnissa Horisontissa 2020 strategiapäivä 26.4.2012 Vs. hallintojohtaja, VT Jari-Pekka Tuominen Varsinais-Suomen sairaanhoitopiiri Lääketieteellistä tutkimusta koskevat
Ajankohtaista tutkimusten viranomaisarvioinnissa Horisontissa 2020 strategiapäivä 26.4.2012 Vs. hallintojohtaja, VT Jari-Pekka Tuominen Varsinais-Suomen sairaanhoitopiiri Lääketieteellistä tutkimusta koskevat
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Auria Biopankin selvitys alaikäisen lapsen huoltajalle suostumuksen antamista varten
 Auria Biopankin selvitys alaikäisen lapsen huoltajalle suostumuksen antamista varten Teiltä pyydetään suostumusta lapsenne näytteiden ja henkilötietojen käsittelyyn biopankkitoiminnassa. Suostumusta pyydetään
Auria Biopankin selvitys alaikäisen lapsen huoltajalle suostumuksen antamista varten Teiltä pyydetään suostumusta lapsenne näytteiden ja henkilötietojen käsittelyyn biopankkitoiminnassa. Suostumusta pyydetään
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Lakisääteisen eettisen toimikunnan tehtävät alueellinen yhteistyö
 Lakisääteisen eettisen toimikunnan tehtävät alueellinen yhteistyö Tapani Keränen Itä-Suomen yliopisto; Pohjois-Savon sairaanhoitopiiri, tutkimusyksikkö ja eettinen toimikunta 21.3.2012 1 Alueelliset eettiset
Lakisääteisen eettisen toimikunnan tehtävät alueellinen yhteistyö Tapani Keränen Itä-Suomen yliopisto; Pohjois-Savon sairaanhoitopiiri, tutkimusyksikkö ja eettinen toimikunta 21.3.2012 1 Alueelliset eettiset
Potilaan opas. Acitretin Orifarm 10 mg ja 25 mg. Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Osteopaatti Jutta Aalto Anatomia- ja kehotietoisuuskoulutus TIETOSUOJASELOSTE
 Osteopaatti Jutta Aalto Anatomia- ja kehotietoisuuskoulutus TIETOSUOJASELOSTE 1 Yksityisyytesi suojaaminen Pitää kaikkien palveluitani käyttävien asiakkaiden/ potilaiden yksityisyyttä erittäin tärkeänä.
Osteopaatti Jutta Aalto Anatomia- ja kehotietoisuuskoulutus TIETOSUOJASELOSTE 1 Yksityisyytesi suojaaminen Pitää kaikkien palveluitani käyttävien asiakkaiden/ potilaiden yksityisyyttä erittäin tärkeänä.
KLIINISTEN TUTKIMUSLÄÄKKEIDEN KÄSITTELY (Internetversio)
 Laatija: Ercan Celikkayalar Hyväksyjä: Eeva Suvikas-Peltonen Satakunnan sairaanhoitopiirin ky:n Sairaanhoidollisten palveluiden liikelaitos SataDiag Sairaala-apteekki Koodi: B.10net.2 Sivu: 1(5) Korvaa
Laatija: Ercan Celikkayalar Hyväksyjä: Eeva Suvikas-Peltonen Satakunnan sairaanhoitopiirin ky:n Sairaanhoidollisten palveluiden liikelaitos SataDiag Sairaala-apteekki Koodi: B.10net.2 Sivu: 1(5) Korvaa
Itä-Suomen Biopankki Selvitys näytteenantajalle biopankkitoiminnasta suostumuksen antamista varten
 Selvitys näytteenantajalle biopankkitoiminnasta suostumuksen antamista varten Pyydämme teiltä suostumusta näytteiden ja niihin liittyvien tietojen keräämiseen ja tallentamiseen Itä- Suomen Biopankkiin
Selvitys näytteenantajalle biopankkitoiminnasta suostumuksen antamista varten Pyydämme teiltä suostumusta näytteiden ja niihin liittyvien tietojen keräämiseen ja tallentamiseen Itä- Suomen Biopankkiin
Fimea kehittää, arvioi ja informoi
 Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Tampereen BIOPANKKI. Selvitys näytteenantajalle suostumuksen antamista varten
 Tampereen BIOPANKKI Selvitys näytteenantajalle suostumuksen antamista varten Pyydämme sinulta suostumusta näytteiden ja sinua koskevien tietojen keräämiseksi Tampereen Biopankkiin ja käytettäväksi biopankkitutkimukseen.
Tampereen BIOPANKKI Selvitys näytteenantajalle suostumuksen antamista varten Pyydämme sinulta suostumusta näytteiden ja sinua koskevien tietojen keräämiseksi Tampereen Biopankkiin ja käytettäväksi biopankkitutkimukseen.
Tärkeää tietoa GILENYA -hoidosta
 Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
Tutkimuslain alainen tutkimus on sellaista, jossa seuraavat kaksi ehtoa täyttyvät samanaikaisesti:
 LAUSUNTOHAKEMUS tutkimuseettiselle toimikunnalle Pvm Dnro / (sihteeri täyttää tämän kohdan) Keski-Suomen sairaanhoitopiirin (Ksshp) tutkimuseettinen toimikunta on alueellinen lakisääteinen toimikunta,
LAUSUNTOHAKEMUS tutkimuseettiselle toimikunnalle Pvm Dnro / (sihteeri täyttää tämän kohdan) Keski-Suomen sairaanhoitopiirin (Ksshp) tutkimuseettinen toimikunta on alueellinen lakisääteinen toimikunta,
LÄÄKETIETEELLINEN TUTKIMUS IHMISILLÄ
 LÄÄKETIETEELLINEN TUTKIMUS IHMISILLÄ Dos., OTT, MA, Salla LötjL tjönen Tutkimuseettinen neuvottelukunta perusteet 1 Pääasialliset oikeuslähteet Kansalliset L lääl ääketieteellisestä tutkimuksesta (488/1999,
LÄÄKETIETEELLINEN TUTKIMUS IHMISILLÄ Dos., OTT, MA, Salla LötjL tjönen Tutkimuseettinen neuvottelukunta perusteet 1 Pääasialliset oikeuslähteet Kansalliset L lääl ääketieteellisestä tutkimuksesta (488/1999,
Kansallisten tietovarantojen toissijainen käyttö biopankkitutkimuksessa
 Kansallisten tietovarantojen toissijainen käyttö biopankkitutkimuksessa Sandra Liede Lakimies Sosiaali- ja terveysalan lupa- ja valvontavirasto (Valvira) 14.9.2015 15.9.2015 Sandra Liede 1 Biopankkilaki
Kansallisten tietovarantojen toissijainen käyttö biopankkitutkimuksessa Sandra Liede Lakimies Sosiaali- ja terveysalan lupa- ja valvontavirasto (Valvira) 14.9.2015 15.9.2015 Sandra Liede 1 Biopankkilaki
Hämeenkyrön terveyskeskus. Yhteystiedot: Hämeenkyrön terveyskeskus Härkikuja 10 39100 Hämeenkyrö
 HÄMEENKYRÖN KUNTA REKISTERISELOSTE Henkilötietolaki (523/99) 10 Perusturva Terveyspalvelut 15.4.2014 1. Terveydenhuollon toimintayksikkö (rekisterinpitäjä) 2. Rekisteriasioista vastaava henkilö Rekisteriasioiden
HÄMEENKYRÖN KUNTA REKISTERISELOSTE Henkilötietolaki (523/99) 10 Perusturva Terveyspalvelut 15.4.2014 1. Terveydenhuollon toimintayksikkö (rekisterinpitäjä) 2. Rekisteriasioista vastaava henkilö Rekisteriasioiden
Itä-Suomen Biopankki Selvitys näytteenantajalle biopankkitoiminnasta suostumuksen antamista varten
 Itä-Suomen Biopankki Selvitys näytteenantajalle biopankkitoiminnasta suostumuksen antamista varten Pyydämme teiltä suostumusta näytteiden ja niihin liittyvien tietojen keräämiseen ja tallentamiseen Itä-
Itä-Suomen Biopankki Selvitys näytteenantajalle biopankkitoiminnasta suostumuksen antamista varten Pyydämme teiltä suostumusta näytteiden ja niihin liittyvien tietojen keräämiseen ja tallentamiseen Itä-
REKISTERINPITÄJÄ JA YHTEYSHENKILÖ REKISTERIÄ KOSKEVISSA ASIOISSA Rekisterinpitäjä: Tmi ML-hahmoterapia Yhteyshenkilö: Mikko Lounela Puh:
 REKISTERINPITÄJÄ JA YHTEYSHENKILÖ REKISTERIÄ KOSKEVISSA ASIOISSA Rekisterinpitäjä: Tmi ML-hahmoterapia Yhteyshenkilö: Mikko Lounela Puh: 0505490789 Sp: mikko.lounela@hahmoterapia.com REKISTERIN NIMI Tmi
REKISTERINPITÄJÄ JA YHTEYSHENKILÖ REKISTERIÄ KOSKEVISSA ASIOISSA Rekisterinpitäjä: Tmi ML-hahmoterapia Yhteyshenkilö: Mikko Lounela Puh: 0505490789 Sp: mikko.lounela@hahmoterapia.com REKISTERIN NIMI Tmi
Sydänlihaksen aineenvaihdunnan laaja PET-TT tutkimus
 Sydänlihaksen aineenvaihdunnan laaja PET-TT tutkimus Tutkimusaika Sinulle on varattu aika PET-TT tutkimukseen. Tutkimuksen kokonaiskesto on 2-4 tuntia, josta osa on vuodelevossa. Varsinainen kuvaus kestää
Sydänlihaksen aineenvaihdunnan laaja PET-TT tutkimus Tutkimusaika Sinulle on varattu aika PET-TT tutkimukseen. Tutkimuksen kokonaiskesto on 2-4 tuntia, josta osa on vuodelevossa. Varsinainen kuvaus kestää
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
Proscar. 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Opas sädehoitoon tulevalle
 Opas sädehoitoon tulevalle Satakunnan keskussairaala Syöpätautien yksikkö / sädehoito 2014 Teksti ja kuvitus: Riitta Kaartinen Pekka Kilpinen Taru Koskinen Syöpätautien yksikkö / sädehoito Satakunnan keskussairaala
Opas sädehoitoon tulevalle Satakunnan keskussairaala Syöpätautien yksikkö / sädehoito 2014 Teksti ja kuvitus: Riitta Kaartinen Pekka Kilpinen Taru Koskinen Syöpätautien yksikkö / sädehoito Satakunnan keskussairaala
REKISTERISELOSTE Henkilötietolaki (523/99) 10
 REKISTERISELOSTE Henkilötietolaki (523/99) 10 Laatimispvm: 5.1.2010 Lue täyttöohjeet ennen rekisteriselosteen täyttämistä. Käytä tarvittaessa liitettä. 1. Rekisterinpitäjä Nimi Salon kaupunki, Ympäristönsuojeluyksikkö
REKISTERISELOSTE Henkilötietolaki (523/99) 10 Laatimispvm: 5.1.2010 Lue täyttöohjeet ennen rekisteriselosteen täyttämistä. Käytä tarvittaessa liitettä. 1. Rekisterinpitäjä Nimi Salon kaupunki, Ympäristönsuojeluyksikkö
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Uutta lääkkeistä: Ulipristaali
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Ulipristaali Annikka Kalliokoski Esmya, 5 mg tabletti, PregLem France SAS. Ulipristaaliasetaattia voidaan käyttää kohdun myoomien
Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Ulipristaali Annikka Kalliokoski Esmya, 5 mg tabletti, PregLem France SAS. Ulipristaaliasetaattia voidaan käyttää kohdun myoomien
Interventiotutkimuksen etiikkaa. Mikko Yrjönsuuri Metodifestivaali Jyväskylä
 Interventiotutkimuksen etiikkaa Mikko Yrjönsuuri Metodifestivaali Jyväskylä 22.5.2013 Klassinen interventiotutkimus James Lind tekee interventiotutkimusta HMS Salisburyllä 1747 Keripukin hoitoa mm. siiderillä,
Interventiotutkimuksen etiikkaa Mikko Yrjönsuuri Metodifestivaali Jyväskylä 22.5.2013 Klassinen interventiotutkimus James Lind tekee interventiotutkimusta HMS Salisburyllä 1747 Keripukin hoitoa mm. siiderillä,
Potilasturvallisuuden edistämisen ohjausryhmä. Potilasturvallisuus on yhteinen asia! Potilasturvallisuus. Kysy hoidostasi vastaanotolla!
 Potilasturvallisuus on yhteinen asia! Potilasturvallisuus on osa hyvää hoitoa kattaa tutkimuksen, hoidon ja laitteiden turvallisuuden tarkoittaa myös sitä, ettei hoidosta aiheutuisi potilaalle haittaa
Potilasturvallisuus on yhteinen asia! Potilasturvallisuus on osa hyvää hoitoa kattaa tutkimuksen, hoidon ja laitteiden turvallisuuden tarkoittaa myös sitä, ettei hoidosta aiheutuisi potilaalle haittaa
Tutkimusetiikkaseminaarin Kliiniset laitetutkimukset ja uudet EU-asetukset
 Tutkimusetiikkaseminaarin Kliiniset laitetutkimukset ja uudet EU-asetukset 1.12.2017 Minna Kymäläinen Tarkastaja Valvira.fi, @ValviraViestii Valvira valvoo valtakunnallisesti jokaisen oikeutta hyvinvointiin,
Tutkimusetiikkaseminaarin Kliiniset laitetutkimukset ja uudet EU-asetukset 1.12.2017 Minna Kymäläinen Tarkastaja Valvira.fi, @ValviraViestii Valvira valvoo valtakunnallisesti jokaisen oikeutta hyvinvointiin,
Rekisterinpitäjä. Rekisteriasioista vastaava yhteyshenkilö. Rekisterin nimi. Rekisterin käyttötarkoitus. Rekisterin tietosisältö
 Ekapeli-palvelun (Java-versiot: Ekapeli-Eskari, Ekapeli-Yksi, Ekapeli-Lukeminen, Ekapeli-Sujuvuus, Ekapeli- Maahanmuuttaja, Ekapeli-Spel-Ett, Ekapeli-Matikka) rekisteriseloste Henkilötietolain mukainen
Ekapeli-palvelun (Java-versiot: Ekapeli-Eskari, Ekapeli-Yksi, Ekapeli-Lukeminen, Ekapeli-Sujuvuus, Ekapeli- Maahanmuuttaja, Ekapeli-Spel-Ett, Ekapeli-Matikka) rekisteriseloste Henkilötietolain mukainen
POTILASVAHINKOJEN KORVAUSTOIMINNAN REKISTERI
 1 (5) POTILASVAHINKOJEN KORVAUSTOIMINNAN REKISTERI EU:n tietosuoja-asetuksen (EU 2016/679) 30 artiklan mukainen seloste käsittelytoimista 1. Rekisterin nimi Potilasvahinkojen korvaustoiminnan rekisteri
1 (5) POTILASVAHINKOJEN KORVAUSTOIMINNAN REKISTERI EU:n tietosuoja-asetuksen (EU 2016/679) 30 artiklan mukainen seloste käsittelytoimista 1. Rekisterin nimi Potilasvahinkojen korvaustoiminnan rekisteri
TIEDOTE TUTKIMUKSESTA
 TIEDOTE TUTKIMUKSESTA 21.11.2018 Keskushermoston herkistyminen kyselyn, Kolmen kohdan kipu ja uni kyselyn ja Terveellinen elämäntyyli ja henkilökohtainen elämänhallinnan kyselyjen validointityö Teitä pyydetään
TIEDOTE TUTKIMUKSESTA 21.11.2018 Keskushermoston herkistyminen kyselyn, Kolmen kohdan kipu ja uni kyselyn ja Terveellinen elämäntyyli ja henkilökohtainen elämänhallinnan kyselyjen validointityö Teitä pyydetään
POTILASASIAKIRJASSA OLEVAN TIEDON ANTAMINEN POTILAALLE
 17.3.2016 Dnro 1669/2/15 Ratkaisija: Oikeusasiamies Petri Jääskeläinen Esittelijä: Vanhempi oikeusasiamiehensihteeri Håkan Stoor POTILASASIAKIRJASSA OLEVAN TIEDON ANTAMINEN POTILAALLE 1 ASIA Tutkittavani
17.3.2016 Dnro 1669/2/15 Ratkaisija: Oikeusasiamies Petri Jääskeläinen Esittelijä: Vanhempi oikeusasiamiehensihteeri Håkan Stoor POTILASASIAKIRJASSA OLEVAN TIEDON ANTAMINEN POTILAALLE 1 ASIA Tutkittavani
POTILAS- JA ASIAKASTURVALLISUUSSTRATEGIA Potilaan ja asiakkaan aktiivinen osallistuminen
 POTILAS- JA ASIAKASTURVALLISUUSSTRATEGIA 2017 2021 Potilaan ja asiakkaan aktiivinen osallistuminen Tavoitteet vuoteen 2021 mennessä Potilas- ja asiakasturvallisuus näkyy rakenteissa ja käytännön toiminnassa.
POTILAS- JA ASIAKASTURVALLISUUSSTRATEGIA 2017 2021 Potilaan ja asiakkaan aktiivinen osallistuminen Tavoitteet vuoteen 2021 mennessä Potilas- ja asiakasturvallisuus näkyy rakenteissa ja käytännön toiminnassa.
Suomeksi Näin käytät ereseptiä
 Suomeksi Näin käytät ereseptiä Kaikkialla Suomessa siirrytään vaiheittain käyttämään sähköistä reseptiä eli ereseptiä. Tarkista, mitkä apteekit ja terveydenhuollon toimipaikat käyttävät jo ereseptiä. Saat
Suomeksi Näin käytät ereseptiä Kaikkialla Suomessa siirrytään vaiheittain käyttämään sähköistä reseptiä eli ereseptiä. Tarkista, mitkä apteekit ja terveydenhuollon toimipaikat käyttävät jo ereseptiä. Saat
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Potilasinformaatio ja suostumus
 Potilasinformaatio ja suostumus Suomen lihastautirekisteri, Duchennen lihasdystrofia Tietoa verkostoon rekisteröityvälle Ennen rekisteröitymistä Suomen Lihastautirekisteriin, on hyvin tärkeää että ymmärrät
Potilasinformaatio ja suostumus Suomen lihastautirekisteri, Duchennen lihasdystrofia Tietoa verkostoon rekisteröityvälle Ennen rekisteröitymistä Suomen Lihastautirekisteriin, on hyvin tärkeää että ymmärrät
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
LAPSET JA BIOPANKIT. Valvira 25.11.2014. Jari Petäjä
 LAPSET JA BIOPANKIT Valvira 25.11.2014 Jari Petäjä 1 Lasten elämänkaari sairaanhoidon näkökulmasta Aikuisten hoito kasvu ja kehitys perhe ja vanhemmuus raha, taudit potilaan hoitomyöntyvyys 0 ikä 16 25
LAPSET JA BIOPANKIT Valvira 25.11.2014 Jari Petäjä 1 Lasten elämänkaari sairaanhoidon näkökulmasta Aikuisten hoito kasvu ja kehitys perhe ja vanhemmuus raha, taudit potilaan hoitomyöntyvyys 0 ikä 16 25
REKISTERISELOSTE Henkilötietolaki (523/99) 10
 Salon kaupunki 3470/07.01.01.02.00/2018 REKISTERISELOSTE Henkilötietolaki (523/99) 10 Laatimispvm: 9.2.2017 Lue täyttöohjeet ennen rekisteriselosteen täyttämistä. Käytä tarvittaessa liitettä. 1. Rekisterinpitäjä
Salon kaupunki 3470/07.01.01.02.00/2018 REKISTERISELOSTE Henkilötietolaki (523/99) 10 Laatimispvm: 9.2.2017 Lue täyttöohjeet ennen rekisteriselosteen täyttämistä. Käytä tarvittaessa liitettä. 1. Rekisterinpitäjä
Potilaan käsikirja. Potilaan opas turvalliseen hoitoon sairaalassa 1(16) Tämän kirjan omistaa: -----------------------------------------
 1(16) Potilasturvallisuuden edistämisen ohjausryhmä Potilaan käsikirja Potilaan opas turvalliseen hoitoon sairaalassa Tämän kirjan omistaa: ----------------------------------------- Meritullinkatu 8, Helsinki
1(16) Potilasturvallisuuden edistämisen ohjausryhmä Potilaan käsikirja Potilaan opas turvalliseen hoitoon sairaalassa Tämän kirjan omistaa: ----------------------------------------- Meritullinkatu 8, Helsinki
Hämeenkyrön terveyskeskus. Yhteystiedot: Hämeenkyrön terveyskeskus Härkikuja 10 39100 Hämeenkyrö
 HÄMEENKYRÖN KUNTA REKISTERISELOSTE Henkilötietolaki (523/99) 10 Perusturva Terveyspalvelut Laatimispäivä 24.7.2007 Päivitetty 15.4.2014 1. Terveydenhuollon toimintayksikkö (rekisterinpitäjä) 2. Rekisteriasioista
HÄMEENKYRÖN KUNTA REKISTERISELOSTE Henkilötietolaki (523/99) 10 Perusturva Terveyspalvelut Laatimispäivä 24.7.2007 Päivitetty 15.4.2014 1. Terveydenhuollon toimintayksikkö (rekisterinpitäjä) 2. Rekisteriasioista
Lumetta vai lääkettä? Tapani Keränen Kanta-Hämeen keskussairaala
 Lumetta vai lääkettä? Tapani Keränen Kanta-Hämeen keskussairaala Ovatko lumelääketutkimukset välttämättömiä lumelääke mittaa tutkimuksen kykyä osoittaa eroja eri hoitoryhmien välillä tautiin/oireeseen
Lumetta vai lääkettä? Tapani Keränen Kanta-Hämeen keskussairaala Ovatko lumelääketutkimukset välttämättömiä lumelääke mittaa tutkimuksen kykyä osoittaa eroja eri hoitoryhmien välillä tautiin/oireeseen
Optimointi muutokset vaatimuksissa
 Optimointi muutokset vaatimuksissa STUKin Säteilyturvallisuuspäivät Jyväskylä 24.-25.5.2018 Ylitarkastaja Petra Tenkanen-Rautakoski Optimoinnista säädetään jatkossa SätL 2 luku, 6 Optimointiperiaate Tarkemmat
Optimointi muutokset vaatimuksissa STUKin Säteilyturvallisuuspäivät Jyväskylä 24.-25.5.2018 Ylitarkastaja Petra Tenkanen-Rautakoski Optimoinnista säädetään jatkossa SätL 2 luku, 6 Optimointiperiaate Tarkemmat
Kansallinen rokotusohjelma tutuksi
 Kansallinen rokotusohjelma tutuksi Tämä selkokielinen esite on tehty osana opinnäytetyötä Kansallinen rokotusohjelma tutuksi selkokielinen esite maahanmuuttajille. Opinnäytetyön toimeksiantaja on MARJAT-hanke.
Kansallinen rokotusohjelma tutuksi Tämä selkokielinen esite on tehty osana opinnäytetyötä Kansallinen rokotusohjelma tutuksi selkokielinen esite maahanmuuttajille. Opinnäytetyön toimeksiantaja on MARJAT-hanke.
ACUTE OHJE Informointi, kielto ja suostumus
 ACUTE OHJE Informointi, kielto ja suostumus Sisällysluettelo 1 Johdanto 2 Informointi, kielto, suostumus 2.1 Informointi 2.2 Suostumus 2.3 Kielto 1 Johdanto Asiakkaan informointi, suostumus ja kieltomerkintöjä
ACUTE OHJE Informointi, kielto ja suostumus Sisällysluettelo 1 Johdanto 2 Informointi, kielto, suostumus 2.1 Informointi 2.2 Suostumus 2.3 Kielto 1 Johdanto Asiakkaan informointi, suostumus ja kieltomerkintöjä
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä
 mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
ASIAKKAAN ASIAKIRJATIETOJEN KÄSITTELY JA ARKISTOINTI
 2018 ASIAKKAAN ASIAKIRJATIETOJEN AUTISMISÄÄTIÖ Anssi Tuomi, tietosuojavastaava AUTISMISÄÄTIÖ Tietosuojaryhmä 2018 Autismisäätiö, tietosuojaryhmä 1(4) SISÄLLYSLUETTELO 1. Mihin tarkoitukseen Autismisäätiö
2018 ASIAKKAAN ASIAKIRJATIETOJEN AUTISMISÄÄTIÖ Anssi Tuomi, tietosuojavastaava AUTISMISÄÄTIÖ Tietosuojaryhmä 2018 Autismisäätiö, tietosuojaryhmä 1(4) SISÄLLYSLUETTELO 1. Mihin tarkoitukseen Autismisäätiö
Nimi Tampereen kaupunki, kiinteistötoimi. Aila Taura p. 050 351 8256 Marjut Malo-Siltanen p. 040 801 6776 ja Jaana Rimpi-Muhonen p.
 Henkilötietolain (523/99) 10 :n mukainen REKISTERISELOSTE 1. Rekisterinpitäjä (tarvittaessa eli jos rekisterinpitäjällä ei toimipaikkaa EU:n alueella, myös edustaja) Nimi Tampereen kaupunki, kiinteistötoimi
Henkilötietolain (523/99) 10 :n mukainen REKISTERISELOSTE 1. Rekisterinpitäjä (tarvittaessa eli jos rekisterinpitäjällä ei toimipaikkaa EU:n alueella, myös edustaja) Nimi Tampereen kaupunki, kiinteistötoimi
EDENNEEN PARKINSONIN TAUDIN HOITO
 EDENNEEN PARKINSONIN TAUDIN HOITO Parkinsonin tauti on etenevä neurologinen sairaus, jonka oireita ovat liikkeiden hitaus, lepovapina, lihasjäykkyys ja tasapainovaikeudet. Oireet johtuvat aivojen mustan
EDENNEEN PARKINSONIN TAUDIN HOITO Parkinsonin tauti on etenevä neurologinen sairaus, jonka oireita ovat liikkeiden hitaus, lepovapina, lihasjäykkyys ja tasapainovaikeudet. Oireet johtuvat aivojen mustan
2. REKISTERINPITÄJÄ Nimi Pohjois-Pohjanmaan sairaanhoitopiiri
 Rekisteriseloste 1 (5) 1. REKISTERIN NIMI Potilasrekisteri 2. REKISTERINPITÄJÄ Nimi Pohjois-Pohjanmaan sairaanhoitopiiri Käyntiosoite Postiosoite Puhelinvaihde (08) 315 2011 3. REKISTERIASIOIDEN VASTUUHENKILÖ
Rekisteriseloste 1 (5) 1. REKISTERIN NIMI Potilasrekisteri 2. REKISTERINPITÄJÄ Nimi Pohjois-Pohjanmaan sairaanhoitopiiri Käyntiosoite Postiosoite Puhelinvaihde (08) 315 2011 3. REKISTERIASIOIDEN VASTUUHENKILÖ
Yliopiston ja sairaanhoitopiirin tutkimuseettisten toimikuntien työnjako
 Yliopiston ja sairaanhoitopiirin tutkimuseettisten toimikuntien työnjako Kirsi Luoto, tutkimuspäällikkö, FT PSSHP:n TETMK KYS /Tutkimusyksikkö 21.3.2011 Sairaanhoitopiirin tutkimuseettinen toimikunta Sairaanhoitopiirin
Yliopiston ja sairaanhoitopiirin tutkimuseettisten toimikuntien työnjako Kirsi Luoto, tutkimuspäällikkö, FT PSSHP:n TETMK KYS /Tutkimusyksikkö 21.3.2011 Sairaanhoitopiirin tutkimuseettinen toimikunta Sairaanhoitopiirin
Veriturvallisuus ja jäljitettävyysvaatimukset. Anu Puomila, ylitarkastaja puh
 Veriturvallisuus ja jäljitettävyysvaatimukset Anu Puomila, ylitarkastaja anu.puomila@fimea.fi puh. 029-522 3242 Fimean Luvat ja tarkastukset -yksikkö Vuonna 2016 yksikössä: käsiteltiin 2356 lupa-asiaa
Veriturvallisuus ja jäljitettävyysvaatimukset Anu Puomila, ylitarkastaja anu.puomila@fimea.fi puh. 029-522 3242 Fimean Luvat ja tarkastukset -yksikkö Vuonna 2016 yksikössä: käsiteltiin 2356 lupa-asiaa
EU:n tietosuoja-asetus (GDPR)
 EU:n tietosuoja-asetus (GDPR) Mikä GDPR? The General Data Protection Regulation (GDPR) = EU:n tietosuoja-asetus Asetus, ei direktiivi, eli kaikkien jäsenmaiden on pakko noudattaa Astuu voimaan 25.5.2018
EU:n tietosuoja-asetus (GDPR) Mikä GDPR? The General Data Protection Regulation (GDPR) = EU:n tietosuoja-asetus Asetus, ei direktiivi, eli kaikkien jäsenmaiden on pakko noudattaa Astuu voimaan 25.5.2018
LÄHTÖVAIHEEN KYSELY - HIV-POSITIIVINEN NAINEN
 OHJEET TUTKIMUSHENKILÖKUNNALLE: Antakaa tutkimukseen osallistujien täyttää tämä lähtövaiheen kysely tutkimukseen ilmoittauduttaessa. Varmistakaa, että annatte oikean kyselylomakkeen. Kun kyselylomake on
OHJEET TUTKIMUSHENKILÖKUNNALLE: Antakaa tutkimukseen osallistujien täyttää tämä lähtövaiheen kysely tutkimukseen ilmoittauduttaessa. Varmistakaa, että annatte oikean kyselylomakkeen. Kun kyselylomake on
Erivedge -valmisteen raskaudenehkäisyohjelma
 Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Tutkittavan tiedote ja tietoinen suostumus HIV-negatiiviselle kumppanille. PARTNER-tutkimus
 Tutkittavan tiedote ja tietoinen suostumus HIV-negatiiviselle kumppanille PARTNER-tutkimus PARTNER-tutkimus on tutkimus, joka tehdään pareille, joissa: (i) toinen osapuoli on HIV-positiivinen ja toinen
Tutkittavan tiedote ja tietoinen suostumus HIV-negatiiviselle kumppanille PARTNER-tutkimus PARTNER-tutkimus on tutkimus, joka tehdään pareille, joissa: (i) toinen osapuoli on HIV-positiivinen ja toinen
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Vaaratilanneilmoitusmenettely Minna Kymäläinen
 Vaaratilanneilmoitusmenettely 26.5.2016 Minna Kymäläinen Valvira valvoo valtakunnallisesti jokaisen oikeutta hyvinvointiin, laadukkaisiin palveluihin ja turvallisiin elinoloihin. Vaaratilanteista ilmoittaminen
Vaaratilanneilmoitusmenettely 26.5.2016 Minna Kymäläinen Valvira valvoo valtakunnallisesti jokaisen oikeutta hyvinvointiin, laadukkaisiin palveluihin ja turvallisiin elinoloihin. Vaaratilanteista ilmoittaminen
Laitetutkimukset terveydenhuollossa Minna Kymäläinen Tarkastaja
 Laitetutkimukset terveydenhuollossa 17.3.2017 Minna Kymäläinen Tarkastaja Valvira.fi, @ValviraViestii Valvira valvoo valtakunnallisesti jokaisen oikeutta hyvinvointiin, laadukkaisiin palveluihin ja turvallisiin
Laitetutkimukset terveydenhuollossa 17.3.2017 Minna Kymäläinen Tarkastaja Valvira.fi, @ValviraViestii Valvira valvoo valtakunnallisesti jokaisen oikeutta hyvinvointiin, laadukkaisiin palveluihin ja turvallisiin
Propecia (finasteridi 0,2 ja 1 mg) tabletti , versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN
 Ohje x.x.2017 6895/00.01.02/2016 x/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut
Ohje x.x.2017 6895/00.01.02/2016 x/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut
Rivarko Oy:n tietosuojakäytäntö Viimeksi päivitetty
 1(5) Rivarko Oy:n tietosuojakäytäntö Viimeksi päivitetty 24.5.2018 Tämä tietosuojakäytäntö soveltuu Rivarko Oy:n asiakkaiden henkilötietojen käsittelyyn, ja siinä kuvataan keskeiset henkilötietojen käsittelyä
1(5) Rivarko Oy:n tietosuojakäytäntö Viimeksi päivitetty 24.5.2018 Tämä tietosuojakäytäntö soveltuu Rivarko Oy:n asiakkaiden henkilötietojen käsittelyyn, ja siinä kuvataan keskeiset henkilötietojen käsittelyä
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski
 mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
PJ:n puheenvuoro uusille eettisten toimikuntien jäsenille Katia Käyhkö LT Yleislääketieteen erikoislääkäri HUS Koordinoivan tmk:n pj
 PJ:n puheenvuoro uusille eettisten toimikuntien jäsenille Katia Käyhkö LT Yleislääketieteen erikoislääkäri HUS Koordinoivan tmk:n pj Miten eettisessä toimikunnassa mukana oleminen olisi jäsenelle mahdollisimman
PJ:n puheenvuoro uusille eettisten toimikuntien jäsenille Katia Käyhkö LT Yleislääketieteen erikoislääkäri HUS Koordinoivan tmk:n pj Miten eettisessä toimikunnassa mukana oleminen olisi jäsenelle mahdollisimman
RMP section VI.2 Elements for Public Summary
 RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
