N-asetyylikysteiini (NAC) on luonnossa
|
|
|
- Hilja Väänänen
- 5 vuotta sitten
- Katselukertoja:
Transkriptio
1 Katsaus N-asetyylikysteiini: uusia käyttömahdollisuuksia vanhalle aineelle Terhi Ahola ja Risto Lapatto N-asetyylikysteiini on alun perin yskänlääkkeeksi kehitetty tioliyhdiste, joka toimii sellaisenaan antioksidanttina. Pääosa tämän aineen vaikutuksista johtuu sen muuttumisesta kysteiiniksi, joka lisää soluja suojaavan glutationin synteesiä. N-asetyylikysteiinilääkitys on käypä hoito maksan toimintaa uhkaavissa parasetamolimyrkytyksissä, ja siitä saattaa olla apua muissakin maksaa vaurioittavissa tilanteissa. Sen käyttöä on esitetty myös monen muun patogeneesiltään erilaisen sairauden hoitoon. Eniten N-asetyylikysteiiniä kuluu nykyisin tutkimuslaboratorioissa, joissa sitä käytetään mm. muuntamaan solujen hapetus-pelkistystilaa, joka on tärkeä esimerkiksi solujen kasvun säätelyssä. N-asetyylikysteiini (NAC) on luonnossa esiintyvän kysteiiniaminohapon synteettinen johdos, jonka kestävyyttä on parannettu liittämällä asetyyliryhmä kysteiinin aminotyppeen. NAC kehitettiin ensisijaisesti yskänlääkkeeksi jo vuosikymmeniä sitten. Se pelkistää ysköksessä olevia rikkisiltoja vapaiksi sulfidiryhmiksi, ja siksi lima muuttuu juoksevammaksi. NAC:tä on vuosien saatossa kokeiltu moninaisten keuhkosairauksien hoitoon inhaloituna sekä suun kautta ja suoneen annettuna. Se ei ole osoittautunut ihmelääkkeeksi, mutta sitä käytetään edelleen mm. kroonisen bronkiitin ja kystisen fibroosin hoidossa. NAC:n on osoitettu parantavan fagosytoivien solujen toimintaa keuhkoissa (Oddera ym.1994), millä on suotuisa vaikutus em. taudeissa. Myös fibrotisoivan alveoliitin tukihoitona NAC:tä saaneilla on todettu keuhkojen toiminnan paranevan (Behr ym. 1997). NAC:lle alkoi löytyä muitakin käyttökohteita, joista maksan tukeminen parasetamolimyrkytyksen hoidossa vakiintui 1980-luvulla. Viime vuosina aine on saanut lisää suosiota sekä tutkimuksessa että hoidossa uusien käyttötarkoitusten ilmaantuessa tutkimusten edistyessä. Tässä katsauksessa käymme läpi NAC:n nykyiset käyttötavat, pohdimme uusia käyttöaiheita ja luomme silmäyksen aineen käyttöön tutkimuslaboratoriossa. Antioksidantti ja glutationin esiaste N-asetyylikysteiinin vaikutusmekanismeja ei kaikilta osin tunneta. Aine vaikuttaa kahdella edullisella tavalla elimistön puolustukseen reaktiivisia happiyhdisteitä kuten vetyperoksidia sekä superoksidi- ja hydroksyyliradikaaleja vastaan. Ensinnäkin se voi toimia radikaalien sieppaajana. Erityisen hyvin se eliminoi hydroksyyliradikaaleja (Aruoma ym. 1989), jotka ovat elimistölle kaikkein vaarallisimpia reaktiivisuutensa vuoksi. Toisaalta NAC deasetyloituu kysteiiniksi mm. suolen mukoosassa ja maksassa. Näin se tukee kysteiinin saantia esimerkiksi glutationisynteesiin. Glutationi (GSH) on erittäin tärkeä solunsisäinen suoja-aine, jonka pitoisuus soluissa on suuri, jopa millimolaarinen. GSH toimii sekä antioksidanttina että konjugaattina, johon haitallisia aineita liitetään solusta poistamista helpottamaan. Se koostuu kolmesta aminohaposta (glysiini, kysteiini ja glutamiinihappo), joista kysteiiniä on vähiten tarjolla synteesiin. Ihminen saa kysteiiniä ravinnosta, ja maksa voi teh- Duodecim 1999; 115:
2 dä sitä transsulfuraatioreitin entsyymien avulla metioniinista. Erityisasemassa ovat keskoset, sillä heillä maksan kystationaasientsyymin aktiivisuus on olematon ja kysteiini siksi välttämätön (Sturman ym. 1970). Kystationaasin aktiivisuutta eri maksasairauksissa ei tunneta, mutta maksasolun tuhoutuessa häviää entsyymiaktiivisuuskin. Glutationia sen sijaan syntyy joka solussa tarpeen mukaan, jos raaka-aineita ja energiaa on saatavissa. NAC:n farmakokinetiikkaa ihmisessä on tutkittu sekä suun kautta että laskimoon annon yhteydessä. On jossakin määrin harhaanjohtavaa, kun tuloksissa ilmoitetaan huono biologinen hyötyosuus. Suun kautta saadun annoksen jälkeen ei systeemikierrossa ole NAC:tä kuin muutama prosentti, mutta koska biologisesta vaikutuksesta suuri osa tulee kysteiinin ja glutationin välityksellä, ei plasman NAC-pitoisuus kerro kaikkea. Mainitun deasetylaation lisäksi vapaa NAC häviää verenkierrosta erittymällä sellaisenaan virtsaan ja liittymällä rikkisillalla toisiin NAC-molekyyleihin tai muihin molekyyleihin (Cotgreave 1997). Vapaan NAC:n puoliintumisaika plasmassa on muutamia tunteja, ja se jakaantuu pääosin solunulkoiseen vesifaasiin (Olsson ym.1988). Parasetamolimyrkytys Etenkin lasten kipu- ja kuumelääkkeenä paljon käytetty parasetamoli on suurina annoksina maksatoksinen. Parasetamolin yliannostus itsemurhatarkoituksessa on maailmalla varsin tavallista. Toksisuuden biokemialliset mekanismit eivät ole täysin selvillä, mutta sytokromi P-450- entsyymit hapettavat noin 5 % annoksesta reaktiiviseksi metaboliitiksi, N-asetyyli-p-bentsokinoni-imiiniksi (NAPQI). Maksa pyrkii poistamaan NAPQI:n konjugoimalla sen glutationin kanssa. Myrkytyksessä NAPQI:tä syntyy runsaasti, eikä maksasolujen glutationi riitä kaiken konjugoimiseen, jolloin vapaaksi jäävä osa sitoutuu kovalentisti proteiineihin aiheuttaen kudosnekroosia. N-asetyylikysteiinin avulla maksan kysteiinija glutationimäärää voidaan lisätä. Lisäksi NAC inaktivoi myös suoraan NAPQI:tä. Parasetamolimyrkytyksen myöhemmässä vaiheessa NAC:n arvellaan suojaavan antioksidanttina eliminoimalla paikalle tulleiden neutrofiilien tuottamia reaktiivisia happiyhdisteitä. Lisäksi on viitteitä siitä, että NAC positiivisena inotrooppina ja vasodilataattorina parantaa verenvirtausta maksassa (Harrison ym.1990). Parasetamolimyrkytyksen vakavuuden arviointi on vaikeaa, koska eri ihmiset sietävät hyvin erilaisia määriä parasetamolia. Kerta-annoksen ylittäessä aikuisella 10 g tai 150 mg/kg on maksavaurion vaara suuri. Alkoholin pitkäaikainen tai maksan mikrosomaalisia entsyymejä indusoivien lääkkeiden kuten karbamatsepiinin, fenytoiinin ja rifampisiinin käyttö saattaa lisätä maksavaurion riskiä, jolloin jo pienemmätkin annokset voivat olla maksatoksisia. Kerta-annos, jonka suuruus on yli mg/kg aiheuttaa lapsille usein maksavaurioita. Lisäksi on huomioitava parasetamolin krooninen toksisuus, kun käytetään isoja terapeuttisia kertaannoksia useamman päivän ajan. Jopa pienemmän annoksen kuin 100 mg/kg/vrk on kuvattu aiheuttaneen lapsille fataaleja maksavaurioita (Heubi ym. 1998). Mikäli parasetamolimyrkytystä epäillään, NAC-hoito on syytä aloittaa mahdollisimman pian (Smilkstein ym.1991, Vale ja Proudfoot 1995). Suomessa, ja Euroopassa yleensä, suositellaan suonensisäistä infuusiota, mutta Yhdysvalloissa käytetään pääosin suun kautta annettavaa hoitoa. Yhdysvaltalaisissa laajoissa tutkimuksissa on selvinnyt, että seerumin parasetamolipitoisuutta määritettynä aikaisintaan neljän tunnin kuluttua lääkkeen ottamisesta voidaan käyttää perusteena ratkaistaessa, tarvitseeko NAClääkitystä jatkaa (Rumack ja Matthew 1975) (kuva 1). NAC-hoito estää maksavauriota parhaiten, kun se aloitetaan kahdeksan tunnin kuluessa lääkkeen otosta. Se vähentää kuolleisuutta myös myöhemmin, jopa yli vuorokauden kuluttua lääkkeen otosta aloitettuna (Keays ym. 1991). Oleellista on hoidon jatkaminen tarpeeksi kauan, jos todetaan viitteitä maksavauriosta. Myrkyn eliminoiminen vie aikaa ja glutationia, jota myös mainittu tulehdusreaktio kuluttaa. Jos aikuisen ottama parasetamoliannos on yli 10 g tai 150 mg/kg eikä lääkkeen pitoisuutta 376 T. Ahola ja R. Lapatto
3 Seerumin parasetamolipitoisuus (µmol/l) Maksavaurion riski merkittävä Maksavaurion riski vähäinen Yliannoksesta kulunut aika tunteina Kuva 1. Nomogrammi, jonka avulla voidaan arvioida maksavaurion riski ja N-asetyylikysteiinihoidon tarve parasetamolimyrkytyspotilaalla. Lääkeainepitoisuus on mitattava imeytymisvaiheen jälkeen, aikaisintaan neljän tunnin kuluttua yliannoksen ottamisesta. Suoran yläpuolelle osuva pitoisuus-aikapiste merkitsee, että maksavaurion riski on merkittävä, ja alapuolelle osuva, että maksavaurion riski on vähäinen. Parasetamolipitoisuudet voidaan muuntaa yksiköstä toiseen sen perusteella, että 100 µg/ml vastaa pitoisuutta 661 µmol/l (Kivistö ym. 1997). seerumissa tiedetä, aloitetaan NAC-infuusio riippumatta siitä, kuinka kauan lääkkeen ottamisesta on kulunut. Lapsilla ja alkoholin suurkuluttajilla on NAC-infuusion aloittamista harkittava jo pienemmänkin parasetamoliannoksen jälkeen. NAC:tä annetaan 150 mg/kg 200 ml:ssa 5-prosenttista glukoosiliuosta 15 minuutin aikana (tai 60 minuutissa, jos sivuvaikutuksia ilmaantuu), sitten 50 mg/kg 500 ml:ssa em. liuosta neljän tunnin aikana ja sen jälkeen 100 mg/kg ml:ssa 16 tunnin aikana eli NAC:tä annetaan yhteensä 300 mg/kg 20 tunnissa. Kun tiedetään seerumin parasetamolipitoisuus, määritettynä aikaisintaan neljän tunnin kuluttua lääkkeen ottamisesta, arvioidaan NACinfuusion tarve uudelleen. Mikäli pitoisuus ylittää kuvassa 1 olevan suoran tai potilaalla esiintyy maksavaurion oireita tai löydöksiä, jatketaan NAC-lääkitystä annoksella 6 mg/kg/h, kunnes potilas toipuu. Jos potilaalle kehittyy hoidosta huolimatta fulminantti maksavaurio, on harkittava maksansiirtoa. Lapsille NAC:n annos on sama, mutta infusoitavan nesteen määrää on syytä vähentää lapsen koon mukaan, jotta vältettäisiin liikaa nesteytystä ja siihen liittyviä ongelmia. NAC voidaan lisätä moniin infuusioliuoksiin, ja sen liukoisuus on hyvä. Koska parasetamoli läpäisee istukan, pitää sen aiheuttamaa myrkytystä hoitaa aktiivisesti NAC:llä myös raskauden aikana. NAC:n sivuvaikutuksina, etenkin infuusion alussa pitoisuuden ollessa plasmassa suurimmillaan, on kuvattu anafylaktisia oireita, ja niihin on syytä varautua. Oireena voi olla pahoinvointia, verenpaineen laskua, bronkusobstruktiota, urtikariaa, ihon punoitusta ja kutinaa (Mant ym. 1984). Reaktio saadaan yleensä hallintaan parenteraalisilla antihistamiineilla; hätätilanteissa käytetään adrenaliinia. NAC-infuusion hidastaminen vähentää allergista oireilua, eikä suositusten mukaiselle isolle alkuannokselle ole tieteellisiä perusteita. Kun maksa pettää, NAC voi auttaa! Maksa voi vaurioitua monista syistä, joista yleisimpiä ovat virukset ja myrkyt, ja edellä kuvatusta parasetamolimyrkytyksen hoidosta kannattaa ottaa mallia muidenkin maksakatastrofien hoitoon. Maksan heikentyessä sen kyky ja siis koko elimistön kyky tehdä kysteiiniä metioniinistä heikkenee ja glutationisynteesin raaka-ainetta on vähemmän saatavilla kaikissa soluissa. Tilannetta huonontaa usein vielä aminohappojen saannin rajoittaminen. Kun potilaalle annetaan vain vähän aminohappoja, välttämättömistä olisi pidettävä erityistä huolta. Kysteiiniä, joka muuttuu välttämättömäksi oman synteesin loppuessa, on useimmissa kaupallisissa liuoksissa varsin vähän. Olipa siis maksan vajaatoiminnan syy mikä hyvänsä ja tilanne akuutti tai krooninen, koko elimistön glutationin riittävyys on uhattuna. Tällaisissa harvinaisissa henkeä uhkaavissa tilanteissa NAC olisi mielestämme kokeilemisen arvoinen, koska sen sivuvaikutukset ovat vähäiset (ks. myös Isoniemi ja Pöyhiä, tässä numerossa). Sivuvaikutukset ovat epätodennäköisiä käytettäessä pientä jatkuvaa infuusiota. (Sitä on syytä jatkaa riittävän kauan eli usean vuorokauden ajan). Harrison ym. antoivat parasetamolimyrkytyksen hoitosuosituksen mukaista NAC-hoitoa potilaille, joiden maksan toiminta N-asetyylikysteiini: uusia käyttömahdollisuuksia vanhalle aineelle 377
4 oli akuutin hepatiitin vuoksi heikentynyt, ja he totesivat maksan hapensaannin parantuvan (Harrison ym. 1991). Aiheesta kaivattaisiin hyvin toteutettuja tutkimuksia. Erilaisia myrkytyspotilaita hoidettaessa on syytä muistaa, että GSH on toisen vaiheen detoksikaatioreaktioissa keskeinen komponentti, kuten edellä jo parasetamolin osalta todettiin, ja sitä kuluu soluissa monen myrkytyksen yhteydessä. Potilaan kysteiinin saannista on tällöin huolehdittava tarkoin, ja NAC voisikin auttaa, etenkin jos potilaan maksan toiminta on vähänkään uhanalainen. Lupaavia tuloksia uusissa käyttöaiheissa Tulehdussoluista vapautuvien happiradikaalien arvellaan olevan osatekijänä septisen sokin ja aikuisten akuutin hengitysvaikeusoireyhtymän (ARDS) synnyssä. NAC:tä onkin kokeiltu ARDS:n ja septisen sokin tukihoitona aikuisilla vaihtelevin tuloksin (Jepsen ym. 1992, Spies ym. 1994, Peake ym. 1996, Galley ym. 1997). Selvää hyötyä, esimerkiksi kuolleisuuden vähenemistä, ei ole voitu osoittaa, mutta plasman ja alveolaarinesteen GSH-pitoisuuksien on todettu suurenevan ja hemodynamiikan kohentuvan. Joissakin tutkimuksissa myös sairastamisaika on lyhentynyt (Suter ym. 1994, Bernard ym. 1997). T-lymfosyyttien viallisen toiminnan katsotaan aiheuttavan melkoisen kirjon tauteja allergiasta immuunikatoon. NAC vaikuttaa T-lymfosyyttien toimintaan ilmeisesti pääosin säätelemällä geenien luentaa. Immuunikatopotilailla on osoitettu plasman kysteiinipitoisuuden ja T-solujen GSH-pitoisuuksien pienentyneen, mikä johtaa ennenaikaiseen solukuolemaan ja virusreplikaation lisääntymiseen. NAC-terapia tuntuu siksi kokeilemisen arvoiselta (Dröge ym. 1995). Sillä onkin parannettu immuunikatopotilaiden selviytymistä kokeessa, jossa potilaat saivat kahdeksan viikon ajan NAC:tä tai lumetta (Herzenberg ym. 1997). Viitteitä NAC:n vaikutuksista immuunijärjestelmään antoi myös De Floran ym. (1997) tutkimus, jossa kroonisia ei-respiratorisia degeneratiivisia sairauksia poteville annettiin kuuden kuukauden ajan suun kautta NAC:tä satunnaistetussa kaksoissokkokokeessa ja todettiin influenssan kaltaisten oireiden vähentyneen. NAC:n, kuten muidenkin tiolien, on osoitettu vähentävän nitraattitoleranssin kehittymistä (Boesgaard ym. 1992). Käytettynä yhdessä glyseryylinitraatin ja streptokinaasin kanssa siitä saattaa olla hyötyä myös akuutin sydäninfarktin hoidossa (Arstall ym. 1995). Myös vatsaaortan aneurysmaleikkauksen jälkeistä reperfuusion aiheuttamaa oksidatiivista stressiä on vähennetty NAC:llä (Kretzschmar ym. 1996). Valitettavasti tavallisemmissa reperfuusiotilanteissa NAC:n vaikutusta ei ole tutkittu. Laboratoriosta klinikkaan? Laboratoriokokeissa NAC on estänyt tehokkaasti mm. apoptoosia, proliferaatiota ja transformaatiota eräissä koeasetelmissa. Nämäkin vaikutukset välittyvät osittain suoraan NAC:n SH-ryhmän ja osin GSH:n kautta. Hapetus-pelkistystilan mukaan toimivia transkriptiotekijöitä löytyy koko ajan lisää, kun geenien säätelyä tutkitaan. NAC ja GSH vaikuttavat solujen hapetus-pelkistystilaan tarjoamalla pelkistyneitä SH-ryhmiä, jotka voivat toisaalta sitoutua transkriptiotekijöiden SH-ryhmiin ja toisaalta vapauttaa niitä muista molekyyleistä kilpailemalla samoista sitoutumispaikoista. NAC on sekä antimutageeni että antikarsinogeeni in vitro. Joissakin syövän eläinmalleissa se on mm. vähentänyt kasvainten syntyä (De Flora ym. 1991). NAC:tä onkin kokeiltu syövän ehkäisyn (van Zandwijk 1995) ja lääkityksen sivuvaikutuksia vähentävänä tukihoitona. Doksorubisiinin kardiotoksisuutta rotille onkin saatu pienenemään NAC:llä (De Flora ym. 1996), mutta ihmisillä tehtyjen hoito- ja preventiokokeiden tulokset ovat olleet toistaiseksi melko huonoja. Laboratoriokokeissa on myös osoitettu NAC:n vähentävän neuronivauriota erilaisissa malleissa. Kunnollisia hoitokokeita ei ole tehty, mutta etenevää myoklonusepilepsiaa (PME-UL) sairastavilla neljällä sisaruksella tehdyssä hoitokokeessa NAC yhdessä muiden antioksidanttien ja magnesiumin kanssa paransi potilaiden vointia huomattavasti vuoden seuranta-aikana (Hurd ym. 1996). 378 T. Ahola ja R. Lapatto
5 Laboratoriohavaintojen mahdollista kliinistä sovellusta ajateltaessa on syytä muistaa, että vaikutukset on usein saatu aikaan varsin suurilla NAC-pitoisuuksilla. Aivan varmaa on, että soluviljelmissä ja koe-eläimillä saadaan myönteisiä tuloksia, jotka kaikki eivät valitettavasti johda parempaan hoitoon. Olisi tärkeää tehdä hyvän tutkimustavan mukaisia hoitokokeita eikä suin päin ryhtyä kokeilemaan NAC:tä vaivaan kuin vaivaan. NAC ei kuulu rohdoskauppojen antioksidanttihyllylle. N-asetyylikysteiinin vaiheet osoittavat, että vanhoja vaatteita ei kannata hävittää, ne tulevat vielä joskus takaisin muotiin. Tutkijoiden ennakkoluulottomat ajatukset ja kokeilut ovat tuoneet vanhan yskänlääkkeen immuunikadon hoitoon, syövän ehkäisyyn ja jopa keskosten ravinnoksi. Lähivuosien kliiniset tutkimukset osoittavat, löytyykö NAC:n käytölle tieteellisiä perusteita muulloinkin kuin parasetamolimyrkytyksessä. Kirjallisuutta Arstall M A, Yang J, Stafford I, Betts W H, Horowitz J D. N-acetylcysteine in combination with nitroglycerin and streptokinase for the treatment of evolving myocardial infarction. Safety and biochemical effects. Circulation 1995; 92: Aruoma O I, Halliwell B, Hoey B M, Butler J. The antioxidant action of N-acetylcysteine: its reaction with hydrogen peroxide, hydroxyl radical, superoxide, and hypochlorous acid. Free Radic Biol Med 1989; 6: Behr J, Maier K, Degenkolb B, Krombach F,Vogelmeier C. Antioxidative and clinical effects of high-dose N-acetylcysteine in fibrosing alveolitis. Adjunctive therapy to maintenance immunosuppression. Am J Respir Crit Care Med 1997; 156: Bernard G R, Wheeler A P, Arons M M, ym. A trial of antioxidants N-acetylcysteine and procysteine in ARDS. CHEST 1997; 112: Boesgaard S, Aldershvile J, Poulsen H E. Preventive administration of intravenous N-acetylcysteine and development of tolerance to isosorbide dinitrate in patients with angina pectoris. Circulation 1992; 85: Cotgreave I A. N-acetylcysteine: pharmacological considerations and experimental and clinical applications. Adv Pharmacol 1997; 38: De Flora S, D Agostini F, Masiello L, Giunciuglio D, Albini A. Synergism between N-acetylcysteine and doxorubicin in the prevention of tumorigenicity and metastasis in murine models. Int J Cancer 1996; 67: De Flora S, Grassi C, Carati L. Attenuation of influenza-like symptomalogy and improvement of cell-mediated immunity with long-term N-acetylcysteine treatment. Eur Respir J 1997; 10: De Flora S, Izzotti A, D Agostini F, Cesarone C F. Antioxidant activity and other mechanisms of thiols involved in chemoprevention of mutation and cancer. Am J Med 1991; 91: 122S 30S. Dröge W, Kinscherf R, Mihm S, ym. Thiols and the immune system: effect of N-acetylcysteine on T cell system in human subjects. Methods Enzymol 1995; 251: Galley H F, Howdle P D, Walker B E, Webster N R. The effects of intravenous antioxidants in patients with septic shock. Free Radic Biol Med 1997; 23: Harrison P M, Keays R, Bray G P, Alexander G J, Williams R. Improved outcome of paracetamol-induced fulminant hepatic failure by late administration of acetylcysteine [see comments]. Lancet 1990; 335: Harrison P M, Wendon J A, Gimson A E S, Alexander G J M, Williams R. Improvement by acetylcysteine of hemodynamics and oxygen transport in fulminant hepatic failure. N Engl J Med 1991; 324: Herzenberg L A, De Rosa S C, Dubs J G, ym. Glutathione deficiency is associated with impaired survival in HIV disease. Proc Natl Acad Sci U S A. 1997; 94: Heubi J E, Barbacci M B, Zimmerman H J. Therapeutic misadventures with acetaminophen: hepatoxicity after multiple doses in children [see comments]. J Pediatr 1998; 132: TERHI AHOLA, LL, tutkija terhi.ahola@helsinki.fi HYKS Lasten ja nuorten sairaala PL 281, HYKS Hurd R W, Wilder B J, Helveston W R, Uthman B M. Treatment of four siblings with progressive myoclonus epilepsy of the Unverricht- Lundborg type with N-acetylcysteine. Neurology 1996; 47: Jepsen S, Herlevsen P, Knudsen P, Bud M I, Klausen N-O. Antioxidant treatment with N-acetylcysteine during adult respiratory distress syndrome: a prospective, randomized, placebo-controlled study. Crit Care Med 1992; 20: Keays R, Harrison P M, Wendon J A, ym. Intravenous acetylcysteine in paracetamol induced fulminant hepatic failure: a prospective controlled trial. BMJ 1991; 303: Kivistö K T, Kinos M, Neuvonen P J. Antidootit myrkytysten hoidossa. Suom Lääkäril 1997; 52: Kretzschmar M, Klein U, Palutke M, Schirrmeister W. Reduction of ischemia-reperfusion syndrome after abdominal aortic aneurysmectomy by N-acetylcysteine but not mannitol. Acta Anaesthesiol Scand 1996; 40: Mant T G, Tempowski J H, Volans G N, Talbot J C. Adverse reactions to acetylcysteine and effects of overdose. BMJ (Clin Res Ed) 1984; 289: Oddera S, Silvestri M, Sacco O, Eftimiadi C, Rossi G A. N-acetylcysteine enhances in vitro the intracellular killing of Staphylococcus aureus by human alveolar macrophages and blood polymorphonuclear leukocytes and partially protects phagocytes from self-killing. J Lab Clin Med 1994; 124: Olsson B, Johansson M, Gabrielsson J, Bolme P. Pharmacokinetics and bioavailability of reduced and oxidized N-acetylcysteine. Eur J Clin Pharmacol 1988; 34: Peake S L, Moran J L, Leppard P I. N-acetyl-L-cysteine depresses cardiac performance in patients with septic shock. Crit Care Med 1996; 24: Rumack B H, Matthew H. Acetaminophen poisoning and toxicity. Pediatrics 1975; 55: Smilkstein M J, Bronstein A C, Linden C, ym. Acetaminophen overdose: a 48-hour intravenous N-acetylcysteine treatment protocol. Ann Emerg Med 1991; 20: Spies C D, Reinhart K, Witt I, ym. Influence of N-acetylcysteine on indirect indicators of tissue oxygenation in septic shock patients: results from a prospective, randomized, double-blind study. Crit Care Med. 1994; 22: Sturman J A, Gaull G, Raiha N C. Absence of cystathionase in human fetal liver: is cystine essential? Science 1970; 169: Suter P M, Domenighetti G, Schaller M-D, ym. N-acetylcysteine enhances recovery from acute lung injury in man. A randomized, doubleblind, placebo-controlled clinical study. CHEST 1994; 105: Vale J A, Proudfoot A T. Paracetamol (acetaminophen) poisoning. Lancet 1995; 346: Van Zandwijk N. N-acetylcysteine (NAC) and glutathione (GSH): antioxidant and chemopreventive properties, with special reference to lung cancer. J Cell Biochem 1995; 22 Suppl: RISTO LAPATTO, dosentti, tutkija HYKS Lasten ja nuorten sairaala ja Biolääketieteen laitos PL 8, Helsingin yliopisto Aikakauskirjan pyytämä artikkeli Jätetty toimitukselle N-asetyylikysteiini: uusia käyttömahdollisuuksia vanhalle aineelle 379
Parasetamolimyrkytyksen hoito. Oikein annettu antidoottihoito pelastaa maksavauriolta. Kalle Hoppu
 Näin hoidan Parasetamolimyrkytyksen hoito Oikein annettu antidoottihoito pelastaa maksavauriolta Kalle Hoppu Parasetamoli on vanha mutta edelleen usein käytetty kipulääke. Ehkä suurin sen käyttöön liittyvä
Näin hoidan Parasetamolimyrkytyksen hoito Oikein annettu antidoottihoito pelastaa maksavauriolta Kalle Hoppu Parasetamoli on vanha mutta edelleen usein käytetty kipulääke. Ehkä suurin sen käyttöön liittyvä
Parasetamolin aiheuttamat myrkytykset Suomessa
 Page 1 of 6 JULKAISTU NUMEROSSA 4/2015 LÄÄKKEIDEN HAITTAVAIKUTUKSET Parasetamolin aiheuttamat myrkytykset Suomessa Mikko Parry, Kalle Hoppu / Kirjoitettu 16.10.2015 / Julkaistu 4.12.2015. istock/dolgachov
Page 1 of 6 JULKAISTU NUMEROSSA 4/2015 LÄÄKKEIDEN HAITTAVAIKUTUKSET Parasetamolin aiheuttamat myrkytykset Suomessa Mikko Parry, Kalle Hoppu / Kirjoitettu 16.10.2015 / Julkaistu 4.12.2015. istock/dolgachov
VALMISTEYHTEENVETO. Yli 33 kg painavat lapset (noin 11-vuotiaat), alle 50 kg painavat nuoret ja aikuiset:
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml, infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia 1 infuusiopullo sisältää 50 ml vastaten 500
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml, infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia 1 infuusiopullo sisältää 50 ml vastaten 500
Läpimurto ms-taudin hoidossa?
 Läpimurto ms-taudin hoidossa? Läpimurto ms-taudin hoidossa? Kansainvälisen tutkijaryhmän kliiniset kokeet uudella lääkkeellä antoivat lupaavia tuloksia sekä aaltoilevan- että ensisijaisesti etenevän ms-taudin
Läpimurto ms-taudin hoidossa? Läpimurto ms-taudin hoidossa? Kansainvälisen tutkijaryhmän kliiniset kokeet uudella lääkkeellä antoivat lupaavia tuloksia sekä aaltoilevan- että ensisijaisesti etenevän ms-taudin
Toksikologian perusteita ja toksisuuden arviointi
 Toksikologia Toksikologian perusteita ja toksisuuden arviointi Pekka Rauhala 2012 Oppi vieraiden aineiden haitallisista vaikutuksista eläviin organismeihin Paracelsus (1493-1541): Ei ole myrkytöntä ainetta,
Toksikologia Toksikologian perusteita ja toksisuuden arviointi Pekka Rauhala 2012 Oppi vieraiden aineiden haitallisista vaikutuksista eläviin organismeihin Paracelsus (1493-1541): Ei ole myrkytöntä ainetta,
Vammapotilaan kivunhoito, Jouni Kurola erikoislääkäri, KYS
 1 Vammapotilaan kivunhoito Jouni Kurola KYS Vammautuneen erityispiirteet Tajunnan muutokset Hengitystie-ongelmat Hengitysongelmat Verenkierron epävakaus Erilaiset vammat Yksittäiset raajavammat kivunhoito
1 Vammapotilaan kivunhoito Jouni Kurola KYS Vammautuneen erityispiirteet Tajunnan muutokset Hengitystie-ongelmat Hengitysongelmat Verenkierron epävakaus Erilaiset vammat Yksittäiset raajavammat kivunhoito
Sekundaaripreventio aivohalvauksen jälkeen
 Sekundaaripreventio aivohalvauksen jälkeen Juhani Sivenius Kuopion yliopisto, neurologian klinikka, KYS, Suomen aivotutkimus- ja kuntoutuskeskus Neuron Aivoinfarktipotilaan seuraava päätetapahtuma on todennäköisesti
Sekundaaripreventio aivohalvauksen jälkeen Juhani Sivenius Kuopion yliopisto, neurologian klinikka, KYS, Suomen aivotutkimus- ja kuntoutuskeskus Neuron Aivoinfarktipotilaan seuraava päätetapahtuma on todennäköisesti
Hyötyosuus. ANNOS ja sen merkitys lääkehoidossa? Farmakokinetiikan perusteita. Solukalvon läpäisy. Alkureitin metabolia
 Neurofarmakologia Farmakologian perusteiden kertausta Pekka Rauhala Syksy 2012 Koulu, Mervaala & Tuomisto, 8. painos, 2012 Kappaleet 11-30 (pois kappale 18) tai vastaavat asiat muista oppikirjoista n.
Neurofarmakologia Farmakologian perusteiden kertausta Pekka Rauhala Syksy 2012 Koulu, Mervaala & Tuomisto, 8. painos, 2012 Kappaleet 11-30 (pois kappale 18) tai vastaavat asiat muista oppikirjoista n.
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Kissa: Leikkauksen jälkeisen kivun lievitys kohdun ja munasarjojen poistoleikkauksen sekä pienten pehmytkudoskirurgisten toimenpiteiden jälkeen.
 1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa. Tietoa terveydenhuollon ammattilaisille
 Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa Tietoa terveydenhuollon ammattilaisille Suositukset seuraavissa tilanteissa: - maksan toiminnan seuraaminen - yhteisvaikutukset
Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa Tietoa terveydenhuollon ammattilaisille Suositukset seuraavissa tilanteissa: - maksan toiminnan seuraaminen - yhteisvaikutukset
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos. 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
VALMISTEYHTEENVETO. Valkoinen, pyöreä, kaksoiskupera tabletti, jossa jakoura yhdellä puolella, halkaisija 12 mm.
 1. LÄÄKEVALMISTEEN NIMI Paracetamol-ratiopharm 500 mg tabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 500 mg parasetamolia Täydellinen apuaineluettelo, kohta.
1. LÄÄKEVALMISTEEN NIMI Paracetamol-ratiopharm 500 mg tabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 500 mg parasetamolia Täydellinen apuaineluettelo, kohta.
VALMISTEYHTEENVETO. Valkoinen, pyöreä, kummaltakin puolelta litteä viistoreunainen tabletti, jossa jakouurre toisella puolella.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
LIITE VALMISTEYHTEENVETO
 LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. PERFALGAN 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia. Yksi 50 ml:n infuusiopullo sisältää 500 mg parasetamolia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia. Yksi 50 ml:n infuusiopullo sisältää 500 mg parasetamolia.
Olavi Airaksinen Dosentti, ylilääkäri kivunhoidon ja kuntoutuksen erityispätevyys Fysiatrian klinikka, KYS, Kuopio
 Parasetamolin asema hoitosuosituksissa Olavi Airaksinen Dosentti, ylilääkäri kivunhoidon ja kuntoutuksen erityispätevyys Fysiatrian klinikka, KYS, Kuopio Parasetamoli (BMJ 2015) Clinical practice guidelines
Parasetamolin asema hoitosuosituksissa Olavi Airaksinen Dosentti, ylilääkäri kivunhoidon ja kuntoutuksen erityispätevyys Fysiatrian klinikka, KYS, Kuopio Parasetamoli (BMJ 2015) Clinical practice guidelines
bukkaalinen fentanyylitabletti Effentora_ohjeet annostitrausta varten opas 6.indd :04:58
 10 10 9 8 7 6 5 4 3 2 1 0 Yksilöllisesti sopiva annos jokaiselle syövän läpilyöntikivuista kärsivälle potilaalle: Viisi Effentora - vahvuutta mahdollistavat yksilöllisen läpilyöntikipujen hoidon Ohjeet
10 10 9 8 7 6 5 4 3 2 1 0 Yksilöllisesti sopiva annos jokaiselle syövän läpilyöntikivuista kärsivälle potilaalle: Viisi Effentora - vahvuutta mahdollistavat yksilöllisen läpilyöntikipujen hoidon Ohjeet
Valmistetta ei tule käyttää tiineillä ja imettävillä nartuilla eikä koirilla, joilla on maksan vajaatoiminta.
 1. ELÄINLÄÄKKEEN NIMI Barbivet vet. 30 mg tabletti Barbivet vet. 60 mg tabletti 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine Yksi 30 mg tabletti sisältää fenobarbitaalia 30 mg. Yksi 60 mg tabletti
1. ELÄINLÄÄKKEEN NIMI Barbivet vet. 30 mg tabletti Barbivet vet. 60 mg tabletti 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine Yksi 30 mg tabletti sisältää fenobarbitaalia 30 mg. Yksi 60 mg tabletti
4.1 Käyttöaihe Akuutteihin tai kroonisiin keuhko- ja keuhkoputkisairauksiin liittyvän limaa erittävän yskän limaa irrottava hoito.
 V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
METELI-projekti lopetuskokous 12.4.2005
 METELI-projekti lopetuskokous 12.4.2005 -hankkeen tavoite -keskeiset tulokset, kliininen ja kineettiset kokeet -johtopäätökset Hankkeen tavoite Tuottaa tietoa antioksidatiivisesti vaikuttavien, terveysvaikutteisten
METELI-projekti lopetuskokous 12.4.2005 -hankkeen tavoite -keskeiset tulokset, kliininen ja kineettiset kokeet -johtopäätökset Hankkeen tavoite Tuottaa tietoa antioksidatiivisesti vaikuttavien, terveysvaikutteisten
Eläimiä koskevat erityiset varotoimet Jos haittavaikutuksia ilmenee, tulee hoito keskeyttää ja ottaa yhteys eläinlääkäriin.
 1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
VALMISTEYHTEENVETO. Aikuiset ja yli 12-vuotiaat (>40 kg) lapset ja nuoret: 500 mg 1000 mg suun kautta 4-6 tunnin välein 1-3 kertaa vuorokaudessa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PARAMAX Junior 250 mg tabletit PARAMAX Rap 500 mg tabletit PARAMAX Forte 1000 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 PARAMAX Junior 250 mg tabletti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PARAMAX Junior 250 mg tabletit PARAMAX Rap 500 mg tabletit PARAMAX Forte 1000 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 PARAMAX Junior 250 mg tabletti
VALMISTEYHTEENVETO. Tämä lääkevalmiste on tarkoitettu vain IgE-välitteisen allergian spesifiseen diagnostiseen käyttöön.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SOLUPRICK SQ hyönteismyrkyt, liuos ihopistotestiin - 801 Mehiläisen myrkky (Apis mellifera) - 802 Ampiaisen myrkky (Vespula spp.) 2. VAIKUTTAVAT AINEET JA NIIDEN
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SOLUPRICK SQ hyönteismyrkyt, liuos ihopistotestiin - 801 Mehiläisen myrkky (Apis mellifera) - 802 Ampiaisen myrkky (Vespula spp.) 2. VAIKUTTAVAT AINEET JA NIIDEN
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI. Norocarp vet 50 mg/ml injektioneste, liuos koiralle ja kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Norocarp vet 50 mg/ml injektioneste, liuos koiralle ja kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra sisältää: Vaikuttava aine: Karprofeeni 50
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Norocarp vet 50 mg/ml injektioneste, liuos koiralle ja kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra sisältää: Vaikuttava aine: Karprofeeni 50
Farmakologian tenttitärpit Toinen välitentti Lyhyet kysymykset. Sisällys
 Farmakologian tenttitärpit Toinen välitentti Lyhyet kysymykset Sisällys Sivu 2 Bentsomyrkytys Beetasalpaajamyrkytys Parasetamolimyrkytys Partiaalinen agonisti Asetyylikoliiniesteraasi Sivu 3 Lääkehiili
Farmakologian tenttitärpit Toinen välitentti Lyhyet kysymykset Sisällys Sivu 2 Bentsomyrkytys Beetasalpaajamyrkytys Parasetamolimyrkytys Partiaalinen agonisti Asetyylikoliiniesteraasi Sivu 3 Lääkehiili
VALMISTEYHTEENVETO. Tabletti, kalvopäällysteinen Valkea, kalvopäällysteinen kapselin muotoinen tabletti, jakouurre, koko 19,0x9,7 mm, merkintä PAN 1G.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol Forte 1g tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää parasetamolia 1g. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol Forte 1g tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää parasetamolia 1g. Täydellinen apuaineluettelo, ks. kohta
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana
 Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Yli kuusivuotiaat lapset voivat imeskellä tabletit ne hajoavat hyvin nopeasti suussa joutuessaan kosketuksiin syljen kanssa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL F 250 mg, dispergoituva tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi dispergoituva tabletti sisältää 250 mg parasetamolia (päällystettyinä parasetamolikiteinä).
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL F 250 mg, dispergoituva tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi dispergoituva tabletti sisältää 250 mg parasetamolia (päällystettyinä parasetamolikiteinä).
Neuroendokriinisten syöpien lääkehoito
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2015 TEEMAT Neuroendokriinisten syöpien lääkehoito Maija Tarkkanen / Kirjoitettu 16.6.2015 / Julkaistu 13.11.2015 Neuroendokriinisten (NE) syöpien ilmaantuvuus lisääntyy,
Page 1 of 5 JULKAISTU NUMEROSSA 3/2015 TEEMAT Neuroendokriinisten syöpien lääkehoito Maija Tarkkanen / Kirjoitettu 16.6.2015 / Julkaistu 13.11.2015 Neuroendokriinisten (NE) syöpien ilmaantuvuus lisääntyy,
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
Lapsuusiän astman ennuste aikuisiällä Anna Pelkonen, LT, Dos Lastentautien ja lasten allergologian el HYKS, Iho-ja allergiasairaala
 Lapsuusiän astman ennuste aikuisiällä Anna Pelkonen, LT, Dos Lastentautien ja lasten allergologian el HYKS, Iho-ja allergiasairaala 22.1.2015 Mikä on lapseni astman ennuste? Mikä on lapsen astman ennuste
Lapsuusiän astman ennuste aikuisiällä Anna Pelkonen, LT, Dos Lastentautien ja lasten allergologian el HYKS, Iho-ja allergiasairaala 22.1.2015 Mikä on lapseni astman ennuste? Mikä on lapsen astman ennuste
Myyntiluvan haltija Valmisteen nimi Vaikuttava aine + vahvuus Lääkemuoto
 ETA:n jäsenvaltio Myyntiluvan haltija Valmisteen nimi Vaikuttava aine + vahvuus Lääkemuoto Chiesi Limited Formodual beklometasonidipropionaatti 100 µg/annos, formoterolifumaraattidihydraatti 6 µg/annos
ETA:n jäsenvaltio Myyntiluvan haltija Valmisteen nimi Vaikuttava aine + vahvuus Lääkemuoto Chiesi Limited Formodual beklometasonidipropionaatti 100 µg/annos, formoterolifumaraattidihydraatti 6 µg/annos
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
VALMISTEYHTEENVETO. Tilavuus / antokerta
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia. Yksi 50 ml:n infuusiopullo sisältää 500 mg parasetamolia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia. Yksi 50 ml:n infuusiopullo sisältää 500 mg parasetamolia.
VALMISTEYHTEENVETO. Suussa hajoava tabletti. Valkoinen, pyöreä, kaksoiskupera, mustaherukantuoksuinen tabletti, jossa on kovera uurre keskellä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL F 500 mg, suussa hajoava tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi suussa hajoava tabletti sisältää 500 mg parasetamolia (päällystettyinä parasetamolikiteinä).
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL F 500 mg, suussa hajoava tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi suussa hajoava tabletti sisältää 500 mg parasetamolia (päällystettyinä parasetamolikiteinä).
1. ELÄINLÄÄKKEEN NIMI. Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Panadol 60 mg peräpuikko Panadol 125 mg peräpuikko Panadol 250 mg peräpuikko
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol 60 mg peräpuikko Panadol 125 mg peräpuikko Panadol 250 mg peräpuikko 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 60 mg peräpuikko sisältää parasetamolia
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol 60 mg peräpuikko Panadol 125 mg peräpuikko Panadol 250 mg peräpuikko 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 60 mg peräpuikko sisältää parasetamolia
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Työn muutokset kuormittavat
 Työn muutokset kuormittavat Kirsi Ahola, tiimipäällikkö, työterveyspsykologian dosentti Sisältö Mikä muutoksessa kuormittaa? Keitä muutokset erityisesti kuormittavat? Miten muutosten vaikutuksia voi hallita?
Työn muutokset kuormittavat Kirsi Ahola, tiimipäällikkö, työterveyspsykologian dosentti Sisältö Mikä muutoksessa kuormittaa? Keitä muutokset erityisesti kuormittavat? Miten muutosten vaikutuksia voi hallita?
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Mannitol Braun 150 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Mannitol Braun 150 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1000 ml infuusionestettä sisältää 150 g mannitolia. Ominaisuudet: Teoreettinen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Mannitol Braun 150 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1000 ml infuusionestettä sisältää 150 g mannitolia. Ominaisuudet: Teoreettinen
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
Erityisturvallisuustiedote
 Erityisturvallisuustiedote Arava (leflunomidi) on tautiprosessia hidastava antireumaattinen lääke (DMARD), joka on tarkoitettu aikuisten aktiivista nivelreumaa tai aktiivista nivelpsoriaasia sairastavien
Erityisturvallisuustiedote Arava (leflunomidi) on tautiprosessia hidastava antireumaattinen lääke (DMARD), joka on tarkoitettu aikuisten aktiivista nivelreumaa tai aktiivista nivelpsoriaasia sairastavien
NOBIVAC RABIES VET. Adjuvantti: Alumiinifosfaatti (2 %) 0,15 ml (vastaten alumiinifosfaattia 3 mg)
 VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
Somaattinen sairaus nuoruudessa ja mielenterveyden häiriön puhkeamisen riski
 + Somaattinen sairaus nuoruudessa ja mielenterveyden häiriön puhkeamisen riski LINNEA KARLSSON + Riskitekijöitä n Ulkonäköön liittyvät muutokset n Toimintakyvyn menetykset n Ikätovereista eroon joutuminen
+ Somaattinen sairaus nuoruudessa ja mielenterveyden häiriön puhkeamisen riski LINNEA KARLSSON + Riskitekijöitä n Ulkonäköön liittyvät muutokset n Toimintakyvyn menetykset n Ikätovereista eroon joutuminen
Kenelle täsmähoitoja ja millä hinnalla?
 Kenelle täsmähoitoja ja millä hinnalla? Heikki Joensuu ylilääkäri, Syöpätautien klinikka, HYKS, ja professori, Lääketieteellinen tiedekunta, Helsingin yliopisto EUROCARE-4 tutkimus Syöpäpotilaiden eloonjääminen
Kenelle täsmähoitoja ja millä hinnalla? Heikki Joensuu ylilääkäri, Syöpätautien klinikka, HYKS, ja professori, Lääketieteellinen tiedekunta, Helsingin yliopisto EUROCARE-4 tutkimus Syöpäpotilaiden eloonjääminen
VALMISTEYHTEENVETO. Täydellisen parenteraalisen ravitsemuksen täydennyksenä vesiliukoisten vitamiinien päivittäisen tarpeen tyydyttämiseksi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO. Addex-Magnesiumsulfaatti 246 mg/ml infuusiokonsentraatti, liuosta varten
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Magnesiumsulfaatti 246 mg/ml infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Magnesiumsulfaatti infuusiokonsentraattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Magnesiumsulfaatti 246 mg/ml infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Magnesiumsulfaatti infuusiokonsentraattia
VALMISTEYHTEENVETO. Antotiheys Kahden annoksen välisen ajan tulisi olla aikuisilla vähintään neljä tuntia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL F 500 mg, suussa hajoava tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi suussa hajoava tabletti sisältää 500 mg parasetamolia (päällystettyinä parasetamolikiteinä).
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL F 500 mg, suussa hajoava tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi suussa hajoava tabletti sisältää 500 mg parasetamolia (päällystettyinä parasetamolikiteinä).
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
VALMISTEYHTEENVETO. Pediatriset potilaat Parasetamolin annos lapsille (yli 3 kk) on 15 mg/painokilo korkeintaan 3 kertaa vuorokaudessa.
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol 60 mg peräpuikko Panadol 125 mg peräpuikko Panadol 250 mg peräpuikko 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 60 mg peräpuikko sisältää parasetamolia
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol 60 mg peräpuikko Panadol 125 mg peräpuikko Panadol 250 mg peräpuikko 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 60 mg peräpuikko sisältää parasetamolia
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PULLO PÄIVÄSSÄ RIITTÄÄ. Tee tilaa. kolesterolia alentavalle täydennykselle potilaittesi ruokavalioon
 PULLO PÄIVÄSSÄ RIITTÄÄ Tee tilaa kolesterolia alentavalle täydennykselle potilaittesi ruokavalioon Lähteet 1. Catapano et al. ESC/EAS Guidelines for the management of dyslipidaemias. Atherosclerosis 2016;
PULLO PÄIVÄSSÄ RIITTÄÄ Tee tilaa kolesterolia alentavalle täydennykselle potilaittesi ruokavalioon Lähteet 1. Catapano et al. ESC/EAS Guidelines for the management of dyslipidaemias. Atherosclerosis 2016;
Mikä puuttuu. potilaasi kolesterolia alentavasta ruokavaliosta?
 Mikä puuttuu potilaasi kolesterolia alentavasta ruokavaliosta? Alentaa 1-4 kolesterolia todistetun tehokkaasti Terveysvaikutteiset elintarvikkeet, joihin on lisätty kasvistanolia*, tarjoavat tehokkaan
Mikä puuttuu potilaasi kolesterolia alentavasta ruokavaliosta? Alentaa 1-4 kolesterolia todistetun tehokkaasti Terveysvaikutteiset elintarvikkeet, joihin on lisätty kasvistanolia*, tarjoavat tehokkaan
B12-vitamiini eli kobalamiini on ihmiselle välttämätön vitamiini. Sitä tarvitaan elintoimintojen entsyymijärjestelmien toiminnallisina osina:
 B12-vitamiini B12-vitamiini eli kobalamiini on ihmiselle välttämätön vitamiini. Sitä tarvitaan elintoimintojen entsyymijärjestelmien toiminnallisina osina: solujen jakautumiseen kudosten muodostumiseen
B12-vitamiini B12-vitamiini eli kobalamiini on ihmiselle välttämätön vitamiini. Sitä tarvitaan elintoimintojen entsyymijärjestelmien toiminnallisina osina: solujen jakautumiseen kudosten muodostumiseen
Hoidon hyötyihin liittyvät asiat, joita ei tunneta (yksi lyhyt kappale kustakin käyttöaiheesta, enintään 50 sanaa)
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
Firmagon eturauhassyövän hoidossa
 Firmagon eturauhassyövän hoidossa Käytännön tietoa ja ohjeita potilaalle Eturauhassyöpään sairastuminen ja sen hoito aiheuttavat uuden elämäntilanteen. Mielessä voi pyöriä monia kysymyksiä. Ajatusten kanssa
Firmagon eturauhassyövän hoidossa Käytännön tietoa ja ohjeita potilaalle Eturauhassyöpään sairastuminen ja sen hoito aiheuttavat uuden elämäntilanteen. Mielessä voi pyöriä monia kysymyksiä. Ajatusten kanssa
Diabetes ja verenpaine - uudet suositukset
 Diabetes ja verenpaine - uudet suositukset Ilkka Tikkanen Professori, osastonylilääkäri Sisätautien ja nefrologian erikoislääkäri HYKS, Vatsakeskus, nefrologia, ja Lääketieteellinen tutkimuslaitos Minerva
Diabetes ja verenpaine - uudet suositukset Ilkka Tikkanen Professori, osastonylilääkäri Sisätautien ja nefrologian erikoislääkäri HYKS, Vatsakeskus, nefrologia, ja Lääketieteellinen tutkimuslaitos Minerva
Appendisiitin diagnostiikka
 Appendisiitti score Panu Mentula LT, gastrokirurgi HYKS Appendisiitin diagnostiikka Anamneesi Kliiniset löydökset Laboratoriokokeet Ł Epätarkka diagnoosi, paljon turhia leikkauksia 1 Insidenssi ja diagnostinen
Appendisiitti score Panu Mentula LT, gastrokirurgi HYKS Appendisiitin diagnostiikka Anamneesi Kliiniset löydökset Laboratoriokokeet Ł Epätarkka diagnoosi, paljon turhia leikkauksia 1 Insidenssi ja diagnostinen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Lonkan ja polvien nivelrikkoon liittyvä lievä ja keskivaikea kipu
 1. LÄÄKEVALMISTEEN NIMI Rolod 500 mg tabletti Rolod 1000 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Rolod 500 mg: Yksi tabletti sisältää 500 mg parasetamolia. Rolod 1000 mg: Yksi tabletti sisältää
1. LÄÄKEVALMISTEEN NIMI Rolod 500 mg tabletti Rolod 1000 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Rolod 500 mg: Yksi tabletti sisältää 500 mg parasetamolia. Rolod 1000 mg: Yksi tabletti sisältää
VALMISTEYHTEENVETO. Valkoinen tai melkein valkoinen, kaksoiskupera, soikea, päällystämätön tabletti, jossa on jakouurre kummallakin puolella.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Pamol 1000 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1000 mg parasetamolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Pamol 1000 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1000 mg parasetamolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: Yksi poretabletti sisältää 75 mg laktoosia, 74 mg natriumia ja 25 mg sorbitolia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Meditus 200 mg poretabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 200 mg asetyylikysteiiniä. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Meditus 200 mg poretabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 200 mg asetyylikysteiiniä. Apuaineet, joiden vaikutus tunnetaan:
TYÖTURVALLISUUSSÄÄNNÖKSIÄ VALMISTELEVA NEUVOTTELUKUNTA Luonnos 2/HTP2012
 TYÖTURVALLISUUSSÄÄNNÖKSIÄ VALMISTELEVA NEUVOTTELUKUNTA Luonnos 2/HTP2012 5.5.2011 1 (6) Propyleeni HTP-ARVON PERUSTELUMUISTIO Yksilöinti ja ominaisuudet CAS No: 115-07-1 EINECS No: 204-062-1 EEC No: 601-011-00-9
TYÖTURVALLISUUSSÄÄNNÖKSIÄ VALMISTELEVA NEUVOTTELUKUNTA Luonnos 2/HTP2012 5.5.2011 1 (6) Propyleeni HTP-ARVON PERUSTELUMUISTIO Yksilöinti ja ominaisuudet CAS No: 115-07-1 EINECS No: 204-062-1 EEC No: 601-011-00-9
Uutta lääkkeistä: Deksmedetomidiini
 Page 1 of 5 JULKAISTU NUMEROSSA 2/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Deksmedetomidiini Annikka Kalliokoski / Kirjoitettu 10.8.2012 Dexdor 100 mikrog/ml infuusiokonsentraatti, liuosta varten, Orion
Page 1 of 5 JULKAISTU NUMEROSSA 2/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Deksmedetomidiini Annikka Kalliokoski / Kirjoitettu 10.8.2012 Dexdor 100 mikrog/ml infuusiokonsentraatti, liuosta varten, Orion
VALMISTEYHTEENVETO. 100 ml:pullo on tarkoitettu aikuisille ja yli 33 kg painaville nuorille ja lapsille.
 1. LÄÄKEVALMISTEEN NIMI Paracetamol Sandoz 10 mg/ml infuusioneste, liuos VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia. Yksi 100 ml pullo sisältää 1000 mg
1. LÄÄKEVALMISTEEN NIMI Paracetamol Sandoz 10 mg/ml infuusioneste, liuos VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia. Yksi 100 ml pullo sisältää 1000 mg
Tässä osassa on tietoa kivunlievityksestä lääkkein nielurisaleikkauksen jälkeen. Voit laskea oikean kipulääkeannoksen lapsellesi.
 Kivunlievitys Tässä osassa on tietoa kivunlievityksestä lääkkein nielurisaleikkauksen jälkeen. Voit laskea oikean kipulääkeannoksen lapsellesi. Huomaa, että tämä kivunlievitysohje pätee vain, jos lapsella
Kivunlievitys Tässä osassa on tietoa kivunlievityksestä lääkkein nielurisaleikkauksen jälkeen. Voit laskea oikean kipulääkeannoksen lapsellesi. Huomaa, että tämä kivunlievitysohje pätee vain, jos lapsella
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
Potilaan päiväkirja. Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi
 Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Numeta G16E, Numeta G19E 2332015, Versio 30 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2 Julkisen yhteenvedon osiot VI21 Tietoa sairauden esiintyvyydestä Joillakin sairaalapotilailla ei välttämättä
Numeta G16E, Numeta G19E 2332015, Versio 30 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2 Julkisen yhteenvedon osiot VI21 Tietoa sairauden esiintyvyydestä Joillakin sairaalapotilailla ei välttämättä
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI. GastroGard 370 mg/g oraalipasta hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. 1 gramma sisältää:
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI GastroGard 370 mg/g oraalipasta hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 gramma sisältää: Vaikuttava aine Omepratsoli 370 mg Apuaineet Keltainen rautaoksidi
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI GastroGard 370 mg/g oraalipasta hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 gramma sisältää: Vaikuttava aine Omepratsoli 370 mg Apuaineet Keltainen rautaoksidi
VALMISTEYHTEENVETO. Jos ihoärsytystä, kosketusihottumaa tai yliherkkyyttä esiintyy, lopeta valmisteen käyttö.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BETADINE 75 mg/ml -ihonpuhdisteliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jodattu povidoni 75 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BETADINE 75 mg/ml -ihonpuhdisteliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jodattu povidoni 75 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO. Liuos on kirkas ja väritön tai hieman vaaleanpunaiseen/oranssiin vivahtava. Havainto väristä saattaa vaihdella.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi ml infuusionestettä sisältää 10 mg parasetamolia. Yksi 10 ml:n
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi ml infuusionestettä sisältää 10 mg parasetamolia. Yksi 10 ml:n
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI. Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
x _ Miksi elinikä ei ole rajaton? Mediterranean fruitfly (Ceratitis capitata) Eliniän jakautuma
 Vanhenemisen fysiologia 1 Elinikä ja vanheneminen Käsitteet Elinikä - yksilön elinikä Eliniän odotusarvo, aktuaarinen (kirjanpidollinen) elinikä - keskimääräinen odotettavissa oleva elinikä tietylle lajille,
Vanhenemisen fysiologia 1 Elinikä ja vanheneminen Käsitteet Elinikä - yksilön elinikä Eliniän odotusarvo, aktuaarinen (kirjanpidollinen) elinikä - keskimääräinen odotettavissa oleva elinikä tietylle lajille,
Oligonukleotidi-lääkevalmisteet ja niiden turvallisuuden tutkiminen - Sic!
 Page 1 of 5 JULKAISTU NUMEROSSA 3-4/2017 EX TEMPORE Oligonukleotidi-lääkevalmisteet ja niiden turvallisuuden tutkiminen Enni-Kaisa Mustonen / Kirjoitettu 18.12.2017 / Julkaistu Oligonukleotidit ovat nukleotideista
Page 1 of 5 JULKAISTU NUMEROSSA 3-4/2017 EX TEMPORE Oligonukleotidi-lääkevalmisteet ja niiden turvallisuuden tutkiminen Enni-Kaisa Mustonen / Kirjoitettu 18.12.2017 / Julkaistu Oligonukleotidit ovat nukleotideista
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
ESTO Eturauhassyövältä Suojaavien lääkkeellisten Tekijöiden Osoittaminen
 ESTO Eturauhassyövältä Suojaavien lääkkeellisten Tekijöiden Osoittaminen LT Teemu Murtola Tampereen yliopisto, lääketieteen yksikkö TAYS, urologian vastuualue Lääke-epidemiologia Suomessa-seminaari Huhtikuu
ESTO Eturauhassyövältä Suojaavien lääkkeellisten Tekijöiden Osoittaminen LT Teemu Murtola Tampereen yliopisto, lääketieteen yksikkö TAYS, urologian vastuualue Lääke-epidemiologia Suomessa-seminaari Huhtikuu
1. ELÄINLÄÄKKEEN NIMI. Loxicom 0,5 mg/ml oraalisuspensio kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. Yksi millilitra sisältää: Vaikuttava aine:
 1. ELÄINLÄÄKKEEN NIMI Loxicom 0,5 mg/ml oraalisuspensio kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra sisältää: Vaikuttava aine: Meloksikaami Apuaineet: Natriumbentsoaatti 0,5 mg 1,5
1. ELÄINLÄÄKKEEN NIMI Loxicom 0,5 mg/ml oraalisuspensio kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra sisältää: Vaikuttava aine: Meloksikaami Apuaineet: Natriumbentsoaatti 0,5 mg 1,5
Yleisimmät idiopaattiset interstitiaalipneumoniat ja tavalliset keuhkovauriot - avainasemassa moniammatillisuus
 Yleisimmät idiopaattiset interstitiaalipneumoniat ja tavalliset keuhkovauriot - avainasemassa moniammatillisuus 12.11.2015 IAP Tampere Airi Jartti Elisa Lappi-Blanco Sidonnaisuudet Luentopalkkioita Oy
Yleisimmät idiopaattiset interstitiaalipneumoniat ja tavalliset keuhkovauriot - avainasemassa moniammatillisuus 12.11.2015 IAP Tampere Airi Jartti Elisa Lappi-Blanco Sidonnaisuudet Luentopalkkioita Oy
Sietokyvyn lisääminen ruoka-allergiassa
 Sietokyvyn lisääminen ruoka-allergiassa Erkka Valovirta, Prof. Asiantuntijalääkäri, Filha ry Lastentautien ja lasten allergisten sairauksien erikoislääkäri Kliinisen allergologian dosentti Keuhkosairauksien
Sietokyvyn lisääminen ruoka-allergiassa Erkka Valovirta, Prof. Asiantuntijalääkäri, Filha ry Lastentautien ja lasten allergisten sairauksien erikoislääkäri Kliinisen allergologian dosentti Keuhkosairauksien
Keuhkoahtaumataudin monet kasvot
 Keuhkoahtaumataudin monet kasvot Alueellinen koulutus 21.4.2016 eval Henrik Söderström / TYKS Lähde: Google Lähde: Google Lähde: Google Lähde: Google Keuhkoahtaumatauti, mikä se on? Määritelmä (Käypä
Keuhkoahtaumataudin monet kasvot Alueellinen koulutus 21.4.2016 eval Henrik Söderström / TYKS Lähde: Google Lähde: Google Lähde: Google Lähde: Google Keuhkoahtaumatauti, mikä se on? Määritelmä (Käypä
Mirja Koivunen Yleislääketieteen erikoislääkäri Palliatiivisen lääketieteen erityispätevyys Länsi-Suomen Diakonialaitos
 Mirja Koivunen Yleislääketieteen erikoislääkäri Palliatiivisen lääketieteen erityispätevyys Länsi-Suomen Diakonialaitos Palliatiivisella sedaatiolla tarkoitetaan sitä, että kuolevaa potilasta rauhoitetaan
Mirja Koivunen Yleislääketieteen erikoislääkäri Palliatiivisen lääketieteen erityispätevyys Länsi-Suomen Diakonialaitos Palliatiivisella sedaatiolla tarkoitetaan sitä, että kuolevaa potilasta rauhoitetaan
PREDIALYYSI - kun munuaisesi eivät toimi normaalisti
 PREDIALYYSI - kun munuaisesi eivät toimi normaalisti Munuaiset ovat pavunmuotoiset elimet ja ne sijaitsevat selkärankasi kummallakin puolella keskimäärin puolessa välissä selkääsi. Munuaiset toimivat suodattimena.
PREDIALYYSI - kun munuaisesi eivät toimi normaalisti Munuaiset ovat pavunmuotoiset elimet ja ne sijaitsevat selkärankasi kummallakin puolella keskimäärin puolessa välissä selkääsi. Munuaiset toimivat suodattimena.
PREDIALYYSI - kun munuaisesi eivät toimi normaalisti
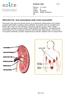 Sisäinen ohje 1 (5) PREDIALYYSI - kun munuaisesi eivät toimi normaalisti Munuaiset ovat pavunmuotoiset elimet ja ne sijaitsevat selkärankasi kummallakin puolella keskimäärin puolessa välissä selkääsi.
Sisäinen ohje 1 (5) PREDIALYYSI - kun munuaisesi eivät toimi normaalisti Munuaiset ovat pavunmuotoiset elimet ja ne sijaitsevat selkärankasi kummallakin puolella keskimäärin puolessa välissä selkääsi.
Liikunnan vaikuttavuus ja kuntoutus
 Liikunnan vaikuttavuus ja kuntoutus Urho Kujala Liikuntalääketieteen erikoislääkäri Liikuntalääketieteen professori Terveystieteiden yksikkö, Liikuntatieteellinen tiedekunta Jyväskylän yliopisto urho.m.kujala@jyu.fi
Liikunnan vaikuttavuus ja kuntoutus Urho Kujala Liikuntalääketieteen erikoislääkäri Liikuntalääketieteen professori Terveystieteiden yksikkö, Liikuntatieteellinen tiedekunta Jyväskylän yliopisto urho.m.kujala@jyu.fi
LAPSET JA BIOPANKIT. Valvira 25.11.2014. Jari Petäjä
 LAPSET JA BIOPANKIT Valvira 25.11.2014 Jari Petäjä 1 Lasten elämänkaari sairaanhoidon näkökulmasta Aikuisten hoito kasvu ja kehitys perhe ja vanhemmuus raha, taudit potilaan hoitomyöntyvyys 0 ikä 16 25
LAPSET JA BIOPANKIT Valvira 25.11.2014 Jari Petäjä 1 Lasten elämänkaari sairaanhoidon näkökulmasta Aikuisten hoito kasvu ja kehitys perhe ja vanhemmuus raha, taudit potilaan hoitomyöntyvyys 0 ikä 16 25
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Nuoren niska-hartiakipu
 Nuoren niska-hartiakipu Jari Arokoski, prof. fysiatrian erikoislääkäri HYKS fysiatrian klinikka / Helsingin yliopisto Esityksen sisältö Epidemiologiaa Niskahartiakäsite Etiologia Nuoren niska-hartiakipuun
Nuoren niska-hartiakipu Jari Arokoski, prof. fysiatrian erikoislääkäri HYKS fysiatrian klinikka / Helsingin yliopisto Esityksen sisältö Epidemiologiaa Niskahartiakäsite Etiologia Nuoren niska-hartiakipuun
VALMISTEYHTEENVETO. Valkoinen, pyöreä, kaksoiskupera tabletti, jossa jakoura yhdellä puolella, halkaisija 12 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Paracetamol-ratiopharm 500 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 500 mg parasetamolia Täydellinen apuaineluettelo, kohta.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Paracetamol-ratiopharm 500 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 500 mg parasetamolia Täydellinen apuaineluettelo, kohta.
VALMISTEYHTEENVETO. Lääkemääräyksellä aikuisille 1-2 tablettia 4 kertaa päivässä. Maksimiannos on 4 g vuorokaudessa.
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol 500 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää parasetamolia 500 mg. Täydellinen apuaineluettelo, ks.
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Panadol 500 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää parasetamolia 500 mg. Täydellinen apuaineluettelo, ks.
VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL 500 mg, kalvopäällysteinen tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 500 mg parasetamolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAMOL 500 mg, kalvopäällysteinen tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 500 mg parasetamolia. Täydellinen apuaineluettelo,
BI4 IHMISEN BIOLOGIA
 BI4 IHMISEN BIOLOGIA MITÄ ROKOTUKSIA? Muistatko mitä rokotuksia olet saanut ja minkä viimeiseksi? Miten huolehdit koulun jälkeen rokotuksistasi? Mikrobit uhkaavat elimistöä Mikrobit voivat olla bakteereita,
BI4 IHMISEN BIOLOGIA MITÄ ROKOTUKSIA? Muistatko mitä rokotuksia olet saanut ja minkä viimeiseksi? Miten huolehdit koulun jälkeen rokotuksistasi? Mikrobit uhkaavat elimistöä Mikrobit voivat olla bakteereita,
