LIITE I VALMISTEYHTEENVETO
|
|
|
- Maria Palo
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 LIITE I VALMISTEYHTEENVETO 1
2 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 3 ml:n esitäytetty kynä sisältää 750 mikrogrammaa teriparatidia (vastaten 250 mikrogrammaa millilitrassa). Yksi annos sisältää 20 mikrogrammaa teriparatidia. Esitäytetty kynä sisältää 28 päivän lääkityksen. Teriparatidi, rhpth(1-34), (FORSTEO), on identtinen ihmisen endogeenisen lisäkilpirauhashormonin 34 N -terminaalisen aminohappojärjestyksen kanssa, ja se tuotetaan yhdistelmä-dna-tekniikalla E. coli bakteerissa. Apuaineet, ks LÄÄKEMUOTO Injektioneste, esitäytetyssä kynässä. Väritön, kirkas liuos. 4. KLIINISET TIEDOT 4.1 Käyttöaiheet Todetun osteoporoosin hoito postmenopausaalisilla naisilla. Nikamamurtumien, mutta ei lonkkaluun murtumien, ilmaantuvuuden on osoitettu vähenevän merkitsevästi. 4.2 Annostus ja antotapa FORSTEOn suositusannos on 20 mikrogrammaa, joka pistetään kerran päivässä ihon alle reiteen tai vatsan alueelle. Potilaille on opetettava oikea pistämistekniikka. (Ks. kohta 6.6). Saatavilla on myös käyttäjän opas, jossa potilaalle esitetään yksityiskohtaisesti annostelukynän oikea käyttö. FORSTEO-hoidon kesto on korkeintaan 18 kuukautta (ks. kohta 4.4 Varoitukset ja käyttöön liittyvät varotoimet). FORSTEO-hoidon aikana tulee huolehtia potilaan kalsium- ja D-vitamiinilisästä, mikäli niitä on ruokavaliossa liian vähän. FORSTEO-hoidon lopettamisen jälkeen potilaille voidaan aloittaa muita osteoporoosihoitoja. Munuaisten vajaatoiminta: FORSTEOta ei tule käyttää potilailla, joilla on vaikea munuaisten vajaatoiminta (ks. 4.3 Vasta-aiheet). Varovaisuutta tulee noudattaa, kun FORSTEOta käytetään potilailla, joilla on keskivaikea munuaisten vajaatoiminta. Maksan vajaatoiminta: maksan vajaatoiminnasta kärsiviä potilaita koskevia tietoja ei ole saatavilla (ks. kohta 5.3 Prekliiniset tiedot turvallisuudesta). 2
3 Erityisryhmät: Lapset: FORSTEOta ei ole tutkittu lapsipotilailla. FORSTEOta ei pidä antaa lapsipotilaille eikä nuorille aikuisille, joiden epifyysit eivät ole sulkeutuneet. Vanhukset: Annoksen muuttaminen iän perusteella ei ole tarpeen (ks. 5.2 Farmakokinetiikka). 4.3 Vasta-aiheet Yliherkkyys teriparatidille tai FORSTEOn sisältämille apuaineille Hyperkalseeminen tila Vaikea munuaisten toimintahäiriö Luuston aineenvaihduntasairaus, joka ei ole primaari osteoporoosi (kuten hyperparatyreoosi ja Pagetin luutauti) Selittämätön seerumin alkalisen fosfataasin nousu Aiempi luuston sädehoito 4.4 Varoitukset ja käyttöön liittyvät varotoimet Potilailla, joiden veren kalsiumpitoisuus on normaali, on havaittu seerumin kalsiumpitoisuuden vähäistä ja ohimenevää nousua teriparatidi-injektion jälkeen. Kalsiumin huippupitoisuus seerumissa saavutetaan 4 6 tunnin kuluttua, ja pitoisuus palautuu lähtötasolle viimeistään tunnin kuluttua kunkin teriparatidi-injektion jälkeen. Kalsiumpitoisuuksien rutiiniseuranta ei ole tarpeellista hoidon aikana. Mikäli potilaalta halutaan tutkia seerumin kalsiumpitoisuus, verinäyte tulee ottaa aikaisintaan 16 tuntia viimeisimmän FORSTEO-injektion jälkeen. FORSTEO saattaa lisätä vähäisessä määrin kalsiumin erittymistä virtsaan, mutta kliinisissä lääkeainetutkimuksissa ei hyperkalsiurian esiintymisessä todettu merkittävää eroa lumehoitoa saaneiden potilaiden virtsan kalsiumin eritykseen. FORSTEOta ei ole tutkittu potilailla, joilla on aktiivinen virtsakivitauti. FORSTEOn käytössä tulee noudattaa varovaisuutta hoidettaessa potilaita, joilla on aktiivinen tai hiljattain sairastettu virtsakivitauti, koska tämä tila saattaa pahentua. FORSTEOta koskevissa lyhytkestoisissa kliinisissä tutkimuksissa havaittiin yksittäisiä ohimeneviä ortostaattisen hypotension jaksoja. Tapahtuma alkoi yleensä 4 tunnin kuluessa lääkkeen otosta ja hävisi itsestään muutaman minuutin - muutamaan tunnin aikana. Silloin kun ohimenevää ortostaattista hypotensiota esiintyi, se tapahtui ensimmäisten annosten yhteydessä. Se lievittyi, kun potilas asetettiin lepoasentoon, eikä estänyt hoidon jatkamista. Varovaisuutta tulee noudattaa, jos potilaalla on keskivaikea munuaisten vajaatoiminta. Rotilla tehdyt tutkimukset osoittavat, että teriparatidin pitkäaikaiskäyttö lisää osteosarkooman ilmaantuvuutta (ks. kohta 5.3). Ennen kuin tästä saadaan lisää kliinistä kokemusta, hoidon keston ei tule ylittää suositettua 18 kuukautta. 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset FORSTEOlla ei ole havaittu olevan kliinisesti merkittäviä interaktioita hydroklooritiatsidin kanssa. Raloksifeenin tai hormonikorvaushoidon samanaikainen anto FORSTEOn kanssa ei muuttanut vaikutuksia, joita FORSTEOlla on seerumin tai virtsan kalsiumpitoisuuteen eikä kliinisiin haittavaikutuksiin. 3
4 Eräässä tutkimuksessa 15 terveelle tutkimushenkilölle annettiin digoksiinia päivittäin vakaan tilan saavuttamiseen asti, jolloin annettu kerta-annos FORSTEOta ei muuttanut digoksiinin sydänvaikutuksia. Yksittäiset tapausselostukset ovat kuitenkin viitanneet siihen, että hyperkalsemia voi altistaa potilasta digitaliksen toksisille vaikutuksille. Koska FORSTEO aiheuttaa seerumin kalsiumin ohimenevän nousun, FORSTEOta tulee käyttää varoen potilailla, jotka saavat digitalista. 4.6 Raskaus ja imetys Kaniineilla tehdyissä tutkimuksissa on ilmennyt lisääntyvyyteen liittyviä haitallisia vaikutuksia. Ihmiseen mahdollisesti kohdistuvaa riskiä ei tunneta. Käyttöaihe huomioiden FORSTEOta ei tulisi antaa raskauden eikä imetyksen aikana. 4.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty. Ohimenevää ortostaattista hypotensiota tai huimausta on kuitenkin tavattu joillakin potilailla. Näiden potilaiden tulee pidättäytyä ajamisesta ja koneiden käytöstä kunnes oireet ovat hävinneet. 4.8 Haittavaikutukset Teriparatidin kliinisissä tutkimuksissa 82,2 % FORSTEO-potilaista ja 84,5 % plasebopotilaista raportoi vähintään yhden haittavaikutustapahtuman. Yleisimmin ilmoitettuja haittavaikutuksia FORSTEO-hoitoa saaneilla potilailla ovat pahoinvointi, raajan kipu, päänsärky ja huimaus. Taulukoissa 1, 2 ja 3 on esitetty haittavaikutukset, jotka havaittiin kliinisissä tutkimuksissa syy-yhteyteen katsomatta. Seuraavat haittavaikutukset havaittiin 1382 potilaan kliinisissä tutkimuksissa. Taulukko 1 Erittäin yleiset haittavaikutukset ( 10 %) Elinjärjestelmä Haittavaikutus FORSTEO N=691 (%) Plasebo N=691 (%) Tuki- ja liikuntaelimistön, Raajan kipu 10,0 9,0 sidekudosten ja luuston häiriöt Taulukko 2 Yleiset haittavaikutukset ( 1 %, < 10 %) Elinjärjestelmä Haittavaikutus FORSTEO N=691 (%) Plasebo N=691 (%) Veren ja imunestejärjestelmän Anemia 1,7 1,3 häiriöt Aineenvaihdunta- ja Hyperkolesterolemia 2,6 2,3 ravitsemushäiriöt Psykiatriset häiriöt Masennus 4,1 2,5 Hermojärjestelmän häiriöt Päänsärky Huimaus Iskias 7,7 8,0 1,3 7,4 5,2 0,7 Korva- ja sisäkorvahäiriöt Huimaus 3,6 2,5 Sydänhäiriöt Sydämentykytys 1,4 1,2 Verisuonistohäiriöt Hypotensio 1,0 1,0 Hengitys-, rintakehä- ja välikarsinahäiriöt Mahalaukku- ja suolistohäiriöt Hengenahdistus 3,3 2,3 Pahoinvointi Oksentelu Hiatushernia 8.,5 3,3 1,0 6,2 2,6 0,9 4
5 Gastroesofageaalinen refluksi 1,0 0,4 Ihon ja ihonalaiskerrosten häiriöt Lisääntynyt hikoilu 1,9 1,3 Tuki- ja liikuntaelimistön, Lihaskouristukset 3,6 2,9 sidekudosten ja luuston häiriöt Yleisluontoiset häiriöt ja lääkkeenantokohta Väsymys Rintakipu Heikkous Taulukko 3 Epätavalliset haittavaikutukset ( 0,1 %, < 1 %) Elinjärjestelmä Haittavaikutus FORSTEO N=691 (%) Plasebo N=691 (%) Sydänhäiriöt Takykardia 0,9 0,9 Hengitys-, rintakehä- ja Emfyseema 0,3 0 välikarsinahäiriöt Mahalaukku- ja ohutsuolihäiriöt Peräpukamat 0,9 0,4 Munuais- ja virtsatiehäiriöt Virtsainkontinenssi Polyuria Virtsapakko 0,6 0,3 0,3 0,3 0,1 0 Yleisluontoiset häiriöt ja annostuspaikan tila Tutkimukset Pistoskohdan punoitus Pistoskohdan reaktiot Painon nousu Sydämen sivuääni FORSTEO lisää virtsahapon pitoisuutta seerumissa. Kliinisissä tutkimuksissa 2,8 %:lla FORSTEOhoitoa saaneista potilaista oli normaalia suurempi virtsahapon pitoisuus seerumissa, kun vastaava luku plaseboa saaneilla potilailla oli 0,7 %. Hyperurikemia ei kuitenkaan johtanut kihti-, artralgia- eikä virtsatiekivitapausten lisääntymiseen. Laajassa kliinisessä tutkimuksessa havaittiin teriparatidin kanssa ristireagoivia vasta-aineita 2,8 %:lla FORSTEOta saaneista naisista. Vasta-aineita todettiin yleensä 12 kuukauden hoidon jälkeen ja ne vähenivät hoidon lopettamisen jälkeen. Merkkejä yliherkkyysreaktioista, allergisista reaktioista, seerumin kalsiumiin kohdistuvista vaikutuksista eikä luun mineraalitiheysvasteeseen kohdistuvista vaikutuksista ei havaittu. 4.9 Yliannostus Merkit ja oireet Kliinisissä tutkimuksissa ei ole raportoitu yhtään yliannostustapausta. FORSTEOta on annettu turvallisesti kerta-annoksina enimmillään 100 mikrogrammaa ja toistuvina annoksina enimmillään 60 mikrog/vrk 6 viikon ajan. 4,8 3,8 1,6 0,7 0,3 0,7 0,4 4,3 3,5 1,2 0 0,1 0,3 0,1 Odotettavissa olevia yliannoksesta johtuvia haittavaikutuksia ovat viivästynyt hyperkalsemia ja ortostaattisen hypotension riski. Lisäksi saattaa esiintyä pahoinvointia, oksentelua, huimausta ja päänsärkyä. Yliannostuksen hoito: FORSTEOlle ei ole spesifistä antidoottia. Epäillyn yliannostuksen hoitoon tulee sisällyttää seuraavat toimet: FORSTEO-lääkityksen tilapäinen lopettaminen, seerumin kalsiumpitoisuuden seuranta sekä asianmukaisten tukitoimien, kuten nesteytyksen, aloittaminen. 5. FARMAKOLOGISET OMINAISUUDET 5.1 Farmakodynamiikka 5
6 Farmakoterapeuttinen ryhmä: Lisäkilpirauhasen hormonit, ATC-koodi: H05AA02. Vaikutusmekanismi Endogeeninen 84-aminohaponlisäkilpirauhashormoni (PTH) on luustossa ja munuaisissa tapahtuvan kalsium- ja fosfaattimetabolian ensisijainen säätelijä. FORSTEO (rhpth(1-34)) on ihmisen endogeenisen lisäkilpirauhashormonin aktiivinen fragmentti (1-34). PTH:n fysiologisiin vaikutuksiin kuuluu se, että se stimuloi luunmuodostusta vaikuttamalla suoraan luuta muodostaviin soluihin (osteoblasteihin), jolloin kalsiumin imeytyminen suolistosta lisääntyy epäsuorasti ja kalsiumin tubulaarinen reabsorptio sekä fosfaatineritys munuaisissa lisääntyvät. Farmakodynaamiset vaikutukset FORSTEO on osteoporoosin hoitoon tarkoitettu luunmuodostukseen vaikuttava lääke. FORSTEOn luustovaikutukset riippuvat systeemisen altistuksen luonteesta. Kerran vuorokaudessa otettuna FORSTEO lisää uuden luun kerroskasvua trabekulaarisilla ja kortikaalisilla luupinnoilla stimuloimalla enemmän osteoblastien kuin osteoklastien toimintaa. Kliininen tehokkuus Postmenopausaaliset naiset, joilla todettu osteoporoosi (T-score alle 2,5 sekä yksi tai useampi pienienerginen murtuma): Ydintutkimukseen osallistui 1637 postmenopausaalista naista (keski-ikä 69,5 vuotta). Potilaista 90 %:lla oli lähtötilanteessa yksi tai useampia nikamamurtumia. Kaikki potilaat saivat 1000 mg kalsiumia ja vähintään 400 IU D-vitamiinia vuorokaudessa. Enimmillään 24 kuukautta kestäneen FORSTEO-hoitojakson (mediaanikesto 19 kuukautta) tulokset osoittavat murtumien vähenemän olevan tilastollisesti merkitsevä (Taulukko 4). Jotta saatiin ehkäistyksi vähintään yksi uusi nikamamurtuma, oli hoidettava 11 naista hoitoajan mediaanin ollessa 19 kuukautta. Taulukko 4 Nikamamurtumien insidenssi postmenopausaalisilla naisilla Plasebo (N=448) (%) FORSTEO (N=444) (%) Suhteellinen riski (95 % CI) vs. plasebo Uusi murtuma ( 1) 14,3 5,0 a 0,35 (0,22; 0,55) Useita murtumia ( 2) 4,9 1,1 a 0,23 (0,09; 0,60) a p 0,001 verrattuna plaseboon, CI = luottamusväli Luun mineraalitiheys (BMD) oli suurentunut merkitsevästi kun hoidon keston mediaani oli 19 kuukautta lannerangan BMD oli suurentunut 9 % ja lonkan 4 % plaseboon nähden (p < 0,001). Hoidon jälkeinen taudin hallinta: FORSTEO-hoidon jälkeen 1262 postmenopausaalista ydintutkimukseen osallistunutta naista jatkoivat seurantatutkimuksessa. Tutkimuksen pääasiallinen tarkoitus oli kerätä turvallisuustietoja FORSTEO-valmisteesta. Tämän havainnointijakson aikana potilaat saivat käyttää muita osteoporoosihoitoja, ja nikamamurtumista tehtiin lisäarviointeja. FORSTEO-hoidon lopettamista seuranneena aikana, jonka mediaani oli 18 kuukautta uusien nikamamurtumien vähenemä oli FORSTEOta saaneilla naisilla 41 % (p=0,004) plaseboa saaneisiin verrattuna. Miesten osteoporoosi: 437 hypogonadaalista tai idiopaattista osteoporoosia sairastavaa miestä sai FORSTEO-hoitoa. Kaikki potilaat saivat 1000 mg kalsiumia ja vähintään 400 IU D-vitamiinia vuorokaudessa. Lannerangan BMD:n lisääntyminen oli merkitsevää kolmen kuukauden kuluttua. 6
7 Kahdentoista kuukauden jälkeen lannerangan luun mineraalipitoisuus oli lisääntynyt 5 % ja lonkan 1 % plaseboon verrattuna. Murtumiin ei kuitenkaan voitu osoittaa merkitsevää vaikutusta. 5.2 Farmakokinetiikka FORSTEO eliminoituu maksan ja maksanulkoisen puhdistuman kautta (naisilla noin 62 l/h ja miehillä 94 l/h). Jakautumistilavuus on noin 1,7 l/kg. FORSTEOn puoliintumisaika on noin yksi tunti, kun sitä annetaan ihon alle, ja se heijastaa aikaa, joka kuluu imeytymiseen pistoskohdasta. FORSTEOn metaboliaa ja erittymistä koskevia tutkimuksia ei ole tehty, mutta PTH:n perifeerisen metabolian uskotaan tapahtuvan pääosin maksassa ja munuaisissa. Erityiset potilasryhmät: Ikääntyneet tai vanhukset FORSTEOn farmakokinetiikassa ei todettu eroja iän suhteen (vaihteluväli vuotta). Annoksen muuttaminen iän perusteella ei ole tarpeen. 5.3 Prekliiniset tiedot turvallisuudesta Teriparatidi ei ollut genotoksinen missään standarditesteissä. Teriparatidi ei vaikuttanut teratogeenisesti rottiin, hiiriin eikä kaniineihin. Rotilla, joita hoidettiin lähes niiden koko eliniän päivittäisillä injektioilla, esiintyi annoksesta riippuvaa ylivilkasta luunmuodostusta sekä osteosarkoomainsidenssin lisääntymistä, joka johtuu todennäköisesti epigeneettisestä mekanismista. Teriparatidi ei lisännyt muuntyyppisten kasvainten insidenssiä rotalla. Koska rotan ja ihmisen luuston fysiologiassa on eroja, näiden löydösten kliininen merkitys on todennäköisesti pieni. Luukasvaimia ei havaittu hoitoa18 kuukauden ajan saaneilla apinoilla, joiden munasarjat oli poistettu. Osteosarkoomia ei myöskään ole havaittu kliinisissä tutkimuksissa eikä hoidon jälkeisissä seurantatutkimuksissa. Eläintutkimukset ovat osoittaneet, että vaikeasti heikentynyt maksan verenvirtaus vähentää PTH:n altistumista sen pääasialliselle pilkkoutumisjärjestelmälle (Kupffer-solut) ja pienentää siten myös PTH(1-84):n puhdistumaa. 6. FARMASEUTTISET TIEDOT 6.1 Apuaineet Väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli (säilöntäaine), kloorivetyhappo, natriumhydroksidi, injektionesteisiin käytettävä vesi. Valmisteeseen on voitu lisätä kloorivetyhappoa ja/tai natriumhydroksidia ph:n säätöön. 7
8 6.2 Yhteensopimattomuudet Koska yhteensopimattomuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa. 6.3 Kestoaika 2 vuotta. Kemiallinen, fysikaalinen ja mikrobiologinen käytönaikainen säilyvyys on osoitettu 28 päivälle 2 8 C:ssa. Avaamisen jälkeen kynää voidaan käyttää enintään 28 päivää, jos sitä säilytetään 2 8 C:ssa. Muut säilytysajat ja olosuhteet käytön aikana ovat käyttäjän vastuulla. 6.4 Säilytys Säilytä aina 2 8 C:n lämpötilassa. Pane kynä takaisin jääkaappiin heti käytön jälkeen. Ei saa jäätyä. Älä säilytä kynää siten, että neula on siinä kiinni. 6.5 Pakkaustyyppi ja pakkauskoot 3 ml liuosta sylinteriampullissa (silikonoitu tyypin I lasi), jossa on mäntä (halobutyylikumia), kiekkosuljin (polyisopreeni/bromobutyylikumilaminaatti) ja muotoonpuristettu (alumiini) korkki kertakäyttökynässä. FORSTEOn pakkauskoot ovat yksi tai kolme kynää. Yksi kynä sisältää 28 kpl 20 mikrogramman annosta/80 mikrolitraa. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. 6.6 Käyttö- ja käsittelyohjeet FORSTEO on esitäytetty injektiokynä, ja se on tarkoitettu potilaskohtaiseen käyttöön. Jokaisella pistämiskerralla on käytettävä uutta steriiliä neulaa. Jokaisessa FORSTEO-pakkauksessa on käyttäjän opas, jossa kuvataan kynän käyttö. Valmisteen mukana ei toimiteta neuloja. Kynässä voidaan käyttää insuliinikynän neuloja (esim. Becton Dickinson). FORSTEO-kynä on säilytettävä aina jääkaapissa. FORSTEOta ei tule käyttää jos liuos on samea, värjäytynyt tai siinä on hiukkasia. Kynän käyttöohjeet ovat myös käyttäjän oppaassa. 7. MYYNTILUVAN HALTIJA Eli Lilly Nederland B.V, Grootslag 1-5, NL-3991 RA Houten, Alankomaat 8. MYYNTILUVAN NUMERO(T) 9. MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ/UUDISTAMISPÄIVÄMÄÄRÄ 10. TEKSTIN MUUTTAMISPÄIVÄMÄÄRÄ 8
9 LIITE II A. BIOLOGISEN VAIKUTTAVAN AINEEN VALMISTAJA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA B. MYYNTILUVAN EHDOT 9
10 A BIOLOGISEN VAIKUTTAVAN AINEEN VALMISTAJA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA Biologisen vaikuttavan aineen valmistajan nimi ja osoite Eli Lilly and Company, Lilly Technology Centre, Indianapolis, Indiana 46285, USA Erän vapauttamisesta vastaavan valmistajan nimi ja osoite: Lilly France S.A.S., Rue du colonel Lilly, Fegersheim, Ranska B MYYNTILUVAN EHDOT MYYNTILUVAN HALTIJALLE ASETETUT TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET Lääkemääräys MUUT EHDOT Tämän myyntiluvan haltijan on tiedotettava Euroopan komissiolle tämän päätöksen perusteella hyväksytyn lääkevalmisteen markkinointisuunnitelmista. 10
11 LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 11
12 A. MYYNTIPÄÄLLYSMERKINNÄT 12
13 ULKOPAKKAUKSESSA TAI SEN PUUTTUESSA SISÄPAKKAUKSESSA ON OLTAVA SEURAAVAT MERKINNÄT KOTELON TEKSTI 1. LÄÄKEVALMISTEEN NIMI Forsteo 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi 2. VAIKUTTAVA(T) AINE(ET) Yksi ml sisältää 250 mikrogrammaa teriparatidia 3. LUETTELO APUAINEISTA Apuaineet: Väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli 3,0 mg/ml (säilöntäaine), injektionesteisiin käytettävä vesi. Valmisteeseen on voitu lisätä kloorivetyhappoa ja/tai natriumhydroksidia (tarvittaessa). 4. LÄÄKEMUOTO JA SISÄLLÖN MÄÄRÄ Injektioneste, liuos. Yksi esitäytetty kynä 3 ml. Yksi kynä sisältää 28 annosta, yhdessä annoksessa on 20 mikrogrammaa (/80 mikrolitraa). 5. ANTOTAPA JA TARVITTAESSA ANTOREITTI (ANTOREITIT) Ihon alle TÄRKEÄÄ: LUE PAKKAUSSELOSTE ENNEN KÄYTTÖÄ 6. ERITYISVAROITUS VALMISTEEN SÄILYTTÄMISESTÄ POIS LASTEN ULOTTUVILTA Ei lasten ulottuville. 7. MUU ERITYISVAROITUS (MUUT ERITYISVAROITUKSET), JOS TARPEEN 8. VIIMEINEN KÄYTTÖPÄIVÄMÄÄRÄ Käyt. viim. {KK/VVVV} Kynä tulee hävittää 28 päivän kuluttua ensimmäisestä käyttökerrasta. Ensimmäinen käyttöpvm. 9. ERITYISET SÄILYTYSOLOSUHTEET Säilytä 2 C 8 C (jääkaapissa) koko ajan. Ei saa jäätyä. 13
14 10. ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMIEN LÄÄKEVALMISTEIDEN TAI NIISTÄ PERÄISIN OLEVAN JÄTEMATERIAALIN HÄVITTÄMISEKSI, JOS TARPEEN 11. MYYNTILUVAN HALTIJAN NIMI JA OSOITE Eli Lilly Nederland B.V. Grootslag 1-5, NL-3991 RA Houten Alankomaat 12. MYYNTILUVAN NUMERO(T) EU/0/00/000/ VALMISTAJAN ERÄNUMERO Erä 14. YLEINEN TOIMITTAMISLUOKITTELU Reseptilääke. 15. KÄYTTÖOHJEET 14
15 ULKOPAKKAUKSESSA TAI SEN PUUTTUESSA SISÄPAKKAUKSESSA ON OLTAVA SEURAAVAT MERKINNÄT KOTELON TEKSTI 1. LÄÄKEVALMISTEEN NIMI Forsteo 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi 2. VAIKUTTAVA(T) AINE(ET) Yksi ml sisältää 250 mikrogrammaa teriparatidia 3. LUETTELO APUAINEISTA Apuaineet: Väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli 3,0 mg/ml (säilöntäaine), injektionesteisiin käytettävä vesi. Valmisteeseen on voitu lisätä kloorivetyhappoa ja/tai natriumhydroksidia (tarvittaessa). 4. LÄÄKEMUOTO JA SISÄLLÖN MÄÄRÄ Injektioneste, liuos. 3 esitäytettyä 3 ml:n kynää Yksi kynä sisältää 28 annosta, yhdessä annoksessa on 20 mikrogrammaa (/80 mikrolitraa) 5. ANTOTAPA JA TARVITTAESSA ANTOREITTI (ANTOREITIT) Ihon alle TÄRKEÄÄ: LUE PAKKAUSSELOSTE ENNEN KÄYTTÖÄ 6. ERITYISVAROITUS VALMISTEEN SÄILYTTÄMISESTÄ POIS LASTEN ULOTTUVILTA Ei lasten ulottuville. 7. MUU ERITYISVAROITUS (MUUT ERITYISVAROITUKSET), JOS TARPEEN 8. VIIMEINEN KÄYTTÖPÄIVÄMÄÄRÄ Käyt. viim. {KK/VVVV} Kynä tulee hävittää 28 päivän kuluttua ensimmäisestä käyttökerrasta. Ensimmäinen käyttöpvm. 15
16 9. ERITYISET SÄILYTYSOLOSUHTEET Säilytä 2 C 8 C (jääkaapissa) koko ajan. Ei saa jäätyä. 10. ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMIEN LÄÄKEVALMISTEIDEN TAI NIISTÄ PERÄISIN OLEVAN JÄTEMATERIAALIN HÄVITTÄMISEKSI, JOS TARPEEN 11. MYYNTILUVAN HALTIJAN NIMI JA OSOITE Eli Lilly Nederland B.V. Grootslag 1-5, NL-3991 RA Houten Alankomaat 12. MYYNTILUVAN NUMERO(T) EU/0/00/000/ VALMISTAJAN ERÄNUMERO Erä 14. YLEINEN TOIMITTAMISLUOKITTELU Reseptilääke. 15. KÄYTTÖOHJEET 16
17 PIENISSÄ SISÄPAKKAUKSISSA ON OLTAVA VÄHINTÄÄN SEURAAVAT MERKINNÄT ETIKETIN TEKSTI 1. LÄÄKEVALMISTEEN NIMI JA TARVITTAESSA ANTOREITTI (ANTOREITIT) Forsteo 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Ihon alle 2. ANTOTAPA 3. VIIMEINEN KÄYTTÖPÄIVÄMÄÄRÄ Käyt. viim. {KK/VVVV} Säilytä 2 C 8 C 4. ERÄNUMERO Erä 5. SISÄLLÖN MÄÄRÄ PAINONA, TILAVUUTENA TAI YKSIKKÖINÄ 3 ml 17
18 B. PAKKAUSSELOSTE 18
19 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla on lisäkysymyksiä, käänny lääkärisi tai apteekin puoleen. - Tämä lääke on määrätty sinulle henkilökohtaisesti eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heidän oireensa olisivat samat kuin sinun. Tässä selosteessa esitetään: 1. Mitä FORSTEO on ja mihin sitä käytetään 2. Ennen kuin käytät FORSTEOta 3. Miten FORSTEOta käytetään 4. Mahdolliset haittavaikutukset 5. FORSTEOn säilyttäminen 6. Muuta tietoa FORSTEO 20 mikrogrammaa /80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi - Vaikuttava aine on teriparatidi. Yksi ml injektionestettä sisältää 250 mikrogrammaa teriparatidia. - Muut aineet ovat väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli 3,0 mg/ml (säilöntäaine) ja injektionesteisiin käytettävä vesi. Liuokseen on voitu lisätä myös kloorivetyhappoa ja/tai natriumhydroksidia happamuuden säätöön. Myyntiluvan haltija on Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Alankomaat. FORSTEOn valmistaja on Lilly France S.A.S., Rue du Colonel Lilly, Fegersheim, Ranska. 1. MITÄ FORSTEO ON JA MIHIN SITÄ KÄYTETÄÄN FORSTEO on väritön ja kirkas liuos, joka pistetään ihon alle (subkutaanisesti). Se toimitetaan sylinteriampulleihin pakattuna esitäytetyssä injektiokynässä, joka hävitetään, kun se on tyhjä. Yhdessä kynässä on 3 ml liuosta, josta riittää 28 annokseen. Kynät toimitetaan yhden tai kolmen kynän pakkauksissa. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. FORSTEO on luunmuodostukseen vaikuttava lääke, joka vahvistaa luuta ja vähentää nikamamurtumariskiä. Tämä valmiste on tarkoitettu osteoporoosin hoitoon. Osteoporoosi on sairaus, joka aiheuttaa luiden ohenemista ja haurastumista. Tämä tauti on erityisen yleinen vaihdevuosi-iän ohittaneilla naisilla. Vaikka oireita ei välttämättä aluksi ilmene, osteoporoosi lisää luunmurtumien todennäköisyyttä, etenkin selkärangan, lonkkien ja ranteiden alueella ja saattaa aiheuttaa selkäkipua, pituuden menetystä ja selän kumaruutta. 2. ENNEN KUIN KÄYTÄT FORSTEOta Terveydenhuollon ammattilainen opastaa sinua FORSTEO-kynän käytössä. Älä käytä FORSTEOta jos: sinulla on ollut allerginen reaktio, joka johtui teriparatidista tai jostakin muusta sen aineosasta, jotka on mainittu tämän pakkausselosteen alussa; veresi kalsiumpitoisuus on suuri (sinulla on hyperkalsemia), 19
20 sinulla on munuaisvaivoja (vaikea munuaisten vajaatoiminta), sinulla on toinen luuston sairaus, sinulla on korkea alkalisen fosfataasin arvo, olet saanut luurankoon sädehoitoa, olet raskaana tai imetät. FORSTEOta ei saa antaa lapsille tai kasvuvaiheessa oleville nuorille aikuisille. Älä koskaan käytä yhteistä FORSTEO-kynää muiden kanssa. Raskaus ja imettäminen Älä käytä FORSTEOta, jos olet raskaana tai imetät. Ennen kuin otat mitään lääkettä, keskustele asiasta lääkärisi tai apteekkihenkilökunnan kanssa. Ajaminen ja koneiden käyttö Joillekin potilaille FORSTEO-pistos voi aiheuttaa huimausta. Jos sinua huimaa, älä aja autoa äläkä käytä koneita ennen kuin olosi paranee. Muiden lääkkeiden käyttö Kerro aina lääkärillesi, jos parhaillaan käytät tai olet äskettäin käyttänyt muita lääkkeitä, myös itsehoitolääkkeitä, koska niillä voi joskus olla yhteisvaikutuksia (esim. digoksiini-/digitalis-valmisteet, joita käytetään sydäntaudeissa). 3. MITEN FORSTEOta KÄYTETÄÄN FORSTEOn suositusannos on 20 mikrogrammaa kerran vuorokaudessa pistoksena ihon alle (ihonalainen injektio) reiteen tai vatsan alueelle. Jotta muistaisit ottaa FORSTEO-pistoksen, ota se suunnilleen samaan aikaan joka päivä. Ota FORSTEO-pistos joka päivä niin pitkään kuin lääkärisi on sinulle määrännyt. FORSTEO-hoidon kesto on korkeintaan 18 kuukautta. FORSTEO voidaan pistää ruokailun yhteydessä. Käytä aina FORSTEOta juuri niin kuin lääkärisi on sinua neuvonut. Tarkista lääkäriltäsi tai apteekista, ellet ole varma. Lue pakkauksessa oleva käyttäjän opas, jotta osaat käyttää FORSTEO-kynää. Injektioneuloja ei toimiteta kynän mukana. Käytä tavanomaisia insuliinikyniin tarkoitettuja injektioneuloja (esim. Becton Dickinson and Companyn neuloja). Pistä FORSTEO pian sen jälkeen, kun olet ottanut kynän jääkaapista. Noudata käyttäjän oppaan ohjeita. Pane kynä takaisin jääkaappiin heti käytön jälkeen. Käytä joka pistokerralla uutta neulaa ja hävitä neula käytön jälkeen. Älä koskaan säilytä kynää niin, että neula on siinä kiinni. Lääkärisi voi määrätä sinulle FORSTEOn lisäksi kalsium- ja/tai D-vitamiinilisiä. Lääkärisi kertoo sinulle, kuinka paljon kalsiumia ja D-vitamiinia voit ottaa päivässä. Jos unohdat ottaa FORSTEO-pistoksen tai jos et pysty ottamaan pistosta tavanomaiseen aikaan, ota se mahdollisimman pian saman päivän aikana. Älä ota samana päivänä yhtä pistosta enempää. Älä yritä korvata unohtunutta annosta. Jos otat enemmän FORSTEO-valmistetta kuin sinun pitäisi Jos olet vahingossa ottanut enemmän teriparatidia kuin olisi pitänyt, ota yhteys lääkäriisi tai apteekkiin. 4. MAHDOLLISET HAITTAVAIKUTUKSET 20
21 Kuten kaikilla lääkkeillä, FORSTEOllakin voi olla haittavaikutuksia. FORSTEOn yleisimpiä haittavaikutuksia, joita ilmenee 1-10 %:lla potilaista, ovat huonovointisuus, päänsärky ja huimaus sekä raajoissa ilmenevä kipu. Muita yleisiä kliinisissä lääketutkimuksissa ilmoitettuja haittavaikutuksia olivat veren kolesterolipitoisuuden nousu, masennus, hermosärkyä jaloissa, heikotuksen tunne, epäsäännölliset sydänlyönnit, hengenahdistus, lisääntynyt hikoilu, lihaskouristukset, energian puute, väsymys ja rintakipu. Epätavallisia haittavaikutuksia, joita havaittiin kliinisissä tutkimuksissa 0,1-1 %:lla potilaista olivat sykkeen kiihtyminen, matala verenpaine, keuhkonlaajentuma, tyrä, vatsapoltto, peräpukamat, virtsan karkaaminen, lisääntynyt virtsaamistarve, painon nousu. Joillekin voi tulla kipua tai mustelma pistokohdassa. Niiden pitäisi hävitä muutamassa päivässä tai viikossa. Jos näin ei tapahdu, kerro asiasta lääkärillesi. Jos sinua alkaa huimata pistoksen antamisen jälkeen, istu tai asetu makuulle, kunnes olosi paranee. Jos olosi ei parane, soita lääkärille ennen hoidon jatkamista. Jos havaitset sellaisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa, kerro niistä lääkärillesi tai apteekkiin. 5. FORSTEOn SÄILYTTÄMINEN Ei lasten ulottuville. FORSTEO on säilytettävä 2 C 8 C (jääkaapissa) ennen avaamista ja käytön aikana. FORSTEOta voidaan käyttää enintään 28 päivän ajan ensimmäisen pistokerran jälkeen, jos kynää on säilytetty 2 8 C (jääkaapissa). FORSTEO ei saa jäätyä. Älä pane kyniä jääkaapin pakastelokeron lähelle jotta ne eivät jäädy. Älä käytä FORSTEOta, jos se on jäätynyt. FORSTEO-kynä tulee hävittää asianmukaisesti 28 päivän kuluttua, vaikka se ei olisi täysin tyhjä. Älä käytä FORSTEOta pakkaukseen ja kynään merkityn viimeisen käyttöpäivämäärän jälkeen. FORSTEO sisältää väritöntä ja kirkasta liuosta. Älä käytä FORSTEOta, jos liuoksessa on kiinteitä hiukkasia tai jos se on samea tai värjäytynyt. 21
22 6. MUUTA TIETOA Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja. België/Belgique/Belgien Eli Lilly Benelux S.A. Rue de l Etuve 52/1, Stoofstraat B-1000 Bruxelles, Brussel Tél/Tel: + 32-(0) Danmark Eli Lilly Danmark A/S Nybrovej 110 DK-2800 Lyngby Tlf: Deutschland Lilly Deutschland GmbH Saalburgstraße 153 D Bad Homburg Tel (0) Ελλάδα ΦΑΡΜΑΣΕΡΒ-ΛΙΛΛΥ Α.Ε.Β.Ε 15 0 χλµ Εθνικής Οδού Αθηνών-Λαµίας GR Κηφισιά Τηλ: +30 (0) España Lilly S.A. Avda. de la Industria, 30 E Alcobendas (Madrid) Tel: France Lilly France S.A.S. 13 rue Pagès F Suresnes Cedex Tel: +33-(0) Ireland Eli Lilly and Company (Ireland) Limited, Hyde House, 65 Adelaide Road, IRL - Dublin 2. Tel: (0) Ísland Eli Lilly Danmark A/S, Útibú á Íslandi Brautarholti 28 IS-105 Reykjavík Tel: Italia Luxembourg/Luxemburg Eli Lilly Benelux S.A. Rue de l Etuve 52/1, Stoofstraat B-1000 Bruxelles, Brussel Belgique / Belgien Tél/Tel: + 32-(0) Nederland Eli Lilly Nederland B.V, Grootslag 1-5, NL-3991 RA Houten Tel: + 31-(0) Norge Eli Lilly Norge A.S. Postboks 6090 Etterstad N-0601 Oslo Tlf: Österreich Eli Lilly Ges. m.b.h. Barichgasse A-1030 Wien Tel: + 43-(0) Portugal Lilly Farma Produtos Farmacêuticos, Lda Rua Dr. António Loureiro Borges, 4- Piso 3, Arquiparque- Miraflores P Algés Tel: Suomi/Finland Oy Eli Lilly Finland Ab PL 16 / Box 16 FIN Vantaa / Vanda Puh/Tel: (0) Sverige Eli Lilly Sweden AB Box S Stockholm Tel: + 46-(0) United Kingdom Eli Lilly and Company Limited Lilly House, Priestley Road, Basingstoke, Hampshire, RG24 9NL - UK Tel: + 44-(0)
23 Eli Lilly Italia S.p.A. Via Gramsci 731/733 I Sesto Fiorentino (FI) Tel: Tämä seloste on hyväksytty viimeksi: 23
24 Tulee pakkausselosteen lisäksi Käyttäjän opas Käyttöohjeet Lue käyttöohjeet huolellisesti ja toimi niiden mukaan. Ohjeista poikkeaminen voi johtaa väärään FORSTEO-annokseen. Lue myös PAKKAUSSELOSTE, joka on mukana pakkauksessa. Kynän ominaisuudet Yksi 3 ml:n esitäytetty injektiokynä sisältää 28 päivän FORSTEO-lääkityksen. FORSTEO on yhdistelmä-dna-peräinen teriparatidi-injektio. Kynällä voidaan pistää 20 mikrogramman lääkeannos kerrallaan. 24
25 Sisällysluettelo Kynän osat 3 Tärkeää 4 I. Esivalmistelut 5 II. Neulan kiinnittäminen kynään (Kynäpakkaus ei sisällä neuloja) 6 III. Kynän valmistelu pistoskuntoon 7 IV. Annoksen valitseminen 9 V. Lääkkeen pistäminen 10 VI. Toimenpiteet pistoksen jälkeen 11 Kysymyksiä ja vastauksia 12 25
26 Kynän osat Injektionappi Kohdennusmerkki Annosnuppi Kohdennusmerkki Etiketti Forsteo-säiliö Annosikkunan merkit annosnuppi valmis ulosvedettäväksi valmis annoksen valintaan pistoskuntoon valmistelu valmis pistokseen lääkeannos pistetty Läpinäkyvä säiliönpidike Kumitulppa Suojapaperi Injektioneula Säiliön suojus Neulan suojakorkki Neulan suoja Huom! Pakkauksessa ei ole mukana neuloja. 26
27 Tärkeää Monia lääkevalmisteita on saatavilla injektiokynissä. Tarkista kynän etiketistä ennen jokaista pistosta, että sinulla on FORSTEO-kynä. Älä anna kynääsi muiden käyttöön. FORSTEO-kynä sisältää 3 ml:n säiliön. Säiliön kyljessä on viivoin ja numeroin merkitty asteikko, josta näet suunnilleen jäljellä olevan lääkkeen määrän. Kun mäntä on numeron 100 kohdalla, noin 2/3 lääkkeestä on käytetty. Kun mäntä on numeron 60 kohdalla, kynä on melkein tyhjä. Tarkista, että sinulla on uusi FORSTEO-kynä käytettävissä. Annosta EI saa määrittää säiliön asteikon avulla. Älä koskaan säilytä FORSTEO-kynääsi neula kiinnitettynä. Hävitä käytetty neula ja kynä kuten lääkärisi tai hoitajasi on sinua neuvonut. Käytä aina neulan hävittämiseen säiliötä, jota neula ei voi läpäistä. Kynää ei suositella sokeiden tai näkövammaisten käyttöön ilman kynän käyttöön perehtyneen henkilön apua. 27
28 I. Esivalmistelut 1. Ota FORSTEO-kynä jääkaapista. 2. Pese kätesi aina ennen kuin alat valmistella kynääsi pistoskuntoon. 3. Vedä pois säiliön suojus. 4. Ennen kuin jatkat, tarkista, että kynänsäiliössä oleva lääke on kirkasta ja väritöntä eikä siinä näy kiinteitä hiukkasia. Älä käytä lääkettä, jos se on samea tai siinä näkyy hiukkasia. Säiliön suojus 5. Pyyhi kynän päässä oleva säiliön kumitulppa antiseptisella vanutupolla. 28
29 II. Neulan kiinnittäminen kynään (Kynäpakkaus ei sisällä neuloja) Tähän kynään sopivat Becton Dickinson and Company -yhtiön insuliinikynän neulat. 1. Ota aina joka pistosta varten uusi neula. 2. Poista suojapaperi neulan suojakorkista. Suojapaperi 3. Ruuvaa neula suojakorkkeineen myötäpäivään tiukasti paikoilleen kynään. Neulan suojakorkki 4. Pidä kynää kärki ylöspäin ja poista neulan suojakorkki. Säilytä se, sillä neula irrotetaan kynästä tämän suojakorkin avulla pistoksen jälkeen. Neulan suoja (hävitä) Neulan suojakorkki (säilytä) 5. Poista neulan suoja ja hävitä se. 29
30 III. Kynän valmistelu pistoskuntoon Ennen jokaista pistosta kynä on valmisteltava käyttökuntoon, jotta sillä voidaan pistää lääkettä. Tarkista ennen jokaista pistosta, että FORSTEOta tulee neulasta kun painat injektionapista, ja että säiliöön ei jää ilmakuplia, joita sinne on voinut kerääntyä tavanomaisen käytön aikana. Esivalmistelujen laiminlyönti voi johtaa väärään annokseen. Kynän esivalmistelut varmistavat sen, että FORSTEOta tulee neulasta ja että ilmakuplat on poistettu, koska ne voivat vaikuttaa annoksen suuruuteen. Säiliöön voi kerääntyä tavanomaisen käytön aikana pieniä ilmakuplia. Huom. Säiliöön voi kynän esivalmistelujen ja ilmakuplien poistamisen jälkeenkin jäädä vielä pieni kupla. Jos olet toiminut huolellisesti, tämä pieni kupla ei vaikuta annoksesi suuruuteen. Kynän pistoskuntoon valmistelussa kuluu pieni määrä lääkettä, mikä ei vaikuta kynän sisältämään 28 päivän annokseen. 1. Käännä annosnuppia myötäpäivään, kunnes annosikkunaan tulee esiin nuoli () ja kynässä ja annosnupissa olevat kohdennusmerkit ovat vastakkain. 2. Nuoli annosikkunassa ja kohdennusmerkit vastakkain vedä annosnupista nuolen suuntaan, kunnes annosikkunaan ilmestyy nolla 0. 30
31 III. Kynän valmistelu pistoskuntoon (jatkuu) 3. Käännä annosnuppia MYÖTÄPÄIVÄÄN, kunnes annosikkunassa näkyy numero 1. Ykkönen tarkoittaa, että voit nyt valmistella kynän pistoskuntoon. 4. Pidä kynää kärki ylöspäin. Napauta kevyesti sormella läpinäkyvää säiliötä, jotta mahdolliset ilmakuplat siirtyvät ylös. 5. Paina peukalolla, jos mahdollista, injektionappi pohjaan asti ja pidä nappi alhaalla, kunnes injektionesteen tulo lakkaa. Nestettä pitää tulla neulan kärjestä joko tippa tai jatkuva vähäinen virta. Annosikkunaan ilmestyy timantti () osoittamaan, että kynä on nyt valmis annoksen valintaan. Huom: Jos neulasta ei tule mitään ulos, toista kohdat 1-5. Jos neulasta ei useamman yrittämisen jälkeen tule ulos nestettä, katso ohjeita tämän oppaan lopussa olevasta kohdasta Kysymyksiä ja vastauksia. 31
32 IV. Annoksen valitseminen Varoitus: Älä paina injektionapista annosta valitessasi. Jos vahingossa painat injektionappia, sinun on aloitettava uudelleen kohdasta III. Kynän valmistelu pistoskuntoon. Annosikkunan numerot EIVÄT osoita annoksen suuruutta, vaan kertovat missä vaiheessa olet kynän valmisteluissa (ks. kohta Kynän osat). 1. Käännä annosnuppia myötäpäivään, kunnes nuoli () näkyy annosikkunassa ja kynässä ja annosnupissa olevat kohdennusmerkit ovat vastakkain. 2. Nuolen () näkyessä annosikkunassa ja kohdennusmerkkien ollessa vastakkain vedä annosnupista nuolen suuntaan, kunnes nolla 0 ilmestyy annosikkunaan. Annosta ei voi valita, jollei annosnuppia ole vedetty ulos. 3. Käännä annosnuppia myötäpäivään, kunnes annosikkunaan ilmestyy numero 2. Kynä on suunniteltu siten, että annosnuppia ei voi kääntää numeroa 2 pidemmälle. Älä yritä väkisin kääntää annosnuppia numeroa 2 pidemmälle. Kun numero 2 ilmestyy annosikkunaan, 20 mikrogramman annos on valittu ja kynä on pistosvalmis. 4. Jos et saa käännetyksi annosikkunaan numeroa 2, katso ohjeita tämän oppaan lopussa olevasta kohdasta Kysymyksiä ja vastauksia. 32
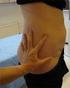
33 V. Lääkkeen pistäminen Numero (2) annosikkunassa tarkoittaa, että lääkeannos on valmis pistettäväksi. Hoidostasi vastaava lääkäri tai hoitaja neuvoo sinulle, kuinka lääke pistetään ihon alle, mihin kohtaan pistetään ja kuinka pistoskohtia vaihdellaan. 1. Ennen FORSTEO-pistosta puhdista pistoskohdan iho sinulle neuvotulla tavalla. 2. Nipistä sormilla pistoskohdan ihoa poimulle kuten kuvassa näkyy ja pistä neula suoraan ihon läpi. Saattaa olla, että joudut kohottamaan ihoa hieman, ettei pistos mene lihakseen, erityisesti reiden alueella. 3. Varmista, että annosikkunassa näkyy yhä numero 2. Pistä FORSTEO painamalla injektionappi pohjaan saakka, peukalollasi mikäli mahdollista. Pidä nappi alas painettuna ja laske hitaasti viiteen. Vedä sen jälkeen neula ihosta. or = tai 4. Pistoksen jälkeen annosikkunassa pitää näkyä timantti (), joka osoittaa, että injektionappi on painettu pohjaan asti. Jos annosikkunassa ei näy timanttia, et ole saanut koko annosta. Jos et saa painettua injektionappia pohjaan, katso ohjeita tämän oppaan lopussa olevasta kohdasta Kysymyksiä ja vastauksia. Ongelmatilanteessa ota yhteys hoidostasi vastaavaan henkilöön, jolta saat lisäohjeita. 33
34 VI. Toimenpiteet pistoksen jälkeen 1. Pane varovasti neulan suojakorkki takaisin paikalleen sinulle annettujen ohjeiden mukaisesti. 2. Irrota neula kynästä kiertämällä neulan suojakorkkia vastapäivään ja hävitä neula sinulle annettujen ohjeiden mukaisesti. Neulan suojakorkki 3. Pane säiliön suojus takaisin paikoilleen. 4. FORSTEO -kynä säilytetään aina jääkaapissa 2 8 C:ssa. FORSTEO -pistos tulee ottaa heti sen jälkeen, kun kynä on otettu pois jääkaapista. Pane kynä takaisin jääkaappiin välittömästi käytön jälkeen. Huom: Älä käytä FORSTEO-kynää etikettiin merkityn viimeisen käyttöpäivämäärän jälkeen. 34
35 Kysymyksiä ja vastauksia Ongelma Annos valittu ja injektionappi painettu sisään ilman, että neula on kiinnitetty kynään. Lääkettä ei tule neulasta. Valittu väärä annos (valmisteluannos tai pistosannos). Et ole varma jäljellä olevan FORSTEOn määrästä. Annoksen valitseminen ei onnistu. (Annosikkunassa ei näy numeroa, kun annosta yritetään valita.) Annosikkunassa näkyy x. Ratkaisu Jotta saisit tarkalleen oikean annoksen, toimi seuraavasti: 1) Kiinnitä kynään uusi neula. 2) Paina injektionappi pohjaan asti (vaikka ikkunaan ilmestyisikin 0 ), kunnes annosikkunassa näkyy timantti () tai nuoli (). 3) Valmistele kynä pistoskuntoon (ks. III. Kynän valmistelu pistoskuntoon) Jotta saisit tarkalleen oikean annoksen, toimi seuraavasti: 1) Kiinnitä kynään uusi neula. 2) Paina injektionappi pohjaan asti (vaikka ikkunaan ilmestyisikin 0 ), kunnes annosikkunassa näkyy timantti () tai nuoli (). 3) Valmistele kynä pistoskuntoon (ks. III. Kynän valmistelu pistoskuntoon) Jos et ole painanut injektionappia, kierrä annosnuppia eteen- tai taaksepäin, kunnes oikea annos on valittu. Jos olet jo pistänyt FORSTEOn, et ole saanut oikeaa annosta. Ota yhteys hoidostasi vastaavaan henkilöön, jolta saat lisäohjeita. Pidä kynää neulan kärki alaspäin. Läpinäkyvän säiliönpidikkeen kyljessä on asteikko, josta näet suunnilleen jäljellä olevan FORSTEOn määrän. Lääkeannosta tai jäljellä olevaa lääkemäärää ei saa määrittää säiliön asteikon avulla. Kynä on suunniteltu siten, että valmisteluannosta tai pistosannosta ei voida valita, jos säiliössä ei ole jäljellä tarpeeksi FORSTEOta. Jos annosta ei voida valita, FORSTEO-annos täytyy antaa uudella kynällä. Annos on valittu väärin, jos annosikkunaan ilmestyy x. Älä ota pistosta. Hylkää tämä annos ja aloita uudelleen kohdasta IV. Annoksen valitseminen. 35
36 Säiliössä on jäljellä vähän FORSTEOta, mutta annoksen valitseminen ei onnistu. Injektionappia ei saa painetuksi pohjaan kynän valmisteluvaiheessa tai pistosta annettaessa. Pistoksen antamisen jälkeen ikkunassa ei näy timanttia. Kynä on suunniteltu siten, että säiliötä ei voi tyhjentää kokonaan. Säiliöön jää aina pieni määrä FORSTEOta. 1) Jos neulasta ei tule mitään ulos, tarkista onko neula kiinnitetty oikein tai onko neula tukkeutunut. Seuraa ohjeita kohdassa Lääkettä ei tule neulasta. 2) Jos olet varma, että neulasta tulee FORSTEOta, paina injektionappi sisään hitaammin käyttäen vähemmän voimaa, ja säilytä paine tasaisena, kunnes injektionappi on täysin pohjassa. Et ole saanut oikeaa annosta. Ota yhteys hoidostasi vastaavaan henkilöön, jolta saat lisäohjeita. 36
FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä.
 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos sisältää 20 mikrogrammaa teriparatidia. Yksi
1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos sisältää 20 mikrogrammaa teriparatidia. Yksi
PAKKAUSSELOSTE. FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi
 PAKKAUSSELOSTE FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
KYNÄN KÄYTTÄJÄN OPAS Byetta 5 mikrogrammaa injektioneste, liuos, esitäytetyssä injektiokynässä (eksenatidi)
 KYNÄN KÄYTTÄJÄN OPAS Byetta 5 mikrogrammaa injektioneste, liuos, esitäytetyssä injektiokynässä (eksenatidi) KÄYTTÄJÄN OPPAAN SISÄLLYSLUETTELO Luku 1 MITÄ SINUN TULEE TIETÄÄ BYETTA-KYNÄSTÄSI Luku 2 UUDEN
KYNÄN KÄYTTÄJÄN OPAS Byetta 5 mikrogrammaa injektioneste, liuos, esitäytetyssä injektiokynässä (eksenatidi) KÄYTTÄJÄN OPPAAN SISÄLLYSLUETTELO Luku 1 MITÄ SINUN TULEE TIETÄÄ BYETTA-KYNÄSTÄSI Luku 2 UUDEN
Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONS
 Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONSVÆSKE, OPLØSNING I FYLDT PEN 250 mikrogram/mikrogrammaa
Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONSVÆSKE, OPLØSNING I FYLDT PEN 250 mikrogram/mikrogrammaa
OPAS KOTIPISTOSHOITOON
 OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
a. asettaa sinulle määrätyn annoksen b. varmistaa koko pistoksen antamisen c. nähdä toisella kynällä pistettävän lisäannoksen.
 FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml Bruksanvisning Käyttöohjeet Brugervejledning FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml ESITÄYTETTY GONAL F-KYNÄ 300 IU/0,5 ml FYLDT PEN 300 IE/0,5 ml Sisällysluettelo
FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml Bruksanvisning Käyttöohjeet Brugervejledning FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml ESITÄYTETTY GONAL F-KYNÄ 300 IU/0,5 ml FYLDT PEN 300 IE/0,5 ml Sisällysluettelo
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä injektiokynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 80 mikrolitran
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä injektiokynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 80 mikrolitran
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Purevax Rabies injektioneste, suspensio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: Rabies rekombinantti canarypox-virus
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Purevax Rabies injektioneste, suspensio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: Rabies rekombinantti canarypox-virus
PAKKAUSSELOSTE. Recuvyra 50 mg/ml transdermaalinen liuos koirille
 PAKKAUSSELOSTE Recuvyra 50 mg/ml transdermaalinen liuos koirille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
PAKKAUSSELOSTE Recuvyra 50 mg/ml transdermaalinen liuos koirille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
NOBIVAC RABIES VET. Adjuvantti: Alumiinifosfaatti (2 %) 0,15 ml (vastaten alumiinifosfaattia 3 mg)
 VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE LIITE III 1. MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE
 LIITE LIITE III 1. MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 1 B. PAKKAUSSELOSTE 2 LÄÄKEVALMISTEEN NIMI ZYPREXA 2,5 mg TABLETIT (OLANTSAPIINI) YLEISTÄ Lue tämä pakkausseloste tarkkaan ennen kuin aloitat
LIITE LIITE III 1. MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 1 B. PAKKAUSSELOSTE 2 LÄÄKEVALMISTEEN NIMI ZYPREXA 2,5 mg TABLETIT (OLANTSAPIINI) YLEISTÄ Lue tämä pakkausseloste tarkkaan ennen kuin aloitat
VALMISTEYHTEENVETO. Ruiskeina annettavien jauheiden, konsentraattien ja liuosten liuottamiseen ja laimentamiseen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
LIITE 1. B. PAKKAUSSELOSTE
 LIITE 1. B. PAKKAUSSELOSTE 4 PAKKAUSSELOSTE Lue tämä seloste huolellisesti ennen lääkevalmisteen käyttöä - Tämä seloste sisältää hyödyllistä tietoa Tractocile-valmisteesta. - Säilytä seloste. Voit tarvita
LIITE 1. B. PAKKAUSSELOSTE 4 PAKKAUSSELOSTE Lue tämä seloste huolellisesti ennen lääkevalmisteen käyttöä - Tämä seloste sisältää hyödyllistä tietoa Tractocile-valmisteesta. - Säilytä seloste. Voit tarvita
Veterelin vet 4 mikrog/ml injektioneste, liuos naudalle, hevoselle, sialle ja kanille
 1. ELÄINLÄÄKKEEN NIMI Veterelin vet 4 mikrog/ml injektioneste, liuos naudalle, hevoselle, sialle ja kanille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra injektionestettä sisältää: Vaikuttava
1. ELÄINLÄÄKKEEN NIMI Veterelin vet 4 mikrog/ml injektioneste, liuos naudalle, hevoselle, sialle ja kanille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra injektionestettä sisältää: Vaikuttava
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Equilis West Nile injektioneste, suspensio hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttava aine: Inaktivoitu
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Equilis West Nile injektioneste, suspensio hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttava aine: Inaktivoitu
MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE
 LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 1 A. MYYNTIPÄÄLLYSMERKINNÄT 2 MIRAPEXIN 0,088 MG, 30 TABLETTIA LÄPIPAINOPAKKAUKSISSA Mirapexin 0,088 mg 0,088 mg pramipeksolia vastaa 0,125 mg pramipeksolidihydrokloridimonohydraattia
LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 1 A. MYYNTIPÄÄLLYSMERKINNÄT 2 MIRAPEXIN 0,088 MG, 30 TABLETTIA LÄPIPAINOPAKKAUKSISSA Mirapexin 0,088 mg 0,088 mg pramipeksolia vastaa 0,125 mg pramipeksolidihydrokloridimonohydraattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI. Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
VALMISTEYHTEENVETO. Täydellisen parenteraalisen ravitsemuksen täydennyksenä vesiliukoisten vitamiinien päivittäisen tarpeen tyydyttämiseksi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
Annosta tulee muuttaa eläimillä, joilla on munuaisten tai maksan vajaatoiminta, koska haittavaikutusriski on suurentunut.
 1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
PAKKAUSSELOSTE. Prolia 60 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
PAKKAUSSELOSTE. XGEVA 120 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Equilis injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Annos (1 ml) sisältää: Vaikuttava(t) aine(et) Hevosen influenssaviruksien
LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Equilis injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Annos (1 ml) sisältää: Vaikuttava(t) aine(et) Hevosen influenssaviruksien
VALMISTEYHTEENVETO. Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
Lääkäri tai sairaanhoitaja opettaa sinulle, kuinka pistät esitäytetyssä ruiskussa olevan ORENCIAannoksen
 Ohjeet ORENCIA-pistoksen valmisteluun ja antoon ihon alle: Lue nämä ohjeet huolellisesti läpi, ja noudata ohjeita vaihe kerrallaan. Lääkäri tai sairaanhoitaja opettaa sinulle, kuinka pistät esitäytetyssä
Ohjeet ORENCIA-pistoksen valmisteluun ja antoon ihon alle: Lue nämä ohjeet huolellisesti läpi, ja noudata ohjeita vaihe kerrallaan. Lääkäri tai sairaanhoitaja opettaa sinulle, kuinka pistät esitäytetyssä
Ennen käyttöä. Käytön jälkeen
 Tärkeät käyttöohjeet. Lue huolellisesti. KUINKA KÄYTETÄÄN ORENCIA-VALMISTETTA (abatasepti) ClickJect esitäytetty kynä 125 mg, injektioneste, liuos ihon alle Lue nämä ohjeet ennen kuin käytät ClickJect
Tärkeät käyttöohjeet. Lue huolellisesti. KUINKA KÄYTETÄÄN ORENCIA-VALMISTETTA (abatasepti) ClickJect esitäytetty kynä 125 mg, injektioneste, liuos ihon alle Lue nämä ohjeet ennen kuin käytät ClickJect
VALMISTEYHTEENVETO. Liialliseen kaasunmuodostukseen liittyvät mahan ja suoliston vaivat
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
TESLASCAN 0,01 mmol/ml infuusioneste (kirkas vaalean-tai tummankeltainen neste) sisältää:
 B. PAKKAUSSELOSTE 4 Lääkevalmisteen nimi TESLASCAN Mangafodipiiritrinatrium Koostumus TESLASCAN 0,01 mmol/ml infuusioneste (kirkas vaalean-tai tummankeltainen neste) sisältää: Vaikuttava aine: 1 ml sisältää
B. PAKKAUSSELOSTE 4 Lääkevalmisteen nimi TESLASCAN Mangafodipiiritrinatrium Koostumus TESLASCAN 0,01 mmol/ml infuusioneste (kirkas vaalean-tai tummankeltainen neste) sisältää: Vaikuttava aine: 1 ml sisältää
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO. Yksi tippa silmän sidekalvopussiin 4 kertaa päivässä tai tarpeen mukaan tilan vaikeusasteesta riippuen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4, injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4, injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
1. ELÄINLÄÄKKEEN NIMI. Porceptal Vet 4 mikrog/ml injektioneste, liuos sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. 1 ml injektionestettä sisältää:
 1. ELÄINLÄÄKKEEN NIMI Porceptal Vet 4 mikrog/ml injektioneste, liuos sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Busereliiniasetaatti 4,2 mikrog (vastaten
1. ELÄINLÄÄKKEEN NIMI Porceptal Vet 4 mikrog/ml injektioneste, liuos sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Busereliiniasetaatti 4,2 mikrog (vastaten
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Metronidatsoli 0,75 paino-%, 7,5 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
TIETOA POTILAALLE. Tietoa teil e, joil e on määrätty Suliqua-lääkitys
 Finska TIETOA POTILAALLE Tietoa teil e, joil e on määrätty Suliqua-lääkitys Olemme kirjoittaneet tämän esitteen teille, joilla on diabetes ja joille lääkäri on määrännyt Suliqua-lääkityksen (glargiini-insuliini+liksisenatidi).
Finska TIETOA POTILAALLE Tietoa teil e, joil e on määrätty Suliqua-lääkitys Olemme kirjoittaneet tämän esitteen teille, joilla on diabetes ja joille lääkäri on määrännyt Suliqua-lääkityksen (glargiini-insuliini+liksisenatidi).
LIITE II A. ERÄN VAPAUTTAMISESTA VASTAAVAT VALMISTUSLUVAN HALTIJAT
 LIITE II A. ERÄN VAPAUTTAMISESTA VASTAAVAT VALMISTUSLUVAN HALTIJAT B. MYYNTILUVAN EHDOT 1 A. ERÄN VAPAUTTAMISESTA VASTAAVAT VALMISTUSLUVAN HALTIJAT Kalvopäällysteisten tablettien erän vapauttamisesta vastaavan
LIITE II A. ERÄN VAPAUTTAMISESTA VASTAAVAT VALMISTUSLUVAN HALTIJAT B. MYYNTILUVAN EHDOT 1 A. ERÄN VAPAUTTAMISESTA VASTAAVAT VALMISTUSLUVAN HALTIJAT Kalvopäällysteisten tablettien erän vapauttamisesta vastaavan
AVONEX in (beeta-1a-interferoni) antaminen on entistäkin helpompaa
 AVONEX in (beeta-1a-interferoni) antaminen on entistäkin helpompaa Uusi BIO-SET-yhdistäjä Potilaille, jotka käyttävät AVONEX ia (beeta-1a-interferoni) BIO-SET is a Trademark of BIODOME beeta-1a-interferoni
AVONEX in (beeta-1a-interferoni) antaminen on entistäkin helpompaa Uusi BIO-SET-yhdistäjä Potilaille, jotka käyttävät AVONEX ia (beeta-1a-interferoni) BIO-SET is a Trademark of BIODOME beeta-1a-interferoni
VALMISTEYHTEENVETO. Koira Lievän tai kohtalaisen sisäelimiin liittyvän kivun lievittämiseen. Rauhoittamiseen yhdessä medetomidiinin kanssa.
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Torphasol vet 4 mg/ml injektioneste, liuos koiralle ja kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Butorfanoli (butorfanolitartraattina
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Torphasol vet 4 mg/ml injektioneste, liuos koiralle ja kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Butorfanoli (butorfanolitartraattina
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
 1. ELÄINLÄÄKKEEN NIMI Ancesol 10 mg/ml injektioneste, liuos, naudoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Kloorifenamiinimaleaatti (vastaa 7,03 mg kloorifenamiinia)
1. ELÄINLÄÄKKEEN NIMI Ancesol 10 mg/ml injektioneste, liuos, naudoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Kloorifenamiinimaleaatti (vastaa 7,03 mg kloorifenamiinia)
PAKKAUSSELOSTE. NeuroBloc 5000 U/ml injektioneste, liuosta varten. Vaikuttava aine on B-tyypin botulinumtoksiini.
 B. PAKKAUSSELOSTE 1 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla on lisäkysymyksiä, käänny
B. PAKKAUSSELOSTE 1 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla on lisäkysymyksiä, käänny
LIITE II MAAHANTUONNISTA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA SEKÄ TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET
 LIITE II MAAHANTUONNISTA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA SEKÄ TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET 1 A. VALMISTUSLUVAN HALTIJA Maahantuonnista ja erän vapauttamisesta
LIITE II MAAHANTUONNISTA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA SEKÄ TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET 1 A. VALMISTUSLUVAN HALTIJA Maahantuonnista ja erän vapauttamisesta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ditebooster Injektioneste, suspensio, esitäytetyissä ruiskuissa. Kurkkumätä- ja jäykkäkouristusrokote (adsorboitu, vähennetty antigeenimäärä) 2. VAIKUTTAVAT AINEET
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ditebooster Injektioneste, suspensio, esitäytetyissä ruiskuissa. Kurkkumätä- ja jäykkäkouristusrokote (adsorboitu, vähennetty antigeenimäärä) 2. VAIKUTTAVAT AINEET
VALMISTEYHTEENVETO. Neste- ja elektrolyyttihukka esim. leikkauksen, trauman tai palovammojen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO. Vaikuttava(t) aine(et): Hevosen puhdistettua antiseerumia, jonka vaikuttava aine on tetanusantitoksiini.
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Equilis Tetanus-Serum vet injektioneste, liuos 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava(t) aine(et): Hevosen puhdistettua antiseerumia,
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Equilis Tetanus-Serum vet injektioneste, liuos 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava(t) aine(et): Hevosen puhdistettua antiseerumia,
1. ELÄINLÄÄKKEEN NIMI. Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
VALMISTEYHTEENVETO. Akrivastiinia ei pidä määrätä potilaille, joiden munuaistoiminta on merkittävästi heikentynyt.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO. Yli 33 kg painavat lapset (noin 11-vuotiaat), alle 50 kg painavat nuoret ja aikuiset:
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml, infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia 1 infuusiopullo sisältää 50 ml vastaten 500
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PERFALGAN 10 mg/ml, infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 10 mg parasetamolia 1 infuusiopullo sisältää 50 ml vastaten 500
VALMISTEYHTEENVETO. 1 ml = noin 31 tippaa. Yksi tippa sisältää noin 2 mikrog ja 5 tippaa noin 10 mikrog D-vitamiinia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Jekovit 2440 IU/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml tippoja sisältää 2440 IU (= 61 mikrog) ergokalsiferolia (D2-vitamiinia) Apuaine: etanoli.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Jekovit 2440 IU/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml tippoja sisältää 2440 IU (= 61 mikrog) ergokalsiferolia (D2-vitamiinia) Apuaine: etanoli.
Yksi gramma Silkis-voidetta sisältää 3 mikrogrammaa kalsitriolia (INN). Täydellinen apuaineluettelo, ks. kohta 6.1.
 1. LÄÄKEVALMISTEEN NIMI Silkis 3 mikrog/g voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma Silkis-voidetta sisältää 3 mikrogrammaa kalsitriolia (INN). Täydellinen apuaineluettelo, ks. kohta 6.1.
1. LÄÄKEVALMISTEEN NIMI Silkis 3 mikrog/g voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma Silkis-voidetta sisältää 3 mikrogrammaa kalsitriolia (INN). Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO. Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500 mg:aa kalsiumia.
 1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
Tiineys. Eläimet, joilla on akuutti tai subakuutti verenkierto-, suolisto- tai hengitystiesairaus.
 1. ELÄINLÄÄKKEEN NIMI Dinolytic vet. 12,5 mg/ml injektioneste, liuos naudalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: dinoprosti 12,5 mg/ml (dinoprostitrometamolina). Apuaineet: bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Dinolytic vet. 12,5 mg/ml injektioneste, liuos naudalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: dinoprosti 12,5 mg/ml (dinoprostitrometamolina). Apuaineet: bentsyylialkoholi
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
KÄYTTÄJÄN OPAS. Yksityiskohtainen käyttöoppaasi. BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten
 KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
VALMISTEYHTEENVETO. Nuhaan ja poskiontelotulehdukseen liittyvän limakalvojen turvotuksen lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia, joka vastaa 2,68 mg bentsydamiinia.
 1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
PISTOSOPAS. Lapsipotilaiden vanhemmille/hoitajille. injektioneste. 40 mg/ml injektioneste, liuos. 18 mg/0.45 ml 28 mg/0.
 PISTOSOPAS Lapsipotilaiden vanhemmille/hoitajille (asfotase (asfotaasialfa) alfa) injektioneste 40 mg/ml injektioneste, liuos 18 mg/0.45 ml 28 mg/0.7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0.8
PISTOSOPAS Lapsipotilaiden vanhemmille/hoitajille (asfotase (asfotaasialfa) alfa) injektioneste 40 mg/ml injektioneste, liuos 18 mg/0.45 ml 28 mg/0.7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0.8
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Proteq West Nile injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: West Nile rekombinantti
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Proteq West Nile injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: West Nile rekombinantti
Liite III. Muutokset tuotetietojen olennaisiin kohtiin
 Liite III Muutokset tuotetietojen olennaisiin kohtiin Huomautus: Nämä valmistetiedot ovat tulos referraaliprosessista, johon tämä komission päätös liittyy. Jäsenvaltioiden toimivaltaiset viranomaiset voivat
Liite III Muutokset tuotetietojen olennaisiin kohtiin Huomautus: Nämä valmistetiedot ovat tulos referraaliprosessista, johon tämä komission päätös liittyy. Jäsenvaltioiden toimivaltaiset viranomaiset voivat
VALMISTEYHTEENVETO. Addex-Magnesiumsulfaatti 246 mg/ml infuusiokonsentraatti, liuosta varten
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Magnesiumsulfaatti 246 mg/ml infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Magnesiumsulfaatti infuusiokonsentraattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Magnesiumsulfaatti 246 mg/ml infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Magnesiumsulfaatti infuusiokonsentraattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
LIITE I VALMISTEYHTEENVETO
 [Version 7.2, 12/2008] LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Parevet vet infuusioneste, liuos 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttavat aineet: Kalsiumglukonaatti (1 H 2 O) 200 mg,
[Version 7.2, 12/2008] LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Parevet vet infuusioneste, liuos 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttavat aineet: Kalsiumglukonaatti (1 H 2 O) 200 mg,
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1. ELÄINLÄÄKEVALMISTEEN NIMI HALOCUR 0,5 mg/ml oraaliliuos 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 2.1 Vaikuttava aine(vaikuttavat aineet) Halofuginoniemäs (laktaattisuolana)
LIITE I VALMISTEYHTEENVETO 1. ELÄINLÄÄKEVALMISTEEN NIMI HALOCUR 0,5 mg/ml oraaliliuos 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 2.1 Vaikuttava aine(vaikuttavat aineet) Halofuginoniemäs (laktaattisuolana)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Normofusin 50 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Normofusin 50 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml Normofusin 50 mg/ml infuusionestettä sisältää: Vaikuttava aine Määrä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Normofusin 50 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml Normofusin 50 mg/ml infuusionestettä sisältää: Vaikuttava aine Määrä
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1/19 1. ELÄINLÄÄKKEEN NIMI Eurican Herpes 205 injektiokuiva-aine ja liuotin, emulsiota varten 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: 1 ml annos: koirien herpesvirus
LIITE I VALMISTEYHTEENVETO 1/19 1. ELÄINLÄÄKKEEN NIMI Eurican Herpes 205 injektiokuiva-aine ja liuotin, emulsiota varten 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: 1 ml annos: koirien herpesvirus
Histadin- valmisteen tehoa ja turvallisuutta ei ole osoitettu alle 2-vuotiailla lapsilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
1. ELÄINLÄÄKKEEN NIMI. PARVOERYSIN vet injektioneste, emulsio sialle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. Yksi 2 ml:n annos sisältää:
 1. ELÄINLÄÄKKEEN NIMI PARVOERYSIN vet injektioneste, emulsio sialle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 2 ml:n annos sisältää: Vaikuttavat aineet: Parvovirus suis inaktivoitu (kanta S-27) Vähintään
1. ELÄINLÄÄKKEEN NIMI PARVOERYSIN vet injektioneste, emulsio sialle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 2 ml:n annos sisältää: Vaikuttavat aineet: Parvovirus suis inaktivoitu (kanta S-27) Vähintään
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml injektionestettä sisältää natriumkloridia Elektrolyyttipitoisuudet
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml injektionestettä sisältää natriumkloridia Elektrolyyttipitoisuudet
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.1 Käyttöaiheet. 4.2 Annostus ja antotapa
 1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
PAKKAUSSELOSTE Dicural 15 mg päällystetyt tabletit koiralle Dicural 50 mg päällystetyt tabletit koiralle
 PAKKAUSSELOSTE Dicural 15 päällystetyt tabletit koiralle Dicural 50 päällystetyt tabletit koiralle Dicural 100 päällystetyt tabletit koiralle Dicural 150 päällystetyt tabletit koiralle 1. MYYNTILUVAN HALTIJAN
PAKKAUSSELOSTE Dicural 15 päällystetyt tabletit koiralle Dicural 50 päällystetyt tabletit koiralle Dicural 100 päällystetyt tabletit koiralle Dicural 150 päällystetyt tabletit koiralle 1. MYYNTILUVAN HALTIJAN
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Zenapax 5 mg/ml infuusiokonsentraatti Daklitsumabi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla
PAKKAUSSELOSTE Zenapax 5 mg/ml infuusiokonsentraatti Daklitsumabi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla
Injektioneste, suspensio. Vaaleanpunertava tai valkoinen neste, joka sisältää valkoista sakkaa. Sakka sekoittuu helposti ravisteltaessa.
 1. ELÄINLÄÄKKEEN NIMI Trilyme injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttavat aineet: Inaktivoitu Borrelia burgdorferi sensu lato: Borrelia
1. ELÄINLÄÄKKEEN NIMI Trilyme injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttavat aineet: Inaktivoitu Borrelia burgdorferi sensu lato: Borrelia
LIITE VALMISTEYHTEENVETO
 LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Preotact 100 mikrogrammaa injektiokuiva-aine ja liuotin, liuosta varten esitäytetyssä kynässä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi esitäytetty
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Preotact 100 mikrogrammaa injektiokuiva-aine ja liuotin, liuosta varten esitäytetyssä kynässä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi esitäytetty
VALMISTEYHTEENVETO. Valmistetta ei saa antaa kanille, marsulle, hamsterille, gerbiilille eikä muille pienille jyrsijöille.
 1. ELÄINLÄÄKKEEN NIMI Amovet vet 150 mg/ml injektioneste, suspensio VALMISTEYHTEENVETO 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Amoksisilliinitrihydraatti (172,1 mg) vastaten
1. ELÄINLÄÄKKEEN NIMI Amovet vet 150 mg/ml injektioneste, suspensio VALMISTEYHTEENVETO 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Amoksisilliinitrihydraatti (172,1 mg) vastaten
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Duvaxyn WNV injektioneste, emulsio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml annos sisältää: Vaikuttava aine: Inaktivoitu Länsi-Niilin virus,
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Duvaxyn WNV injektioneste, emulsio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml annos sisältää: Vaikuttava aine: Inaktivoitu Länsi-Niilin virus,
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: etanoli 81,00 mg/ml, makrogoliglyserolihydroksistearaatti 120,00 mg/ml.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Jekovit D 3 2440 IU/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml tippoja sisältää 2440 IU kolekalsiferolia (D 3 -vitamiinia). Apuaineet, joiden
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Jekovit D 3 2440 IU/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml tippoja sisältää 2440 IU kolekalsiferolia (D 3 -vitamiinia). Apuaineet, joiden
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKEVALMISTEEN NIMI Nobivac Bb kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine 10 6.3 ja 10 7.3 pmy elävää Bordetella bronchiseptica bakteerin kantaa
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKEVALMISTEEN NIMI Nobivac Bb kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine 10 6.3 ja 10 7.3 pmy elävää Bordetella bronchiseptica bakteerin kantaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO. Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia 20 mg (2 %).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
