LIITE I VALMISTEYHTEENVETO
|
|
|
- Marjatta Jaakkola
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 LIITE I VALMISTEYHTEENVETO 1
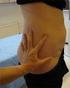
2 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä injektiokynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 80 mikrolitran annos sisältää 20 mikrogrammaa teriparatidia. Yksi 2,4 ml:n esitäytetty kynä sisältää 600 mikrogrammaa teriparatidia (vastaten 250 mikrogrammaa millilitrassa). *Teriparatidi, rhpth(1-34), on identtinen ihmisen endogeenisen lisäkilpirauhashormonin 34 N -terminaalisen aminohappojärjestyksen kanssa, ja se tuotetaan yhdistelmä-dna-tekniikalla E. coli - bakteerissa. Täydellinen apuaineluettelo, ks. kohta LÄÄKEMUOTO Injektioneste, liuos. Väritön, kirkas liuos. 4. KLIINISET TIEDOT 4.1 Käyttöaiheet Forsteo on tarkoitettu aikuisten hoitoon. Osteoporoosin hoitoon postmenopausaalisille naisille sekä miehille, joilla on suuri luun murtumavaara (katso kohta 5.1). Nikamamurtumien ja nikaman ulkopuolisten murtumien, mutta ei lonkkaluun murtumien ilmaantuvuuden on osoitettu vähenevän merkitsevästi postmenopausaalisilla naisilla. Pitkäaikaiseen, systeemiseen glukokortikoidihoitoon liittyvän osteoporoosin hoitoon sekä naisille että miehille, joiden luunmurtuman vaara on suurentunut (ks. kohta 5.1). 4.2 Annostus ja antotapa Annostus FORSTEOn suositusannos on 20 mikrogrammaa kerran vuorokaudessa. FORSTEO-lääkityksen kokonaiskeston tulisi olla 24 kuukautta (ks. kohta 4.4). Tätä 24 kuukauden FORSTEO-hoitoa ei saa uusia potilaan elinaikana. FORSTEO-hoidon aikana tulee huolehtia potilaan kalsium- ja D-vitamiinilisästä, mikäli niitä on ruokavaliossa liian vähän. FORSTEO-hoidon lopettamisen jälkeen potilaille voidaan aloittaa muita osteoporoosihoitoja. Erityisryhmät Munuaisten vajaatoiminta FORSTEOta ei saa käyttää potilaille, joilla on vaikea munuaisten vajaatoiminta (ks. kohta 4.3). Varovaisuutta tulee noudattaa, kun FORSTEOta käytetään potilaille, joilla on kohtalainen munuaisten vajaatoiminta. Lievässä munuaisten vajaatoiminnassa erityiset varotoimet eivät ole tarpeen. 2
3 Maksan vajaatoiminta Maksan vajaatoiminnasta kärsiviä potilaita koskevia tietoja ei ole saatavilla (ks. kohta 5.3), joten FORSTEO-valmistetta tulee käyttää varoen tälle potilasryhmälle. Lapset ja nuoret aikuiset, joiden epifyysit eivät ole sulkeutuneet FORSTEOn tehoa ja turvallisuutta lapsilla ja alle 18-vuotiailla nuorilla ei ole osoitettu. FORSTEOta ei pidä antaa lapsipotilaille (alle 18 v.) eikä nuorille aikuisille, joiden epifyysit eivät ole sulkeutuneet. Iäkkäät Annoksen muuttaminen iän perusteella ei ole tarpeen (ks. kohta 5.2). Antotapa FORSTEO pistetään kerran päivässä ihon alle reiteen tai vatsan alueelle. Potilaille on opetettava oikea pistämistekniikka. (ks. kohta 6.6). Saatavilla on myös käyttäjän opas, jossa potilaalle esitetään yksityiskohtaisesti injektiokynän oikea käyttö. 4.3 Vasta-aiheet Yliherkkyys vaikuttavalle aineelle tai kohdassa 6.1 mainituille apuaineille Raskaus ja imetys (ks. kohdat 4.4 ja 4.6) Hyperkalseeminen tila Vaikea munuaisten toimintahäiriö Luuston aineenvaihduntasairaus (kuten hyperparatyreoosi ja Pagetin luutauti), joka ei ole primaari osteoporoosi tai glukokortikoidihoitoon liittyvä osteoporoosi Selittämätön seerumin alkalisen fosfataasin nousu Aiempi luuston ulkoinen tai kudoksensisäinen sädehoito Teriparatidia ei saa antaa potilaille, joilla on luuston pahanlaatuinen kasvain tai etäpesäkkeitä luussa. 4.4 Varoitukset ja käyttöön liittyvät varotoimet Seerumin ja virtsan kalsium Potilailla, joiden veren kalsiumpitoisuus on normaali, on havaittu seerumin kalsiumpitoisuuden vähäistä ja ohimenevää nousua teriparatidi-injektion jälkeen. Kalsiumin huippupitoisuus seerumissa saavutetaan 4 6 tunnin kuluttua, ja pitoisuus palautuu lähtötasolle viimeistään tunnin kuluttua kunkin teriparatidi-injektion jälkeen. Näin ollen jos potilaalta halutaan tutkia seerumin kalsiumpitoisuus, verinäyte tulee ottaa aikaisintaan 16 tuntia viimeisimmän FORSTEO-injektion jälkeen. Kalsiumpitoisuuksien rutiiniseuranta ei ole tarpeellista hoidon aikana. FORSTEO saattaa lisätä vähäisessä määrin kalsiumin erittymistä virtsaan, mutta kliinisissä lääkeainetutkimuksissa ei hyperkalsiurian esiintymisessä todettu merkittävää eroa lumehoitoa saaneiden potilaiden virtsan kalsiumin eritykseen. Virtsakivitauti FORSTEOta ei ole tutkittu potilailla, joilla on aktiivinen virtsakivitauti. FORSTEOn käytössä tulee noudattaa varovaisuutta hoidettaessa potilaita, joilla on aktiivinen tai hiljattain sairastettu virtsakivitauti, koska tämä tila saattaa pahentua. Ortostaattinen hypotensio FORSTEOta koskevissa lyhytkestoisissa kliinisissä tutkimuksissa havaittiin yksittäisiä ohimeneviä ortostaattisen hypotension jaksoja. Tapahtuma alkoi yleensä 4 tunnin kuluessa lääkkeen otosta ja hävisi itsestään muutaman minuutin muutamaan tunnin aikana. Silloin kun ohimenevää ortostaattista hypotensiota esiintyi, se tapahtui ensimmäisten annosten yhteydessä. Se lievittyi, kun potilas asetettiin lepoasentoon, eikä estänyt hoidon jatkamista. 3
4 Munuaisten vajaatoiminta Varovaisuutta tulee noudattaa, jos potilaalla on kohtalainen munuaisten vajaatoiminta. Nuoret aikuiset Kokemuksia nuorten aikuisten, mukaan lukien premenopausaalisten naisten, väestöotoksista on niukalti (ks. kohta 5.1). Hoito tulee aloittaa vain, jos hyödyt selvästi ylittävät riskit tässä potilasryhmässä. Hedelmällisessä iässä olevien naisten on käytettävä luotettavaa raskauden ehkäisymenetelmää FORSTEO-lääkityksen aikana. Jos raskaus alkaa, FORSTEO on lopetettava. Hoidon kesto Rotilla tehdyt tutkimukset osoittavat, että teriparatidin pitkäaikaiskäyttö lisää osteosarkooman ilmaantuvuutta (ks. kohta 5.3). Ennen kuin tästä saadaan lisää kliinistä kokemusta, hoidon keston ei tule ylittää suositettua 24 kuukautta. 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset Eräässä tutkimuksessa 15 terveelle tutkimushenkilölle annettiin digoksiinia päivittäin vakaan tilan saavuttamiseen asti, jolloin annettu kerta-annos FORSTEOta ei muuttanut digoksiinin sydänvaikutuksia. Yksittäiset tapausselostukset ovat kuitenkin viitanneet siihen, että hyperkalsemia voi altistaa potilasta digitaliksen toksisille vaikutuksille. Koska FORSTEO aiheuttaa seerumin kalsiumin ohimenevän nousun, FORSTEOta tulee käyttää varoen potilaille, jotka saavat digitalista. FORSTEOlla ei ole havaittu olevan kliinisesti merkittäviä interaktioita hydroklooritiatsidin kanssa. Raloksifeenin tai hormonikorvaushoidon samanaikainen anto FORSTEOn kanssa ei muuttanut vaikutuksia, joita FORSTEOlla on seerumin tai virtsan kalsiumpitoisuuteen eikä kliinisiin haittavaikutuksiin. 4.6 Fertiliteetti, raskaus ja imetys Hedelmällisessä iässä olevat naiset /naisten raskauden ehkäisy Hedelmällisessä iässä olevien naisten on käytettävä luotettavaa raskauden ehkäisymenetelmää FORSTEO-lääkityksen aikana. Jos raskaus alkaa, FORSTEO on lopetettava. Raskaus FORSTEOn käyttö on vasta-aiheista raskauden aikana (ks. kohta 4.3). Imetys FORSTEOn käyttö on vasta-aiheista imetyksen aikana. Ei tiedetä, erittyykö teriparatidi rintamaitoon. Fertiliteetti Kaneilla tehdyissä tutkimuksissa on ilmennyt lisääntymistoksisuutta (ks. kohta 5.3). Teriparatidin vaikutusta ihmissikiön kehitykseen ei ole tutkittu. Ihmiseen mahdollisesti kohdistuvaa riskiä ei tunneta. 4.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn FORSTEO-valmisteella ei ole tai on vain vähäistä haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn. Ohimenevää ortostaattista hypotensiota tai huimausta on tavattu joillakin potilailla. Näiden potilaiden tulee pidättäytyä ajamisesta ja koneiden käytöstä kunnes oireet ovat hävinneet. 4
5 4.8 Haittavaikutukset Turvallisuusprofiilin yhteenveto Yleisimmin ilmoitettuja haittavaikutuksia FORSTEO-hoitoa saaneilla potilailla ovat pahoinvointi, raajan kipu, päänsärky ja huimaus. Haittavaikutustaulukko Teriparatidin kliinisissä tutkimuksissa 82,2 % FORSTEO-potilaista ja 84,5 % plasebopotilaista raportoi vähintään yhden haittavaikutustapahtuman. Seuraavassa taulukossa luetellaan teriparatidin kliinisissä osteoporoositutkimuksissa todetut sekä kauppaantulon jälkeen ilmoitetut haittavaikutukset. Haittavaikutukset on esitetty kussakin yleisyysluokassa seuraavasti: Hyvin yleinen ( 10 %), yleinen ( 1 % ja < 10 %), melko harvinainen ( 0,1 % ja < 1 %), harvinainen ( 0,01 % ja < 0,1 %), hyvin harvinainen (< 0,01 %). Veri ja imukudos Yleinen: anemia Immuunijärjestelmä Harvinainen: Anafylaksia Aineenvaihdunta ja ravitsemus Yleinen: hyperkolesterolemia Melko harvinainen: hyperkalsemia, yli 2,76 mmol/l, hyperurikemia Harvinainen: hyperkalsemia, yli 3,25 mmol/l Psyykkiset häiriöt Yleinen: masennus Hermosto Yleinen: heitehuimaus, päänsärky, iskias, pyörtyminen Kuulo ja tasapainoelin Yleinen: huimaus Sydän Yleinen: sydämentykytys Melko harvinainen: takykardia Verisuonisto Yleinen: hypotensio Hengityselimet, rintakehä ja välikarsina Yleinen: hengenahdistus Melko harvinainen: emfyseema Ruoansulatuselimistö Yleinen: pahoinvointi, oksentelu, hiatushernia, gastroesofageaalinen refluksi Melko harvinainen: peräpukamat Iho ja ihonalainen kudos Yleinen: lisääntynyt hikoilu Luusto, lihakset ja sidekudos Hyvin yleinen: raajan kipu Yleinen: lihaskouristukset Melko harvinainen: lihaskipu, nivelkipu, selkälihaskouristus/kipu* Munuaiset ja virtsatiet Melko harvinainen: virtsainkontinenssi, polyuria, virtsapakko, munuaiskivet Harvinainen: eriasteinen munuaisten vajaatoiminta Yleisoireet ja antopaikassa todettavat haitat Yleinen: väsymys, rintakipu, heikkous, pistoskohdassa lieviä ja ohimeneviä vaivoja mukaan lukien kipu, turvotus, eryteema, paikalliset mustelmat, kutina ja pistospaikan vähäinen verenvuoto Melko harvinainen: punoitus injektiokohdassa, injektiokohdan reaktioita Harvinainen: mahdollisia allergisia reaktioita pian injektion jälkeen; akuutti hengenahdistus, suun/kasvojen turvotus, yleistynyt urtikaria, rintakipu, turvotus (lähinnä perifeerinen). 5
6 Tutkimukset Melko harvinainen: painon nousu, sydämen sivuääni, alkalisen fosfataasiarvon suurentuminen *Vaikeita selkälihaskouristuksia tai kiputiloja on raportoitu ilmaantuneen muutaman minuutin kuluttua injektiosta. Valikoitujen haittavaikutusten kuvaus Kliinisissä tutkimuksissa seuraavien tapahtumien ilmoitettu esiintyvyys teriparatidilla oli vähintään 1 % suurempi kuin plasebolla: huimaus, pahoinvointi, raajan kipu, heitehuimaus, masennus, hengenahdistus. FORSTEO lisää virtsahapon pitoisuutta seerumissa. Kliinisissä tutkimuksissa 2,8 %:lla FORSTEOhoitoa saaneista potilaista oli normaalia suurempi virtsahapon pitoisuus seerumissa, kun vastaava luku plaseboa saaneilla potilailla oli 0,7 %. Hyperurikemia ei kuitenkaan johtanut kihti-, artralgia- eikä virtsatiekivitapausten lisääntymiseen. Laajassa kliinisessä tutkimuksessa havaittiin teriparatidin kanssa ristireagoivia vasta-aineita 2,8 %:lla FORSTEOta saaneista naisista. Vasta-aineita todettiin yleensä 12 kuukauden hoidon jälkeen ja ne vähenivät hoidon lopettamisen jälkeen. Merkkejä yliherkkyysreaktioista, allergisista reaktioista, seerumin kalsiumiin kohdistuvista vaikutuksista ja luun mineraalitiheysvasteeseen kohdistuvista vaikutuksista ei havaittu. Epäillyistä haittavaikutuksista ilmoittaminen On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista liitteessä V* luetellun kansallisen ilmoitusjärjestelmän kautta. 4.9 Yliannostus Merkit ja oireet FORSTEOta on annettu turvallisesti kerta-annoksina enimmillään 100 mikrogrammaa ja toistuvina annoksina enimmillään 60 mikrog/vrk 6viikon ajan. Odotettavissa olevia yliannoksesta johtuvia haittavaikutuksia ovat viivästynyt hyperkalsemia ja ortostaattisen hypotension vaara. Lisäksi saattaa esiintyä pahoinvointia, oksentelua, huimausta ja päänsärkyä. Kauppaantulonjälkeisiin spontaaniraportteihin perustuva yliannostuskokemus Kauppaantulonjälkeisissä spontaaniraporteissa on ilmoitettu tapauksia, joissa koko teriparatidikynän sisältö (jopa 800 mikrog.) on pistetty erehdyksessä yhtenä annoksena. Ohimenevinä haittavaikutuksina ilmoitettiin pahoinvointia, heikkoutta/letargiaa ja verenpaineen laskua. Joissakin tapauksissa haittavaikutuksia ei ilmennyt yliannostuksen seurauksena. Kuolemantapauksia ei ole raportoitu yliannostukseen liittyen. Yliannostuksen hoito FORSTEOlle ei ole spesifistä antidoottia. Epäillyn yliannostuksen hoitoon tulee sisällyttää seuraavat toimet: FORSTEO-lääkityksen tilapäinen lopettaminen, seerumin kalsiumpitoisuuden seuranta sekä asianmukaisten tukitoimien, kuten nesteytyksen aloittaminen. 5. FARMAKOLOGISET OMINAISUUDET 5.1 Farmakodynamiikka Farmakoterapeuttinen ryhmä: kalsiumtasapainoon vaikuttavat valmisteet, lisäkilpirauhasen hormonit ja analogit, ATC-koodi: H05AA02. 6
7 Vaikutusmekanismi Endogeeninen 84-aminohaponlisäkilpirauhashormoni (PTH) on luustossa ja munuaisissa tapahtuvan kalsium- ja fosfaattimetabolian ensisijainen säätelijä. FORSTEO (rhpth(1-34)) on ihmisen endogeenisen lisäkilpirauhashormonin aktiivinen fragmentti (1-34). PTH:n fysiologisiin vaikutuksiin kuuluu se, että se stimuloi luunmuodostusta vaikuttamalla suoraan luuta muodostaviin soluihin (osteoblasteihin), jolloin kalsiumin imeytyminen suolistosta lisääntyy epäsuorasti ja kalsiumin tubulaarinen reabsorptio sekä fosfaatineritys munuaisissa lisääntyvät. Farmakodynaamiset vaikutukset FORSTEO on osteoporoosin hoitoon tarkoitettu luunmuodostukseen vaikuttava lääke. FORSTEOn luustovaikutukset riippuvat systeemisen altistuksen luonteesta. Kerran vuorokaudessa otettuna FORSTEO lisää uuden luun kerroskasvua trabekulaarisilla ja kortikaalisilla luupinnoilla stimuloimalla enemmän osteoblastien kuin osteoklastien toimintaa. Kliininen teho ja turvallisuus Riskitekijät Erilliset riskitekijät, kuten esimerkiksi matala luun mineraalitiheys, ikä, aikaisemmat murtumat, suvussa todetut lonkkaluun murtumat, nopea luun aineenvaihdunta ja matala kehon painoindeksi tulisi ottaa huomioon, jotta voidaan tunnistaa ne naiset ja miehet, joilla on suurentunut riski saada osteoporoottisia murtumia ja jotka voisivat hyötyä hoidosta. Premenopausaaliset naiset, joilla on glukokortikoidihoidon aiheuttama osteoporoosi, ovat vaarassa saada luunmurtumia, jos heillä on jo murtuma tai jos heillä on murtumille altistavien riskitekijöiden kasauma (esim. jos heidän luuntiheytensä on pieni [esim. T-score -2], heitä on hoidettu pitkään suuriannoksisella glukokortikoidilla [esim. 7,5 mg/vrk ainakin 6 kuukauden ajan], heillä on aktiivinen tausta sairaus tai matalat sukuhormonipitoisuudet). Postmenopausaalinen osteoporoosi Ydintutkimukseen osallistui 1637 postmenopausaalista naista (keski-ikä 69,5 vuotta). Potilaista 90 %:lla oli lähtötilanteessa yksi tai useampia nikamamurtumia ja kehon painoindeksi oli keskimäärin 0,82 g/cm 2 (vastaa T-score -2,6). Kaikki potilaat saivat 1000 mg kalsiumia ja vähintään 400 IU D- vitamiinia vuorokaudessa. Enimmillään 24 kuukautta kestäneen FORSTEO-hoitojakson (mediaanikesto 19 kuukautta) tulokset osoittavat murtumien vähenemän olevan tilastollisesti merkitsevä (Taulukko 1). Jotta saatiin ehkäistyksi vähintään yksi uusi nikamanmurtuma, oli hoidettava 11 naista hoitoajan mediaanin ollessa 19 kuukautta. Taulukko 1 Murtumien insidenssi postmenopausaalisilla naisilla: Plasebo (N=554) (%) FORSTEO (N=541) (%) Suhteellinen riski (95 % CI) vs. plasebo Uusi nikamanmurtuma ( 1) a 14,3 5,0 b 0,35 (0,22; 0,55) Useita nikamanmurtumia ( 2) a 4,9 1,1 b 0,23 (0,09; 0,60) Nikaman ulkopuolisia pienienergisiä murtumia c 5,5 % 2,6 % d 0,47 (0,25; 0,87) Merkittäviä nikaman ulkopuolisia pienienergisiä murtumia c (lonkka, värttinäluu, olkaluu, kylkiluut ja lantio) Lyhenteiden selitykset: N = potilasmäärä, joka satunnaistettiin jokaiseen hoitoryhmään. CI = luottamusväli 3,9 % 1,5 % d 0,38 (0,17; 0,86) 7
8 a. Nikamamurtumien esiintyvyys; 448 potilasta plaseboryhmässä ja 444 potilasta Forsteo-ryhmässä. Näiltä potilailta otettiin sekä lähtötasolla että seurannassa selkärangan röntgenkuva. b. p 0,001 verrattuna plaseboon c. lonkkamurtumien esiintyvyydessä ei ole osoitettu merkitsevää pienenemistä. d. p 0,025 verrattuna plaseboon. Luun mineraalitiheys (BMD) oli suurentunut merkitsevästi, kun hoidon keston mediaani oli 19 kuukautta, tällöin lannerangan BMD oli suurentunut 9 % ja lonkan 4 % plaseboon nähden (p < 0,001). Hoidon jälkeinen taudin hallinta: FORSTEO-hoidon jälkeen 1262 postmenopausaalista ydintutkimukseen osallistunutta naista jatkoivat seurantatutkimuksessa. Tutkimuksen pääasiallinen tarkoitus oli kerätä turvallisuustietoja FORSTEO-valmisteesta. Tämän havainnointijakson aikana potilaat saivat käyttää muita osteoporoosihoitoja, ja nikamamurtumista tehtiin lisäarviointeja. FORSTEO-hoidon lopettamista seuranneena aikana, jonka mediaani oli 18 kuukautta uusien nikamamurtumien vähenemä oli FORSTEOta saaneilla naisilla 41 % (p=0,004) plaseboa saaneisiin verrattuna. Avoimessa tutkimuksessa FORSTEO-valmisteella hoidettiin 24 kuukauden ajan 503 naista, joilla oli vaikea osteoporoosi ja pienienerginen murtuma edeltävien 3 vuoden aikana (tutkittavista 83 % oli saanut aikaisemmin hoitoa osteoporoosiin). 24 kuukauden kohdalla keskimääräinen luuntiheys oli suurentunut lähtötilanteesta lannerangassa 10,5 %, lonkassa 2,6 % ja reisiluun kaulassa 3,9 %. Keskimääräinen luuntiheyden suureneminen aikavälillä 18 kuukaudesta 24 kuukauteen oli lannerangassa 1,4 %, lonkassa 1,2 % ja reisiluun kaulassa 1,6 %. Miesten osteoporoosi 437 hypogonadaalista (aamulla mitattu alhainen vapaa testosteroni tai suurentuneet FSH- tai LH-arvot) tai idiopaattista osteoporoosia sairastavaa miestä otettiin mukaan kliiniseen tutkimukseen. Miesten keskimääräinen ikä oli 58,7 vuotta. Lähtötasolla selkärangan ja reisiluun mineraalitiheydet keskimääräisinä T-score-lukuina olivat selkärangasta mitattuna -2,2 ja reisiluun kaulasta mitattuna - 2,1. Lähtötasolla 35 %:lla potilaista oli nikamamurtumia ja 59 %:lla nikaman ulkopuolisia murtumia. Kaikki potilaat saivat 1000 mg kalsiumia ja vähintään 400 IU D-vitamiinia vuorokaudessa. Lannerangan BMD lisääntyi merkitsevästi kolmen kuukauden kuluttua. Kahdentoista kuukauden jälkeen lannerangan luun mineraalipitoisuus oli lisääntynyt 5 % ja lonkan 1 % plaseboon verrattuna. Murtumiin ei kuitenkaan voitu osoittaa merkitsevää vaikutusta. Glukokortikoidihoidon aiheuttama osteoporoosi FORSTEOn tehosta on käynnissä 36 kuukauden kestoinen satunnaistettu, kaksoissokkoutettu, kontrolloitu tutkimus, jossa vertailulääkkeenä on alendronaatti 10 mg/vrk. Tutkimuksesta tehtiin välianalyysi 18 kuukauden kohdalla (tutkimuksen kesto 36 kk). Tutkittavat ovat miehiä ja naisia (N=428), joilla on pitkäkestoinen glukokortikoidihoito (vastaten vähintään 5 mg prednisonia ainakin 3 kuukauden ajan). Potilaista 28 %:lla oli ainakin yksi radiologisesti todettu nikamanmurtuma tutkimuksen alussa. Kaikille potilaille tarjottiin päivittäin 1000 mg kalsiumia ja 800 yksikköä D- vitamiinia. Tutkimuksessa oli mukana 277 postmenopausaalista naista, 67 premenopausaalista naista sekä 83 miestä. Tutkimuksen alussa postmenopausaalisten naisten keskimääräinen ikä oli 61 vuotta, heidän keskimääräinen lannerangan T-arvonsa oli -2,7, he käyttivät keskimäärin 7,5 mg:aa prednisonia vastaavaa kortikoidiannosta vuorokaudessa ja 34 %:lla oli ainakin yksi radiologisesti todettu nikamanmurtuma. Premenopausaalisten naisten keskimääräinen ikä oli 37 vuotta, heidän keskimääräinen lannerangan T-arvonsa oli -2,5, he käyttivät keskimäärin 10 mg:aa prednisonia vastaavaa kortikoidiannosta vuorokaudessa ja 9 %:lla oli ainakin yksi radiologisesti todettu nikamanmurtuma. Miesten keskimääräinen ikä oli 57 vuotta, heidän keskimääräinen lannerangan T- arvonsa oli -2,2, he käyttivät keskimäärin 10 mg:aa prednisonia vastaavaa kortikoidiannosta vuorokaudessa ja 24 %:lla oli ainakin yksi radiologisesti todettu nikamanmurtuma. 8
9 Potilaista 69 % oli mukana tutkimuksen 18 kuukauden välianalyysin kohdalla. 18 kuukauden kohdalla FORSTEO oli suurentanut merkitsevästi enemmän lannerangan luun mineraalitiheyttä (7,2 %) kuin alendronaatti (3,4 %) (p< 0,001). FORSTEO suurensi lonkan mineraalitiheyttä enemmän (3,6 %) kuin alendronaatti (2,2 %) (p< 0,01), ja samoin reisiluun kaulan mineraalitiheyttä enemmän (3,7 %) kuin alendronaatti (2,1 %) (p< 0,05). Teriparatidilla hoidetuilla potilailla luuntiheys suureni aikavälillä 18 kuukaudesta 24 kuukauteen lannerangassa 1,7 %, lonkassa 0,9 % ja reisiluun kaulassa 0,4 %. 36 kuukauden kohdalla selkärangan röntgenkuvien analyysissä havaittiin alendronaattia saaneista 169 potilaasta 13:lla (7,7 %:lla) uusi selkänikaman murtuma, kun taas FORSTEO-ryhmän 173 potilaasta uusi selkänikaman murtuma havaittiin kolmella potilaalla (1,7 %), (p=0,01). Lisäksi 15 potilasta 214:sta alendronaattia saaneesta potilaasta (7,0 %) oli saanut nikamanulkopuolisen murtuman, vastaavasti 214 potilaan FORSTEO-ryhmässä oli 16 nikamanulkopuolista murtumaa (7,5 %) (p=0,84). FORSTEO-lääkettä käyttäneillä premenopausaalisilla naisilla luun mineraalitiheys suureni tutkimuksen alusta 18 kuukauden loppuarvioon merkitsevästi enemmän kuin alendronaattia käyttäneillä sekä lannerangassa (4,2 % vs. -1,9 %; p< 0,001) että koko lonkassa (3,8 % vs. 0,9 %; p= 0,005). Kuitenkaan ei osoitettu merkitsevää vaikutusta murtumien määrään. 5.2 Farmakokinetiikka Jakautuminen Jakautumistilavuus on noin 1,7 l/kg. FORSTEOn puoliintumisaika on noin yksi tunti, kun sitä annetaan ihon alle, ja se heijastaa aikaa, joka kuluu imeytymiseen pistoskohdasta. Biotransformaatio FORSTEOn metaboliaa ja erittymistä koskevia tutkimuksia ei ole tehty, mutta PTH:n perifeerisen metabolian uskotaan tapahtuvan pääosin maksassa ja munuaisissa. EliminaatioFORSTEO eliminoituu maksan ja maksanulkoisen puhdistuman kautta (naisilla noin 62 l/h ja miehillä 94 l/h). Iäkkäät potilaat FORSTEOn farmakokinetiikassa ei todettu eroja iän suhteen (vaihteluväli vuotta). Annoksen muuttaminen iän perusteella ei ole tarpeen. 5.3 Prekliiniset tiedot turvallisuudesta Teriparatidi ei ollut genotoksinen missään standarditesteissä. Teriparatidi ei vaikuttanut teratogeenisesti rottiin, hiiriin eikä kaneihin. Tiineille rotille tai hiirille annettu päivittäinen teriparatidin mikrog/kg annos ei aiheuttanut oleellisia vaikutuksia. Kuitenkin tiineillä kaneilla vuorokausiannoksen ollessa mikrog/kg ilmeni sikiöiden resorptiota ja pesuekoko pieneni. Kaneilla havaittu alkiotoksisuus saattaa liittyä siihen, että kani on huomattavasti herkempi PTH:n vaikutuksille veren ionisoituun kalsiumiin kuin jyrsijät. Rotilla, joita hoidettiin lähes niiden koko eliniän päivittäisillä injektioilla, esiintyi annoksesta riippuvaa ylivilkasta luunmuodostusta sekä osteosarkoomainsidenssin lisääntymistä, joka johtuu todennäköisesti epigeneettisestä mekanismista. Teriparatidi ei lisännyt muuntyyppisten kasvainten insidenssiä rotalla. Koska rotan ja ihmisen luuston fysiologiassa on eroja, näiden löydösten kliininen merkitys on todennäköisesti pieni. Apinoilla, joiden munasarjat oli poistettu, luukasvaimia ei havaittu hoitoa18 kuukauden ajan saaneilla eikä 3 vuoden seuranta-aikana hoidon lopettamisen jälkeen. Osteosarkoomia ei myöskään ole havaittu kliinisissä tutkimuksissa eikä hoidon jälkeisissä seurantatutkimuksissa. Eläintutkimukset ovat osoittaneet, että vaikeasti heikentynyt maksan verenvirtaus vähentää PTH:n altistumista sen pääasialliselle pilkkoutumisjärjestelmälle (Kupffer-solut) ja pienentää siten myös PTH(1-84):n puhdistumaa. 9
10 6. FARMASEUTTISET TIEDOT 6.1 Apuaineet Väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli, kloorivetyhappo (ph:n säätö), natriumhydroksidi (ph:n säätö), injektionesteisiin käytettävä vesi. 6.2 Yhteensopimattomuudet Koska yhteensopimattomuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa. 6.3 Kestoaika 2 vuotta. Kemiallinen, fysikaalinen ja mikrobiologinen käytönaikainen säilyvyys on osoitettu 28 päivälle 2 8 C:ssa. Avaamisen jälkeen kynää voidaan käyttää enintään 28 päivää, jos sitä säilytetään 2 8 C:ssa. Muut säilytysajat ja -olosuhteet käytön aikana ovat käyttäjän vastuulla. 6.4 Säilytys Säilytä aina jääkaapissa (2 C 8 C). Pane kynä takaisin jääkaappiin heti käytön jälkeen. Ei saa jäätyä. Älä säilytä kynää siten, että neula on siinä kiinni. 6.5 Pakkaustyyppi ja pakkauskoot 2,4 ml liuosta sylinteriampullissa (silikonoitu tyypin I lasi), jossa on mäntä (halobutyylikumia), kiekkosuljin (polyisopreeni/bromobutyylikumilaminaatti) ja muotoonpuristettu (alumiini) korkki kertakäyttökynässä. FORSTEOn pakkauskoot ovat yksi tai kolme kynää. Yksi kynä sisältää 28 kpl 20 mikrogramman annosta/80 mikrolitraa. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. 6.6 Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet FORSTEO-lääke on esitäytetyssä injektiokynässä. Kynä on tarkoitettu potilaskohtaiseen käyttöön. Jokaisella pistämiskerralla on käytettävä uutta steriiliä neulaa. Jokaisessa FORSTEO-pakkauksessa on käyttäjän opas, jossa kuvataan kynän käyttö. Valmisteen mukana ei toimiteta neuloja. Kynässä voidaan käyttää insuliinikynän neuloja. FORSTEO-kynä on säilytettävä aina jääkaapissa. FORSTEOta ei tule käyttää jos liuos on samea, värjäytynyt tai siinä on hiukkasia. Kynän käyttöohjeet ovat myös käyttäjän oppaassa. Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. 10
11 7. MYYNTILUVAN HALTIJA Eli Lilly Nederland B.V, Grootslag 1-5, NL-3991 RA Houten, Alankomaat 8. MYYNTILUVAN NUMERO EU/1/03/247/ MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ/UUDISTAMISPÄIVÄMÄÄRÄ Myyntiluvan myöntämispäivämäärä 10. kesäkuuta 2003 Viimeisimmän uudistamisen päivämäärä 10. kesäkuuta TEKSTIN MUUTTAMISPÄIVÄMÄÄRÄ Lisätietoa tästä lääkevalmisteesta on Euroopan lääkeviraston verkkosivuilla 11
12 LIITE II A. BIOLOGISEN VAIKUTTAVAN AINEEN VALMISTAJA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTAJA B. TOIMITTAMISEEN JA KÄYTTÖÖN LIITTYVÄT EHDOT TAI RAJOITUKSET C. MYYNTILUVAN MUUT EHDOT JA EDELLYTYKSET D. EHDOT TAI RAJOITUKSET, JOTKA KOSKEVAT LÄÄKEVALMISTEEN TURVALLISTA JA TEHOKASTA KÄYTTÖÄ 12
13 A BIOLOGISEN VAIKUTTAVAN AINEEN VALMISTAJA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTAJA Biologisen vaikuttavan aineen valmistajan nimi ja osoite Boehringer-Ingelheim RCV GmbH & Co KG, Dr.-Boehringer-Gasse 5-11, 1121 Wien, Itävalta Erän vapauttamisesta vastaavann valmistajan nimi ja osoite Lilly France S.A., Rue du colonel Lilly, Fegersheim, Ranska B. TOIMITTAMISEEN JA KÄYTTÖÖN LIITTYVÄT EHDOT TAI RAJOITUKSET Reseptilääke C. MYYNTILUVAN MUUT EHDOT JA EDELLYTYKSET Määräaikaiset turvallisuuskatsaukset Myyntiluvan haltijan on toimitettava tätä valmistetta koskevat määräaikaiset turvallisuuskatsaukset niiden vaatimusten mukaisesti, jotka on esitetty unionin viitepäivien luettelossa (EURD-luettelo), josta säädetään direktiivin 2001/83/EY 107c artiklan 7 kohdassa ja joka julkaistaan Euroopan lääkealan verkkoportaalissa. D. EHDOT TAI RAJOITUKSET, JOTKA KOSKEVAT LÄÄKEVALMISTEEN TURVALLISTA JA TEHOKASTA KÄYTTÖÄ Riskinhallintasuunnitelma (RMP) Myyntiluvan haltijan on suoritettava vaaditut lääketurvatoimet ja interventiot myyntiluvan moduulissa esitetyn sovitun riskinhallintasuunnitelman sekä mahdollisten sovittujen riskinhallintasuunnitelman myöhempien päivitysten mukaisesti. Päivitetty RMP tulee toimittaa Euroopan lääkeviraston pyynnöstä kun riskinhallintajärjestelmää muutetaan, varsinkin kun saadaan uutta tietoa, joka saattaa johtaa hyöty-riskiprofiilin merkittävään muutokseen, tai kun on saavutettu tärkeä tavoite (lääketurvatoiminnassa tai riskien minimoinnissa). Jos määräaikaisen turvallisuuskatsauksen toimittaminen ja riskinhallintasuunnitelman päivitys osuvat samaan aikaan, ne voidaan toimittaa samanaikaisesti. Päivitetty riskinhallintasuunnitelma tulee toimittaa kolmen vuoden välein. 13
14 LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 14
15 A. MYYNTIPÄÄLLYSMERKINNÄT 15
16 ULKOPAKKAUKSESSA ON OLTAVA SEURAAVAT MERKINNÄT KOTELON TEKSTI 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi 2. VAIKUTTAVA(T) AINE(ET) Yksi ml sisältää 250 mikrogrammaa teriparatidia 3. LUETTELO APUAINEISTA Väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli, injektionesteisiin käytettävä vesi. Valmisteeseen on voitu lisätä kloorivetyhappoa ja/tai natriumhydroksidia (ph:n säätöön). 4. LÄÄKEMUOTO JA SISÄLLÖN MÄÄRÄ Injektioneste, liuos. 1esitäytetty kynä 2,4 ml esitäytetty kynä 3 x 2,4 ml Kynä sisältää 28 annosta, yhdessä annoksessa on 20 mikrogrammaa (/80 mikrolitraa) 5. ANTOTAPA JA TARVITTAESSA ANTOREITTI (ANTOREITIT) Lue pakkausseloste ennen käyttöä. Ihon alle 6. ERITYISVAROITUS VALMISTEEN SÄILYTTÄMISESTÄ POIS LASTEN ULOTTUVILTA Ei lasten ulottuville eikä näkyville. 7. MUU ERITYISVAROITUS (MUUT ERITYISVAROITUKSET), JOS TARPEEN Avataan nostamalla ja repäisemällä tästä. 8. VIIMEINEN KÄYTTÖPÄIVÄMÄÄRÄ Käyt. viim. {KK/VVVV} Kynä tulee hävittää 28 päivän kuluttua ensimmäisestä käyttökerrasta. Ensimmäinen käyttöpvm. 9. ERITYISET SÄILYTYSOLOSUHTEET Säilytä jääkaapissa. Ei saa jäätyä. 10. ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMIEN LÄÄKEVALMISTEIDEN TAI NIISTÄ PERÄISIN OLEVAN JÄTEMATERIAALIN HÄVITTÄMISEKSI, JOS TARPEEN 16
17 11. MYYNTILUVAN HALTIJAN NIMI JA OSOITE Eli Lilly Nederland B.V. Grootslag 1-5, NL-3991 RA Houten Alankomaat 12. MYYNTILUVAN NUMERO(T) EU/1/03/247/001 tai EU/1/03/247/ ERÄNUMERO Lot 14. YLEINEN TOIMITTAMISLUOKITTELU Reseptilääke. 15. KÄYTTÖOHJEET 16. TIEDOT PISTEKIRJOITUKSELLA FORSTEO 17
18 PIENISSÄ SISÄPAKKAUKSISSA ON OLTAVA VÄHINTÄÄN SEURAAVAT MERKINNÄT ETIKETIN TEKSTI 1. LÄÄKEVALMISTEEN NIMI JA TARVITTAESSA ANTOREITTI (ANTOREITIT) FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste Teriparatidi Ihon alle 2. ANTOTAPA 3. VIIMEINEN KÄYTTÖPÄIVÄMÄÄRÄ EXP 4. ERÄNUMERO Lot 5. SISÄLLÖN MÄÄRÄ PAINONA, TILAVUUTENA TAI YKSIKKÖINÄ 2,4 ml 6. MUUTA Säilytä jääkaapissa 18
19 B. PAKKAUSSELOSTE 19
20 Pakkausseloste: Tietoa käyttäjälle FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen. - Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla. - Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen, vaikka kokemiasi haittavaikutuksia ei olisikaan mainittu tässä pakkausselosteessa. Katso kohta 4. Tässä pakkausselosteessa kerrotaan: 1. Mitä FORSTEO on ja mihin sitä käytetään 2. Mitä sinun on tiedettävä, ennen kuin käytät FORSTEO-valmistetta 3. Miten FORSTEO-valmistetta käytetään 4. Mahdolliset haittavaikutukset 5. FORSTEO-valmisteen säilyttäminen 6. Pakkauksen sisältö ja muuta tietoa 1. Mitä FORSTEO on ja mihin sitä käytetään FORSTEO sisältää vaikuttavana aineena teriparatidia, joka vahvistaa luuta ja vähentää murtumavaaraa edistämällä luun muodostusta. FORSTEO on tarkoitettu aikuisten osteoporoosin hoitoon. Osteoporoosi on sairaus, joka aiheuttaa luiden ohenemista ja haurastumista. Tämä tauti on erityisen yleinen vaihdevuosi-iän ohittaneilla naisilla, mutta sitä voi ilmetä myös miehillä. Osteoporoosia esiintyy myös usein potilailla, jotka käyttävät kortikosteroidivalmisteita (kortisonia). 2. Mitä sinun on tiedettävä, ennen kuin käytät FORSTEO-valmistetta Älä käytä FORSTEO-valmistetta jos olet allerginen teriparatidille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6) jos veresi kalsiumpitoisuus on suuri (sinulla on hyperkalsemia) jos sinulla on vakavia munuaisvaivoja jos sinulla on ollut luusyöpä tai muu syöpä, joka on levinnyt luustoon (etäpesäkkeitä luustossa) tiettyjen luusairauksien yhteydessä. Jos sinulla on jokin luuston sairaus, kerro se lääkärillesi jos sinulla on selittämätön, suurentunut alkalisen fosfataasin arvo. Tämä voi viitata sinulla mahdollisesti olevaan Pagetin luutautiin (sairaus, jossa luun muodostuminen on häiriintynyt). Jos et ole varma, kysy lääkäriltäsi. jos olet saanut sädehoitoa luustoon jos olet raskaana tai imetät. Varoitukset ja varotoimet FORSTEO voi aiheuttaa suurentuneen kalsiumpitoisuuden veressä tai virtsassa. Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät tai kun käytät FORSTEOvalmistetta: 20
21 jos sinulla on jatkuvaa pahoinvointia, oksentelua, ummetusta, vetämättömyyttä tai lihasheikkoutta. Nämä voivat olla oireita veren liian suuresta kalsiumpitoisuudesta. jos sinulla on tai on ollut munuaiskiviä. jos sinulla on munuaisvaivoja (kohtalainen munuaisten vajaatoiminta). Joillekin potilaille FORSTEO voi aiheuttaa huimausta tai sydämen tykytystä muutaman ensimmäisen pistoksen jälkeen. Ota FORSTEO-pistos ensimmäisillä kerroilla sellaisessa paikassa, että voit istua tai mennä pitkäksesi, jos saat huimausta. Suositeltua 24 kuukauden hoitoaikaa ei pidä ylittää. FORSTEO-valmistetta ei tule antaa aikuisille, jotka voivat vielä kasvaa. Lapset ja nuoret FORSTEO-valmistetta ei tule antaa lapsille tai nuorille (alle 18-vuotiaille). Muut lääkevalmisteet ja FORSTEO Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat joutua käyttämään muita lääkkeitä, koska niillä voi joskus olla yhteisvaikutuksia (esim. digoksiini/digitalis -valmisteet, joita käytetään sydäntaudeissa). Raskaus ja imetys Älä käytä FORSTEO-valmistetta, jos olet raskaana tai imetät. Jos olet hedelmällisessä iässä oleva nainen, sinun on käytettävä luotettavaa raskauden ehkäisymenetelmää FORSTEO-lääkityksen aikana. Jos tulet raskaaksi, FORSTEO on lopetettava. Kysy lääkäriltäsi tai apteekista neuvoa ennen minkään lääkkeen käyttöä. Ajaminen ja koneiden käyttö Joillekin potilaille FORSTEO-pistos voi aiheuttaa huimausta. Jos sinua huimaa, älä aja autoa äläkä käytä koneita ennen kuin olosi paranee. Tärkeää tietoa FORSTEO-lääkkeen sisältämistä aineista Tämä lääke sisältää alle yhden millimoolin natriumia (23 mg) yhdessä annoksessa. Näin ollen se on käytännöllisesti natriumvapaa. 3. Miten FORSTEO-valmistetta käytetään Käytä tätä lääkettä juuri siten kuin lääkärisi on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on 20 mikrogrammaa kerran vuorokaudessa pistoksena ihon alle (ihonalainen injektio) reiteen tai vatsan alueelle. Jotta muistat ottaa lääkkeesi, ota se suunnilleen samaan aikaan joka päivä. Ota FORSTEO-pistos joka päivä niin pitkään kuin lääkärisi on sinulle määrännyt. FORSTEO-hoidon kesto on 24 kuukautta. Voit saada elinaikanasi vain yhden 24 kuukauden FORSTEO-hoidon. FORSTEO voidaan pistää ruokailun yhteydessä. Lue pakkauksessa oleva käyttäjän opas, jotta osaat käyttää FORSTEO-kynää. Injektioneuloja ei ole lääkepakkauksessa. Becton Dickinson and Company -yhtiön neuloja (BD) kooltaan G (läpimitta 0,25 0,33 mm) ja pituus 12,7 mm, 8 mm tai 5 mm voidaan käyttää. Pistä FORSTEO pian sen jälkeen, kun olet ottanut kynän jääkaapista. Noudata käyttäjän oppaan ohjeita. Pane kynä takaisin jääkaappiin heti käytön jälkeen. Käytä joka pistokerralla uutta neulaa ja hävitä neula käytön jälkeen. Älä koskaan säilytä kynää niin, että neula on siinä kiinni. Älä anna koskaan muiden käyttää kynääsi. 21
22 Lääkärisi voi määrätä sinulle FORSTEO-pistoksen lisäksi kalsium- ja/tai D-vitamiinilisiä. Lääkärisi kertoo sinulle, kuinka paljon kalsiumia ja D-vitamiinia voit ottaa päivässä. FORSTEO voidaan ottaa ruokailun yhteydessä tai ilman ruokaa. Jos otat enemmän FORSTEO-valmistetta kuin sinun pitäisi Jos olet vahingossa ottanut enemmän FORSTEO-lääkettä kuin olisi pitänyt, ota yhteyttä lääkäriin tai apteekkiin. Yliannostuksen oireina voi ilmetä pahoinvointia, oksentelua, heitehuimausta ja päänsärkyä. Jos unohdat ottaa FORSTEO-pistoksen tai jos et pysty ottamaan pistosta tavanomaiseen aikaan, ota se mahdollisimman pian saman päivän aikana. Ota vain yksi pistos päivässä. Älä yritä korvata unohtunutta annosta. Jos lopetat FORSTEOn käytön Jos harkitset FORSTEOn käytön lopettamista, keskustele asiasta lääkärisi kanssa. Lääkärisi neuvoo sinua ja päättää FORSTEO-lääkityksesi kestosta. Jos sinulla on kysyttävää tämän lääkkeen käytöstä, käänny lääkärisi tai apteekkihenkilökunnan puoleen. 4. Mahdolliset haittavaikutukset Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan saa niitä. Yleisimpiä haittavaikutuksia ovat raajoissa ilmenevä kipu (hyvin yleinen, esiintyy yli 1 potilaalla 10:stä) sekä huonovointisuus, päänsärky ja heitehuimaus (yleisiä haittavaikutuksia). Jos sinua alkaa huimata pistoksen ottamisen jälkeen, istu tai asetu makuulle, kunnes olosi paranee. Jos olosi ei parane, soita lääkärille ennen hoidon jatkamista. Teriparatidin käytön yhteydessä on ilmoitettu pyörtymistapauksia. Joillekin voi tulla oireilua kuten ihon punoitusta, kipua, turvotusta, kutinaa, mustelma tai vähäistä verenvuotoa pistosalueella (yleisiä haittavaikutuksia). Niiden pitäisi hävitä muutamassa päivässä tai viikossa. Jos näin ei tapahdu, kerro asiasta lääkärillesi mahdollisimman pian. Joillakin potilailla on pian pistoksen jälkeen ilmennyt yliherkkyysoireita kuten hengitysvaikeuksia, kasvojen turvotusta, ihottumaa ja rintakipua (harvinaisia haittavaikutuksia). Harvinaisissa tapauksissa voi esiintyä vakavia ja mahdollisesti henkeä uhkaavia allergisia reaktioita, kuten anafylaksiaa. Muita haittavaikutuksia: Yleiset haittavaikutukset: esiintyy korkeintaan 1 potilaalla 10:sta veren kolesterolipitoisuuden suurentuminen masennus hermosärkyä jaloissa pyörryttäminen epäsäännölliset sydämenlyönnit hengenahdistus lisääntynyt hikoilu lihaskouristukset vetämättömyys väsymys rintakipu matala verenpaine närästys (kipeä tai polttava tunne rintalastan alla) pahoinvointi (oksentelu) 22
23 palleatyrä matala hemoglobiini eli punasolujen määrä (anemia). Melko harvinaiset haittavaikutukset: esiintyy korkeintaan1 potilaalla 100:sta sykkeen kiihtyminen epätavallinen sydänääni hengästyminen peräpukamat virtsan karkaaminen lisääntynyt virtsaamistarve painon nousu munuaiskivet lihas- ja nivelkipu. Joillekin potilaille on ilmaantunut vaikeita selkälihaskouristuksia (kramppeja) tai kipua, jotka ovat vaatineet sairaalahoitoa. suurentunut veren kalsiumpitoisuus suurentunut veren virtsahappopitoisuus. alkalinen fosfataasi -nimisen entsyymin (AFOS) arvon suurentumista. Harvinaiset haittavaikutukset: esiintyy korkeintaan 1 potilaalla 1 000:sta eriasteinen munuaisten vajaatoiminta turvotus lähinnä käsissä, jalkaterissä ja säärissä Haittavaikutuksista ilmoittaminen Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista liitteessä V* luetellun kansallisen ilmoitusjärjestelmän kautta. Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta. 5. Forsteo-valmisteen säilyttäminen Ei lasten ulottuville eikä näkyville. Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen (Käyt.viim./EXP). Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää. FORSTEO säilytetään jääkaapissa (2 C 8 C) ennen avaamista ja käytön aikana. FORSTEOvalmistetta voidaan käyttää enintään 28 päivän ajan ensimmäisen pistokerran jälkeen, jos kynää on säilytetty jääkaapissa (2 C 8 C). FORSTEO ei saa jäätyä. Älä pane kyniä jääkaapin pakastelokeron lähelle, jotta ne eivät jäädy. Älä käytä FORSTEO-valmistetta, jos se on jäätynyt. FORSTEO-kynä tulee hävittää asianmukaisesti 28 päivän kuluttua, vaikka se ei olisi täysin tyhjä. FORSTEO sisältää väritöntä ja kirkasta liuosta. Älä käytä FORSTEOta, jos liuoksessa on kiinteitä hiukkasia tai jos se on samea tai värjäytynyt. Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy apteekista käyttämättömien lääkkeiden hävittämisestä. Näin menetellen suojelet luontoa. 6. Pakkauksen sisältö ja muuta tietoa Mitä FORSTEO sisältää 23
24 - Vaikuttava aine on teriparatidi. Yksi millilitra injektionestettä sisältää 250 mikrogrammaa teriparatidia. - Muut aineet ovat väkevä etikkahappo, natriumasetaatti (vedetön), mannitoli, metakresoli ja injektionesteisiin käytettävä vesi. Liuokseen on voitu lisätä myös kloorivetyhappoa ja/tai natriumhydroksidia happamuuden säätöön. Lääkevalmisteen kuvaus ja pakkauskoot FORSTEO on väritön ja kirkas liuos. Se toimitetaan sylinteriampulleihin pakattuna esitäytetyssä injektiokynässä, joka hävitetään, kun se on tyhjä. Yhdessä kynässä on 2,4 ml liuosta, josta riittää 28 annokseen. Kynät toimitetaan yhden tai kolmen kynän pakkauksissa. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. Myyntiluvan haltija Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Alankomaat. Valmistaja Lilly France S.A.S., Rue du Colonel Lilly, Fegersheim, Ranska. Lisätietoja tästä lääkkeestä antaa myyntiluvan haltijan paikallinen edustaja. België/Belgique/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0) България ТП "Ели Лили Недерланд" Б.В. - България тел Česká republika ELI LILLY ČR, s.r.o. Tel: Danmark Eli Lilly Danmark A/S Tlf: Deutschland Lilly Deutschland GmbH. Tel (0) Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: Ελλάδα ΦΑΡΜΑΣΕΡΒ-ΛΙΛΛΥ Α.Ε.Β.Ε. Τηλ: España Elanco Valquímica, S.A. Tel: France Lilly France SAS Tél: + 33-(0) Lietuva Eli Lilly Holdings Limited atstovybė Tel (5) Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0) Magyarország Lilly Hungária Kft. Tel: Malta Charles de Giorgio Ltd. Tel: Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) Norge Eli Lilly Norge A.S. Tlf: Österreich Eli Lilly Ges. m.b.h. Tel: + 43-(0) Polska Eli Lilly Polska Sp. z o.o. Tel.: + 48 (0) Portugal Lilly Portugal - Produtos Farmacêuticos, Lda. Tel:
25 Hrvatska Eli Lilly Hrvatska d.o.o. Tel: Ireland Eli Lilly and Company (Ireland) Limited. Tel: (0) Ísland Icepharma hf. Sími: Italia Eli Lilly Italia S.p.A. Tel: Κύπρος Phadisco Ltd Τηλ: Latvija Eli Lilly Holdings Limited pārstāvniecība Latvijā Tel: România Eli Lilly România S.R.L. Tel: Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: (0) Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: (0) Sverige Eli Lilly Sweden AB Tel: + 46-(0) United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) Tämä pakkausseloste on tarkistettu viimeksi: Lisätietoja tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta Tämä pakkausseloste on saatavilla kaikilla EU/ETA alueen kielillä Euroopan lääkeviraston verkkosivuilla. 25
26 INJEKTIOKYNÄN KÄYTTÖOPAS Forsteo FORSTEO, 20 mikrogrammaa / 80 mikrolitraa, injektioneste, liuos esitäytetyssä injektiokynässä. Käyttöohjeet Lue Käyttöohjeet kokonaan läpi ennen kuin otat käyttöön uuden injektiokynän. Noudata ohjeita huolellisesti, kun käytät injektiokynääsi. Lue myös injektiokynän pakkauksessa oleva seloste. Ethän anna kenenkään muun käyttää injektiokynääsi tai neulojasi, koska tartuntataudit voivat levitä niiden kautta. Injektiokynä sisältää 28 päivän lääkityksen. Forsteo -injektiokynän osat* Musta pistospainike Keltainen varsi Punainen raita Sininen runko-osa Lääkesäiliö Valkoinen korkki Suojapaperi Neula Neulan ulkosuojus Neulan sisäsuojus * Neulat eivät sisälly pakkaukseen. Voit käyttää Becton Dickinson and Company -yhtiön (BD) G kynäneuloja (halkaisija 0,25 0,33 mm), joiden pituus on joko 12,7 mm, 8 mm tai 5 mm. Kysy lääkäriltä tai hoitajalta, minkä pituiset ja paksuiset neulat sopivat sinulle parhaiten. Pese kädet aina ennen kuin käytät injektiokynää. Valmistele pistoskohta lääkärin tai hoitajan ohjeiden mukaisesti. 1 Poista valkoinen korkki 2 Kiinnitä injektiokynään uusi neula Poista suojapaperi. Paina neula suoraan kiinni lääkesäiliöön. Kierrä neula tiukasti paikoilleen. Poista neulan ulkosuojus ja säilytä se. 26
27 3 Valitse annos Punainen raita Neulan sisäsuojus 4 Pistä annos Vedä musta pistospainike kokonaan ulos. Jos mustan pistospainikkeen ulos vetäminen ei onnistu, ks. Ongelmanratkaisu, ongelma E. Varmista, että punainen raita näkyy. Poista neulan sisäsuojus ja heitä se pois. 5 Tarkista, että sait lääkeannoksen Nipistä reiden tai vatsan ihoa kevyesti poimulle ja työnnä neula suoraan ihoon. TÄRKEÄÄ Lääkkeen pistämisen jälkeen: Vedettyäsi neulan ihosta tarkista, että musta pistospainike on painettu pohjaan. Jos injektiokynän keltaista vartta ei näy, olet pistänyt lääkkeen oikein. Paina musta pistospainike pohjaan. Pidä pistospainike alas painettuna ja laske h-i-ta-a-s-t-i viiteen. Vedä sitten neula ihosta. Injektiokynän keltaisen varren EI pitäisi jäädä näkyviin. Jos se kuitenkin jää näkyviin ja olet jo ehtinyt pistää lääkkeen, älä ota samana päivänä enää toista pistosta. FORSTEOinjektiokynä TÄYTYY kuitenkin valmistella taas käyttökuntoon (ks. Ongelmanratkaisu, ongelma A). 6 Irrota neula Neulan ulkosuojus Pane neulan ulkosuojus takaisin paikoilleen. Irrota neula injektiokynästä kiertämällä neulan ulkosuojusta 3 5 kierrosta. Vedä neula irti ja hävitä se lääkärin tai hoitajan ohjeiden mukaisesti. Napsauta valkoinen korkki paikoilleen. Pane FORSTEOinjektiokynä jääkaappiin välittömästi käytön jälkeen. Neulojen käsittelyohjeiden ei ole tarkoitus korvata paikallisia terveydenhuollon ammattilaisen antamia ohjeita tai laitoksen käytäntöjä. 27
28 Forsteo FORSTEO, 20 mikrogrammaa / 80 mikrolitraa, injektioneste, liuos esitäytetyssä injektiokynässä. Ongelma A. Painoin mustan pistospainikkeen alas, mutta keltainen varsi jäi silti näkyviin. Miten valmistelen FORSTEOinjektiokynän taas käyttökuntoon? Ongelmanratkaisu Ratkaisu FORSTEO-injektiokynä valmistellaan käyttökuntoon seuraavasti: 1) Jos olet jo ehtinyt pistää lääkkeen, ÄLÄ ota samana päivänä enää toista pistosta. 2) Irrota neula injektiokynästä. 3) Kiinnitä injektiokynään uusi neula. Poista neulan ulkosuojus ja pane se talteen. 4) Vedä musta pistospainike kokonaan ulos. Varmista, että punainen raita näkyy kunnolla. 5) Poista neulan sisäsuojus ja heitä se pois. 6) Suuntaa neula alaspäin johonkin tyhjään astiaan. Paina musta pistospainike pohjaan. Pidä pistospainike alas painettuna ja laske h-it-a-a-s-t-i viiteen. Neulankärjestä saattaa tulla ohut suihku tai pieni pisara nestettä. Kun nesteen tulo lakkaa, mustan pistospainikkeen pitäisi olla pohjaan painettuna. 7) Jos injektiokynän keltainen varsi on edelleen näkyvissä, ota yhteys lääkäriin tai hoitajaan. 8) Pane neulan ulkosuojus takaisin paikoilleen. Irrota neula injektiokynästä kiertämällä neulansuojusta 3 5 kierrosta. Vedä suojus neuloineen irti ja hävitä se lääkärin tai hoitajan ohjeiden mukaisesti. Napsauta valkoinen korkki paikoilleen ja pane FORSTEO-injektiokynä jääkaappiin. Voit estää tämän ongelman käyttämällä jokaiseen pistokseen UUTTA neulaa, painamalla mustan pistospainikkeen pohjaan ja laskemalla h-i-t-a-a-st-i viiteen. B. Mistä tiedän, että FORSTEOinjektiokynäni toimii kunnolla? FORSTEO-injektiokynä on suunniteltu antamaan täysi annos joka kerta, kun sitä käytetään Käyttöohjeiden mukaan. Olet saanut täyden FORSTEO-annoksen, jos musta pistospainike on painettu pohjaan. Muista käyttää jokaiseen pistokseen uutta neulaa, jotta FORSTEO-injektiokynäsi toimii varmasti kunnolla. C. FORSTEOinjektiokynässäni on ilmakupla. Pieni ilmakupla ei vaikuta annokseen eikä vahingoita sinua. Voit ottaa annoksen normaalisti. D. Neula ei irtoa. 1) Pane neulan ulkosuojus paikoilleen. 2) Neula irrotetaan neulan ulkosuojuksen avulla. 3) Irrota neula injektiokynästä kiertämällä 28
29 neulan ulkosuojusta 3 5 kierrosta. 4) Jos neula ei vieläkään irtoa, pyydä apua. E. Entä jos mustan pistospainikkeen ulos vetäminen ei onnistu? Vaihda FORSTEO-injektiokynä uuteen ja ota annos lääkärin tai hoitajan ohjeiden mukaisesti. Olet käyttänyt tämän lääkkeen loppuun. Lääkesäiliössä mahdollisesti jäljellä oleva lääketilkka ei riitä tarkkaan annosteluun. Puhdistus ja säilytys FORSTEO-injektiokynän puhdistus Pyyhi FORSTEO-injektiokynä kostealla liinalla. Älä upota injektiokynää veteen äläkä puhdista sitä millään nestemäisellä pesuaineella. FORSTEO-injektiokynän säilytys Pane FORSTEO-injektiokynä välittömästi jääkaappiin jokaisen käyttökerran jälkeen. Tutustu Pakkausselosteen ohjeisiin kynäsi säilytyksestä ja noudata niitä. Älä koskaan säilytä FORSTEO-injektiokynää neula kiinnitettynä, sillä tällöin kynänsäiliöön voi muodostua ilmakuplia. Napsauta injektiokynän valkoinen korkki paikoilleen säilytyksen ajaksi. Älä koskaan säilytä FORSTEO-injektiokynää pakastimessa. Jos lääke on päässyt jäätymään, vaihda FORSTEO-injektiokynä uuteen. Jos FORSTEO-injektiokynä on unohtunut huoneenlämpöön, älä heitä sitä pois. Pane injektiokynä takaisin jääkaappiin ja ota yhteys lääkäriin, hoitajaan tai apteekkiin. Kynäneulojen ja injektiokynän hävittäminen Kynäneulojen ja FORSTEO-injektiokynän hävittäminen Muista aina irrottaa neula ennen kuin heität FORSTEO-injektiokynän pois. Hävitä injektiokynä ja käytetyt neulat lääkärin tai hoitajan ohjeiden mukaisesti. Hävitä injektiokynä 28 päivän kuluttua ensimmäisestä käyttökerrasta. Muita tärkeitä tietoja Injektiokynä sisältää 28 päivän FORSTEO-lääkityksen. Älä siirrä lääkettä kynästä injektioruiskuun. Merkitse ensimmäisen pistoksen ottamispäivä kalenteriin. Tutustu Pakkausselosteen ohjeisiin lääkkeen käytöstä ja noudata niitä. Tarkista injektiokynän etiketistä, että olet ottamassa oikeaa lääkettä eikä se ole vanhentunutta. Ota yhteys lääkäriin tai hoitajaan, jos huomaat seuraavia ongelmia: - FORSTEO-injektiokynä näyttää vaurioituneelta - FORSTEO-liuos EI ole kirkasta ja väritöntä, tai siinä näkyy hiukkasia. Käytä jokaiseen pistokseen uutta neulaa. Pistämisen aikana injektiokynästä saattaa kuulua naksahduksia. Tämä on täysin normaalia. FORSTEO-injektiokynää ei suositella sokeiden tai näkövammaisten käyttöön ilman kynän käyttöön perehtyneen henkilön apua. Pidä FORSTEO-injektiokynä poissa lasten ulottuvilta ja näkyviltä. Eli Lilly and Company -yhtiölle valmistanut: Lilly France, F Fegersheim, Ranska. Tämä käyttöopas päivitettiin viimeksi 29
PAKKAUSSELOSTE. FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi
 PAKKAUSSELOSTE FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä.
 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos sisältää 20 mikrogrammaa teriparatidia. Yksi
1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos sisältää 20 mikrogrammaa teriparatidia. Yksi
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 3 ml:n esitäytetty kynä
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI FORSTEO 20 mikrogrammaa/80 mikrolitraa, injektioneste, liuos esitäytetyssä kynässä. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 3 ml:n esitäytetty kynä
KYNÄN KÄYTTÄJÄN OPAS Byetta 5 mikrogrammaa injektioneste, liuos, esitäytetyssä injektiokynässä (eksenatidi)
 KYNÄN KÄYTTÄJÄN OPAS Byetta 5 mikrogrammaa injektioneste, liuos, esitäytetyssä injektiokynässä (eksenatidi) KÄYTTÄJÄN OPPAAN SISÄLLYSLUETTELO Luku 1 MITÄ SINUN TULEE TIETÄÄ BYETTA-KYNÄSTÄSI Luku 2 UUDEN
KYNÄN KÄYTTÄJÄN OPAS Byetta 5 mikrogrammaa injektioneste, liuos, esitäytetyssä injektiokynässä (eksenatidi) KÄYTTÄJÄN OPPAAN SISÄLLYSLUETTELO Luku 1 MITÄ SINUN TULEE TIETÄÄ BYETTA-KYNÄSTÄSI Luku 2 UUDEN
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
PAKKAUSSELOSTE. Prolia 60 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. XGEVA 120 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE. CIALIS 10 mg kalvopäällysteinen tabletti tadalafiili
 PAKKAUSSELOSTE CIALIS 10 mg kalvopäällysteinen tabletti tadalafiili Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE CIALIS 10 mg kalvopäällysteinen tabletti tadalafiili Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
NOBIVAC RABIES VET. Adjuvantti: Alumiinifosfaatti (2 %) 0,15 ml (vastaten alumiinifosfaattia 3 mg)
 VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Equilis West Nile injektioneste, suspensio hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttava aine: Inaktivoitu
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Equilis West Nile injektioneste, suspensio hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttava aine: Inaktivoitu
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Purevax Rabies injektioneste, suspensio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: Rabies rekombinantti canarypox-virus
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Purevax Rabies injektioneste, suspensio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: Rabies rekombinantti canarypox-virus
Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONS
 Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONSVÆSKE, OPLØSNING I FYLDT PEN 250 mikrogram/mikrogrammaa
Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONSVÆSKE, OPLØSNING I FYLDT PEN 250 mikrogram/mikrogrammaa
Lääkäri tai sairaanhoitaja opettaa sinulle, kuinka pistät esitäytetyssä ruiskussa olevan ORENCIAannoksen
 Ohjeet ORENCIA-pistoksen valmisteluun ja antoon ihon alle: Lue nämä ohjeet huolellisesti läpi, ja noudata ohjeita vaihe kerrallaan. Lääkäri tai sairaanhoitaja opettaa sinulle, kuinka pistät esitäytetyssä
Ohjeet ORENCIA-pistoksen valmisteluun ja antoon ihon alle: Lue nämä ohjeet huolellisesti läpi, ja noudata ohjeita vaihe kerrallaan. Lääkäri tai sairaanhoitaja opettaa sinulle, kuinka pistät esitäytetyssä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Metronidatsoli 0,75 paino-%, 7,5 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
Pakkausseloste: Tietoa potilaalle. Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas)
 Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO. Ruiskeina annettavien jauheiden, konsentraattien ja liuosten liuottamiseen ja laimentamiseen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
PAKKAUSSELOSTE ProMeris paikallisvaleluliuos kissoille
 PAKKAUSSELOSTE ProMeris paikallisvaleluliuos kissoille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
PAKKAUSSELOSTE ProMeris paikallisvaleluliuos kissoille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
OPAS KOTIPISTOSHOITOON
 OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
PAKKAUSSELOSTE. ZOSTAVAX Injektiokuiva-aine ja liuotin, suspensiota varten esitäytetyssä ruiskussa vyöruusurokote (herpes zoster), elävä
 PAKKAUSSELOSTE ZOSTAVAX Injektiokuiva-aine ja liuotin, suspensiota varten esitäytetyssä ruiskussa vyöruusurokote (herpes zoster), elävä Lue tämä pakkausseloste huolellisesti, ennen kuin sinut rokotetaan
PAKKAUSSELOSTE ZOSTAVAX Injektiokuiva-aine ja liuotin, suspensiota varten esitäytetyssä ruiskussa vyöruusurokote (herpes zoster), elävä Lue tämä pakkausseloste huolellisesti, ennen kuin sinut rokotetaan
Veterelin vet 4 mikrog/ml injektioneste, liuos naudalle, hevoselle, sialle ja kanille
 1. ELÄINLÄÄKKEEN NIMI Veterelin vet 4 mikrog/ml injektioneste, liuos naudalle, hevoselle, sialle ja kanille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra injektionestettä sisältää: Vaikuttava
1. ELÄINLÄÄKKEEN NIMI Veterelin vet 4 mikrog/ml injektioneste, liuos naudalle, hevoselle, sialle ja kanille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra injektionestettä sisältää: Vaikuttava
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
PAKKAUSSELOSTE Dicural 15 mg päällystetyt tabletit koiralle Dicural 50 mg päällystetyt tabletit koiralle
 PAKKAUSSELOSTE Dicural 15 päällystetyt tabletit koiralle Dicural 50 päällystetyt tabletit koiralle Dicural 100 päällystetyt tabletit koiralle Dicural 150 päällystetyt tabletit koiralle 1. MYYNTILUVAN HALTIJAN
PAKKAUSSELOSTE Dicural 15 päällystetyt tabletit koiralle Dicural 50 päällystetyt tabletit koiralle Dicural 100 päällystetyt tabletit koiralle Dicural 150 päällystetyt tabletit koiralle 1. MYYNTILUVAN HALTIJAN
PAKKAUSSELOSTE. Actos 15 mg tabletti Pioglitatsoni
 PAKKAUSSELOSTE Actos 15 mg tabletti Pioglitatsoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Actos 15 mg tabletti Pioglitatsoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
VALMISTEYHTEENVETO. Neste- ja elektrolyyttihukka esim. leikkauksen, trauman tai palovammojen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO. Yksi tippa silmän sidekalvopussiin 4 kertaa päivässä tai tarpeen mukaan tilan vaikeusasteesta riippuen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia 20 mg (2 %).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO. Akrivastiinia ei pidä määrätä potilaille, joiden munuaistoiminta on merkittävästi heikentynyt.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
PAKKAUSSELOSTE. Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani
 PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
VALMISTEYHTEENVETO. Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu). 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 0,5
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu). 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 0,5
PAKKAUSSELOSTE. Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa
 PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
Annosta tulee muuttaa eläimillä, joilla on munuaisten tai maksan vajaatoiminta, koska haittavaikutusriski on suurentunut.
 1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
VALMISTEYHTEENVETO. Vero-soluissa kasvatetut poliovirukset tyyppi 1 (Brunhilde), tyyppi 2 (MEF-1) ja tyyppi 3 (Saukett) on puhdistettu ja inaktivoitu.
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI VeroPol Injektioneste, liuos, esitäytetty ruisku. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos = 0,5 ml: Poliovirus tyyppi 1, inaktivoitu Poliovirus tyyppi
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI VeroPol Injektioneste, liuos, esitäytetty ruisku. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos = 0,5 ml: Poliovirus tyyppi 1, inaktivoitu Poliovirus tyyppi
1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.1 Käyttöaiheet. 4.2 Annostus ja antotapa
 1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4, injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4, injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
VALMISTEYHTEENVETO. Shampoo Viskoosi liuos, joka on väriltään kirkkaan oljenkeltainen tai vaaleanoranssi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO. Lievän tai kohtalaisen vaikean polven nivelrikon oireiden lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Täydellisen parenteraalisen ravitsemuksen täydennyksenä vesiliukoisten vitamiinien päivittäisen tarpeen tyydyttämiseksi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI. Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
PAKKAUSSELOSTE. Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
VALMISTEYHTEENVETO. Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
Pakkausseloste: Tietoa potilaalle. Baraclude 0,05 mg/ml oraaliliuos entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO. Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500 mg:aa kalsiumia.
 1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
a. asettaa sinulle määrätyn annoksen b. varmistaa koko pistoksen antamisen c. nähdä toisella kynällä pistettävän lisäannoksen.
 FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml Bruksanvisning Käyttöohjeet Brugervejledning FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml ESITÄYTETTY GONAL F-KYNÄ 300 IU/0,5 ml FYLDT PEN 300 IE/0,5 ml Sisällysluettelo
FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml Bruksanvisning Käyttöohjeet Brugervejledning FÖRFYLLD INJEKTIONSPENNA 300 IE/0,5 ml ESITÄYTETTY GONAL F-KYNÄ 300 IU/0,5 ml FYLDT PEN 300 IE/0,5 ml Sisällysluettelo
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Zenapax 5 mg/ml infuusiokonsentraatti Daklitsumabi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla
PAKKAUSSELOSTE Zenapax 5 mg/ml infuusiokonsentraatti Daklitsumabi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO. Valmisteen kuvaus: pyöreä, merkintä BEPANTHEN kehässä, halkaisija n. 18 mm, paksuus n. 3,5 mm, harmaankeltainen, sitruunan tuoksu.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
1. ELÄINLÄÄKKEEN NIMI. Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
Pakkausseloste: Tietoa potilaalle. Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
Pakkausseloste: Tietoa potilaalle Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen tai melkein valkoinen talkkimainen jauhe.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
PAKKAUSSELOSTE. Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit. Rivastigmiini
 PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
KÄYTTÄJÄN OPAS. Yksityiskohtainen käyttöoppaasi. BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten
 KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
Pakkausseloste: Tietoa käyttäjälle. Desloratadine Actavis 5 mg kalvopäällysteiset tabletit desloratadiini
 Pakkausseloste: Tietoa käyttäjälle Desloratadine Actavis 5 mg kalvopäällysteiset tabletit desloratadiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Desloratadine Actavis 5 mg kalvopäällysteiset tabletit desloratadiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
VALMISTEYHTEENVETO. 1 kalvopäällysteinen tabletti sisältää kalsiumkarbonaattia vastaten 500 mg kalsiumia. Täydellinen apuaineluettelo, ks. kohta 6.
 1. LÄÄKEVALMISTEEN NIMI Kalcipos 500 mg tabletti, kalvopäällysteinen VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kalvopäällysteinen tabletti sisältää kalsiumkarbonaattia vastaten 500 mg
1. LÄÄKEVALMISTEEN NIMI Kalcipos 500 mg tabletti, kalvopäällysteinen VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kalvopäällysteinen tabletti sisältää kalsiumkarbonaattia vastaten 500 mg
1. ELÄINLÄÄKKEEN NIMI. Porceptal Vet 4 mikrog/ml injektioneste, liuos sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. 1 ml injektionestettä sisältää:
 1. ELÄINLÄÄKKEEN NIMI Porceptal Vet 4 mikrog/ml injektioneste, liuos sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Busereliiniasetaatti 4,2 mikrog (vastaten
1. ELÄINLÄÄKKEEN NIMI Porceptal Vet 4 mikrog/ml injektioneste, liuos sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Busereliiniasetaatti 4,2 mikrog (vastaten
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ditebooster Injektioneste, suspensio, esitäytetyissä ruiskuissa. Kurkkumätä- ja jäykkäkouristusrokote (adsorboitu, vähennetty antigeenimäärä) 2. VAIKUTTAVAT AINEET
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ditebooster Injektioneste, suspensio, esitäytetyissä ruiskuissa. Kurkkumätä- ja jäykkäkouristusrokote (adsorboitu, vähennetty antigeenimäärä) 2. VAIKUTTAVAT AINEET
VALMISTEYHTEENVETO. Liialliseen kaasunmuodostukseen liittyvät mahan ja suoliston vaivat
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Equilis injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Annos (1 ml) sisältää: Vaikuttava(t) aine(et) Hevosen influenssaviruksien
LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Equilis injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Annos (1 ml) sisältää: Vaikuttava(t) aine(et) Hevosen influenssaviruksien
PAKKAUSSELOSTE. Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos
PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos
Ennen käyttöä. Käytön jälkeen
 Tärkeät käyttöohjeet. Lue huolellisesti. KUINKA KÄYTETÄÄN ORENCIA-VALMISTETTA (abatasepti) ClickJect esitäytetty kynä 125 mg, injektioneste, liuos ihon alle Lue nämä ohjeet ennen kuin käytät ClickJect
Tärkeät käyttöohjeet. Lue huolellisesti. KUINKA KÄYTETÄÄN ORENCIA-VALMISTETTA (abatasepti) ClickJect esitäytetty kynä 125 mg, injektioneste, liuos ihon alle Lue nämä ohjeet ennen kuin käytät ClickJect
PAKKAUSSELOSTE. Baraclude 0,05 mg/ml oraaliliuos Entekaviiri
 PAKKAUSSELOSTE Baraclude 0,05 mg/ml oraaliliuos Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla on lisäkysymyksiä,
PAKKAUSSELOSTE Baraclude 0,05 mg/ml oraaliliuos Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla on lisäkysymyksiä,
VALMISTEYHTEENVETO. Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia, joka vastaa 2,68 mg bentsydamiinia.
 1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
PAKKAUSSELOSTE. Neulasta 6 mg injektioneste, liuos esitäytetyssä ruiskussa pegfilgrastiimi
 PAKKAUSSELOSTE Neulasta 6 mg injektioneste, liuos esitäytetyssä ruiskussa pegfilgrastiimi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE Neulasta 6 mg injektioneste, liuos esitäytetyssä ruiskussa pegfilgrastiimi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
 1. ELÄINLÄÄKKEEN NIMI Ancesol 10 mg/ml injektioneste, liuos, naudoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Kloorifenamiinimaleaatti (vastaa 7,03 mg kloorifenamiinia)
1. ELÄINLÄÄKKEEN NIMI Ancesol 10 mg/ml injektioneste, liuos, naudoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Kloorifenamiinimaleaatti (vastaa 7,03 mg kloorifenamiinia)
VALMISTEYHTEENVETO. Huom. Emätinpuikko tulee työntää syvälle emättimeen, ei mielellään kuukautisten aikana.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Valmistetta ei saa antaa kanille, marsulle, hamsterille, gerbiilille eikä muille pienille jyrsijöille.
 1. ELÄINLÄÄKKEEN NIMI Amovet vet 150 mg/ml injektioneste, suspensio VALMISTEYHTEENVETO 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Amoksisilliinitrihydraatti (172,1 mg) vastaten
1. ELÄINLÄÄKKEEN NIMI Amovet vet 150 mg/ml injektioneste, suspensio VALMISTEYHTEENVETO 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Amoksisilliinitrihydraatti (172,1 mg) vastaten
PAKKAUSSELOSTE. Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
Yksi annos sisältää 200 IU kalsitoniinia (lohen synteettinen), missä yksi IU vastaa 0,167 mikrog vaikuttavaa ainetta.
 1. LÄÄKEVALMISTEEN NIMI Miacalcic Nasal 200 IU/annos nenäsumute, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos sisältää 200 IU kalsitoniinia (lohen synteettinen), missä yksi IU vastaa 0,167 mikrog
1. LÄÄKEVALMISTEEN NIMI Miacalcic Nasal 200 IU/annos nenäsumute, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos sisältää 200 IU kalsitoniinia (lohen synteettinen), missä yksi IU vastaa 0,167 mikrog
VALMISTEYHTEENVETO. Yksi 8,5 ml ampulli sisältää 1 mg terlipressiiniasetaattia, vastaten 0,85mg terlipressiiniä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GLYPRESSIN 1 mg injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 8,5 ml ampulli sisältää 1 mg terlipressiiniasetaattia, vastaten 0,85mg terlipressiiniä.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GLYPRESSIN 1 mg injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 8,5 ml ampulli sisältää 1 mg terlipressiiniasetaattia, vastaten 0,85mg terlipressiiniä.
TIETOA POTILAALLE. Tietoa teil e, joil e on määrätty Suliqua-lääkitys
 Finska TIETOA POTILAALLE Tietoa teil e, joil e on määrätty Suliqua-lääkitys Olemme kirjoittaneet tämän esitteen teille, joilla on diabetes ja joille lääkäri on määrännyt Suliqua-lääkityksen (glargiini-insuliini+liksisenatidi).
Finska TIETOA POTILAALLE Tietoa teil e, joil e on määrätty Suliqua-lääkitys Olemme kirjoittaneet tämän esitteen teille, joilla on diabetes ja joille lääkäri on määrännyt Suliqua-lääkityksen (glargiini-insuliini+liksisenatidi).
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
PAKKAUSSELOSTE. Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta
 PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
