PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA
|
|
|
- Sakari Salminen
- 6 vuotta sitten
- Katselukertoja:
Transkriptio
1 versio Palveluvalikoimaneuvoston perustelumuistio PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA
2 versio Sisällys 1. Taustaa, perusteet suosituksen laatimiseen Aiheen määrittely ja rajaus Kysymyksenasettelu; terveysongelma-interventio-parin muotoilu Terveysongelman vakavuus Aihetta koskevat selvitykset ja suositukset Selvitys/Fimean arviointiraportti tms Kotimaiset hoitosuositukset ja selvitykset Ulkomaiset hoitosuositukset ja selvitykset Intervention sisällöstä Vaihtoehdot interventiolle Terveysongelman ja intervention käytön yleisyys Intervention vaikuttavuus Intervention turvallisuus Intervention kustannukset ja budjettivaikutukset Intervention kustannusvaikuttavuus Eettinen tarkastelu Poikkeaminen palveluvalikoimasta Lisänäytön kerääminen ja suositusten vaikutusten seuranta Johtopäätökset Palkon suositus Liite 1. Suosituksen valmistelun vaiheet Liite 2. Lähteet... 15
3 Perustelumuistioluonnos 1(19) 1. Taustaa, perusteet suosituksen laatimiseen Pertutsumabi on sairaalassa käytettävä lääke, jolla on kolme erillistä käyttöaihetta HER2-positiivisen rintaysövän hoitoon. Tämä suositus koskee uusinta (v. 2018) käyttöaiheen laajennusta eli pertutsumabin käyttöä varhaisvaiheen HER2-positiivisen rintasyövän liitännäishoidossa. Pertutsumabin kuulumisesta terveydenhuollon palveluvalikoimaan tässä käyttöaiheessa ei ole annettu aiempaa Palkon suositusta. Palkon suositus perustuu Fimean tuottamaan arviointikoosteeseen (Hyvärinen ym. 2018). Yksi Fimean tehtävistä on tuottaa ja koota lääkehoitojen hoidollisen ja taloudellisen arvon arviointeja ja koordinoida tätä koskevaa yhteistyötä (Laki Lääkealan turvallisuus- ja kehittämiskeskuksesta 593/2009). Terveydenhuollon palveluvalikoimaneuvoston tehtävänä on antaa suosituksia siitä, mitkä palvelut kuuluvat terveydenhuollon palveluvalikoimaan (Terveydenhuoltolaki 1202/2013). 2. Aiheen määrittely ja rajaus 2.1. Kysymyksenasettelu; terveysongelma-interventio-parin muotoilu Terveysongelma Interventio Varhaisvaiheen HER2-positiivinen rintasyöpä. Pertutsumabia voidaan käyttää varhaisvaiheen HER2-positiivisen rintasyövän adjuvanttihoitona eli leikkauksen jälkeisenä liitännäishoitona aikuispotilaille, joilla taudin uusiutumisriski on suuri. Valmisteyhteenvedon mukaan suuri uusiutumisriski tarkoittaa HER2- positiivista syöpää, joka on levinnyt imusolmukkeisiin tai jossa kasvain on hormonireseptorinegatiivinen. Pertutsumabi annetaan yhdessä trastutsumabin ja solunsalpaajahoidon kanssa. 3. Terveysongelman vakavuus Rintasyöpä on naisten yleisin syöpä Suomessa. Rintasyövän ikävakioitu ilmaantuvuus on 2,3-kertaistunut viimeisten 40 vuoden aikana. Vuonna 2015 uusia rintasyöpiä diagnosoitiin henkilöllä, joista miehiä oli 30 ja naisia Rintasyöpään kuoli vuonna 2015 yhteensä 841 naista. Rintasyöpäkasvaimista arviolta 15 % tai hieman vähemmän on HER2- positiivisia.
4 Perustelumuistioluonnos 2(19) Valtaosalla potilaista (n. 90 %) syöpä löydetään varhain, eikä diagnoosihetkellä todeta etäpesäkkeitä. Varhaisen vaiheen rintasyövällä tarkoitetaan ei-metastasoitunutta, primaarista, invasiivista rinnan syöpäkasvainta, jossa voi olla paikallisesti etäpesäkkeitä kainalon alueen imusolmukkeissa. Varhaisvaiheen rintasyöpäpotilailla hoidon tavoite on parantuminen syövästä. HER2-positiivisella rintasyövällä tarkoitetaan sellaista syöpäkasvainta, jonka soluissa todetaan tavallista enemmän HER2- kasvutekijäreseptoreita. HER2-positiivisten rintasyöpien uusiutumisriski luokitellaan korkeaksi, ja liitännäislääkehoito (adjuvanttihoito) annetaan siksi syöpäleikkauksen jälkeen lähes kaikille HER2-positiivisista syöpää sairastaville potilaille. Varhaisvaiheen liitännäislääkehoitojen tavoitteena on pienentää syövän uusiutumisriskiä. Erityisesti halutaan ehkäistä etäpesäkkeisen taudin kehittymistä, koska nimenomaan tämä johtaa potilaan elinajan lyhenemiseen. Syövän uusiutuessa etäpesäkkeisenä parantava hoito ei tyypillisesti ole enää mahdollista. Tällöin keskitytään potilaan taudin etenemisen hidastamiseen ja sitä kautta potilaan elinajan pidentämiseen sekä elämän laadun parantamiseen. 4. Aihetta koskevat selvitykset ja suositukset a. Selvitys/Fimean arviointiraportti tms. Palkon suositus perustuu Fimean tuottamaan arviointikoosteeseen (Hyvärinen ym. 2018). b. Kotimaiset hoitosuositukset ja selvitykset Suomen Rintasyöpäryhmä ry on päivittänyt rintasyövän hoitosuosituksen keväällä 2018, jolloin pertutsumabilla ei vielä ollut käyttöaihetta HER2-positiivisen varhaisvaiheen rintasyövän liitännäishoitoon. Suosituksessa ei oteta kantaa pertutsumabin käyttöön tässä käyttöaiheessa. Varhaisvaiheen HER2-positiivisen rintasyövän liitännäishoitona annetaan suomalaisen hoitosuosituksen mukaan 6 8 sykliä solunsalpaajaa kolmen viikon välein ja trastutsumabi-hoitoa yhden vuoden kestoisena. Trastutsumabihoidon optimaalista kestoa ei tunneta ja myös lyhyempiä hoitojaksoja (esim. FinHer protokolla: 9 viikkoa yhtä aikaa solunsalpaajahoidon kanssa) käytetään yleisesti. Lisäksi annetaan tarpeen mukaan sädehoitoa ja/tai hormonihoitoa. c. Ulkomaiset hoitosuositukset ja selvitykset
5 Perustelumuistioluonnos 3(19) Eurooppalaisen syöpäjärjestön (European Society for Medical Oncology, ESMO) suositus rintasyövän hoitoon on vuodelta 2015, jolloin pertutsumabilla ei vielä ollut käyttöaihetta HER2-positiivisen varhaisvaiheen rintasyövän liitännäishoitoon (Senkus ym. 2015). ESMO:n viimeisin päivitys rintasyövästä on julkaistu heinäkuussa 2018, mutta se käsittelee edenneen rintasyövän hoitoa (Cardoso ym. 2018). Vasta muutama maa on julkaissut HTA-arviointeja ja niihin perustuvia suosituksia. Taulukkoon 1 on koottu tietoa joistakin maista, joissa arviointi on meneillään. Ruotsi TLV on julkaissut arvioinnin Sen mukaan pertutsumabi ei olisi kustannusvaikuttava. - Perusanalyysi euroa/qaly ( kr/qaly) - Imusolmukepositiivisilla euroa/qaly ( kr/qaly) - HR-negatiivisilla euroa/qaly ( kr/qaly) (Kruunut muutettu euroiksi käyttäen keskikurssia ) /bes_underlag180924_perjeta.pdf NT-rådet on ottanut pertutusumabin kansallisen suosituksen valmisteluun NT-rådet suositteli välttämään pertutsumabin käyttöä varhaisvaiheen rintasyövän adjuvanttihoidossa kunnes kansallinen suositus on valmis /Pertuzumab-(Perjeta)-adjuvant-vid-brostcancer pdf Tanska Tanskan Medicinrådet on julkaissut poisrajaavan suosituksen. Sen mukaan pertutsumabin ja trastutsumabin yhdistelmähoidon hoidollinen lisäarvo ei ole kohtuullisessa suhteessa sen kustannuksiin verrattuna trastutsumabiin yksin käytettynä. Kanada
6 Perustelumuistioluonnos 4(19) Ei suositeltu korvattavuutta, koska lääkkeen nettohyötyä (net benefit) ei pidetty kliinisesti merkityksellisenä. Taulukko 1. Meneillään olevat HTA-arvioinnit ja suositusvalmistelu eräissä muissa maissa. Norja Englanti ja Wales Arviointi on meneillään, valmistumisaikataulusta ei tietoa. Arviointi on meneillään, valmistuu tammikuussa Elokussa 2018 julkaistun alustavan lausunnon mukaan pertutsumabia ei suositella HER2-positiivisen varhaisvaiheen rintasyövän adjuvanttihoitoon Intervention sisällöstä Pertutsumabi on monoklonaalisiin vasta-aineisiin kuuluva syöpälääke, jonka vaikutuskohteena on kasvaimen pinnalla olevan HER2-reseptorin solunulkoinen osa (anti-her2-lääke). Pertutsumabin sitoutuminen reseptoriin estää solunsisäistä signaalinvälitystä. Signalointireittien estyminen voi johtaa solun kasvun pysähtymiseen ja ohjelmoituun solukuolemaan. Pertutsumabi toimii lisäksi vasta-aineriippuvaisen soluvälitteisen sytotoksisuuden (ADCC) välittäjänä. Pertutsumabia käytetään rintasyövän leikkauksen jälkeisenä liitännäishoitona yhdessä trastutsumabin ja solunsalpaajahoidon kanssa. Myös trastutsumabi sitoutuu HER2:een, mutta sen vaikutusmekanismi on erilainen. Pertutsumabin ja trastutsumabin vaikutusmekanismien ajatellaan olevan toisiaan täydentäviä. Trastutsumabia ei siksi ole tarkoituksenmukaista korvata pertutsumabilla, vaan käyttää pertutsumabia lisälääkkeenä yhdistelmässä. Pertutsumabi annostellaan laskimoon kolmen viikon välein. Suositeltu hoidon kesto liitännäishoitona on 18 hoitosykliä eli noin yksi vuosi. 6. Vaihtoehdot interventiolle Pertutsumabipohjaisen liitännäishoidon tärkein vertailuhoito on hoitosuositusten mukainen solunsalpaajien ja trastutsumabin yhdistelmähoito. Solunsalpaajahoidon kesto on suomalaisen hoitosuosituksen mukaan 6 8 hoitosykliä. Trastutsumabi-hoidon suositeltu kesto on yksi vuosi, mutta lyhyempiä, tutkimusnäyttöön perustuvia hoitojaksoja käytetään myös. Trastutsumabi voidaan annostella laskimoon tai ihon alle.
7 Perustelumuistioluonnos 5(19) 7. Terveysongelman ja intervention käytön yleisyys 8. Intervention vaikuttavuus Fimean arvion mukaan pertutsumabi-hoidon mahdollisen kohderyhmän koon arviointiin liittyy huomattavaa epävarmuutta. Uusien rintasyöpäpotilaiden määrä tiedetään varsin tarkasti (reilut tapausta vuosittain). Tarkempaa tietoa ei kuitenkaan ole siitä, kuinka suuri osa näistä potilaista täyttäisi nyt arvioinnin kohteena olevan käyttöaiheen kriteerit ja soveltuisi saamaan pertutsumabia osana liitännäishoitoa. Fimea on arvioinut, että vuosittainen potilasmäärä voisi olla noin 200. Tämä sisältää niiden korkean uusiutumisriskin omaavien potilaiden arvioidun kokonaismäärän, jotka soveltuvat saamaan liitännäishoitona jotakin anti-her2-hoitoa (pertutsumabilla tai ilman) yhdessä solunsalpaajan kanssa. Pertutsumabia mahdollisesti saavien potilaiden määrä voi olla arvioitua pienempi, mikäli osa potilaista saa nykykäytännön mukaisesti vain trastutsumabia ja solunsalpaajaa. Potilasmäärä voi myös olla todellisuudessa Fimean arvioimaa pienempi johtuen siitä, että laskelmassa ei ollut mahdollista huomioida kaikkia hoidon kohderyhmää rajaavia tekijöitä. Esimerkiksi pienellä osalla potilaista kasvain on sen verran pieni ( 5 mm, TNM-luokitus pt1an0), ettei liitännäishoito ole tarpeen. Fimean arviointi perustuu yhteen faasin III satunnaistettuun tutkimukseen (APHINITY), jossa potilaat saivat trastutsumabin ja solunsalpaajan yhdistelmähoitoa ja sen lisäksi pertutsumabia tai lumetta. Tutkimukseen osallistui henkilöä, ja ensisijainen tulosmuuttuja oli elossaoloaika ilman invasiivista tautia (IDFS). Absoluuttinen ero pertutsumabi-ryhmän hyväksi oli 1,7 prosenttiyksikköä. Tutkimusta on kuvattu tarkemmin Fimean arviointiraportissa. Keskeiset tulokset on koottu taulukkoon 2.
8 Perustelumuistioluonnos 6(19) Taulukko 2. Pertutsumabin hoitovaikutukset APHINITY-tutkimuksessa, mediaaniseurantaaika 45,4 kk (EPAR). Pertutsumabi + trastutsumabi + solunsalpaaja N = Ensisijainen päätetapahtuma (potilaita, joilla tapahtuma) Trastutsumabi + solunsalpaaja + lume N = Hasardisuhde (HR) (95 %:n luottamusväli) IDFS N (%) 171 (7,1) 210 (8,7) 0,81 (0,66 1,00) Toissijaiset päätetapahtumat (potilaita, joilla tapahtuma) IDFS-SPNBC N (%) 189 (7,9) 230 (9,6) 0,82 (0,68 0,99) DFS N (%) 192 (8,0) 236 (9,8) 0,81 (0,67 0,98) RFI N (%) 138 (5,8) 173 (7,2) 0,79 (0,63 0,99) OS N (%) 80 (3,3) 89 (3,7) 0,89 (0,66 1,21) DRFI N (%) 119 (5,0) 145 (6,0) 0,82 (0,64 1,04) a IDFS = elossaoloaika ennen invasiivista tautia; IDFS-SPNBC = IDFS + uusi muu primaarisyöpä kuin rintasyöpä; DFS = tauditon elossaoloaika; RFI = taudin uusiutumisvapaa aika; OS = kokonaiselossaoloaika; DRFI = etäpesäkkeiden uusiutumisvapaa aika Ensisijaisia päätetapahtumia (IDFS) oli pertutsumabi-ryhmässä 171 kappaletta ja lumeryhmässä 210 kappaletta. Invasiivisesta taudista vapaiden potilaiden Kaplan-Meier-käyristä estimoitu osuus 4 vuoden kohdalla oli pertutsumabi-hoitoa saaneessa ryhmässä 92,3 % verrattuna lumeryhmän 90,6 %:iin. Absoluuttinen ero pertutsumabi-ryhmän hyväksi oli siis 1,7 prosenttiyksikköä (HR = 0,81; 95 %:n luottamusväli 0,66-1,00; p = 0,045). Etäpesäkkeisenä uusiutuneita tauteja (DRFI) oli pertutsumabi-ryhmässä 119 (5,0 %) ja lumeryhmässä 145 (6,0 %). Kuolema ilman taudin uusiutumista oli ensimmäinen IDFS-tapahtuma 28 potilaalla pertutsumabi-ryhmässä (16 % tapahtumista) ja 26 potilaalla lumeryhmässä (12 % tapahtumista). Seurannan mediaani APHINITY-tutkimuksen arvion aikana oli 45,5 kuukautta. Päätelmiä pertutsumabin vaikutuksista kokonaiselossaoloaikaan (OS) ei ole voitu vielä tehdä, koska seurantaaika tämän päätetapahtuman tutkimiseksi oli liian lyhyt ja tapahtumia liian vähäinen määrä. Elossaolotulosten odotetaan valmistuvan vuonna 2023, jolloin on kulunut 10 vuotta viimeisen tutkimuspotilaan satunnaistamisesta. Potilaiden raportoimassa elämänlaadussa (EORTC QLQ-C30 Global Health Status, EORTC QLQ-C30 Physical Functioning, EQ-5D-kysely) ei esiintynyt merkittäviä eroja eri hoitoa saaneiden ryhmien välillä. Ripulioireita raportoitiin taksaanihoidon (eräs solunsalpaajista) ja anti- HER2-hoidon aikana molemmissa ryhmissä, ja ne olivat kliinisesti merkittäviä ( 10 pisteen muutos alkutilanteesta) erityisesti
9 Perustelumuistioluonnos 7(19) pertutsumabi-ryhmässä. Lyhyen seuranta-ajan vuoksi lääkkeen pitkäaikaisvaikutuksista ole tietoa. APHINITY-tutkimuksen hoitoaiepopulaatio ei vastaa pertutsumabin käyttöaihetta HER2-positiivisen varhaisvaiheen rintasyövän liitännäislääkehoidossa. Käyttöaihetta rajattiin APHINITY-tutkimuksen tulosten perusteella korkean riskin potilaille, eli potilaille, joiden kasvain on imusolmukepositiivinen tai hormonireseptorinegatiivinen. Tulosten mukaan uusiutumisriskin väheneminen korostui niillä pertutsumabia saaneilla potilailla, joilla tauti oli levinnyt imusolmukkeisiin (4 vuoden arvioitu IDFS osuuksien ero 3,2 %; HR 0,77; 95 %:n luottamusväli 0, ). Alaryhmäanalyysin mukaan imusolmukenegatiiviset potilaat eivät todennäköisesti hyödy pertutsumabin lisäämisestä hoitoon. Alaryhmäanalyysien tulokset eivät anna viitteitä siitä, että pertutsumabin suhteellinen teho olisi oleellisesti erilainen hormonireseptoripositiivisten tai -negatiivisten kasvainten hoidossa. Ensisijaisena päätetapahtumana APHINITY-tutkimuksessa käytettiin elossaoloaikaa ilman invasiivista tautia (IDFS). Lopullisena kiinnostuksen kohteena on kuitenkin syöpäpotilaiden elinajan piteneminen, mutta tämän tutkiminen suoraan on epäkäytännöllistä, koska se edellyttäisi huomattavan pitkää seuranta-aikaa ja uusiutuneeseen tautiin annetaan todennäköisesti erilaisia hoitoja. Koska erityisesti etäpesäkkeinen tauti johtaa elinajan lyhentymiseen, olisi etäpesäkkeiden uusiutumisvapaa-aika (APHINITY-tutkimuksessa DRFI) joidenkin asiantuntijoiden mukaan parempi korvikemuuttuja kokonaiselinajalle kuin nyt käytetty IDFS. DRFI- ja IDFS- päätetapahtumat eroavat siinä, että jälkimmäiseen sisällytetään tapahtumiksi syövän paikallinen uusiutuminen, joka voi vielä olla kuratiivisesti hoidettavissa mutta DRFI:aan tätä ei lasketa. DRFI-päätetapahtuman suhteen pertutsumabi-ryhmä ei ole APHINITYtutkimuksessa ainakaan vielä käytettävissä olevalla seuranta-ajalla osoittautunut standardihoitoryhmää merkitsevästi paremmaksi (p = 0,1007). 9. Intervention turvallisuus APHINITY-tutkimuksessa potilaat saivat trastutsumabin ja solunsalpaajan yhdistelmähoitoa ja sen lisäksi pertutsumabia. Vertailuryhmään kuuluvat saivat trastutsumabin ja solunsalpaajan yhdistelmähoitoa ja sen lisäksi lumetta. APHINITY-tutkimuksessa yleisimmät asteen 1 5 haittavaikutukset olivat pahoinvointi, karvojen lähtö (alopecia), ripuli ja uupumus. Näistä haittavaikutuksista ripulia esiintyi pertutsumabia saaneilla yleisemmin
10 Perustelumuistioluonnos 8(19) (71,2 %) verrattuna vertailulääkkeitä saaneiden ryhmään (45,2 %), ja muita haittoja oli suunnilleen yhtä paljon kummassakin hoitohaarassa. APHINITY-tutkimuksen pertutsumabi-ryhmässä 7,0 % potilaista keskeytti pertutsumabin ja vertailuryhmässä 5,8 % keskeytti lumeen haittavaikutuksen vuoksi. (Taulukko 3). Yleisimpiä vakavia (haitta-aste 3) haittavaikutuksia olivat leukopenia, ripuli, limakalvotulehdus, infuusioon liittyvät reaktiot ja ihottuma. Näistä erityisesti ripulia esiintyi pertutsumabi-ryhmässä enemmän (9,8 %) kuin vertailuryhmässä (3,7 %). Vakavaa ripulia esiintyi erityisesti taksaania ja pertutsumabia yhtäaikaisesti (yhdeksän viikon jakso) saaneilla (18 %). Tällä ryhmällä ripulin vaikutus oli nähtävissä myös potilaan raportoimissa elämänlaatumittareissa (EPAR). (Taulukko 3) Haittavaikutuksia on kuvattu tarkemmin esim. pertutsumabin valmisteyhteenvedossa. Taulukko 3. Yleisimmät APHINITY-tutkimuksessa koetut haittavaikutukset (EPAR). Haittavaikutus, % potilaista Pertutsumabi + trastutsumabi + solunsalpaaja N = Trastutsumabi + solunsalpaaja N = Vähintään yksi haitta (aste 1 5) 99,9 % 99,5 % Vähintään yksi haitta (aste 3 5) 64,2 % 57,3 % Vakava haitta 29,3 % 24,3 % Hoidon keskeytykseen johtanut haitta a 13,1 % 11,5 % Pertutsumabin/ lumeen keskeytykseen johtanut haitta 7,0 % 5,8 % Kuolemaan johtanut haitta b 0,8 % 0,8 % Kuolema muusta syystä c 0,3 % 0,5 % Sydänturvallisuus Primaarinen sydäntapahtuma d 0,7 % 0,3 % Sekundaarinen sydäntapahtuma e 2,7 % 2,8 % Asteen 3 seuratut haittavaikutukset, % potilaista Leukopenia 37,3 % 35,0 % Ripuli 9,9 % 3,7 % Limakalvontulehdus 4,9 % 2,3 % Infuusioon liittyvä reaktio 2,7 % 2,1 % Ihottuma 2,5 % 1,5 % a sisältää solunsalpaajajakson; b sisältää sekundaarisyöpien aiheuttamat kuolemat (9 kpl pertutsumabi ja 8 kpl lume); c muusta kuin taudin etenemisestä tai haittavaikutuksesta johtuvat; d NYHA luokan III tai IV tapahtumat ja LVEF:n lasku 10 pistettä alkutilanteesta ja alle 50 %:n, tai sydänkuolema; e NYHA luokan II tapahtumat ja LVEF:n lasku 10 pistettä alkutilanteesta ja alle 50 %:n
11 Perustelumuistioluonnos 9(19) 10. Intervention kustannukset ja budjettivaikutukset Keskimääräiset lääkekustannukset potilasta kohden vuoden liitännäishoidossa ovat euroa, kun potilas saa pertutsumabin, trastutsumabin ja solunsalpaajan yhdistelmähoitoa. Trastutsumabin ja solunsalpaajan yhdistelmähoidossa kustannukset ovat vastaavasti euroa eli pertutsumabin lisäämisestä aiheutuvat kustannukset ovat keskimäärin euroa potilasta kohti. Mikäli 200 potilasta Suomessa vuosittain saisi trastutsumabi- ja solunsalpaajahoidon lisäksi myös pertutsumabia, vuosittainen lisäkustannus olisi noin 9,3 miljoonaa euroa verrattuna siihen, että pertutsumabia ei käytetä tässä käyttöaiheessa. Potilasmäärän arviointiin liittyy huomattavaa epävarmuutta. Kustannukset on ilmoitettu verottomin tukkuhinnoin (ns. listahinta) huomioimatta mahdollisia sairaalakohtaisissa hintaneuvotteluissa sovittavia alennuksia. Kustannusten arvioinnissa ei myöskään ole huomioitu tänä vuonna myyntiluvan saaneiden trastutsumabin biosimilaarien vaikutusta lääkehintoihin. 11. Intervention kustannusvaikuttavuus Fimean raportissa ei ole arvioitu pertutsumabin liitännäishoitoon lisäämisen kustannusvaikuttavuutta. NICE on julkaissut alustavia tuloksia pertutsumabi-hoidon kustannusvaikuttavuusanalyyseista. Näiden perusteella pertutsumabihoito varhaisvaiheen HER2-positiivisen rintasyövän liitännäislääkkeenä ei vaikuta kustannusvaikuttavalta huolimatta hoidon kohdentamisesta suuren uusiutumisriskin potilaisiin sekä ehdotetusta hallitun käyttöönoton sopimuksesta. (Hyvärinen ym. 2018) (Kustannusvaikuttavuustietoja löytyy myös muiden maiden HTAarvioinneista, ks. kohta 4). 12. Eettinen tarkastelu Oikeudenmukaisuus Yhteiskunnassa rajalliset voimavarat pyritään jakamaan oikeudenmukaisesti terveydenhuoltopalveluja tarvitsevien kesken. Tärkeää on taata yhtäläinen käyttömahdollisuus yhtäläisessä tarpeessa
12 Perustelumuistioluonnos 10(19) Hyvän tekeminen ja vahingon välttäminen oleville. Tästä seuraa että hoitoon käytettävät kustannukset voivat ja saavat vaihdella potilasryhmien välillä. Terveydenhuollon kulloinkin käytettävissä olevat voimavarat voidaan käyttää vaihtoehtoisilla tavoilla terveyshyötyjen aikaan saamiseksi. Rajalliset voimavarat tulisi käyttää niin, että niillä saataisiin mahdollisimman paljon terveyshyötyä. Jos terveydenhuollon voimavarat käytetään hoitomenetelmiin, joiden kustannukset saavutettuihin hyötyihin nähden ovat korkeat, menetetään ne terveyshyödyt, jotka vastaavalla voimavarojen käytöllä muissa tilanteissa saataisiin. Seuranta-ajan lyhyyden vuoksi pertutsumabin lisäämisen vaikutuksista varhaisvaiheen HER2-positiivisten rintasyöpäpotilaiden kokonaiselossaoloaikaan (OS) ei voida vielä tehdä päätelmiä, ja päätelmiin pidemmänkin seuranta-ajan jälkeen liittyy epävarmuutta. Suurempi osa pertutsumabia saaneista potilaista kuin standardihoitoryhmässä hoidetuista oli elossa ja ilman invasiivista syöpää 4 vuoden seurannan kohdalla (4 vuoden arvioitu IDFS-osuus). Absoluuttinen ero syövän uusiutumisen riskissä oli 1,7 % pertutsumabin hyväksi. Pertutsumabin lisäkustannukset nostaisivat lääkehoidon kustannukset yli kaksinkertaisiksi. Hoitoon liittyvät riskit tulee suhteuttaa hoidettavan sairauden vakavuuteen ja siihen liittyviin riskeihin. Pertutsumabin haittavaikutuksille altistuminen on riski ottaen huomioon sen mahdollisuus vaikuttaa sairauden etenemiseen. Potilasnäkökulma Suositusvalmisteluun liittyen järjestettiin tapaaminen Europa Donna Finland-yhdistyksen edustajien kanssa Tässä tapaamisessa esille tulivat rintasyöpään sairastumisen ja hoitojen raskaus, joista usein julkisuudessa ja keskusteluissa annetaan todellisuutta helpompi kuva. Psykologisen tuen tarjoaminen ja saatavuus rintasyöpäpotilaille sairauden eri vaiheissa koettiin tärkeäksi. Pertutsumabiin ja uusiin lääkkeisiin yleensä todettiin liittyvän usein suuria odotuksia. Lääketieteellisen näytön ja riskitietojen toivottiin olevan saatavilla myös helpommin ymmärrettävässä muodossa. Kalliiden uusien lääkkeiden osalta keskusteltiin vaihtoehtoiskustannuksista ja rintasyöpäpotilaiden muista hoidollisista tarpeista. 13. Poikkeaminen palveluvalikoimasta Terveydenhuoltolain 7 a :n 3 momentin mukaan potilasta voidaan tutkia ja hoitaa palveluvalikoimaan kuulumattomalla lääketieteellisellä
13 Perustelumuistioluonnos 11(19) tai hammaslääketieteellisellä tutkimus- ja hoitomenetelmällä, jos se on potilaan henkeä tai terveyttä vakavasti uhkaavan sairauden tai vamman takia lääketieteellisesti välttämätöntä potilaan terveydentila ja sairauden ennakoitavissa oleva kehitys huomioon ottaen. Vaikka päätös palveluvalikoimasta poikkeamisesta tehdään kunkin potilaan kohdalla yksilöllisen arvion perusteella, on etenkin uuden menetelmän kohdalla huomioitava, että yksittäisellä lääkärillä ei käytännössä voi olla käytettävissään muunlaista tutkimustietoa kuin myyntilupaviranomaisilla ja terveydenhuollon menetelmiä arvioivilla tahoilla. Tästä seuraa, että kynnys poiketa palveluvalikoimasta muodostuu väistämättä korkeaksi ja että päätökset tulee perustella huolellisesti ja perustaa lääketieteelliseen tietoon. 14. Lisänäytön kerääminen ja suositusten vaikutusten seuranta 15. Johtopäätökset Pertutsumabilla on kolme eri käyttöaihetta, jotka kaikki liittyvät HER2- positiivisen rintasyövän hoitoon. Merkittävä lisätietoa toisi, jos sairaaloiden tietojärjestelmistä voitaisiin tunnistaa pertutsumabia saaneiden potilaiden määrä käyttöaiheen mukaisesti eriteltynä. Lisäksi olisi tärkeää saada seurattua tietoa potilaiden ja kasvaimien ominaisuuksista, perusteluista hoitojen aloittamiselle ja lopettamiselle (mikäli ne poikkeavat suositellusta), hoitojen vaikuttavuudesta sekä potilaiden saamista muista hoidoista. PALKO on hyväksymässään väliraportissa katsonut, että palveluvalikoiman määrittelyssä tulee perustuslain ja terveydenhuoltolain (TervHL 7a ja TervHL 78a ) asettamien reunaehtojen puitteissa noudattaa seuraavia periaatteita: Terveysongelman merkittävyys Terveysongelman on oltava riittävän merkittävä, jotta sitä on perusteltua hoitaa lääketieteen keinoin julkisin varoin. Merkityksen arvioinnissa sovelletaan lääketieteellisen tiedon lisäksi yhteiskunnallisia arvoja. Rintasyöpä on vakava, mahdollisesti kuolemaan johtava sairaus. Sen hoitaminen julkisin varoin on perusteltua. Lääketieteellinen perusteltavuus Palveluvalikoimaan kuuluvan toiminnan on terveydenhuoltolain 7a :n 1 momentin mukaan oltava lääketieteellisesti tai hammaslääketieteellisesti
14 Perustelumuistioluonnos 12(19) perusteltua. Perusteltavuutta arvioidaan suhteuttamalla toisiinsa vaikuttavuus, turvallisuus ja terveysongelman vakavuus. Vaikuttavuutta ja turvallisuutta arvioidaan suhteessa hoidettavan terveysongelman vakavuuteen tutkimustiedon ja muun näytön perusteella. Toiminnalla on oltava näytön perusteella riittävä vaikuttavuus ja siihen liittyvien riskien suuruuden on oltava hyväksyttäviä. Pertutsumabin lisääminen varhaisvaiheen rintasyöpäpotilaiden liitännäishoitoon vähensi jonkin verran (absoluuttinen ero pertutsumabiryhmän hyväksi oli 1,7 prosenttiyksikköä) syövän uusiutumisen riskiä, etenkin imusolmukkeisiin levinneissä taudeissa. Pertutsumabin lisäämisen vaikutuksia kokonaiselossaoloaikaan ei vielä tiedetä. Potilaiden raportoimassa elämänlaadussa ei esiintynyt merkittäviä eroja pertutsumabi- ja standardihoitoryhmien välillä. Yleisimpiä haittavaikutuksia ja yleisimpiä vakavia haittavaikutuksia pertutsumabilla oli yhtä paljon tai enemmän kuin vertailuryhmässä. Edellä oleva lääketieteellinen näyttö huomioiden, Palko ei pidä pertutsumabin lisäämistä HER2-positiivisen rintasyövän liitännäishoitoon terveydenhuoltolain 7a :n 1 momentissa tarkoitetulla tavalla lääketieteellisesti perusteltuna. Lisäksi Palko katsoo edellä todetuilla perusteilla, että vuoden kestoisen pertutusumabi-hoidon aiheuttamat lisäkustannukset ovat kohtuuttomat saavutettavissa olevaan terveyshyötyyn ja hoidolliseen arvoon nähden tilanteessa, jossa sen vaikuttavuus on vähäinen. Näin ollen myös terveydenhuoltolain 7a :n 2 momentti puoltaa lääkkeen rajaamista palveluvalikoiman ulkopuolelle. Eettisyys ja taloudellisuus kokonaisuutena Palveluvalikoiman määrittelemisessä on terveydenhuoltolain 78a :n 1 momentin mukaan otettava huomioon eettiset ja terveydenhuollon organisointiin liittyvät näkökohdat. Tämä tarkoittaa esimerkiksi sitä, että julkisin varoin rahoitetun terveydenhuollon toiminta rakentuu yhteiskunnassa hyväksytyille arvoille, muun muassa ihmisarvoisen kohtelun periaatteelle. Käytettävissä olevat voimavarat pyritään jakamaan oikeudenmukaisesti terveydenhuoltopalveluja tarvitsevien kesken. Erityisesti kalliiden uusien menetelmien käyttöönottoa arvioidaan myös yhteiskunnan ja terveydenhuoltojärjestelmän käytettävissä olevien taloudellisten voimavarojen kannalta.
15 Perustelumuistioluonnos 13(19) Julkisesti rahoitetussa terveydenhuollossa käytettäviä lääkkeitä koskevassa päätöksenteossa tulee käyttää samoja periaatteita kuin muidenkin terveydenhuollon menetelmien kohdalla. Suhteessa vertailulääkkeisiin pertutusumabin hoidollinen lisävaikutus on vähäinen ja haittavaikutuksien riski on hieman korkeampi. Lääkkeen kustannukset ovat saavutettaviin hyötyihin nähden korkeat. Eettiset ja taloudelliset näkökohdat eivät puolla pertutsumabin ottamista palveluvalikoimaan. 16. Palkon suositus Palko katsoo, että pertutusumabi ei kuulu kansalliseen palveluvalikoimaan varhaisvaiheen HER2-positiivisen rintasyövän leikkauksen jälkeisenä liitännäishoitona solunsalpaaja- ja trastutsumabihoidon lisänä.
16 Perustelumuistioluonnos 14(19) Liite 1. Suosituksen valmistelu ja sen vaiheet Suosituksen valmisteluun osallistuneet Suositukset on valmisteltu Palkon lääkejaostossa (toimikausi ), johon ovat kuuluneet: Puheenjohtaja: Miia Turpeinen, arviointiylilääkäri, Pohjois-Pohjanmaan sairaanhoitopiiri Jäsenet: professori Risto Huupponen, Turun yliopisto ylilääkäri Annikka Kalliokoski, STM/Lääkkeiden hintalautakunta dosentti Heikki Lukkarinen, Varsinais-Suomen sairaanhoitopiiri professori Marja Blom, Helsingin yliopisto johtava ylilääkäri Ilona Autti-Rämö, Kela lääketaloustieteilijä Piia Rannanheimo, Fimea johtajaylilääkäri Vesa Kataja, Keski-Suomen sairaanhoitopiiri ylilääkäri Asko Järvinen, Helsingin ja Uudenmaan sairaanhoitopiiri ( alkaen) arviointiylilääkäri Anna-Kaisa Parkkila, Pirkanmaan sairaanhoitopiiri ( alkaen) Jaoston vastuusihteerinä on toiminut Taina Mäntyranta. Jaoston tehtävänä on valmistella sairaalalääkkeitä koskevia suosituksia. Suosituksen valmistelun vaiheet Lokakuu 2018 Fimea julkaisi lääkearvioinnin Lokakuu 2018 Palkon suositustyön aloitus Lääkejaosto Lääkejaosto Alustava käsittely Palkossa Joulukuu 2018-tammikuu 2019 Otakantaa-kommentointi Suositusluonnosten kommentointi Täydennetään kommentoinnin jälkeen
17 Perustelumuistioluonnos 15(19) Liite 2. Lähteet Cardoso F, Senkus E, Costa A ym. 4th ESO ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 4). Ann Oncol (2018); 29: International-Consensus-Guidelines-for-Advanced-Breast-Cancer-ABC- 4 Hyvärinen A, Härkönen U, Kiviniemi V, Oravilahti T. Pertutsumabi varhaisvaiheen HER2-positiivisen rintasyövän liitännäishoidossa. Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Fimea kehittää, arvioi ja informoi -julkaisusarja 13/ s. ISBN vioinnit Senkus E, Kyriakides S, Ohno S ym. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v8 v30,
PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA
 Hyväksytty Palkon kokouksessa 5.2.2019 Palveluvalikoimaneuvoston perustelumuistio PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA Sisällys 1. Taustaa, perusteet suosituksen
Hyväksytty Palkon kokouksessa 5.2.2019 Palveluvalikoimaneuvoston perustelumuistio PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA Sisällys 1. Taustaa, perusteet suosituksen
Esimerkki palveluvalikoiman määrittelyn periaatteiden soveltamisesta: Biosimilaarit ja kokonaistaloudellisuus
 Esimerkki palveluvalikoiman määrittelyn periaatteiden soveltamisesta: Biosimilaarit ja kokonaistaloudellisuus Jaana Leipälä Terveydenhuollon palveluvalikoimaneuvoston sidosryhmätilaisuus 29.9.2016 Lääkkeet
Esimerkki palveluvalikoiman määrittelyn periaatteiden soveltamisesta: Biosimilaarit ja kokonaistaloudellisuus Jaana Leipälä Terveydenhuollon palveluvalikoimaneuvoston sidosryhmätilaisuus 29.9.2016 Lääkkeet
Ilona Autti-Rämö Pääsihteeri Palveluvalikoimaneuvosto STM/OHJA
 Ilona Autti-Rämö Pääsihteeri Palveluvalikoimaneuvosto STM/OHJA 1 Mitä on palveluvalikoima? Palveluvalikoima eli Suomen julkisin varoin rahoitettujen terveydenhuollon palveluiden kokonaisuus ohjaa terveydenhuollon
Ilona Autti-Rämö Pääsihteeri Palveluvalikoimaneuvosto STM/OHJA 1 Mitä on palveluvalikoima? Palveluvalikoima eli Suomen julkisin varoin rahoitettujen terveydenhuollon palveluiden kokonaisuus ohjaa terveydenhuollon
Espoossa ) Perjeta-liitännäishoidon hoidollinen arvo
 Espoossa 19.10.2018 Roche Oy:n kommentteja Fimean 4.10.2018 julkaisemaan arviointiraporttiin pertutsumabin hoidollisesta ja taloudellisesta arvosta HER2-positiivisen varhaisvaiheen rintasyövän liitännäishoidossa
Espoossa 19.10.2018 Roche Oy:n kommentteja Fimean 4.10.2018 julkaisemaan arviointiraporttiin pertutsumabin hoidollisesta ja taloudellisesta arvosta HER2-positiivisen varhaisvaiheen rintasyövän liitännäishoidossa
Palveluvalikoiman määrittelyn periaatteet. PALKOn avoin seminaari Jaana Leipälä
 Palveluvalikoiman määrittelyn periaatteet PALKOn avoin seminaari 22.11.2016 Jaana Leipälä TAUSTA Keskustelu terveydenhuollon priorisoinnista ja valmistautuminen potilasdirektiivin toimeenpanoon 23.11.2016
Palveluvalikoiman määrittelyn periaatteet PALKOn avoin seminaari 22.11.2016 Jaana Leipälä TAUSTA Keskustelu terveydenhuollon priorisoinnista ja valmistautuminen potilasdirektiivin toimeenpanoon 23.11.2016
Durvalumabi ei-pienisoluisen keuhkosyövän hoidossa kemosädehoidon jälkeen
 versio 13.3.2019 Palveluvalikoimaneuvoston suositus Durvalumabi ei-pienisoluisen keuhkosyövän hoidossa kemosädehoidon jälkeen Durvalumabi kuuluu kansalliseen palveluvalikoimaan paikallisesti edenneen,
versio 13.3.2019 Palveluvalikoimaneuvoston suositus Durvalumabi ei-pienisoluisen keuhkosyövän hoidossa kemosädehoidon jälkeen Durvalumabi kuuluu kansalliseen palveluvalikoimaan paikallisesti edenneen,
Fimean suositus lääkkeiden hoidollisen ja taloudellisen arvon arvioinnista. Hannes Enlund Tutkimuspäällikkö Fimea
 Fimean suositus lääkkeiden hoidollisen ja taloudellisen arvon arvioinnista Hannes Enlund Tutkimuspäällikkö Fimea hannes.enlund@fimea.fi Kysymyksiä joihin etsitään vastauksia? Onko uusi lääke A tehokkaampi
Fimean suositus lääkkeiden hoidollisen ja taloudellisen arvon arvioinnista Hannes Enlund Tutkimuspäällikkö Fimea hannes.enlund@fimea.fi Kysymyksiä joihin etsitään vastauksia? Onko uusi lääke A tehokkaampi
Lääkkeiden taloudellinen arviointi Olli Pekka Ryynänen Itä Suomen yliopisto, Fimea
 Lääkkeiden taloudellinen arviointi Olli Pekka Ryynänen Itä Suomen yliopisto, Fimea Lääkevalmisteiden arviointi Onko lääke tehokas ja turvallinen; täyttääkö se laatuvaatimukset? Lääkehoitojen arviointi
Lääkkeiden taloudellinen arviointi Olli Pekka Ryynänen Itä Suomen yliopisto, Fimea Lääkevalmisteiden arviointi Onko lääke tehokas ja turvallinen; täyttääkö se laatuvaatimukset? Lääkehoitojen arviointi
JULKAISUSARJA 13/2018 PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA. Uusien sairaalalääkkeiden arviointi
 JULKAISUSARJA 13/2018 PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA Uusien sairaalalääkkeiden arviointi PERTUTSUMABI VARHAISVAIHEEN HER2-POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA
JULKAISUSARJA 13/2018 PERTUTSUMABI VARHAISVAIHEEN HER2- POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA Uusien sairaalalääkkeiden arviointi PERTUTSUMABI VARHAISVAIHEEN HER2-POSITIIVISEN RINTASYÖVÄN LIITÄNNÄISHOIDOSSA
Hoidollisen ja taloudellisen arvon arviointi tukee lääkehoitoja koskevaa päätöksenteko...
 Page 1 of 4 JULKAISTU NUMEROSSA 1/2016 TEEMAT Hoidollisen ja taloudellisen arvon arviointi tukee lääkehoitoja koskevaa päätöksentekoa Piia Rannanheimo, Ulla Härkönen, Vesa Kiviniemi / Kirjoitettu 21.2.2016
Page 1 of 4 JULKAISTU NUMEROSSA 1/2016 TEEMAT Hoidollisen ja taloudellisen arvon arviointi tukee lääkehoitoja koskevaa päätöksentekoa Piia Rannanheimo, Ulla Härkönen, Vesa Kiviniemi / Kirjoitettu 21.2.2016
OBINUTUTSUMABI-LÄÄKE FOLLIKULAARISEN LYMFOOMAN ENSILINJAN HOIDOSSA
 Perustelumuistio Hyväksytty Palkon kokouksessa 18.12.2018 Palveluvalikoimaneuvoston perustelumuistio OBINUTUTSUMABI-LÄÄKE FOLLIKULAARISEN LYMFOOMAN ENSILINJAN HOIDOSSA Perustelumuistio Sisällys 1. Taustaa,
Perustelumuistio Hyväksytty Palkon kokouksessa 18.12.2018 Palveluvalikoimaneuvoston perustelumuistio OBINUTUTSUMABI-LÄÄKE FOLLIKULAARISEN LYMFOOMAN ENSILINJAN HOIDOSSA Perustelumuistio Sisällys 1. Taustaa,
TULISIKO SUOMALAISTEN LÄÄKKEIDEN SAANTIA JA KÄYTTÖÄ OHJAILLA?
 TULISIKO SUOMALAISTEN LÄÄKKEIDEN SAANTIA JA KÄYTTÖÄ OHJAILLA? Palveluvalikoimaneuvoston näkökulma Reima Palonen 10.9.2015 Esityksen sisältö Mikä on terveydenhuollon palveluvalikoima? Mikä on terveydenhuollon
TULISIKO SUOMALAISTEN LÄÄKKEIDEN SAANTIA JA KÄYTTÖÄ OHJAILLA? Palveluvalikoimaneuvoston näkökulma Reima Palonen 10.9.2015 Esityksen sisältö Mikä on terveydenhuollon palveluvalikoima? Mikä on terveydenhuollon
Uutta lääkkeistä: Palbosiklibi
 Page 1 of 5 JULKAISTU NUMEROSSA 1/2017 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Palbosiklibi Annikka Kalliokoski / Kirjoitettu 25.1.2017 / Julkaistu Ibrance 75 mg, 100 mg, 125 mg kovat kapselit, Pfizer Limited
Page 1 of 5 JULKAISTU NUMEROSSA 1/2017 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Palbosiklibi Annikka Kalliokoski / Kirjoitettu 25.1.2017 / Julkaistu Ibrance 75 mg, 100 mg, 125 mg kovat kapselit, Pfizer Limited
Kysely syöpäpotilaiden hoidosta Tulokset FIN-P-CARF /18
 Kysely syöpäpotilaiden hoidosta Tulokset FIN-P-CARF-0918-0844-9/18 OTOS Näissä tuloksissa on mukana tulokset, jotka on kerätty ajalla 4.5 18..18. Tässä esityksessä tuloksia tarkastellaan seuraavien kohderyhmien
Kysely syöpäpotilaiden hoidosta Tulokset FIN-P-CARF-0918-0844-9/18 OTOS Näissä tuloksissa on mukana tulokset, jotka on kerätty ajalla 4.5 18..18. Tässä esityksessä tuloksia tarkastellaan seuraavien kohderyhmien
Daratumumabi yhdistelmänä (D-VMP) ja ylläpitohoitona äskettäin diagnosoidun multippelin myelooman hoidossa
 1 2 3 4 5 6 7 8 9 10 11 versio 12.6.2019 Palveluvalikoimaneuvoston suositus Daratumumabi yhdistelmänä (D-VMP) ja ylläpitohoitona äskettäin diagnosoidun multippelin myelooman hoidossa 12 13 14 Yhteenveto
1 2 3 4 5 6 7 8 9 10 11 versio 12.6.2019 Palveluvalikoimaneuvoston suositus Daratumumabi yhdistelmänä (D-VMP) ja ylläpitohoitona äskettäin diagnosoidun multippelin myelooman hoidossa 12 13 14 Yhteenveto
Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän
 Hyväksytty Palkon kokouksessa 4.9.2018 Palveluvalikoimaneuvoston perustelumuistio Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa Hyväksytty Palkon kokouksessa
Hyväksytty Palkon kokouksessa 4.9.2018 Palveluvalikoimaneuvoston perustelumuistio Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa Hyväksytty Palkon kokouksessa
Erityisasiantuntija Reima Palonen Palveluvalikoimaneuvoston potilaspäivä
 Erityisasiantuntija Reima Palonen Palveluvalikoimaneuvoston potilaspäivä 17.9.2015 Potilasdirektiivi taustalla Vakuutusjäsenvaltion asiana on määrittää, millaisesta terveydenhuollosta vakuutettu on oikeutettu
Erityisasiantuntija Reima Palonen Palveluvalikoimaneuvoston potilaspäivä 17.9.2015 Potilasdirektiivi taustalla Vakuutusjäsenvaltion asiana on määrittää, millaisesta terveydenhuollosta vakuutettu on oikeutettu
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi. Terveysfoorumi 2011 Piia Peura Lääketaloustieteilijä Piia.Peura@fimea.fi
 Lääkkeiden hoidollisen ja taloudellisen arvon arviointi Terveysfoorumi 2011 Piia Peura Lääketaloustieteilijä Piia.Peura@fimea.fi Arviointien tavoite Tuottaa tietoa lääkkeiden käyttöönottoon ja korvattavuuteen
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi Terveysfoorumi 2011 Piia Peura Lääketaloustieteilijä Piia.Peura@fimea.fi Arviointien tavoite Tuottaa tietoa lääkkeiden käyttöönottoon ja korvattavuuteen
Arviointien hyödyntäminen käytännön työssä Ayl Katariina Klintrup Syöpätautien ja hematologian vastuualue
 Arviointien hyödyntäminen käytännön työssä 19.9.2018 Ayl Katariina Klintrup Syöpätautien ja hematologian vastuualue 1 Uuden lääkkeen käyttöönotto Alle 35 000? Menettelytapa alle 35 000 kustannuksissa?
Arviointien hyödyntäminen käytännön työssä 19.9.2018 Ayl Katariina Klintrup Syöpätautien ja hematologian vastuualue 1 Uuden lääkkeen käyttöönotto Alle 35 000? Menettelytapa alle 35 000 kustannuksissa?
TISAGENLEKLEUSEELI (Kymriah ) B-SOLULINJAN AKUUTIN LYMFOBLASTISEN LEUKEMIAN HOIDOSSA
 Hyväksytty Palkon kokouksessa 13.3.2019 Palveluvalikoimaneuvoston perustelumuistio TISAGENLEKLEUSEELI (Kymriah ) B-SOLULINJAN AKUUTIN LYMFOBLASTISEN LEUKEMIAN HOIDOSSA Hyväksytty Palkon kokouksessa 13.3.2019
Hyväksytty Palkon kokouksessa 13.3.2019 Palveluvalikoimaneuvoston perustelumuistio TISAGENLEKLEUSEELI (Kymriah ) B-SOLULINJAN AKUUTIN LYMFOBLASTISEN LEUKEMIAN HOIDOSSA Hyväksytty Palkon kokouksessa 13.3.2019
Kenelle täsmähoitoja ja millä hinnalla?
 Kenelle täsmähoitoja ja millä hinnalla? Heikki Joensuu ylilääkäri, Syöpätautien klinikka, HYKS, ja professori, Lääketieteellinen tiedekunta, Helsingin yliopisto EUROCARE-4 tutkimus Syöpäpotilaiden eloonjääminen
Kenelle täsmähoitoja ja millä hinnalla? Heikki Joensuu ylilääkäri, Syöpätautien klinikka, HYKS, ja professori, Lääketieteellinen tiedekunta, Helsingin yliopisto EUROCARE-4 tutkimus Syöpäpotilaiden eloonjääminen
Yhteenveto otakantaa-palvelun kommenteista. Aihe: NUSINERSEENI SMA-TAUDIN HOIDOSSA
 Yhteenveto otakantaa-palvelun kommenteista Aihe: NUSINERSEENI SMA-TAUDIN HOIDOSSA 2(7) Taustaa Terveydenhuollon palveluvalikoimaneuvosto (Palko) hyväksyi suosituksen nusinerseenistä SMA-taudin hoidossa
Yhteenveto otakantaa-palvelun kommenteista Aihe: NUSINERSEENI SMA-TAUDIN HOIDOSSA 2(7) Taustaa Terveydenhuollon palveluvalikoimaneuvosto (Palko) hyväksyi suosituksen nusinerseenistä SMA-taudin hoidossa
Mitä ja miten PALKO tekee?
 Mitä ja miten PALKO tekee? 22.9.2015 Sidonnaisuudet päätoimi: Terveydenhuollon palveluvalikoimaneuvoston pääsihteeri, STM (1.2.2014 alkaen) aiempi päätoimi: ylilääkäri, THL (31.1.2014 asti) aikaisemmat
Mitä ja miten PALKO tekee? 22.9.2015 Sidonnaisuudet päätoimi: Terveydenhuollon palveluvalikoimaneuvoston pääsihteeri, STM (1.2.2014 alkaen) aiempi päätoimi: ylilääkäri, THL (31.1.2014 asti) aikaisemmat
Miten uudet (syöpä)lääkkeet tulevat kliiniseen käyttöön?
 Lääkehoitojen priorisointi Miten uudet (syöpä)lääkkeet tulevat kliiniseen käyttöön? Vesa Kataja, erikoislääkäri kliinisen onkologian dosentti johtajaylilääkäri Keski-Suomen sairaanhoitopiiri Terveysfoorumi
Lääkehoitojen priorisointi Miten uudet (syöpä)lääkkeet tulevat kliiniseen käyttöön? Vesa Kataja, erikoislääkäri kliinisen onkologian dosentti johtajaylilääkäri Keski-Suomen sairaanhoitopiiri Terveysfoorumi
Miten lääkehoidon vaikuttavuutta mitataan? Näkökulmana lääkkeiden hoidollisen ja taloudellisen arvon arviointi
 Miten lääkehoidon vaikuttavuutta mitataan? Näkökulmana lääkkeiden hoidollisen ja taloudellisen arvon arviointi Piia Rannanheimo Fimea, lääketaloustieteilijä (2010 ) Palveluvalikoimaneuvoston lääkejaosto,
Miten lääkehoidon vaikuttavuutta mitataan? Näkökulmana lääkkeiden hoidollisen ja taloudellisen arvon arviointi Piia Rannanheimo Fimea, lääketaloustieteilijä (2010 ) Palveluvalikoimaneuvoston lääkejaosto,
AKSIKABTAGEENISILOLEUSEELI (YESCARTA ) UUSIUTUNEEN TAI HOITORESISTENTIN DIFFUUSIN SUURISOLUISEN B-SOLULYMFOOMAN (DLBCL) JA PRIMAARISEN VÄLIKARSINAN
 versio 13.3.2019 Palveluvalikoimaneuvoston perustelumuistio AKSIKABTAGEENISILOLEUSEELI (YESCARTA ) UUSIUTUNEEN TAI HOITORESISTENTIN DIFFUUSIN SUURISOLUISEN B-SOLULYMFOOMAN (DLBCL) JA PRIMAARISEN VÄLIKARSINAN
versio 13.3.2019 Palveluvalikoimaneuvoston perustelumuistio AKSIKABTAGEENISILOLEUSEELI (YESCARTA ) UUSIUTUNEEN TAI HOITORESISTENTIN DIFFUUSIN SUURISOLUISEN B-SOLULYMFOOMAN (DLBCL) JA PRIMAARISEN VÄLIKARSINAN
Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän
 versio 27.6.2018 Palveluvalikoimaneuvoston perustelumuistio ja perusteet neuvostolle suosituksen antamiseksi Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa
versio 27.6.2018 Palveluvalikoimaneuvoston perustelumuistio ja perusteet neuvostolle suosituksen antamiseksi Atetsolitsumabi-, nivolumabi- ja pembrolitsumabi -lääkkeet levinneen virtsarakkosyövän hoidossa
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Uusien sairaalalääkkeiden arviointi Fimeassa. Vesa Kiviniemi Fimea
 Uusien sairaalalääkkeiden arviointi Fimeassa Vesa Kiviniemi Fimea 29.9.2016 Arvioinnin ja arviointiprosessin taustaa Sairaalalääkkeille ei Suomessa toistaiseksi ole ollut keskitettyä tai yhtenäistä arviointiprosessia
Uusien sairaalalääkkeiden arviointi Fimeassa Vesa Kiviniemi Fimea 29.9.2016 Arvioinnin ja arviointiprosessin taustaa Sairaalalääkkeille ei Suomessa toistaiseksi ole ollut keskitettyä tai yhtenäistä arviointiprosessia
Mitä vaikuttavuusnäytöllä tehdään? Jorma Komulainen LT, dosentti Käypä hoito suositusten päätoimittaja
 Mitä vaikuttavuusnäytöllä tehdään? Jorma Komulainen LT, dosentti Käypä hoito suositusten päätoimittaja Sidonnaisuudet Käypä hoito päätoimittaja, Duodecim Palveluvalikoimaneuvoston pysyvä asiantuntija,
Mitä vaikuttavuusnäytöllä tehdään? Jorma Komulainen LT, dosentti Käypä hoito suositusten päätoimittaja Sidonnaisuudet Käypä hoito päätoimittaja, Duodecim Palveluvalikoimaneuvoston pysyvä asiantuntija,
Mini-HTA Petra Falkenbach, TtM erikoissuunnittelija
 Mini-HTA 19.9.2018 Petra Falkenbach, TtM erikoissuunnittelija Mini-HTA tausta Mini-HTA on tanskalaisten kehittämä menetelmä, jolla voidaan arvioida systemaattisesti terveydenhuollon menetelmän soveltuvuutta
Mini-HTA 19.9.2018 Petra Falkenbach, TtM erikoissuunnittelija Mini-HTA tausta Mini-HTA on tanskalaisten kehittämä menetelmä, jolla voidaan arvioida systemaattisesti terveydenhuollon menetelmän soveltuvuutta
Kustannusvaikuttavuustiedon hyödyntäminen Hilan päätöksissä
 Kustannusvaikuttavuustiedon hyödyntäminen Hilan päätöksissä Elina Asola johtava proviisori Lääkkeiden hintalautakunta Sosiaali- ja terveysministeriö 25.4.2018 1 Lääkkeiden hintalautakunta (Hila) toimii
Kustannusvaikuttavuustiedon hyödyntäminen Hilan päätöksissä Elina Asola johtava proviisori Lääkkeiden hintalautakunta Sosiaali- ja terveysministeriö 25.4.2018 1 Lääkkeiden hintalautakunta (Hila) toimii
Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto
 1 (7) 5.2.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto Fimea ja arviointiylilääkärien verkosto
1 (7) 5.2.2015 Dnro 1896/60.02.01/2014 UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja arviointiylilääkäreiden verkosto Fimea ja arviointiylilääkärien verkosto
TERVEYDENHUOLLON MENETELMIEN KARSINTA. Petra Falkenbach, TtM FinCCHTA,PPSHP
 TERVEYDENHUOLLON MENETELMIEN KARSINTA Petra Falkenbach, TtM FinCCHTA,PPSHP 23.2.2018 Historiaa, onnistumisia Nykypäivää Antibiootit (40-luku) Avosydänleikkaukset ja sähköinen sydämentahdistin (50-luku)
TERVEYDENHUOLLON MENETELMIEN KARSINTA Petra Falkenbach, TtM FinCCHTA,PPSHP 23.2.2018 Historiaa, onnistumisia Nykypäivää Antibiootit (40-luku) Avosydänleikkaukset ja sähköinen sydämentahdistin (50-luku)
Teknologian hankintapäätökset sairaaloissa. Risto Roine Professori Itä-Suomen yliopisto
 Teknologian hankintapäätökset sairaaloissa Risto Roine Professori Itä-Suomen yliopisto Uusien menetelmien arviointi sairaanhoitopiireissä Uusien menetelmien käyttöönotolle ei yleensä virallista, organisaatiotason
Teknologian hankintapäätökset sairaaloissa Risto Roine Professori Itä-Suomen yliopisto Uusien menetelmien arviointi sairaanhoitopiireissä Uusien menetelmien käyttöönotolle ei yleensä virallista, organisaatiotason
Fimean ja PALKOn yhteistyö lääkkeiden arvioinnissa
 Fimean ja PALKOn yhteistyö lääkkeiden arvioinnissa Vesa Kiviniemi Fimea 22.11.2016 Fimean ja PALKOn yhteistyöalueet Uusien sairaalalääkkeiden hoidollisen ja taloudellisen arvon arviointi sekä tähän liittyvä
Fimean ja PALKOn yhteistyö lääkkeiden arvioinnissa Vesa Kiviniemi Fimea 22.11.2016 Fimean ja PALKOn yhteistyöalueet Uusien sairaalalääkkeiden hoidollisen ja taloudellisen arvon arviointi sekä tähän liittyvä
Ajankohtaista lääkealalla toukokuussa
 Page 1 of 5 JULKAISTU NUMEROSSA 2/2018 AJANKOHTAISTA LÄÄKEALALLA Ajankohtaista lääkealalla toukokuussa Päivi Ruokoniemi / Kirjoitettu 13.6.2028 / Julkaistu 18.6.2018 Toukokuun ajankohtaisissa lääkealan
Page 1 of 5 JULKAISTU NUMEROSSA 2/2018 AJANKOHTAISTA LÄÄKEALALLA Ajankohtaista lääkealalla toukokuussa Päivi Ruokoniemi / Kirjoitettu 13.6.2028 / Julkaistu 18.6.2018 Toukokuun ajankohtaisissa lääkealan
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi. HTA-näkökulma Sote-tietojen sekundaarikäyttöön
 Lääkkeiden hoidollisen ja taloudellisen arvon arviointi HTA-näkökulma Sote-tietojen sekundaarikäyttöön Piia Rannanheimo (proviisori) Fimea, lääketaloustieteilijä 2010 --> Canadian Agency for Drugs and
Lääkkeiden hoidollisen ja taloudellisen arvon arviointi HTA-näkökulma Sote-tietojen sekundaarikäyttöön Piia Rannanheimo (proviisori) Fimea, lääketaloustieteilijä 2010 --> Canadian Agency for Drugs and
Hoidetun rintasyöpäpotilaan seuranta
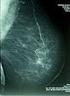 Hoidetun rintasyöpäpotilaan seuranta Tavoitteet Seurannassa pyritään rintasyövän mahdollisen paikallisen uusiutumisen ja vastakkaisen rinnan uuden syövän varhaiseen toteamiseen. Oireettomalle potilaalle
Hoidetun rintasyöpäpotilaan seuranta Tavoitteet Seurannassa pyritään rintasyövän mahdollisen paikallisen uusiutumisen ja vastakkaisen rinnan uuden syövän varhaiseen toteamiseen. Oireettomalle potilaalle
TIETOA ETURAUHASSYÖPÄPOTILAAN SOLUNSALPAAJAHOIDOSTA
 TIETOA ETURAUHASSYÖPÄPOTILAAN SOLUNSALPAAJAHOIDOSTA TOSIASIOITA USKOMUSTEN TAKANA HARVINAISET SAIRAUDET I MS-TAUTI I ONKOLOGIA I IMMUNOLOGIA 1 LUKIJALLE Eturauhassyöpä on Suomessa miesten yleisin syöpä.
TIETOA ETURAUHASSYÖPÄPOTILAAN SOLUNSALPAAJAHOIDOSTA TOSIASIOITA USKOMUSTEN TAKANA HARVINAISET SAIRAUDET I MS-TAUTI I ONKOLOGIA I IMMUNOLOGIA 1 LUKIJALLE Eturauhassyöpä on Suomessa miesten yleisin syöpä.
Lääkehoitojen arviointi
 Lääkehoitojen arviointi Vesa Kiviniemi Arviointipäällikkö Fimea 23.2.2018 Sisältö Sairaalalääkkeiden arviointi Tausta ja tavoitteet Arvioinnin prosessi ja PALKOn suositukset Tulevaisuuden suunnitelmia
Lääkehoitojen arviointi Vesa Kiviniemi Arviointipäällikkö Fimea 23.2.2018 Sisältö Sairaalalääkkeiden arviointi Tausta ja tavoitteet Arvioinnin prosessi ja PALKOn suositukset Tulevaisuuden suunnitelmia
Terveydenhuollon menetelmien arviointi Suomessa. Hoitoteknologioiden arviointi, osa Miia Turpeinen
 Terveydenhuollon menetelmien arviointi Suomessa Hoitoteknologioiden arviointi, osa 1 18.4.2018 Miia Turpeinen 20.4.2018 Terveydenhuoltolaki 2010/1326 Palveluvalikoimaan ei kuitenkaan kuulu sellainen terveyden-
Terveydenhuollon menetelmien arviointi Suomessa Hoitoteknologioiden arviointi, osa 1 18.4.2018 Miia Turpeinen 20.4.2018 Terveydenhuoltolaki 2010/1326 Palveluvalikoimaan ei kuitenkaan kuulu sellainen terveyden-
Opas terveydenhuollon ammattilaisille. Kadcyla (trastutsumabiemtansiini)
 Opas terveydenhuollon ammattilaisille Kadcyla (trastutsumabiemtansiini) Riskienhallintamateriaali, versio 3.0. Hyväksytty Fimeassa 20.11.2018 2 Riskienhallintamateriaali marraskuu 2018 VAROITUS: Riski
Opas terveydenhuollon ammattilaisille Kadcyla (trastutsumabiemtansiini) Riskienhallintamateriaali, versio 3.0. Hyväksytty Fimeassa 20.11.2018 2 Riskienhallintamateriaali marraskuu 2018 VAROITUS: Riski
Uutta lääkkeistä: Vemurafenibi
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Vemurafenibi Kristiina Airola / Julkaistu 28.9.2012. Zelboraf 240 mg kalvopäällysteinen tabletti, Roche Registration Ltd. Zelboraf-valmistetta
Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Vemurafenibi Kristiina Airola / Julkaistu 28.9.2012. Zelboraf 240 mg kalvopäällysteinen tabletti, Roche Registration Ltd. Zelboraf-valmistetta
TISAGENLEKLEUSEELI (KYMRIAH ) UUSIUTUNEEN TAI HOITORESISTENTIN DIFFUUSIN SUURISOLUISEN B-SOLULYMFOOMAN (DLBCL) HOIDOSSA
 versio 13.3.2019 Palveluvalikoimaneuvton perustelumuistio TISAGENLEKLEUSEELI (KYMRIAH ) UUSIUTUNEEN TAI HOITORESISTENTIN DIFFUUSIN SUURISOLUISEN B-SOLULYMFOOMAN (DLBCL) HOIDOSSA versio 13.3.2019 Sisällys
versio 13.3.2019 Palveluvalikoimaneuvton perustelumuistio TISAGENLEKLEUSEELI (KYMRIAH ) UUSIUTUNEEN TAI HOITORESISTENTIN DIFFUUSIN SUURISOLUISEN B-SOLULYMFOOMAN (DLBCL) HOIDOSSA versio 13.3.2019 Sisällys
TERVEYDENHUOLLON PALVELUVALIKOIMANEUVOSTON SÄHKÖPOSTIKOKOUS 3/2017
 PALVELUVALiKOIMA Tiänsteutbudet i Choices in liealch care PÖYTÄKIRJA 1(2) STM038:00/2017 4.10.2017 TERVEYDENHUOLLON PALVELUVALIKOIMANEUVOSTON SÄHKÖPOSTIKOKOUS 3/2017 Aika Paikka Osallistujat 2.-4.10.2017
PALVELUVALiKOIMA Tiänsteutbudet i Choices in liealch care PÖYTÄKIRJA 1(2) STM038:00/2017 4.10.2017 TERVEYDENHUOLLON PALVELUVALIKOIMANEUVOSTON SÄHKÖPOSTIKOKOUS 3/2017 Aika Paikka Osallistujat 2.-4.10.2017
PALKOn avoin seminaari
 PALKOn avoin seminaari 22.11.2016 22.11.2016 1 PALKOn jäsenet ja jaostot PALKON SUOSITUSPROSESSI Potilaat Viranomaiset (Kela ym.) Terveydenhuollon palveluiden järjestäjät Terveydenhuollon palveluiden tuottajat
PALKOn avoin seminaari 22.11.2016 22.11.2016 1 PALKOn jäsenet ja jaostot PALKON SUOSITUSPROSESSI Potilaat Viranomaiset (Kela ym.) Terveydenhuollon palveluiden järjestäjät Terveydenhuollon palveluiden tuottajat
Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN
 Ohje x.x.2017 6895/00.01.02/2016 x/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut
Ohje x.x.2017 6895/00.01.02/2016 x/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje LÄÄKKEIDEN HAITTAVAIKUTUSTEN ILMOIT- TAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut
Kehittyneet terapiat ja kalliit lääkehoidot
 Kehittyneet terapiat ja kalliit lääkehoidot Tarvitaanko käyttöönottoon uusia lähestymistapoja? Mitä nämä voisivat olla? Kuopio 9.5.2019 Susanne Bergius, Amgen Ansaintalogiikat ja hinnoittelu muuttuvat
Kehittyneet terapiat ja kalliit lääkehoidot Tarvitaanko käyttöönottoon uusia lähestymistapoja? Mitä nämä voisivat olla? Kuopio 9.5.2019 Susanne Bergius, Amgen Ansaintalogiikat ja hinnoittelu muuttuvat
Propecia (finasteridi 0,2 ja 1 mg) tabletti , versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
TERVEYDENHUOLLON MENETELMIEN HALLITTU KÄYTTÖÖNOTTO
 1 TERVEYDENHUOLLON MENETELMIEN HALLITTU KÄYTTÖÖNOTTO Aino-Liisa Oukka Asiantuntijaneuvoston pj. Dosentti, johtajaylilääkäri PPSHP 2 Taustaa Sisältö HALO organisaatio Katsaus ja suositus Haasteet ja tulevaisuus
1 TERVEYDENHUOLLON MENETELMIEN HALLITTU KÄYTTÖÖNOTTO Aino-Liisa Oukka Asiantuntijaneuvoston pj. Dosentti, johtajaylilääkäri PPSHP 2 Taustaa Sisältö HALO organisaatio Katsaus ja suositus Haasteet ja tulevaisuus
Finohta Asiakkuus ja vaikuttavuus yksikkö
 Finohta Asiakkuus ja vaikuttavuus yksikkö 24.9.2015 Niina Kovanen Esityksen nimi / tekijä 1 Finohtan perustehtävät tuottaa ja välittää menetelmien arviointitietoa päätöksenteon tueksi edistää näyttöön
Finohta Asiakkuus ja vaikuttavuus yksikkö 24.9.2015 Niina Kovanen Esityksen nimi / tekijä 1 Finohtan perustehtävät tuottaa ja välittää menetelmien arviointitietoa päätöksenteon tueksi edistää näyttöön
Sebelipaasi alfa lääke lysosomaalisen happaman lipaasin puutoksen hoidossa
 Hyväksytty terveydenhuollon palveluvalikomaneuvoston kokouksessa 12.6.2018 Palveluvalikoimaneuvoston perustelumuistio ja perusteet neuvostolle suosituksen antamiseksi Sebelipaasi alfa lääke lysosomaalisen
Hyväksytty terveydenhuollon palveluvalikomaneuvoston kokouksessa 12.6.2018 Palveluvalikoimaneuvoston perustelumuistio ja perusteet neuvostolle suosituksen antamiseksi Sebelipaasi alfa lääke lysosomaalisen
Viisaita päätöksiä kustannusvaikuttavuudella
 Viisaita päätöksiä kustannusvaikuttavuudella Lääketeollisuus ry:n seminaari 25.4.2018 Päivi Kerkola, Lääketeollisuus ry:n hallituksen puheenjohtaja, Pfizer Oy, toimitusjohtaja Vaikuttavuustutkimusta eri
Viisaita päätöksiä kustannusvaikuttavuudella Lääketeollisuus ry:n seminaari 25.4.2018 Päivi Kerkola, Lääketeollisuus ry:n hallituksen puheenjohtaja, Pfizer Oy, toimitusjohtaja Vaikuttavuustutkimusta eri
Annikka Kalliokoski, Vesa Mustalammi / Kirjoitettu / Julkaistu
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2016 Reslitsumabi Annikka Kalliokoski, Vesa Mustalammi / Kirjoitettu 28.9.2016 / Julkaistu 7.11.2016 Cinqaero 10 mg/ml infuusiokonsentraatti, liuosta varten, Teva Pharmaceuticals
Page 1 of 5 JULKAISTU NUMEROSSA 3/2016 Reslitsumabi Annikka Kalliokoski, Vesa Mustalammi / Kirjoitettu 28.9.2016 / Julkaistu 7.11.2016 Cinqaero 10 mg/ml infuusiokonsentraatti, liuosta varten, Teva Pharmaceuticals
Liite III Valmisteyhteenvetoon ja pakkausselosteeseen tehtävät muutokset
 Liite III Valmisteyhteenvetoon ja pakkausselosteeseen Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen jäsenvaltioiden
Liite III Valmisteyhteenvetoon ja pakkausselosteeseen Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen jäsenvaltioiden
Uusien lääkkeiden ja menetelmien käyttöönottoprosessi OYS-ERVAlla
 Uusien lääkkeiden ja menetelmien käyttöönottoprosessi OYS-ERVAlla Miia Turpeinen, Dos., el. Arviointiylilääkäri, OYS-ERVA 30.3.2017 Yhteistyöseminaari 1. Too much unnecessary care 2. Avoidable harm to
Uusien lääkkeiden ja menetelmien käyttöönottoprosessi OYS-ERVAlla Miia Turpeinen, Dos., el. Arviointiylilääkäri, OYS-ERVA 30.3.2017 Yhteistyöseminaari 1. Too much unnecessary care 2. Avoidable harm to
Lääkealan turvallisuus- ja kehittämiskeskuksen ohje HAITTAVAIKUTUSTEN ILMOITTAMINEN
 Ohje 27.2.2017 6895/00.01.02/2016 1/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje HAITTAVAIKUTUSTEN ILMOITTAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut henkilöt Voimassaoloaika
Ohje 27.2.2017 6895/00.01.02/2016 1/2017 Lääkealan turvallisuus- ja kehittämiskeskuksen ohje HAITTAVAIKUTUSTEN ILMOITTAMINEN Kohderyhmät Lääkkeen määräämiseen tai toimittamiseen oikeutetut henkilöt Voimassaoloaika
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Kadcyla (trastutsumabiemtansiini)
 Kadcyla (trastutsumabiemtansiini) Opas terveydenhuollon ammattilaisille 2 VAROITUS: Riski Kadcylan ja Herceptinin vaihtumisesta Lääkkeen määräämiseen, käyttökuntoon saattamiseen ja antoon liittyvissä vaiheissa
Kadcyla (trastutsumabiemtansiini) Opas terveydenhuollon ammattilaisille 2 VAROITUS: Riski Kadcylan ja Herceptinin vaihtumisesta Lääkkeen määräämiseen, käyttökuntoon saattamiseen ja antoon liittyvissä vaiheissa
Kadcyla (trastutsumabiemtansiini)
 Kadcyla (trastutsumabiemtansiini) Opas terveydenhuollon ammattilaisille Riskienhallintamateriaali syyskuu 2016 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta
Kadcyla (trastutsumabiemtansiini) Opas terveydenhuollon ammattilaisille Riskienhallintamateriaali syyskuu 2016 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta
Tärkeä lääketurvatiedote terveydenhuollon ammattilaisille. RAS-villityyppistatuksen (KRAS- ja NRAS-statuksen
 Tärkeä lääketurvatiedote terveydenhuollon ammattilaisille. RAS-villityyppistatuksen (KRAS- ja NRAS-statuksen eksoneissa 2, 3 ja 4) varmistaminen on tärkeää ennen Erbitux (setuksimabi) -hoidon aloittamista
Tärkeä lääketurvatiedote terveydenhuollon ammattilaisille. RAS-villityyppistatuksen (KRAS- ja NRAS-statuksen eksoneissa 2, 3 ja 4) varmistaminen on tärkeää ennen Erbitux (setuksimabi) -hoidon aloittamista
Käypä hoito: Kliinisen työn helpottaja vai kurjistaja? Jorma Komulainen SSLY
 Käypä hoito: Kliinisen työn helpottaja vai kurjistaja? Jorma Komulainen SSLY 14.3.2019 Mitä teidän tulee tietää minusta? LT, dosentti, lastentautien ja lastenendokrinologian erikoislääkäri Päätoimi Käypä
Käypä hoito: Kliinisen työn helpottaja vai kurjistaja? Jorma Komulainen SSLY 14.3.2019 Mitä teidän tulee tietää minusta? LT, dosentti, lastentautien ja lastenendokrinologian erikoislääkäri Päätoimi Käypä
Katsaus menetelmien arviointiin Suomessa, mitä on saatu aikaan. Risto Roine Professori Itä-Suomen yliopisto Ylilääkäri, HUS ja KYS
 Katsaus menetelmien arviointiin Suomessa, mitä on saatu aikaan Risto Roine Professori Itä-Suomen yliopisto Ylilääkäri, HUS ja KYS Terveydenhuollon käytettävissä olevat resurssit ovat rajalliset ja niiden
Katsaus menetelmien arviointiin Suomessa, mitä on saatu aikaan Risto Roine Professori Itä-Suomen yliopisto Ylilääkäri, HUS ja KYS Terveydenhuollon käytettävissä olevat resurssit ovat rajalliset ja niiden
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
Pertutsumabi on nisäkkään (kiinanhamsterin munasarja) soluissa rekombinantti DNA teknologialla tuotettu humanisoitu monoklonaalinen IgG1-vasta-aine.
 1. LÄÄKEVALMISTEEN NIMI Perjeta 420 mg infuusiokonsentraatti, liuosta varten. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 14 ml:n injektiopullo sisältää 420 mg pertutsumabia (pitoisuus 30 mg/ml). Laimentamisen
1. LÄÄKEVALMISTEEN NIMI Perjeta 420 mg infuusiokonsentraatti, liuosta varten. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 14 ml:n injektiopullo sisältää 420 mg pertutsumabia (pitoisuus 30 mg/ml). Laimentamisen
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Miten uudet lääkkeet tulevat sairaaloihin?
 Miten uudet lääkkeet tulevat sairaaloihin? Ulla Härkönen, tutkijalääkäri Satu Multanen, korkeakouluharjoittelija Lääkehoitojen arviointi -prosessi, Fimea 12.10.2016 Esityksen sisältö Esimerkkejä alueellisista
Miten uudet lääkkeet tulevat sairaaloihin? Ulla Härkönen, tutkijalääkäri Satu Multanen, korkeakouluharjoittelija Lääkehoitojen arviointi -prosessi, Fimea 12.10.2016 Esityksen sisältö Esimerkkejä alueellisista
RINNAN NGS PANEELIEN KÄYTTÖ ONKOLOGIN NÄKÖKULMA
 RINNAN NGS PANEELIEN KÄYTTÖ ONKOLOGIN NÄKÖKULMA Johanna Mattson dosentti ylilääkäri, vs. toimialajohtaja HYKS Syöpäkeskus 28.11.2016 1 RINTASYÖPÄ SUOMESSA 5008 uutta tapausta vuonna 2014 Paikallinen rintasyöpä
RINNAN NGS PANEELIEN KÄYTTÖ ONKOLOGIN NÄKÖKULMA Johanna Mattson dosentti ylilääkäri, vs. toimialajohtaja HYKS Syöpäkeskus 28.11.2016 1 RINTASYÖPÄ SUOMESSA 5008 uutta tapausta vuonna 2014 Paikallinen rintasyöpä
Lääketeollisuus ry kevätseminaari VIISAITA PÄÄTÖKSIÄ KUSTANNUSVAIKUTTAVUUDELLA. Teija Kotomäki. Yhteiskuntasuhdejohtaja
 Lääketeollisuus ry kevätseminaari VIISAITA PÄÄTÖKSIÄ KUSTANNUSVAIKUTTAVUUDELLA Vaikuttavuustieto ja mittaaminen. Miten ja millaista tietoa tulisi kerätä? Miten saadaan tietoa kustannusvaikuttavista ja
Lääketeollisuus ry kevätseminaari VIISAITA PÄÄTÖKSIÄ KUSTANNUSVAIKUTTAVUUDELLA Vaikuttavuustieto ja mittaaminen. Miten ja millaista tietoa tulisi kerätä? Miten saadaan tietoa kustannusvaikuttavista ja
Jyviä ja akanoita Milloin seulonta lisää terveyttä? Prof. Marjukka Mäkelä FinOHTA/Stakes
 Jyviä ja akanoita Milloin seulonta lisää terveyttä? Prof. Marjukka Mäkelä FinOHTA/Stakes Jyviä ja akanoita Leikkuupuimuri seuloo jyvät mukaan ja akanat pois. Terveydenhuollon seulonnoissa halutaan löytää
Jyviä ja akanoita Milloin seulonta lisää terveyttä? Prof. Marjukka Mäkelä FinOHTA/Stakes Jyviä ja akanoita Leikkuupuimuri seuloo jyvät mukaan ja akanat pois. Terveydenhuollon seulonnoissa halutaan löytää
Tutkimuksesta vastaavan henkilön eettinen arvio tutkimussuunnitelmasta. Tapani Keränen TAYS
 eettinen arvio tutkimussuunnitelmasta Tapani Keränen TAYS eettinen arvio tutkimussuunnitelmasta: perusteet Tutkimuksesta vastaavan henkilön (TVH) tulee havaita ja arvioida tutkimukseen liittyvät eettiset
eettinen arvio tutkimussuunnitelmasta Tapani Keränen TAYS eettinen arvio tutkimussuunnitelmasta: perusteet Tutkimuksesta vastaavan henkilön (TVH) tulee havaita ja arvioida tutkimukseen liittyvät eettiset
Uutta lääkkeistä: Ulipristaali
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Ulipristaali Annikka Kalliokoski Esmya, 5 mg tabletti, PregLem France SAS. Ulipristaaliasetaattia voidaan käyttää kohdun myoomien
Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Ulipristaali Annikka Kalliokoski Esmya, 5 mg tabletti, PregLem France SAS. Ulipristaaliasetaattia voidaan käyttää kohdun myoomien
Syöpäpotilaan luunhoito
 Syöpäpotilaan luunhoito Petteri Hervonen Syöpätautien el, LT Oyl, HYKS Syöpäkeskus 18.4.2018 ja 26.4.2018 Syöpäpotilaan luunhoito Eturauhassyöpäpotilaan luunhoito Hormonaalinen liitännäishoito Levinneen
Syöpäpotilaan luunhoito Petteri Hervonen Syöpätautien el, LT Oyl, HYKS Syöpäkeskus 18.4.2018 ja 26.4.2018 Syöpäpotilaan luunhoito Eturauhassyöpäpotilaan luunhoito Hormonaalinen liitännäishoito Levinneen
EOAK 1165/2018. Ratkaisija: Apulaisoikeusasiamiehen sijainen Mikko Sarja. Esittelijä: Esittelijäneuvos Kaija Tanttinen-Laakkonen
 5.7.2019 EOAK 1165/2018 Ratkaisija: Apulaisoikeusasiamiehen sijainen Mikko Sarja Esittelijä: Esittelijäneuvos Kaija Tanttinen-Laakkonen SMA-SAIRAUTTA SAIRASTAVAN LAPSEN LÄÄKEHOITO 1 KANTELU Kantelija arvosteli
5.7.2019 EOAK 1165/2018 Ratkaisija: Apulaisoikeusasiamiehen sijainen Mikko Sarja Esittelijä: Esittelijäneuvos Kaija Tanttinen-Laakkonen SMA-SAIRAUTTA SAIRASTAVAN LAPSEN LÄÄKEHOITO 1 KANTELU Kantelija arvosteli
annetaan suosituksia palveluvalikoiman sisällöstä ja lausuntoja palveluvalikoiman soveltamisesta.
 PALVELUVALIKOIMANEUVOSTON TOIMINTASUUNNITELMA 2019 Lyhyesti Palkosta Terveydenhuollon palveluvalikoimaneuvoston (Palko) tehtävänä on antaa suosituksia siitä, mitkä palvelut kuuluvat julkisesti rahoitettuun
PALVELUVALIKOIMANEUVOSTON TOIMINTASUUNNITELMA 2019 Lyhyesti Palkosta Terveydenhuollon palveluvalikoimaneuvoston (Palko) tehtävänä on antaa suosituksia siitä, mitkä palvelut kuuluvat julkisesti rahoitettuun
PÄÄASIALLINEN SISÄLTÖ
 HE 37/2001 vp Hallituksen esitys Eduskunnalle laiksi sairausvakuutuslain 5 a ja 9 :n muuttamisesta ESITYKSEN PÄÄASIALLINEN SISÄLTÖ Esityksessä ehdotetaan, että sairausvakuutuslakia alemmanasteisten lääkekorvauksia
HE 37/2001 vp Hallituksen esitys Eduskunnalle laiksi sairausvakuutuslain 5 a ja 9 :n muuttamisesta ESITYKSEN PÄÄASIALLINEN SISÄLTÖ Esityksessä ehdotetaan, että sairausvakuutuslakia alemmanasteisten lääkekorvauksia
Lääkkeiden korvattavuus
 Sosiaaliturvan abc toimittajille 26.5.2011 Lääkkeiden korvattavuus Suomessa Päivi Kaikkonen yliproviisori Kela Terveysosasto 1 Lääkehuollon ja lääkekorvausjärjestelmän tavoitteita Mahdollistaa tehokas,
Sosiaaliturvan abc toimittajille 26.5.2011 Lääkkeiden korvattavuus Suomessa Päivi Kaikkonen yliproviisori Kela Terveysosasto 1 Lääkehuollon ja lääkekorvausjärjestelmän tavoitteita Mahdollistaa tehokas,
Lääkkeet osana perustoimeentulotukea Erityislupavalmisteet
 Lääkkeet osana perustoimeentulotukea Erityislupavalmisteet Kelan miniseminaari 6.3.2018 Liisa Näveri, yksikön päällikkö Fimea Ensisijaisesti tulisi aina käyttää myyntiluvallisia lääkevalmisteita Lääkevalmisteella
Lääkkeet osana perustoimeentulotukea Erityislupavalmisteet Kelan miniseminaari 6.3.2018 Liisa Näveri, yksikön päällikkö Fimea Ensisijaisesti tulisi aina käyttää myyntiluvallisia lääkevalmisteita Lääkevalmisteella
Miten syövän hoidon hyötyä mitataan? Olli Tenhunen LT FIMEA/PPSHP
 Miten syövän hoidon hyötyä mitataan? Olli Tenhunen LT FIMEA/PPSHP Disclosures No interests in pharmaceutical industry Member of EMA Scientific Advice Working Party, Oncology Working Party, Committee for
Miten syövän hoidon hyötyä mitataan? Olli Tenhunen LT FIMEA/PPSHP Disclosures No interests in pharmaceutical industry Member of EMA Scientific Advice Working Party, Oncology Working Party, Committee for
Lääketaloustiede. UEF // University of Eastern Finland. Janne Martikainen professori Farmasian laitos Itä-Suomen yliopisto Tel.
 Lääketaloustiede Janne Martikainen professori Farmasian laitos Itä-Suomen yliopisto Tel. 040 355 2600 Terveydenhuollon menetelmien arviointi käyttöönottopäätösten tukena Terveydenhuollon nykytilanne -
Lääketaloustiede Janne Martikainen professori Farmasian laitos Itä-Suomen yliopisto Tel. 040 355 2600 Terveydenhuollon menetelmien arviointi käyttöönottopäätösten tukena Terveydenhuollon nykytilanne -
Pandemian kulku Suomessa eri seurantamittarein Markku Kuusi Ylilääkäri Tartuntatautien torjuntayksikkö
 Pandemian kulku Suomessa eri seurantamittarein Markku Kuusi Ylilääkäri Tartuntatautien torjuntayksikkö Pandemian seurantajärjestelmät Tartuntatautirekisteri Yksittäisten tapausten seuranta Laboratorionäytteet
Pandemian kulku Suomessa eri seurantamittarein Markku Kuusi Ylilääkäri Tartuntatautien torjuntayksikkö Pandemian seurantajärjestelmät Tartuntatautirekisteri Yksittäisten tapausten seuranta Laboratorionäytteet
IÄKKÄIDEN LÄÄKITYKSEN TIETOKANTA. Jouni Ahonen, FaT, KYS 19.9.2013 Fimea
 IÄKKÄIDEN LÄÄKITYKSEN TIETOKANTA Jouni Ahonen, FaT, KYS 19.9.2013 Fimea IÄKKÄILLÄ VÄLTETTÄVÄ LÄÄKEAINE 1. Haittavaikutusriski suurempi kuin kliininen hyöty 2. Liian suuri annos 3. Liian pitkä käyttöaika
IÄKKÄIDEN LÄÄKITYKSEN TIETOKANTA Jouni Ahonen, FaT, KYS 19.9.2013 Fimea IÄKKÄILLÄ VÄLTETTÄVÄ LÄÄKEAINE 1. Haittavaikutusriski suurempi kuin kliininen hyöty 2. Liian suuri annos 3. Liian pitkä käyttöaika
Perusseikkoja julkista yhteenvetoa varten
 Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Syöpäjärjestöt kuntoutumisen tukena
 Syöpäjärjestöt kuntoutumisen tukena Ylilääkäri, LT, dosentti Suomen Syöpäyhdistys ry SYÖPÄJÄRJESTÖT Syöpäjärjestöillä tarkoitetaan Suomen Syöpäyhdistyksen ja Syöpäsäätiön muodostamaa kokonaisuutta. Suomen
Syöpäjärjestöt kuntoutumisen tukena Ylilääkäri, LT, dosentti Suomen Syöpäyhdistys ry SYÖPÄJÄRJESTÖT Syöpäjärjestöillä tarkoitetaan Suomen Syöpäyhdistyksen ja Syöpäsäätiön muodostamaa kokonaisuutta. Suomen
Hoitaminen. Yhdessä kohti terveyttä ja hyvinvointia. Potilas. Potilas. Liite 1, LTK 6/2010. Palvelut - valikoima - vaikuttavuus ja laatu
 Yhdessä kohti terveyttä ja hyvinvointia Liite 1, LTK 6/2010 Potilas Vetovoimaisuus - julkinen kuva -ympäristö Palvelut - valikoima - vaikuttavuus ja laatu Hoitaminen Asiointi ja viestintä - sähköinen asiointi
Yhdessä kohti terveyttä ja hyvinvointia Liite 1, LTK 6/2010 Potilas Vetovoimaisuus - julkinen kuva -ympäristö Palvelut - valikoima - vaikuttavuus ja laatu Hoitaminen Asiointi ja viestintä - sähköinen asiointi
Lyhyt historia Fimea aloitti toimintansa Kuopiossa. Lääkealan turvallisuus- ja kehittämiskeskus. GLP-tilaisuus Eija Pelkonen
 Lyhyt historia 10.9.2008 Projektin asettaminen (STM105:00/2008) 19.1.2009 Perustamispäätös: Kuopio (STM/298/2009) 24.7.2009 Laki (593/2009) vahvistettiin (VN+TP) 13.8.2009 Asetus hyväksyttiin valtioneuvostossa
Lyhyt historia 10.9.2008 Projektin asettaminen (STM105:00/2008) 19.1.2009 Perustamispäätös: Kuopio (STM/298/2009) 24.7.2009 Laki (593/2009) vahvistettiin (VN+TP) 13.8.2009 Asetus hyväksyttiin valtioneuvostossa
(12) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI. 1 Arviointiprosessin tavoitteet
 14.6.2018 1 (12) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI 1 Arviointiprosessin tavoitteet Sairaalalääkkeiden nopean arvioinnin tavoitteena on: lisätä lääkkeen käyttöönottopäätöksissä tarvittavaa tietoa
14.6.2018 1 (12) UUSIEN SAIRAALALÄÄKKEIDEN NOPEA ARVIOINTI 1 Arviointiprosessin tavoitteet Sairaalalääkkeiden nopean arvioinnin tavoitteena on: lisätä lääkkeen käyttöönottopäätöksissä tarvittavaa tietoa
Tervekudosten huomiointi rinnan sädehoidossa
 Tervekudosten huomiointi rinnan sädehoidossa Onkologiapäivät 30.8.2013 Sairaalafyysikko Sami Suilamo Tyks, Syöpäklinikka Esityksen sisältöä Tervekudoshaittojen todennäköisyyksiä Tervekudosten annostoleransseja
Tervekudosten huomiointi rinnan sädehoidossa Onkologiapäivät 30.8.2013 Sairaalafyysikko Sami Suilamo Tyks, Syöpäklinikka Esityksen sisältöä Tervekudoshaittojen todennäköisyyksiä Tervekudosten annostoleransseja
Suomen Reumatologisen Yhdistyksen (SRY) kannanotto biosimilaarilääkkeisiin (biologisiin kopiolääkkeisiin)
 Suomen Reumatologisen Yhdistyksen (SRY) kannanotto biosimilaarilääkkeisiin (biologisiin kopiolääkkeisiin) Taustaa Biosimilaarilääke on patenttisuojansa menettäneen biologisen alkuperäislääkkeen samankaltainen,
Suomen Reumatologisen Yhdistyksen (SRY) kannanotto biosimilaarilääkkeisiin (biologisiin kopiolääkkeisiin) Taustaa Biosimilaarilääke on patenttisuojansa menettäneen biologisen alkuperäislääkkeen samankaltainen,
Kehittyneet terapiat ja kalliit lääkehoidot. Vesa Kiviniemi Arviointipäällikkö Fimea
 Kehittyneet terapiat ja kalliit lääkehoidot Vesa Kiviniemi Arviointipäällikkö Fimea Seminaarissa suurennuslasin alla Mitä lääkekehityksen horisontissa näkyy? Kehittyneet terapiat ja kalliit lääkehoidot
Kehittyneet terapiat ja kalliit lääkehoidot Vesa Kiviniemi Arviointipäällikkö Fimea Seminaarissa suurennuslasin alla Mitä lääkekehityksen horisontissa näkyy? Kehittyneet terapiat ja kalliit lääkehoidot
Suomen Syöpärekisteri Syöpätautien tilastollinen ja epidemiologinen tutkimuslaitos. Syöpäpotilaiden eloonjäämisluvut alueittain
 Syöpäpotilaiden eloonjäämisluvut alueittain Sivuilla 2 15 esitetään ikävakioidut suhteelliset elossaololuvut yliopistollisten sairaaloiden vastuualueilla vuosina 2007 2014 todetuilla ja 2012 2014 seuratuilla
Syöpäpotilaiden eloonjäämisluvut alueittain Sivuilla 2 15 esitetään ikävakioidut suhteelliset elossaololuvut yliopistollisten sairaaloiden vastuualueilla vuosina 2007 2014 todetuilla ja 2012 2014 seuratuilla
Pertutsumabi on nisäkkään (kiinanhamsterin munasarja) soluissa rekombinantti DNA teknologialla tuotettu humanisoitu monoklonaalinen IgG1-vasta-aine.
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista.
Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista.
Eettisen toimikunnan ja TUKIJA:n vuorovaikutuksesta. Tapani Keränen Kuopion yliopisto
 Eettisen toimikunnan ja TUKIJA:n vuorovaikutuksesta Tapani Keränen Kuopion yliopisto Helsingin julistus Ennen kuin ihmiseen kohdistuvaan lääketieteelliseen tutkimustyöhön ryhdytään, on huolellisesti arvioitava
Eettisen toimikunnan ja TUKIJA:n vuorovaikutuksesta Tapani Keränen Kuopion yliopisto Helsingin julistus Ennen kuin ihmiseen kohdistuvaan lääketieteelliseen tutkimustyöhön ryhdytään, on huolellisesti arvioitava
Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio)
 28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
PET-tutkimusten vaikuttavuus ja kustannukset. Esko Vanninen palvelualuejohtaja Kuopion yliopistollinen sairaala
 PET-tutkimusten vaikuttavuus ja kustannukset Esko Vanninen palvelualuejohtaja Kuopion yliopistollinen sairaala ISI Web of Science: hakusana PET/CT N = 4974, 27.4.2010 Mihin diagnostisia menetelmiä tarvitaan?
PET-tutkimusten vaikuttavuus ja kustannukset Esko Vanninen palvelualuejohtaja Kuopion yliopistollinen sairaala ISI Web of Science: hakusana PET/CT N = 4974, 27.4.2010 Mihin diagnostisia menetelmiä tarvitaan?
