LAPPEENRANNAN TEKNILLINEN YLIOPISTO Kemiantekniikan osasto Paperitekniikan laboratorio MANGAANI MEKAANISEN MASSAN PEROKSIDIVALKAISUSSA
|
|
|
- Kirsti Haapasalo
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 LAPPEENRANNAN TEKNILLINEN YLIOPISTO Kemiantekniikan osasto Paperitekniikan laboratorio MANGAANI MEKAANISEN MASSAN PEROKSIDIVALKAISUSSA Diplomityön aihe on hyväksytty Kemiantekniikan osaston osastoneuvostossa Työn tarkastaja: Professori Hannu Manner Työn ohjaaja: Tkt Jari Käyhkö Juha Tamper Ravunkatu Lappeenranta p
2 TIIVISTELMÄ Lappeenrannan teknillinen yliopisto Kemiantekniikan osasto Juha Tamper Mangaani mekaanisen massan peroksidivalkaisussa Diplomityö sivua, 54 kuvaa ja 5 taulukkoa Tarkastaja: Professori Hannu Manner Hakusanat: Mangaani, hapetusaste, mekaaninen massa, peroksidi, valkaisu, kelatointi Keywords: Manganese, oxidation state, mechanical pulp, peroxide, bleaching, chelation Mangaanilla on havaittu olevan haitallisia vaikutuksia mekaanisen massan peroksidivalkaisussa. Suurin ongelma on mangaanin katalyyttisen aktiivisuuden aiheuttama peroksidin hajoaminen. On havaittu, että mangaanin hapetusasteella voisi olla merkittävä vaikutus mangaanin kelatoitumiseen sekä sen katalysoimaan peroksidin hajoamiseen valkaisun aikana. Työssä selvitettiin, miten massan mangaanipitoisuus ja mangaanin hapetusasteen muutos vaikuttavat valkaisuun ja mangaanin kelatoitumiseen. Laboratoriokokeiden tulokset osoittavat, että mangaani kelatoituu hapetusasteilla +II ja +III happamissa oloissa yhtä hyvin. ph:n nousu heikentää enemmän hapetusasteella +III olevan mangaanin kelatoitumista. Mangaani ei kelatoidu hapetusasteella +IV lainkaan. Valkaisukokeiden perusteella mangaani katalysoi peroksidin hajoamista hapetusasteilla +II ja +III yhtä voimakkaasti, mikä näkyy samalla vaaleuden nousun heikkenemisenä peroksidin määrän vähetessä. Mn(IV) ei katalysoi peroksidin hajoamista ollenkaan ja sen vaikutus vaaleuteen on selvästi pienempi kuin hapetusasteilla +II ja +III. Laboratoriokokeiden tulokset osoittavat myös, että kompleksinmuodostajalla on valkaisussa selvä positiivinen vaikutus. DTPA estää hapetusasteen +II katalyyttistä aktiivisuutta voimakkaammin kuin hapetusasteen +III. Valkaisusakeuden nosto pienensi mangaanin katalyyttistä aktiivisuutta, minkä oletettiin johtuvan stabilointikemikaalien konsentraation noususta.
3 ABSTRACT Lappeenranta University of Technology Department of Chemical Technology Juha Tamper Manganese in peroxide bleaching of mechanical pulp Master s thesis pages, 54 figures and 5 tables Supervisor: Professor Hannu Manner Keywords: Manganese, oxidation state, mechanical pulp, peroxide, bleaching, chelation Manganese has detrimental effects on the peroxide bleaching of mechanical pulp. Biggest problem is the decomposition of hydrogen peroxide by the catalytic activity of manganese. It has been noticed that the oxidation state of manganese can have remarkable effect on the chelation of manganese and the decomposition of hydrogen peroxide. In this thesis it was studied how the content and the oxidation state of manganese effect on the bleaching and chelation of manganese. In acidic conditions manganese was equally chelatable at oxidation states +II and +III. The increase of alkalinity had more detrimental effect on the chelation of manganese at oxidation state +III than at oxidation state +II. Manganese was not chelatable at oxidation state +IV. In the bleaching studies Mn(III) and Mn(II) had a similar effect on the decomposition of peroxide and also on the brightness gain. Mn(IV) did not catalyze peroxide decomposition at all and its effect to the brightness was minor than at oxidation states +II and +III. Use of chelating agents in the bleaching decreased the catalytic activity of manganese effectively. DTPA prevented the catalytic activity of manganese at oxidation state +II more effectively than at oxidation state +III. At the higher bleaching consistency the effect of manganese was decreased and the reason for this was assumed to be the higher concentration of stabilizing chemicals.
4 1 SISÄLLYSLUETTELO SYMBOLIT 1 JOHDANTO 4 KIRJALLISUUSOSA 2 MEKAANISEN MASSAN PEROKSIDIVALKAISU Valkaisureaktiot Prosessimuuttujien vaikutukset valkaisussa Peroksidiannos ph Sakeus Lämpötila 9 3 SIIRTYMÄMETALLIT MEKAANISEN MASSAN VALMISTUKSESSA Mangaani Rauta ja kupari 10 4 METALLIEN SITOUTUMINEN Adsorptio massaan Kelatoituminen Perusteoriaa kelatoinnista Mangaanin kelatointi 16 5 MANGAANI PEROKSIDIVALKAISUSSA Mangaanin katalysoima peroksidin hajoaminen Katalyysimekanismit Mangaanin vaikutus vaaleuteen 28 6 MANGAANIN STABILOINTIMEKANISMIT PEROKSIDIVALKAISUSSA Kelatointi valkaisussa Silikaatti Magnesiumsulfaatti 36 7 YHTEENVETO KIRJALLISUUDESTA 39
5 2 KOKEELLINEN OSA 8 KOKEELLISEN OSAN TAVOITTEET 40 9 KÄYTETYT MATERIAALIT JA MENETELMÄT Kelatointikokeet Valkaisukikokeet Vesiliuoskokeet MANGAANIN KELATOITUMINEN Hapetusasteen vaikutus mangaanin kelatoitumiseen ph:n vaikutus mangaanin kelatoitumiseen MANGAANI VALKAISUSSA Mangaanin hapetusasteen ja määrän vaikutus peroksidin kulutukseen ja massan vaaleuteen Valkaisusakeuden vaikutus Mangaanin adsorptio massaan valkaisun aikana DTPA valkaisussa DTPA pesemättömän massan valkaisussa DTPA pestyn massan valkaisussa Pesussa poistuvan orgaanisen aineksen vaikutus valkaisuun VESILIUOSKOKEET Liukenevuuskokeet Mangaanin vaikutus peroksidin hajoamiseen ilman kuituja YHTEENVETO JA JOHTOPÄÄTÖKSET 70 KIRJALLISUUS 72
6 3 SYMBOLIT c metalli-ioninen pitoisuus liuoksessa, mol/l K kelatointivakio, - K L Langmuirin isotermin adsorptiovakio, - [L] vapaiden ligandien konsentraatio, mol/l [M] vapaiden metalli-ionien konsentraatio, mol/l [ML] kelatoituneiden metalli-ionien konsentraatio, mol/l S selluloosaan adsorboitunneiden metalli-ionien määrä, - S max selluloosaan maksimissaan adsorboituva metalli-ionien määrä, -
7 4 1 JOHDANTO Vedenkäytön vähentäminen aiheuttaa erilaisia ongelmia massan ja paperin valmistuksessa, jotka vaativat prosessien hallintaan vaikuttavien tekijöiden yhä parempaa tuntemista. Metalleilla, kuten mangaani, rauta ja kupari on haitallisia vaikutuksia mekaanisen massan peroksidivalkaisussa. Suurin ongelma muodostuu näiden metallien peroksidin hajoamista katalysoivista ja vaaleutta heikentävistä vaikutuksista. Näiden metallien vaikutuksia mekaanisen massan peroksidivalkaisussa on tutkittu paljon, mutta asiaa ei vielä täysin tunneta. Referenssituloksia mangaanin vaikutuksista valkaistavuuteen on niukasti. Mangaanin osalta on havaittu, että sen hapetusaste voisi vaikuttaa merkittävästi kelatoitumiseen sekä peroksidin hajoamiseen valkaisun aikana. Mangaani on prosessissa pääosin hapetusasteella +II, mutta sen esiintyminen myös muilla hapetusasteilla on mahdollista. Työn tavoitteena oli selvittää, miten massan mangaanipitoisuuden vaihtelut sekä mangaanin hapetusaste vaikuttavat massan valkaistavuuteen. Lisäksi tutkittiin mangaanin hapetusasteen vaikutusta mangaanin kelatoitumiseen. Kirjallisuusosassa on koostettu teoriaa ja referenssituloksia mangaanin ja sen hapetusasteen vaikutuksista massan vaaleuteen ja peroksidin kulutukseen sekä mangaanin katalysoimista peroksidia hajottavista reaktiomekanismeista valkaisussa. Lisäksi on arvioitu kuinka stabilointiaineiden käytöllä voidaan eliminoida mangaanin negatiivisia vaikutuksia. Kirjallisuusosaan on koostettu myös tuloksia raudan ja kuparin vaikutuksista valkaisussa. Kokeellinen osa on jaettu kolmeen osaan. Kelatointikokeisiin, joissa selvitettiin mangaanin määrän ja hapetusasteen vaikutusta kelatoitumiseen. Valkaisukokeisiin, joissa tutkitttiin mangaanin määrän ja hapetusasteen vaikutusta peroksidin kulutukseen ja massan vaaleuteen sekä vesiliuoskokeisiin, joissa selvitettiin mangaanin määrän ja hapetusasteen vaikutusta peroksidin hajoamisnopeuteen valkaisua vastaavissa tilanteissa siten, että kuituja ei ollut läsnä.
8 5 2 MEKAANISEN MASSAN PEROKSIDIVALKAISU Mekaanisen massan valkaisussa yleisimmin käytetty kemikaali on vetyperoksidi. Vetyperoksidi on heikosti sinertävä, siirappimainen neste. Se on hyvin pysymätön ja hajoaa usein räjähdysmäisesti varsinkin orgaanisten yhdisteiden läsnäollessa. Vetyperoksidi on voimakas hapetin, mutta erittäin voimakkaiden hapettimien kanssa se voi toimia myös pelkistimenä /1/. Vetyperoksidia toimitetaan yleensä 50 % vesiliuoksena tehtaille, jossa se laimennetaan ennen käyttöä /2/. 2.1 Valkaisureaktiot Vetyperoksidin massaa valkaiseva vaikutus perustuu perhydroksyyli-ionin OOH - nukleofiilisiin reaktioihin ligniinin kromoforiyhdisteiden kanssa /2,3/. Tämän lisäksi valkaisevia reaktioita voi tapahtua myös ligniinin fenolisten rakenteiden hajotessa hapettumalla, kuten kuvassa 1 on esitetty /2,3/. a) b) Kuva 1. a) ligniinin värillisten kromoforiyhdisteiden ja b) fenolisten rakenteiden reaktioita vetyperoksidin kanssa /2/. Vetyperoksidi on stabiili ph:n ollessa happaman puolella, mutta alkalisuuden kasvaessa peroksidin dissosioituminen alkaa reaktioyhtälön (1) mukaisesti muodostaen valkaisussa tarvittavan perhydroksyyli-ionin /3, 4, 5/: H 2 O 2 + OH - H 2 O + OOH - (1)
9 6 Vetyperoksidi voi hajota alkalisissa oloissa myös itsekseen, jolloin se reagoi muodostuneen perhydroksyyli-ionin kanssa hajoten vedeksi ja hapeksi reaktioyhtälön 2 mukaisesti /4,6/: H 2 O 2 + OOH - O 2 +H 2 O + OH - (2) Erään tutkimuksen mukaan runsaasti ligniiniä sisältävien massojen peroksidivalkaisussa valkaisevien reaktioiden rinnalla tapahtuu kilpailevia, värillisiä kromoforeja muodostavia reaktioita. Reaktiot ovat seurausta hydroksyyliradikaalien muodostumisesta erityisesti metallien katalysoidessa peroksidin hajoamista /7/. 2.2 Prosessimuuttujien vaikutukset valkaisussa Peroksidiannos Peroksidin kulumiseen valkaisun aikana vaikuttavia prosessimuuttujia ovat ph, sakeus ja lämpötila. Tavallisesti mekaanisen massan valkaisussa käytetty peroksidiannos vaihtelee 1-3 % välillä /8/. Kuvassa 2 on esitetty suuntaa antava peroksidin määrän vaikutus vaaleuden nousuun. Kuva 2. Peroksidiannoksen vaikutus vaaleuden nousuun /2/.
10 7 Kuvasta 2 nähdään, että jo yhden prosentin peroksidiannoksella ISO vaaleus nousee 6-8 % ja maksimivaaleus saavutetaan 3-4 % peroksidiannoksella. Riittävä peroksidiannos voidaan määrittää myös jäännösperoksidin avulla. Erään tutkimuksen mukaan optimivaaleus hiokkeella saadaan, kun jäännösperoksidia on vähintään 10 % /9/. Valkaisussa on tärkeää, että peroksidi ei pääse kulumaan loppuun. Valkaisuoloissa peroksidi estää massan alkalisen tummumisen. Alkalinen tummuminen valkaisun jälkeen estetään loppuhapotuksella, jossa ph lasketaan alle seitsemän, tavallisesti tasolle 5-6 rikkihapon, bisulfiitin tai rikkidioksidiveden avulla /2/ ph Valkaisu tapahtuu alkalisissa oloissa, jotta yhtälön 1 mukainen reaktio olisi mahdollinen. Maksimiteho valkaisussa saadaan ph:n ollessa 11-11,5 /6/. Liian korkeassa ph:ssa tapahtuu enemmän ei toivottua, yhtälön 2 mukaista peroksidin hajoamista /4/, jolloin kemikaaleja kuluu tarpeettomasti. Optimaalinen ph riippuu käytetyn peroksidin määrästä /2/. Mitä enemmän peroksidia käytetään, sitä enemmän tarvitaan natriumhydroksidia, kuten kuvassa 3 on esitetty. Kuva 3. Tarvittavan NaOH-annoksen määrä, jotta ph valkaisun alussa olisi 11,5 /2/.
11 Sakeus Valkaisusakeudella on havaittu olevan merkittävä vaikutus mekaanisen massan peroksidivalkaisussa. Kuvassa 4 on erään tutkimuksen tulos, jonka mukaan vaaleuden nousu olisi suorassa suhteessa valkaisusakeuden neliöjuureen /7/. Kuva 4. Sakeuden neliöjuuren vaikutus tehtaalla kelatoidun TMP massan vaaleuden nousuun peroksidivalkaisussa /7/. (60 C, 120 min, 3,2 % H 2 O 2, 3 % Na 2 SiO 3, 0,05 % MgSO 4, 2,4 % NaOH, massan alkuvaaleus 59,0 % ISO) Vaaleuden paranemiselle valkaistaessa korkeammassa sakeudessa on esitetty seuraavanlaisia syitä: - Valkaisukemikaalien suurempi konsentraatio /2/ - Suuremmat reaktionopeudet /2/ - Vähäisempi epäpuhtauksien määrä /2/ - Suurempi osa peroksidista on kuituseinien sisäpuolella, jolloin valkaisevat reaktiot pääsevät tapahtumaan nopeammin /7/ Edellä mainittujen syiden seurauksena peroksidia kuluu siis vähemmän hyödyttömiin reaktioihin, jolloin tarvittavan peroksidin määrä vähenee ja vaaleuden nousu paranee.
12 Lämpötila Lämpötilan vaikutus valkaisussa perustuu reaktionopeuden kasvamiseen lämpötilan noustessa. Korkeammassa lämpötilassa valkaisureaktiot tapahtuvat nopeammin, mutta samalla myös peroksidin hajoaminen nopeutuu /2/. Lämpötila ei siis vaikuta tarvittavan peroksidin määrään, vaan ainoastaan valkaisuaikaan. Kuvassa 5 on esitetty erään tutkimuksen tulos lämpötilan vaikutuksesta peroksidin hajoamiseen vesiliuoksessa. Kuva 5. Lämpötilan vaikutus peroksidin hajoamiseen vesiliuoksessa /10/. (ph 10) Mekaanisen massan tornivalkaisu tehdään yleensä C lämpötiloissa /2/. Korkeammissa lämpötiloissa vaaleuden nousu on nopeampaa, mutta samalla kasvaa myös massan tummumisreaktioiden riski /2/.
13 10 3 SIIRTYMÄMETALLIT MEKAANISEN MASSAN VALMISTUKSESSA Metallit aiheuttavat eniten ongelmia valkaisussa. Joidenkin tutkimusten mukaan jopa kolmasosa valkaisukapasiteetista voidaan menettää metallien takia /11/. Eri metallit käyttäytyvät valkaisussa hieman eri tavoin. Jotkut heikentävät massan vaaleutta, kun taas toiset katalysoivat peroksidin hajoamista voimakkaasti. Metallien vaikutuksia voidaan vähentää käyttämällä ennen valkaisua kelatointiaineita, kuten DTPA (dietyleenitriamiinipentaetikkahappo) tai EDTA (etyleenidiamiinitetraetikkahappo), ja pesemällä kelaatin ja metallin muodostamat kompleksit pois. 3.1 Mangaani Mangaania tulee prosessiin pääosin vain raaka-aineen eli puun mukana /11/. Puun mangaanipitoisuus riippuu voimakkaasti puun kasvupaikasta ja puulajista. Pohjoismaisen kuusen mangaanipitoisuus vaihtelee välillä ppm /11/, kun taas Pohjois-Amerikassa on mitattu jopa puolet suurempia pitoisuuksia. Valkaisuun menevän mangaanin määrä riippuu kelatoinnin onnistumisesta ja kelatoinnin jälkeisen pesun tehokkuudesta. Mangaani on rautaan ja kupariin verrattuna selvästi heikoimmin kiinni massassa ja siten helposti poistettavissa massasta. Pohjoismaista kuusta käytettäessä valkaisuun menevän mangaanin määrä vaihtelee yleensä välillä 5-20 ppm /12/. Mangaanilla ei ole havaittu olevan suoranaista vaikutusta vaaleuteen /13, 14, 15/, mutta se katalysoi peroksidin hajoamista erittäin voimakkaasti /16/. Mangaani katalysoi peroksidin hajoamista tehokkaammin kuin rauta ja kupari /17/. 3.2 Rauta ja kupari Rautaa ja kuparia tulee mekaaniseen massaan sekä puun mukana, että prosessista. Raudan määrä voi vaihdella tehdaskohtaisesti paljon. Rautapitoisuus vaihtelee yleensä välillä ppm ja kuparipitoisuus välillä 2-10 ppm /12/.
14 11 Kelatointi on raudan ja kuparin osalta huomattavasti tehottomampaa verrattuna mangaaniin. Kun mangaanista saadaan yleensä kelatoitua yli 90 %, niin raudasta ja kuparista saadaan poistettua kelatoinnilla vain alle kolmasosa. Valkaisuun menevän raudan määrä voi siis helposti nousta mangaanin määrää suuremmaksi kuparipitoisuuden jäädessä pienen alkupitoisuutensa takia selvästi pienimmäksi. Raudan negatiiviset vaikutukset vaaleuteen näistä kolmesta metallista ovat selvästi suurimmat /13,15/. Kupari katalysoi peroksidin hajoamista, mutta pienen pitoisuutensa takia sen vaikutukset jäävät selvästi mangaanin vaikutuksia pienemmiksi. 4 METALLIEN SITOUTUMINEN Metallien sitoutuminen massaan ja erilaisten saostumien muodostuminen riippuvat prosessiolosuhteista ja käytetyistä kemikaaleista. Metallit voivat sitoutua mekaaniseen massaan joko adsorboitumalla kuidun pinnalle tai ionisidoksella kuituun. Metallien poistamiseksi tai metallien muuttamiseksi inerttiin muotoon, tärkein menetelmä on kelatointi. Lisäksi metallit voivat muodostaa orgaanisia ja epäorgaanisia saostumia /18/. 4.1 Sitoutuminen massaan Mekaanisen massan voidaan ajatella toimivan eräänlaisena ioninvaihtimena. Tämä johtuu kuitujen ja hienoaineen sisältämistä karboksyyli- ja hydroksyyliryhmistä /18/. Kun selluloosassa tai ligniinissä oleva karboksyyliryhmä protolysoituu, se saa negatiivisen varauksen, kuten kuvassa 6. O O C + OH - C + H 2 O OH O - Kuva 6. Karboksyyliryhmän protolysoituminen hiukkasen pinnalla /19/.
15 12 Kuvasta 6 nähdään, että mitä suurempi on OH - ionien konsentraatio, sitä suuremman negatiivisen varauksen selluloosa saa /19/. Negatiivisesti varautunut selluloosapinta vetää puoleensa positiivisia metalli-ioneja ja positiivisesti varautuneita metallikomplekseja. Metallien sitoutumishalukkuus kuituihin ja hienoaineeseen riippuu siis negatiivisen pintavarauksen suuruudesta, johon vaikuttaa olennaisesti massan ph. Metalli-ionien adsorptiota massaan voidaan kuvata Langmuirin adsorptioisotermillä /3/: S=S max (K L c/(1+k L c)) (3) jossa S selluloosaan adsorboituneiden määrä S max K L c selluloosaan maksimissaan adsorboituva määrä Langmuirin isotermin adsorptiovakio metalli-ioninen pitoisuus liuoksessa Yhtälö 3 pätee vain yhden metallin adsorptiolle. Käytännössä systeemi sisältää useita metalleja, jolloin helpommin adsorboituvan metallin lisäys aiheuttaa jo adsorboituneen aineen irtoamista adsorboivasta aineesta /3/. Tilannetta monimutkaistaa vielä eri metalli-ionien erilaiset sitoutumisaffiniteetit. Ioninvaihdolle ominaisesti affiniteetti kasvaa ionin varausluvun kasvaessa.metalli-ionien affiniteeteille havupuumassassa on saatu seuraava järjestys /3/: Fe 3+ > Al 3+ > Cu 2+ > Co 2+ > Ni 2+ > Ca 2+ > Mg 2+ > Mn 2+ > Na + Metalli-ioni voi sitoutua myös ei-ionisesti, jolloin metallihydroksidi kiinnittyy vetysidoksella hydroksidiryhmiin tai positiivinen metallihydroksikolloidi adsorboituu pintavaraukseltaan negatiivisten selluloosamisellien pinnalle /3/. Lisäksi metalli-ioni voi muodostaa melko stabiileja komplekseja lignoselluloosan kanssa. Metalli-ionien ja ligniinin muodostamien kompleksien tasapainovakio on suurempi kuin metalliionien ja selluloosan muodostamilla komplekseilla, joten voidaan olettaa, että metalli-ionit ovat suurimmaksi osaksi kompleksoituneet ligniinin kanssa /20/.
16 13 Metallien kiinnittymiseen kuitujen ja hienoaineen välillä vaikuttaa ominaispinta-ala. Hienoaineen suuremman ominaispinta-alan takia metalleja sitoutuu grammaa kohti noin 2-3 kertaa enemmän hienoaineeseen kuin kuituihin /18/. Sakeilla massoilla on havaittu, että samassa massassa olevat kahdenarvoiset metalli-ionit ovat pääosin adsorboituneina kuitujen pinnalle, kun taas yhdenarvoiset metalli-ionit ovat liuenneina /18/. Toisin sanoen, mitä suurempi varausluku metallilla on, sitä herkemmin se adsorboituu. 4.2 Kelatoituminen Perusteoriaa Metallien poistamiseksi mekaanisesta massasta käytetään kompleksinmuodostajia, joista yleisimpiä ovat DTPA ja EDTA (kuva 7). Kompleksinmuodostajien teho perustuu siihen, että ne muodostavat vesiliukoisia ja stabiilimpia komplekseja metalli-ionien kanssa kuin ligniini tai selluloosa /20/. DTPA (dietyleenitriamiinipentaetikkahappo) EDTA (etyleenidiamiinitetraetikkahappo) Kuva 7. DTPA:n ja EDTA:n kemialliset rakenteet /21/. Kuvan 7 kelaatinmuodostajat ovat eräänlaisia monihampaisia ligandeja. Ligandin hampaat voivat sitoutua samaan keskusatomiin, jolloin muodostuu rengasmainen atomiryhmä. Tällaista kompleksia kutsutaan kelaatiksi /3/. Kuvassa 8 on esitetty miten EDTA voi muodostaa metalli-ionin kanssa kelaattirenkaan.
17 14 Kuva 8. Kaksi erilaista EDTA-metallikompleksia. Kelatointi on tasapainoprosessi, jossa metalli-ionit ovat jakautuneet kelatoituneisiin ja kelatoitumattomiin. Tasapaino voidaan esittää seuraavasti /22/: [M] + [L] [ML] (4) jossa [M] vapaiden metalli-ionien konsentraatio [L] vapaiden ligandien konsentraatio [ML] kelatoituneiden metalli-ionien konsentraatio Yhtälön 4 saavutettua tasapainotilan, voidaan kelatointivakio määrittää: K = [ML] / ( [M] [L] ) (5) jossa K kelatointivakio Kelatointivakio kuvaa kelatoitumisen tehokkuutta. Mitä suurempi kelatoitumisvakion arvo jollakin tietyllä metallilla on, sitä suurempi osa tästä metallista on kelatoituneena. Vastaavasti kahden metallin tapauksessa suuremman kelatointivakion omaava metalli kelatoituu paremmin. Kelatointivakioiden arvot ovat niin suuria, että metalli/kompleksi ainemääräsuhteella 1:1 metallit esiintyvät käytännöllisesti katsoen täysin kelatoituneena.
18 15 Kuvassa 9 on esitetty eräiden metalli-dtpa ja metalli-edta kompleksien kelatoitumisvakioiden logaritmit ph:n muuttuessa. DTPA EDTA Kuva 9. Eräiden metalli-dtpa ja metalli-edta kompleksien kelatoitumisvakioiden logaritmit (log K cond ) ph:n muuttuessa /23/. EDTA ja DTPA sitoutuvat metalli-ionien kanssa moolisuhteessa 1:1 /21,1/. Tarvittava kelaatinmuodostajan annos on siis helposti laskettavissa, jos metallien määrä massassa tiedetään. Paras kelatointitulos saadaan silloin kun massan ph on 4,5-5,5 ja kelatointiaika vähintään puoli tuntia /21/.
19 16 Eräässä tutkimuksessa todetaan, että ligniini voi pidätellä joitakin metalleja, jolloin kelatoituminen huononee /21/. Toisen tutkimuksen mukaan etenkin korkealla hapetusasteella olevat metallit voivat muodostaa erittäin stabiileja komplekseja ligniinin tai muiden ligandien kanssa /24/. Alemmalla hapetusasteella kompleksit eivät ole yhtä stabiileja. Toisaalta on myös havaittu, että esimerkiksi mangaanin hapetusastetta alentamalla ennen kelatointia, esimerkiksi ditioniitilla, saadaan parempi kelatointitulos /24/. Mekaaninen massa voi myös toimia kelatointiaineena /22/. Kelatointivakio puun ja metallin välillä on kuitenkin erittäin paljon pienempi kuin kelatointiaineen ja metallin välillä. Tästä johtuu siis kelatointiaineiden tehokkuus metallien poistajina mekaanisesta massasta. Tavallisesti mekaanisen massan kelatointivaihetta seuraa joko sakeutus puristimella tai pesu, joilla metallit saadaan poistettua massasta Mangaanin kelatointi Mangaani-ionit ovat sitoutuneena massaan yksinomaan ioninvaihtomekanismilla ja ovat siksi haitallisista metalleista helpoimmin poistettavissa /3/. Kuvassa 10 on esitetty erään tutkimuksen tuloksia kompleksinmuodostajan annoksen vaikutuksesta mangaanin poiston tehokkuuteen CTMP massasta, jonka mangaanipitoisuus oli 135 ppm. Kuva 10. Pois pestyn mangaanin määrä EDTA:n ja DTPA:n annostuksen kasvaessa /25/.
20 17 Kuvasta 10 nähdään, että suurimmalla EDTA annoksella saadaan mangaanista pestyä pois 96 %. Vastaava luku DTPA:ta käytettäessä on 79 %. EDTA näyttäisi siis olevan DTPA:ta tehokkaampi mangaania kelatoitaessa, joskin kuvan 11 perustella, jossa esitetään ph:n vaikutusta mangaanin kelatoitumiseen TMP massassa, DTPA näyttäisi toimivan paremmin varsinkin ph:n noustessa yli kahdeksan, jolloin EDTA:n kelatointiteho heikkenee voimakkaasti. Kuva 11. ph:n vaikutus mangaanin kelatoitumiseen /26/. (Sakeus 3 %, 60 C, 15 min, Mn 82 ppm) Muilla olosuhteilla, kuten lämpötilalla, sakeudella ja kelatointiajalla ei näytä olevan merkittävää vaikutusta mangaanin kelatoitumiseen, kuten kuvasta 12 voidaan havaita.
21 18 Kuva 12. Lämpötilan, sakeuden ja kelatointiajan vaikutus mangaanin kelatoitumiseen /26/. (ph 5,5) Mangaanin hapetusasteen vaikutuksesta kelatoitumiseen ei ole olemassa juurikaan tutkimustuloksia. Hapetusaste +II on mangaanin pysyvin, mutta se voi esiintyä myös hapetusasteilla +II - +VII /1/. Mangaani esiintyy puussa luultavimmin juuri hapetusasteella +II.
22 19 Eräässä tutkimuksessa /24/ selvitettiin ditioniitin,na 2 S 2 O 4, vaikutusta metallien kelatoitumiseen TMP massassa ja sillä havaittiin olevan positiivinen vaikutus. Massan mangaani ja rautapitoisuudet olivat noin puolet pienempiä verrattuna tavanomaiseen kelatointiin. Ditioniitin vaikutusta perusteltiin sen kykyyn pelkistää metallihydroksideja alemmalle hapetusasteelle ja saada ne liuenneeseen, helpommin kelatoituvaan muotoon. Näin ollen voidaan olettaa, että mangaanin hapetusasteella voisi olla vaikutusta kelatoitumiseen siten, että kelatoituminen huononee hapetusasteen noustessa. Mangaani ei siis välttämättä olekaan ennen kelatointia hapetusasteella +II, vaan se voi esiintyä prosessissa myös korkeammilla hapetusasteilla.
23 20 5 MANGAANI PEROKSIDIVALKAISUSSA Metalleilla on yleisesti tiedetty olevan peroksidin hajoamista kiihdyttävä vaikutus. Mangaanin suurimmat haittavaikutukset mekaanisen massan peroksidivalkaisussa perustuvatkin sen kykyyn katalysoida peroksidin hajoamista tehokkaasti. Siirtymämetalleista mangaanilla on suurin vaikutus katalyyttiseen peroksidin hajoamiseen, koska se on rautaan ja kupariin verrattuna selvästi heikoimmin kiinni massassa. /17, 11/. Kelatoinnin jälkeen massassa kiinni olevat rauta ja kupari ovat niin tiukasti sitoutuneina, että niillä ei ole merkittävää vaikutusta peroksidin hajoamiseen /27/. Mangaanilla ei ole havaittu olevan yhtä suurta vaikutusta massan vaaleuteen kuin esimerkiksi raudalla /15/. Mangaanin vaikutus vaaleuden nousun heikkenemiseen perustuu sen katalysoimaan peroksidin hajoamiseen ja siitä johtuvaan valkaisukapasiteetin alenemiseen. 5.1 Mangaanin katalysoima peroksidin hajoaminen Vetyperoksidi on stabiili neutraalissa ja happamissa liuoksissa joissa on mangaania läsnä /28,29/. Mangaanin katalysoima peroksidin hajoaminen alkaa ph:n noustessa, jolloin mangaani voi saostua ja hapettua korkeammille hapetusasteille. Mangaanin katalysoimat peroksidia hajottavat reaktiot ovat nopeita verrattuna peroksidin normaaliin hajoamiseen /10, 21/. Mangaanin katalysoimaan peroksidin hajoamiseen vaikuttaa mangaanipitoisuuden lisäksi voimakkaasti myös mangaanin hapetusaste. Kuvassa 13 on esitetty erään tutkimuksen tulos mangaanin pitoisuuden ja hapetusasteen vaikutuksesta peroksidin hajoamiseen.
24 21 Kuva 13. Mangaanipitoisuuden ja mangaanin hapetusasteen vaikutus peroksidin hajoamiseen /29/. Pitoisuudet on ilmoitettu pitoisuuksina vedessä. (Sakeus 0,64 %, Mg ppm, Na 2 SiO 3 0,25 %, ph 11, 70 C, 60 min, H 2 O 2 1g/l) Kuvasta 13 nähdään, että hapetusasteella +III mangaani hajottaa magnesiumin ja silikaatin läsnäollessa peroksidia selvästi hapetusastetta +II voimakkaammin. Lisäksi huomattavaa on se, että jo hyvin pienillä, alle 5 ppm:n pitoisuuksilla, peroksidi kuluu lähes loppuun. Yli 4 ppm:n pitoisuuksilla hapetusasteiden välistä eroa ei voi enää verrata, koska peroksidia on vain vähän jäljellä. Kokeessa sakeus oli hyvin alhainen, mikä vaikeuttaa tulosten vertailua suoraan todellisen prosessin valkaisutapahtumaan. Kuvassa 14 on esitetty TMP massalla, 10 % sakeudella tehtyjen valkaisukokeiden tuloksia mangaanin, raudan ja kuparin vaikutuksista peroksidin kulutukseen eri metallipitoisuuksilla ja hapetusasteilla.
25 22 Kuva 14. Metallilisäyksen ja hapetusasteen vaikutus peroksidin kulutukseen /12/. (Sakeus 10 %, 2,3 % Na 2 SiO 3, 2,5 % NaOH, 3,5 % H 2 O 2, 60 C, 90 min) Ainoastaan mangaanilla ja etenkin sen hapetusasteilla +II ja +III näyttäisi olevan selvä haitallinen vaikutus peroksidin hajoamiseen. Kuvan 14 tulokset mangaanin hapetusasteen vaikutuksesta peroksidin kulutukseen antavat vastaavia tuloksia kuin edellisessä kuvassa esitetyt. Mn(III) hajottaa peroksidia selvästi enemmän kuin Mn(II). Raudalla ja kuparilla ei näyttäisi olevan merkittävää vaikutusta, kuten ei myöskään hapetusasteella IV olevalla mangaanilla. Eräässä tutkimuksessa Colodette et al. selvittivät ph:n vaikutusta mangaanin katalysoimaan peroksidin hajoamiseen /17/. Kuvassa 15 on esitetty metallipitoisuuden ja ph:n vaikutusta peroksidin hajoamisnopeuteen vesiliuoskokeilla, joissa ei ollut stabilointiaineita läsnä.
26 23 Kuva 15. ph:n vaikutus 0,098 M H 2 O 2 liuoksen hajoamiseen mangaanin, raudan ja kuparin läsnäollessa /17/ (50 C, 120 min). Vesiliuoksessa mangaani näyttää ph:n muuttuessa hajottavan peroksidia eri tavalla kuin rauta ja kupari. Raudan ja kuparin katalysoima peroksidin hajoaminen voimistuu ph:n noustessa, kun taas mangaanin katalyyttinen aktiivisuus näyttäisi olevan suurimmillaan ph:ssa 9,8 ja pienimmillään ph:ssa 10,3. Colodetten /17/ mukaan mangaani muodostaa ph:ssa 10.3 liukenemattoman mangaanihydroksidin, joka ei ole tehokas peroksidia hajottava katalyytti. Vesiliuoksessa ph-alueella 9,8-11,8 mangaani on todennäköisimmin mangaanidioksidina MnO 2, jonka on useissa tutkimuksissa havaittu olevan tehokas katalyytti /17/. Erään peruskemian oppikirjan mukaan mangaani-ioni, Mn 2+, saostuu alkalisissa oloissa hydroksidina, yhtälön 6 mukaisesti /1/: Mn OH Mn(OH) 2 (6) Hydroksidi hapettuu ruskeaksi Mn(III) hydroksidiksi hapen avulla: Mn(OH) 2 + O 2 MnOOH + H 2 O (7) Vetyperoksidi voi hapettaa Mn(II)hydroksidin hapetusluvulle IV: Mn(OH) 2 + H 2 O 2 MnO H 2 O (8)
27 24 Puun mukana prosessiin tuleva mangaani, joka on todennäköisesti hapetusasteella +II, voi siis edellä mainittujen yhtälöiden mukaisesti hapettua valkaisuun tullessaan joko hapetusasteelle +III tai +IV, jolloin peroksidin kulutus valkaisussa kasvaa. Mn(II) voi hapettua vasta kun ph ylittää arvon 9,5 /30/. Yhtälöt 6-8 pätevät varmasti ainoastaan tilanteissa, joissa ei ole kuituja eikä stabilointiaineita läsnä. Kuten kuvista 13 ja 14 havaittiin, peroksidin kulutus riippuu voimakkaasti hapetusasteesta kuitujen ja stabilointiaineiden läsnä ollessa. Etenkin hapetusaste +III näyttäisi olevan erityisen haitallinen. Eräissä tutkimuksissa havaittiin, että happamalla käsittelyllä voidaan alentaa mangaanin hapetusastetta (Mn(III) Mn(II)) kuitujen toimiessa pelkistäjinä /28,29/. Hapetusasteen aleneminen puolestaan vähentää peroksidin kulutusta. Kuvassa 16 on esitetty, miten esikäsittelyvaiheen ph vaikuttaa jäännösperoksidin määrään mangaanin ollessa ennen ph:n alentamista hapetusasteella +III /29/. Kuva 16. ph:n vaikutus happamassa pelkistysvaiheessa peroksidin stabiilisuuteen /29/. Mn-lisäys 3 ppm. Pitoisuudet on ilmoitettu pitoisuuksina vedessä. (Pelkistys: Sakeus 0,64 %, 70 C, 30 min. Valkaisu: Sakeus 0,64 %, Mg ppm, Na 2 SiO 3 0,25 %, ph 11, 70 C, 60 min, H 2 O 2 1g/l)
28 25 Massa pelkistää mangaanin, kun ph laskee alle arvon 3,5. Paras tulos saadaan alle 2,5 ph arvoilla. Mangaanin hapetusasteen alentamisesta on tehty joitakin tutkimuksia, joissa on havaittu peroksidin ph:ssa 3, DTPA:n ph:ssa 5 ja ditioniitin ph:ssa 5,5-6 pelkistävän hapetusasteella +III olevan mangaanin hapetusasteelle +II, jolloin kelatoituminen paranee sekä mangaanin katalysoima peroksidin hajoaminen vähenee /29,30,31/. Vetyperoksidi voi pelkistää happamissa oloissa mangaanin yhtälön 9 mukaisesti /31/: 2 Mn 3+ + H 2 O 2 2 Mn 2+ + O H + (9) Ni et al. tutkivat peroksidin käyttöä mangaanin pelkistämiseen happamassa esikäsittelyssä /31/. Taulukossa I on esitetty tuloksia heidän tekemistään laboratoriokokeista, joissa saatiin happamalla peroksidikäsittelyllä pelkistettyä Mn(III) hapetusasteelle +II ja siten pienennettyä peroksidin kulutus samalle tasolle Mn(II):n kanssa. Taulukko I. Mangaanin hapetusasteen alentaminen happamalla peroksidikäsittelyllä ja sen vaikutus peroksidin kulutukseen /31/. (Sakeus 0,8 %, 3ppm Mn, 300 ppm Mg, 2500 ppm Na 2 SiO 3, 600 ppm NaOH, 1g/l H 2 O 2 )
29 Katalyysimekanismit Eri metallit katalysoivat peroksidin hajoamista eri tavoilla. Metallien katalysoimille peroksidin hajoamisreaktioille on esitetty yleensä kolmea eri mekanismia /16, 17/: 1. Siirtymämetallin katalysoima vapaa radikaalimekanismi 2. Siirtymämetallin reaktio perhydroksyylianionin kanssa muodostaen epästabiileja peroksideja tai komplekseja 3. Kolloidisen siirtymämetallioksidin tai -hydroksidin aikaansaamat heterogeeniset pintakatalyyttiset reaktiot Metalli-ionin katalysoimalle vapaalle radikaalimekanismille on esittetty seuraavat reaktioyhtälöt /7,10/: M + H 2 O 2 M + + HO + HO (10) M + + HOO M + O 2 + H 2 O (11) M + + O 2 M + O 2 (12) Tämän mekanismin on havaittu toimivan lähinnä kuparin katalysoimassa peroksidin hajoamisessa. Useammassa tutkimuksessa on havaittu, että mangaanin katalysoimassa peroksidin hajoamisessa ei muodostu radikaaleja /32,17/. Myöskään rauta ei muodosta radikaaleja /17/. Koska radikaaleja ei mangaanin katalysoimassa peroksidin hajoamisessa muodostunut, Colodette et al. ja Rodriguez et al. ovat ehdottaneet seuraavanlaista mekanismia /27, 17/: Mn OH Mn(OH) 2 (13) Mn(OH) 2 MnO H 2 O (14) MnO 2 + H 2 O 2 Mn OH + O 2 (15) Ni et al. havaitsi tutkimuksissaan, että mangaanidioksidia, MnO 2, ei muodostu valkaisun aikana, vaan vasta kun peroksidi on kulunut loppuun /16/. Heidän mukaan Mn 2+ ja Mn 3+ ovat ne mangaanin muodot jotka ovat vastuussa peroksidin katalyyttisestä hajoamisesta. Kuvassa 17 on esitetty kuinka mangaanin hapetusaste muuttuu peroksidin hajotessa.
30 27 Kuva 17. Mangaanin hapetusasteen kehitys mangaanin katalysoidessa peroksidin hajoamista vesiliuoksessa ilman stabilointiaineita /16/. (Mn lisäys 3.3 ppm Mn 2+, ph 10,0, 0,75 % H 2 O 2, 23 C) Ni et al. tulivat siihen tulokseen, että Mn(II) hapettuu ensin, joko hapen tai peroksidin vaikutuksesta hapetusasteelle +III /16/: 4 Mn 2+ + O H 2 O 4 Mn OH (16) 2 Mn 2+ + H 2 O 2 2 Mn OH (17) Hapettumista seuraa pelkistyminen, jolloin sykli on valmis: 2 Mn 3+ + H 2 O OH 2 Mn 2+ + O H 2 O (18) Peroksidin loputtua hapettunut Mn 3+ hajoaa nopeasti /16/: 2 Mn 3+ Mn 2+ + Mn 4+ (19) Mn H 2 O MnO 2 + 4H + (20)
31 28 Jakubikova et al. tulivat myös siihen tulokseen tutkiessaan mangaanin katalysoimaa peroksidin hajoamista, että aktiivinen komponentti peroksidin hajoamisessa on Mn 3+. Heidän mukaansa mangaanin katalysoidessa peroksidin hajoamista ei muodostu hydroksyyliradikaaleja, kuten aiemminkin on jo todettu, vaan peroksidin hajotessa muodostuu hydroperoksyyli radikaaleja HOO, jotka pelkistävät peroksidin kanssa hapen avulla hapettuneen mangaanin /10/: Mn 2+ + O 2 Mn 3+ (21) Mn 3+ + H 2 O 2 Mn 2+ + HOO + H + (22) Mn 3+ + HOO Mn 2+ + O 2 + H + (23) Mikäli happea ei ole läsnä, voi peroksidi hajota seuraavan autokatalyyttisen mekanismin mukaisesti /10/: Mn 2+ + H 2 O 2 (MnO) 2+ + H 2 O (24) (MnO) 2+ + Mn 2+ 2 Mn 3+ + O 2 (25) Mn 3+ + H 2 O 2 Mn 2+ + HOO + H + (26) Mn 3+ + HOO Mn 2+ + O 2 + H + (27) Kuten voidaan huomata, mangaanin katalysoimaa peroksidin hajoamismekanismia on jonkin verran tutkittu, mutta täyttä yksimielisyyttä kyseisestä mekanismista ei ole. Tutkimukset on yleensä tehty vesiliuoksissa, eikä niissä ole käytetty stabilointiaineita, joten todellisen kuvan muodostaminen mangaanin katalysoimasta peroksidin hajoamismekanismista valkaisuprosessissa on vaikeaa. 5.3 Mangaanin vaikutus vaaleuteen Kuten jo aiemmin todettiin, mangaanilla ei ole merkittävää suoranaista vaikutusta massan vaaleuteen. Suurilla yli 20 ppm mangaanilisäyksillä on havaittu valkaisussa olevan pieni vaaleutta alentava vaikutus /13/. Syynä tähän on mangaanin kyky katalysoida peroksidin hajoamista, jolloin valkaiseviin reaktioihin jäävän peroksidin määrä vähenee.
32 29 Kuvassa 18 on esitetty kelatoidulla TMP massalla, 10 % sakeudella tehtyjen valkaisukokeiden tuloksia mangaanin, raudan ja kuparin vaikutuksista vaaleuteen eri metallipitoisuuksilla ja hapetusasteilla. Kuva 18. Metallilisäyksen vaikutus vaaleuteen TMP massan peroksidivalkaisussa /12/. (Sakeus 10 %, 2,3 % Na 2 SiO 3, 2,5 % NaOH, 3,5 % H 2 O 2, 60 C, 90 min) Kuvasta 18 nähdään, että ainoastaan mangaanin hapetusaseella +III on merkittävä vaaleutta heikentävä vaikutus. Vaaleuden heikkeneminen johtuu Mn(III):n voimakkaasta katalyyttisestä aktiivisuudesta. Erään tutkimuksen mukaan pieni määrä massassa kiinni olevaa mangaania voisi olla jopa hyödyllinen valkaisussa /27/. Väitettä perusteltiin sillä, että pienellä alle 4 ppm mangaanimäärällä hajoaminen tapahtuisi radikaalimekanismilla, joka sopivassa määrin edesauttaisi valkaisua. Suurempi mangaanimäärä johtaisi taas heterolyyttiseen mekanismiin, jolloin peroksidin hajoaminen olisi voimakkaampaa ja siten haitallista. On myös havaittu, että kelatoidun TMP-massan valkaisussa olisi hyvä olla ainakin vähän katalyyttisesti aktiivisia metalleja läsnä riittävän peroksidin kulutuksen takaamiseksi /5/.
33 30 Mangaanilla on havaittu olevan massan alkalista tummumista lisäävä vaikutus /9/. Kuvassa 19 on esitetty tutkimustulos mangaanilisäyksen vaikutuksesta peroksidivalkaistun hiokkeen alkaliseen tummumiseen. Kuva 19. Mangaanilisäyksen (MnSO 4 ) vaikutus peroksidivalkaistun massan alkaliseen tummumiseen /9/. ( 1% NaOH, 50 C, 30 min, sakeus 12 %) Massan alkalinen tummuminen nousee voimakkaasti mangaaniannoksen kasvaessa nollasta 20 ppm:n lisäykseen saakka. Tätä suuremmilla lisäyksillä vaikutus pienenee selvästi /9/. Syitä mangaanin alkaalista tummumista lisäävään vaikutukseen ei varmuudella tiedetä. Seuraavanlaisia vaihtoehtoja tummumisen syiksi on ehdotettu /12/: - Värillisten kuitu-mangaani kompleksien muodostuminen tai mangaanin hapettuminen värillisiksi Mn(III) tai Mn(IV) yhdisteiksi - Mangaanin katalysoimassa peroksidin hajoamisessa syntyneet hajoamistuotteet aiheuttavat massaa tummentavia reaktioita
34 31 6 MANGAANIN STABILOINTIMEKANISMIT PEROKSIDIVALKAISUSSA Mangaanin haittavaikutusten ehkäisystä mekaanisen massan peroksidivalkaisussa on tehty paljon tutkimuksia. Mangaanin katalyyttistä aktiivisuutta pystytään vähentämään magnesiumin ja silikaatin avulla. Myös kompleksinmuodostajien käyttöä on tutkittu, mutta tulokset vaihtelevat positiivisesta hyödyttömään. 6.1 Kelatointi valkaisussa Eräässä tutkimuksessa selvitettiin TMP massan kelatointivaiheen korvaamista kompleksinmuodostajan annosteluna suoraan valkaisuun muiden kemikaalien mukana. Kuva 20. Vertaus erillisen kelatointivaiheen korvaamisesta annostelemalla DTPA suoraan valkaisuun /21/.
35 32 Tutkimuksen mukaan paras tulos DTPA:n käytöllä saadaan perinteisellä esikäsittelyllä DTPA:n ja metallien moolisuhteella 2:1. Ero syötettäessä DTPA suoraan valkaisuun on vaaleudessa noin 3 yksikköä jäännösperoksidin jäädessä yli 10 % huonommaksi. Kelatointiaineen käytöstä voi olla valkaisussa hyötyä, mutta se ei ole yhtä tehokasta eriliseen kelatointivaiheeseen verrattuna /21/. Metallien katalyyttistä aktiivisuutta ei pystytä täysin estämään DTPA:n käytöllä. Erillistä kelatointivaihetta ei siis tämän tutkimuksen perusteella voi korvata pelkällä kompleksinmuodostajan syötöllä valkaisuun. Ni et al. tutkivat DTPA:n käyttöa peroksidivalkaisussa ehkäisemään mangaanin katalysoimaa peroksidin hajoamista /28/. Myös heidän tutkimustuloksensa, kuva 21, osoittaa, että DTPA:n käytöllä valkaisussa voidaan parantaa peroksidin stabiilisuutta. Kuvasta 21 nähdään myös, että mangaani katalysoi DTPA:n läsnä ollessa hapetusasteella +III peroksidin hajoamista selvästi tehokkaammin kuin Mn(II). Kompleksinmuodostajalla ei siis pystytä estämään mangaanin korkeamman hapetusasteen voimakkaampaa katalyyttistä aktiivisuutta. Kuva 21. DTPA/Mn moolisuhteen vaikutus katalyyttiseen aktiivisuuteen mangaanin hapetusasteilla +II ja +III /28/.
36 33 On myös esitetty tutkimustuloksia, joissa kompleksinmuodostajasta ei ole ollut mitään hyötyä peroksidin stabiloimisessa mangaanin katalysoimaa peroksidin hajoamista vastaan. Erään tutkimuksen mukaan kalsiumilla olisi merkittävä Mn- EDTA-kompleksin stabiilisuutta heikentävä vaikutus, etenkin korkeassa ph:ssa, jolloin mangaani pääsee hapettumaan /33/. Tämä tarkoittaisi sitä, että vaikka vesiliuoksissa mangaanin katalysoima peroksidin hajoaminen pystyttäisiin kompleksinmuodostajilla estämään, ei se käytännössä toimikaan kun massaa on läsnä. 6.2 Silikaatti Natriumsilikaatti on mekaanisen massan peroksidivalkaisussa käytetyistä peroksidin stabilointiaineista tehokkain /34/. Natriumsilikaatti on alkalisuuden lähde ja se toimii ph puskurina ph:ssa 11,3 /4/. Silikaatista 80 % on valkaisun aikana vesifaasissa. Kuivatussa massassa silikaatti tarttuu massaan, eikä irtoa enää uudelleen sulputettaessa /34/. Natriumsilikaatti liukenee veteen yhtälön 28 mukaisesti /4/: Na 2 SiO 3 + H 2 O 2Na + + OH + HSiO 3 (28) Tarvittava natriumsilikaatin määrä riippuu valkaisuun tulevien metallien, erityisesti mangaanin, määrästä /34/. Mitä enemmän mangaania valkaisuun menee, sitä enemmän silikaattia tarvitaan. Silikaatti stabiloi peroksidia valkaisuoloissa muodostamalla kationisten mangaani-ionien kanssa saostumia, jotka estävät mangaanin hapettumisen /35/. Kuvassa 22 on esitetty miten mekaanisen massan peroksidivalkaisussa tarvittavan silikaatin ja peroksidin määrä riippuu valkaisuun tulevan mangaanin määrästä, jotta maksimivaaleus valkaisussa saavutetaan /34/.
37 34 Kuva 22. Maksimivaaleuden saavuttamiseksi tarvittava silikaattiannos eri peroksidiannoksilla ja mangaanipitoisuuksilla /34/. (Sakeus 20 %, 60 C, 2,0 h) Ni et al. tutkivat silikaatti/mn(ii) suhteen vaikutusta jäännösperoksidin määrään ja havaitsivat, että silikaatti ehkäisi erittäin tehokkaasti mangaanin katalysoimaa peroksidin hajoamista, mikä selitettiin vapaiden Mn ionien määrän vähenemisellä silikaatin määrää nostettaessa, kuva 23 /29/. Samassa tutkimuksessa havaittiin, että silikaatti ei pysty yhtä tehokkaasti ehkäisemään Mn(III):n katalysoimaa peroksidin hajoamista, mistä todisteena jo aiemmin esitetty kuva 13. Kuva 23. Silikaatti/Mn(II) suhteen vaikutus jäännösperoksidin määrään /29/. Pitoisuudet on ilmoitettu pitoisuuksina vedessä. (Sakeus 0,64 %, Mg ppm, ph 11, lämpötila 70 C, aika 60 min, H 2 O 2 1g/l)
38 35 Colodette et al. /35/ vertasivat myös tutkimuksissaan silikaatin kykyä ehkäistä mangaanin ja hapetetun mangaanin katalysoimaa peroksidin hajoamista. He eivät havainneet yhtä suurta eroa peroksidin kulutuksessa kuin Ni: Taulukko II. Mangaanin hapetusasteen ja kemikaalien lisäysjärjestyksen vaikutus peroksidin kulutukseen /35/. (0,08 M SiO 2, 5 ppm Mn, ph 10,8, 50 C) Peroksidia hajonnut, % Lisäysjärjestys Mn(II) hapetettu Mn Mn/Silikaatti/NaOH 19,5 18,3 Mn/NaOH/Silikaatti 43,2 41,0 Mn/NaOH 85,9 83,6 Taulukon II tulosten perusteella ei mangaanin hapetusasteella ole havaittavissa juurikaan eroa peroksidin kulutukseen. Sen sijaan kemikaalien lisäysjärjestyksellä on. ph:n nosto ennen silikaatin lisäystä lisää peroksidin kulutusta. Tehokkaimmillaan silikaatti on silloin, kun se ehtii ennen ph:n nostoa sitoa mangaanin. Silikaatin käytöllä on havaittu olevan myös haittavaikutuksia. Silikaatti voi muodostaa saostumia ja kerrostumia prosessilaitteisiin, häiritä märän pään kemiaa, alentaa paperin laatua ja heikentää jätevesien käsittelyn tehokkuutta /34,35/.
39 Magnesiumsulfaatti Natriumsilikaatin lisäksi yleisimmin mekaanisen massan peroksidivalkaisussa peroksidin stabilointiin käytetty kemikaali on magnesiumsulfaatti MgSO 4. Magnesiumin lisääminen on erityisen tarpeellista silloin, kun massasta on poistettu metallit happamalla pesulla ja massassa oleva magnesium on peseytynyt samalla pois /34/. Magnesiumin kyky estää metallien katalysoimaa peroksidin hajoamista perustuu radikaalisen ketjureaktiohajoamisen keskeytykseen kuparin katalysoidessa tai metalli-ionin kanssa muodostettuun saostumaan Mg - O - Mn, joka voi liittyä anioniseen kuituun /29,36/. Toisen teorian mukaan mangaanin hapettumisen estää sen saostuminen siten, että mangaani on saostuman sisällä sitoutuneena anioniseen komponenttiin ja magnesium saostuman pinnalla eräänlaisena kuorena. Anionisena komponenttina voi toimia OH -, CO 2-3 tai SiO 2-3 /37/. Taulukossa III on esitetty erään tutkimuksen tulos, jossa selvitettiin mangaanin hapetusasteen ja magnesiumlisäyksen vaikutusta peroksidin kulutukseen ilman kuituja ja kuitujen läsnä ollessa. Ilman silikaattia magnesiumin on havaittu lisäävän mangaanin katalyyttistä aktiivisuutta /36,38/. Taulukko III. Magnesiumin vaikutuksia mangaanin katalysoimaan peroksidin hajoamiseen /36/. (1000 ppm H 2 O 2, ph kuitujen läsnä ollessa 10,5 ja ilman kuituja 11,5, sakeus 10 %, 50 C, 30 min) Mn(II) Mn(III) Mg 2+ H 2 O 2 hajonnut (ppm) (ppm) (ppm) (%) Ilman kuituja 2, ,7 Ilman kuituja 2,5-5,0 100 Kuituja 2, ,3 Kuituja 2,5-5,0 46,6 Ilman kuituja 1) - 2,5-33,7 Ilman kuituja 1) - 2,5 5,0 99,9 1) lämpötila 25 C
40 37 Taulukon III tuloksista voidaan selvästi havaita magnesiumin lisäämisen tehostavan mangaanin katalysoimaa peroksidin hajoamista voimakkaasti sekä hapetusasteella +II, että +III. Kuitujen läsnäololla ei näytä olevan minkäänlaista vaikutusta magnesiumin toimintaan. Colodette et al. tutkivat stabilointiaineiden vaikutuksia yksitellen sekä erilaisina yhdistelminä /38/. He päätyivät tutkimuksessaan samaan tulokseen, että magnesium yksin tehostaa mangaanin katalysoimaa peroksidin hajoamista. Tehokkaimmaksi stabilointimenetelmäksi he havaitsivat magnesiumin, silikaatin ja DTPA:n yhdistelmän, kuten kuvasta 24 voidaan havaita. Kuva 24. Mangaanin, raudan ja kuparin katalysoima peroksidin hajoaminen, eri stabilointiaineiden ja niiden yhdistelmien läsnäollessa /38/. (16,7 g/l NaSiO 3, 0,17 g/l MgSO 4 7H 2 O, 0,34 g/l Na 5 DTPA, ph 10,8, 50 C 120 min)
41 38 Peroksidin hajoaminen voimistui vasta yli 20 ppm mangaanilisäyksellä Myös magnesium yhdessä silikaatin kanssa stabiloi mangaanin katalysoimaa peroksidin hajoamista melko hyvin. Raudan katalysoimaa peroksidin hajoamista stabilisoi selvästi parhaiten magnesiumin ja silikaatin yhdistelmä /38/. DTPA:n lisäys näyttäisi huonontavan tilannetta. Myös pelkän silikaatin lisääminen estää raudan katalysoiman peroksidin hajoamisen tehokkaasti, kun taas kuparin kohdalla tilanne on päinvastainen. Silikaatti yksin lisää peroksidin hajoamista kaikkien kolmen stabiloijan yhdistelmän ollessa selvästi paras vaihtoehto.
42 39 7 YHTEENVETO KIRJALLISUUDESTA Kirjallisuudesta löytyneiden tutkimusten perusteella mangaani kelatoituu melko hyvin hapetusasteella +II. Tätä korkeampien hapetusasteiden kelatoitumisesta ei löytynyt tutkimustuloksia. Valkaisussa mangaani katalysoi peroksidin hajoamista tehokkaasti. Mn(III):n on havaittu olevan katalyyttisesti hapetusastetta +II aktiivisempi. On esitetty väittämiä, että mangaani voisi olla valkaisussa myös hapetusasteella +IV, mutta tutkimustuloksia tämän hapetusasteen vaikutuksista valkaisussa ei ole. Mangaanin vaikutus vaaleuden alenemiseen peroksidivalkaisussa perustuu sen katalyyttiseen aktiivisuteen, jolloin valkaiseviin reaktioihin jäävän peroksidin määrä vähenee. Mangaanin haitallisuuteen valkaisussa vaikuttaa valkaisuun menevän mangaanin määrä ja hapetusaste. Silikaatin ja magnesiumin avulla pystytään melko hyvin ehkäisemään Mn(II):n haitalliset vaikutukset valkaisussa. Useissa tutkimuksissa on kuitenkin havaittu, että stabilointiaineet eivät tehoa yhtä hyvin mangaaniin hapetusasteella +III. Stabilointiaineiden tehoa Mn(IV):n katalyyttisen aktiivisuuten vähentämiseen ei ole tutkittu. Tutkimuksia kelatointiaineen käytöstä valkaisussa on tehty vähän. Joissakin tutkimuksissa on kelatointiaineen käytöllä valkaisussa havaittu olevan positiivinen vaikutus, mutta on myös havaintoja, joissa kelatointiaineen käytöstä ei ole ollut hyötyä. Kirjallisuudessa esitettyjen, erityisesti valkaisukokeiden, tulosten vertaaminen käytännön tilanteisiin on vaikeaa, koska ne on yleensä tehty joko hyvin alhaisissa sakeuksissa tai peroksidin hajoamista on tutkittu tilanteessa, jossa ei ole ollut kuituja läsnä.
43 40 KOKEELLINEN OSA 8 LABORATORIOKOKEIDEN TAVOITTEET Työn tarkoituksena oli selvittää, miten massan mangaanipitoisuuden vaihtelut ja mangaanin hapetusaste vaikuttavat massan valkaistavuuteen. Lisäksi laboratoriokokeilla tutkittiin mangaanin hapetusasteen vaikutusta mangaanin kelatoitumiseen. Kokeellinen osa jakautui kolmeen osaan: - Kelatointikokeisiin, joissa selvitettiin mangaanin määrän ja hapetusasteen vaikutusta kelatoitumiseen. Kelatointikokeilla haettiin vastausta siihen, onko korkeammalla hapetusasteella oleva mangaani hankalampi kelatoida. - Valkaisukokeisiin, joissa selvitettiin mangaanin määrän ja hapetusasteen vaikutusta massan vaaleuteen ja peroksidin kulutukseen. Hajoaako peroksidi nopeammin mangaanin korkeammilla hapetusasteilla ja millaisilla mangaanipitoisuuksilla on haittaava vaikutus peroksidivalkaisussa. Lisäksi tutkittiin kompleksinmuodostajan käyttöä valkaisussa ehkäisemään mangaanin haitallisia vaikutuksia. - Vesiliuoskokeisiin, joissa selvitettiin mangaanin hapetusasteen vaikutusta peroksidin hajoamisnopeuteen valkaisua vastaavissa tilanteissa siten, että kuituja ei ollut läsnä.
44 41 9 LABORATORIOKOKEISSA KÄYTETYT MATERIAALIT JA MENETELMÄT Laboratoriokokeissa käytettiin kuusesta valmistettua TMP massaa, jonka kuivaainepitoisuus oli 53 % ja tehtaalla mitattu freeness 140 ml. Massaa säilytettiin pakastettuna muovipusseissa. Laimennusvesinä kokeissa käytettiin milliporevettä. Taulukossa IV on esitetty kokeissa käytetyt kemikaalit ja niiden käyttötarkoitus. Taulukko IV. Laboratoriokokeissa käytetyt kemikaalit ja niiden käyttötarkoitus. Kemikaali Käyttökohde Pitoisuus Valmistaja DTPA Kelatointi-, valkaisu- ja vesiliuoskokeet 99 % J.T. Baker NaOH Kelatointi-, valkaisu- ja vesiliuoskokeet 99 % Merck MnCl 2 4H 2 O Kelatointi-, valkaisu- ja vesiliuoskokeet 99 % Merck Mn(OOCCH 3 ) 3 2H 2 O Kelatointi-, valkaisu- ja vesiliuoskokeet 98 % Merck MnO 2 Kelatointi-, valkaisu- ja vesiliuoskokeet % Riedel-de Haën MnSO 4 H 2 O Kelatointi- ja valkaisukokeet 99 % Merck H 2 O 2 Valkaisu- ja vesiliuoskokeet 30 % J.T. Baker H 2 O 2 Valkaisukokeet 35 % Oy FF-Chemicals Ab Na 2 O 2,5 SiO 2 Valkaisu- ja vesiliuoskokeet 43 % Zeofinn OY MgSO 4 7H 2 O Vesiliuoskokeet 99,5 % Merck H 2 SO 4 Valkaisukokeet 99 % Riedel-de Haën KJ Jäännösperoksidin määritys 99,5 % Merck (NH 4 ) 6 Mo 7 O 24 4H 2 O Jäännösperoksidin määritys 99 % Merck Na 2 S 2 O 3 5H 2 O Jäännösperoksidin määritys 99,5 % Riedel-de Haën Tärkkelys Jäännösperoksidin määritys - Merck Kelatointi- ja valkaisukokeissa mangaanipitoisuudet määritettiin valmistamalla ensin massanäytteistä liuokset standardin SCAN-CM 38:87 mukaisesti. Massanäytteistä valmistetuista liuoksista ja suodosnäytteistä määritettiin mangaanipitoisuudet atomiabsorptiospektrometrillä liekkimenetelmällä standardin SFS 3044 mukaisesti. Näytteitä ei kestävöity. Mangaanipitoisuuksien määrityksiin käytettiin laitetta GBC 932 AA. Valkaisukokeissa ISO-vaaleus määritettiin ELREPHO-2000 laitteella bychnersuodatuksesta saaduista massakakuista kakkujen kuivuttua ensin vakiohuoneessa noin viikon ajan. Jäännösperoksidin määritykseen valkaisu-ja vesiliuoskokeissa käytettiin Keskuslaboratorion menetelmää N:o 214:85.
45 Kelatointikokeet Kelatointikokeet tehtiin kolmen litran muoviämpärissä 4 % sakeudessa mekaanisella sekoituksella sekoitusnopeudella 400 rpm. Kokeet suoritettiin 60 C lämpötilassa. Lämmitys tapahtui vesihauteessa. Kokeen kokonaisaika oli 20 min ja massan alkuperäinen mangaanipitoisuus 110 mg/kg. Kelatointikokeita tehtiin kolmella eri koejärjestelyllä, jotka on esitetty kelatointikokeiden tulosten yhteydessä. Kelatointikokeita varten eri hapetusasteilla olevista mangaaneista tehtiin 2000 ppm:n työliuokset liuottamalla ne milliporeveteen. Mangaani(II)kloridi liukeni veteen hyvin, mutta mangaani(iii)asetaatti ja mangaani(iv)dioksidi eivät liuenneet. Niihin jäi selvästi kiinteitä mustia partikkeleita, asetaattiin isompia ja dioksidiin pienempiä. Partikkelit eivät kuitenkaan tarttuneet muovipullon seinämiin, joten lisäykset massaan onnistuivat sekoittamalla liuokset huolellisesti juuri ennen pipetointia. Kelatointi- valkaisukokeissa käytettiin Mn(III)asetaatin lisäksi myös Mn(II) sulfaatista Mn(III):ksi hapetettua mangaania. Hapetus tapahtui liuottamalla Mn(II)sulfaatti ensin milliporeveteen ja nostamalla tämän jälkeen ph NaOH:lla välille Liuennut Mn saostui ensin mangaanihydroksidiksi, jonka jälkeen saostuma muuttui muutamassa minuutissa tumman ruskeaksi ilman hapettaessa mangaanin hapetusastelle +III. Kelatointikokeissa käytettiin DTPA-liuosta, jonka konsentraatio oli 10g/l. Jauhemainen DTPA liukeni milliporeveteen nostamalla ph NaOH:lla yli seitsemän. Kemikaalilisäykset tehtiin pipetoimalla ja ph:n mittaukseen käytettiin Metrohm 744 ph mittaria. Kelatoinnin jälkeen massa suodatettiin bychner-suppilolla. Saadusta suodoksesta ja kakusta mitattiin Mn-pitoisuus.
1 Tehtävät. 2 Teoria. rauta(ii)ioneiksi ja rauta(ii)ionien hapettaminen kaliumpermanganaattiliuoksella.
 1 Tehtävät Edellisellä työkerralla oli valmistettu rauta(ii)oksalaattia epäorgaanisen synteesin avulla. Tätä sakkaa tarkasteltiin seuraavalla kerralla. Tällä työ kerralla ensin valmistettiin kaliumpermanganaatti-
1 Tehtävät Edellisellä työkerralla oli valmistettu rauta(ii)oksalaattia epäorgaanisen synteesin avulla. Tätä sakkaa tarkasteltiin seuraavalla kerralla. Tällä työ kerralla ensin valmistettiin kaliumpermanganaatti-
2CHEM-A1210 Kemiallinen reaktio Kevät 2017 Laskuharjoitus 7.
 HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
HEM-A0 Kemiallinen reaktio Kevät 07 Laskuharjoitus 7.. Metalli-ioni M + muodostaa ligandin L - kanssa : kompleksin ML +, jonka pysyvyysvakio on K ML + =,00. 0 3. Mitkä ovat kompleksitasapainon vapaan metalli-ionin
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
Maa- ja metsätalousministeriön asetus lannoitevalmisteista annetun maa- ja metsätalousministeriön asetuksen muuttamisesta
 MAA- JA METSÄTALOUSMINISTERIÖ ASETUS nro 7/13 Päivämäärä Dnro 27.03.2013 731/14/2013 Voimaantulo- ja voimassaoloaika 15.04.2013 toistaiseksi Muuttaa MMMa lannoitevalmisteista (24/11) liitettä I ja II,
MAA- JA METSÄTALOUSMINISTERIÖ ASETUS nro 7/13 Päivämäärä Dnro 27.03.2013 731/14/2013 Voimaantulo- ja voimassaoloaika 15.04.2013 toistaiseksi Muuttaa MMMa lannoitevalmisteista (24/11) liitettä I ja II,
KALIUMPERMANGANAATIN KULUTUS
 sivu 1/6 Kohderyhmä: Työ on suunniteltu lukiolaisille Aika: n. 1h + laskut KALIUMPERMANGANAATIN KULUTUS TAUSTATIEDOT tarkoitaa veden sisältämien kemiallisesti hapettuvien orgaanisten aineiden määrää. Koeolosuhteissa
sivu 1/6 Kohderyhmä: Työ on suunniteltu lukiolaisille Aika: n. 1h + laskut KALIUMPERMANGANAATIN KULUTUS TAUSTATIEDOT tarkoitaa veden sisältämien kemiallisesti hapettuvien orgaanisten aineiden määrää. Koeolosuhteissa
Tasapainotilaan vaikuttavia tekijöitä
 REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA
 sivu 1/6 KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää myös yläkoululaisille, kunhan
sivu 1/6 KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää myös yläkoululaisille, kunhan
TKK, TTY, LTY, OY, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 31.5.2006
 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
Tiedelimsa. KOHDERYHMÄ: Työ voidaan tehdä kaikenikäisien kanssa. Teorian laajuus riippuu ryhmän tasosta/iästä.
 KOHDERYHMÄ: Työ voidaan tehdä kaikenikäisien kanssa. Teorian laajuus riippuu ryhmän tasosta/iästä. KESTO: 15min 1h riippuen työn laajuudesta ja ryhmän koosta. MOTIVAATIO: Arkipäivän kemian ilmiöiden tarkastelu
KOHDERYHMÄ: Työ voidaan tehdä kaikenikäisien kanssa. Teorian laajuus riippuu ryhmän tasosta/iästä. KESTO: 15min 1h riippuen työn laajuudesta ja ryhmän koosta. MOTIVAATIO: Arkipäivän kemian ilmiöiden tarkastelu
RAUDAN KATALYYTTINEN SUODATUS
 www.watman.fi RAUDAN KATALYYTTINEN SUODATUS Suodatinmallit WatMan FeA, FeAC ja FeACMn 550-2000 Oy WatMan Ab Vedenkäsittely Yrittäjäntie 4 09430 SAUKKOLA Puhelin 020 741 7220 www.watman.fi info@watman.fi
www.watman.fi RAUDAN KATALYYTTINEN SUODATUS Suodatinmallit WatMan FeA, FeAC ja FeACMn 550-2000 Oy WatMan Ab Vedenkäsittely Yrittäjäntie 4 09430 SAUKKOLA Puhelin 020 741 7220 www.watman.fi info@watman.fi
Voimalaitoksen vesikemian yleiset tavoitteet ja peruskäsitteitä
 Voimalaitoksen vesikemian yleiset tavoitteet ja peruskäsitteitä Susanna Vähäsarja ÅF-Consult 4.2.2016 1 Sisältö Vedenkäsittelyn vaatimukset Mitä voimalaitoksen vesikemialla tarkoitetaan? Voimalaitosten
Voimalaitoksen vesikemian yleiset tavoitteet ja peruskäsitteitä Susanna Vähäsarja ÅF-Consult 4.2.2016 1 Sisältö Vedenkäsittelyn vaatimukset Mitä voimalaitoksen vesikemialla tarkoitetaan? Voimalaitosten
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA
 SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA Työskentelet metallinkierrätyslaitoksella. Asiakas tuo kierrätyslaitokselle 1200 kilogramman erän kellertävää metallimateriaalia, joka on löytynyt purettavasta
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA Työskentelet metallinkierrätyslaitoksella. Asiakas tuo kierrätyslaitokselle 1200 kilogramman erän kellertävää metallimateriaalia, joka on löytynyt purettavasta
luku2 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen
 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta.
 Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Teollisuusveden ja kaupungin huleveden käsittely bio- ja mineraalisorbenteilla laboratoriomittakaavan tutkimus
 Teollisuusveden ja kaupungin huleveden käsittely bio- ja mineraalisorbenteilla laboratoriomittakaavan tutkimus Tiina Leiviskä HuJa-projektin loppuseminaari, Oulun yliopisto Miksi luonnonmateriaaleja vedenpuhdistukseen?
Teollisuusveden ja kaupungin huleveden käsittely bio- ja mineraalisorbenteilla laboratoriomittakaavan tutkimus Tiina Leiviskä HuJa-projektin loppuseminaari, Oulun yliopisto Miksi luonnonmateriaaleja vedenpuhdistukseen?
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
CHEM-A1200 kurssin laboratoriotöiden tulosten yhteenveto syksy 2016
 CHEM-A1200 kurssin laboratoriotöiden tulosten yhteenveto syksy 2016 Näyte Sundown Naturals Vaikuttava aine on kuivattu ferrosulfaatti FeSO 4. Valmistajan mukaan yksi tabletti sisältää 202 mg kuivaa ferrosulfaattia
CHEM-A1200 kurssin laboratoriotöiden tulosten yhteenveto syksy 2016 Näyte Sundown Naturals Vaikuttava aine on kuivattu ferrosulfaatti FeSO 4. Valmistajan mukaan yksi tabletti sisältää 202 mg kuivaa ferrosulfaattia
Veden ionitulo ja autoprotolyysi TASAPAINO, KE5
 REAKTIOT JA Veden ionitulo ja autoprotolyysi TASAPAINO, KE5 Kun hapot ja emäkset protolysoituvat, vesiliuokseen muodostuu joko oksoniumioneja tai hydroksidi-ioneja. Määritelmä: Oksoniumionit H 3 O + aiheuttavat
REAKTIOT JA Veden ionitulo ja autoprotolyysi TASAPAINO, KE5 Kun hapot ja emäkset protolysoituvat, vesiliuokseen muodostuu joko oksoniumioneja tai hydroksidi-ioneja. Määritelmä: Oksoniumionit H 3 O + aiheuttavat
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
joka voidaan määrittää esim. värinmuutosta seuraamalla tai lukemalla
 REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
REAKTIOT JA TASAPAINO, KE5 Happo-emästitraukset Määritelmä, titraus: Titraus on menetelmä, jossa tutkittavan liuoksen sisältämä ainemäärä määritetään lisäämällä siihen tarkkaan mitattu tilavuus titrausliuosta,
Luku 2. Kemiallisen reaktion tasapaino
 Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Kosteikkojen puhdistustehokkuuden parantaminen sorptiomateriaaleilla
 Kosteikkojen puhdistustehokkuuden parantaminen sorptiomateriaaleilla Satu Maaria Karjalainen SYKE TuKos-hankkeen loppuseminaari 1.9.2011 Oulussa Tausta Osassa turvetuotannon t t valumavesiä puhdistavissa
Kosteikkojen puhdistustehokkuuden parantaminen sorptiomateriaaleilla Satu Maaria Karjalainen SYKE TuKos-hankkeen loppuseminaari 1.9.2011 Oulussa Tausta Osassa turvetuotannon t t valumavesiä puhdistavissa
Normaalipotentiaalit
 Normaalipotentiaalit MATERIAALIT JA TEKNOLOGIA, KE4 Yksittäisen elektrodin aiheuttaman jännitteen mittaaminen ei onnistu. Jännitemittareilla voidaan havaita ja mitata vain kahden elektrodin välinen potentiaaliero
Normaalipotentiaalit MATERIAALIT JA TEKNOLOGIA, KE4 Yksittäisen elektrodin aiheuttaman jännitteen mittaaminen ei onnistu. Jännitemittareilla voidaan havaita ja mitata vain kahden elektrodin välinen potentiaaliero
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Ylioppilastutkintolautakunta S tudentexamensnämnden
 Ylioppilastutkintolautakunta S tudentexamensnämnden KEMIAN KOE 22.3.2013 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten piirteiden ja sisältöjen luonnehdinta ei sido ylioppilastutkintolautakunnan arvostelua.
Ylioppilastutkintolautakunta S tudentexamensnämnden KEMIAN KOE 22.3.2013 HYVÄN VASTAUKSEN PIIRTEITÄ Alla oleva vastausten piirteiden ja sisältöjen luonnehdinta ei sido ylioppilastutkintolautakunnan arvostelua.
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Metallien ympäristölaatunormit ja biosaatavuus. Matti Leppänen SYKE,
 Metallien ympäristölaatunormit ja biosaatavuus Matti Leppänen SYKE, 20.11.2018 Uudet ympäristölaatunormit direktiivissä ja asetuksessa Muutos Ni ja Pb AA-EQS Biosaatavuus Miksi mukana? Vedenlaatu vaihtelee
Metallien ympäristölaatunormit ja biosaatavuus Matti Leppänen SYKE, 20.11.2018 Uudet ympäristölaatunormit direktiivissä ja asetuksessa Muutos Ni ja Pb AA-EQS Biosaatavuus Miksi mukana? Vedenlaatu vaihtelee
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA
 SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää
SUMUINEN AAMU METALLINKIERRÄTYSLAITOKSELLA KOHDERYHMÄ: Työ on suunniteltu lukion kurssille KE4, jolla käsitellään teollisuuden tärkeitä raaka-aineita sekä hapetus-pelkitysreaktioita. Työtä voidaan käyttää
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Reaktioyhtälö. Sähköisen oppimisen edelläkävijä www.e-oppi.fi. Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava
 Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
KaiHali & DROMINÄ hankkeiden loppuseminaari
 KaiHali & DROMINÄ hankkeiden loppuseminaari Sedimentin geokemiallisten olojen muuttuminen kaivoskuormituksessa (KaiHali-projektin työpaketin 2 osatehtävä 3), Jari Mäkinen, Tommi Kauppila ja Tatu Lahtinen
KaiHali & DROMINÄ hankkeiden loppuseminaari Sedimentin geokemiallisten olojen muuttuminen kaivoskuormituksessa (KaiHali-projektin työpaketin 2 osatehtävä 3), Jari Mäkinen, Tommi Kauppila ja Tatu Lahtinen
Mikä on kationinvaihtokapasiteetti? Iina Haikarainen ProAgria Etelä-Savo Ravinnepiian Kevätinfo
 Mikä on kationinvaihtokapasiteetti? Iina Haikarainen ProAgria Etelä-Savo Ravinnepiian Kevätinfo 15.3.2017 Kationinvaihtokapasiteetti Ca 2+ K + Mg 2+ Kationi = Positiivisesti varautunut ioni Kationinvaihtokapasiteetti
Mikä on kationinvaihtokapasiteetti? Iina Haikarainen ProAgria Etelä-Savo Ravinnepiian Kevätinfo 15.3.2017 Kationinvaihtokapasiteetti Ca 2+ K + Mg 2+ Kationi = Positiivisesti varautunut ioni Kationinvaihtokapasiteetti
PK-yrityksen kokemuksia KaivosVV:stä ja mitä
 PK-yrityksen kokemuksia KaivosVV:stä ja mitä olemme tehneet sen aikana SanOx Ltd, Jukka Hakola, Commercial Director Jukka.hakola@sansox.fi +358 40 500 1123 DOUBLE WINNER OF EU INNOVATION AWARD 2014 OxTube,
PK-yrityksen kokemuksia KaivosVV:stä ja mitä olemme tehneet sen aikana SanOx Ltd, Jukka Hakola, Commercial Director Jukka.hakola@sansox.fi +358 40 500 1123 DOUBLE WINNER OF EU INNOVATION AWARD 2014 OxTube,
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
COLAJUOMAN HAPPAMUUS Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAUSTA Cola-juomien voimakas happamuus johtuu pääosin niiden sisältämästä fosforihaposta. Happamuus saattaa laskea jopa ph
KaiHali & DROMINÄ hankkeiden loppuseminaari
 KaiHali & DROMINÄ hankkeiden loppuseminaari Kaivosvesien muuttamien vesistöjen aktiiviset puhdistusmenetelmät Esther Takaluoma / Kimmo Kemppainen, KAMK 04.12.2018 Aktiiviset puhdistusmenetelmät 1. Luontainen
KaiHali & DROMINÄ hankkeiden loppuseminaari Kaivosvesien muuttamien vesistöjen aktiiviset puhdistusmenetelmät Esther Takaluoma / Kimmo Kemppainen, KAMK 04.12.2018 Aktiiviset puhdistusmenetelmät 1. Luontainen
ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia)
 ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia) Elämän edellytykset: Solun täytyy pystyä (a) replikoitumaan (B) katalysoimaan tarvitsemiaan reaktioita tehokkaasti ja selektiivisesti eli sillä on oltava
ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia) Elämän edellytykset: Solun täytyy pystyä (a) replikoitumaan (B) katalysoimaan tarvitsemiaan reaktioita tehokkaasti ja selektiivisesti eli sillä on oltava
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Bioöljyn ja biodieselin säilyvyyden parantaminen
 Katriina Sirviö Bioöljyn ja biodieselin säilyvyyden parantaminen 5.5.2011 Tulevaisuuden moottori- ja polttoaineteknologiat VTT, Espoo Polttoainetutkimus Vaasan yliopistossa Moottorilaboratorio Biopolttoainelaboratorio
Katriina Sirviö Bioöljyn ja biodieselin säilyvyyden parantaminen 5.5.2011 Tulevaisuuden moottori- ja polttoaineteknologiat VTT, Espoo Polttoainetutkimus Vaasan yliopistossa Moottorilaboratorio Biopolttoainelaboratorio
Epäpuhtaudet vesi-höyrypiirissä lähteet ja vaikutukset
 Epäpuhtaudet vesihöyrypiirissä lähteet ja vaikutukset Susanna Vähäsarja ÅFConsult 11.2.2016 1 Sisältö Epäpuhtauksien lähteet ja kulkeutuminen vesihöyrypiirissä Korroosiovauriot ja muodot vesihöyrypiirissä
Epäpuhtaudet vesihöyrypiirissä lähteet ja vaikutukset Susanna Vähäsarja ÅFConsult 11.2.2016 1 Sisältö Epäpuhtauksien lähteet ja kulkeutuminen vesihöyrypiirissä Korroosiovauriot ja muodot vesihöyrypiirissä
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
energiatehottomista komponenteista tai turhasta käyntiajasta
 LUT laboratorio- ato o ja mittauspalvelut ut Esimerkkinä energiatehokkuus -> keskeinen keino ilmastomuutoksen hallinnassa Euroopan sähkönkulutuksesta n. 15 % kuluu pumppusovelluksissa On arvioitu, että
LUT laboratorio- ato o ja mittauspalvelut ut Esimerkkinä energiatehokkuus -> keskeinen keino ilmastomuutoksen hallinnassa Euroopan sähkönkulutuksesta n. 15 % kuluu pumppusovelluksissa On arvioitu, että
Sähkökemian perusteita, osa 1
 Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
5 LIUOKSEN PITOISUUS Lisätehtävät
 LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
LIUOKSEN PITOISUUS Lisätehtävät Esimerkki 1. a) 100 ml:ssa suolaista merivettä on keskimäärin 2,7 g NaCl:a. Mikä on meriveden NaCl-pitoisuus ilmoitettuna molaarisuutena? b) Suolaisen meriveden MgCl 2 -pitoisuus
Biokemian perusteet 26.9.2012: Hemoglobiini, Entsyymikatalyysi
 Biokemian perusteet 26.9.2012: Hemoglobiini, Entsyymikatalyysi Dos. Tuomas Haltia Sirppisoluanemia, Hb-mutaatio Glu-6 Val Hemoglobiini allosteerinen hapen kuljettajaproteiini (ei ole entsyymi!) Allosteerinen
Biokemian perusteet 26.9.2012: Hemoglobiini, Entsyymikatalyysi Dos. Tuomas Haltia Sirppisoluanemia, Hb-mutaatio Glu-6 Val Hemoglobiini allosteerinen hapen kuljettajaproteiini (ei ole entsyymi!) Allosteerinen
Oppikirjan tehtävien ratkaisut
 Oppikirjan tehtävien ratkaisut Liukoisuustulon käyttö 10. a) Selitä, mitä eroa on käsitteillä liukoisuus ja liukoisuustulo. b) Lyijy(II)bromidin PbBr liukoisuus on 1,0 10 mol/dm. Laske lyijy(ii)bromidin
Oppikirjan tehtävien ratkaisut Liukoisuustulon käyttö 10. a) Selitä, mitä eroa on käsitteillä liukoisuus ja liukoisuustulo. b) Lyijy(II)bromidin PbBr liukoisuus on 1,0 10 mol/dm. Laske lyijy(ii)bromidin
Elektrolyysi Anodilla tapahtuu aina hapettuminen ja katodilla pelkistyminen!
 Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
Osasto: Materiaalin käsittely, Rikkihapon annostelu agglomeraattiin kuljettimella
 1/6 Osasto: Projekti: TK Materiaalin käsittely, Rikkihapon annostelu agglomeraattiin kuljettimella Pvm. 17.12.2015 jatkettu 7.4.2016 Tekijä: Ville Heikkinen, Matti Okkonen, Herkko Kylli Asiakirja: Tulokset
1/6 Osasto: Projekti: TK Materiaalin käsittely, Rikkihapon annostelu agglomeraattiin kuljettimella Pvm. 17.12.2015 jatkettu 7.4.2016 Tekijä: Ville Heikkinen, Matti Okkonen, Herkko Kylli Asiakirja: Tulokset
COLAJUOMAN HAPPAMUUS
 COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
COLAJUOMAN HAPPAMUUS KOHDERYHMÄ: Työ soveltuu lukion viidennelle kurssille KE5. KESTO: 90 min MOTIVAATIO: Juot paljon kolajuomia, miten ne vaikuttavat hampaisiisi? TAVOITE: Opiskelija pääsee titraamaan.
Prosessimittaukset. Miksi prosessikierroista tehdään mittauksia
 Prosessimittaukset Miksi prosessikierroista tehdään mittauksia Saadaan informaatiota prosessiolosuhteista Tiedetään, että prosessissa tapahtuu oikeita asioita Osataan ohjata prosessia Virtausmittaukset
Prosessimittaukset Miksi prosessikierroista tehdään mittauksia Saadaan informaatiota prosessiolosuhteista Tiedetään, että prosessissa tapahtuu oikeita asioita Osataan ohjata prosessia Virtausmittaukset
17VV VV Veden lämpötila 14,2 12,7 14,2 13,9 C Esikäsittely, suodatus (0,45 µm) ok ok ok ok L. ph 7,1 6,9 7,1 7,1 RA2000¹ L
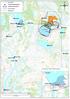 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
17VV VV 01021
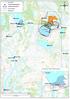 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
ROMUMETALLIA OSTAMASSA (OSA 1)
 ROMUMETALLIA OSTAMASSA (OSA 1) Johdanto Kupari on metalli, jota käytetään esimerkiksi sähköjohtojen, tietokoneiden ja putkiston valmistamisessa. Korkean kysynnän vuoksi kupari on melko kallista. Kuparipitoisen
ROMUMETALLIA OSTAMASSA (OSA 1) Johdanto Kupari on metalli, jota käytetään esimerkiksi sähköjohtojen, tietokoneiden ja putkiston valmistamisessa. Korkean kysynnän vuoksi kupari on melko kallista. Kuparipitoisen
EPÄORGAANINEN KEMIA HARJOITUKSIA. Jaksollinen järjestelmä
 EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
Metsäteollisuuden sivuvirrat Hyödyntämisen haasteet ja mahdollisuudet
 Metsäteollisuuden sivuvirrat Hyödyntämisen haasteet ja mahdollisuudet GES-verkostotapaaminen Kukkuroinmäen jätekeskus 24.02.2016 Apila Group Oy Ab Mervi Matilainen Apila Group Kiertotalouden koordinaattori
Metsäteollisuuden sivuvirrat Hyödyntämisen haasteet ja mahdollisuudet GES-verkostotapaaminen Kukkuroinmäen jätekeskus 24.02.2016 Apila Group Oy Ab Mervi Matilainen Apila Group Kiertotalouden koordinaattori
Käytännön esimerkkejä on lukuisia.
 PROSESSI- JA Y MPÄRISTÖTEKNIIK KA Ilmiömallinnus prosessimet allurgiassa, 01 6 Teema 4 Tehtävien ratkaisut 15.9.016 SÄHKÖKEMIALLISTEN REAKTIOIDEN TERMODYNAMIIKKA JA KINETIIKKA Yleistä Tämä dokumentti sisältää
PROSESSI- JA Y MPÄRISTÖTEKNIIK KA Ilmiömallinnus prosessimet allurgiassa, 01 6 Teema 4 Tehtävien ratkaisut 15.9.016 SÄHKÖKEMIALLISTEN REAKTIOIDEN TERMODYNAMIIKKA JA KINETIIKKA Yleistä Tämä dokumentti sisältää
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle 1
POHDITTAVAKSI ENNEN TYÖTÄ
 MUSTIKKATRIO KOHDERYHMÄ: Työ voidaan suorittaa kaikenikäisten kanssa, jolloin teoria sovelletaan osaamistasoon. KESTO: n. 1h MOTIVAATIO: Arkipäivän ruokakemian ilmiöiden tarkastelu uudessa kontekstissa.
MUSTIKKATRIO KOHDERYHMÄ: Työ voidaan suorittaa kaikenikäisten kanssa, jolloin teoria sovelletaan osaamistasoon. KESTO: n. 1h MOTIVAATIO: Arkipäivän ruokakemian ilmiöiden tarkastelu uudessa kontekstissa.
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seokset ja liuokset. 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen
 Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
KEHÄVALU OY Mattilanmäki 24 TAMPERE
 PENTTI PAUKKONEN VALUHIEKAN HAITTA-AINETUTKIMUS KEHÄVALU OY Mattilanmäki 24 TAMPERE Työ nro 82102448 23.10.2002 VALUHIEKAN HAITTA-AINETUTKIMUS Kehävalu Oy 1 SISÄLLYS 1. JOHDANTO 2 2. TUTKIMUSKOHDE 2 2.1
PENTTI PAUKKONEN VALUHIEKAN HAITTA-AINETUTKIMUS KEHÄVALU OY Mattilanmäki 24 TAMPERE Työ nro 82102448 23.10.2002 VALUHIEKAN HAITTA-AINETUTKIMUS Kehävalu Oy 1 SISÄLLYS 1. JOHDANTO 2 2. TUTKIMUSKOHDE 2 2.1
sivu 1/7 OPETTAJALLE Työn motivaatio
 sivu 1/7 PETTAJALLE Työn motivaatio Työssä saadaan kemiallinen reaktio näkyväksi käyttämällä katalyyttiä. Työssä katalyyttinä toimii veren hemoglobiinin rauta tai yhtä hyvin liuos joka sisältää esimerkiksi
sivu 1/7 PETTAJALLE Työn motivaatio Työssä saadaan kemiallinen reaktio näkyväksi käyttämällä katalyyttiä. Työssä katalyyttinä toimii veren hemoglobiinin rauta tai yhtä hyvin liuos joka sisältää esimerkiksi
125,0 ml 0,040 M 75,0+125,0 ml Muodostetaan ionitulon lauseke ja sijoitetaan hetkelliset konsentraatiot
 4.4 Syntyykö liuokseen saostuma 179. Kirjoita tasapainotettu nettoreaktioyhtälö olomuotomerkintöineen, kun a) fosforihappoliuokseen lisätään kaliumhydroksidiliuosta b) natriumvetysulfaattiliuokseen lisätään
4.4 Syntyykö liuokseen saostuma 179. Kirjoita tasapainotettu nettoreaktioyhtälö olomuotomerkintöineen, kun a) fosforihappoliuokseen lisätään kaliumhydroksidiliuosta b) natriumvetysulfaattiliuokseen lisätään
L7 Kaasun adsorptio kiinteän aineen pinnalle
 CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
CHEM-C2230 Pintakemia L7 Kaasun adsorptio kiinteän aineen pinnalle Monika Österberg Barnes&Gentle, 2005, luku 8 Aikaisemmin käsitellyt Adsorptio kiinteälle pinnalle nesteessä Adsorptio nestepinnalle Oppimistavoitteet
VILJAVUUSTUTKIMUS s-posti: neuvonta@viljavuuspalvelu.fi Päivämäärä Asiakasnro Tutkimusnro
 1/8 Näytteen numero 1 2 3 4 5 6 7 Peruslohkotunnus 754-07722- 19 754-07334- 19 Pintamaan maalaji a) HeS HeS HeS HeS HsS HsS HeS Multavuus a) rm rm rm rm rm rm rm 0,8 1,0 0,7 0,5 0,4 0,6 0,5 Happamuus ph
1/8 Näytteen numero 1 2 3 4 5 6 7 Peruslohkotunnus 754-07722- 19 754-07334- 19 Pintamaan maalaji a) HeS HeS HeS HeS HsS HsS HeS Multavuus a) rm rm rm rm rm rm rm 0,8 1,0 0,7 0,5 0,4 0,6 0,5 Happamuus ph
Miksi ja millaista hulevesikohteiden seurantaa tarvitaan? Uudet hulevesien hallinnan Smart & Clean ratkaisut Kick Off
 Miksi ja millaista hulevesikohteiden seurantaa tarvitaan? Uudet hulevesien hallinnan Smart & Clean ratkaisut Kick Off 31.1.2018 Nora Sillanpää Tutkijatohtori, TkT Rakennetun ympäristön laitos Aalto-yliopiston
Miksi ja millaista hulevesikohteiden seurantaa tarvitaan? Uudet hulevesien hallinnan Smart & Clean ratkaisut Kick Off 31.1.2018 Nora Sillanpää Tutkijatohtori, TkT Rakennetun ympäristön laitos Aalto-yliopiston
Sokerijuurikas ja ravinteet 14.-15.4.2016. Susanna Muurinen
 Sokerijuurikas ja ravinteet 14.-15.4.2016 Susanna Muurinen Pääravinteet N-typpi P-fosfori K-kalium Ca-kalsium Mg-magnesium Na-natrium S-rikki Pääravinteiden otto 50-500 kg ha -1 Hivenravinteet B- boori
Sokerijuurikas ja ravinteet 14.-15.4.2016 Susanna Muurinen Pääravinteet N-typpi P-fosfori K-kalium Ca-kalsium Mg-magnesium Na-natrium S-rikki Pääravinteiden otto 50-500 kg ha -1 Hivenravinteet B- boori
Perunan tummuminen. Pohjoisen Kantaperuna Paavo Ahvenniemi
 Perunan tummuminen Pohjoisen Kantaperuna 12.4.2011 Paavo Ahvenniemi Perunan tummuminen Lisätietoa: Lehtiartikkelini keittotummumisesta www.saunalahti.fi/ahven/peruna/learti55.htm Tietoa tummumisesta Kotipuutarhurin
Perunan tummuminen Pohjoisen Kantaperuna 12.4.2011 Paavo Ahvenniemi Perunan tummuminen Lisätietoa: Lehtiartikkelini keittotummumisesta www.saunalahti.fi/ahven/peruna/learti55.htm Tietoa tummumisesta Kotipuutarhurin
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ASPIRIININ MÄÄRÄN MITTAUS VALOKUVAAMALLA
 ASPIRIININ MÄÄRÄN MITTAUS VALOKUVAAMALLA Jaakko Lohenoja 2009 Johdanto Asetyylisalisyylihapon määrä voidaan mitata spektrofotometrisesti hydrolysoimalla asetyylisalisyylihappo salisyylihapoksi ja muodostamalla
ASPIRIININ MÄÄRÄN MITTAUS VALOKUVAAMALLA Jaakko Lohenoja 2009 Johdanto Asetyylisalisyylihapon määrä voidaan mitata spektrofotometrisesti hydrolysoimalla asetyylisalisyylihappo salisyylihapoksi ja muodostamalla
Vinkkejä opettajille ja odotetut tulokset SIVU 1
 Vinkkejä opettajille ja odotetut tulokset SIVU 1 Konteksti palautetaan oppilaiden mieliin käymällä Osan 1 johdanto uudelleen läpi. Kysymysten 1 ja 2 tarkoituksena on arvioida ovatko oppilaat ymmärtäneet
Vinkkejä opettajille ja odotetut tulokset SIVU 1 Konteksti palautetaan oppilaiden mieliin käymällä Osan 1 johdanto uudelleen läpi. Kysymysten 1 ja 2 tarkoituksena on arvioida ovatko oppilaat ymmärtäneet
KUPARIASPIRINAATIN VALMISTUS
 TAUSTAA KUPARIASPIRINAATIN VALMISTUS Kupariaspirinaatti eli dikuparitetra-asetyylisalisylaatti on epäorgaaninen yhdiste, jonka käyttöä nivelreuman hoidossa ja toisen sukupolven lääkevalmistuksessa on tutkittu
TAUSTAA KUPARIASPIRINAATIN VALMISTUS Kupariaspirinaatti eli dikuparitetra-asetyylisalisylaatti on epäorgaaninen yhdiste, jonka käyttöä nivelreuman hoidossa ja toisen sukupolven lääkevalmistuksessa on tutkittu
E Seleeni 7000 plex. Tärkeitä antioksidantteja ja orgaanista seleeniä
 E Seleeni 7000 plex Tärkeitä antioksidantteja ja orgaanista seleeniä KOOSTUMUS E-vitamiini 7 000 mg/kg B6-vitamiini B12-vitamiini C-vitamiini Sinkki (Zn) Seleeni (Se) 60 % natriumseleniittinä 40 % orgaanisena
E Seleeni 7000 plex Tärkeitä antioksidantteja ja orgaanista seleeniä KOOSTUMUS E-vitamiini 7 000 mg/kg B6-vitamiini B12-vitamiini C-vitamiini Sinkki (Zn) Seleeni (Se) 60 % natriumseleniittinä 40 % orgaanisena
Neutraloituminen = suolan muodostus
 REAKTIOT JA TASAPAINO, KE5 Neutraloituminen = suolan muodostus Taustaa: Tähän asti ollaan tarkasteltu happojen ja emästen vesiliuoksia erikseen, mutta nyt tarkastellaan mitä tapahtuu, kun happo ja emäs
REAKTIOT JA TASAPAINO, KE5 Neutraloituminen = suolan muodostus Taustaa: Tähän asti ollaan tarkasteltu happojen ja emästen vesiliuoksia erikseen, mutta nyt tarkastellaan mitä tapahtuu, kun happo ja emäs
Alkuaineita luokitellaan atomimassojen perusteella
 IHMISEN JA ELINYMPÄRISTÖN KEMIAA, KE2 Alkuaineen suhteellinen atomimassa Kertausta: Isotoopin määritelmä: Saman alkuaineen eri atomien ytimissä on sama määrä protoneja (eli sama alkuaine), mutta neutronien
IHMISEN JA ELINYMPÄRISTÖN KEMIAA, KE2 Alkuaineen suhteellinen atomimassa Kertausta: Isotoopin määritelmä: Saman alkuaineen eri atomien ytimissä on sama määrä protoneja (eli sama alkuaine), mutta neutronien
Kemia ja ympäristö opintojakso
 1 FILE:\EVTEK_Kemia ja ymparisto_luku5 ja 6_03102005 Opettaja: Pekka Lehtonen GSM: 050-3595099 E-mail: pekka.lehtonen@evtek.fi opintojakso Tiivistelmä oppikrjan luvuista 5 ja 6 LUKU 5: SEOKSET - Liuokset
1 FILE:\EVTEK_Kemia ja ymparisto_luku5 ja 6_03102005 Opettaja: Pekka Lehtonen GSM: 050-3595099 E-mail: pekka.lehtonen@evtek.fi opintojakso Tiivistelmä oppikrjan luvuista 5 ja 6 LUKU 5: SEOKSET - Liuokset
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
Arvio NP3-rikastushiekka-altaalle tulevien prosessikemikaalien jäämien pitoisuuksista ja niiden pysyvyydestä ja mahdollisesta muuntumisesta.
 Arvio NP3-rikastushiekka-altaalle tulevien prosessikemikaalien jäämien pitoisuuksista ja niiden pysyvyydestä ja mahdollisesta muuntumisesta. NP3-altaalle läjitettävä NP-rikastehiekka sisältää prosessikaaviossa
Arvio NP3-rikastushiekka-altaalle tulevien prosessikemikaalien jäämien pitoisuuksista ja niiden pysyvyydestä ja mahdollisesta muuntumisesta. NP3-altaalle läjitettävä NP-rikastehiekka sisältää prosessikaaviossa
Talvivaaran jätevesipäästön alapuolisten järvien veden laatu 2010-2011 - Tarkkailutulosten mukaan
 Talvivaaran jätevesipäästön alapuolisten järvien veden laatu 21-211 - Tarkkailutulosten mukaan 4.1.211 1 Pintavesien tarkkailukohteet, Talvivaara Jormasjärvi Kolmisoppi Tuhkajoki Kalliojärvi Salminen Ylälumijärvi
Talvivaaran jätevesipäästön alapuolisten järvien veden laatu 21-211 - Tarkkailutulosten mukaan 4.1.211 1 Pintavesien tarkkailukohteet, Talvivaara Jormasjärvi Kolmisoppi Tuhkajoki Kalliojärvi Salminen Ylälumijärvi
Esimerkiksi ammoniakin valmistus typestä ja vedystä on tyypillinen teollinen tasapainoreaktio.
 REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
Ilma betonissa Betonitutkimusseminaari 2017 TkT Anna Kronlöf, FM Jarkko Klami VTT Expert Services Oy
 Kuvapaikka (ei kehyksiä kuviin) Ilma betonissa Betonitutkimusseminaari 2017 TkT Anna Kronlöf, FM Jarkko Klami VTT Expert Services Oy En kyllä tajua, mistä betoniin tulee ylimääräistä ilmaa. Betonissa
Kuvapaikka (ei kehyksiä kuviin) Ilma betonissa Betonitutkimusseminaari 2017 TkT Anna Kronlöf, FM Jarkko Klami VTT Expert Services Oy En kyllä tajua, mistä betoniin tulee ylimääräistä ilmaa. Betonissa
Kenttätutkimus hiiliteräksen korroosiosta kaukolämpöverkossa
 1 (17) Tilaajat Suomen KL Lämpö Oy Sari Kurvinen Keisarinviitta 22 33960 Pirkkala Lahti Energia Olli Lindstam PL93 15141 Lahti Tilaus Yhteyshenkilö VTT:ssä Sähköposti 30.5.2007, Sari Kurvinen, sähköposti
1 (17) Tilaajat Suomen KL Lämpö Oy Sari Kurvinen Keisarinviitta 22 33960 Pirkkala Lahti Energia Olli Lindstam PL93 15141 Lahti Tilaus Yhteyshenkilö VTT:ssä Sähköposti 30.5.2007, Sari Kurvinen, sähköposti
Lääkeainejäämät biokaasulaitosten lopputuotteissa. Marja Lehto, MTT
 Kestävästi Kiertoon - seminaari Lääkeainejäämät biokaasulaitosten lopputuotteissa Marja Lehto, MTT Orgaaniset haitta-aineet aineet Termillä tarkoitetaan erityyppisiä orgaanisia aineita, joilla on jokin
Kestävästi Kiertoon - seminaari Lääkeainejäämät biokaasulaitosten lopputuotteissa Marja Lehto, MTT Orgaaniset haitta-aineet aineet Termillä tarkoitetaan erityyppisiä orgaanisia aineita, joilla on jokin
Uusi ejektoripohjainen hiilidioksidin talteenotto-menetelmä. BioCO 2 -projektin loppuseminaari elokuuta 2018, Jyväskylä.
 Uusi ejektoripohjainen hiilidioksidin talteenotto-menetelmä BioCO 2 -projektin loppuseminaari - 30. elokuuta 2018, Jyväskylä Kristian Melin Esityksen sisältö Haasteet CO 2 erotuksessa Mitä uutta ejektorimenetelmässä
Uusi ejektoripohjainen hiilidioksidin talteenotto-menetelmä BioCO 2 -projektin loppuseminaari - 30. elokuuta 2018, Jyväskylä Kristian Melin Esityksen sisältö Haasteet CO 2 erotuksessa Mitä uutta ejektorimenetelmässä
Ratkaisu. Tarkastellaan aluksi Fe 3+ - ja Fe 2+ -ionien välistä tasapainoa: Nernstin yhtälö tälle reaktiolle on:
 Esimerkki Pourbaix-piirroksen laatimisesta Laadi Pourbaix-piirros, jossa on esitetty metallisen ja ionisen raudan sekä raudan oksidien stabiilisuusalueet vesiliuoksessa 5 C:een lämpötilassa. Ratkaisu Tarkastellaan
Esimerkki Pourbaix-piirroksen laatimisesta Laadi Pourbaix-piirros, jossa on esitetty metallisen ja ionisen raudan sekä raudan oksidien stabiilisuusalueet vesiliuoksessa 5 C:een lämpötilassa. Ratkaisu Tarkastellaan
Mangaani porraskokeen tuloksia Sokerijuurikkaan Tutkimuskeskus (SjT)
 Mangaani porraskokeen tuloksia 2014-2016 Sokerijuurikkaan Tutkimuskeskus (SjT) Mangaani (Mn) Tyydyttävä Juurikasmaiden Mn-pitoisuudet Varsinais-Suomessa, Satakunnassa ja Hämeessä vuosina 2002-2012 Viljavuusarvosta
Mangaani porraskokeen tuloksia 2014-2016 Sokerijuurikkaan Tutkimuskeskus (SjT) Mangaani (Mn) Tyydyttävä Juurikasmaiden Mn-pitoisuudet Varsinais-Suomessa, Satakunnassa ja Hämeessä vuosina 2002-2012 Viljavuusarvosta
TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU
 Oulun Seudun Ammattiopisto Raportti Page 1 of 6 Turkka Sunnari & Janika Pietilä 23.1.2016 TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU PERIAATE/MENETELMÄ Työssä valmistetaan
Oulun Seudun Ammattiopisto Raportti Page 1 of 6 Turkka Sunnari & Janika Pietilä 23.1.2016 TITRAUKSET, KALIBROINNIT, SÄHKÖNJOHTAVUUS, HAPPOJEN JA EMÄSTEN TARKASTELU PERIAATE/MENETELMÄ Työssä valmistetaan
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I
 Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Asukkaat ovat kysyneet Kalliojärven ja Kivijärven veden käyttökelpoisuutta talous-, uima-, pesu- ja löylyvedeksi.
 12.5.2011 Kainuun ELY-keskus PL 115 87101 Kajaani Asukkaat ovat kysyneet Kalliojärven ja Kivijärven veden käyttökelpoisuutta talous-, uima-, pesu- ja löylyvedeksi. Ympäristöterveydenhuolto on arvioinut
12.5.2011 Kainuun ELY-keskus PL 115 87101 Kajaani Asukkaat ovat kysyneet Kalliojärven ja Kivijärven veden käyttökelpoisuutta talous-, uima-, pesu- ja löylyvedeksi. Ympäristöterveydenhuolto on arvioinut
Liitetaulukko 1/11. Tutkittujen materiaalien kokonaispitoisuudet KOTIMAINEN MB-JÄTE <1MM SAKSAN MB- JÄTE <1MM POHJAKUONA <10MM
 Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Kemian opetuksen keskus Helsingin yliopisto Veden kovuus Oppilaan ohje. Veden kovuus
 Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Siirtymämetallien erityisominaisuuksia
 Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
HAPPO-EMÄSTITRAUS ANALYYSIMENETELMÄNÄ. Copyright Isto Jokinen
 HAPPO-EMÄSTITRAUS ANALYYSIMENETELMÄNÄ HAPPO-EMÄSTITRAUS ANALYYSINÄ PINTAKÄSITTELYLINJOILLA Happo-emäs-titraus on yksinkertainen analyysikeino jolla voidaan selvittää pintakäsittelyissä käytettävien kylpyjen
HAPPO-EMÄSTITRAUS ANALYYSIMENETELMÄNÄ HAPPO-EMÄSTITRAUS ANALYYSINÄ PINTAKÄSITTELYLINJOILLA Happo-emäs-titraus on yksinkertainen analyysikeino jolla voidaan selvittää pintakäsittelyissä käytettävien kylpyjen
Ultrasil 11. Kuvaus. Ominaisuudet. Vahvasti emäksinen, jauhemainen membraanien pesuaine
 Ultrasil 11 Kuvaus Vahvasti emäksinen, jauhemainen membraanien pesuaine Ominaisuudet irrottaa tehokkaasti proteiini- ja muita orgaanisia jäämiä irrottaa hyvin kerrostumia Konsentraatti Ulkonäkö: valkoinen/kellertävä
Ultrasil 11 Kuvaus Vahvasti emäksinen, jauhemainen membraanien pesuaine Ominaisuudet irrottaa tehokkaasti proteiini- ja muita orgaanisia jäämiä irrottaa hyvin kerrostumia Konsentraatti Ulkonäkö: valkoinen/kellertävä
