WOMN Ehkäisyn vaihtoehdot
|
|
|
- Tyyne Järvenpää
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 Ehkäisyn vaihtoehdot
2 Hormonaalisen ehkäisyn vaihtoehdot Yhdistelmähormoniehkäisyn vaihtoehdot (sisältävät estrogeenia ja progestiinia) Ehkäisyrengas (annostelu: kerran kuussa) Ehkäisylaastari (annostelu: kerran viikossa) Ehkäisytabletti (annostelu: päivittäin) Progestiiniehkäisyn vaihtoehdot (sisältävät pelkästään progestiinia) Hormonikierukka (5 vuoden ehkäisy) MUISTA: Vain kondomi suojaa seksitaudeilta! Implantaatti (3 5 vuoden ehkäisy) Injektio (3 kuukauden ehkäisy) Minipilleri (annostelu: päivittäin)
3 Yhdistelmähormoniehkäisymenetelmät Kaikki yhdistelmähormoniehkäisymenetelmät sisältävät kahta hormonia: estrogeenia ja progestiinia. Menetelmät eroavat toisistaan siinä, miten usein ja mitä reittiä hormonit annostellaan. Annostelulla voi olla vaikutusta käyttömukavuuteen. Muista lääkärillä käydessäsi aina mainita, että käytät ehkäisyä. Ehkäisyrengas (kerran kuukaudessa) Ehkäisypillerit (kerran päivässä) Ehkäisylaastari (kerran viikossa) Tuotteen kuvaus Pehmeä muovirengas, joka sisältää sekä estrogeenia että progestiinia. Rengasta käytetään 3 vkon ajan raskauden ehkäisemiseksi. Pilleriliuska, jossa on yleisimmin 21 sekä estrogeenia että progestiinia sisältävää pilleriä. Pilleri otetaan säännöllisesti kerran päivässä raskauden ehkäisemiseksi. Kolme laastaria, jotka sisältävät sekä estrogeenia että progestiinia. Laastari vaihdetaan viikon välein raskauden ehkäisemiseksi. Teho (kun ohjeita noudatetaan) Mitä tapahtuu, jos unohdan ehkäisyn? Mitä tapahtuu, kun lopetan ehkäisyn käytön? Erot ja yhtäläisyydet Näin sitä käytetään Käyttö imetyksen aikana Suoja sukupuolitauteja ja HI-virusta vastaan Yleisimmät haittavaikutukset Rengas poistetaan 3 viikon käytön jälkeen. Jos poikkeat käyttöohjeesta, lue pakkausselosteesta kuinka toimia. * Ei tarvitse muistaa joka päivä - rengas vaihdetaan kerran kuukaudessa. * Erittäin säännölliset kuukautiset. Tiputtelu on harvinaista 1. * Voidaan haluttaessa käyttää kuukautisten siirtämiseen. * Renkaasta vapautuu tasaisesti hormoneja, jotka imeytyvät verenkiertoon emättimen limakalvon kautta 2. * Estrogeenitasot verenkierrossa ovat alhaiset ja tasaiset (21 vrk seuranta) 1. * Rengas asetetaan emättimeen niin syvälle, että se ei tunnu. Rengas pysyy hyvin paikallaan 3. Rengas harvoin tuntuu yhdynnässä 3. * Ei lisää limakalvojen kuivuutta 4. * Voi joissakin harvoissa tapauksissa aiheuttaa reaktioita emättimessä 2. Emättimen kautta 99 %:n ehkäisyteho Pilleri otetaan joka päivä samaan aikaan. Jos unohdat pillerin, lue pakkausselosteesta ohjeet kuinka toimia. Mahdollisuus tulla raskaaksi palautuu nopeasti ehkäisyn käytön lopettamisen jälkeen. * Pilleri on otettava säännöllisesti päivittäin. * Säännölliset kuukautiset. Tiputtelu on harvinaista. * Voidaan haluttaessa käyttää kuukautisten siirtämiseen. * Pillerin hormonit imeytyvät verenkiertoon vatsassa ja suolistossa. Vaikutus voi sen vuoksi heikentyä oksentelun ja/tai ripulin yhteydessä. * Estrogeenitasot verenkierrossa vaihtelevat päivittäin (21 vrk seuranta) 2. Suun kautta Ei saa käyttää imetyksen aikana. Ei suojaa sukupuolitaudeilta eikä HI-virukselta. Laastari vaihdetaan viikon välein. Jos poikkeat käyttöohjeesta, lue pakkausselosteesta kuinka toimia. * Ei tarvitse muistaa joka päivä - laastari vaihdetaan kerran viikossa. * Säännölliset kuukautiset. Tiputtelu on harvinaista. * Voidaan haluttaessa käyttää kuukautisten siirtämiseen. * Laastarista vapautuu tasaisesti hormoneja, jotka imeytyvät verenkiertoon ihon kautta. * Estrogeenitasot verenkierrossa tasaisemmat kuin ehkäisypillerillä, mutta korkeammat kuin ehkäisyrenkaalla (21 vrk seuranta) 2. * Ei suositella naisille, jotka painavat yli 90 kg. * Voi joskus aiheuttaa ihoärsytystä. Ihon kautta Epäsäännölliset vuodot, päänsärky, oksentelu, ripuli, vatsakivut, painonnousu (nesteen kertyminen), masennus, mielialojen vaihtelut ja rintojen arkuus. Joillekin naisille voi olla hyvä vaihtoehto käyttää ehkäisymenetelmää, joka sisältää pelkkää progestiinia (minipillerit, ehkäisyimplantaatit, ehkäisyruiske tai hormonikierukka). Nämä menetelmät ovat hyvin tehokkaita, ja niitä voidaan käyttää myös imetyksen aikana. Pelkästään progestiinia sisältävien menetelmien käytön aikana vuodot eivät usein ole säännöllisiä. Hormonittomia vaihtoehtoja ovat mm. miehen ja naisen kondomi sekä kuparikierukka. * Veren estrogeenipitoisuus (etinyyliestradioli) 21 vuorokauden aikana. Tämän tiedon todellista kliinistä merkitystä ei tunneta. 1. Milsom I et al. Human Reprod 2006;21(9): Van den Heuvel M et al. Contraception 2005;727: Roumen FJME et al. Human Reprod 2001;16(3): Sabatini R., et al., Contraception 2006:74;220,23.
4 Hormonien tehtävä yhdistelmähormoniehkäisyvalmisteissa Ehkäisyrengas Progestiini = Ovulaation esto = ehkäisyteho Ehkäisylaastari Estrogeeni = Vuotokontrolli = säännölliset kuukautiset Ehkäisytabletti
5 Hormonin tehtävät progestiiniehkäisyvalmisteissa Hormonikierukka Implantaatti Ehkäisyinjektio Minipilleri / pelkkää progestiinia sisältävä pilleri Kohdunsuun lima muuttuu sitkeämmäksi ja siittiöille hankalaksi läpäistä Kohdun limakalvon rauhaset vähenevät ja implantaatio vaikeutuu Ovulaatio häiriytyy tai estyy kokonaan
6 Yhdistelmähormoniehkäisyn terveyshyödyt Hyvä ehkäisyteho Säännöllistää kuukautiskiertoa Yleensä niukemmat kuukautisvuodot Kuukautiskivut yleensä vähenevät tai poistuvat kokonaan Kuukautisten ajoittaminen mahdollista Voi lievittää aknea ja liikakarvoitusta Ennen kuukautisia esiintyvät erilaiset PMS-oireet lievittyvät yleensä Vähemmän endometrioosia Vähemmän munatorvien tulehdusvaurioita sekä sisäsynnytinelinten tulehduksia Suojaa kohdun ulkopuolisilta raskauksilta Raskauksien ajoittaminen mahdollista Vähemmän rintojen ja munasarjojen hyvänlaatuisia kasvaimia Antaa suojaa kohdun runko-osan (limakalvon) syöpää ja munasarjasyöpää vastaan Yhdistelmähormoniehkäisyyn liittyvät haittavaikutukset Haittavaikutuksia voi esiintyä varsinkin ensimmäisten käyttökuukausien aikana Yleisimmät haittavaikutukset: Tiputteluvuodot / epäsäännölliset vuodot Mielialamuutokset Pahoinvointi Päänsärky Rintojen aristus Painonnousu
7 Progestiiniehkäisyn terveyshyödyt Hyvä ehkäisyteho Voidaan käyttää imetysaikana Progestiiniehkäisyyn liittyvät haittavaikutukset Haittavaikutuksia voi esiintyä varsinkin ensimmäisten käyttökuukausien aikana Yleisimmät haittavaikutukset: Tiputteluvuodot / epäsäännölliset vuodot Akne Päänsärky Painonnousu Rintojen aristus Pahoinvointi Mikäli oireet jatkuvat pidempään (yli 3 6 kk) tai ovat häiritseviä, ota yhteyttä terveydenhoitajaan / lääkäriin.
8 Yhdistelmähormoniehkäisyn yleisimmät vasta-aiheet Aikaisemmin sairastettu laskimotukos/ lisääntynyt laskimotukosriski Aurallinen migreeni (neurologiset oireet, esim. näkö- tai tunto-oireet) Hoitamaton korkea verenpaine Yli 35 vuoden ikä ja tupakointi Selittämätön gynekologinen vuoto Maligniteetit, joihin sukupuolihormonit vaikuttavat Progestiiniehkäisyn yleisimmät vasta-aiheet Selittämätön gynekologinen vuoto Akuutti laskimotukos Maksasairaus Maligniteetit, joihin sukupuolihormonit vaikuttavat
9 Sopivan ehkäisymenetelmän löytäminen Yhdistelmähormoniehkäisy Minipilleri Implantaatti Hormonikierukka Kuparikierukka (Ehkäisyrengas, -laastari tai -tabletti) Migreeni Aurallinen Auraton * > 35 v. < 35 v. Tupakointi < 35 v. > 35 v. Ylipaino BMI > 30 Diabetes (Ilman kohde-elinvauriota) Imetys < 6 kk ikäinen lapsi Laskimotukostaipumus Akuutti Aiemmin sairastettu Epilepsia Ikä < 40 v. > 40 v. Verenpainetauti LÄHTEET: Kelsey B. Contraceptive for obese women: considerations. Nurse pract, 2010, Mar 35 (3) Speroff L, Andosek K, Hormonal contraception and obesity. Dialogues in Contraception. 2003;8 (2):1-4. Society of family planning, Higginbotham S: Contraceptive considerations in obese women: release date 1 September 2009, SFP Guideline Contraception 2009 Dec 8 (6) Perheentypa A; Raskauden ehkäisy imetys aikana, Duodecim (12) Morin Papunen L, Päivi Lehtovirta ja Aila Tiitinen: Pitkäaikaissairaus ja raskauden ehkäisyn valinta Duodecim 2008, 124 (4): Risto Kaaja ja Oskari Heikinheimo. Hormonaalinen ehkäisy ja tromboosi mitä uutta? Duodecim 2008, 124 (4): Hickey M et al: Breast cancer in young women and its impact on reproductive function. Hum Reprod Update 2009 May-Jun; 15 (3) : Shimoni N. Intrauterine contraceptives: a review of uses, side effects and candidates.semin reprod Med 2010Mar 28 (2): Ferreira RA et al: Effects of the levonorgestrel-releasing intrauterine system on cardiovascular risk markers in patients with endometriosis: a comparative study with the GnRH analogue. Contraception 2010 Feb; 81 (2): Gillum LA, Mamidipudi SK, Johnston SC. Ischemic stroke risk with oral contraceptives: a metaanalysis.jama, 2000, 284:72-8. Khader YS et al. Oral contraceptives use and the risk of myocardial infarction: a meta-analysis.contraception, 2003, 68:11-7. WHO medical eligibility criteria for contraceptive use 2009 Fourth Edition. = Suositeltava menetelmä = Yksilöllisesti harkiten = Ei suositeltava menetelmä * = Jos sairastuu käytön aikana, käyttö on lopetettava. = Huomioi lääkitys.
10 Ehkäisyn unohtaminen Lue ehkäisyvalmisteesi pakkausselosteesta, kuinka sinun tulee toimia. Ota tarvittaessa yhteyttä terveydenhoitajaan / lääkäriin. Muista! Jälkiehkäisy on hätäratkaisu, jälkiehkäisyä ei ole tarkoitettu jatkuvaan käyttöön! Jälkiehkäisy on tehokkainta, kun sen ottaa mahdollisimman pian yhdynnän jälkeen (valmisteesta riippuen 3 5 vrk). MUISTA seksitautien mahdollisuus! Ota yhteyttä terveydenhoitajaan/ lääkäriin, jotta löydät itsellesi sopivan ehkäisyn.
11 Milloin yhteyttä terveydenhoitajaan/lääkäriin Jos sinulla on: Äkillistä turvotusta tai kovaa kipua pohkeessa Voimakasta tai toistuvaa päänsärkyä Hengenahdistusta Voimakasta rintakipua STOP Epäilet olevasi raskaana
12 Yleisimmät myytit Aiheuttaako pitkään käytetty hormonaalinen ehkäisy lapsettomuutta? EI. Ehkäisy ei aiheuta lapsettomuutta. Hedelmällisyys palautuu nopeasti hormonaalisen ehkäisyn käytön lopettamisen jälkeen. On kuitenkin hyvä muistaa, että hedelmällisyys laskee iän myötä. Huom. Sairastetut seksitaudit voivat aiheuttaa lapsettomuutta. Onko hormonaalisen ehkäisyn käytössä pidettävä käyttökatkoksia? EI. Hormonaalista ehkäisyä voi käyttää niin kauan kuin on tarvetta ehkäistä suunnittelematon raskaus eikä sen käytölle ole vasta-aiheita. Hormonit eivät varastoidu elimistöön. On myös hyvä muistaa, että naisen keho tuottaa itsessäänkin hormoneja.
13 Imetysajan ehkäisy Synnytyksen jälkeen/imetysaikana tarvitaan luotettavaa ehkäisyä. Imetys yksinään antaa 98 %:sen raskaussuojan, jos kaikki seuraavista kriteereistä täyttyvät: - äiti täysimettää (lapsi ei saa mitään lisäravintoa) - synnytyksestä on enintään 6 kk - kuukautiset eivät ole vielä alkaneet Jos yksikin kolmesta kriteeristä jää täyttymättä, imetys ei suojaa raskaudelta. Imetys ei ole ehkäisymenetelmä. Imetysaikana voi käyttää seuraavia ehkäisymenetelmiä: Progestiiniehkäisyvalmisteet: - minipilleri (pelkästään progestiinia sisältävä tabletti) - implantaatti - hormonikierukka - injektio Hormonittomat menetelmät: - kondomi - kuparikierukka
14 MSD:n ehkäisyvalmisteiden hinnat ehkäisyn käyttäjille* Valmiste Pakkauskoko Hinta (sis. alv) Hinta /kk (sis. alv) NuvaRing 1 rengas 15,79 15,79 NuvaRing 3 rengasta 44,23 14,74 Zoely 1 x 28 tabl 14,28 14,28 Zoely 3 x 28 tabl 39,29 13,10 Nexplanon 1 implant. asettimella 189,35 5,26 *Lääketaksa 2013
15 NuvaRing... on kerran kuukaudessa emättimen kautta annosteltava yhdistelmähormoniehkäisy. on vähintään yhtä tehokas kuin ehkäisytabletti. vapauttaa tasaisesti pienen määrän kahta hormonia (estrogeenia ja keltarauhashormonia eli progestiinia). NuvaRing-valmisteyhteenveto
16 NuvaRingin käyttö Ehkäisyrenkaan sijainti emättimessä ei vaikuta sen ehkäisytehoon. Jos ehkäisyrengas tuntuu, se on jäänyt liian alas emättimen suuaukolle. Työnnä se sormellasi syvemmälle emättimeen. Ehkäisyrenkaan käyttöaika on 3 viikkoa, jonka jälkeen pidetään viikon tauko. Tauon jälkeen asetetaan uusi ehkäisyrengas. NuvaRing-valmisteyhteenveto
17 NuvaRingin käytön aloitus Edellinen Aloitusajankohta Tarvitaanko lisäehkäisynä ehkäisymenetelmä estemenetelmää (esim. kondomi) Ei hormonaalista ehkäisyä Kuukautiskierron 1. päivä Ei Kuukautiskierron päivä Kyllä, 1. kierron 7 ensimmäisen renkaan käyttöpäivän ajan Vaihto Aiemman yhdistelmähormoniehkäisyvalmisteen Ei yhdistelmähormoniehkäisyvalmisteesta tavanomaisen tablettitauon, lumetabletti- tai laastaritauon (e-pilleri, e-laastari) päättymistä seuraavana päivänä. Jos aiempaa hormonaalista menetelmää on käytetty oikein ja on kohtuullisen varmaa ettei nainen ole raskaana, voi aiemmasta menetelmästä siirtyä ehkäisyrenkaaseen myös syklin minä tahansa päivänä. Ei Vaihto pelkkää progestiinia Minipilleristä koska tahansa. Kyllä, 1. kierron 7 ensimmäisen sisältävästä ehkäisyvalmisteesta Implantaatista tai hormonikierukasta niiden poistopäivänä. renkaan käyttöpäivän ajan (minipilleri, injektio, implantaatti Injektiosta seuraavana suunniteltuna injektiopäivänä. tai hormonikierukka) Ensimmäisellä raskauskolmenneksella Heti Ei tapahtuneen raskauden keskeytymisen jälkeen Synnytyksen tai toisella raskaus- Neljännellä viikolla synnytyksen tai toisella raskauskolmanneksella Ei kolmanneksella tapahtuneen tapahtuneen raskauden keskeytymisen jälkeen. raskauden keskeytymisen jälkeen (Kts. Käyttö imetyksen aikana) Käytön aloittaminen myöhemmin Kyllä, 1. kierron 7 ensimmäisen renkaan käyttöpäivän ajan. NuvaRing-valmisteyhteenveto
18 WOMN Kuukautisten siirto NuvaRingilla 7 vrk 7 vrk 3 vk 3 vk 3 vk 3 vk 3 vk 3 vk Renkaan poistamisen jälkeen aseta uusi ehkäisyrengas emättimeen ilman taukoviikkoa. Uutta ehkäisyrengasta voi käyttää enintään 3 viikkoa. Kun kuukautisten halutaan alkavan, poistetaan ehkäisyrengas ja pidetään normaali 7 päivän tauko ennen uuden ehkäisyrenkaan asettamista. NuvaRing-valmisteyhteenveto
19 Jos NuvaRing unohtuu Unohdus Toiminta Tarvitaanko lisäehkäisynä estemenetelmää (kondomi) Jos tauko renkaan Uusi ehkäisyrengas tulee Kyllä, 7 seuraavan päivän ajan vaihdon yhteydessä on asettaa heti muistettaessa. ollut liian pitkä (>7 pv) Jos ehkäisyrengas on väliaikaisesti ollut poissa emättimestä: Alle 3 tuntia Aseta ehkäisyrengas välittömästi paikoilleen. Ei - Yli 3 tuntia ensimmäisen Aseta ehkäisyrengas välittömästi paikoilleen. Kyllä, 7 seuraavan päivän ajan tai toisen käyttöviikon aikana - Yli 3 tuntia kolmannen Aseta uusi ehkäisyrengas välittömästi. Kyllä, 7 seuraavan päivän ajan käyttöviikon aikana Vaihtoehtoisesti odota tyhjennysvuotoa ja aseta uusi rengas viimeistään 7 päivän Kyllä, 7 seuraavan päivän ajan kuluttua renkaan poistamisesta. (HUOM. Tämän jälkimmäisen vaihtoehdon voi valita, jos rengasta on käytetty oikein yhtäjaksoisesti edellisen 7 päivän ajan.) Jos ehkäisyrenkaan käyttö on Enintään 4 viikkoa Ei kestänyt liian pitkään Yli 4 viikkoa Kyllä, 7 seuraavan päivän ajan Tee raskaustesti! NuvaRing-valmisteyhteenveto
20 Nexplanon on pelkästään progestiinia sisältävä taipuisa implantaatti, joka asetetaan olkavarren ihon alle paikallispuudutuksessa. ei vaadi käytönaikaisia toimenpiteitä ja sen teho kestää 3 vuotta. poistetaan paikallispuudutuksessa viimeistään 3 vuoden kuluttua asettamisesta. Potilaan pyynnöstä implantaatti voidaan poistaa jo aikaisemmin. Fertiliteetti palautuu nopeasti käytön lopettamisen jälkeen. todennäköisesti aiheuttaa vuotoprofiiliin muutoksia käytön aikana. Nexplanon-valmisteyhteenveto
21 Nexplanonin käytön aloitus Edellinen ehkäisymenetelmä Ei hormonaalista ehkäisyä Vaihto yhdistelmähormoniehkäisystä ehkäisyrengas/-laastari pitäisi ottaa käyttöön. Vaihto pelkästään progestiinia sisältävästä valmisteesta (minipillerit, injektiot, implantaatti, hormonikierukka) Injektio Implantaatti tai hormonikierukka Minipilleri Abortin tai keskenmenon jälkeen Ensimmäinen raskauskolmannes Toinen raskauskolmannes Synnytyksen jälkeen Imetys Ei imetystä Aloitusajankohta Implantaatti asetetaan kuukautiskierron päivänä. Seuraavana päivänä, kun viimeinen vaikuttavaa ainetta sisältävä tabletti on otettu tai ehkäisyrenkaan tai -laastarin poistopäivänä tai taukoviikon jälkeen viimeistään normaalia tablettitaukoa/viimeistä lumetablettia seuraavana päivänä tai viimeistään silloin kuin uusi Implantaatti asetetaan päivänä, jolloin seuraava injektio tulisi antaa. Implantaatin tai hormonikierukan poistopäivänä Minipillereistä voidaan siirtyä Nexplanonin käyttöön minä päivänä tahansa. Implantaatti asetetaan välittömästi päivän kuluttua abortista tai keskenmenosta Neljä viikkoa synnytyksen jälkeen päivän kuluttua synnytyksestä Nexplanon-valmisteyhteenveto
22 Miten Nexplanon asetetaan? 8-10 cm Nexplanonin asetuskohta on n cm olkaluun koukistajalisäkkeen yläpuolella. Ennen asettamista iho puhdistetaan antiseptisella liuoksella ja paikallispuudutetaan. Implantaatti asetetaan paikoilleen aivan ihon alle asettimella. Käsin tunnustelemalla lääkäri varmistaa, että implantaatti on paikoillaan. Miten Nexplanon poistetaan? Nexplanon paikannetaan tunnustelemalla. Paikallispuudute ruiskutetaan implantaatin alle. Ihoon tehdään n. 2 mm viilto. Nexplanon poistetaan pihdeillä. Viilto suljetaan teipillä. Nexplanon-valmisteyhteenveto
23 Imetysajan ehkäisy Nexplanon sopii imettävälle naiselle. Nexplanon ei vaikuta rintamaidon määrään eikä sen laatuun. Nexplanon-valmisteyhteenveto
24 Zoely Zoely on e-pilleri, joka sisältää kahta eri hormonia: Zoelyn sisältämä estrogeeni, estradioli on identtinen naisen elimistön tuottaman estrogeenin kanssa. Zoelyn sisältämä keltarauhashormoni, nomegestroliasetaatti on luonnollisen progesteronin hyvin selektiivinen johdannainen. Monofaasinen annostelu Zoely-valmisteyhteenveto
25 Zoelyn käyttö Pakkaus sisältää 28 tablettia: 24 vaikuttavaa ainetta sisältävää valkoista tablettia 4 keltaista lumetablettia Aloita tablettilaatan vasemmasta yläreunasta (tabletti nro 1), valkoisesta tabletista. Valitse viikonpäivätarroista se, joka alkaa sinä päivänä jona aloitat tablettien käytön. Liimaa se kohtaan kiinnitä viikonpäivätarra tähän. Ota tabletti joka päivä suunnilleen samaan aikaan. Zoely-valmisteyhteenveto
26 Zoelyn käytön aloitus Edellinen ehkäisymenetelmä Aloitusajankohta Tarvitaanko lisäehkäisynä estemenetelmää (esim. kondomia) Ei hormonaalista ehkäisyä Kuukautiskierron 1. päivä (eli ensimmäinen vuotopäivä) Ei Vaihto yhdistelmähormoniehkäisyvalmisteesta (ehkäisytabletti, ehkäisylaastari, ehkäisyrengas) Vaihto pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (minipilleri, injektio, implantaatti tai hormonikierukka) Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen (Kts. Käyttö imetyksen aikana) Seuraavana päivänä, kun olet ottanut vaikuttavaa ainetta sisältävän viimeisen tabletin tai poistanut renkaan/laastarin. Tai viimeistään tavanomaisen tablettitauon, lumetabletti-, laastari- tai rengastauon päättymistä seuraavana päivänä. Minipilleri milloin tahansa Injektio, implantaatti tai hormonikierukka Kun olisi määrä saada seuraava injektio tai kierukan/ implantaatin poistopäivänä Heti vuorokauden kuluttua Käytön aloittaminen myöhemmin Ei Ei Kyllä, ensimmäisen kierron 7 ensimmäisen tabletin käyttöpäivän ajan Ei Ei Kyllä, ensimmäisen kierron 7 ensimmäisen tabletin käyttöpäivän ajan Zoely-valmisteyhteenveto
27 Kuukautisten siirto Zoelyllä Jätä keltaiset lumetabletit ottamatta ja aloita uusi laatta heti. Kuukautisten alkamispäivän muuttaminen Zoelyllä Lyhennä 4 päivän lumetablettijaksoa ottamalla vähemmän keltaisia tabletteja. Zoely-valmisteyhteenveto
28 Vuotoprofiili Zoelyn käyttäjillä Kuukautisten kesto keskimäärin 3-4 päivää Kuukautiset voivat jäädä tulematta, ilman että käyttäjä on raskaana; 18-32% naisista tyhjennysvuoto jäi tulematta kiertojen aikana. On epätodennäköistä, että käyttäjä on raskaana, mikäli tabletteja on käytetty ohjeen mukaan. Zoely-valmisteyhteenveto
29 Unohtuneen pillerin toimintaohjeet Missä kohtaa Toiminta Tarvitaanko lisäehkäisynä estepillerilaattaa menetelmää (esim. kondomia) Alle 12 tuntia Unohtunut tabletti otetaan heti muistettaessa ja seuraavat tabletit tavanomaiseen aikaan. Ei Yli 12 tuntia Päivät 1-7 Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka olisikin Kyllä, seuraavien 7 päivän ajan otettava 2 tablettia samalla kertaa. Seuraavat tabletit tavanomaiseen aikaan. Päivät 8-17 Päivät Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka olisikin otettava 2 tablettia samalla kertaa. Seuraavat tabletit tavanomaiseen aikaan. - Jos tabletteja ei ole unohtunut edellisten 7 päivän aikana Ei - Jos tabletteja on unohtunut edeltäneen 7 päivän aikana Kyllä Jos edeltäneen 7 päivän aikana tabletit muistettu: Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka olisikin otettava 2 tablettia samalla kertaa. Seuraavat tabletit tavanomaiseen aikaan. Viimeisen tablettirivin neljä keltaista tablettia hävitetään ja jatketaan suoraan uudella pillerilaatalla. Vaikuttavia aineita sisältävien pillereiden ottaminen lopetetaan ja siirrytään ottamaan viimeisen rivin keltaiset tabletit 4 päivän ajan (mukaan lasketaan päivät, jolloin tabletti on unohtunut ottaa). Tämän jälkeen aloitetaan uusi pillerilaatta. Jos edeltäneen 7 päivän aikana tabletteja ei ole muistettu ottaa: Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka olisikin otettava 2 tablettia samalla kertaa. Seuraavat tabletit tavanomaiseen aikaan. Viimeisen tablettirivin neljä keltaista tablettia hävitetään ja jatketaan suoraan uudella pillerilaatalla. Ei Ei Kyllä, seuraavien 7 päivän ajan Zoely-valmisteyhteenveto
30 NUVARING Vaikuttavat aineet ja niiden määrät: Etonogestreeli 11,7 mg. Etinyyliestradioli 2,7 mg. Emätinrenkaasta vapautuu keskimäärin 0,120 mg etonogestreelia ja 0,015 mg etinyyliestradiolia vuorokaudessa 3 viikon ajan. Käyttöaiheet: Raskauden ehkäisy. Annostus ja antotapa: Nainen voi itse asettaa NuvaRing-renkaan emättimeen. Lääkärin tulee neuvoa potilaalle valmisteen asetus ja poisto. NuvaRingin tarkalla sijainnilla emättimessä ei ole merkitystä ehkäisytehon kannalta. Kun NuvaRing on asetettu paikalleen, se jätetään emättimeen yhtäjaksoisesti kolmeksi viikoksi. NuvaRing on poistettava 3 viikon käytön jälkeen samana viikonpäivänä kuin se asetettiin. Viikon tauon jälkeen asetetaan uusi rengas. Tyhjennysvuoto alkaa yleensä 2 3 päivän kuluttua NuvaRingin poistamisesta ja saattaa jatkua vielä kun on aika asettaa uusi rengas. Muut tiedot ks. valmisteyhteenveto. Vasta-aiheet: Laskimotromboosi tai laskimotromboosianamneesi, johon on tai ei ole liittynyt keuhkoemboliaa. Valtimo tromboosi tai valtimotromboosianamneesi (esim. aivoverisuonitapahtuma, sydäninfarkti) tai tromboosin ennakko-oire (esim. angina pectoris tai TIA-kohtaus). Tunnettu taipumus laskimo- tai valtimotromboosille, johon liittyy tai ei liity peritty alttius kuten aktivoidun proteiini C:n (APC)-resistenssi, antitrombiini III:n puutos, proteiini C:n puutos, proteiini S:n puutos, hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiini vasta-aineet, lupus antikoagulantti). Migreeni, johon on liittynyt fokaalisia neurologisia oireita. Diabetes mellitus, johon liittyy verisuonikomplikaatioita. Myös huomattavat tai useat laskimo- tai valtimotromboosien riskitekijät voivat olla käytön vasta-aiheita (ks. valmisteyhteenveto Varoitukset ja käyttöön liittyvät varotoimet). Haimatulehdus tai aikaisempi haimatulehdus, jos siihen liittyi vakava hypertriglyseridemia. Vaikea maksasairaus, nykyinen tai aiemmin ilmennyt, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi. Nykyinen tai aiemmin ilmennyt hyvän- tai pahanlaatuinen maksakasvain. Todetut tai oletetut sukupuolielinten tai rintojen maligniteetit, joihin sukupuolihormonit vaikuttavat. Vaginaverenvuoto, jonka syytä ei ole selvitetty. Yliherkkyys vaikuttaville aineille tai jollekin NuvaRingin apuaineelle. Varoitukset ja käyttöön liittyvät varotoimet: NuvaRingin käytöstä aiheutuvaa hyötyä on punnittava siitä mahdollisesti koituvia haittoja vasten erikseen kussakin tapauksessa, ja käyttäjän kanssa on keskusteltava asiasta ennen kuin hän päättää käytön aloittamisesta. Ks. valmisteyhteenveto. Jos jokin näistä sairauksista tai riskitekijöistä ilmaantuu ensimmäistä kertaa tai pahenee, käyttäjän on otettava yhteys lääkäriin. Lääkärin tulee tällöin päättää käytön mahdollisesta keskeyttämisestä. Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset: Ks. valmisteyhteenveto. Raskaus ja imetys: NuvaRing ei ole tarkoitettu käytettäväksi raskauden aikana. Jos raskaus havaitaan NuvaRing-renkaan käytön aikana, tulee rengas poistaa. Estrogeenit voivat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi NuvaRing-rengasta tulisi yleisen suosituksen mukaisesti käyttää vasta, kun lapsi on vieroitettu rintamaidosta. Pieniä määriä kontraseptiivisiä steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon, mutta tämän haitallisuudesta lapsen terveydelle ei ole näyttöä. Haittavaikutukset: Yleisimpiä (Yleiset 1/100, 1/10) haittavaikutuksia ovat emätintulehdus, masennus, libidon heikkeneminen, päänsärky, migreeni, vatsakivut, pahoinvointi, akne, rintojen arkuus, sukupuolielinten kutina naisella, kuukautiskivut, lantion kipu, valkovuoto, painonnousu, renkaan ekspulsio, lääkinnällisen laitteen aiheuttama epämukavuus. Muut haittavaikutukset, ks. valmisteyhteenveto. Pakkaukset ja valmisteen kuvaus: NuvaRing on pakattu pahvikoteloon, joka sisältää 1 tai 3 yksittäispakattua rengasta. Säilytys: Apteekista toimittamisen jälkeen: 4 kk, säilytä alle 30º C:ssa. Säilytä alkuperäispakkauksessa. Hinnat ja hoitokustannukset (VOH+alv 09/2012): 1 x ehkäisyrengas 15,64 ja 3 x ehkäisyrengas 43,83 (14,61 /kk). Korvattavuus: Ei sv-korvattava. Tutustu NuvaRing-valmisteyhteenvetoon ennen lääkkeen määräämistä, Lisätietoja: Valmisteyhteenveto (tekstin muuttamispäivämäärä ), Pharmaca Fennica tai MSD, Keilaranta 3, Espoo, puh. (09) , NEXPLANON Vaikuttavat aineet ja niiden määrät: NEXPLANON on säteilyä läpäisemätön, biologisesti hajoamaton, pelkästään progestiinia sisältävä taipuisa implantaatti, joka on pakattu steriiliin kertakäyttöiseen asettimeen. Yksi säteilyä läpäisemätön implantaatti sisältää 68 mg etonogestreelia, jonka vapautumisnopeus on noin mikrog/vrk 5 6 ensimmäisen käyttöviikon ajan ja hidastuu siten, että se on ensimmäisen vuoden lopussa noin mikrog/vrk, toisen vuoden lopussa noin mikrog/vrk ja kolmannen vuoden lopussa noin mikrog/vrk. Asetin on tarkoitettu käytettäväksi yhdellä kädellä ja se on suunniteltu helpottamaan implantaatin asettamista oikein ihon alle. Lääkemuoto: Implantaatti ihon alle. Säteilyä läpäisemätön, biologisesti hajoamaton, valkoinen tai melkein valkoinen, pehmeä, joustava sauva, jonka pituus on 4 cm ja läpimitta 2 mm. Käyttöaiheet: Raskauden ehkäisy. Annostus ja antotapa: Raskauden mahdollisuus on suljettava pois ennen NEXPLANONin asettamista. Ennen implantaatin asettamista lue huolellisesti implantaatin asettamista ja poistamista koskevat ohjeet valmisteyhteenvedon kohdista NEXPLANONin asettaminen ja NEXPLANONin poistaminen ja noudata näitä ohjeita. Miten NEXPLANONia käytetään: NEXPLANON on pitkävaikutteinen hormonaalinen ehkäisyväline. Ihon alle asetetaan yksi implantaatti, joka voi olla paikoillaan kolmen vuoden ajan. Implantaatti poistetaan viimeistään kolmen vuoden kuluttua sen asettamisesta. Painavammilla naisilla lääkäri voi harkita implantaatin vaihtamista uuteen aikaisemmin (ks. Valmisteyhteenveto kohta Varoitukset ). Jos heti implantaatin poiston jälkeen asetetaan uusi implantaatti, ehkäisysuoja jatkuu. Jos nainen ei halua jatkaa NEXPLANONin käyttöä, mutta haluaa ehkäisysuojan jatkuvan, hänelle on suositeltava toista ehkäisymenetelmää. NEXPLANON-implantaatti asetetaan aivan ihon alle olkavarren sisäpuolelle varoen syvemmällä sidekudoksessa kolmipäisen olkalihaksen ja hauislihaksen välissä sijaitsevia suuria verisuonia ja hermoja. Implantaatin sijainti on varmistettava palpoimalla välittömästi sen asettamisen jälkeen. Jos implantaatti ei ole palpoitavissa tai sen paikallaan olo on epävarmaa, asia tulee varmistaa muilla menetelmillä (ks. Valmisteyhteenveto kohta NEXPLANONIN asettaminen ). Naista on kehotettava käyttämään lisäksi muuta kuin hormonaalista ehkäisyä, kunnes on varmistettu, että implantaatti on asetettu oikein. NEXPLANON-pakkaus sisältää potilaalle annettavan kortin, johon merkitään implantaatin eränumero. Terveydenhuollon ammattilaisen on kirjattava korttiin implantaatin asettamispäivämäärä, kumpaan käteen implantaatti asetettiin sekä implantaatin suunniteltu poistopäivämäärä. Pakkaus sisältää myös terveydenhuollon ammattilaisten potilasarkistoja varten tarraetikettejä, joihin on painettu implantaatin eränumero. Vasta-aiheet: Aktiivinen laskimopuolen tromboembolinen häiriö. Todetut tai epäillyt maligniteetit, joihin sukupuolihormonit vaikuttavat. Parhaillaan esiintyvä tai aiemmin esiintynyt maksakasvain (hyvän- tai pahanlaatuinen). Maksasairaus, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi. Verinen emätinvuoto, jonka syytä ei ole selvitetty. Yiherkkyys NEXPLANONin vaikuttavalle aineelle tai jollekin apuaineelle. Varoitukset ja käyttöön liittyvät varotoimet: Progestiinin käytön etuja on verrattava mahdollisiin riskeihin tapauskohtaisesti ja niistä on keskusteltava käyttäjän kanssa ennen kuin hän tekee päätöksen NEXPLANONin käytöstä (ks. valmisteyhteenveto: Varoitukset ja käyttöön liittyvät varotoimet). Käyttäjää on neuvottava ottamaan yhteyttä lääkäriin, jos jokin valmisteyhteenvedon kohdassa Varoitukset ja käyttöön liittyvät varotoimet mainituista tiloista tai riskitekijöistä pahenee, uusiutuu tai jos uusia oireita ilmenee. Tällöin lääkäri päättää, lopetetaanko NEXPLANONin käyttö. Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset: Ks. valmisteyhteenveto. Raskaus ja imetys: NEXPLANONia ei ole tarkoitettu käytettäväksi raskauden aikana. Jos nainen tulee raskaaksi NEXPLANONin käytön aikana, implantaatti pitää poistaa. Kliiniset tiedot viittaavat siihen, että NEXPLANON ei vaikuta rintamaidon tuotantoon tai maidon laatuun (proteiini-, laktoosi- tai rasvapitoisuuksiin). Saatavilla olevan tiedon perusteella NEXPLANONia voidaan käyttää imetyksen aikana ja se tulisi asettaa, kun synnytyksestä on kulunut neljä viikkoa. Tästä huolimatta lapsen kehitystä ja kasvua pitää seurata tarkoin. Haittavaikutukset: Hyvin yleisiä (>1/10) NEXPLANONin kliinisissä tutkimuksissa raportoituja haittavaikutuksia, jotka mahdollisesti liittyvät NEXPLANONin käyttöön ovat: emätintulehdus, päänsärky, akne, rintojen aristus ja kipu, kuukautisten epäsäännöllisyys ja painon nousu sekä yleisiä (<1/10, 1/100) lisääntynyt ruokahalu, mielialan labiliteetti, masentunut mieliala, hermostuneisuus, libidon heikentyminen, heitehuimaus, kuumat aallot, vatsakipu, pahoinvointi, ilmavaivat, alopesia, dysmenorrea, munasarjakystat, kipu asetuskohdassa, asetuskohdan reaktiot, väsymys, influenssan kaltainen sairaus, kipu ja painon lasku. Muut haittavaikutukset, ks. valmisteyhteenveto. Säilytys: NEXPLANON ei vaadi erityisiä säilytysolosuhteita. Pakkaukset ja valmisteen kuvaus: Pakkaus sisältää yhden säteilyä läpäisemättömän, biologisesti hajoamattoman, pelkästään progestiinia sisältävän taipuisan implantaatin (pituus 4 cm, läpimitta 2 mm), joka on pakattu ruostumattomasta teräksestä valmistettuun neulaan kertakäyttöisessä, steriilissä, käyttövalmiisssa asettimessa. Vahingoittumattoman ja avaamattoman läpipainopakkauksen sisältö on steriili. Hinta ja hoitokustannus (VOH+alv 09/2012): 1 implantaatti asettimella 187,63 (5,21 /kk). Korvattavuus: Ei SV-korvattava. Tutustu NEXPLANONin valmisteyhteenvetoon ennen implantaatin asettamista, Lisätiedot: Valmisteyhteenveto (tekstin muuttamispäivämäärä ) tai MSD, Keilaranta 3, Espoo, puh. (09) MSD, Keilaranta 3, Espoo puh. (09) faksi (09)
31 ZOELY Vaikuttavat aineet ja niiden määrät: Valkoiset, vaikuttavia aineita sisältävät kalvopäällysteiset tabletit: yksi kalvopäällysteinen tabletti sisältää 2,5 mg nomegestroliasetaattia ja 1,5 mg estradiolia (hemihydraattina). Keltaiset kalvopäällysteiset lumetabletit: tabletti ei sisällä vaikuttavia aineita. Käyttöaiheet: Raskauden ehkäisy. Annostus ja antotapa: Tabletteja otetaan yksi päivässä 28 peräkkäisen päivän ajan. Jokaisen läpipainopakkauksen alussa on 24 valkoista, vaikuttavia aineita sisältävää tablettia ja niiden jälkeen 4 keltaista lumetablettia. Seuraava läpipainopakkaus aloitetaan välittömästi edellisen loputtua ilman, että tablettien päivittäisen ottamisen väliin jää taukoa ja huolimatta mahdollisesta tyhjennysvuodon esiintymisestä. Tyhjennysvuoto alkaa yleensä 2 3 päivän kuluttua viimeisen valkoisen tabletin ottamisesta ja saattaa jatkua vielä seuraavan pakkauksen aloittamisajankohtana. muut tiedot ks. valmisteyhteenveto. Vasta-aiheet: Yliherkkyys vaikuttaville aineille tai apuaineille, nykyinen tai aiemmin ilmennyt laskimotromboosi (syvä laskimotromboosi, keuhkoembolia), nykyinen tai aiemmin ilmennyt valtimotromboosi (esim. sydäninfarkti) tai sitä ennakoivat tilat (esim. TIA, angina pectoris), nykyinen tai aiemmin ilmennyt aivoverisuonitapahtuma, aiemmin ilmennyt migreenipäänsärky, johon on liittynyt fokaalisia neurologisia oireita, vaikeat tai useat laskimo- tai valtimotromboosien riskitekijät (ks. valmisteyhteenveto Varoitukset ja käyttöön liittyvät varotoimet), kuten: diabetes mellitus, johon liittyy verisuonioireita; vaikea hypertensio; vaikea dyslipoproteinemia, perinnöllinen tai hankittu laskimo- tai valtimotromboosialttius, kuten resistenssi aktivoidulle proteiini C:lle (APC-resistenssi), antitrombiini III:n puutos, proteiini C:n puutos, proteiini S:n puutos, hyperhomokysteinemia ja antifosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti), nykyinen tai aiemmin ilmennyt haimatulehdus, jos siihen liittyy/liittyi vaikea hypertriglyseridemia, nykyinen tai aiemmin ilmennyt vaikea maksasairaus, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi, nykyinen tai aiemmin ilmennyt hyvän- tai pahanlaatuinen maksakasvain, todetut tai epäillyt sukupuolihormoniriippuvaiset maligniteetit (esim. sukupuolielinten tai rintojen), diagnosoimaton verenvuoto emättimestä. Varoitukset ja käyttöön liittyvät varotoimet: ZOELY-valmisteen käytöstä aiheutuvaa hyötyä on arvioitava siitä mahdollisesti koituvia haittoja vasten jokaisen käyttäjän kohdalla erikseen, ja käyttäjän kanssa on keskusteltava asiasta ennen kuin hän päättää ZOELY-valmisteen käytön aloittamisesta. Ks. valmisteyhteenveto. Jos jokin näistä sairauksista tai riskitekijöistä pahenee tai ilmenee ensimmäistä kertaa käytön aikana, käyttäjän on otettava yhteys lääkäriin. Lääkärin täytyy tällöin päättää ZOELY-valmisteen käytön mahdollisesta keskeyttämisestä. Seuraavassa esitetyt epidemiologiset tiedot perustuvat etinyyliestra- diolia sisältävistä yhdistelmäehkäisytableteista saatuihin tietoihin. ZOELY-valmiste sisältää 17 estradiolia. Koska estradiolia sisältävistä yhdistelmäehkäisytableteista ei vielä ole epidemiologista tietoa saatavilla, varoitusten voidaan katsoa koskevan myös ZOELYvalmistetta. Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset: Ks. valmisteyhteenveto. Fertiliteetti, raskaus ja imetys: ZOELY-valmistetta ei ole tarkoitettu käytettäväksi raskauden aikana. Jos nainen tulee raskaaksi ZOELY-tablettien käytön aikana, on tablettien käyttö lopetettava. Useimpien epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski ei ole suurentunut ennen raskautta etinyyliestradiolia sisältäviä yhdistelmäehkäisytabletteja käyttäneiden naisten vauvoilla, eikä teratogeenisten vaikutusten riski silloin, kun etinyyliestradiolia sisältäviä yhdistelmäehkäisytabletteja on käytetty tahattomasti raskauden varhaisvaiheessa. Rintamaitoon saattaa erittyä pieniä määriä ehkäisyyn käytettäviä steroideja ja/tai niiden metaboliitteja, mutta niiden haitallisista vaikutuksista imeväisikäisen terveyteen ei ole näyttöä. Yhdistelmäehkäisytabletit voivat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi yhdistelmäehkäisytabletteja suositellaan käytettäväksi vasta, kun lapsi on vieroitettu rintamaidosta, ja jos nainen haluaa imettää, hänelle on ehdotettava toisen ehkäisymenetelmän käyttöä. ZOELY on tarkoitettu raskauden ehkäisyyn. Tietoa hedelmällisyyden palautumisesta, ks. valmisteyhteenveto. Haittavaikutukset: Hyvin yleisiä ( 1/10) haittavaikutuksia ovat akne ja poikkeava tyhjennysvuoto, yleisiä ( 1/100 < 1/10) haittavaikutuksia ovat libidon heikkeneminen, masennus/alakuloisuus, mielialan vaihtelu, päänsärky, migreeni, pahoinvointi, metrorragia, menorragia, kipu rinnoissa, lantiokipu, painon nousu. Muut haittavaikutukset ks. valmisteyhteenveto. Pakkaustyyppi ja pakkauskoot: PVC-/alumiiniläpipainopakkaus, jossa 28 kalvopäällysteistä tablettia (24 valkoista kalvopäällysteistä tablettia ja 4 keltaista kalvopäällysteistä tablettia). Pakkauskoot: 28 ja 84 (3 x28) kalvopäällysteistä tablettia. Säilytys: Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita. Hinnat ja hoitokustannukset (VOH+alv 09/2012): 1 x 28 tablettia 14,15, 3 x 28 tablettia 38,93 (12,98 /kk). Korvattavuus: Ei sv-korvattava. Tutustu ZOELY-valmisteyhteenvetoon ennen lääkkeen määräämistä, Lisätietoja: Valmisteyhteenveto (tekstin muuttamispäivämäärä ), Pharmaca Fennica tai MSD, Keilaranta 3, Espoo, puh. (09) , MSD, Keilaranta 3, Espoo puh. (09) faksi (09) Copyright 2012 Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., Whitehouse Station, NJ, USA. All rights reserved WOMN
ZOELY -käyttäjäopas. nomegestroliasetaatti estradioli 2,5 mg/1,5 mg kalvopäällysteisiä tabletteja
 ZOELY -käyttäjäopas nomegestroliasetaatti estradioli 2,5 mg/1,5 mg kalvopäällysteisiä tabletteja SISÄLLYS Tietoja ZOELY-valmisteesta... 2 Miten ZOELY toimii?... 3 ZOELY on tehty sinua varten... 4 5 Lisätietoja
ZOELY -käyttäjäopas nomegestroliasetaatti estradioli 2,5 mg/1,5 mg kalvopäällysteisiä tabletteja SISÄLLYS Tietoja ZOELY-valmisteesta... 2 Miten ZOELY toimii?... 3 ZOELY on tehty sinua varten... 4 5 Lisätietoja
Ehkäisymenetelmät PP-PF--WHC-FI /
 Ehkäisymenetelmät Ehkäisyn aloitus & valinta Mikäli raskaus ei ole ajankohtainen toive ja seksistä haluaa nauttia huoletta, on syytä huolehtia luotettavasta raskauden ehkäisystä Keskustele terveydenhoitajan
Ehkäisymenetelmät Ehkäisyn aloitus & valinta Mikäli raskaus ei ole ajankohtainen toive ja seksistä haluaa nauttia huoletta, on syytä huolehtia luotettavasta raskauden ehkäisystä Keskustele terveydenhoitajan
Raskauden ehkäisy. Jokaisella on oikeus raskauden ehkäisyyn. Siihen on monta keinoa eli menetelmää.
 Raskauden ehkäisy Jokaisella on oikeus raskauden ehkäisyyn. Siihen on monta keinoa eli menetelmää. Jokaisella on oikeus saada oikeaa tietoa ja neuvontaa raskauden ehkäisyn keinoista sekä niiden hyödyistä,
Raskauden ehkäisy Jokaisella on oikeus raskauden ehkäisyyn. Siihen on monta keinoa eli menetelmää. Jokaisella on oikeus saada oikeaa tietoa ja neuvontaa raskauden ehkäisyn keinoista sekä niiden hyödyistä,
Naisella on vapaus valita SINULLE SOPIVIN EHKÄISY
 Naisella on vapaus valita SINULLE SOPIVIN EHKÄISY Jos lasten hankinta ei ole ajankohtaista, on ehkäisyä käytettävä yhdyntöjen aloittamisesta vaihdevuosiin saakka. Niin hormonaalisia kuin muitakin ehkäisyvaihtoehtoja
Naisella on vapaus valita SINULLE SOPIVIN EHKÄISY Jos lasten hankinta ei ole ajankohtaista, on ehkäisyä käytettävä yhdyntöjen aloittamisesta vaihdevuosiin saakka. Niin hormonaalisia kuin muitakin ehkäisyvaihtoehtoja
Nuoren naisen ehkäisymenetelmät L.FI.MKT.11.2015.3751
 Nuoren naisen ehkäisymenetelmät Pitkäaikaiset ehkäisymenetelmät Hormonikierukka 3 v ja 5 v Pitkäaikainen ehkäisy (pienempi 3 vuotta, isompi 5 vuotta) Sisältää paikallisesti vapautuvaa keltarauhashormonia
Nuoren naisen ehkäisymenetelmät Pitkäaikaiset ehkäisymenetelmät Hormonikierukka 3 v ja 5 v Pitkäaikainen ehkäisy (pienempi 3 vuotta, isompi 5 vuotta) Sisältää paikallisesti vapautuvaa keltarauhashormonia
EHKÄISYOPAS. www.ehkaisy.com TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ. www.ehkaisy.com
 EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden paikkeilla ja mies noin vuotta myöhemmin.
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden paikkeilla ja mies noin vuotta myöhemmin.
Asiaa ehkäisystä. Hormonaalinen ehkäisy. Gynekologian alueellinen koulutuspäivä Sonja Eronen. Yhdistelmäehkäisy (progestiini + estrogeeni)
 Asiaa ehkäisystä Gynekologian alueellinen koulutuspäivä 27.10.2017 Sonja Eronen Hormonaalinen ehkäisy Yhdistelmäehkäisy (progestiini + estrogeeni) Pilleri, laastari ja rengas Progestiiniehkäisy Pilleri,
Asiaa ehkäisystä Gynekologian alueellinen koulutuspäivä 27.10.2017 Sonja Eronen Hormonaalinen ehkäisy Yhdistelmäehkäisy (progestiini + estrogeeni) Pilleri, laastari ja rengas Progestiiniehkäisy Pilleri,
Käyttäjän opas 1 mirena_kayttajanopas_fin_2018.indd 1 25/09/
 Käyttäjän opas 1 SISÄLTÖ Onneksi olkoon! Olet yhdessä lääkärisi tai hoitajasi kanssa valinnut sinulle Mirena-kierukan raskauden ehkäisyyn. Toivotamme sinulle onnellista ja tyydyttävää seksielämää ilman
Käyttäjän opas 1 SISÄLTÖ Onneksi olkoon! Olet yhdessä lääkärisi tai hoitajasi kanssa valinnut sinulle Mirena-kierukan raskauden ehkäisyyn. Toivotamme sinulle onnellista ja tyydyttävää seksielämää ilman
Raskauden ehkäisy synnytyksen jälkeen Katja Hämeenoja, ylilääkäri Lapin keskussairaala
 Raskauden ehkäisy synnytyksen jälkeen 3.5.2017 Katja Hämeenoja, ylilääkäri Lapin keskussairaala Miksi tärkeä asia? Vuonna 2015 Suomessa tehtiin 9441 raskaudenkeskeytystä, mikä on pienin määrä vuonna 1970
Raskauden ehkäisy synnytyksen jälkeen 3.5.2017 Katja Hämeenoja, ylilääkäri Lapin keskussairaala Miksi tärkeä asia? Vuonna 2015 Suomessa tehtiin 9441 raskaudenkeskeytystä, mikä on pienin määrä vuonna 1970
NuvaRing. N.V. Organon. 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
JADELLE. JADELLE -valmisteen seuranta
 Käyttäjän opas JADELLE Olet valinnut ehkäisymenetelmäksesi JADELLE -ehkäisykapselit. Lue huolellisesti tämä vihkonen niin saat vastauksen useimpiin kysymyksiisi, jotka koskevat JADELLE -valmistetta. Tärkeää
Käyttäjän opas JADELLE Olet valinnut ehkäisymenetelmäksesi JADELLE -ehkäisykapselit. Lue huolellisesti tämä vihkonen niin saat vastauksen useimpiin kysymyksiisi, jotka koskevat JADELLE -valmistetta. Tärkeää
Tutustu myös Jaydess -mobiilipalveluun: potilaspalvelu.ehkaisynetti.fi. > Katso video Jaydess-kierukan käytöstä tai kysy lisää asiantuntijalta.
 Käyttäjän opas 1 SISÄLTÖ Onneksi olkoon! Olet yhdessä lääkärisi tai hoitajasi kanssa valinnut sinulle Jaydess-kierukan raskauden ehkäisyyn. Toivotamme sinulle onnellista ja tyydyttävää seksielämää ilman
Käyttäjän opas 1 SISÄLTÖ Onneksi olkoon! Olet yhdessä lääkärisi tai hoitajasi kanssa valinnut sinulle Jaydess-kierukan raskauden ehkäisyyn. Toivotamme sinulle onnellista ja tyydyttävää seksielämää ilman
EHKÄISYOPAS. TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.ehkaisy.com
 EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.ehkaisy.com 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden paikkeilla ja mies noin
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.ehkaisy.com 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden paikkeilla ja mies noin
Liite III. Valmisteyhteenvetojen ja pakkausselosteiden muutokset
 Liite III Valmisteyhteenvetojen ja pakkausselosteiden muutokset 39 VALMISTEYHTEENVETO 40 Kohta 4.1 Käyttöaiheet [Tällä hetkellä hyväksytyt käyttöaiheet poistetaan ja korvataan seuraavasti:] Keskivaikean
Liite III Valmisteyhteenvetojen ja pakkausselosteiden muutokset 39 VALMISTEYHTEENVETO 40 Kohta 4.1 Käyttöaiheet [Tällä hetkellä hyväksytyt käyttöaiheet poistetaan ja korvataan seuraavasti:] Keskivaikean
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ. www.parempaaelamaa.fi 1. www.parempaaelamaa.fi
 EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.parempaaelamaa.fi www.parempaaelamaa.fi 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.parempaaelamaa.fi www.parempaaelamaa.fi 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ. www.parempaaelamaa.fi 1. www.parempaaelamaa.fi
 EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.parempaaelamaa.fi www.parempaaelamaa.fi 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.parempaaelamaa.fi www.parempaaelamaa.fi 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ. www.parempaaelamaa.fi 1. www.parempaaelamaa.fi
 EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.parempaaelamaa.fi www.parempaaelamaa.fi 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ www.parempaaelamaa.fi www.parempaaelamaa.fi 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden
Nuorten raskauden ehkäisy. Miila Halonen asiantuntijalääkäri Väestöliitto
 Nuorten raskauden ehkäisy Miila Halonen asiantuntijalääkäri Väestöliitto Tässä puheenvuorossa Ehkäisytarve nuoruusiässä UKMEC kriteeristö (kategoriat ja tulkinta) Ehkäisyn aloittamiskäytännöistä Nuoruusikä,
Nuorten raskauden ehkäisy Miila Halonen asiantuntijalääkäri Väestöliitto Tässä puheenvuorossa Ehkäisytarve nuoruusiässä UKMEC kriteeristö (kategoriat ja tulkinta) Ehkäisyn aloittamiskäytännöistä Nuoruusikä,
EHKÄISYOPAS. TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ.
 EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden paikkeilla ja mies noin vuotta myöhemmin.
EHKÄISYOPAS TIETOA RASKAUDEN EHKÄISYMENETELMISTÄ 1 RASKAUDEN EHKÄISY ON TÄRKEÄ OSA NAISEN ELÄMÄÄ Nainen tulee normaalisti sukukypsäksi keskimäärin 12 13 ikävuoden paikkeilla ja mies noin vuotta myöhemmin.
PAKKAUSSELOSTE NUVARING
 PAKKAUSSELOSTE NUVARING Lue tämä pakkausseloste huolellisesti, ennen kuin alat käyttää NuvaRingemätinrengasta. Pakkausseloste sisältää tietoa, jonka avulla sinun on helpompi käyttää emätinrengasta turvallisesti
PAKKAUSSELOSTE NUVARING Lue tämä pakkausseloste huolellisesti, ennen kuin alat käyttää NuvaRingemätinrengasta. Pakkausseloste sisältää tietoa, jonka avulla sinun on helpompi käyttää emätinrengasta turvallisesti
Potilaan opas. Acitretin Orifarm 10 mg ja 25 mg. Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma. (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Evran luonnollinen koko
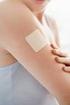 mielenrauhaa Evran luonnollinen koko Evra uudenlainen ehkäisyvalmiste Esitteestä lukemasi tiedon tarkoitus oli vastata yleisimmin kysyttyihin käytännön kysymyksiin Evrasta. Jos haluat lisää tietoa, käänny
mielenrauhaa Evran luonnollinen koko Evra uudenlainen ehkäisyvalmiste Esitteestä lukemasi tiedon tarkoitus oli vastata yleisimmin kysyttyihin käytännön kysymyksiin Evrasta. Jos haluat lisää tietoa, käänny
Laskimotukos on kaikkien yhdistelmäehkäisytablettien. Laskimotukos on yhdistelmäehkäisytablettien HARVINAINEN HAITTA
 MARJA-LEENA NURMINEN LT, dosentti Ylilääkäri, Fimea Laskimotukos on yhdistelmäehkäisytablettien HARVINAINEN HAITTA Laskimotukos voi liittyä harvinaisena haittana kaikkien yhdistelmäehkäisytablettien käyttöön.
MARJA-LEENA NURMINEN LT, dosentti Ylilääkäri, Fimea Laskimotukos on yhdistelmäehkäisytablettien HARVINAINEN HAITTA Laskimotukos voi liittyä harvinaisena haittana kaikkien yhdistelmäehkäisytablettien käyttöön.
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
Avuksi ehkäisyn valintaan
 Opas synnytyksen jälkeiseen ja imetyksen aikaiseen raskauden ehkäisyyn Avuksi ehkäisyn valintaan Veera Korhonen & Reeta Minkkinen Sisällysluettelo Tietoa naisen hedelmällisyydestä... 1 Kehon palautuminen
Opas synnytyksen jälkeiseen ja imetyksen aikaiseen raskauden ehkäisyyn Avuksi ehkäisyn valintaan Veera Korhonen & Reeta Minkkinen Sisällysluettelo Tietoa naisen hedelmällisyydestä... 1 Kehon palautuminen
Valmistaudu vaihdevuosiin. 24.3.2011 Teija Alanko Gynekologi
 Valmistaudu vaihdevuosiin 24.3.2011 Teija Alanko Gynekologi Menopaussi keskimäärin 45-58 v, keski-ikä 51v. aiemmin jos munasarjat poistettu, säde- tai solusalpaajahoidon jälkeen tupakointi varhentaa 1-2
Valmistaudu vaihdevuosiin 24.3.2011 Teija Alanko Gynekologi Menopaussi keskimäärin 45-58 v, keski-ikä 51v. aiemmin jos munasarjat poistettu, säde- tai solusalpaajahoidon jälkeen tupakointi varhentaa 1-2
SINULLE, JOKA TARVITSET PAIKALLISTA ESTROGEENIHOITOA.
 SINULLE, JOKA TARVITSET PAIKALLISTA ESTROGEENIHOITOA. POTILASTIEDOTE 1 2 SISÄLLYS Vähentynyt estrogeenituotanto ja sukupuolielinten vaivat... 4 Oestring-hoito... 5 Kenelle Oestring sopii?... 7 Onko Oestringillä
SINULLE, JOKA TARVITSET PAIKALLISTA ESTROGEENIHOITOA. POTILASTIEDOTE 1 2 SISÄLLYS Vähentynyt estrogeenituotanto ja sukupuolielinten vaivat... 4 Oestring-hoito... 5 Kenelle Oestring sopii?... 7 Onko Oestringillä
RASKAUDEN EHKÄISY SYNNYTYKSEN JÄLKEEN
 RASKAUDEN EHKÄISY SYNNYTYKSEN JÄLKEEN Anneli Kivijärvi LKT, naistentautien ja synnytysten erikoislääkäri, vastaava lääkäri Turun Hyvinvointitoimiala 11.05.2016 Turku, Yleislääkäripäivät Mitkä asiat otetaan
RASKAUDEN EHKÄISY SYNNYTYKSEN JÄLKEEN Anneli Kivijärvi LKT, naistentautien ja synnytysten erikoislääkäri, vastaava lääkäri Turun Hyvinvointitoimiala 11.05.2016 Turku, Yleislääkäripäivät Mitkä asiat otetaan
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 JAYDESS 13,5 mg, kohdunsisäinen ehkäisin 5/2014 versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
JAYDESS 13,5 mg, kohdunsisäinen ehkäisin 5/2014 versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Zoely 2,5 mg/1,5 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Valkoiset, vaikuttavia aineita sisältävät kalvopäällysteiset
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Zoely 2,5 mg/1,5 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Valkoiset, vaikuttavia aineita sisältävät kalvopäällysteiset
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Tarkastuslista määrättäessä asitretiinia naispotilaille
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Tarkastuslista määrättäessä asitretiinia naispotilaille (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Asitretiini on erittäin teratogeenistä ja
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Tarkastuslista määrättäessä asitretiinia naispotilaille (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Asitretiini on erittäin teratogeenistä ja
VALMISTEYHTEENVETO. Pediatriset potilaat Nexplanonin turvallisuutta ja tehoa alle 18-vuotiailla nuorilla ei ole tutkittu.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nexplanon 68 mg implantaatti, ihon alle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Nexplanon on säteilyä läpäisemätön, biologisesti hajoamaton, pelkästään progestiinia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nexplanon 68 mg implantaatti, ihon alle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Nexplanon on säteilyä läpäisemätön, biologisesti hajoamaton, pelkästään progestiinia
19.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Apuaine, jonka vaikutus tunnetaan: 53,895 mg laktoosimonohydraattia (ks. kohta 4.4).
 1. LÄÄKEVALMISTEEN NIMI Desogestrel Sandoz 75 mikrog tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreelia. Apuaine, jonka vaikutus tunnetaan:
1. LÄÄKEVALMISTEEN NIMI Desogestrel Sandoz 75 mikrog tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreelia. Apuaine, jonka vaikutus tunnetaan:
Sinulle, joka tarvitset paikallista estrogeenihoitoa.
 Sinulle, joka tarvitset paikallista estrogeenihoitoa. POTILASTIEDOTE 1 2 SISÄLLYS Vähentynyt estrogeenituotanto ja sukupuolielinten vaivat... 4 Oestring-hoito... 5 Kenelle Oestring sopii?... 7 Onko Oestringillä
Sinulle, joka tarvitset paikallista estrogeenihoitoa. POTILASTIEDOTE 1 2 SISÄLLYS Vähentynyt estrogeenituotanto ja sukupuolielinten vaivat... 4 Oestring-hoito... 5 Kenelle Oestring sopii?... 7 Onko Oestringillä
PAKKAUSSELOSTE. Vagifem 10 mikrog emätinpuikot. Estradioli
 PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
Potilasohje. Sinulle on määrätty Donaxyl (dekvaliniumkloridi) -valmistetta bakteerivaginoosin hoitoon
 Potilasohje Sinulle on määrätty Donaxyl (dekvaliniumkloridi) -valmistetta bakteerivaginoosin hoitoon Bakteerivaginoosi Epämiellyttävän hajuisen valkovuodon yleisin aiheuttaja on bakteerivaginoosi. 1 Sinulle
Potilasohje Sinulle on määrätty Donaxyl (dekvaliniumkloridi) -valmistetta bakteerivaginoosin hoitoon Bakteerivaginoosi Epämiellyttävän hajuisen valkovuodon yleisin aiheuttaja on bakteerivaginoosi. 1 Sinulle
Erivedge -valmisteen raskaudenehkäisyohjelma
 Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Tarkastuslista määrättäessä asitretiinia naispotilaille
 Tarkastuslista määrättäessä asitretiinia naispotilaille Acitretin Orifarm 10 mg:n ja 25 mg:n kovat kapselit Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Asitretiini on erittäin teratogeenistä
Tarkastuslista määrättäessä asitretiinia naispotilaille Acitretin Orifarm 10 mg:n ja 25 mg:n kovat kapselit Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Asitretiini on erittäin teratogeenistä
Osa A. Täytetään kaikkien naispotilaiden kohdalla
 Tarkastuslista määrättäessä isotretinoiinia naispotilaille: Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Raskauden ja sikiöaltistuksen ehkäisyohjelma Isotretinoiini on erittäin
Tarkastuslista määrättäessä isotretinoiinia naispotilaille: Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Raskauden ja sikiöaltistuksen ehkäisyohjelma Isotretinoiini on erittäin
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
SARAN JA TUOMAKSEN TARINA
 SARAN JA TUOMAKSEN TARINA Opettajalle Sara on 15-vuotias ja Tuomas 17. He ovat seurustelleet parisen kuukautta. He olivat olleet yhdynnässä ensimmäistä kertaa eräissä bileissä, joissa he olivat myös juoneet
SARAN JA TUOMAKSEN TARINA Opettajalle Sara on 15-vuotias ja Tuomas 17. He ovat seurustelleet parisen kuukautta. He olivat olleet yhdynnässä ensimmäistä kertaa eräissä bileissä, joissa he olivat myös juoneet
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
1. LÄÄKEVALMISTEEN NIMI. IOA 2,5 mg/1,5 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1. LÄÄKEVALMISTEEN NIMI IOA 2,5 mg/1,5 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Valkoiset, vaikuttavia aineita sisältävät kalvopäällysteiset tabletit: yksi kalvopäällysteinen
1. LÄÄKEVALMISTEEN NIMI IOA 2,5 mg/1,5 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Valkoiset, vaikuttavia aineita sisältävät kalvopäällysteiset tabletit: yksi kalvopäällysteinen
Uutta lääkkeistä: Ulipristaali
 Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Ulipristaali Annikka Kalliokoski Esmya, 5 mg tabletti, PregLem France SAS. Ulipristaaliasetaattia voidaan käyttää kohdun myoomien
Page 1 of 5 JULKAISTU NUMEROSSA 3/2012 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Ulipristaali Annikka Kalliokoski Esmya, 5 mg tabletti, PregLem France SAS. Ulipristaaliasetaattia voidaan käyttää kohdun myoomien
VALMISTEYHTEENVETO. Munuaisten vajaatoiminta Kliinisiä tutkimuksia ei ole tehty potilailla, joilla on munuaisten vajaatoimintaa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Cerazette 75 mikrog tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreelia. Apuaine(et), joiden
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Cerazette 75 mikrog tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreelia. Apuaine(et), joiden
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Orgametril 5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Orgametril 5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 5 mg lynestrenolia. Apuaineet, joiden vaikutus tunnetaan: laktoosimonohydraattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Orgametril 5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 5 mg lynestrenolia. Apuaineet, joiden vaikutus tunnetaan: laktoosimonohydraattia
Tieteelliset johtopäätökset ja perusteet
 Liite IV Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle sekä yksityiskohtainen selvitys lääketurvallisuuden riskinarviointikomitean suositukseen liittyvistä eroista Tieteelliset
Liite IV Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle sekä yksityiskohtainen selvitys lääketurvallisuuden riskinarviointikomitean suositukseen liittyvistä eroista Tieteelliset
Vagifem 10 mikrog emätinpuikko, tabletti estrogeenin puutteesta aiheutuvien paikallisten vaihdevuosioireiden hoitoon
 Vagifem 10 mikrog emätinpuikko, tabletti estrogeenin puutteesta aiheutuvien paikallisten vaihdevuosioireiden hoitoon 10µg 17ß-estradiol Tämä opas sisältää tietoa Vagifem -valmisteesta, joka on tarkoitettu
Vagifem 10 mikrog emätinpuikko, tabletti estrogeenin puutteesta aiheutuvien paikallisten vaihdevuosioireiden hoitoon 10µg 17ß-estradiol Tämä opas sisältää tietoa Vagifem -valmisteesta, joka on tarkoitettu
TIETOA MYOOMISTA JA ESMYA -HOIDOSTA
 TIETOA MYOOMISTA JA ESMYA -HOIDOSTA Olet saanut tämän esitteen lääkäriltäsi/sairaanhoitajaltasi Sisältö 3 Tietoa myoomista 6 Myoomien oireet 9 Myoomien hoito 10 Tietoa Esmyasta 13 Haittavaikutukset 14
TIETOA MYOOMISTA JA ESMYA -HOIDOSTA Olet saanut tämän esitteen lääkäriltäsi/sairaanhoitajaltasi Sisältö 3 Tietoa myoomista 6 Myoomien oireet 9 Myoomien hoito 10 Tietoa Esmyasta 13 Haittavaikutukset 14
Toctino (alitretinoiini)
 TIETOA RASKAUDEN EHKÄISYSTÄ Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-E Sisällys 1. Luuloja ja tieroa 3 2. Raskauden ehkäisy ja Toctino 4 3. Raskaustestit 6 4. Teille soveltuvat
TIETOA RASKAUDEN EHKÄISYSTÄ Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-E Sisällys 1. Luuloja ja tieroa 3 2. Raskauden ehkäisy ja Toctino 4 3. Raskaustestit 6 4. Teille soveltuvat
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3 mg laktoosimonohydraattia. Täydellinen apuaineluettelo, ks. kohta 6.
 1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
 PAKKAUSSELOSTE Gestinyl 20 mikrog/75 mikrog tabletti, päällystetty Gestinyl 30 mikrog/75 mikrog tabletti, päällystetty Etinyyliestradioli / gestodeeni Lue tämä seloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE Gestinyl 20 mikrog/75 mikrog tabletti, päällystetty Gestinyl 30 mikrog/75 mikrog tabletti, päällystetty Etinyyliestradioli / gestodeeni Lue tämä seloste huolellisesti, ennen kuin aloitat
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana
 Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
VALMISTEYHTEENVETO. Tabletti Valmisteen kuvaus: valkoinen, pyöreä tabletti, jossa ei ole merkintöjä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NorLevo 750 mikrog -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 750 mikrogrammaa levonorgestreeliä. Apuaineet: yksi tabletti sisältää
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NorLevo 750 mikrog -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 750 mikrogrammaa levonorgestreeliä. Apuaineet: yksi tabletti sisältää
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. PAUSANOL 0,1 mg/g -emätinemulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAUSANOL 0,1 mg/g -emätinemulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emätinemulsiovoidetta sisältää estriolia 0,1 mg. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAUSANOL 0,1 mg/g -emätinemulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emätinemulsiovoidetta sisältää estriolia 0,1 mg. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Desogestrel Stada 75 mikrog tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Desogestrel Stada 75 mikrog tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreeliä. Apuaine: 58,22 mg laktoosia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Desogestrel Stada 75 mikrog tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreeliä. Apuaine: 58,22 mg laktoosia
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Tarkastuslista määrättäessä isotretinoiinia naispotilaille Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Tarkastuslista
Raskauden ja sikiöaltistuksen ehkäisyohjelma Tarkastuslista määrättäessä isotretinoiinia naispotilaille Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Tarkastuslista
Erityisryhmät Munuaisten vajaatoiminta Kliinisiä tutkimuksia ei ole tehty potilailla, joilla on munuaisten vajaatoimintaa.
 1. LÄÄKEVALMISTEEN NIMI Zarelle 75 mikrogrammaa tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 75 mikrogrammaa desogestreeliä. Apuaine(et),
1. LÄÄKEVALMISTEEN NIMI Zarelle 75 mikrogrammaa tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 75 mikrogrammaa desogestreeliä. Apuaine(et),
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
RMP section VI.2 Elements for Public Summary
 RMP section VI.2 Elements for Public Summary Product: Zarelle 75 microgram filmcoated tablet RMP: Version 1.0 DLP: 28-02-2013 MAH: Stragen Nordic A/S 32 VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden
RMP section VI.2 Elements for Public Summary Product: Zarelle 75 microgram filmcoated tablet RMP: Version 1.0 DLP: 28-02-2013 MAH: Stragen Nordic A/S 32 VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Emättimen luontaisen bakteerikannan tasapainottamiseen ja ylläpitoon.
 Emättimen luontaisen bakteerikannan tasapainottamiseen ja ylläpitoon. C-vitamiini 250 mg, 6 emätinpuikkoa. Apteekista ilman reseptiä. Emättimen bakteeritasapainon häiriö Emättimen bakteeritasapainon häiriö
Emättimen luontaisen bakteerikannan tasapainottamiseen ja ylläpitoon. C-vitamiini 250 mg, 6 emätinpuikkoa. Apteekista ilman reseptiä. Emättimen bakteeritasapainon häiriö Emättimen bakteeritasapainon häiriö
Nexplanon. 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
VALMISTEYHTEENVETO. Huom. Emätinpuikko tulee työntää syvälle emättimeen, ei mielellään kuukautisten aikana.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
epalvelupolku - ehkäisypotilas
 epalvelupolku - ehkäisypotilas 1 Johdanto Tässä dokumentissa on kuvattu eppu palvelun hoidontarpeen arvioinnin testi ehkäisypotilaalle. Testiin kuuluu arviointiin liittyvät kysymykset, vastaukset ja hoidontarpeen
epalvelupolku - ehkäisypotilas 1 Johdanto Tässä dokumentissa on kuvattu eppu palvelun hoidontarpeen arvioinnin testi ehkäisypotilaalle. Testiin kuuluu arviointiin liittyvät kysymykset, vastaukset ja hoidontarpeen
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
Valkoinen tai luonnonvalkoinen, pyöreä, kaksoiskupera tabletti, jonka läpimitta on 5,4-5,8 mm. Tabletissa ei ole kohokuvioita.
 1. VALMISTEEN NIMI Gestrina 75 mikrog tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreelia. Apuaine, jonka vaikutus tunnetaan: Jokainen
1. VALMISTEEN NIMI Gestrina 75 mikrog tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 75 mikrogrammaa desogestreelia. Apuaine, jonka vaikutus tunnetaan: Jokainen
VALMISTEYHTEENVETO. NuvaRing, 0,120 mg / 0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen
 1. LÄÄKEVALMISTEEN NIMI VALMISTEYHTEENVETO NuvaRing, 0,120 mg / 0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT NuvaRing sisältää 11,7 mg etonogestreelia ja
1. LÄÄKEVALMISTEEN NIMI VALMISTEYHTEENVETO NuvaRing, 0,120 mg / 0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT NuvaRing sisältää 11,7 mg etonogestreelia ja
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
Tiineys. Eläimet, joilla on akuutti tai subakuutti verenkierto-, suolisto- tai hengitystiesairaus.
 1. ELÄINLÄÄKKEEN NIMI Dinolytic vet. 12,5 mg/ml injektioneste, liuos naudalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: dinoprosti 12,5 mg/ml (dinoprostitrometamolina). Apuaineet: bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Dinolytic vet. 12,5 mg/ml injektioneste, liuos naudalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: dinoprosti 12,5 mg/ml (dinoprostitrometamolina). Apuaineet: bentsyylialkoholi
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
Gynekologinen tutkimus
 Gynekologinen tutkimus Gynekologinen tutkimus tarkoittaa sisätutkimusta, jonka lääkäri tekee naiselle emättimen kautta. Sisätutkimuksen tekijä on yleislääkäri tai erikoislääkäri. Jos hän on erikoislääkäri,
Gynekologinen tutkimus Gynekologinen tutkimus tarkoittaa sisätutkimusta, jonka lääkäri tekee naiselle emättimen kautta. Sisätutkimuksen tekijä on yleislääkäri tai erikoislääkäri. Jos hän on erikoislääkäri,
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: Laktoosimonohydraatti 41 mg ja sakkaroosi 10 mg. Täydellinen apuaineluettelo, ks. 6.1.
 VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
Potilasopas TREVICTA
 Potilasopas TREVICTA Miten pitkävaikutteinen psykoosilääke toimii? Pitkävaikutteisella psykoosilääkkeellä saadaan vakaa veren lääkepitoisuus. Lääke vapautuu tasaisesti ja saavuttaa pitkäkestoisen vaikutuksen
Potilasopas TREVICTA Miten pitkävaikutteinen psykoosilääke toimii? Pitkävaikutteisella psykoosilääkkeellä saadaan vakaa veren lääkepitoisuus. Lääke vapautuu tasaisesti ja saavuttaa pitkäkestoisen vaikutuksen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 JAYDESS 13,5 mg / KYLEENA 19,5 mg, kohdunsisäinen ehkäisin 05/2017 versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
JAYDESS 13,5 mg / KYLEENA 19,5 mg, kohdunsisäinen ehkäisin 05/2017 versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Suomalaisen Lääkäriseuran Duodecimin, Suomen Gynekologiyhdistyksen ja Suomen Yleislääketieteen Yhdistyksen asettama työryhmä.
 Suomalaisen Lääkäriseuran Duodecimin, Suomen Gynekologiyhdistyksen ja Suomen Yleislääketieteen Yhdistyksen asettama työryhmä Julkaistu 13.11.2015 PDF-versio sisältää suositustekstin, taulukot ja kuvat
Suomalaisen Lääkäriseuran Duodecimin, Suomen Gynekologiyhdistyksen ja Suomen Yleislääketieteen Yhdistyksen asettama työryhmä Julkaistu 13.11.2015 PDF-versio sisältää suositustekstin, taulukot ja kuvat
LÖYDÄ SINULLE SOPIVIN EHKÄISY MENETELMÄ Erilaisia vaihtoehtoja on paljon
 LÖYDÄ SINULLE SOPIVIN EHKÄISY MENETELMÄ Erilaisia vaihtoehtoja on paljon TUNNETKO SUKUPUOLI ELIMESI? Tietoa naisen ja miehen anatomiasta SEKSI JA SEKSUAALISUUS Mitä ne ovat? 2 Sisältö On aika ottaa vastuu
LÖYDÄ SINULLE SOPIVIN EHKÄISY MENETELMÄ Erilaisia vaihtoehtoja on paljon TUNNETKO SUKUPUOLI ELIMESI? Tietoa naisen ja miehen anatomiasta SEKSI JA SEKSUAALISUUS Mitä ne ovat? 2 Sisältö On aika ottaa vastuu
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Kosidina 75 mikrog/20 mikrog tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Kosidina 75 mikrog/20 mikrog tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi vaikuttava valkoinen tabletti sisältää 75 mikrogrammaa (eli 0,075 mg) gestodeenia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Kosidina 75 mikrog/20 mikrog tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi vaikuttava valkoinen tabletti sisältää 75 mikrogrammaa (eli 0,075 mg) gestodeenia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Marvelon tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Marvelon tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen tabletti sisältää 150 mikrogrammaa desogestreelia ja 30 mikrogrammaa etinyyliestradiolia. Apuaine,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Marvelon tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen tabletti sisältää 150 mikrogrammaa desogestreelia ja 30 mikrogrammaa etinyyliestradiolia. Apuaine,
LIITE I LUETTELO LÄÄKEVALMISTEEN NIMISTÄ, LÄÄKEMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, HAKIJOISTA JA MYYNTILUVAN HALTIJOISTA JÄSENVALTIOISSA 1/17
 LIITE I LUETTELO LÄÄKEVALMISTEEN NIMISTÄ, LÄÄKEMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, HAKIJOISTA JA MYYNTILUVAN HALTIJOISTA JÄSENVALTIOISSA 1/17 Jäsenvaltio Myyntiluvan haltija Hakija Kauppanimi Vahvuus
LIITE I LUETTELO LÄÄKEVALMISTEEN NIMISTÄ, LÄÄKEMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, HAKIJOISTA JA MYYNTILUVAN HALTIJOISTA JÄSENVALTIOISSA 1/17 Jäsenvaltio Myyntiluvan haltija Hakija Kauppanimi Vahvuus
LIITE III. Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin
 HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
VALMISTEYHTEENVETO. Vagiprev 0,120 mg/0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Vagiprev 0,120 mg/0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vagiprev sisältää 11,0 mg etonogestreelia ja 3,474
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Vagiprev 0,120 mg/0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vagiprev sisältää 11,0 mg etonogestreelia ja 3,474
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
VALMISTEYHTEENVETO. 1 tabletti sisältää 250 mikrog norgestimaattia ja 35 mikrog etinyyliestradiolia
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Cilest tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 250 mikrog norgestimaattia ja 35 mikrog etinyyliestradiolia Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Cilest tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 250 mikrog norgestimaattia ja 35 mikrog etinyyliestradiolia Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Beigen värinen, pyöreä, kaksoiskupera tabletti, tasainen molemmilta puolilta.
 VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE. (alitretinoiini) Lääkärin materiaalit. Potilaan nimi.
 LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE (alitretinoiini) Lääkärin materiaalit Potilaan nimi alitretinoiini Lääkärin materiaalit Lääkärin tarkistuslista/vahvistuslomake
LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE (alitretinoiini) Lääkärin materiaalit Potilaan nimi alitretinoiini Lääkärin materiaalit Lääkärin tarkistuslista/vahvistuslomake
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Laurina 28, kalvopäällysteinen tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Laurina 28, kalvopäällysteinen tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT jokainen keltainen tabletti sisältää 0,050 mg desogestreelia ja 0,035 mg etinyyliestradiolia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Laurina 28, kalvopäällysteinen tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT jokainen keltainen tabletti sisältää 0,050 mg desogestreelia ja 0,035 mg etinyyliestradiolia
