Pakkausseloste: Tietoa käyttäjälle. Myfenax 500 mg tabletti, kalvopäällysteinen mykofenolaattimofetiili
|
|
|
- Sofia Manninen
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Pakkausseloste: Tietoa käyttäjälle Myfenax 500 mg tabletti, kalvopäällysteinen mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen. - Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla. - Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta 4. Tässä pakkausselosteessa kerrotaan: 1. Mitä Myfenax on ja mihin sitä käytetään 2. Mitä sinun on tiedettävä, ennen kuin otat Myfenaxia 3. Miten Myfenaxia otetaan 4. Mahdolliset haittavaikutukset 5. Myfenaxin säilyttäminen 6. Pakkauksen sisältö ja muuta tietoa 1. Mitä Myfenax on ja mihin sitä käytetään Myfenax on lääke, jota käytetään estämään elimistön immuunijärjestelmän toimintaa. Tämän lääkkeen vaikuttava aine on mykofenolaattimofetiili. Myfenax-tablettien tarkoitus on estää elimistöä hylkimästä munuais-, sydän- tai maksasiirrettä. Sitä käytetään yhdessä muiden samalla tavoin vaikuttavien lääkkeiden (siklosporiinin ja kortikosteroidien) kanssa. 2. Mitä sinun on tiedettävä ennen kuin otat Myfenaxia VAROITUS Mykofenolaatti aiheuttaa synnynnäisiä epämuodostumia ja keskenmenoja. Jos olet nainen ja voit tulla raskaaksi, sinun on tehtävä ennen hoidon aloittamista raskaustesti ja testin tuloksen on oltava negatiivinen. Sinun on myös noudatettava lääkärin antamia ehkäisyä koskevia ohjeita. Lääkäri kertoo sinulle ja antaa kirjallista tietoa erityisesti mykofenolaatin vaikutuksista sikiöön. Lue tiedot tarkkaan ja noudata annettuja ohjeita. Jos jokin kohta näistä ohjeista jää epäselväksi, pyydä lääkäriä selvittämään asia sinulle ennen kuin otat mykofenolaattia. Ks. myös lisätietoja tämän kohdan otsikoiden Varoitukset ja varotoimet sekä Raskaus, ehkäisy ja imetys alta. Älä ota Myfenaxia jos olet allerginen (yliherkkä) mykofenolaattimofetiilille, mykofenolihapolle tai tämän lääkkeen jollekin muulle aineelle (ks. kohta 6) jos olet nainen ja voit tulla raskaaksi etkä ole ennen ensimmäisen lääkemääräyksen saamista tehnyt raskaustestiä ja saanut siitä negatiivista (ei raskaana) testitulosta, koska mykofenolaatti aiheuttaa epämuodostumia ja keskenmenoja jos olet raskaana tai suunnittelet raskaaksi tulemista tai epäilet olevasi raskaana 1
2 jos et käytä tehokasta ehkäisymenetelmää (ks. Raskaus, ehkäisy ja imetys) jos imetät. Älä ota lääkettä, jos jokin yllä mainituista asioista liittyy sinuun. Jos et ole varma, keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin otat Myfenaxia. Varoitukset ja varotoimet Keskustele lääkärisi kanssa välittömästi: jos sinulle ilmaantuu tulehdusoireita (esim. kuumetta, kurkkukipua), odottamattomia mustelmia ja/tai verenvuotoa jos sinulla on tai on aikaisemmin ollut ruoansulatuselimistön häiriöitä, esim. mahahaava. jos suunnittelet raskautta tai tulet raskaaksi Myfenax-hoidon aikana. Myfenax heikentää elimistösi vastustuskykyä. Riski sairastua ihosyöpään on tämän vuoksi suurentunut. Sinun on siksi rajoitettava altistumista auringonvalolle ja ultraviolettivalolle (UVsäteilylle) käyttämällä suojaavia vaatteita ja auringonsuojavoidetta, jossa on korkea suojakerroin. Et saa luovuttaa verta Myfenix-hoidon aikana etkä vähintään 6 viikkoon hoidon lopettamisen jälkeen. Miehet eivät saa luovuttaa siemennestettä Myfenix-hoidon aikana eivätkä vähintään 90 päivään hoidon lopettamisen jälkeen. Lapset ja nuoret Myfenaxia käytetään lapsilla ja nuorilla (2-18-vuotiaat) hylkimisreaktion estoon munuaisensiirron yhteydessä. Myfenaxia ei pidä käyttää lapsilla ja nuorilla (2-18-vuotiaat) sydämen- tai maksansiirron yhteydessä. Myfenaxia ei pidä käyttää ollenkaan alle 2-vuotiailla lapsilla. Muut lääkevalmisteet ja Myfenax Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt. Jos jokin seuraavista koskee sinua, keskustele lääkärisi kanssa ennen Myfenax-lääkityksen aloittamista: käytät atsatiopriinia tai muita immunosuppressiivisia lääkkeitä (niitä määrätään toisinaan potilaille elimensiirron jälkeen), kolestyramiinia (korkeiden kolesteroliarvojen hoitoon), rifampisiinia (antibiootti), antasideja tai protonipumpun estäjiä (käytetään happovaivojen hoitoon, esim. aterianjälkeisiin vatsavaivoihin), fosfaattia sitovia lääkeaineita (kroonisen munuaisten vajaatoiminnan yhteydessä vähentämään fosfaatin imeytymistä) tai joitakin muita lääkkeitä (ilman reseptiä saatavat lääkkeet mukaan lukien), joista lääkärisi ei ole tietoinen. Lääkäri antaa lisäohjeita jos tarvitset rokotuksia (eläviä rokotteita). Raskaus, ehkäisy ja imetys Jos olet nainen ja voit tulla raskaaksi, sinun on aina käytettävä Myfenix-hoidon kanssa kahta tehokasta ehkäisymenetelmää: ennen Myfenax-hoidon aloittamista koko Myfenax-hoidon ajan 6 viikon ajan Myfenax-hoidon loputtua. Keskustele lääkärin kanssa sinulle parhaiten soveltuvasta ehkäisymenetelmästä. Tämä riippuu henkilökohtaisesta tilanteestasi. Jos epäilet, että ehkäisysi saattaa olla pettänyt tai jos olet unohtanut ottaa ehkäisytabletin, ota mahdollisimman pian yhteyttä lääkäriin Et voi tulla raskaaksi, jos jokin seuraavista koskee sinua: sinulla on ollut vaihdevuodet: olet vähintään 50 vuotta ja viimeisistä kuukautisista on kulunut enemmän kuin vuosi (jos kuukautiset ovat jääneet pois syöpähoitojen seurauksena, raskaaksi tulo on edelleen mahdollista) 2
3 munanjohtimesi ja molemmat munasarjasi on poistettu (molemminpuolinen salpingo-ooforektomia) kohtusi on kirurgisesti poistettu (hysterektomia) sinulla on gynekologin toteama ennenaikainen munasarjojen toimintahäiriö sinulla on diagnosoitu yksi seuraavista harvinaisista tiloista, joka synnynnäisesti estää raskaaksi tulon: XY genotyyppi, Turnerin oireyhtymä tai kohdun synnynnäinen puuttuminen olet lapsi tai teini-ikäinen nuori, jolla kuukautiset eivät ole vielä alkaneet, ja et voi tulla raskaaksi. Raskaus ja imetys Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä. Lääkäri kertoo sinulle raskauteen liittyvistä riskeistä ja muista elinsiirteen hylkimisenestoon käytettävistä hoitovaihtoehdoista jos suunnittelet raskaaksi tulemista jos kuukautisesi jäävät tai epäilet niiden jääneen tulematta, jos sinulla on epätavallista kuukautisvuotoa tai epäilet, että olet raskaana jos olet sukupuoliyhteydessä etkä käytä tehokasta ehkäisymenetelmää. Jos tulet raskaaksi mykofenolaattihoidon aikana, sinun on ilmoitettava siitä heti lääkärille. Jatka kuitenkin Myfenix-hoitoa, kunnes pääset lääkärin vastaanotolle. Raskaus Mykofenolaatti aiheuttaa hyvin usein keskenmenon (50 %) ja sikiölle vaikeita synnynnäisiä epämuodostumia (23 27 %). Raportoituja synnynnäisiä epämuodostumia ovat olleet korvien, silmien, kasvojen (huuli- ja suulakihalkio), sormien kehityksen, sydämen, ruokatorven (nielun mahaan yhdistävän kanavan), munuaisten ja hermoston (esimerkiksi selkäydintyrä, jossa selkärangan luiden kehitys on poikkeava) epämuodostumat. Vauvallasi saattaa olla yksi tai useita tällaisia epämuodostumia. Jos olet nainen ja saatat tulla raskaaksi, sinun on tehtävä ennen hoidon aloittamista raskaustesti, jonka tuloksen pitää olla negatiivinen, ja sinun on noudatettava lääkärin antamia raskauden ehkäisyä koskevia ohjeita. Lääkäri saattaa tehdä useamman kuin yhden raskaustestin varmistaakseen ennen hoitoa, että et ole raskaana. Imetys Älä käytä Myfenixiä, jos imetät. Pieniä lääkeainemääriä saattaa kulkeutua äidinmaitoon. Ajaminen ja koneiden käyttö Myfenaxin ei ole todettu vaikuttavan ajokykyyn tai kykyyn käyttää koneita. 3. Miten Myfenaxia otetaan Ota Myfenaxia juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Hoitosi aloittaa ja sitä seuraa elinsiirtoihin erikoistunut lääkäri. Tavanomainen Myfenax-annostus on: Munuaisensiirto Aikuiset Ensimmäinen annos annetaan 72 tunnin kuluessa siirtoleikkauksesta. Suositeltu annostus on 4 tablettia vuorokaudessa (2 g vaikuttavaa ainetta) kahteen annokseen jaettuna. Ota siis 2 tablettia aamulla ja 2 tablettia illalla. Lapset ja nuoret (2-18-vuotiaat) Annos vaihtelee lapsen koon mukaan. Lääkäri määrää sopivimman annoksen kehon pinta-alan mukaan (pituus ja paino). Suositeltu annos on 600 mg/m² kaksi kertaa vuorokaudessa. 3
4 Sydämensiirto Aikuiset Ensimmäinen annos annetaan viiden vuorokauden kuluessa siirtoleikkauksesta. Suositeltu annostus on 6 tablettia vuorokaudessa (3 g vaikuttavaa ainetta) kahteen annokseen jaettuna. Ota siis 3 tablettia aamulla ja 3 tablettia illalla. Maksansiirto Aikuiset Ensimmäinen annos suun kautta otettavaa Myfenaxia annetaan vähintään neljän päivän kuluttua siirtoleikkauksesta, kun pystyt nielemään suun kautta annettavia lääkkeitä. Suositeltu annostus on 6 tablettia vuorokaudessa (3 g vaikuttavaa ainetta) kahteen annokseen jaettuna. Ota siis 3 tablettia aamulla ja 3 tablettia illalla. Antotapa ja antoreitti Tabletit niellään kokonaisina vesilasillisen kanssa. Voit ottaa tabletit joko ruuan kanssa tai ilman ruokaa. Tabletteja ei saa jakaa eikä murskata. Hoitoa jatketaan niin kauan kuin tarvitset immuunivastetta heikentävää lääkettä, joka estää elimistöäsi hylkimästä siirrännäistä. Jos otat enemmän Myfenaxia kuin sinun pitäisi On tärkeää ettet ota enempää tabletteja kuin lääkärisi on sinulle määrännyt. Ota heti yhteyttä lääkäriin tai sairaalan päivystyspoliklinikkaan, jos olet ottanut enemmän tabletteja kuin mitä lääkäri on määrännyt tai jos epäilet lapsen nielleen niitä. Jos unohdat ottaa Myfenaxia Jos unohdat ottaa lääkkeesi (milloin tahansa), ota se heti kun huomaat ja jatka lääkkeen ottamista normaalin aikataulun mukaan. Älä ota kaksinkertaista annosta korvataksesi unohtamasi annoksen. Jos lopetat Myfenaxin oton Älä lopeta itse Myfenax-hoitoa, vaikka tuntisit olosi paremmaksi. On erittäin tärkeää ottaa lääkettä lääkärin määräämän ajanjakson ajan. Myfenax-hoidon lopettaminen saattaa lisätä siirteen hyljintäreaktion mahdollisuutta. Lääkitystä ei saa lopettaa, ellei lääkäri ole niin kehottanut. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen. 4. Mahdolliset haittavaikutukset Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Hyvin yleiset (saattaa esiintyä useammalla kuin yhdellä potilaalla kymmenestä) ripuli, oksentelu, pahoinvointi eri verisolujen määrän väheneminen normaaliarvoista, mikä voi johtaa infektioiden, mustelmien, verenvuodon, hengenahdistuksen ja heikkouden tunteen vaaran suurenemiseen ruoansulatuselimistön ja virtsateiden bakteeri-, sieni- ja virusinfektiot, huuliherpes ja vyöruusu Yleiset (saattaa esiintyä jopa yhdellä potilaalla kymmenestä) muutokset eri laboratorioarvoissa, myös maksan entsyymiarvoissa, munuaisten toimintaa kuvaavissa arvoissa, kuten kreatiniiniarvoissa, kaliumarvoissa, verensokeriarvoissa, veren rasva-, kolesteroli-, fosfaatti-, magnesium-, kalsium- ja virtsahappoarvoissa munuaisten toiminnan häiriöt ureapitoisuuden suurenemisen seurauksena 4
5 ruoansulatuselimistön häiriöt, kuten ummetus, ruoansulatushäiriöt, ilmavaivat, röyhtäily, ikenien turpoaminen, suu-, ruokatorvi-, maha-, suoli-, maksa- tai haimatulehdus ja ruoansulatuselimistön verenvuoto kouristukset, lihasten jännittyneisyyden lisääntyminen, vapina ja lihasheikkous, nivelkipu unettomuus, heitehuimaus ja päänsärky, pistely ja puutuminen, makuaistin muutokset, ruokahalun puuttuminen, painon lasku hengitys- ja ruoansulatuskanavan tulehdus ja infektiot, kurkkukipu, sivuontelotulehdus, nenän vuotaminen ja kutiaminen ihosyöpä tai ihon hyvänlaatuiset kasvaimet, sekä ihon ja emättimen sieni-infektiot verenpaineen muutokset, sydämen syketiheyden kiihtyminen, verisuonten laajeneminen nesteen kertyminen elimistöön, kuume, epämukava olo, horrostila ja heikkous maksatulehdus, ihon ja silmän valkuaisen keltaisuus Melko harvinaiset (saattaa esiintyä jopa yhdellä potilaalla sadasta) imukudoksen lisäkasvu, pahanlaatuiset kasvaimet mukaan lukien sydämen ja sydänläppien tulehdus, aivokalvojen ja selkäytimen tulehdus tai infektiot Tuntematon (koska saatavissa oleva tieto ei riitä esiintymistiheyden arviointiin) yliherkkyysreaktiot (allergiset reaktiot) hengenahdistus, yskä, jotka voivat johtua keuhkoputkien laajentumasta (sairaus, jossa keuhkoputket ovat laajentuneet epänormaalisti) tai keuhkofibroosista (keuhkojen arpeutumisesta). Kerro lääkärille, jos sinulle ilmaantuu pitkittyvää yskää tai hengenahdistusta. Älä itse lopeta lääkitystäsi, ellet ole keskustellut siitä lääkärisi kanssa. Haittavaikutuksista ilmoittaminen Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa samaan enemmän tietoa lääkevalmisteen turvallisuudesta. www-sivusto: Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL 55 FI Fimea 5. Myfenaxin säilyttäminen Ei lasten ulottuville eikä näkyville. Älä käytä Myfenax-tabletteja läpipainopakkauksessa ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää. Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita. Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa. 6. Pakkauksen sisältö ja muuta tietoa Mitä Myfenax sisältää Vaikuttava aine on mykofenolaattimofetiili. Yksi tabletti sisältää 500 mg mykofenolaattimofetiilia. Muut aineet ovat: 5
6 Tabletin ydin mikrokiteinen selluloosa povidoni K-30 magnesiumstearaatti kroskarmelloosinatrium Tabletin kalvopäällyste hypromelloosi (HPMC 2910) titaanidioksidi (E 171) makrogoli (PEG 400) talkki indigokarmiini alumiinilakka (E 132) musta rautaoksidi (E 172) punainen rautaoksidi (E 172) Lääkevalmisteen kuvaus ja pakkauskoot Tabletti, kalvopäällysteinen Vaalean purppuranvärinen, ovaalinmuotoinen kalvopäällysteinen tabletti, jonka toisella puolella on merkintä "M500", toisella puolella ei ole merkintää Myfenax 500 mg kalvopäällysteiset tabletit ovat PVC/PVdC-alumiiniläpipainopakkauksessa 50 tabletin tai 150 tabletin tai 50x1 tabletin pakkauksina. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. Myyntiluvan haltija ja valmistaja Myyntiluvan haltija TEVA B.V. Swensweg GA Haarlem Alankomaat Valmistajat TEVA Pharmaceutical Works Private Limited Company Pallagi út, 13 Debrecen H-4042 Unkari Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja: Suomi/Finland ratiopharm Oy Puh/Tel: Tämä pakkausseloste on tarkistettu viimeksi 01/2016 Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla 6
7 7
Pakkausseloste: Tietoa käyttäjälle. CellCept 250 mg kapselit (mykofenolaattimofetiili)
 Pakkausseloste: Tietoa käyttäjälle CellCept 250 mg kapselit (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
Pakkausseloste: Tietoa käyttäjälle CellCept 250 mg kapselit (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
Pakkausseloste: Tietoa käyttäjälle. Lomustine medac 40 mg kapselit, kova
 Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. Pantoprazole Teva 40 mg enterotabletit. pantopratsoli
 PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
Pakkausseloste: Tietoa käyttäjälle. CellCept 500 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos (mykofenolaattimofetiili)
 Pakkausseloste: Tietoa käyttäjälle CellCept 500 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen
Pakkausseloste: Tietoa käyttäjälle CellCept 500 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen
PAKKAUSSELOSTE. Mycophenolate mofetil Teva 250 mg kapseli, kova Mykofenolaattimofetiili
 PAKKAUSSELOSTE Mycophenolate mofetil Teva 250 mg kapseli, kova Mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Mycophenolate mofetil Teva 250 mg kapseli, kova Mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä
 mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
Pakkausseloste: Tietoa käyttäjälle. CellCept 1 g/5 ml jauhe oraalisuspensiota varten (mykofenolaattimofetiili)
 Pakkausseloste: Tietoa käyttäjälle CellCept 1 g/5 ml jauhe oraalisuspensiota varten (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle CellCept 1 g/5 ml jauhe oraalisuspensiota varten (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
PAKKAUSSELOSTE. CellCept 500 mg infuusiokuiva-aine konsentraattiliuosta varten mykofenolaattimofetiili
 PAKKAUSSELOSTE CellCept 500 mg infuusiokuiva-aine konsentraattiliuosta varten mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE CellCept 500 mg infuusiokuiva-aine konsentraattiliuosta varten mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste.
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski
 mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
PAKKAUSSELOSTE. Risedronat Teva 35 mg kalvopäällysteiset tabletit. risedronaattinatrium
 PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
PAKKAUSSELOSTE. Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani
 PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE. Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi
 PAKKAUSSELOSTE Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. IRESSA 250 mg kalvopäällysteiset tabletit gefitinibi
 PAKKAUSSELOSTE IRESSA 250 mg kalvopäällysteiset tabletit gefitinibi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE IRESSA 250 mg kalvopäällysteiset tabletit gefitinibi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Pakkausseloste: Tietoa käyttäjälle. Kipupois 200 mg tabletit. ibuprofeeni
 Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS
 EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
Pakkausseloste: Tietoa käyttäjälle. CellCept 500 mg kalvopäällysteiset tabletit (mykofenolaattimofetiili)
 Pakkausseloste: Tietoa käyttäjälle CellCept 500 mg kalvopäällysteiset tabletit (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle
Pakkausseloste: Tietoa käyttäjälle CellCept 500 mg kalvopäällysteiset tabletit (mykofenolaattimofetiili) Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle
PAKKAUSSELOSTE. Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo
 PAKKAUSSELOSTE Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE. Eliquis 2,5 mg kalvopäällysteiset tabletit Apiksabaani
 1 2 B. PAKKAUSSELOSTE 3 PAKKAUSSELOSTE Eliquis 2,5 mg kalvopäällysteiset tabletit Apiksabaani Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
1 2 B. PAKKAUSSELOSTE 3 PAKKAUSSELOSTE Eliquis 2,5 mg kalvopäällysteiset tabletit Apiksabaani Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE. Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit. Rivastigmiini
 PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Pakkausseloste: Tietoa potilaalle. Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi
 Pakkausseloste: Tietoa potilaalle Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita
Pakkausseloste: Tietoa potilaalle Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita
PAKKAUSSELOSTE. Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit
 PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
Pakkausseloste: Tietoa potilaalle. Baraclude 0,05 mg/ml oraaliliuos entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE. Comtan 200 mg kalvopäällysteiset tabletit Entakaponi
 PAKKAUSSELOSTE Comtan 200 mg kalvopäällysteiset tabletit Entakaponi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Comtan 200 mg kalvopäällysteiset tabletit Entakaponi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
Pakkausseloste: Tietoa käyttäjälle. Lomustine medac 40 mg kapseli, kova lomustiini
 Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapseli, kova lomustiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapseli, kova lomustiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
Pakkausseloste: Tietoa käyttäjälle. Myfenax 500 mg tabletti, kalvopäällysteinen Mykofenolaattimofetiili
 Pakkausseloste: Tietoa käyttäjälle Myfenax 500 mg tabletti, kalvopäällysteinen Mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle
Pakkausseloste: Tietoa käyttäjälle Myfenax 500 mg tabletti, kalvopäällysteinen Mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle
Pakkausseloste: Tietoa käyttäjälle. Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi
 Pakkausseloste: Tietoa käyttäjälle Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
PAKKAUSSELOSTE Myfenax 500 mg tabletti, kalvopäällysteinen Mykofenolaattimofetiili
 PAKKAUSSELOSTE Myfenax 500 mg tabletti, kalvopäällysteinen Mykofenolaattimofetiili Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Myfenax 500 mg tabletti, kalvopäällysteinen Mykofenolaattimofetiili Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani
 PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
PAKKAUSSELOSTE. Vagifem 10 mikrog emätinpuikot. Estradioli
 PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
PAKKAUSSELOSTE. Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta
 PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE. Lamivudine Teva Pharma B.V. 150 mg kalvopäällysteiset tabletit lamivudiini
 PAKKAUSSELOSTE Lamivudine Teva Pharma B.V. 150 mg kalvopäällysteiset tabletit lamivudiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE Lamivudine Teva Pharma B.V. 150 mg kalvopäällysteiset tabletit lamivudiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi
 Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi Tärkeää tietoa TASIGNA-hoidosta Mitä TASIGNA ON? TASIGNA on reseptilääke, jota käytetään Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian
Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi Tärkeää tietoa TASIGNA-hoidosta Mitä TASIGNA ON? TASIGNA on reseptilääke, jota käytetään Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti
 Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
PAKKAUSSELOSTE. Efficib 50 mg/1000 mg kalvopäällysteiset tabletit (sitagliptiini/metformiinihydrokloridi)
 PAKKAUSSELOSTE Efficib 50 mg/1000 mg kalvopäällysteiset tabletit (sitagliptiini/metformiinihydrokloridi) Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE Efficib 50 mg/1000 mg kalvopäällysteiset tabletit (sitagliptiini/metformiinihydrokloridi) Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE. Tracleer 125 mg kalvopäällysteinen tabletti Bosentaani
 PAKKAUSSELOSTE Tracleer 125 mg kalvopäällysteinen tabletti Bosentaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Tracleer 125 mg kalvopäällysteinen tabletti Bosentaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
PAKKAUSSELOSTE. Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo
 PAKKAUSSELOSTE Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
PAKKAUSSELOSTE. Zylagren 75 mg kalvopäällysteiset tabletit Klopidogreeli
 PAKKAUSSELOSTE Zylagren 75 mg kalvopäällysteiset tabletit Klopidogreeli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE Zylagren 75 mg kalvopäällysteiset tabletit Klopidogreeli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE. Rivastigmine Actavis 3 mg kovat kapselit Rivastigmiini
 PAKKAUSSELOSTE Rivastigmine Actavis 3 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Rivastigmine Actavis 3 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
OPAS KOTIPISTOSHOITOON
 OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä
Pakkausseloste: Tietoa potilaalle. Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
Pakkausseloste: Tietoa potilaalle Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
PAKKAUSSELOSTE. Pravafenix 40 mg / 160 mg, kovat kapselit Pravastatiini/fenofibraatti
 PAKKAUSSELOSTE Pravafenix 40 mg / 160 mg, kovat kapselit Pravastatiini/fenofibraatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Pravafenix 40 mg / 160 mg, kovat kapselit Pravastatiini/fenofibraatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Pakkausseloste: Tietoa potilaalle. Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas)
 Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
PAKKAUSSELOSTE. Xenical 120 mg kovat kapselit Orlistaatti
 PAKKAUSSELOSTE Xenical 120 mg kovat kapselit Orlistaatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Xenical 120 mg kovat kapselit Orlistaatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE. FIRDAPSE 10 mg tabletti amifampridiini
 PAKKAUSSELOSTE FIRDAPSE 10 mg tabletti amifampridiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE FIRDAPSE 10 mg tabletti amifampridiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Caprelsa. Vandetanibi CAPRELSA (VANDETANIBI) POTILAAN JA POTILAAN HUOLTAJAN (PEDIATRINEN KÄYTTÖ) OPAS ANNOSTELUSTA JA SEURANNASTA
 Caprelsa Vandetanibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Caprelsa Vandetanibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
PAKKAUSSELOSTE. Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos
PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos
PAKKAUSSELOSTE. Actos 15 mg tabletti Pioglitatsoni
 PAKKAUSSELOSTE Actos 15 mg tabletti Pioglitatsoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Actos 15 mg tabletti Pioglitatsoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
PAKKAUSSELOSTE. Pantoprazole Teva 20 mg enterotabletit. pantopratsoli
 PAKKAUSSELOSTE 20 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE 20 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
PAKKAUSSELOSTE. Possia 90 mg kalvopäällysteinen tabletti tikagrelori
 PAKKAUSSELOSTE Possia 90 mg kalvopäällysteinen tabletti tikagrelori Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Possia 90 mg kalvopäällysteinen tabletti tikagrelori Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
CORTIMENT -LÄÄKITYKSESI
 CORTIMENT -LÄÄKITYKSESI MITÄ CORTIMENT ON?1 Cortiment-tabletit sisältävät lääkeainetta nimeltä budesonidi. Budesonidi kuuluu kortikosteroidien lääkeryhmään. Näitä lääkkeitä käytetään tulehduksen hoitoon.
CORTIMENT -LÄÄKITYKSESI MITÄ CORTIMENT ON?1 Cortiment-tabletit sisältävät lääkeainetta nimeltä budesonidi. Budesonidi kuuluu kortikosteroidien lääkeryhmään. Näitä lääkkeitä käytetään tulehduksen hoitoon.
kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista.
 1 kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista. 2 3 Sisältö Miten Uptravi otetaan?............................................ 4 Miten
1 kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista. 2 3 Sisältö Miten Uptravi otetaan?............................................ 4 Miten
Potilaan opas. Acitretin Orifarm 10 mg ja 25 mg. Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma. (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3 mg laktoosimonohydraattia. Täydellinen apuaineluettelo, ks. kohta 6.
 1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
PAKKAUSSELOSTE. Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE. Valdoxan 25 mg tabletti, kalvopäällysteinen Agomelatiini
 PAKKAUSSELOSTE Valdoxan 25 mg tabletti, kalvopäällysteinen Agomelatiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Valdoxan 25 mg tabletti, kalvopäällysteinen Agomelatiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
Erivedge -valmisteen raskaudenehkäisyohjelma
 Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Olmesartan medoxomil STADA. 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
PAKKAUSSELOSTE. Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen.
 PAKKAUSSELOSTE Mimpara 30 mg kalvopäällysteiset tabletit Mimpara 60 mg kalvopäällysteiset tabletit Mimpara 90 mg kalvopäällysteiset tabletit Sinakalseetti Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Mimpara 30 mg kalvopäällysteiset tabletit Mimpara 60 mg kalvopäällysteiset tabletit Mimpara 90 mg kalvopäällysteiset tabletit Sinakalseetti Lue tämä pakkausseloste huolellisesti, ennen kuin
Opas Tietoja potilaille
 Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
PAKKAUSSELOSTE. Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli
 PAKKAUSSELOSTE Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen Säilytä tämä pakkausseloste. Voit tarvita sitä
1. LÄÄKEVALMISTEEN NIMI. Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1. LÄÄKEVALMISTEEN NIMI Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää: 361-509 mg Arctostaphylos uva-ursi (L.) Spreng. folium (sianpuolukan
1. LÄÄKEVALMISTEEN NIMI Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää: 361-509 mg Arctostaphylos uva-ursi (L.) Spreng. folium (sianpuolukan
PAKKAUSSELOSTE. Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
Pakkausseloste: Tietoa potilaalle. Baraclude 0,5 mg tabletti, kalvopäällysteinen entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 0,5 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
Pakkausseloste: Tietoa potilaalle Baraclude 0,5 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
Isotretinoin Actavis
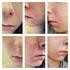 Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
PAKKAUSSELOSTE. Metformin Teva 850 mg kalvopäällysteinen tabletti metformiinihydrokloridi
 PAKKAUSSELOSTE Metformin Teva 850 mg kalvopäällysteinen tabletti metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Metformin Teva 850 mg kalvopäällysteinen tabletti metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE. Enalapril Astimex 2,5 mg, 5 mg, 10 mg ja 20 mg Tabletit
 PAKKAUSSELOSTE Enalapril Astimex 2,5 mg, 5 mg, 10 mg ja 20 mg Tabletit Ota huomioon, että lääkäri on voinut määrätä lääkkeen muuhun käyttötarkoitukseen ja/tai muulla annostuksella kuin mitä pakkausselosteessa
PAKKAUSSELOSTE Enalapril Astimex 2,5 mg, 5 mg, 10 mg ja 20 mg Tabletit Ota huomioon, että lääkäri on voinut määrätä lääkkeen muuhun käyttötarkoitukseen ja/tai muulla annostuksella kuin mitä pakkausselosteessa
HOITO EPCLUSA - VALMISTEELLA (SOFOSBUVIIRI/VELPATASVIIRI) Tietoa potilaille. Tähän lääkkeeseen kohdistuu lisäseuranta.
 HOITO EPCLUSA - VALMISTEELLA (SOFOSBUVIIRI/VELPATASVIIRI) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. 2 Tämä esite ei korvaa lääkkeen pakkausselostetta tai lääkärin antamia tietoja. Lue
HOITO EPCLUSA - VALMISTEELLA (SOFOSBUVIIRI/VELPATASVIIRI) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. 2 Tämä esite ei korvaa lääkkeen pakkausselostetta tai lääkärin antamia tietoja. Lue
