Primovist (dinatriumgadoksetaatti) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
|
|
|
- Juuso Ahola
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Primovist (dinatriumgadoksetaatti) 05/2013, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 2. Julkisen yhteenvedon osiot 2.1 Tietoa sairauden esiintyvyydestä Magneettikuvaus (MK) on yksi useasta vaihtoehdosta ottaa kuvia maksasta, jos potilaalla tiedetään tai epäillään olevan tiettyjä maksasairauksia. Magneettikuvaus on kivuton toimenpide, jossa ei käytetä röntgensäteitä (säteilyä). Primovist on tehosteaine, joka annetaan injektiona laskimoon juuri ennen magneettikuvausta, jotta maksasta saadaan parempia kuvia. Mahdollisia maksasairauksia on monenlaisia, joten kuvantamisesta on usein hyötyä sairauden laadun ja parhaiten sopivan hoidon määrittämisessä. Käytettävissä on myös muita kuvantamismenetelmiä, joista jokaiseen liittyy omat hyötynsä ja riskinsä. Esimerkiksi tietokonetomografiassa (TT-kuvauksessa) käytetään röntgensäteitä, ja intraoperatiivinen ultraäänitutkimus tehdään leikkauksen aikana, joten sitä ei voi hyödyntää leikkausta suunniteltaessa. 2.2 Yhteenveto hoidon hyödyistä Primovist-tehosteaineen avulla tehdyn magneettikuvauksen on todettu tuottavan parempia kuvia maksasta kuin ilman sitä tehty magneettikuvaus. Tämä tarkoittaa, että Primovistvalmistetta käytettäessä lääkäri pystyy paremmin toteamaan tietyt maksasairaudet magneettikuvasta ja erottamaan maksan erityyppiset muutokset (esim. hyvänlaatuinen vs. pahanlaatuinen) kuin jos magneettikuvaus tehtäisiin ilman Primovist-tehosteainetta. Parempien kuvantamistulosten avulla lääkäri ja potilas pystyvät helpommin päättämään, mikä on paras vaihtoehto sairauden hoitamiseen. 2.3 Hoidon hyötyihin liittyvät asiat, joita ei tunneta Primovist-valmistetta tarkastelleisiin kliinisiin tutkimuksiin on osallistunut yli 2000 potilasta. Päätutkimuksessa ja sitä täydentäneissä tutkimuksissa Primovist-valmisteen käyttöä tutkittiin naisilla ja miehillä, joiden ikä vaihteli 18 vuodesta yli 80 vuoteen. Tutkimuksiin osallistui potilaita, jotka edustivat useampaa eri etnistä alkuperää. Maailmanlaajuisesti Primovistvalmistetta on käyttänyt yli 1,7 miljoonaa potilasta. Mitään näyttöä ei ole saatu siitä, että tulokset olisivat erilaiset muiden etnisten ryhmien edustajilla tai tätä nuoremmilla potilailla. Primovist-valmisteen käyttöä tutkitaan parhaillaan yli 2 kuukautta ja alle 18 vuotta vanhoilla lapsilla lisätietojen hankkimiseksi. Lisäksi suunnitteilla on faasin 3 monikeskustutkimus 0 2 kuukauden ikäisille lapsille.
2 2.4 Yhteenveto turvallisuustiedoista Tärkeät tunnistetut riskit Riski Mitä tiedetään Ehkäistävyys Allergian tyyppiset reaktiot, jotka voivat olla vakavia Vakavia allergian tyyppisiä reaktioita saattaa esiintyä kaikkien tehosteaineiden eli myös Primovist-valmisteen antamisen jälkeen. Vakavien reaktioiden yleisyyttä ei tiedetä, sillä kenelläkään Primovisttutkimuksiin osallistuneista potilaista ei ilmennyt vakavia reaktioita. Päivittäisestä kliinisestä käytöstä saatujen kokemusten perusteella hengenvaaralliset allergian tyyppiset reaktiot ovat harvinaisia. Tällaisen reaktion mahdollisuutta ei voi sulkea pois Primovist-valmisteella hoidettavilla potilailla. Potilasta seurataan jonkin aikaa injektion antamisen jälkeen, jotta hoito voidaan aloittaa välittömästi, jos hänelle kehittyy vakava allergian tyyppinen reaktio. Tärkeät mahdolliset riskit Riski Nefrogeeninen systeeminen fibroosi (NSF), joka aiheuttaa ihon ja sidekudosten paksuuntumista ja kovettumista Mitä tiedetään Nefrogeeninen systeeminen fibroosi (NSF) on sairaus, joka aiheuttaa ihon ja sidekudosten paksuuntumista ja kovettumista. NSF voi johtaa toimintakykyä haittaavaan nivelten liikkumattomuuteen, lihasten heikkouteen tai sisäelinten toiminnan heikkenemiseen, joka voi mahdollisesti olla hengenvaarallista mennessä ei Primovist-valmisteen käyttöön ollut raportoitu liittyneen yhtään NSF-tapausta missään maassa, ja on epävarmaa, voiko Primovist aiheuttaa nefrogeenistä systeemistä fibroosia. Joidenkin muiden gadoliniumia sisältävien varjoaineiden käyttöön on kuitenkin liittynyt nefrogeenistä systeemistä fibroosia potilailla, joiden munuaisten toiminta on heikentynyt. Tämän vuoksi ei voida sulkea pois sitä mahdollisuutta, että myös Primovist voi aiheuttaa nefrogeenistä systeemistä fibroosia potilailla, joilla on munuaisten vajaatoiminta. NSF:n mahdollisen riskin määrittämiseksi suositellaan verikoetta, jonka avulla voidaan tarkastaa, miten hyvin potilaan munuaiset toimivat, ennen kuin tehdään päätös Primovist-valmisteen käytöstä. Tämä suositus koskee etenkin iäkkäitä potilaita. Puuttuvat tiedot Riski Luuston tai kudosten gadoliniumkertymien mahdolliset pitkäaikaisvaikutukset Primovist-valmisteen turvallisuus lapsille tai nuorille (alle 18-vuotiaille) Mitä tiedetään Jos munuaisten toiminta on heikentynyt, gadoliniumia sisältävien tehosteaineiden käyttö saattaa johtaa gadoliniumin kertymiseen luustoon tai kudoksiin. Primovist-valmisteen käytön yhteydessä ei ole mennessä raportoitu tällaisista kertymistä johtuvia haitallisia pitkäaikaisvaikutuksia. Primovist-valmisteen turvallisuutta alle 18-vuotiailla ei ole vielä tutkittu. Tämän vuoksi Primovist-valmisteen käyttöä tälle potilasryhmälle ei suositella. Eläinkokeista, meneillään olevista kliinisistä tutkimuksista ja valmisteen markkinoille tulon jälkeen saaduista tiedoista ei ole kuitenkaan
3 Primovist-valmisteen turvallisuus raskauden tai imetyksen aikana saatu mitään viitteitä siitä, että Primovist olisi vahingollinen lapsille tai nuorille. Raskaana olevat naiset jätetään yleensä kliinisten Primovist-tutkimusten ulkopuolelle, joten valmisteen turvallisuutta raskauden aikana ei ole varmistettu. Tämän vuoksi Primovist-valmistetta ei pitäisi käyttää raskauden aikana, ellei se ole ehdottoman välttämätöntä. Eläinkokeista ja päivittäisestä kliinisestä käytöstä saatujen kokemusten perusteella ei ole kuitenkaan saatu mitään viitteitä siitä, että Primovist aiheuttaisi vahinkoa raskaana olevalle naiselle tai syntymättömälle lapselle. Gadoliniumia sisältävää tehosteainetta voi erittyä pieninä määrinä rintamaitoon. Eläinkokeista ja päivittäisestä kliinisestä käytöstä saatujen kokemusten perusteella ei ole kuitenkaan saatu mitään viitteitä siitä, että Primovist aiheuttaisi vahinkoa rintamaitoa saaneelle lapselle. 2.5 Yhteenveto toimenpiteistä riskien minimoimiseksi Lisätoimia seuraavien riskien minimoimiseksi ovat: Nefrogeeninen systeeminen fibroosi (NSF), joka aiheuttaa ihon ja sidekudosten kovettumista ja paksuuntumista Riskien minimoinnin lisätoimet Tavoite ja perustelu: Terveydenhuoltohenkilöstön tulisi ymmärtää NSF:n riski ja tietää, missä potilasryhmissä riski on suurin Tärkeimmät lisätoimet riskien minimoimiseksi Koulutus ja tiedotus terveydenhuoltohenkilöstölle (nettisivusto, tietoiskut ja esitykset konferensseissa) Irrotettava jäljitystarra, joka voidaan liimata potilastietoihin 2.6 Kehityssuunnitelma myyntiluvan myöntämisen jälkeen Luettelo kehityssuunnitelmaan sisältyvistä tutkimuksista Tutkimus (tutkimuksen numero) Tavoitteet Käsiteltävät turvallisuutee n liittyvät seikat Tila Väli- ja loppuraporttien aikataulu NSFhavainnointitutkimus ("PERI-tutkimus", tutkimusnumero 13701) Arvioida NSF:n mahdollisen riskin suuruus gadoliniumpohjaisten tehosteaineiden käytön yhteydessä NSF Rekrytointi saatu loppuun, rekrytoitujen potilaiden seuranta meneillään Vuosittaiset arviot ja raportit. toimitus vuoden 2014 keskivaiheilla. Interventionaalinen tutkimus gadoliniumin Tarkastella gadoliniumin mahdollista pitkäaikaista kertymistä luustoon Gadoliniumin kertyminen luuhun, NSF Käynnissä Viimeisen potilaan viimeisen
4 pitkäaikaisesta kertymisestä luuhun (tutkimusnumero: ALS-Gd64/001) potilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta tai vakaa munuaisten toiminta ja jotka ovat saaneet kerta-annoksen gadoliniumpohjaista tehosteainetta tai useamman annoksen samaa gadoliniumpohjaista tehosteainetta. tutkimuskäynnin suunniteltu aika: lokakuu toimitus: Q2/2015 (suunnitelma) Faasin 4 noninterventionaalinen, pediatrinen Primovist-tutkimus (tutkimusnumero 13729) Kategoria: 2 (US PMR, MRP seuranta SE/H/429/01-02/FU/02) Tutkimusnumero 16078: Avoin, faasin 3 kliininen monikeskustutkim us 0 2 kuukauden ikäisillä lapsilla (tutkimusnumero 16078) Kategoria: 2 (US PMR) Hankkia turvallisuustietoja ja diagnostisia lisätietoja lapsilta (> 2 kuukautta - < 18 vuotta). Turvallisuus ja teho lapsilla, joiden ikä vaihtelee 2 kuukaudesta 18 vuoteen Käynnissä Rekrytointi saatu loppuun. suunniteltu palautus: lokakuussa 2013 Hankkia kokemusta ja tietoa turvallisuudesta, tehosta ja plasman gadoliniumpitoisuuksista, kun Primovist-valmistetta annetaan 0 2 kuukauden ikäisille lapsille, jotka ovat saaneet lähetteen maksan magneettikuvaukseen mistä tahansa syystä. Turvallisuus, teho ja plasman gadoliniumpitoisuudet 0 2 kuukauden ikäisillä lapsilla Suunnitteilla toimitus: Q3/2015 (suunnitelma) Myyntiluvan ehdoissa mainitut tutkimukset Mikään yllä mainituista tutkimuksista ei ole myyntiluvan ehtona EU:ssa.
5 2.7 Yhteenveto riskienhallintasuunnitelman päivityksistä Merkittävät riskienhallintasuunnitelman päivitykset Version numero Päivämäärä Turvallisuustiedot Kommentti Ei lisäturvallisuustietoja niiden lisäksi, jotka kuvattiin tämän riskienhallintasuunnitelman (RMP) edellisessä versiossa. Mitään turvallisuustietoja ei jätetty pois. Rutiinipäivitys, mukaan lukien siirto uuteen EU-RMP-muotoon. Aihe "NSF:n mahdollinen riski annettaessa Primovist-valmistetta injektiona potilaille, joilla on kohtalainen munuaisten vajaatoiminta" lueteltiin erillisenä kohtana tärkeissä puuttuvissa tiedoissa riskienhallintasuunnitelman edellisessä versiossa. Tämä kohta on nyt sisällytetty tärkeään mahdolliseen riskiin "Nefrogeeninen systeeminen fibroosi (NSF)", sillä toimet riskien minimoinniksi koskevat potilaita, joilla on joko kohtalainen tai vaikea munuaisten vajaatoiminta, eikä NSF:ää ole raportoitu liittyneen Primovistvalmisteen käyttöön edes potilailla, joilla on vaikea munuaisten vajaatoiminta.
Propecia (finasteridi 0,2 ja 1 mg) tabletti , versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
RMP section VI.2 Elements for Public Summary
 RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
Proscar. 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio)
 28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Hoidon hyötyihin liittyvät asiat, joita ei tunneta (yksi lyhyt kappale kustakin käyttöaiheesta, enintään 50 sanaa)
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injektioneste, liuos 3.7.2015, Versio 2.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injektioneste, liuos 3.7.2015, Versio 2.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi)
 Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Physioneal 23.3.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Munuaisten toimintahäiriöitä esiintyy Euroopassa
Physioneal 23.3.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Munuaisten toimintahäiriöitä esiintyy Euroopassa
Enstilar , Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Enstilar 21.1.2016, Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Psoriaasi on yleinen ihosairaus, jossa iholle ilmestyy
Enstilar 21.1.2016, Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Psoriaasi on yleinen ihosairaus, jossa iholle ilmestyy
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Erivedge 150 mg kovat kapselit RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lokakuu 2013, v. 8.0 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ihon tyvisolusyöpä on yleisin
Erivedge 150 mg kovat kapselit RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lokakuu 2013, v. 8.0 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ihon tyvisolusyöpä on yleisin
19.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa , Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa 6.7.2016, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa 6.7.2016, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 DUTASTERIDE RATIOPHARM 0,5 MG PEHMEÄT KAPSELIT Päivämäärä: 16.3.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
DUTASTERIDE RATIOPHARM 0,5 MG PEHMEÄT KAPSELIT Päivämäärä: 16.3.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto
 EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
Bimatoprosti. 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Bimatoprosti 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kohonneen silmänpaineen alentaminen kroonista avokulmaglaukoomaa
Bimatoprosti 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kohonneen silmänpaineen alentaminen kroonista avokulmaglaukoomaa
Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi)
 EMA/577184/2015 Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi) Tämä on Repatha-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden avulla
EMA/577184/2015 Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi) Tämä on Repatha-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden avulla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 11 maaliskuuta 2016 Desloratadiini Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Heinänuha Pohjoismaiset tutkimukset
11 maaliskuuta 2016 Desloratadiini Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Heinänuha Pohjoismaiset tutkimukset
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Numeta G16E, Numeta G19E 2332015, Versio 30 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2 Julkisen yhteenvedon osiot VI21 Tietoa sairauden esiintyvyydestä Joillakin sairaalapotilailla ei välttämättä
Numeta G16E, Numeta G19E 2332015, Versio 30 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2 Julkisen yhteenvedon osiot VI21 Tietoa sairauden esiintyvyydestä Joillakin sairaalapotilailla ei välttämättä
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Praluent. 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Praluent 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Praluent-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Praluent 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Praluent-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto
 EMA/738120/2014 Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto Tämä on Ofev-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
EMA/738120/2014 Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto Tämä on Ofev-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
Nucala. 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto
 EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
Perusseikkoja julkista yhteenvetoa varten
 Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Pramipexol Stada. 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pramipexol Stada 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Pramipexol STADA 0,088 mg tabletti Pramipexol STADA 0,18 mg tabletti Pramipexol STADA
Pramipexol Stada 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Pramipexol STADA 0,088 mg tabletti Pramipexol STADA 0,18 mg tabletti Pramipexol STADA
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit , Versio 1.3
 Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit 30.5.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Emtricitabine
Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit 30.5.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Emtricitabine
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 TicoVac ja TicoVac Junior 29.12.2015, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Puutiaisaivotulehdus (TBE) on keskushermostoon
TicoVac ja TicoVac Junior 29.12.2015, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Puutiaisaivotulehdus (TBE) on keskushermostoon
Exviera-valmisteen (dasabuviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775993/2014 Exviera-valmisteen (dasabuviiri) enhallintasuunnitelman yhteenveto Tämä on Exviera-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
EMA/775993/2014 Exviera-valmisteen (dasabuviiri) enhallintasuunnitelman yhteenveto Tämä on Exviera-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 BREVIBLOC 27.2.2015, Versio 6.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä BREVIBLOC kuuluu beetasalpaajien lääkeryhmään. Sitä
BREVIBLOC 27.2.2015, Versio 6.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä BREVIBLOC kuuluu beetasalpaajien lääkeryhmään. Sitä
Julkisen yhteenvedon osiot
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Hunterin oireyhtymä on harvinainen geneettinen sairaus, jota esiintyy pääasiallisesti miehillä kaikissa etnisissä ryhmissä. Esiintyvyys
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Hunterin oireyhtymä on harvinainen geneettinen sairaus, jota esiintyy pääasiallisesti miehillä kaikissa etnisissä ryhmissä. Esiintyvyys
Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Latanoprost Pfizer 4.2.2014, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Glaukooma on toiseksi yleisin sokeuden aiheuttaja
Latanoprost Pfizer 4.2.2014, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Glaukooma on toiseksi yleisin sokeuden aiheuttaja
Ibandronat Stada 150 mg kalvopäällysteiset tabletit. 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
Abstral, EU:n riskienhallintasuunnitelma, versio 4.0
 Vaikuttavat aineet (kansainvälinen INN-nimi tai Fentanyyli (fentanyylisitraattina) yleinen nimi): Farmakoterapeuttinen ryhmä (ATC-koodi): Opioidianalgeetit, fenyylipiperidiinijohdannaiset, N02ABO3 Myyntiluvan
Vaikuttavat aineet (kansainvälinen INN-nimi tai Fentanyyli (fentanyylisitraattina) yleinen nimi): Farmakoterapeuttinen ryhmä (ATC-koodi): Opioidianalgeetit, fenyylipiperidiinijohdannaiset, N02ABO3 Myyntiluvan
Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/702765/2014 Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Harvoni-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/702765/2014 Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Harvoni-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Menjugate. 22.06.2016, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Menjugate 22.06.2016, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä N. meningitidis -bakteeri voi aiheuttaa infektion
Menjugate 22.06.2016, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä N. meningitidis -bakteeri voi aiheuttaa infektion
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
Olmesartan medoxomil STADA. 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
Morphine Orion. Pvm: , Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Morphine Orion Pvm: 19.12.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Tämä lääke on tarkoitettu voimakkaan kivun
Morphine Orion Pvm: 19.12.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Tämä lääke on tarkoitettu voimakkaan kivun
RMP section VI.2 Elements for Public Summary
 RMP section VI.2 Elements for Public Summary Product: Zarelle 75 microgram filmcoated tablet RMP: Version 1.0 DLP: 28-02-2013 MAH: Stragen Nordic A/S 32 VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden
RMP section VI.2 Elements for Public Summary Product: Zarelle 75 microgram filmcoated tablet RMP: Version 1.0 DLP: 28-02-2013 MAH: Stragen Nordic A/S 32 VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden
Lipanthyl Penta 145 mg , versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lipanthyl Penta 145 mg 15.9.2015, versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Fenofibraatti: Julkisen yhteenvedon osiot Fenofibraatti: Tietoa sairauden esiintyvyydestä Arviolta
Lipanthyl Penta 145 mg 15.9.2015, versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Fenofibraatti: Julkisen yhteenvedon osiot Fenofibraatti: Tietoa sairauden esiintyvyydestä Arviolta
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos. 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Symbicort Turbuhaler. Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Symbicort Turbuhaler Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on yleinen hengitysteiden tulehdussairaus,
Symbicort Turbuhaler Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on yleinen hengitysteiden tulehdussairaus,
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Kalii chloridum/glucosum B. Braun 1,5 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/glucosum B. Braun 3 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/natrii chloridum B. Braun 1,5 mg/ml
Kalii chloridum/glucosum B. Braun 1,5 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/glucosum B. Braun 3 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/natrii chloridum B. Braun 1,5 mg/ml
Nexplanon. 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN. Priapismi
 OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN VI1 EPAR-yhteenvetotaulukkojen osiot VI1.1 Yhteenvetotaulukko turvallisuustiedoista Yhteenveto turvallisuustiedoista - Priapismi -
OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN VI1 EPAR-yhteenvetotaulukkojen osiot VI1.1 Yhteenvetotaulukko turvallisuustiedoista Yhteenveto turvallisuustiedoista - Priapismi -
Alteplaasi Versio 3.3
 Boehringer Ingelheim Sivu 1 / 5 OSA VI.2 Osa VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä Erilaiset sairaudet ja tilat edellyttävät laskimokatetrien eli laskimoon asetettavien ohuiden
Boehringer Ingelheim Sivu 1 / 5 OSA VI.2 Osa VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä Erilaiset sairaudet ja tilat edellyttävät laskimokatetrien eli laskimoon asetettavien ohuiden
Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
NuvaRing. N.V. Organon. 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
Julkisen yhteenvedon osiot
 Daptomycin STADA 350 mg ja 500 mg injektio /infuusiokuiva aine liuosta varten 4.5.2017, versio V1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
Daptomycin STADA 350 mg ja 500 mg injektio /infuusiokuiva aine liuosta varten 4.5.2017, versio V1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana
 Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Lescol / Lescol Depot. 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lescol / Lescol Depot 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkea kolesteroli tarkoittaa kolesterolin
Lescol / Lescol Depot 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkea kolesteroli tarkoittaa kolesterolin
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
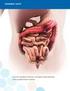 Tisseel 23.3.2015, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Kudosliimoja tai fibriiniliimoja käytetään haavojen
Tisseel 23.3.2015, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Kudosliimoja tai fibriiniliimoja käytetään haavojen
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Julkisen yhteenvedon osiot
 Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Skudex 75 mg / 25 mg kalvopäällysteinen tabletti , v. 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Skudex 75 mg / 25 mg kalvopäällysteinen tabletti 28.12.2015, v. 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Kivulla voi olla
Skudex 75 mg / 25 mg kalvopäällysteinen tabletti 28.12.2015, v. 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Kivulla voi olla
Pronaxen 250 mg tabletti OTC , Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pronaxen 250 mg tabletti OTC 25.9.2015, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Pronaxen 250 mg on tarkoitettu
Pronaxen 250 mg tabletti OTC 25.9.2015, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Pronaxen 250 mg on tarkoitettu
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Elidel 10 mg/g emulsiovoide 8.12.2015, Versio 11 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ekseemaa esiintyy lähinnä lapsilla
Elidel 10 mg/g emulsiovoide 8.12.2015, Versio 11 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ekseemaa esiintyy lähinnä lapsilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 JAYDESS 13,5 mg, kohdunsisäinen ehkäisin 5/2014 versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
JAYDESS 13,5 mg, kohdunsisäinen ehkäisin 5/2014 versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
Kovaltry-valmisteen (oktokogialfa) riskienhallintasuunnitelman yhteenveto
 EMA/1560/2016 Kovaltry-valmisteen (oktokogialfa) riskienhallintasuunnitelman yhteenveto Tämä on Kovaltry-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet, joiden avulla
EMA/1560/2016 Kovaltry-valmisteen (oktokogialfa) riskienhallintasuunnitelman yhteenveto Tämä on Kovaltry-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet, joiden avulla
OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EU RMP Lääkeaine Bikalutamidi Version numero 2 Päivämäärä 2 toukokuu 2014 OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT Bikalutamidi (CASODEX 1 ) on hormonaalinen
EU RMP Lääkeaine Bikalutamidi Version numero 2 Päivämäärä 2 toukokuu 2014 OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT Bikalutamidi (CASODEX 1 ) on hormonaalinen
Riskienhallintasuunnitelman julkinen yhteenveto Imlygic (talimogeenilaherparepveekki)
 EMA/713818/2015 Riskienhallintasuunnitelman julkinen yhteenveto Imlygic (talimogeenilaherparepveekki) Tämä on Imlygic-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/713818/2015 Riskienhallintasuunnitelman julkinen yhteenveto Imlygic (talimogeenilaherparepveekki) Tämä on Imlygic-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Remeron. 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
PLENADREN EU-Riskienhallintasuunnitelma, versio 3.2. Julkisen yhteenvedon osa-alueet. Katsaus taudin epidemiologiaan. Yhteenveto hoidon hyödyistä
 PLENADREN EU-Riskienhallintasuunnitelma, versio 3.2 VI.2 VI.2.1 Julkisen yhteenvedon osa-alueet Katsaus taudin epidemiologiaan PLENADREN sisältää hydrokortisonia ja sitä käytetään lisämunuaisten vajaatoiminnan
PLENADREN EU-Riskienhallintasuunnitelma, versio 3.2 VI.2 VI.2.1 Julkisen yhteenvedon osa-alueet Katsaus taudin epidemiologiaan PLENADREN sisältää hydrokortisonia ja sitä käytetään lisämunuaisten vajaatoiminnan
Riskienhallintasuunnitelman julkinen yhteenveto Blincyto (blinatumomabi)
 EMA/642231/2015 Riskienhallintasuunnitelman julkinen yhteenveto Blincyto (blinatumomabi) Tämä on Blincyto-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/642231/2015 Riskienhallintasuunnitelman julkinen yhteenveto Blincyto (blinatumomabi) Tämä on Blincyto-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO ORION OYJ
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
Riskienhallintasuunnitelman julkinen yhteenveto Kyprolis (karfiltsomibi)
 EMA/639793/2015 Riskienhallintasuunnitelman julkinen yhteenveto Kyprolis (karfiltsomibi) Tämä on Kyprolis-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/639793/2015 Riskienhallintasuunnitelman julkinen yhteenveto Kyprolis (karfiltsomibi) Tämä on Kyprolis-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Extraneal peritoneaalidialyysineste 8.10.2015, Versio 6 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä On arvioitu, että yli 10 % Euroopan väestöstä
Extraneal peritoneaalidialyysineste 8.10.2015, Versio 6 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä On arvioitu, että yli 10 % Euroopan väestöstä
innohep Päivämäärä: , Versio 5 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 innohep Päivämäärä: 27.2.2017, Versio 5 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Käyttöaihe: veritulppien hoito Jalkojen isoissa
innohep Päivämäärä: 27.2.2017, Versio 5 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Käyttöaihe: veritulppien hoito Jalkojen isoissa
Potilasturvallisuuden edistämisen ohjausryhmä. Potilasturvallisuus on yhteinen asia! Potilasturvallisuus. Kysy hoidostasi vastaanotolla!
 Potilasturvallisuus on yhteinen asia! Potilasturvallisuus on osa hyvää hoitoa kattaa tutkimuksen, hoidon ja laitteiden turvallisuuden tarkoittaa myös sitä, ettei hoidosta aiheutuisi potilaalle haittaa
Potilasturvallisuus on yhteinen asia! Potilasturvallisuus on osa hyvää hoitoa kattaa tutkimuksen, hoidon ja laitteiden turvallisuuden tarkoittaa myös sitä, ettei hoidosta aiheutuisi potilaalle haittaa
Physioneal RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Physioneal 13.5.2016, Versio 5.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä On arvioitu, että yli 10 % Euroopan väestöstä sairastaa
Physioneal 13.5.2016, Versio 5.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä On arvioitu, että yli 10 % Euroopan väestöstä sairastaa
Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/661227/2015 Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Genvoya-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/661227/2015 Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Genvoya-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Litalgin-tabletti Litalgin-peräpuikko Litalgin-injektioneste, liuos (metamitsolinatrium ja pitofenonihydrokloridi) , versio 1.
 Litalgin-tabletti Litalgin-peräpuikko Litalgin-injektioneste, liuos (metamitsolinatrium ja pitofenonihydrokloridi) 21.6.2017, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen
Litalgin-tabletti Litalgin-peräpuikko Litalgin-injektioneste, liuos (metamitsolinatrium ja pitofenonihydrokloridi) 21.6.2017, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO. Lynparza-valmisteen (olaparibi) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/681881/2014 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lynparza-valmisteen (olaparibi) riskienhallintasuunnitelman (RMP) yhteenveto VI.2 Julkisen yhteenvedon osiot Tämä on Lynparza-valmisteen
EMA/681881/2014 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lynparza-valmisteen (olaparibi) riskienhallintasuunnitelman (RMP) yhteenveto VI.2 Julkisen yhteenvedon osiot Tämä on Lynparza-valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Duphalac Fruit 667 mg/ml , versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Duphalac Fruit 667 mg/ml 11.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ummetus (epäsäännöllinen vatsan toiminta,
Duphalac Fruit 667 mg/ml 11.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ummetus (epäsäännöllinen vatsan toiminta,
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Telmisartan/ ratiopharm 4.12.2014, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Telmisartan/ ratiopharm on angiotensiini
Telmisartan/ ratiopharm 4.12.2014, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Telmisartan/ ratiopharm on angiotensiini
Ethambutol Orion 500 mg tabletit Päivämäärä: , Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ethambutol Orion 500 mg tabletit Päivämäärä: 21.10.2016, Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Etambutoli on
Ethambutol Orion 500 mg tabletit Päivämäärä: 21.10.2016, Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Etambutoli on
Vokanamet (kanagliflotsiini/metformiini) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/137565/2014 Vokanamet (kanagliflotsiini/metformiini) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Vokanamet-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/137565/2014 Vokanamet (kanagliflotsiini/metformiini) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Vokanamet-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 ETORICOXIB RATIOPHARM KALVOPÄÄLLYSTEISET TABLETIT Päivämäärä: 4.8.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
ETORICOXIB RATIOPHARM KALVOPÄÄLLYSTEISET TABLETIT Päivämäärä: 4.8.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/601943/2014 Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Trulicity-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
EMA/601943/2014 Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Trulicity-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
Xultophy-valmisteen riskienhallintasuunnitelman (RMP) julkinen yhteenveto (degludekinsuliini/liraglutidi)
 Xultophy-valmisteen riskienhallintasuunnitelman (RMP) julkinen yhteenveto (degludekinsuliini/liraglutidi) Tämä on Xultophy-valmisten riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
Xultophy-valmisteen riskienhallintasuunnitelman (RMP) julkinen yhteenveto (degludekinsuliini/liraglutidi) Tämä on Xultophy-valmisten riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO. Moventig-valmisteen (naloksegoli) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/611606/2014 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Moventig-valmisteen (naloksegoli) riskienhallintasuunnitelman (RMP) yhteenveto VI.2 Julkisen yhteenvedon osiot Tämä on Moventig-valmisteen
EMA/611606/2014 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Moventig-valmisteen (naloksegoli) riskienhallintasuunnitelman (RMP) yhteenveto VI.2 Julkisen yhteenvedon osiot Tämä on Moventig-valmisteen
Ohje: Miten haen aineistoa Terveysportin verkkopalvelusta
 Ohje: Miten haen aineistoa Terveysportin verkkopalvelusta a) Verkkopalvelun ulkoasu...1 b) Aineiston hakeminen Terveysportissa...5 c) Aineiston tulostaminen Terveysportissa...7 a) Verkkopalvelun ulkoasu
Ohje: Miten haen aineistoa Terveysportin verkkopalvelusta a) Verkkopalvelun ulkoasu...1 b) Aineiston hakeminen Terveysportissa...5 c) Aineiston tulostaminen Terveysportissa...7 a) Verkkopalvelun ulkoasu
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 22 helmikuuta 2016 Drospirenoni/etinyyliestradioli Versionumero: 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Suun kautta
22 helmikuuta 2016 Drospirenoni/etinyyliestradioli Versionumero: 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Suun kautta
Numeta G13E, Numeta G16E ja Numeta G19E infuusioneste, emulsio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Numeta G13E, Numeta G16E ja Numeta G19E infuusioneste, emulsio 31.3.2016, Versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Numeta G13E, Numeta G16E ja Numeta G19E infuusioneste, emulsio 31.3.2016, Versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
VALGANCICLOVIR TEVA RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 VALGANCICLOVIR TEVA Päivämäärä: 17.7.2013, Versio: 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Useimmat ihmiset joutuvat
VALGANCICLOVIR TEVA Päivämäärä: 17.7.2013, Versio: 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Useimmat ihmiset joutuvat
