Kurssin esittely. Kurssin esittely on monisteella KE4 Metallit ja materiaalit
|
|
|
- Sami Mäki
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 Kurssin esittely 18. huhtikuuta :34 Kurssin esittely on monisteella KE4 Metallit ja materiaalit Tiedonhakutehtävät kannattaa hoitaa mahdollisimman nopeasti pois alta! Tiedonhakutehtävät saa palauttaa myös sähköisessä muodossa! Kertaustehtäviä s. 14. t. 1. a) X = Magnesium, Y = Kloori b) Y eli kloori c) Magnesium hapettuu ja kloori pelkistyy (magnesium luovuttaa elektronin kloorille) d) Kloori on hapetin ja magnesium pelkistin e) s. 14. t. 2. a) b) c) s. 14. t. 3. a) b) Verranto Kemian tehtävien tekeminen tietokoneen näppäimistöllä on vielä nykytekniikalla epäkäytännöllistä. No, tulipahan testattua. :) c) KE4 Sivu 1
2 KE4 Sivu 2 Hapetusluvut 22. huhtikuuta :05 Metalliatomi luovuttaa ulkoelektroninsa, joten se hapettuu Epämetalli vastaanottaa elektroneja, joten se pelkistyy Hapetus-pelkistysreaktio = Elektronien siirtymistä aineelta toiselle Elektronien luovuttaja hapettuu ja sen hapetusluku kasvaa Elektronien vastaanottaja (elektronegatiivisempi) pelkistyy ja sen hapetusluku pienenee s. 36. t. 22. a) Ei, sillä vaikka tuote on ioniyhdiste, lähtöaineet ovat jo ioneina b) Ei, sillä kalsium on myös tuotteen varauksellinen osa c) On, sillä atomit muodostavat ioniyhdisteen, jolloin kupari luovuttaa fluorille elektroneja d) Ei, sillä vety on myös tuotteen varauksellinen osa e) On, koska bariumhydroksidissa barium luovuttaa hydroksidi-ioneille elektronejaan s. 36. t. 23. a) -I b) +I c) +V d) -I e) -I f) -I Alkuaineena olevan atomin hapetusluku on 0 Vedyn hapetusluku on yleensä +I, mutta metallihydrideissä -I Hapen hapetusluku on yleensä -II, mutta peroksideissa -I Yhdisteissä hapetuslukujen summa on nolla. Atomien lukumäärät huomioidaan summaa laskettaessa. Yksiatomisen ionin hapetusluku = ionin varaus Moniatomisen ionin hapetuslukujen summa = ionin varaus
3 KE4 Sivu 3 Reaktioyhtälön tasapainottaminen hapetuslukujen avulla 22. huhtikuuta :35 Selvitetään hapetuslukujen avulla, mikä aine hapettuu ja mikä pelkistyy Hapetusluku kasvaa -> hapettuminen Hapetusluku pienenee -> pelkistyminen Tasapainotetaan elektronien määrä laittamalla sopivat kertoimet hapettuvaa ja pelkistyvää alkuainetta sisältävän aineen kaavan eteen Tasapainotetaan lopuksi muiden aineiden määrä s. 30. esim I +V -II +I +V +II +I -II +II -II Hopea hapettuu kokonaan ja typpi pelkistyy osittain s. 36. t. 25. a) -IV b) +V c) +VII d) +III e) +I f) +III g) -I h) +IV i) +III j) +V k) +IV l) +V
4 Metallien jännitesarja 25. huhtikuuta :43 Vety on epämetalli Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H Cu Hg At Pt Au Epäjalot metallit Jalot metallit Hyvä hapettumiskyky ja heikko pelkistymiskyky Heikko hapettumiskyky ja hyvä pelkistymiskyky Vety jakaa metallit jaloihin ja epäjaloihin metalleihin Metallit järjestyksessä pienenevän hapettumiskykynsä mukaan (mitä jalompi, sitä heikommin hapettuu) Jännitesarjan avulla voidaan ennustaa metallien välisiä hapettumis-pelkistymisreaktioita Epäjalot metallit esiintyvät luonnossa vain yhdisteinä Jaloja metalleja esiintyy luonnossa myös puhtaina aineina Ennen vetyä olevat metallit (=epäjalot metallit) reagoivat happojen kanssa vetyä vapauttaen Jalot metallit hapettuvat vain hapettavien happojen kanssa (typpihappo ) Metallien hapettuminen ja pelkistyminen Epäjalommalle metallille tapahtuu hapettuminen (=elektronien luovuttamista), jos se on alkuainemuotoisena metalliatomina mukana reaktiossa Jalommalle metallille tapahtuu pelkistyminen (=elektronien vastaanottamista), jos se on ionisoituneena metallikationina mukana reaktiossa Esim. t. 15. f), jossa alumiini epäjalompana metallina hapettuu s. 35. t. 14. a) Ei tapahdu b) c) d) Ei tapahdu Normaalipotentiaalitaulukko Sisältää tietoa muidenkin aineiden kuin metallien kyvystä hapettua tai pelkistyä Taulukkoa tulkitsemalla voidaan edelleen ennustaa taulukossa esiintyvien aineiden välisiä reaktioita Taulukossa kaikille aineille on esitetty pelkistymispotentiaaliarvo, mutta ne aineet, joilla arvo on negatiivinen, ovat huonosti pelkistyviä (ja hyviä hapettumaan) Hapettumispotentiaaliarvo saadaan, kun käännetään reaktioyhtälö ja otetaan vastaluku pelkistymispotentiaaliarvosta Jos reaktiossa mukana olevien aineiden hapettumis- (helpommin hapettuvalta aineelta) ja pelkistymis- (helpommin pelkistyvältä aineelta) potentiaaliarvojen summa on positiivinen, on kyseinen reaktio spontaani eli tapahtuu itsestään Jos potentiaaliarvojen summa on negatiivinen, ei reaktio tapahdu ilman ulkoista pakotetta Metallien jännitesarja on myös MAOLissa sivulla 146. Li K Ba Ca Na Mg Al Zn Cr Fe Co Nyi Sn Pb H Cu Hg Ag Au Osa metalleista liukenee jopa veteen. Esimerkiksi litium on tällainen metalli. s. 35. t. 17. a) b) -> Reaktio ei tapahdu Kohdat c-> paperilla (tunnilla loppui paperi kesken) c) -> Reaktio on spontaani eli tapahtuu KESKEN KE4 Sivu 4
5 KE4 Sivu 5 Hapettumis-pelkistymisreaktioiden sovelluksia 29. huhtikuuta :32 = Kappale 3 Akut ovat ladattavia, paristot kertakäyttöisiä Sähköpari eli galvaaninen kenno (eli paristo) Spontaanit hapettumis-pelkistymisreaktiot ovat eksotermisia tapahtumia Vapautunut lämpöenergia voidaan muuttaa sähköenergiaksi Elektronit siirtyvät ulkoista johdinta pitkin hapettuvalta aineelta pelkistyvälle aineelle Suolasilta ylläpitää sähkövarausten tasapainoa liuoksissa
6 KE4 Sivu 6 Sähkömäärä elektrolyysissä 6. toukokuuta :02 Symboli Suure Yksikkö Q Sähkömäärä (varaus) As I Virta A t Aika s F Faradayn vakio n Ainemäärä mol z Ionin varauksen itseisarvo
7 Metallit 7. toukokuuta :12 Mitä on kova vesi? Kova vesi sisältää kalsium- ja magnesiumioneja, joita on tullut kalsium- ja magnesiumkarbonaatin liukenemisesta on saippua Kova vesi siis kuluttaa saippuaa, joten saippuan annostelu pitää moninkertaistaa alueilla, joilla vesi on kovaa Sivuryhmien metallit Saadaan malmeista rikastamalla Elektroneja d- tai f-orbitaaleilla Siirtymäalkuaineet Ti, V, Cr, Mn, Fe, Co, Ni, Cu d-lohkon metalli, joka muodostaa ainakin yhden ionin, jolla on osittain täyttynyt d-orbitaali Yhdisteet värillisiä (virittyminen) Katalyyttejä Kompleksinmuodostajia Muutkin metallit voivat toimia kompleksi-ionien keskusatomeina, mutta vain siirtymäalkuaineiden kompleksi-ioneilla on selkeä väri Siirtymäalkuaineiden ioneissa osittain täyttyneen d-orbitaalin ionit hyppivät myös 4d-orbitaalille, jolloin vapautuu energiaa, joka sitoutuu elektronin palatessa korkeammalle energiatasolle (3d) 3d-orbitaalin energiataso on hieman korkeampi kuin 4s-orbitaalin Saippuan toimintaperiaate: Hiiliketju on pooliton ja siten hydrofobinen Karboksyyliryhmä on poolinen ja siten hydrofiilinen Hydrofobinen osa kiinnittyy rasvatahraan ja hydrofiilinen osa mahdollistaa sen, että saippua saa rasvatahran irtoamaan veteen Orbitaalien täyttymisjärjestys Siirtymäalkuaineiden ionit eivät kuitenkaan noudata tätä altistuessaan säteilylle, sillä silloin niiden 4s-orbitaalin elektroneja pomppii 3d-orbitaalille :D Kompleksi-ionit Keskusatomina yleensä siirtymäalkuaine Ligandina molekyyli tai ioni, jolla on vapaita ulkoelektroneja Koordinaatioluku kertoo, kuinka moneen ligandiin keskusatomilla on sidos Sekä keskusatomi että ligandit vaikuttavat kompleksin väriin s. 83. t. 83. Kohta a Kompleksiioni Kato kirjasta :-DDD Keskusatomi Keskusatomin varaus Koordinaatio luku Ligandit Avaruusrakenne Ag - hopea +1 2 H20 - vesi lineaarinen b Co - koboltti +2 4 Cl- - kloridi-ioni Tasoneliö tai tetraedri c Co - koboltti +3 6 CN- - syanidi-ioni oktaedri d Cr - kromi +3 6 H2O - vesi ja OH- - hydroksidi-ioni Metallit biokemian aineina Kalium ja natrium Toimivat solunesteiden sähkötasapainon ylläpitäjinä elimistössä Magnesium Hermosolut, lihastoiminta ja entsyymit Kalsium Luusto, veren hyytyminen ja lihastoiminta oktaedri KE4 Sivu 7
8 Epämetallit 16. toukokuuta :38 Yksiatomisina esiintyvät Jalokaasut Kaksiatomisina esiintyvät Halogeenit, happi, typpi ja vety Jättiläismolekyyleinä esiintyvät Hiili, (fosfori) Epämetalleista ainoastaan grafiittimuotoinen hiili johtaa sähköä -> Lyijykynällä voi tehdä paperipalalle potentiometrin Kaasuja Vety, jalokaasut, typpi, happi, fluori, kloori Epämetallit Fysikaaliset ja kemialliset ominaisuudet poikkeavat metallien ominaisuuksista: Alhaisemmat sulamis- ja kiehumispisteet Eivät johda sähköä (poikkeuksena grafiitti) Typpi N Ilmasta 70 til-% Kolmoissidoksellisen typpimolekyylin sidosenergia (994 kj/mol) otetaan hyötykäyttöön esim. räjähdysaineissa Tärkeimmät typen yhdisteet ovat ammoniakki ( ja typpihappo ( Ammoniakkia valmistetaan typpi- ja vetykaasusta Haber-Boschmenetelmällä Typpihappoa valmistetaan ammoniakista Ostwaldin menetelmällä Vety on epämetalli (Sherlock ) Vetyfluoridissa ja vetykloridissa olevat sidokset ovat kovalenttisia sidoksia, mutta ne muistuttavat suuren elektronegatiivisuuseron vuoksi ominaisuuksiltaan ionisidoksia. Katso taulukkokirjan sivu 137 s. 99. t. 91. (löytyy myös paperilta) a) b) c) d) tai e) f) g) h) Typpihappo Käytetään Lannoiteteollisuudessa (ammoniumnitraatin valmistukseen) Lääkkeiden valmistukseen Väriaineiden valmistukseen Räjähdysaineiden valmistukseen Typen oksidit ja Ilmakehässä liikenteen päästöistä Happamoittavat sadevettä liuetessaan siihen (hapan laskeuma, happosade) Vaurioittaa kasvillisuutta Lisää maaperän happamuutta Pahimmillaan muodostaa fotokemiallista sumua (sumua, jossa ei ole vettä - Kiinan kaupunkisumut ovat tällaisia) Happi ja otsoni Ilmakehässä noin 21 til-% Veteen liuenneena noin 3 til-% Maankuoren yleisin alkuaine, noin 50 m-% Ihmiskehon yleisin alkuaine, noin 65 m-% Voimakkaita hapettimia, reaktiivisia Otsonin hajotessa muodostuu voimakkaasti reaktiivisia happiradikaaleja Oksidit Happi muodostaa muiden alkuaineiden kanssa helposti oksideja Epämetallioksidit ovat veteen liuetessaan happamuuden aiheuttajia Esim. rikkitrioksidista muodostuu rikkihappoa Metallioksidit ovat yleensä emäksisiä vesiliuoksina Esim. kalsiumoksidista muodostuu kalsiumhydroksidia KE4 Sivu 8
9 Hapen valmistusmenetelmiä Vetyperoksidia hajottamalla hapeksi ja vedeksi Soluissa tähän oma peroksidaasi-entsyymi Hajottamalla vettä elektrolyysillä hapeksi ja vedyksi (Hoffmanin laitteisto) KE4 Sivu 9
10 Polymeerit 20. toukokuuta :24 Mitä tarkoittaa monomeeri? Yhtä polymeerimolekyylin yksikköä Mitä tarkoittaa makromolekyyli? Suurta molekyyliä Mitä muovilaatuja tunnet? PET PE-HD PVC PE-LD PP PS Mistä rakentuvat Hiilihydraatit? Monosakkarideista Proteiinit? Aminohapoista Nukleiinihapot? Emäksistä, deoksiriboosista tai riboosista sekä fosfaatista -> Nukleotideista Mihin solu tarvitsee Hiilihydraatteja? Proteiineja? Nukleiinihappoja? Mikä rakenneyksikkö koostuu selluloosan rakenteessa? Glukoosi Mitä tarkoittaa additioreaktio? Pienen molekyylin lisääminen toiseen molekyyliin, johtaa usein kaksois- tai kolmoissidoksen purkautumiseen Mitä tarkoittaa kondensaatioreaktio? Veden irrottamista molekyylistä Polymeerien luokittelu Alkuperän mukaan Synteettiset polymeerit Laboratoriossa valmistettavat Esim. muovit ja tekokuidut Biopolymeerit eli luonnon polymeerit Elävien solujen valmistamat Esim. hiilihydraatit ja proteiinit TAI Valmistusprosessin mukaan Additiopolymeerit Esim. Polyeteeni (PE) Kondensaatiopolymeerit Esim. polyesteri ja polyamidi Synteettiset polymeerit Muovit Rakentuvat peruspolymeereistä ja käyttökohteen mukaan valituista lisäaineista Kestomuovit, uudelleen muokattavia eli amorfisia Polymeeriketjujen välillä vain dispersiovoimia, joten muovi palautuu muokkaamisen jälkeen samaksi rakenteeksi Kertamuovit Polymeeriketjujen välillä kovalenttisia sidoksia, joten polymeeriketjuja ei voi irrottaa toisistaan ja koota takaisin samaan rakenteeseen Synteettiset kumit eli elastomeerit Vulkanoitu kumi = luonnonkumi (kautsu), joka käsitelty rikillä Luonnonkumin dispersiovoimat korvautuvat rikin mahdollistamilla kovalenttisilla sidoksilla Synteettinen kumi eli neopreeni Tekokuidut Lankamaisia polymeerejä Suuri vetolujuus ja kestävyys Esim. viskoosi, polyamidi ja polyesteri Styrox = polystyreeni Polymeroituminen Polyadditio- eli liittymisreaktio Kaksoissidoksia sisältävät monomeerit liittyvät yhteen polymeeriksi, kun kaksoissidokset aukeavat Polymeerin rakenteessa toistuuu aina uudestaan ja uudestaan sama atomiryhmä, jota kutsutaan toistuvaksi yksiköksi. Polymeerin rakenne esitetään joko katkaistuna ketjuna tai lyhemmin kirjoittamalla vain yhden toistuvan yksikön kaava Muovilaatuja Monomeeri Polymeerin Esimerkki käyttökohteesta Eteeni Polyeteeni (PE) Muovipussit Propeeni Polypropeeni (PP) Muovinarut Kloorieteeni eli vinyylikloridi Polyvinyylikloridi (PVC) Viemäriputki Metyylimetakrylaatti KE4 Sivu 10
11 Metyylimetakrylaatti Kesken Polykondensaatioreaktio Molekyylien liittymistä yhteen siten, että samalla lohkeaa pois jokin pienempi molekyyli, kuten vesi Funktionaaliset ryhmät reagoivat ja muodostuu uusi sidos Esim. polyesteri: happo + alkoholi -> polyesteri + vesi Vety Kevyin alkuaine Orgaanisissa molekyyleissä Vedessä Hyvä pelkistin (metallin valmistus oksidista) Rasvojen kovetin Hydraus vedyn avulla Tulevaisuuden energianlähde Ongelmana räjähdysherkkyys FUUSIO Voidaan valmistaa Hajottamalla vettä elektrolyyttisesti (Hoffmanin laite) Metallien (esim. Pb, Sn, Ni, Zn) ja happojen reaktiolla Aktiivisten metallien (alkalimetallit) reaktiolla veden kanssa Fosfori, Yleisin fosforia sisältävä mineraali on apatiitti Alkuaineena esiintyy yleisimmin kahdessa eri allotropisessa muodossa, valkoisena ( ) ja punaisena fosforina Käytetään lannoitteissa ja pesuaineissa Aiheuttaa vesistöjen rehevöitymistä Rikki Luonnossa myös vapaana alkuaineena Useita allotropisia muotoja, tavallisin Yleisimmät yhdisteet sulfideja Fossiilisissa polttoaineissa! Muodostuu rikin oksideja polttoaineen palaessa Muuttavat sadeveden happamaksi Rikkihappo tärkein rikin teollisista yhdisteistä Luonnon polymeerit Polysakkaridit eli hiilihydraatit Muodostuvat monosakkarideista kondensaatioreaktiolla (glykosidinen sidos happisillan avulla) Esim. glukoosi, tärkkelys, selluloosa Polypeptidit eli proteiinit Muodostuvat aminohapoista kondensaatioreaktiolla (peptidisidos) Esim. insuliini, hemoglobiini, albumiini Polynukleotidit eli nukleiinihapot Muodostuvat nukleotideistä kondensaatioreaktiolla (fosforiesterisidos) Nukleotidi muodostuu sokeriosasta, fosfaattiosasta ja typpeä sisältävästä emäsosasta Monosakkaridit, aminohapot ja nukleotidit ovat siis monomeerejä! Aminohapon kemiallinen kaava voidaan muodostaa taulukkokirjan sivun 157 kaavojen avulla siirtämällä typeltä yksi protoni hapelle. Aminohapon hapan karboksyyliryhmä nimittäin luovuttaa helposti emäksiselle aminoryhmälle protonin. KE4 Sivu 11
12 KE4 Sivu 12 Hiilihydraatit 21. toukokuuta :51 Hiilihydraattien luokittelu Sokerit Eivät ole polymeerejä! Monosakkaridit Esim. glukoosi ja fruktoosi Disakkaridit Esim. laktoosi ja sakkaroosi Glukoosi Polysakkaridit Varastopolysakkaridit Esim. tärkkelys ja glykogeeni Rakennepolysakkaridit Esim. selluloosa ja kitiini Glukoosi voi esiintyä avoketjuisena ja rengasrakenteisena Avoketjuisena Glykosidisen sidoksen muodostuminen Kondensaatioreaktiolla Vettä lohkeaa Glykogeeni Ihmisen tärkein varastopolysakkaridi on glykogeeni, joka myös rakentuu glukoosiyksiköistä. Sen rakenne on hyvin samankaltainen kuin amylopektiinin, mutta vielä haarautuneempi
13 Proteiinit 21. toukokuuta :04 Aminohapot Aminohappoja on luonnossa yli sata Proteiineissa niitä on 23 erilaista Aikuiselle ihmiselle välttämättömiä aminohappoja, joita elimistö ei pysty syntetisoimaan, vaan on saatava ravinnosta, on kahdeksan Kaikki proteiineissa olevat aminohapot ovat α-aminohappoja, eli niissä karboksyyliryhmä ja aminoryhmä ovat kiinni samassa hiilessä Tuo ensimmäinen hiili on se α-hiili Aminohapon kemiallinen kaava voidaan muodostaa taulukkokirjan sivun 157 kaavojen avulla siirtämällä typeltä yksi protoni hapelle. Aminohapon hapan karboksyyliryhmä nimittäin luovuttaa helposti emäksiselle aminoryhmälle protonin. Peptidisidoksen muodostuminen Kyseessä on kondensaatioreaktio, jossa lohkeaa vettä s t a) 2 b) 3 c) Valiini, alaniini ja treoniini Peptidisidos Miten siirtäjä-rna:t kiinnittävät aminohapot toisiinsa järjestyessään lähetti-rna:n mukaan? KE4 Sivu 13
14 Läksyt 18. huhtikuuta :59 s. 14. t. 3, 5 t. 25, 26, 28 - Tee hapetuslukumenetelmän avulla! Keskustele kokeellisen työn ajankohdasta, t. 32, katso partakoneen terän liuotustulokset vanhoista kansioista Tee partakonetyöselostus sivulta 140 kerhon mittaustulosten perusteella s , 16, 17 t. 35. t. 54, 56, työt 4 ja 5 Työt 4 ja 5, t. 63, 65 Työt 4 ja 5, s. 80. t. 67, (s. 82. t. 79.) Monisteet Kokeellinen työ pohjatunnille Kokeessa on ainakin 1 tehtävä kappaleesta 5 ja 1 tehtävä kappaleesta 6 Otava: Abikemia Työselostus KE4 Sivu 14
15 KE4 Sivu 15 Yo-kirjoitukset 21. toukokuuta :14 Otava: abikemia Kesälomasta "2 viikkoa per kurssi" Tärkeitä aiheita 1. kurssin kpl 6 1. kurssin kpl 2:n poolisuusasiat 2. kurssissa paljon kaikenlaista hyödyllistä teoriaa Suurin osa sanallisesta asiasta 1., 2., ja 4. kurssissa 3. ja 5. kurssissa laskentaa Syventävää tietoa -osiot
luku2 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen
 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Metallit materiaaleina. kappale 4
 Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Biomolekyylit ja biomeerit
 Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Käsitteitä. Hapetusluku = kuvitteellinen varaus, jonka atomi saa elektronin siirtyessä
 Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Sähkökemia. Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali
 Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
KE04. Kurssikalvot. Tuomas Hentunen. Kevät Tuomas Hentunen KE04 Kevät / 24
 KE04 Kurssikalvot Tuomas Hentunen Kevät 2016 Tuomas Hentunen KE04 Kevät 2016 1 / 24 Metallien jännitesarja Metallien sähkökemiallinen jännitesarja on muodostettu metallien ja vedyn kasvavan pelkistymiskyvyn
KE04 Kurssikalvot Tuomas Hentunen Kevät 2016 Tuomas Hentunen KE04 Kevät 2016 1 / 24 Metallien jännitesarja Metallien sähkökemiallinen jännitesarja on muodostettu metallien ja vedyn kasvavan pelkistymiskyvyn
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kondensaatio ja hydrolyysi
 Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
Kondensaatio ja hydrolyysi REAKTIOT JA ENERGIA, KE3 Määritelmä, kondensaatioreaktio: Kondensaatioreaktiossa molekyylit liittyvät yhteen muodostaen uuden funktionaalisen ryhmän ja samalla molekyylien väliltä
b) Reaktio Zn(s) + 2 Ag + (aq) Zn 2+ (aq) + 2 Ag (s) tapahtuu galvaanisessa kennossa. Kirjoita kennokaavio eli kennon lyhennetty esitys.
 KE4-KURSSIN KOE Kastellin lukio 2013 Vastaa kuuteen (6) kysymykseen. Tee pisteytysruudukko. 1. Tarkastele jaksollista järjestelmää ja valitse siitä a) jokin jalometalli. b) jokin alkuaine, joka reagoi
KE4-KURSSIN KOE Kastellin lukio 2013 Vastaa kuuteen (6) kysymykseen. Tee pisteytysruudukko. 1. Tarkastele jaksollista järjestelmää ja valitse siitä a) jokin jalometalli. b) jokin alkuaine, joka reagoi
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Liittymis- eli additioreaktio Määritelmä, liittymisreaktio:
 Liittymis- eli additioreaktio Määritelmä, liittymisreaktio: REAKTIOT JA ENERGIA, KE3 Liittymis- eli additioreaktiossa molekyyliin, jossa on kaksois- tai kolmoissidos, liittyy jokin toinen molekyyli. Reaktio
Liittymis- eli additioreaktio Määritelmä, liittymisreaktio: REAKTIOT JA ENERGIA, KE3 Liittymis- eli additioreaktiossa molekyyliin, jossa on kaksois- tai kolmoissidos, liittyy jokin toinen molekyyli. Reaktio
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
EPIONEN Kemia 2015. EPIONEN Kemia 2015
 EPIONEN Kemia 2015 1 Epione Valmennus 2014. Ensimmäinen painos www.epione.fi ISBN 978-952-5723-40-3 Painopaikka: Kopijyvä Oy, Kuopio Tämän teoksen painamiseen käytetty paperi on saanut Pohjoismaisen ympäristömerkin.
EPIONEN Kemia 2015 1 Epione Valmennus 2014. Ensimmäinen painos www.epione.fi ISBN 978-952-5723-40-3 Painopaikka: Kopijyvä Oy, Kuopio Tämän teoksen painamiseen käytetty paperi on saanut Pohjoismaisen ympäristömerkin.
Biopolymeerit. Biopolymeerit ovat kasveissa ja eläimissä esiintyviä polymeerejä.
 Biopolymeerit Biopolymeerit ovat kasveissa ja eläimissä esiintyviä polymeerejä. Tärkeimpiä biopolymeerejä ovat hiilihydraatit, proteiinit ja nukleiinihapot. 1 Hiilihydraatit Hiilihydraatit jaetaan mono
Biopolymeerit Biopolymeerit ovat kasveissa ja eläimissä esiintyviä polymeerejä. Tärkeimpiä biopolymeerejä ovat hiilihydraatit, proteiinit ja nukleiinihapot. 1 Hiilihydraatit Hiilihydraatit jaetaan mono
Elektrolyysi Anodilla tapahtuu aina hapettuminen ja katodilla pelkistyminen!
 Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
a) Puhdas aine ja seos b) Vahva happo Syövyttävä happo c) Emäs Emäksinen vesiliuos d) Amorfinen aine Kiteisen aineen
 1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
Sähkökemiaa. Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio
 Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio Hapettuminen ja pelkistyminen 1. Hapetin ja pelkistin 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi
Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio Hapettuminen ja pelkistyminen 1. Hapetin ja pelkistin 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
MUUTOKSET ELEKTRONI- RAKENTEESSA
 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Reaktioyhtälö. Sähköisen oppimisen edelläkävijä www.e-oppi.fi. Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava
 Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Workshop: Tekniikan kemia OAMK:ssa
 1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU 2012 Workshop: Tekniikan kemia OAMK:ssa Miksi betonissa rauta ruostuu ulkopuolelta ja puussa sisäpuolelta? Rautatanko betonissa:
1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU 2012 Workshop: Tekniikan kemia OAMK:ssa Miksi betonissa rauta ruostuu ulkopuolelta ja puussa sisäpuolelta? Rautatanko betonissa:
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Solun perusrakenne I Solun perusrakenne. BI2 I Solun perusrakenne 3. Solujen kemiallinen rakenne
 Solun perusrakenne I Solun perusrakenne 3. Solujen kemiallinen rakenne 1. Avainsanat 2. Solut koostuvat molekyyleistä 3. Hiilihydraatit 4. Lipidit eli rasva-aineet 5. Valkuaisaineet eli proteiinit rakentuvat
Solun perusrakenne I Solun perusrakenne 3. Solujen kemiallinen rakenne 1. Avainsanat 2. Solut koostuvat molekyyleistä 3. Hiilihydraatit 4. Lipidit eli rasva-aineet 5. Valkuaisaineet eli proteiinit rakentuvat
Metallien ominaisuudet ja rakenne
 Metallien Kemia 25 Metallien ominaisuudet ja rakenne Metallit ovat käyttökelpoisia materiaaleja. Niiden ominaisuudet johtuvat metallin rakennetta koossa pitävästä metallisidoksesta. Metalleja käytetään
Metallien Kemia 25 Metallien ominaisuudet ja rakenne Metallit ovat käyttökelpoisia materiaaleja. Niiden ominaisuudet johtuvat metallin rakennetta koossa pitävästä metallisidoksesta. Metalleja käytetään
BIOMOLEKYYLEJÄ. fruktoosi
 BIMLEKYYLEJÄ IMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Ihminen on käyttänyt luonnosta saatavia, kasveissa ja eläimissä esiintyviä polymeerejä eli biopolymeerejä jo pitkään arkipäivän tarpeisiinsa. Biomolekyylit
BIMLEKYYLEJÄ IMISEN JA ELINYMPÄ- RISTÖN KEMIAA, KE2 Ihminen on käyttänyt luonnosta saatavia, kasveissa ja eläimissä esiintyviä polymeerejä eli biopolymeerejä jo pitkään arkipäivän tarpeisiinsa. Biomolekyylit
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017
 CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
Normaalipotentiaalit
 Normaalipotentiaalit MATERIAALIT JA TEKNOLOGIA, KE4 Yksittäisen elektrodin aiheuttaman jännitteen mittaaminen ei onnistu. Jännitemittareilla voidaan havaita ja mitata vain kahden elektrodin välinen potentiaaliero
Normaalipotentiaalit MATERIAALIT JA TEKNOLOGIA, KE4 Yksittäisen elektrodin aiheuttaman jännitteen mittaaminen ei onnistu. Jännitemittareilla voidaan havaita ja mitata vain kahden elektrodin välinen potentiaaliero
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA
 MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
3.1 Sidostyyppejä ja reaktiotyyppejä. Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa
 3.1 Sidostyyppejä ja reaktiotyyppejä Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa Jos kahden aineen välinen elektronegatiivisuusero on riittävän suuri (>1,7), on se ionisidos. Jos
3.1 Sidostyyppejä ja reaktiotyyppejä Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa Jos kahden aineen välinen elektronegatiivisuusero on riittävän suuri (>1,7), on se ionisidos. Jos
Siirtymämetallien erityisominaisuuksia
 Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Lämpö- eli termokemiaa
 Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Lämpö- eli termokemiaa Endoterminen reaktio sitoo ympäristöstä lämpöenergiaa. Eksoterminen reaktio vapauttaa lämpöenergiaa ympäristöön. Entalpia H kuvaa systeemin sisäenergiaa vakiopaineessa. Entalpiamuutos
Jaksollinen järjestelmä
 Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Tekijä lehtori Zofia Bazia-Hietikko
 Tekijä lehtori Zofia Bazia-Hietikko Tarkoituksena on tuoda esiin, että kemia on osa arkipäiväämme, siksi opiskeltavat asiat kytketään tuttuihin käytännön tilanteisiin. Ympärillämme on erilaisia kemiallisia
Tekijä lehtori Zofia Bazia-Hietikko Tarkoituksena on tuoda esiin, että kemia on osa arkipäiväämme, siksi opiskeltavat asiat kytketään tuttuihin käytännön tilanteisiin. Ympärillämme on erilaisia kemiallisia
AKKU- JA PARISTOTEKNIIKAT
 AKKU- JA PARISTOTEKNIIKAT H.Honkanen Kemiallisessa sähköparissa ( = paristossa ) ylempänä oleva, eli negatiivisempi, metalli syöpyy liuokseen. Akussa ei elektrodi syövy pois, vaan esimerkiksi lyijyakkua
AKKU- JA PARISTOTEKNIIKAT H.Honkanen Kemiallisessa sähköparissa ( = paristossa ) ylempänä oleva, eli negatiivisempi, metalli syöpyy liuokseen. Akussa ei elektrodi syövy pois, vaan esimerkiksi lyijyakkua
ORGAANINEN KEMIA. = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY
 ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
ORGAANINEN KEMIA = kemian osa-alue, joka tutkii hiilen yhdisteitä KPL 1. HIILI JA RAAKAÖLJY Yleistä hiilestä: - Kaikissa elollisen luonnon yhdisteissä on hiiltä - Hiilen määrä voidaan osoittaa väkevällä
2.1 Sähköä kemiallisesta energiasta
 2.1 Sähköä kemiallisesta energiasta Monet hapettumis ja pelkistymisreaktioista on spontaaneja, jolloin elektronien siirtyminen tapahtuu itsestään. Koska reaktio on spontaani, vapautuu siinä energiaa, yleensä
2.1 Sähköä kemiallisesta energiasta Monet hapettumis ja pelkistymisreaktioista on spontaaneja, jolloin elektronien siirtyminen tapahtuu itsestään. Koska reaktio on spontaani, vapautuu siinä energiaa, yleensä
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
Liuos voi olla hapan, emäksinen tai neutraali
 Hapot ja emäkset 19 Liuos voi olla hapan, emäksinen tai neutraali happamuuden aiheuttavat oksoniumionit Monet marjat, hedelmät ja esimerkiksi piimä maistuvat happamilta. Happamuus seuraa siitä kun happo
Hapot ja emäkset 19 Liuos voi olla hapan, emäksinen tai neutraali happamuuden aiheuttavat oksoniumionit Monet marjat, hedelmät ja esimerkiksi piimä maistuvat happamilta. Happamuus seuraa siitä kun happo
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
KEMIAN MIKROMAAILMA, KE2 VESI
 VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
Bensiiniä voidaan pitää hiilivetynä C8H18, jonka tiheys (NTP) on 0,703 g/ml ja palamislämpö H = kj/mol
 Kertaustehtäviä KE3-kurssista Tehtävä 1 Maakaasu on melkein puhdasta metaania. Kuinka suuri tilavuus metaania paloi, kun täydelliseen palamiseen kuluu 3 m 3 ilmaa, jonka lämpötila on 50 C ja paine on 11kPa?
Kertaustehtäviä KE3-kurssista Tehtävä 1 Maakaasu on melkein puhdasta metaania. Kuinka suuri tilavuus metaania paloi, kun täydelliseen palamiseen kuluu 3 m 3 ilmaa, jonka lämpötila on 50 C ja paine on 11kPa?
c) Mitkä alkuaineet ovat tärkeitä ravinteita kasveille?
 ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
Sähkökemiaa. Hapettuminen Jännitesarja Elektrolyysi Korroosio
 Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Korroosio Hapettuminen ja pelkistyminen 1. Määritelmät 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi ja sen sovelluksia
Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Korroosio Hapettuminen ja pelkistyminen 1. Määritelmät 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi ja sen sovelluksia
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Helsingin yliopiston kemian valintakoe. Keskiviikkona klo Vastausselvitykset: Tehtävät:
 1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Kaikki ympärillämme oleva aine koostuu alkuaineista.
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
SIDOKSET. Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
EPÄORGAANINEN KEMIA HARJOITUKSIA. Jaksollinen järjestelmä
 EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
8. Alkoholit, fenolit ja eetterit
 8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
8. Alkoholit, fenolit ja eetterit SM -08 Alkoholit ovat orgaanisia yhdisteitä, joissa on yksi tai useampia -ryhmiä. Fenoleissa -ryhmä on kiinnittynyt aromaattiseen renkaaseen. Alkoholit voivat olla primäärisiä,
9. JAKSOLLINEN JÄRJESTELMÄ
 9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
Johdantoa/Kertausta. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Lukion kemian OPS 2016
 Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta - yhdisteryhmät KE2-kurssiin
Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta - yhdisteryhmät KE2-kurssiin
Jännittävät metallit
 Jännittävät metallit Tästä alkaa tutkimusmatkamme sähkön syntymiseen! Varmaan tiedätkin, että sähköä saadaan sekä pistorasioista että erilaisista paristoista. Pistorasioista saatava sähkö tuotetaan fysikaalisesti,
Jännittävät metallit Tästä alkaa tutkimusmatkamme sähkön syntymiseen! Varmaan tiedätkin, että sähköä saadaan sekä pistorasioista että erilaisista paristoista. Pistorasioista saatava sähkö tuotetaan fysikaalisesti,
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
Esim. ihminen koostuu 3,72 x solusta
 Esim. ihminen koostuu 3,72 x 10 13 solusta Erilaisia soluja Veren punasoluja Tohvelieläin koostuu vain yhdestä solusta Siittiösolu on ihmisen pienimpiä soluja Pajun juurisolukko Bakteereja Malarialoisioita
Esim. ihminen koostuu 3,72 x 10 13 solusta Erilaisia soluja Veren punasoluja Tohvelieläin koostuu vain yhdestä solusta Siittiösolu on ihmisen pienimpiä soluja Pajun juurisolukko Bakteereja Malarialoisioita
17VV VV 01021
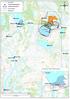 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 28.1.2016 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
MAOL:n pistesuositus kemian reaalikokeen tehtäviin syksyllä 2011.
 MAL:n pistesuositus kemian reaaikokeen tehtäviin syksyä 2011. - Tehtävän eri osat arvosteaan 1/3 pisteen tarkkuudea ja oppusumma pyöristetään kokonaisiksi pisteiksi. Tehtävän sisää pieniä puutteita voi
MAL:n pistesuositus kemian reaaikokeen tehtäviin syksyä 2011. - Tehtävän eri osat arvosteaan 1/3 pisteen tarkkuudea ja oppusumma pyöristetään kokonaisiksi pisteiksi. Tehtävän sisää pieniä puutteita voi
FyKe 7 9 Kemia ja OPS 2016
 Kuvat: vas. Fotolia, muut Sanoma Pro Oy FyKe 7 9 Kemia ja OPS 2016 Kemian opetuksen tehtävänä on tukea oppilaiden luonnontieteellisen ajattelun sekä maailmankuvan kehittymistä. Kemian opetus auttaa ymmärtämään
Kuvat: vas. Fotolia, muut Sanoma Pro Oy FyKe 7 9 Kemia ja OPS 2016 Kemian opetuksen tehtävänä on tukea oppilaiden luonnontieteellisen ajattelun sekä maailmankuvan kehittymistä. Kemian opetus auttaa ymmärtämään
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
JAKSOLLINEN JÄRJESTELMÄ
 JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
Liitetaulukko 1/11. Tutkittujen materiaalien kokonaispitoisuudet KOTIMAINEN MB-JÄTE <1MM SAKSAN MB- JÄTE <1MM POHJAKUONA <10MM
 Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Lukion kemian OPS 2016
 Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta - yhdisteryhmät KE2-kurssiin
Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta - yhdisteryhmät KE2-kurssiin
Kuva 1: Yhdisteet A-F viivakaavoin, tehtävän kannalta on relevanttia lisätä näkyviin vedyt ja hiilet. Piiroteknisistä syistä tätä ei ole tehty
 1. Valitse luettelosta kaksi yhdistettä, joille pätee (a) yhdisteiden molekyylikaava on C 6 10 - A, E (b) yhdisteissä on viisi C 2 -yksikköä - D, F (c) yhdisteet ovat tyydyttyneitä ja syklisiä - D, F (d)
1. Valitse luettelosta kaksi yhdistettä, joille pätee (a) yhdisteiden molekyylikaava on C 6 10 - A, E (b) yhdisteissä on viisi C 2 -yksikköä - D, F (c) yhdisteet ovat tyydyttyneitä ja syklisiä - D, F (d)
Lukion kemian OPS 2016
 Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. Keskeiset sisällöt muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta
Lukion kemian OPS 2016 Tieteellisen maailmankuvan rakentuminen on lähtökohtana. Keskeiset sisällöt muodostavat johdonmukaisen kokonaisuuden (ao. muutoksien jälkeen). Orgaaninen kemia pois KE1-kurssilta
Näiden aihekokonaisuuksien opetussuunnitelmat ovat luvussa 8.
 9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
9. 11. b Oppiaineen opetussuunnitelmaan on merkitty oppiaineen opiskelun yhteydessä toteutuva aihekokonaisuuksien ( = AK) käsittely seuraavin lyhentein: AK 1 = Ihmisenä kasvaminen AK 2 = Kulttuuri-identiteetti
