Rakennusalan kemia 5 op
|
|
|
- Timo-Pekka Koskinen
- 6 vuotta sitten
- Katselukertoja:
Transkriptio
1 Rakennusalan kemia 5 op Moodle - työtila: Rakennusalan kemia R501RL14 (päiväopetus) avain: kemia Oppimateriaali: Materiaalit Moodlessa MaoL:n taulukot: kemian sivut - samat taulukot löytyvät Moodlesta ja webistä:
2 S I S Ä L Osa1 Osa2 Osa3 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä, oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen reaktio, reaktioyhtälö 6. Määrälliset laskut, palamislaskut, 7. Lämpökemiaa 8. Reaktion nopeus, 9. reaktion tasapaino, liukoisuustulo 10. Konsentraatio 11. Hapot, emäkset ja ph 12. Metallien kemiaa (metalliseokset) T Ö Osa4 Osa5 13. Hapettuminen, pelkistyminen 14. Metallien jännitesarja ja akut 15. Elektrolyysin sovelluksia. 16. Sähkökemiallinen korroosio 17. Orgaaniset yhdisteet 18. Ympäristön ja sisäilman kemiaa
3 Opintojakson suorittaminen Moodlen tehtävät 5*10p = 50 p - monivalinta-, aukko- ja yhdistelytehtäviä Palautettavat laskut 5*5p = 25 p - Palautus Moodlen palautuslaatikkoon Koe 25 p -Koealue määritellään erikseen, paino kemian laskuissa yhteensä max 100 p PISTERAJAT: 40 p = 1, 52p = 2, 64 p = 3, 76 p = 4, 88 p = 5 Läpipääsyyn riittää Moodle-tehtävien tekeminen. Ehtona kuitenkin on, että jokaisesta viidestä osiosta on saatava väh. 8 p
4 Peruskäsitteet 1. Alkuaine 2. Yhdiste 3. Seos Alkuaine koostuu vain yhdenlaisista atomeista. Yhdiste koostuu molekyyleistä, jotka rakentuvat useammanlaisista atomeista. Seos ei koostu keskenään samanlaisista molekyyleistä, vaan sisältää erilaisia molekyylejä ja atomeja.
5 Alkuaine ja yhdiste Alkuaineilla on kemiallinen merkki (esim. H, O, S, ) Alkuaineita on n. 108 kpl Yhdisteillä on kemiallinen kaava, josta ilmenee sen molekyylin rakenne: esim. H 2 O, H 2 SO 4, CO 2
6 Eräitä alkuaineita: Nimi Tunnus Engl. Happi O Oxygen Rikki S Sulphur Vety H Hydrogen Hiili C Carbon Kloori Cl Chlorine Rauta Fe Iron
7 Atomimassayksikkö 1 u 1 u = 1/12 hiili-isotooppi 12 C:n massasta vetyatomi H painaa n. 1 u 1 protoni painaa myös 1 u 1 neutroni painaa myös 1 u 1 elektroni painaa 1/2000 u (kevyt)
8 Atomin rakenne Helium Kuoret: Elektroni: massa pieni varaus= -e Ydin: protoni: p massa = 1 u varaus = +e 1 u = atomimassayksikkö = n.protonin massa = 1.6*10-27 kg 1 e = alkeisvaraus = 1.6*10-19 C neutroni: n massa =1 u varaus = 0
9 Atomin rakenne Helium Kuvassa on 4 He -atomi 2 Järjestysluku Z = ytimen protoniluku = 2 Massaluku A = P+N=4 =protoniluku+neutroniluku = ytimen paino elektroneja on sama määrä kuin protoneja
10 Elektronikuoret ydin Kuoret voidaan esittää järjestysluvulla n = 1,2,3,4 tai kirjaimilla K,L,M,N, Kuorelle n mahtuu enintään 2n 2 elektronia. Montako elektronia mahtuu toiselle kuorelle?
11 Atomipaino A Atomin isotoopin massaluku A = P + N Taulukkokirjoissa atomipainot ovat useimmiten desimaalilukuja. Esim. hiilen A = Tähän on kaksi syytä: 1) Luonnossa alkuaineista esiintyy useita isotooppeja. Taulukkokirjan atomipaino on tällöin esiintymisprosenteilla painotettu keskiarvo eri isotooppien massaluvuista. 2) Atomin massa < sen osien massat yhteensä, koska atomin syntyessä osa massoista katoaa Einsteinin kaavalla E = mc 2. Atomin atomipainoista voidaan laskea yhdisteen molekyylipaino: esim. CO 2 : M = *16 = 44
12 Isotoopit Neutronien määrä voi olla eri saman alkuaineen eri atomeilla alkuaineen pysyessä silti samana. Hiilellä on mm.isotoopit: 12 C, 13 C ja 14 C. Protoneja niissä kaikissa on 6 kpl, elektroneja on myös 6 kpl, mutta neutroneja niissä on 6, 7 ja isotoopissa 14 C 8 kpl (14-6). Alkuaineen erimassaisia atomeja sanotaan ko. alkuaineen isotoopeiksi. Esim. Uraanilla (Z=92) on isotoopit: 238 U ja 235 U, joista jälkimmäinen on ydinvoimaloiden polttoaine. Osa isotoopeista on stabiileja, osa radioaktiivisia. Esim. 14 C -isotoopista on MaOL:ssa mainittu säteilylajiksi β- ja puoliintumisajaksi 5600a. (Säteilee elektroneja ja puoliintumisaika on 5600 vuotta.)
13 Eräitä isotooppeja 60 Co = sädehoidossa käytetty koboltti 127 Cs = ydinreaktiossa syntyvää Cesiumia, jota tavataan 60 -luvun ydinkokeiden seurauksena vieläkin Lapin poroista. 14 C = em. radiohiili, jonka avulla voidaan määrittää vanhojen orgaanisten jätteiden ikä Rn = radon, haitallinen kaasu maaperässä, josta suomalainen saa yli 50% vuotuisesta säteilyannoksestaan
14 Ionit Atomi on tavallisesti sähköisesti neutraali (varaukseton) Kun atomiin tulee ylimääräinen elektroni tai siitä lähtee elektroni, atomista tulee ioni, eli varattu atomi Esim. K + Ca 2+ Cl - positiivinen kalium-ioni positiivinen kalsium-ioni negatiivinen kloridi -ioni Positiivisia ioneja sanotaan kationeiksi, negatiivisia anioneiksi
15 Yhdisteet Kemiallinen kaava kertoo alkuainekoostumuksen esim. H 2 SO 4 koostuu molekyyleistä, joissa on 2 vetyä, yksi rikki ja 4 happea: Molekyylipaino M = 2*1 + 1*32+ 4*16= 98 Veden H 2 O molekyylipaino M = 2* = 18
16 Esimerkkejä: Mikä seuraavista kupariyhdisteistä sisältää eniten kuparia? CuO, Cu 2 SO 4 Ratk. Atomipainot: Cu: 63.6, S: 32, O: 16 kuparia CuO:ssa : 63.6/( )*100%= 79.9% ja Cu 2 SO 4 :ssa: 2*63.6 /(2* *16)*100%=57.0% CuO on siis kuparirikkaampi.
17 Tehtäviä 1. Montako protonia, neutronia, ja elektronia on atomeissa a) 235 U b) 238 U c) 60 Co d) 127 Cs 2. Laske atomipainoja käyttäen seuraavien yhdisteiden pros. alkuainekoostumukset: a) H 2 O b) CO 2 c) H 2 SO 4 3. Tutki MaOL:n isotooppitaulukon avulla, mikä jodin (I) isotooppi on se, jota tulee varoa ydinonnettomuuden ensimmäisten viikkojen aikana. (puoliintumisaika muutamia päiviä.
18 Alkuaineiden jaksollinen järjestelmä Alkuaineryhmät Sidostyypit
19 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen uloimman elekt-ronikuoren rakenteesta. Samanlaisen ulkokuori-rakenteen omaavat alku-aineet ovat kemiallisesti sukulaisia ja ne on sijoitettu alkuainetaulukossa alekkain
20 Alkuaineiden atomimassat Uloin elektronikuori määrää alkuaineen kemialliset ominaisuudet ja ryhmän (laskuissa riittää 1. desimaalin tarkkuus)
21 Alkuaineiden muodostumista selittävä teoria on kvanttimekaniikka Tanskalaisen Nils Bohrin luvun alussa esittämän mallin mukaan elektronien tilaa atomissa kuvaa 4 kvanttilukua: pääkvanttiluku n=1,2,3,4, sivukvanttiluku l = 0,,n-1 magneettinen kvanttiluku m = 0, +-1,, +- l spinkvanttiluku s = 1/2, -1/2 Edelleen atomilla voi olla kutakin näiden neljän kvanttiluvun yhdistelmää vastaavassa tilassa vain yksi elektroni.
22 Esim. 3. kuorella (n=3) voi olla seuraavia kvanttilukuyhdistelmiä: l = 0, m=0, 2 elektronia (s=1/2 tai -1/2) l=1, m= 0, 2 el. m= -1, 2 el. m = +1, 2 el. l=2 m= 0, 2 el. m= -1, 2 el. 10e m= -2, 2 el. 6e m= 1, 2 el. 2e m = 2, 2 el. 3. kuoren hienorakenne Yhteensä kuorelle 3 mahtuu (5+ 3+1)*2 = 18 elektronia
23 L:n arvoja 0, 1, 2,3 vastaavia tiloja sanotaan alikuoriksi eli orbitaaleiksi ja niitä merkitään s,p,d,f, s -orbitaaleille mahtuu 2 elektronia (m=0) p-orbitaaleille mahtuu 6 el. (m=0,+-1) d-orbitaaleille mahtuu 10 el. (m=0,+-1,+-2) Lisäksi kuoret ja orbitaalit täyttyvät seuraavan kaavion mukaisessa järjestyksessä.
24 Orbitaalien täyttymisjärjestys kuori1 1s kuori2 2s 2p 2p 2p kuori3 3s 3p 3p 3p 3d 3d 3d 3d 3d kuori4 4s 4p 4p 4p 4d 4d 4d 4d 4d kuori5 5s 5p 5p 5p kuori6 6s Jokainen neliö edustaa alikuorta, johon mahtuu 2 elektronia
25 Teht. Määritä alkuaineen nro 1s 20 (Kalsium) elektronirakenne 2s 2p 2p 2p 3s 3p 3p 3p 3d 3d 3d 3d 3d 4s 4p 4p 4p 4d 4d 4d 4d 4d 5s 6s 5p 5p 5p Uloimmalla (4.) kuorella on 2 elektronia, Ca kuuluu pääryhmään 2
26 Oktettisääntö Ulkokuoren rakenne, jossa ulkokuorella on 2 kpl s-, ja 6 kpl p- elektroneja = yht. 8 elektronia on erityisen stabiili. Sitä sanotaan oktetiksi. Alkuaineet muodostavat yhdisteitä usein siten, että ne pääsevät oktettirakenteeseen. Esim. kun Na luovuttaa 1 elektronin, sille jää oktetti. Kun kloori Cl vastaanottaa elektronin, sille tulee oktetti. Siten kun natrium joutuu kosketuksiin kloorin kanssa, natrium luovuttaa elektronin kloorille ja syntyy NaCl - molekyyli.
27 Alkuaineiden jaksollinen järjestelmä Pääryhmät ovat 1,2,13,14,15,16,17, sisältävät ns. siirtymäalkuaineita
28 Alkalimetalli t Maaalkalimet. Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Pääryhmät perustuvat uloimman kuoren elektronirakenteen samanlaisuuteen
29 Pääryhmät 1 Alkalimetallit - ulkokuoren rakenne : 1kpl S -elektroneja * 1 H vety, 3 Li litium, 11 Na (natrium), 19 K (kalium), 37 Rb (rubidium), 55 Cs (cesium), 87 Fr (frankium) * Atomit pyrkivät oktettiin luovuttamalla 1 elektronin * Ionivaraus +1: H +, Li +, Na +,- - - * erittäin reaktioherkkiä metalleja, esim. Natrium reagoi veden kanssa lähes räjähtämällä muodostaen NaOH:ta ja vetyä * vesiliuokset emäksisiä, josta nimi alkalimetallit Esimerkkejä alkalimetallien yhdisteistä NaCl ruokasuola KCl mineraalisuolassa (Seltin) n. puolet tätä NaOH natriumhydroksidi (lipeä) LiCoO 2 Litiumkobolttioksidi (Iphonen akku)
30 2 Maa-alkalimetallit * ulkokuoren rakenne 2 s -elektronia * Be, Mg, Ca, Sr, Ba, Ra * pyrkivät luovuttamaan 2 el. päästäkseen oktettiin * ionivaraus +2 Ca = kalsium Luonnossa kalkkikivenä: CaCO 3 CaO = kalsiumoksidi (eli kalkki) Ca(OH) 2 = sammutettu kalkki Kovettumisreaktio: Ca(OH) 2 + CO 2 => CaCO 3
31 13 Booriryhmä * ulkokuorella 3 elektronia (2s + 1p) * B, Al, Ga, In, Tl * luovuttavat useimmiten 3 elektronia * ionivaraus + 3 Alumiini Al kuuluu kevytmetalleihin *): tiheys 2700 kg/m 3 Hyvä sähkönjohtokyky Sähkön runkoverkon johdot ovat alumiinia (kevyt ja halpa) Passivoituva metalli (ei korroosiota) -lentokoneissa, veneissä *) Kevytmetalleihin luetaan metallit, joiden tiheys < 5000 kg/m 3.
32 14 hiiliryhmä (ulkokuorella 4 elektronia: 2s+2p) * C, Si, Ge, Sn, Pb * luovutettujen el. määrä vaihtelee sisältää sekä epämetalleja: C ja metalleja Sn,Pb * Tämän ryhmän aineet liittyvät sähkötekniikkaan HIILI: Muotoja: kivihiili, grafiitti, timantti Kaasuja: CO ja CO 2 Orgaanisten yhdisteiden (elollinen luonto) pääalkuaine, miljoonia yhdisteitä
33 15 typpiryhmä * ulkokuori 2 s+3p= yht. 5 elektronia (3 vaille oktetti) * N, P, As, Sb, Bi * epämetalleja Typpi ja fosfori ovat tunnettuja lannoitteista: Fosforilannoitteet ovat fosfaatteja Typpilannoitteet ovat nitraatteja. Nitraatteja käytetään myös räjähteissä. Apatiitti (Soklin esiintymä) on kalsiumfosfaattia Ca 3 (PO4) 2
34 16 Happiryhmä * ulkokuorella 6 elektronia = 2 vaille oktetti * O, S, Se, Te, Po * saavuttavat oktetin ottamalla vastaan 2 elektronia * ionivaraus -2 O 2- on nimeltään oksidi-ioni: H 2 O CO, CO 2 CuO S 2- on nimeltään sulfidi-ioni: H 2 S rikkivety SO 2 rikkidioksidi CuS kuparisulfidi
35 17 halogeenit (ulkokuorella 7 el. = yhtä vaille oktetti) * F, Cl, Br, I ja At * epämetalleja, ionivaraus -1 * erittäin reaktioherkkiä, ottavat yhden elektronin päästäkseen oktettiin. Fluorilla voimakkain elektronegatiivisuus Kloorikaasu Cl 2 - Myrkyllistä hengitettynä, käytetään mm. veden desinfiointiin, aiemmin käytettiin selluloosan valkaisuun Yhdisteitä: NaCl ruokasuola NH 4 Cl salmiakki
36 18 jalokaasut (He, Ne, Kr, Ar, Xe, Rn) * ovat jo oktetissa (8 elektronia ulkokuorella), täysin passiivisia Helium ilmapallot Ne, Xe, kaasuvalot Rn - isotooppi Rn222 on suomalaisten suurin radioaktiivisen säteilyn lähde Passiivisuutensa vuoksi mm. Heliumia ja Argonia käytetään suojakaasuna hitsauksessa (estää hitsattavaa metallia hapettumasta hitsauksen yhteydessä)
37 Siirtymäalkuaineet Siirtymäalkuaineilla ulkokuoren s-tilojen jälkeen täyttyvät edellisen kuoren d-tilat, joille mahtuu 10 elektronia. Ulkokuoren täyttyminen jatkuu vasta tämän jälkeen. Näiden 10 alkuaineen kohdalla ulkokuoren rakenne on sama. Näihin sijoittuu kaupallisesti tärkeitä metalleja: Fe, Ni, Cu, Cr, Co, V, Au, Ag, Ti, Pt Yleiset ominaisuudet: Metallin kiilto Suuri tiheys : > 5000 kg/m 3 Kovuus, taottavuus Hyvä sähkönjohtokyky Hyvä lämmönjohtokyky Korkea sulamis- ja kiehumispiste
38 Metallit ja epämetallit Alkuainekaaviossa suurin osa alkuaineista on metalleja, joilla on kiinteä olomuoto ja hyvä sähkön- ja lämmönjohtokyky. Taulukon oikeassa reunassa sijaitsevat epämetallit, joilta em. ominaisuudet puuttuvat. Monet epämetalleista ovat kaasuja, mutta on mukana myös kidemäisiä aineita kuten rikki (keltaista jauhetta) sekä jodi (kidemäinen) Puolimetalleiksi lasketaan mm. Pii (Si), joka on maankuoren yleisen alkuaine ja tärkeä mm. mikroprosessorien raaka-aine
39 Metallien hintoja
40 Aineen olomuodon yhteys sidostyyppiin Kemialliset sidostyypit
41 Sidostyypit Ionisidos Kovalenttinen sidos Poolinen sidos Metallisidos Ks. Maol:n taulukko: Alkuaineiden elektronegatiivisuudet Elektronegatiivisuus = atomin kyky vetää puoleensa elektroneja
42 Elektronegatiivisuus on luku, joka ilmaisee alkuaineen atomin kykyä vetää puoleensa eletroneja. Pieni e.n. on alkalimetalleilla => esim. Na luovuttaa helposti elektronin Suuri e.n. on halogeeneilla ja hapella => happi, fluori ja kloori ottavat mielellään lisää elektroneja, ne toimivat hapettimina.
43 Ionisidos * Esiintyy, kun atomien elektronegatiivisuusero on suuri ( >1.7) * Elektronegatiivisempi alkuaine riistää elektronin toiselta alkuaineelta. Syntyy posit. ioni eli kationi ja neg. ioni eli anioni. * Kationit ja anionit ryhmittyvät kiteeksi * Yhdisteitä kutsutaan suoloiksi. * tyypillistä kovuus, korkeat sulamispisteet johtuen suurista sähköisistä voimista.olomuoto kiinteä Esim. NaCl -kide + - +
44 Kovalentti sidos * Esiintyy, kun atomien elektronegatiivisuusero on pieni (<=0.5) * Kaksi alkuainetta voivat päästä oktettiin siirtämällä elektroneja yhteiskäyttöön. Esim. 2 klooriatomia : Cl Cl Cl 2 -molekyyli Yhteinen elektronipari merk. Cl-Cl Molemmilla on oktettirakenne eli 8 elektronia ulkokuorella, vaikka yhteensä elektroneja klooriatomeilla on 14 kpl.
45 Molekyylien välisiä voimia ei ole, joten olomuoto on usein kaasu. Jos yhteisiä elektronipareja on 2 kpl on kyseessä kaksoissidos.(jos 3 kpl, kolmoissidos) Huom! Kaikki muut kaasut paitsi jalokaasut esiintyvät 2 atomin molekyyleinä: H 2, N 2, O 2 O O O 2 -molekyyli 2 yhteistä elektroniparia merk. O=O Typpikaasulla N 2 on 3 yhteistä elektroniparia: kolmoissidos N N
46 Poolinen sidos * elektronegatiivisuusero välillä Yhteinen elektronipari on lähempänä elektronegatiivisempaa atomia. Molekyylille tulee tällöin + ja - napa eli siitä tulee dipoli. Molekyylit pitävät kiinni toisistaan sähköisillä voimilla muodostaen ketjuja. Olomuoto on usein neste. Esim. Vesi H 2 O Kuvassa vesimolekyylejä ketjuuntuneena. happi vety - +
47 Metallisidos Metalliatomien välillä oleva sidos poikkeaa edellisistä, eikä selity elektronegatiivisuudella. * Atomit ovat järjestyneet kidetasoihin. Niiden etäisyydet määräytyvät sähköisillä jousivoimiin verrattavilla sidoksilla. * ulkoelektronit eivät kuulu millekään atomille, vaan pääsevät vapaasti liikkumaan kiteessä * ominaista kovuus, hyvä lämmön- ja sähkönjohtokyky
48 Esimerkkejä Mikä sidostyyppi? a) NO b) KF c) O 2 d) Fe e) HBr Elektroneg.ero sidostyyppi = 0.5 lievästi poolinen = 3.2 ionisidos 0 kovalentti sidos Metalli metallisidos = 1.4 poolinen sidos
49 Kemialliset yhdisteet IONIYHDISTEET Kemiallinen kaava Yhdisteiden nimeäminen Epämetallien väliset yhdisteet
50 Systemaattiset nimet ja triviaalinimet Kemialliset yhdisteet voidaan nimetä kansainvälisen IUPAC järjestelmän mukaisesti tiettyjä nimeämissääntöjä noudattaen (ns. systemaattiset nimet) (IUPAC = International Union of Pure and Applied Chemistry) Useilla yhdisteillä on lisäksi jokin yleisesti käytetty triviaalinimi, jolla se tunnetaan. Triviaalinimet eivät ole useinkaan kansainvälisiä, mutta systemaattiset nimet ovat. Esim. CO:n systemaattinen nimi on hiilimonoksidi, engl. carbon monoxide. Sillä on suomen kielessä triviaalinimi häkä. Googlesta voi hakea tietoja kemiallisesta yhdisteestä joko systemaattisella nimellä tai kirjoittamalla yhdisteen kaava selainkenttään: Esim. hakusana CaSO4 tai kalsiumsulfaatti tai calsium sulfate antaa tietoa kyseisestä yhdisteestä (kipsi)
51 Yhdisteen kaava Yhdisteen kaava kertoo mistä atomeista yhdisteen pienin rakenneosa, molekyyli koostuu. (atomilajit ja määrät) H 2 O vesimolekyyli Orgaanisessa kemiassa on tärkeää atomien oikea järjestys kaavassa: C 2 H 5 OH etanolimolekyyli Huom! Yhdisteen suhdekaava olisi C 2 H 6 O, mutta tästä ei kävisi ilmi, että kysessä on alkoholi, jonka funktionaalinen ryhmä on OH.
52 IONIYHDISTEET eli SUOLAT KATIONIT: Metalliatomit luovuttavat helposti ulkokuoren elektroninsa, jolloin atomeista muodostuu positiivisia ioneja, kationeja Yksiarvoisia kationeja ovat mm. Na+, K+, H+, Cu+ - ionit Kaksiarvoisia kationeja ovat mm. Ca 2 +, Mg 2 +, Fe 2+, Cu 2+ Kolmiarvoisia kationeja ovat mm. Al 3 +, Fe 3+ Huom! Siirtymäalkuaineisiin kuuluvilla metalleilla saattaa olla useita eriarvoisia kationeja ANIONIT: Epämetalliatomit ottavat usein ulkokuorelleen lisäelektroneja, jolloin atomeista muodostuu negatiivisia ioneja, anioneja Yksiarvoisia anioneja ovat mm. Cl -, Br-, Kaksiarvoisia kationeja ovat mm. O 2-, S 2- (kloridi ja bromidi ionit) (oksidi- ja sulfidi- ionit) Huomaa: Epämetallien anionien nimessä on di pääte: (Kloori = Cl, kloridi = Cl - )
53 Binääriyhdisteet = kahden alkuaineen yhdisteet Yksinkertaisimmat ioniyhdisteet muodostuvat kahdesta alkuaineesta: metallista ja epämetallista, jolloin puhutaan binääriyhdisteistä Kationi ja anioni liittyvät sähköisesti neutraaliksi yhdisteeksi. Esim. Na + ja Cl - -ioni yhdistyvät natriumkloridiksi NaCl. Jos ionivaraukset eivät ole samat, yhdisteen kaavassa on eri määrä sen muodostavia alkuaineita (kaavassa kunkin atomin määrä merkitään alaindekseillä) Ca 2+ ja kaksi F - ionia muodostavat kalsiumfluoridia CaF 2 Al 3+ ja S 2- muodostavat alumiinisulfidia Al 2 S 3 (varaus on juuri näillä alaindekseillä tasapainossa, koska 2*(+3) + 3*(-2) = 0) Yhdisteen nimi muodostetaan asettamalla kationin ja anionin nimi peräkkäin yhdyssanaksi. Kreikan lukusanoja di, tri ei käytetä, koska ionivarausten perusteella atomien suhteen ovat muutenkin selvät. Metalleilla voi olla useita kationeja: esim. Fe 2+ (rautaii) ja Fe 3+ (rautaiii), mikä näkyy niiden yhdistenimimissä seuraavasti FeO = rauta(ii)oksidi ja Fe 2 O 3 = rauta(iii)oksidi Taulukosta Tavallisimpia kationeja ja anioneja löytyy ioniluettelot ja ionien nimet
54 Nimeä: a) FeO b) Fe 2 O 3 c) MgBr 2 d) FeBr 2 Ratk.a) rauta(ii)oksidi b) rauta(iii)oksidi c) magnesiumbromidi d) rauta(ii) bromidi kationeja: Fe 2+ rauta(ii) Fe 3+ rauta(iii) Mg 2+ magnesium anioneja: O 2- oksidi Br - bromidi S 2- sulfidi
55 Kompleksiyhdisteet - nimeäminen Kompleksiset anionit muodostuvat atomiryhmistä. Esim. CO 3 2- = karbonaatti-ioni Kompleksisia kationeja on mm. NH 4+ = ammonium-ioni. Nimeäminen tapahtuu tässäkin tapauksessa asettamalla kationi-ja anioninimi peräkkäin. Kreikan lukusanoja di, tri, ei käytetä Na 2 CO 3 = natriumkarbonaatti NH 4 NO 3 = ammoniumnitraatti Kompleksisia anioneja: SO 4 2- =sulfaatti NO 3- =nitraatti CO 3 2- = karbonaatti PO 4 3- = ortofosfaatti HCO 3- = vetykarbonaatti Kompleksisia kationeja: NH 4+ = ammonium
56 Epämetallien yhdisteet - nimeäminen Epämetalleilla, kuten C,N, S, O, Cl ei ole positiivista ionia. Sidostyyppinä on kovalentti sidos. Kationivarauksen tilalla on hapetusluku, joka kertoo kuinka monta elektronia alkuaine voi luovuttaa sidokseen. Esim. Hiilellä, typellä ja rikillä on useita mahdollisia hapetuslukuja => niillä on useita oksideja. Nimissä käytetään kreikkalaisia lukusanoja erottamaan yhdisteet toisistaan. Oksidien nimissä käytetään kreikan lukusanoja: SO 2 ja SO 3 ovat rikkidioksidi ja rikkitrioksidi CO ja CO 2 ovat hiilimonoksidi ja hiilidioksidi Eräs typen oksidi N 2 O 5 = dityppipentaoksidi Maol:n hapetuslukutaulukon mukaan rikin S mahdolliset hapetusluvut ovat +II, +IV, ja +VI. Tämän perusteella rikin mahdolliset oksidit olisivat SO, SO 2 ja SO 3 Kreikan lukusanat 1= mono 2= di 3= tri 4= tetra 5= penta 6= heksa 7=hepta 8=okta 9=nona 10=deka
57 Nimeämistehtävä (esimerkki) Ioniyhdisteiden nimi on yhdyssana kationi- ja anioninimestä, jotka löytyvät taulukoista. Jos metallilla on useita kationeja, päätellään yhdisteen kaavasta, mikä ioni on kyseessä. Epämetalliyhdisteiden kohdalla,(esim. hiilen, rikin ja typen oksidit) on nimessä käytettävä kreikan lukusanoja 1. Nimeä a) AlPO 4 b) Ca(HCO 3 ) 2 c) (NH 4 ) 2 SO 3 d) Mg(CN) 2 e) FeBr 2 alumiinifostaatti (tai alumiiniortofosfaatti) Kalsiumvetykarbonaatti ammoniumsulfiitti magnesiumsyanidi rauta(ii)bromidi f) NO 3 typpitrioksidi
58 Yhdisteitä joiden nimeä ei voi muodostaa säännöillä, vaan ne pitää opetella muistamaan Vesi H 2 O Ammoniakki: NH 3
59 Kaavankirjoitustehtävä (käytetään kationi-anionitaulukkoa) 1. Kationin ja anionin varaukset katsotaan taulukosta. 2. Jos ne eivät ole suuruudeltaan samat, joudutaan kaavaan kirjoittamaan kationin ja/tai anionin perään alaindeksit siten, että yhdiste on sähköisesti neutraali. Mikäli anioni tai kationi on kompleksinen atomiryhmä, se kirjoitetaan sulkuihin ja ionin lukumäärää kuvaava alaindeksi tulee sulkumerkin perään 2. Kirjoita kaava a) alumiinioksidi b) typpimonoksidi c) rauta(iii)kloridi d) bariumvetysulfaatti e) ammoniumsulfidi Al 2 O 3 NO FeCl 3 Ba(HSO 4 ) 2 (NH 4 ) 2 S
60 . Yhdisteiden triviaalinimet Useilla yhdisteillä on systemaattisen nimen lisäksi yleiskielessä käytettävä nimi, jolla se paremmin tunnetaan. Triviaalinimiä löytää googlella kirjoittamalla hakukenttään systemaattisen nimen. Kaava systemaattinen nimi triviaalinimi CO hiilimonoksidi häkä NaCl natriumkloridi ruokasuola Na 2 CO 3 natriumkarbonaatti sooda NaHCO 3 natriumvetykarbonaatti ruokasooda CH 3 COOH etaanihappo etikka NaOH natriumhydroksidi lipeä CaSO 4 kalsiumsulfaatti kipsi CaO kalsiumoksidi kalkki Ca(OH) 2 kalsiumhydroksidi sammutettu kalkki CaCO 3 kalsiumkarbonaatti kalkkikivi NH 4 Cl ammoniumkloridi salmiakki CH 2 O metanaali formaldehydi
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Yhdisteiden nimeäminen
 Yhdisteiden nimeäminen Binääriyhdisteiden nimeäminen 1. Ioniyhdisteet 2. Epämetallien väliset yhdisteet Kompleksiyhdisteiden nimeäminen Kemiallinen reaktio 1. Reaktioyhtälö 2. Määrälliset laskut 3. Reaktionopeuteen
Yhdisteiden nimeäminen Binääriyhdisteiden nimeäminen 1. Ioniyhdisteet 2. Epämetallien väliset yhdisteet Kompleksiyhdisteiden nimeäminen Kemiallinen reaktio 1. Reaktioyhtälö 2. Määrälliset laskut 3. Reaktionopeuteen
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Jaksollinen järjestelmä
 Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
MUUTOKSET ELEKTRONI- RAKENTEESSA
 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
elektroni = -varautunut tosi pieni hiukkanen nukleoni = protoni/neutroni
 3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
3.1 Atomin rakenneosat Kaikki aine matter koostuu alkuaineista elements. Jokaisella alkuaineella on omanlaisensa atomi. Mitä osia ja hiukkasia parts and particles atomissa on? pieni ydin, jossa protoneja
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
9. JAKSOLLINEN JÄRJESTELMÄ
 9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Kvanttimekaaninen atomimalli. "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman
 Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017
 CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
luku 1.notebook Luku 1 Mooli, ainemäärä ja konsentraatio
 Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Luku 1 Mooli, ainemäärä ja konsentraatio 1 Kemian kvantitatiivisuus = määrällinen t ieto Kemian kaavat ja reaktioyhtälöt sisältävät tietoa aineiden rakenteesta ja aineiden määristä esim. 2 H 2 + O 2 2
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 8.12.2014 MAOLtaulukot (versio 2001/2013) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Jaksollinen järjestelmä
 Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
Mistä kaikki alkoi? Jaksollinen järjestelmä 1800-luvun alkupuoli: Alkuaineita yritettiin 1800-luvulla järjestää atomipainon mukaan monella eri tavalla. Vuonna 1826 Saksalainen Johann Wolfgang Döbereiner
Johdantoa/Kertausta. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Johdantoa/Kertausta MATERIAALIT JA TEKNOLOGIA, KE4 Mitä on kemia? Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
Atomi. Aineen perusyksikkö
 Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Kaikki ympärillämme oleva aine koostuu alkuaineista.
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014
 Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian pedagogiset perusteet Kari Sormunen Syksy 2014 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
CHEM-A1250 Luento 3 Sidokset (jatkuu) + kemiallinen reaktio
 CHEM-A1250 Luento 3 Sidokset (jatkuu) + kemiallinen reaktio Eeva-Leena Rautama Elektronien vastaanottaminen, luovuttaminen ja jakaminen Pääsääntöisesti kemiallisten sidosten muodostumista Sitoutumisella
CHEM-A1250 Luento 3 Sidokset (jatkuu) + kemiallinen reaktio Eeva-Leena Rautama Elektronien vastaanottaminen, luovuttaminen ja jakaminen Pääsääntöisesti kemiallisten sidosten muodostumista Sitoutumisella
JAKSOLLINEN JÄRJESTELMÄ
 JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
JASOLLINEN JÄRJESTELMÄ Oppitunnin tavoite: Oppitunnin tavoitteena on opettaa jaksollinen järjestelmä sekä sen historiaa alkuainepelin avulla. Tunnin tavoitteena on, että oppilaat oppivat tieteellisen tutkimuksen
c) Mitkä alkuaineet ovat tärkeitä ravinteita kasveille?
 ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
ke1 kertaustehtäviä kurssin lopussa 1. Selitä Kerro lyhyesti, mitä sana tarkoittaa. a) kemikaali b) alkuaine c) molekyyli d) vesiliukoinen 2. Kemiaa kotona ja ympärillä a) Kerro yksi kemian keksintö, jota
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
3.1 Sidostyyppejä ja reaktiotyyppejä. Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa
 3.1 Sidostyyppejä ja reaktiotyyppejä Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa Jos kahden aineen välinen elektronegatiivisuusero on riittävän suuri (>1,7), on se ionisidos. Jos
3.1 Sidostyyppejä ja reaktiotyyppejä Elektronegatiivisuus = alkuaineen kyky vetää elektroneja puoleensa Jos kahden aineen välinen elektronegatiivisuusero on riittävän suuri (>1,7), on se ionisidos. Jos
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
CHEM-A1200 Kemiallinen rakenne ja sitoutuminen
 CHEM-A1200 Kemiallinen rakenne ja sitoutuminen Orgaaninen reaktio Opettava tutkija Pekka M Joensuu Orgaaniset reaktiot Syyt Pelkkä törmäys ei riitä Varaukset (myös osittaisvaraukset) houkuttelevat molekyylejä
CHEM-A1200 Kemiallinen rakenne ja sitoutuminen Orgaaninen reaktio Opettava tutkija Pekka M Joensuu Orgaaniset reaktiot Syyt Pelkkä törmäys ei riitä Varaukset (myös osittaisvaraukset) houkuttelevat molekyylejä
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
luku2 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen
 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2 KE5). Yksi soveltava yo
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
Liitetaulukko 1/11. Tutkittujen materiaalien kokonaispitoisuudet KOTIMAINEN MB-JÄTE <1MM SAKSAN MB- JÄTE <1MM POHJAKUONA <10MM
 Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Liitetaulukko 1/11 Tutkittujen materiaalien kokonaispitoisuudet NÄYTE KOTIMAINEN MB-JÄTE
Metallit materiaaleina. kappale 4
 Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Metallit materiaaleina kappale 4 1 Pääryhmien metallit Hapetusluvut samat kuin ryhmän numero (ulkoelektronien määrä) eli +I, +II ja +III Reaktiokyky kasvaa atomikoon kasvaessa Ionisoitumisenergia kasvaa
Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet
 Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Päivitetty 13.12.2016 MAOLtaulukot (versio 2001/2013/2014) Taulukko Käyttötarkoitus Huomioita, miksi? Kreikkalaisten numeeriset etuliitteet esim. ilmoittamaan atomien lukumäärää molekyylissä (hiilimonoksidi
Alkuaineita luokitellaan atomimassojen perusteella
 IHMISEN JA ELINYMPÄRISTÖN KEMIAA, KE2 Alkuaineen suhteellinen atomimassa Kertausta: Isotoopin määritelmä: Saman alkuaineen eri atomien ytimissä on sama määrä protoneja (eli sama alkuaine), mutta neutronien
IHMISEN JA ELINYMPÄRISTÖN KEMIAA, KE2 Alkuaineen suhteellinen atomimassa Kertausta: Isotoopin määritelmä: Saman alkuaineen eri atomien ytimissä on sama määrä protoneja (eli sama alkuaine), mutta neutronien
Kemian tentti 2017 / RATKAISUT
 Kemian tentti 2017 / RATKAISUT 1. Tunnista seuraavat alkuaineet a) Metallin oksidi on muotoa XO. Metalli värjää liekin tiilenpunaiseksi ja sen yhdisteet ovat käytännön elämässä varsin merkittäviä. b) Aineen
Kemian tentti 2017 / RATKAISUT 1. Tunnista seuraavat alkuaineet a) Metallin oksidi on muotoa XO. Metalli värjää liekin tiilenpunaiseksi ja sen yhdisteet ovat käytännön elämässä varsin merkittäviä. b) Aineen
Tekijä lehtori Zofia Bazia-Hietikko
 Tekijä lehtori Zofia Bazia-Hietikko Tarkoituksena on tuoda esiin, että kemia on osa arkipäiväämme, siksi opiskeltavat asiat kytketään tuttuihin käytännön tilanteisiin. Ympärillämme on erilaisia kemiallisia
Tekijä lehtori Zofia Bazia-Hietikko Tarkoituksena on tuoda esiin, että kemia on osa arkipäiväämme, siksi opiskeltavat asiat kytketään tuttuihin käytännön tilanteisiin. Ympärillämme on erilaisia kemiallisia
Luento 1: Sisältö. Vyörakenteen muodostuminen Molekyyliorbitaalien muodostuminen Atomiketju Energia-aukko
 Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Kemia 1. Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Kemia 1 Mooli 1, Kemiaa kaikkialla, Otava 2016 MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen valmentava
Reaktioyhtälö. Sähköisen oppimisen edelläkävijä www.e-oppi.fi. Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava
 Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Puhtaat aineet ja seokset
 Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
Puhtaat aineet ja seokset KEMIAA KAIKKIALLA, KE1 Määritelmä: Puhdas aine sisältää vain yhtä alkuainetta tai yhdistettä. Esimerkiksi rautatanko sisältää vain Fe-atomeita ja ruokasuola vain NaCl-ioniyhdistettä
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Elektrolyysi Anodilla tapahtuu aina hapettuminen ja katodilla pelkistyminen!
 Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
Orgaanisten yhdisteiden rakenne ja ominaisuudet
 Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Orgaanisten yhdisteiden rakenne ja ominaisuudet 1 2 KOVALENTTISET SIDOKSET ORGAANISISSA YHDISTEISSÄ 3 4 5 6 7 Orgaanisissa molekyyleissä hiiliatomit muodostavat aina neljä kovalenttista sidosta Hiiliketju
Seokset ja liuokset. 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen
 Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
Seokset ja liuokset 1. Seostyypit 2. Aineen liukoisuus 3. Pitoisuuden yksiköt ja mittaaminen Hapot, emäkset ja ph 1. Hapot, emäkset ja ph-asteikko 2. ph -laskut 3. Neutralointi 4. Puskuriliuokset Seostyypit
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Ydinfysiikkaa. Tapio Hansson
 3.36pt Ydinfysiikkaa Tapio Hansson Ydin Ydin on atomin mittakaavassa äärimmäisen pieni. Sen koko on muutaman femtometrin luokkaa (10 15 m), kun taas koko atomin halkaisija on ångströmin luokkaa (10 10
3.36pt Ydinfysiikkaa Tapio Hansson Ydin Ydin on atomin mittakaavassa äärimmäisen pieni. Sen koko on muutaman femtometrin luokkaa (10 15 m), kun taas koko atomin halkaisija on ångströmin luokkaa (10 10
17VV VV Veden lämpötila 14,2 12,7 14,2 13,9 C Esikäsittely, suodatus (0,45 µm) ok ok ok ok L. ph 7,1 6,9 7,1 7,1 RA2000¹ L
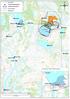 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
17VV VV 01021
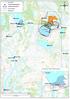 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Osio 1. Laskutehtävät
 Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Atomimallit. Tapio Hansson
 Atomimallit Tapio Hansson Atomin käsite Atomin käsite on peräisin antiikin Kreikasta. Filosofi Demokritos päätteli (n. 400 eaa.), että äärellisen maailman tulee koostua äärellisistä, jakamattomista hiukkasista
Atomimallit Tapio Hansson Atomin käsite Atomin käsite on peräisin antiikin Kreikasta. Filosofi Demokritos päätteli (n. 400 eaa.), että äärellisen maailman tulee koostua äärellisistä, jakamattomista hiukkasista
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
neon kemian kertauskirja Miria Hannola-Teitto Reija Jokela Markku Leskelä Elina Näsäkkälä Maija Pohjakallio Merja Rassi EDITA HELSINKI
 neon kemian kertauskirja Miria Hannola-Teitto Reija Jokela Markku Leskelä Elina Näsäkkälä Maija Pohjakallio Merja Rassi EDITA HELSINKI Tuottaja: Heini Mölsä Toimitus: Riitta Manninen ja Heini Mölsä Graafinen
neon kemian kertauskirja Miria Hannola-Teitto Reija Jokela Markku Leskelä Elina Näsäkkälä Maija Pohjakallio Merja Rassi EDITA HELSINKI Tuottaja: Heini Mölsä Toimitus: Riitta Manninen ja Heini Mölsä Graafinen
Seoksen pitoisuuslaskuja
 Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
Seoksen pitoisuuslaskuja KEMIAA KAIKKIALLA, KE1 Analyyttinen kemia tutkii aineiden määriä ja pitoisuuksia näytteissä. Pitoisuudet voidaan ilmoittaa: - massa- tai tilavuusprosentteina - promilleina tai
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot
 REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
REAKTIOT JA TASAPAINO, KE5 Vahvat&heikot protolyytit (vesiliuoksissa) ja protolyysireaktiot Kertausta: Alun perin hapot luokiteltiin aineiksi, jotka maistuvat happamilta. Toisaalta karvaalta maistuvat
Sähkökemia. Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali
 Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
CHEM-A1250 Luento 3, klo Kemiallinen reaktio
 CHEM-A1250 Luento 3, klo 12.30 Kemiallinen reaktio 18.1.2017 Eeva-Leena Rautama Kemiallinen reaktio: kaavat, stoikiometria, reaktioyhtälöt Atomimassa, atomin massa, atomin moolin massa? Atomimassa, dimensioton
CHEM-A1250 Luento 3, klo 12.30 Kemiallinen reaktio 18.1.2017 Eeva-Leena Rautama Kemiallinen reaktio: kaavat, stoikiometria, reaktioyhtälöt Atomimassa, atomin massa, atomin moolin massa? Atomimassa, dimensioton
Kemia 1. Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava
 Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Kemia 1 Mooli 1, Ihmisen ja elinympäristön kemia, Otava (2009) MAOL-taulukot, Otava 1 Kemia Kaikille yksi pakollinen kurssi (KE1). Neljä valtakunnallista syventävää kurssia (KE2-KE5). Yksi soveltava yo-kokeeseen
Kemia keskeinen luonnontiede
 KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
KEMIAA KAIKKIALLA, KE1 Kemia keskeinen luonnontiede Ihmisen kemian tietämyksen yhtenä alkuvaiheena voidaan pitää tulen keksimisestä (ruuan lämmitys). Myöhemmin, kuitenkin tuhansia vuosia sitten, osattiin
SIDOKSET. Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
SIDOKSET IHMISEN JA ELINYMPÄ- RISTÖN KEMIA, KE2 Palautetaan mieleen millaisia sidoksia kemia tuntee ja miten ne luokitellaan: Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
KE1 Kemiaa kaikkialla
 Kalle Lehtiniemi ja Leena Turpeenoja 1 KE1 Kemiaa kaikkialla HELSINGISSÄ KUSTANNUSOSAKEYHTIÖ OTAVA otavan asiakaspalvelu Puh. 0800 17117 asiakaspalvelu@otava.fi tilaukset Kirjavälitys Oy Puh. 010 345 1520
Kalle Lehtiniemi ja Leena Turpeenoja 1 KE1 Kemiaa kaikkialla HELSINGISSÄ KUSTANNUSOSAKEYHTIÖ OTAVA otavan asiakaspalvelu Puh. 0800 17117 asiakaspalvelu@otava.fi tilaukset Kirjavälitys Oy Puh. 010 345 1520
Puhdasaine Seos Aineen olomuodot
 1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
1. AINEEN RAKENNE Aineet jaetaan puhtaisiin aineisiin ja seoksiin. Puhdasaine Puhdasaine on alkuaine tai yhdiste. Alkuaine koostuu vain keskenään samanlaisista atomeista. Esim. rauta Fe. Yhdiste koostuu
Käsitteitä. Hapetusluku = kuvitteellinen varaus, jonka atomi saa elektronin siirtyessä
 Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Syntymäaika: 2. Kirjoita nimesi ja syntymäaikasi kaikkiin sivuille 1 ja 3-11 merkittyihin kohtiin.
 1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 15.6. 2011 klo 9-12 Nimi: Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-12. 2. Kirjoita nimesi
1 Helsingin, Jyväskylän ja Oulun yliopistojen kemian valintakoe Keskiviikkona 15.6. 2011 klo 9-12 Nimi: Yleiset ohjeet 1. Tarkista, että tehtäväpaperinipussa ovat kaikki sivut 1-12. 2. Kirjoita nimesi
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
AKKU- JA PARISTOTEKNIIKAT
 AKKU- JA PARISTOTEKNIIKAT H.Honkanen Kemiallisessa sähköparissa ( = paristossa ) ylempänä oleva, eli negatiivisempi, metalli syöpyy liuokseen. Akussa ei elektrodi syövy pois, vaan esimerkiksi lyijyakkua
AKKU- JA PARISTOTEKNIIKAT H.Honkanen Kemiallisessa sähköparissa ( = paristossa ) ylempänä oleva, eli negatiivisempi, metalli syöpyy liuokseen. Akussa ei elektrodi syövy pois, vaan esimerkiksi lyijyakkua
a) Puhdas aine ja seos b) Vahva happo Syövyttävä happo c) Emäs Emäksinen vesiliuos d) Amorfinen aine Kiteisen aineen
 1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
2. Maitohapon CH3 CH(OH) COOH molekyylissä
 1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
1. Yhdiste sisältää 37,51 massaprosenttia hiiltä, 58,30 massaprosenttia happea ja loput vetyä. Yhdisteen empiirinen kaava on a) C 3 4 4 b) C 4 5 5 c) C 5 7 6 d) C 6 8 7. 2. Maitohapon C3 C() C molekyylissä
Siirtymämetallien erityisominaisuuksia
 Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Siirtymämetallien erityisominaisuuksia MATERIAALIT JA TEKNOLOGIA, KE4 Sivuryhmien metallien kemiaa: Jaksojen (vaakarivit) 4 ja 5 sivuryhmien metalleista käytetään myös nimitystä d-lohkon alkuaineet, koska
Ydin- ja hiukkasfysiikka: Harjoitus 1 Ratkaisut 1
 Ydin- ja hiukkasfysiikka: Harjoitus Ratkaisut Tehtävä i) Isotoopeilla on sama määrä protoneja, eli sama järjestysluku Z, mutta eri massaluku A. Tässä isotooppeja keskenään ovat 9 30 3 0 4Be ja 4 Be, 4Si,
Ydin- ja hiukkasfysiikka: Harjoitus Ratkaisut Tehtävä i) Isotoopeilla on sama määrä protoneja, eli sama järjestysluku Z, mutta eri massaluku A. Tässä isotooppeja keskenään ovat 9 30 3 0 4Be ja 4 Be, 4Si,
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 22.1.2015 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 22.1.2015 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Kemia s2011 ratkaisuja. Kemian koe s 2011 lyhennettyjä ratkaisuja
 Kemian koe s 2011 lyhennettyjä ratkaisuja 1. a) Veden autoprotolyysin 2H 2 O(l) H 3 O + (aq) + OH (aq) seurauksena vedessä on pieni määrä OH ja H 3 O + ioneja, jotka toimivat varauksen kuljettajina. Jos
Kemian koe s 2011 lyhennettyjä ratkaisuja 1. a) Veden autoprotolyysin 2H 2 O(l) H 3 O + (aq) + OH (aq) seurauksena vedessä on pieni määrä OH ja H 3 O + ioneja, jotka toimivat varauksen kuljettajina. Jos
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli
 KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
