Lääkäriliite Uremian aktiivihoidon ennuste tyypin 1 diabeetikoilla... 3 ELINLUOVUTUKSELLE.
|
|
|
- Ville Nurminen
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 LIVSVILLKOR Lääkäriliite 2014 Voiko rekisteri parantaa hoidon laatua? Uremian aktiivihoidon ennuste tyypin 1 diabeetikoilla... 3 Maksa osana yleissairauksia... 3 Elinluovutustoiminnan lisääminen Suomessa SANO KYLLÄ ELINLUOVUTUKSELLE. Allekirjoita elinluovutuskortti. Kerro tahtosi läheisillesi. Välitä tietoa eteenpäin. Uudistetut KYLLÄ-sivut ovat netissä KYLLÄ on myös Facebookissa
2 non-adherence variability Optimising transplant outcome by improving immunosuppression adherence 1,2 and variability 3,4,5 ADVAGRAF 0,5 mg, 1 mg, 3 mg ja 5 mg depotkapselit. Vaikuttava aine: takrolimuusi. Käyttöaiheet: Siirrännäisen hylkimisreaktion esto allogeenisen munuais- tai maksasiirteen saaneilla aikuisilla. Allogeenista elimensiirtoa seuraavan, muihin immunosuppressiivisiin lääkevalmisteisiin reagoimattoman hylkimisreaktion hoito aikuisilla. Annostus: Advagraf on kerran vuorokaudessa suun kautta otettava takrolimuusimuoto. Tätä lääkevalmistetta saa määrätä ja immuno-suppressiivista hoitoa muuttaa ainoastaan lääkäri, jolla on kokemusta immunosuppressivisesta lääkityksestä ja elinsiirtopotilaiden hoidosta. Annostus vaihtelee käyttöaiheen mukaan. Annostuksen tulee ensisijaisesti perustua yksilölliseen sekä hylkimisreaktion että lääkkeen siedettävyyden kliiniseen arviointiin, joka tapahtuu seuraamalla lääkeaineen pitoisuuksia veressä (lääkkeen pitoisuuden monitorointi). Katso tarkemmin valmisteyhteenvedosta. Antotapa: Depotkapselit suositellaan annettavaksi kerran vuorokaudessa aamulla ja ne tulee nauttia välittömästi läpipainopakkauksesta ottamisen jälkeen nesteen kera tyhjään vatsaan tai viimeistään tunti ennen ateriaa tai 2-3 tuntia aterian jälkeen. Vasta-aiheet: Yliherkkyys takrolimuusille tai muille makrolideille tai apuaineille. Varoitukset ja varotoimet: Lääkitysvirheet ovat aiheuttaneet vakavia haittavaikutuksia, mm. siirrännäisen hylkimistä. Tästä syystä potilaiden tulisi pitäytyä vain yhdessä takrolimuusimuodossa ja sitä vastaavassa annostelutiheydessä. Siirronjälkeisen vaiheen alussa seuraavia parametreja on valvottava säännöllisesti: verenpaine, EKG, neurologinen status ja näöntutkimus, paastoverensokeri, elektrolyytit, maksa- ja munuaisfunktiotestit, hematologiset parametrit, hyytymistekijät ja plasman proteiinimääritykset. Ripulitauti saattaa muuttaa veren takrolimuusitasoja huomattavasti. Yhdistetty siklosporiinija takrolimuusikäyttö ei ole suositeltavaa. Valmistetta ei suositella alle 18-vuotiaille. Immunosuppressiivisia lääkkeitä käyttävillä on suurentunut vaara sairastua opportunisti-infektioihin (esim. PML). Takrolimuusilla hoidetuilla potilailla on todettu posteriorista reversiibeliä enkefalopatiasyndroomaa (PRES). ). Puhdas punasoluaplasia -tapauksia (PRCA) on raportoitu potilailla, jotka ovat saaneet takrolimuusia. Maha-suolikanavan perforaatiota on todettu takrolimuusia saaneilla potilailla. Kammion ja septumin hypertrofiaa on esiintynyt harvoin Prografia saaneilla, joten niitä saattaa esiintyä Advagrafia saavilla. Varovaisuutta tulee noudattaa hoidettaessa potilaita, joilla on todettu tai epäilty synnynnäinen pitkä QT-syndrooma tai hankittu pidentynyt QT-aika tai jotka käyttävät samanaikaisesti lääkkeitä, joiden tiedetään pidentävän QT-väliä, aiheuttavan elektrolyyttihäiriöitä tai lisäävän takrolimuusialtistusta. Takrolimuusia saaneilla potilailla on raportoitu EBV:hen liittyviä lymfoproliferatiivisia häiriöitä. Altistuminen auringonvalolle ja UV-valolle on minimoitava. Annoksen pienentäminen saattaa olla tarpeen vaikeaa maksan vajaatoimintaa sairastavilla. Advagraf-depotkapselit sisältävät laktoosia. Yhteisvaikutukset: CYP3A4:n estäjät (esim. ketokonatsoli, erytromysiini, HIV- ja HCV-proteaasi-inhibiittorit, greippimehu) tai induktorit (esim. rifampisiini, fenytoiini, mäkikuisma) tai CYP3A4:n välityksellä metaboloituvat aineet (esim. siklosporiini). Prokineettiset aineet, kuten metoklopramidi ja sisapridi. Simetidiini. Magnesiumalumiinihydroksidi. Nefrotoksisia tai neurotoksisia vaikutuksia omaavat lääkeaineet. Kalium tai kaliumia säästävät diureetit. Immunosuppressiolääkkeet. Elävät, heikennetyt rokotteet. Plasman proteiineihin voimakkaasti sitoutuvat lääkeaineet. Fertiliteetti, raskaus ja imetys: Keskenmenoja on raportoitu. Jos hoito katsotaan välttämättömäksi, takrolimuusia voidaan harkita raskaana oleville naisille silloin, kun turvallisempaa vaihtoehtoa ei ole ja lääkkeestä odotettavissa oleva hyöty ylittää sikiölle mahdollisesti aiheutuvan vaaran. Imetys tulee lopettaa hoidon ajaksi. Haittavaikutukset: Immunosuppressiivisiin lääkkeisiin liittyvää haittavaikutusprofiilia on usein vaikea arvioida perussairauden ja useiden muiden lääkkeiden samanaikaisen käytön vuoksi. Takrolimuusia saavilla potilailla on suurentunut riski saada jokin infektio tai pahanlaatuisia kasvaimia. Allergisia ja anafylaktoidisia reaktioita voi esiintyä. Hyvin yleisiä haittavaikutuksia ovat vapina, päänsärky, ripuli, pahoinvointi, munuaisten toiminnan heikentyminen, hyperglykemia, diabetes mellitus, hyperkalemia, hypertensio, epänormaalit tulokset maksan toimintaa mittaavissa kokeissa ja unettomuus. Yleiset ja harvinaisemmat haittavaikutukset, ks. valmisteyhteenveto. Pakkaukset ja hinnat (sis. alv 10 %): Advagraf 0,5 mg 50 depotkapselia 88,17, Advagraf 1 mg 50 depotkapselia 148,85, Advagraf 3 mg 50 depotkapselia 372,68, Advagraf 5 mg 50 depotkapselia 598,58. Korvattavuus: Ylempi erityiskorvaus (100 %): Elinsiirron tai kudossiirron jälkitila (127). Reseptilääke. Huom. Tutustu valmisteyhteenvetoon ennen lääkkeen määräämistä! Myyntiluvan haltija: Astellas Pharma Europe B.V., Alankomaat Markkinoija Suomessa: Astellas Pharma, Vaisalantie 2-8, Espoo, info.fi@astellas.com. Teksti perustuu päivättyyn valmisteyhteenvetoon. Muokattu viimeksi: ) Beckebaum S et al, Transpl. Int. 2011;24(7): ) Kuypers D et al, Transplantation 2013;95: ) Wu MJ et al, Transplantation 2011;92: ) Borra LC et al, Nephrol Dial Transplant 2010;25(8): ) Pollock-BarZiv SM et al, Pediatr Transplantation 2010;14: ASTELLAS PHARMA, Falcon Business Park, Vaisalantie 2-8, Espoo, info.fi@astellas.com HØJER /ADV Patrik Finne, dosentti, vastaava lääkäri Suomen munuaistautirekisteri Voiko rekisteri parantaa hoidon laatua? Suomen munuaistautirekisteri on esittänyt raporteissaan analyysejä dialyysi- ja munuaisensiirtopotilaiden hoidon laadusta vertailemalla laatuun liittyviä asioita sairaanhoitopiireittäin ja alueittain sekä tutkittu ajallista kehitystä. Aikaisemmin sairaanhoitopiirit on laatuanalyyseissä esitetty anonyymisti. Vuosiraportti 2012:ssa esitettiin ensimmäistä kertaa kaikki analyysit avoimesti. Näin ovat tehneet myös mm. Ruotsin ja Britannian munuaistautirekisterit. Useimmissa muissa maissa vastaavaa laaturaportointia ei vielä ole munuaistautien alalla. Terveydenhuollon laaturekisteri on rekisteri, joka säännöllisissä raporteissaan vertaa keskeisiä hoidon laatuun liittyviä tuloksia hoitokeskusten kesken ja seuraa hoidon laadun kehittymistä. On näyttöä siitä, että laatutietojen kerääminen ja raportointi parantaa hoidon laatua, joskin yleensä ainoastaan mitattujen parametrien osalta. Hoitokeskusten tulosten avoin esittäminen ja vertaaminen parantaa hoidon laatua yleensä vielä nopeammin. Laaturekistereiden tarve on tunnistettu Suomessakin. Paikallisia laaturekistereitä kehitetään, mutta tietosuojalaki ei salli rekistereiden yhdistämistä sairaanhoitopiirirajojen yli. Ainoastaan muutama rekisteri (mm. Syöpärekisteri ja Näkövammarekisteri) on saanut lakisääteisen aseman ja voi kerätä koko maan potilaiden tietoja ilman potilaiden suostumusta. Suomen munuaistautirekisterillä ei toistaiseksi ole lakisääteistä asemaa, mutta se on potilaiden kirjallisella suostumuksella onnistunut kerämään kattavasti tietoja dialyysi- ja munuaisensiirtopotilaista. Vuonna 2011 voimaan tullut terveydenhuoltolaki edellyttää sellaisten toimintatapojen mahdollistamista, joilla terveydenhuollon henkilökunta voi kehittää laadunhallintaa ja saada palautetta oppimista ja toimintansa kehittämistä varten. Lain mukaan toiminnan on perustuttava näyttöön ja laadunhallinnan on oltava jatkuvaa. Lisäksi ensi vuonna astuu voimaan EU:n potilasdirektiivi, jonka mukaan ajankohtaista tietoa hoidon laadusta on oltava avoimesti saatavilla. Näin ollen toimivat, kattavat kansalliset terveydenhuollon laaturekisterit vaikuttavat välttämättömiltä. Laaturekisteri antaa ajankohtaista ja vertailukelpoista tietoa hoitokeskusten lääketieteellisestä ja muusta laadusta. Ilman tällaista tietoa ei voi varmistua terveydenhuollon tasaarvoisuudesta ja terveydenhuollon kehittäminen on vaikeaa. Ruotsi on laaturekisterien edelläkävijä Ruotsi on laaturekistereiden edelläkävijämaa, jossa on jo 73 virallista terveydenhuollon laaturekisteriä. Svenska Kommuner och Landsting (SKL) valvoo ja rahoittaa rekisterit ja ohjausryhmä Nationella Kvalitetsregister pyrkii aktiivisesti kehittämään rekistereiden laatua. Kotisivul- laan Nationella Kvalitetsregister antaa määritelmän laaturekisteristä ( se). Laaturekisteri sisältää henkilötason tietoa tietyn terveydenhuollon alan ongelmista, hoidoista ja tuloksista. Se seuraa näyttöön perustuvien hoitosuositusten toteutumista ja sitä käytetään hoidon laadun jatkuvaan kehittämiseen ja varmistukseen. Laaturekisteri mahdollistaa parhaiden hoitokäytäntöjen tunnistamista ja jakamista sekä antaa mahdollisuuden jatkuvalle oppimiselle. Se tutkii hoidon vaikuttavuutta ja sen avulla voidaan tehdä alueellisia, kansallisia ja kansainvälisiä vertailuja. Ruotsin Nationella Kvalitetsregister on kehittänyt virallisille laaturekistereille sertifiointijärjestelmän, jonka avulla rekistereiden laatua valvotaan ( Edellytetään, että rekisterit ovat relevantteja erikoisalallaan, toimivia, kattavia ja säännöllisesti raportoivia. Pidetään tärkeänä, että hoitokeskusten laatutiedot raportoidaan avoimesti. Tietojen tallentamiseen rekisteriin ei tarvita potilaan suostumusta, mutta potilas voi kieltää tietojen luovuttamisen. Sertifioitu ruotsalainen laaturekisteri saa säännöllisen rahoituksen. Laaturekisteri myös Suomeen Sosiaali- ja terveysministeriö on myöntänyt Suomen munuaistautirekisterille rahoituksen hankkeelle, jonka tarkoitus on selvittää, miten rekisteriä voidaan kehittää varsinaiseksi laaturekisteriksi. Selvitys tehdään yhteistyös- sä sairaanhoitopiirien vastaavien nefrologien kanssa. Kokouksessa marraskuussa 2013 kukaan läsnäolleista nefrologeista ei vastustanut sairaanhoitopiirien laatutulosten avointa raportointia. Rekisterin tuoreimmassa vuosiraportissa on mukana laatuanalyysejä potilaiden hoitotuloksista, mm. verenpainetasosta, verenpainelääkityksestä, hemoglobiinista, fosforista, LDL-kolesterolista, dialyysiajan riittävyydestä ja dialyysin veritiestä. Kuviossa on esimerkkinä esitetty LDL-kolesterolitavoitteen saavuttaneiden munuaisensiirtopotilaiden osuuden ajallinen kehitys. Hyvien laatumittareiden valinta laaturekisteriin on oleellista, koska valinta ohjaa, millä tavalla laatua pyritään parantamaan. Nefrologien alalla tämä on erityisen haastavaa, koska suuria satunnaistettuja hoitokokeita on vähän. Sen vuoksi pitää nojautua kansainvälisiin hoitosuosituksiin, joiden tieteellinen näytönaste harvoin on kovin vahva. Hoitosuositukset ovat kuitenkin laatineet alan parhaat asiantuntijat. Laatumittareiden valinta on tärkeä osa Suomen munuaistautirekisterin laatuhanketta ja aihetta käsiteltiin sairaanhoitopiirien vastaavien nefrologien kanssa toukokuussa. Tavoitteena on kehittää Suomen munuaistautirekisteristä toimiva ja Suomeen sopiva laaturekisteri, joka palvelee suomalaista nefrologiaa ja sitä kautta parantaa hoitotuloksia. Yli 20-vuotiaiden munuaisensiirtopotilaiden jakauma seerumin LDL-kolesterolipitoisuuden mukaan. Suomen munuaistautirekisteri, vuosiraportti < 2,6 Seerumin LDL-kolesterolipitoisuus (mmol/l) 2, Osuus potilaista (%) 3
3 Helena Isoniemi, professori, ylilääkäri Elinsiirto- ja maksakirurgian klinikka HYKS Elinluovutustoiminnan lisääminen Suomessa Jaakko Helve, LL, Sisätauteihin erikoistuva lääkäri HYKS Uremian aktiivihoidon ennuste tyypin 1 diabeetikoilla Elinsiirtojen määrää rajoittava tekijä on puute elinluovuttajista. Elinluovuttaja on yleensä aivokuollut henkilö, joka ei ole eläessään vastustanut elinluovutusta tai elävä luovuttaja. Suomessa siirryttiin oletetun suostumuksen käyttöön kesällä Eli jos henkilö itse ei ole eläessään vastustanut elinluovutusta, hänen oletetaan suostuvan elinluovutukseen kuoltuaan. Hoitohenkilökunnan velvollisuus on selvittää vainajan tahto, jota tulee kunnioittaa. Omaisilla ei ole enää oikeutta kieltää elinluovutusta. Aivokuolleiden elinluovuttajien kokonaismäärä ei lakimuutoksen jälkeen ole merkittävästi muuttunut. Suomessa elävien luovuttajien määrä suhteessa tehtyjen munuaissiirtojen määrään on ollut Euroopan pienimpiä. Viime vuonna Suomessa oli 13 elävää luovuttajaa eli 2,4 luovuttajaa miljoonaa asukasta kohden. Norjassa tehtiin 68 siirtoa elävältä luovuttajalta, Ruotsissa 151 ja Tanskassa 107. Miljoonaa asukasta kohden muissa Pohjoismaissa oli siis 13,5 18,7 elävää luovuttajaa. Suomen laki sallii nykyisin luovuttajaksi lähiomaisen tai muun läheisen. Aiemmin luovuttajana saattoi toimia vain lähisukulainen, yleensä vanhemmat tai sisarukset, mutta nykyisin myös muu läheinen, kuten avio- tai avopuoliso. Munuaisen saajan ja luovuttajan välillä tulee olla siis vähintään tunneside. Käytännöt vaihtelevat eri maissa, lähestytäänkö dialyysipotilaan läheisiä luovutuksen mahdollisuudesta. Joissakin maissa nefrologit ottavat elinluovutuksen aktiivisesti puheeksi potilaan kanssa tai jopa ottavat yhteyttä potilaan läheisiin. Suomessa tällaista aktiivista linjaa ei ole ollut. On erittäin tärkeää, että elävään luovuttajaan ei kohdisteta minkäänlaista pakottamista. Luovutuksen pitää olla täysin vapaaehtoista ja sen taustalla on oltava pyyteetön halu auttaa toista ihmistä. Se ei kuitenkaan estä kertomasta luovutuksen mahdollisuudesta ja saada näin lisää vapaaehtoisia luovuttajia. Toistaiseksi ainoa opas elävälle munuaisluovuttajalle on Munuais- ja maksaliiton laatima opas, kun monissa muissa maissa on terveysministeriöiden laatimat oppaat. Suomessakin voitaisiin siirtyä aktiivisempaan linjaan tiedottamisessa elävän luovutuksen mahdollisuudesta. Samalla pitää huolehtia, ettei luovuttajaa painosteta eikä myöskään mitään taloudellista hyötyä liitetä luovutukseen. Elinluovutustoiminta osaksi sairaalan normaalia toimintaa Alueelliset erot toteutuneiden aivokuolleiden luovuttajien määrässä suhteutettuna väestöön ovat Suomessa erittäin suuret. Viime vuonna koko maassa oli 17,5 aivokuollutta elinluovuttajaa miljoonaa asukasta kohden. ERVA-alueilla vastaava luku vaihteli viiden viimeisen vuoden aikana välillä 14,3 23,0 ja eri sairaanhoitopiireissä vaihteluväli oli vielä suurempi: Tätä vaihtelua ei selitä erilainen sairastavuus tai muut lääketieteelliset erot. Tehdyt tutkimukset osoittavat, että meillä olisi lähes kaksinkertainen määrä luovuttajia mutta potentiaalisia luovuttajia ei tunnisteta. Jokaisessa luovuttajasairaalassa tulee kiinnittää huomiota tähän ja järjestää jatkuvaa koulutusta henkilökunnalle. Useat esimerkit osoittavat, että elinten saatavuuteen voidaan vaikuttaa kiinnittämällä huomiota elinluovutusprosessin organisointiin. Tästä on hyvänä esimerkkinä Oulun ja Helsingin yliopistollisten sairaaloiden toiminta viime vuosina. Niissä luotiin uusi sisäinen organisoituminen, jotta kaikki mahdolliset elinluovuttajat voidaan tunnistaa paremmin. Kriittisesti neurologisesti sairaan henkilön ensihoito ja päivystysyksiköiden toiminta on avainasemassa mahdollisten luovuttajien tunnistamisessa. Tietoisuutta lisättävä elävän luovutuksen mahdollisuudesta Riittävät resurssit sairaaloihin hoitaa mahdollista aivokuollutta elinluovuttajaa Jokaisen sairaalan sisäistettävä elinluovutus toiminta normaaliksi toiminnaksi Jokaiseen luovuttajasairaalaan elinluovutuksesta vastaavat henkilöt Henkilökunnan jatkuva koulutus elinluovutukseen liittyen Positiivinen tiedottaminen elinsiirroista Onnistumiseen tarvitaan koko henkilökunnan saumatonta yhteistyötä. Olisi tärkeää, että jokaisessa sairaalassa luovutustoiminta katsottaisiin sairaalan normaaliksi toiminnaksi, josta jokaisen tulisi huolehtia. Elinsiirtoja tarvitsevia potilaita tulee kaikista sairaanhoitopiireistä, ja siirron saanut palaa omaan keskussairaalaansa jatkohoitoon ja seurantaan. Vastaavasti kunkin keskussairaalaan pitäisi sisäistää, että elinsiirtoa tarvitseva potilas voi saada elimen vain, jos jokaisessa keskussairaalassa huolehditaan mahdollisten luovuttajien tunnistamisesta ja hoidosta. Tähän toimintaan sairaalan johdon pitää laittaa riittävästi resursseja. Kehitteillä valtakunnallinen elinluovutusorganisaatio Toistaiseksi Suomesta puuttuu valtakunnallinen elinluovutusorganisaatio. Tähän on tulossa muutos. Taustalla on Euroopan komission laatima EU-tason elinsiirtojen ja elinluovutusten määrän kasvuun tähtäävä ohjelma. Sosiaali- ja terveysministeriö asetti vuonna 2013 asiantuntijaryhmän, jonka tehtävä on laatia elinluovutuksia koskeva kansallinen toimintasuunnitelma. Työryhmän toiminnan kautta on jokaiseen luovuttajasairaalaan nimitetty elinluovutusvastaavat. Elinluovutusvastaavien tulee paikallisesti optimoida elinluovutusprosessi ja mahdollisten luovuttajien tunnistaminen. Kunkin sairaalan tulisi myös tehdä jatkuvaa sisäistä arviointia, onko mahdolliset luovuttajat tunnistettu, luovuttajien hoito optimoitu ja annettu riittävät resurssit tähän toimintaan. Henkilökunnalle tulee järjestää säännöllistä koulutusta. Myös elinsiirtojen julkisuutta pitäisi pyrkiä lisäämään. Hoitohenkilökunnasta peräti 84 prosenttia pitää elinsiirtoja koskevaa tietoisuutta suomalaisten keskuudessa korkeintaan keskinkertaisena, paljastaa viime vuonna teetetty kysely. Enemmistön mielestä keskustelua käydään liian vähän ja tiedottamiseen varattuja resursseja pidetään riittämättöminä. Tietoja elinsiirroista ja elinluovutuksista pitäisi pyrkiä pitämään positiivisessa mielessä pinnalla niin joukkotiedotusvälineissä kuin nettikanavilla. Viesti leviää parhaiten ja keskustelu käydään nykyään sosiaalisessa mediassa. Meidän kannattaa ottaa kaikki keinot käyttöön elinluovuttajien lisäämiseksi niin, että jokainen, joka lääketieteellisen arvion perusteella hyötyy elinsiirrosta, saa hyvin toimivan siirteen oikea-aikaisesti ja yhdenvertaisesti. Tähän jokainen voi vaikuttaa ottamalla asian puheeksi, kun sopiva tilanne osuu kohdalle. Riskitekijöiden vaikutus eloonjäämisennusteeseen tyypin 1 diabeetikoilla uremian aktiivihoitoa aloitettaessa Kuva perustuu Suomen munuaistautirekisterin tietoihin vuosilta ,0 0,8 0,6 0,4 0,2 0,0 Riskitekijät: Ikä yli 50 vuotta Seerumin albumiini alle 30 g/l Yksi tai useampi liitännäistauti Tyypin 1 diabeteksen ilmaantuvuus Suomessa on maailman suurin. 1 Vaikka loppuvaiheen munuaisten vajaatoiminnan eli uremian riski on pienentynyt 8 prosenttiin viime vuosikymmeninä näillä potilailla 30 vuoden seurannassa diabetes diagnoosista, 2 on tyypin 1 diabetes yksi merkittävimmistä uremian aktiivihoidon (dialyysi tai munuaisensiirto) syistä ja on munuaistaudin taustalla 16 prosentilla uremian aktiivihoidossa olevista potilaista Suomessa. Ilmaantuvuus on kuitenkin ollut laskussa viime vuosina. 3 Uremian aktiivihoidossa olevilla tyypin 1 diabeteetikoilla on kertainen kuolemanriski muuhun väestöön verrattuna ja kuolemanriski on suurempi kuin muilla uremian aktiivihoidossa olevilla potilailla. 4,5 Uremian aktiivihoidossa olevien tyypin 1 diabeetikoiden eloonjäämisennuste on parantunut merkittävästi viime vuosikymmeninä ja ennusteen paranemiseen näyttää vaikuttaneen sekä munuaiskorvaus hoidon että diabeteksen hoidon kehittyminen. Verrattaessa vuosina ja uremian aktiivihoidon aloittaneita tyypin 1 diabeetikoita, eloonjäämisennuste munuaiskorvaushoidon aloittamisesta parani 3,6 vuodesta yli 8 vuoteen. 6 Kuolemanriskiä lisäävät tekijät tulisi huomioida uremian aktiivihoitoa aloitettaessa, jotta ne voidaan ottaa huomioon potilaan ennustetta arvioitaessa ja hoitoja suunniteltaessa. Uremian aktiivihoidon alkaessa merkittävällä osalla tyypin 1 diabetesta sairastavista potilaista on liitännäissairauksia (sepelvaltimotauti, valtimonkovetustauti, sydämen vasemman kammion hypertrofia, sydämen vajaatoiminta tai aivoverenkierron häiriö) ja niitä on enemmän kuin muilla uremian aktiivihoitoon tulevilla potilailla. Liitännäissairaudet lisäävät ennenaikaisen kuoleman riskiä, ja näistä itsenäisiä kuolemanriskiä lisääviä tekijöitä ovat ahtauttava valtimonkovetustauti, sydämen vasemman kammion hypertrofia ja sydämen vajaatoiminta. 7 Jotta eloonjäämisennustetta voitaisiin parantaa, tulisi liitännäissairauksia pyrkiä ehkäisemään, diagnosoimaan ajoissa ja hoitamaan mahdollisimman hyvin munuaistautia sairastavilla tyypin 1 diabeetikoilla. Laboratorioarvoja voidaan käyttää eloonjäämisennusteen mittareina uremian aktiivihoitoa aloitettaessa. Ennen uremian aktiivihoidon aloittamista mitattu matalampi seerumin kreatiniini ja albumiini sekä korkea CRP liittyvät kohonneeseen kuolemanriskiin myös sekoittavilla tekijöillä vakioinnin jälkeen. 8 Matala kreatiniini kuvastaa alentunutta lihasmassaa ja matala albumiini huonoa ravitsemustilannetta, maksan toimintahäiriötä, merkittävää proteinuriaa tai kroonista inflammaatiota, jotka ymmärrettävästi heikentävät eloonjäämisennustetta. Näillä perustutkimuksilla voidaan tunnistaa suuren kuolemanriskin potilaat ja pyrkiä tehostamaan hoitoja tilanteen parantamiseksi. Kuva 1 osoittaa, miten voimakkaasti ikä, matala seerumin albumiini ja liitännäistaudit vaikuttavat uremian aktiivihoidossa olevien tyypin 1 diabeetikoiden eloonjäämisennusteeseen. Uremian aktiivihoidossa olevista tyypin 1 diabeetikoista Suomessa on 66 prosenttia saanut munuaisensiirron. Siirron saaneilla on merkittävästi parempi eloonjäämisennuste kuin Riskitekijät Ei riskitekijöitä 1 riskitekijä 2 riskitekijää 3 riskitekijää dialyysipotilailla. 6 Kuitenkin munuaisensiirtoon valitaan ennusteeltaan parhaat potilaat, eikä tätä valikoitumisharhaa voida kokonaan poistaa tutkimusasetelmissa, joten luotettavaa vertailua hoitomuotojen välillä on vaikeaa tehdä. Dialyysihoidon tehostamisen, munuaisensiirtojen lisäämisen, diabeteksen hoidon optimoimisen sekä yleisten elintapaohjeiden lisäksi lääkityksellä voidaan pyrkiä parantamaan >>> 4 5
4 <<< elämänlaatua ja eloonjäämisennustetta. Satunnaistettuja tutkimuksia lääkitysten vaikutuksesta kuolemanriskiin näillä potilailla ei kuitenkaan ole. Siitä huolimatta lääkityksen käyttö on yleistä vaikeaa munuaisten vajaatoimintaa sairastavilla tyypin 1 diabeetikoilla ja lisääntyy munuaistaudin edetessä. Yli kaksi kolmasosaa potilaista käyttää kalsiumkanavan salpaajia ja beetasalpaajia ennen uremian aktiivihoidon aloitusta. Tutkimuksessamme kalsiumkanavan salpaajien ja D-vitamiinin käyttöön liittyi pienentynyt kuolemanriski ikä- ja sukupuolivakioinnin jälkeen, mutta vakiointi muilla sekoittavilla tekijöillä hävitti tämän yhteyden. 9 Tällä hetkellä ei ole näyttöä siitä, että tietyllä lääkityksellä voitaisiin pienentää uremian aktiivihoidossa olevien tyypin 1 diabeetikoiden kuolemanriskiä. Näyttää kuitenkin siltä, että lääkityksellä saadaan sitä tarvitsevien potilaiden eloonjäämisennuste samalle tasolle kuin niiden, jotka eivät lääkitystä tarvitse. VIITTEET: 1) Harjutsalo V, Sjoberg L, Tuomilehto J. Time trends in the incidence of type 1 diabetes in finnish children: A cohort study. Lancet. 2008;371(9626): doi: / S (08) ) Finne P, Reunanen A, Stenman S, Groop PH, Gronhagen-Riska C. Incidence of end-stage renal disease in patients with type 1 diabetes. JAMA. 2005;294(14): doi: / jama ) Suomen munuaistautirekisteri, vuosiraportti ) Groop PH, Thomas MC, Moran JL, et al. The presence and severity of chronic kidney disease predicts all-cause mortality in type 1 diabetes. Diabetes. 2009;58(7): ) Lok CE, Oliver MJ, Rothwell DM, Hux JE. The growing volume of diabetes-related dialysis: A pop-ulation based study. Nephrol Dial Transplant. 2004;19(12): doi: / ndt/gfh540. 6) Haapio M, Helve J, Groop P-H, Grönhagen-Riska C, Finne P. Survival of patients with type 1 diabetes receiving renal replacement therapy in Diabetes Care. 2010; 33: ) Helve J, Haapio M, Groop P-H, Grönhagen-Riska C, Finne P. Comorbidities and survival of patients with type 1 diabetes on renal replacement therapy. Diabetologia. 2011; 54: ) Helve J, Haapio M, Groop P-H, Grönhagen-Riska C, Finne P. Biochemical variables and survival of patients with type 1 diabetes on renal replacement therapy. Julkaisematon. 9) Helve Jaakko, Sund Reijo, Haapio Mikko, Groop Per-Henrik, Grönhagen-Riska Carola, Finne Patrik. Medication among patients with type 1 diabetes and predialytic renal disease. Diabetes Res Clin Pract Dec 25. pii: S (13) doi: /j.diabres [Epub ahead of print] Urpo Nieminen, LKT, sisätautien ja gastroenteologian erikoislääkäri, Gastroenterologian klinikka, HYKS Maksa osana yleissaurauksia Maksa voi eräissä yleissairauksissa olla yksi muista kohde-elimistä, tai se voi olla ns. kärsivä sivustaseuraaja, jolloin siinä voidaan todeta ns. reaktiivisia muutoksia. Gastroenterologian alan sairauksista lievästi koholla olevia maksa-arvoja todetaan mm. keliakiassa, ja hoitamaton keliakia voi olla joskus vaikean maksan vajaatoiminnan syy. Yleisesti on tiedossa myös lihavuuteen liittyvä rasvamaksa seuraamuksineen, mutta myös aliravitsemuksessa ja anoreksiapotilailla voi esiintyä poikkeavia maksaentsyymiarvoja. Maksaan vaikuttavat myös mm. eräät kardiovaskulaariset, reumatologiset, hematologiset ja infektiosairaudet sekä mm. sarkoidoosi ja amyloidoosi, joista tarkemmin alla. Sydän- ja verenkiertosairaudet Maksamuutoksia todetaan sekä akuuttien että kroonisten sydänsairauksien yhteydessä. Kongestiivisessa hepatopatiassa todetaan maksalaskimoiden ja maksasinusoidien laajenemista. Kliinisistä oireista yleisin on hepatomegalia, harvoin myös splenomegalia, askites ja ikterus, joskus myös palpaatiolla tunnettavissa oleva pulsoiva maksa. Pitkään jatkuva kongestio voi johtaa maksan kirrotisoitumiseen; kardiaalinen kirroosi, muskottimaksa. Maksaentsyyminousujen ohella verikokeissa todetaan hyperbilirubinemiaa ja INR-arvon nousua. Sydämen toiminnan normalisoiduttua myös veriarvomuutokset yleensä korjautuvat. Iskeeminen hepatiitti Iskeeminen hepatiitti on harvinainen maksan verenkierron nopean vähenemisen aiheuttama tila. Yleisin syy on kardiogeeninen shokki, ja muita syitä ovat hypovoleminen shokki verenvuodon tai dehydraation seurauksena, lämpöhalvaus, palovamma ja septinen shokki. Potilaan hypotensiivinen vaihe voi olla ollut hyvinkin lyhyt, ja saattaa jopa olla jäänyt toteamatta. Iskeemisen hepatiitin kliininen kulku on usein hyvin samankaltainen: hyvin nopeasti ja erittäin korkealle tapahtuva transaminaasitasojen kohoaminen ja sitä seuraava hyvin nopea entsyymitasojen lasku. Transaminaasitasot esim. ASAT on usein tuhansia, jopa yli IU/L. Diagnoosi voidaankin tehdä usein edellä kuvatun kliinisen kuvan perusteella. Nestetasapainon ja hypoksiavaiheen korjauduttua arvot nopeasti myös korjautuvat, usein lähes puolittuvat yhden seurantavuorokauden aikana. Iskeemisen hepatiitin hoito on hypovolemian korjaus ja sydämen iskuvolyymin normalisoiminen. Iskeemisen hepatiitin syynä voi olla myös vaikea keuhkosairaus, tai uniapnea. Reumasairaudet Reuma- ja muut sidekudossairaudet edustavat laajaa tautiryhmää, joissa monissa myös maksan muutoksia on todettavissa. Maksamuutosten esiintyvyys, niiden kliininen kuva ja vaikeusaste vaihtelevat. Maksa-arvojen seuranta pitäisikin kuulua reumapotilaan seurantaan sinänsä, eikä ainoastaan lääketurvakokeiden muodossa. Vaikka maksamanifestaatiot reumatautien yhteydessä ovat harvinaisia, potilailla voidaan todeta kroonista aktiivia hepatiittia, primaari biliaarista kirroosia, sklerosoivaa kolangiittia ja nodulaarista regeneratiivista hyperplasiaa. Esimerkiksi noin joka viidennellä SLE-potilaalla todetaan maksaentsyymimuutoksia. Entsyyminousut ovat yleensä enintään kohtalaisia, mutta osalla muutos voi olla voimakas ja potilaalla saattaa ilmetä ikterusta ja merkittävää maksanvajaatoimintaa. Maksabiopsiassa löydökset ovat vaihtelevia; epäspesifistä portaalista tulehdusta, kroonista aktiivia hepatiittia ja kirroosimuutoksia. Yleisenä muutoksena kuvataan maksan rasvoittumista. Myös nivelreumassa (RA) todetaan usein poikkeavia maksaentsyymiarvoja, erityisesti AFOS-arvon nousuja. Vaikka AFOS saattaa olla myös luustoperäistä, n. 1/3 sen on todettu olevan maksaperäistä. Sjögrenin oireyhtymässä (SS) maksamuutoksia on todettu n. 10 %:lla potilaita. Yleisin maksamuutos on mitokondriovasta-aine-positiivinen primaari biliaarinen kirroosi (PBC), mutta myös myös sklerosoivaa kolangiittia (PSC) on todettu. Maksaentsyyminousuja todettaessa, on potilas tutkittava autoimmuuni maksasairauden selvittämiseksi. Lisäksi maksamuutoksia on kuvattu myös skleroderma- polymyosiitti- ja dermatomyosiitti-potilailla sekä antifosfolipidisyndroomassa. Infektiosairaudet Vaikeisiin infektiosairauksiin kuten ekstrahepaattiseen bakteeri-infektioon ja sepsikseen liittyy yleisenä sivuvaikutuksena kolestaasia. Syynä ajatellaan olevan konjugoituneen bilirubiinin erittymisen estyminen pro-inflammatoristen sytokiinien kuten TNF-α:n ja IL-6:n vaikutuksesta. Erityisesti veren AFOS, mutta myös ALAT, on usein koholla. Potilaat saattavat olla syvästikin ikteerisiä. Kolestaasi laukeaa sepsistilan korjautuessa, joten hoito on kohdistettava ensisijaisesti infektioon. Endokrinologiset sairaudet Endokriinisissa sairauksissa todetaan maksamuutoksia mm. kilpirauhassairauksissa ja diabeteksessa, Cushinin syndroomassa ja Addisonin taudissa. Hypotyreoosia todetaan n. 20% primaari biliaari kirroosia sairastavilla. Yleisimmin todetaan AFOS-arvojen nousua, josta osalla se on luustoperäistä. ALAT-arvojen nousu on harvinaisempaa. Yleisin diabeteksen aiheuttama maksasairaus on kuitenkin rasvamaksa. Myös hyperkortisolismissa maksan rasvoittuneisuutta todetaan n. 50% potilaita. Addisonin taudissa on myös kuvattu kohonneita seerumin aminotransferaasitasoja, jotka normalisoituvat hormonikorvaushoidon aikana. Hematologiset sairaudet Hematologisten sairauksien maksamanifestaatiot: Sekä Hodgkinin taudissa että non-hodgkin-lymfoomassa voidaan todeta tuumorisolukon maksainfiltraatiota ja hepatomegaliaa. Aminotransfraasitasot voivat olla lievästi koholla ja alkalinen fosfataasi kohtalaisesti koholla. Syynä voi olla esimerkiksi lymfooman infiltraatio maksaan. Lymfoomien yhteydessä maksavaurio voi edetä jopa akuuttiin maksan vajaatoimintaan. Lymfoomapotilaiden hoidon aikana ilmenevä maksa-arvojen nousun yhtenä syynä on aiheen muistaa mahdollinen B-hepatiittiviruksen reaktivaatio. Myös myelomassa plasmasolujen maksainfiltraatiota todetaan 30% potilaita. Amyloidoosi Primaarinen systeemi amyloidoosi, AL amyloidoosi, on harvinainen, mutta amyloidin kertyminen maksaan siinä on yleistä, n. 70%:lla potilaita. Sekundaarinen AA amyloidoosi esiintyy pitkäaikaisten tulehduksellisten sairauksien, infektiotautien ja eräiden syöpien yhteydessä. Tulehdukselliset reumasairaudet ovat AA-amyloidoosin tavallisin syy. Hepatomegalia on tavanomaisin maksamuutos. Vain maksan massiivinen amyloidi-infiltraatio aiheuttaa maksan vajaatoimintaa. Sarkoidoosi Sarkoidoosi on yleissairaus, jossa granuloomia esiintyy monissa elimissä, myös maksassa. Vaikka usein myös keuhkoissa todetaan sarkoidoosia, itsenäistä maksan sarkoidoosia on kuvattu n. ¼ potilaita. Maksasarkoidoosi on usein oireeton. Oireina yleisimmin esiintyy kutinaa ja vatsakipuja, harvoin ikterusta tai kuumeilua. Laboratoriokokeissa AFOS-tason kohoaminen on tavanomaisin löydös, ja lievää transaminaasi-arvojen nousua esiintyy noin 1/3 potilaita. Diagnoosi varmentuu maksabiopsiassa. Tärkeää on myös sulkea pois granuloomia aiheuttavat infektiotaudit. Maksasarkoidoosin hoidossa käytetään ensisijaisesti glukokortikoideja kuten keuhkosarkoidoosissakin. Oireettomassa lievässä taudin muodossa hoitoa ei aina pidetä aiheellisena. Glukokortikoidihoidon vaihtoehtoina ovat eri immunosuppressiolääkkeet. Ursodeoksikoolihappo saattaa vähentää potilaiden oireita ja alentaa maksa-arvoja, samoin sillä on kuvattu myös immunomoduloivaa vaikutusta. Hoitoresistentissä vaikeassa sarkoidoosissa maksansiirto saattaa olla hoitovaihtoehto, mutta tauti voi uusia siirrettyyn maksaan. VIITE: Nieminen U. Systeemisairaudet ja maksa. Kirjassa: Färkkilä M, Isoniemi H, Kaukinen K, Puolakkainen P, toim. Gastroenterologia ja hepatologia, DUODECIM 2013, ss Terveet munuaiset Biomedicum, Munuaissäätiö täyttää 40 vuotta ja järjestää Terveet munuaiset -tapahtuman perjantaina Biomedicumissa. Suomen Nefrologiyhdistys järjestää ensin lääketieteellisen juhlaseminaarin, jonka jälkeen alkaa kaikille avoin yleisötapahtuma ja säätiön juhlatilaisuus. Munuais- ja maksaliitto perusti Munuaissäätiön vuonna 1974 tukemaan munuais- ja virtsatiesairauksien lääketieteellistä tutkimusta. Munuaissairauksien ennaltaehkäisy, sairauden syiden selvittäminen ja hoitomuotojen kehitys edellyttävät korkeatasoista tutkimustyötä. munuaissaatio Lääketieteellinen juhlaseminaari LS 2 Biomedicum Sessio I, Eero Honkanen, pj Aikuisten munuaissiirrot 50 vuotta, Kaija Salmela Dialyysin laatu ja kesto vaikuttavat munuaissiirron tuloksiin, Patrik Finne Onko munuaissiirteen ja sen saajan iällä merkitystä? Heikki Saha Munuaissiirto elävältä luovuttajalta, Eero Honkanen Kahvi ja näyttely Sessio II, Krister Höckerstedt, pj HLA-immunisaation merkitys munuaissiirron jälkeen, Jouni Lauronen Haima-munuaissiirto, Marko Lempinen Lasten munuaissiirrot suomalainen menestystarina, Hannu Jalanko Munuaissäätiö 40 vuotta Terveet munuaiset Biomedicum Yleisöluennot Kohonnut verenpaine, professori Ilkka Pörsti Aikuisten munuaissiirrot 50 vuotta, professori Kaija Salmela Lasten munuaissiirrot suomalainen menestystarina, professori Hannu Jalanko Medicanto-kuoro Munuaissäätiön 40 vuotta, Carola Grönhagen-Riska Pro Sanguine Puro -mitalien jako Stipendien jako Sylvi Calasin palkinto ja saajan luento Medicanto-kuoro Yleisöluennot Lisätietoja lääketieteellisestä seminaarista: Satu Mäkelä, pj, SNY, satu.m.makela@pshp.fi. Ilmoittautumiset seminaariin: munuaissaatio@musili.fi. Koulutus on maksuton. 6 7
5 Peginterferoni alfa-2b HELPPO ja JOUSTAVA annostelu sekoita lääke kiinnitä neula valitse annos Lisätietoja: Keilaranta 3, Espoo puh (09) PEGINTRON 50, 80, 100, 120 ja 150 µg injektiokuiva-aine ja liuotin, liuosta varten, esitäytetyssä kynässä. Käyttöaiheet: Aikuiset (kaksoishoito ja monoterapia): PegIntron on tarkoitettu käytettäväksi aikuisille potilaille (18 vuotta täyttäneille), joilla on krooninen C-hepatiitti ja hepatiitti C-viruksen RNA (HCV-RNA) on positiivinen, mukaan lukien potilaat, joilla on kompensoitunut kirroosi ja/tai joilla on kliinisesti stabiili samanaikainen HIV-infektio. Paras tapa käyttää PEGINTRONia tässä indikaatiossa on yhdessä ribaviriinin kanssa. Aikuiset (kolmoishoito): PegIntron yhdessä ribaviriinin ja bosepreviirin kanssa (kolmoishoito) on tarkoitettu kroonisen C-hepatiitin genotyypin 1 infektion hoitoon aikuisille potilaille (18 vuotta täyttäneille), joilla on kompensoitunut maksasairaus ja jotka eivät ole aikaisemmin saaneet hoitoa tai joiden aikaisempi hoito on osoittautunut tehottomaksi. Pediatriset potilaat (kaksoishoito): PegIntron on tarkoitettu yhdessä ribaviriinin kanssa 3 vuottta täyttäneille lapsille ja nuorille, joilla on aiemmin hoitamaton krooninen C-hepatiitti, joilla maksa ei ole dekompensoitunut, ja joilla HCV-RNA on positiivinen. Annostus ja antotapa: Hoidon aloittavan ja sitä valvovan lääkärin tulee olla perehtynyt C-hepatiitin hoitoon. PEGINTRON annetaan kerran viikossa injektiona ihonalaisesti. Aikuiset: PEGINTRONia annetaan 1,5 µg/kg/viikko yhdessä ribaviriinikapseleiden kanssa. Kolme vuotta täyttäneet lapset ja nuoret: PEGINTRONin annos lapsille ja nuorille lasketaan ihon pinta-alan mukaan ja ribaviriinin annos painon mukaan. Suositeltava PEGINTRONin annos on 60 μg/m 2 /viikko ihon alle. Ks. tarkemmin valmisteyhteenveto. Vasta-aiheet: Yliherkkyys vaikuttavalle aineelle, jollekin interferonille tai apuaineille; vaikea sydänsairaus, mukaan lukien epävakaa tai kontrolloimaton sydänsairaus, viimeksi kuluneiden kuuden kuukauden aikana; vaikeat potilasta heikentävät sairaudet; autoimmuunihepatiitti tai aiempi autoimmuunisairaus; vaikea maksan toimintahäiriö tai vajaatoimintaa aiheuttava maksakirroosi; kilpirauhasen sairaus, jos sitä ei pystytä tavanomaisella hoidolla pitämään hallinnassa; epilepsia ja/tai keskushermoston toiminnan häiriö. PEGINTRON-hoitoa ei tule aloittaa samanaikaista HCV/HIV-infektiota sairastaville potilaille, joilla on kirroosi ja Child-Pugh -arvo 6. PegIntronin samanaikainen käyttö telbivudiinin kanssa. Lapset ja nuoret: Nykyinen tai aikaisempi vaikea psyykkinen tila, erityisesti vaikea depressio, itsetuhoajatus tai itsemurhayritys. Yhdistelmähoito ribaviriinin kanssa: Tutustu myös ribaviriinin valmisteyhteenvetoon, jos PEGINTRONia käytetään yhdessä ribaviriinin kanssa kroonista C-hepatiittia sairastavien potilaiden hoitoon. Varoitukset ja käyttöön liittyvät varotoimet: Psyykkiset ja keskushermostovaikutukset: Vaikeita keskushermostovaikutuksia, erityisesti depressiota, itsetuhoajatuksia ja itsemurhayrityksiä, on havaittu joillain potilailla PEGINTRON-hoidon aikana, myös hoidon lopettamisen jälkeen pääasiassa kuuden kuukauden pituisen seurantajakson aikana. Muitakin keskushermostohäiriöitä mukaan lukien aggressiivista käyttäytymistä (toisinaan muihin ihmisiin kohdistuvaa, kuten murhanhimoisia ajatuksia), kaksisuuntaista mielialahäiriötä, maniaa, sekavuutta ja psyykkisen tilan muutoksia, on havaittu alfainterferoneilla. Potilaita on tarkkailtava huolellisesti, jotta havaitaan psyykkisten häiriöiden merkit ja oireet. Mikäli ilmenee edellä mainittuja oireita, lääkärin tulee muistaa näiden ei-toivottujen vaikutusten mahdollinen vakavuus ja sopivan terapeuttisen hoidon tarvetta tulee harkita. Jos psyykkiset oireet jatkuvat tai pahenevat tai havaitaan itsetuhoajatuksia, on suositeltavaa keskeyttää PEGINTRON-hoito, tarkkailla potilasta ja tarpeen mukaan hoitaa psyykkistä tilaa. Nykyinen tai aiempi vaikea psyykkinen sairaus. Jos hoito peginterferoni alfa-2b:llä katsotaan välttämättömäksi potilaille, joilla on tai on ollut vaikea psyykkinen sairaus, hoito tulee aloittaa vasta kun on varmistettu psyykkisen sairauden asianmukainen diagnoosi ja yksilöity hoito. PEGINTRONia ei saa käyttää lapsille ja nuorille, joilla on nykyinen tai aiempi vaikea psyykkinen sairaus. Päihteiden käyttö/väärinkäyttö: Samanaikainen päihteiden käyttö lisää psyykkisten häiriöiden ilmaantumisen tai pahenemisen riskiä alfainterferonihoitoa saavilla C-hepatiittipotilailla. Pituuskasvu ja kehitys (lapset ja nuoret): Jopa 48 viikkoa kestäneen hoidon aikana painon aleneminen ja pituuskasvun hidastuminen olivat yleisiä 3 17-vuotiailla potilailla. Akuutteja yliherkkyysreaktioita on havaittu harvinaisina potilailla interferoni alfa-2b-hoidon aikana. Jos potilaalle kehittyy tällainen reaktio PEGINTRON-hoidon aikana, hoito on keskeytettävä ja asianmukainen lääketieteellinen hoito aloitettava välittömästi. Verenkiertoelimet: Kuten interferoni alfa-2b:llä, aikuisia potilaita, joilla on ollut sydämen vajaatoimintaa, sydäninfarkti ja/tai aiempia tai jatkuvia rytmihäiriöitä, on syytä tarkkailla huolellisesti PEGINTRON-hoidon aikana. Maksan toiminta: Kaikkien interferonien tavoin PEGINTRON-hoito on keskeytettävä, mikäli potilaalla ilmenee maksan vajaatoimintaan viittaavia veren hyytymistekijöiden muutoksia. Kuume: Vaikka kuume saattaa liittyä interferoni-hoidon aikana yleisesti kuvattuun vilustumisen kaltaiseen oireyhtymään, on pitkäaikaisen kuumeen mahdolliset muut syyt suljettava pois. Nesteytys: PEGINTRON-hoitoa saavien potilaiden nestetasapainosta on huolehdittava, sillä joillain alfainterferoneja saaneilla potilailla on havaittu nestevajauksesta johtuvaa verenpaineen laskua. Keuhkomuutokset: Keuhkoinfiltraatteja, pneumoniittia ja pneumoniaa, joskus fataaleja, on harvoin havaittu alfainterferoneja saaneilla potilailla. Autoimmuunisairaus: Autovasta-aineiden ja autoimmuunisairauden kehittymistä on raportoitu alfainterferonihoitojen aikana. Muutokset silmissä: Silmiin liittyviä häiriöitä mukaan lukien verkkokalvon eksudaatteja, serooseja verkkokalvon irtaumia ja verkkokalvovaltimon tai -laskimon tukkeumia on joskus havaittu alfainterferoneilla hoidetuilla. Muutokset kilpirauhasen toiminnassa: Alfainterferonihoitoa saaneille kroonista C-hepatiittia sairastaville aikuisille potilaille on harvoin kehittynyt kilpirauhasen toimintahäiriöitä, joko vajaa- tai liikatoimintaa. Lapsia ja nuoria potilaita pitää seurata kolmen kuukauden välein kilpirauhasen toimintahäiriön havaitsemiseksi (esim. TSH). Aineenvaihduntahäiriöt: Hypertriglyseridemiaa ja hypertriglyseridemian pahenemista, toisinaan vakavaa, on havaittu. Siksi on suositeltavaa tarkkailla lipidiarvoja. Samanaikainen HCV/HIV-infektio: Potilailla, joilla on samanaikainen HIV-infektio ja jotka saavat erittäin tehokasta antiretroviraalista lääkitystä (HAART-hoitoa), saattaa maitohappoasidoosin vaara lisääntyä. On noudatettava varovaisuutta, kun PEGINTRON ja ribaviriini lisätään HAART-hoitoon (ks. ribaviriinin valmisteyhteenveto). Maksan dekompensaatio samanaikaista HCV/HIV-infektiota sairastavilla potilailla, joilla on edennyt kirroosi: Potilailla, joilla on samanaikainen infektio ja edennyt kirroosi ja jotka saavat HAART-hoitoa, saattaa hepatiitin dekompensaation ja kuoleman mahdollisuus lisääntyä. Tässä potilasryhmässä pelkän alfainterferonin tai alfainterferonin ja ribaviriinin yhdistelmän lisääminen hoitoon saattaa suurentaa riskiä. Hematologiset poikkeamat samanaikaista HCV/HIV-infektiota sairastavilla potilailla: Samanaikaista HCV/HIV-infektiota sairastavilla potilailla, jotka saavat peginterferoni alfa-2b/ribaviriini- ja HAART-hoitoa, saattaa hematologisten poikkeamien riski lisääntyä verrattuna potilaisiin, joilla on pelkästään HCV-infektio. Potilailla, jotka saavat PegIntronin ja ribaviriinin yhdistelmähoitoa sekä tsidovudiinia, anemian riski on lisääntynyt. Potilaat, joilla alhaiset CD4-määrät: Samanaikaista HCV/HIV-infektiota sairastavista potilaista, joilla CD4-määrä on alle 200 solua/μl, on vain rajoitetusti tehoon ja turvallisuuteen liittyvää tietoa. Varovaisuutta tulee siten noudattaa, kun hoidetaan potilaita, joilla on alhaiset CD4-määrät. Hampaisiin ja hampaiden vieruskudokseen liittyvät häiriötilat: Hampaisiin ja hampaiden vieruskudokseen liittyviä häiriötiloja, jotka saattavat johtaa hampaiden lähtemiseen, on raportoitu PEGINTRONia ja ribaviriinia yhdistelmähoitona saavilla potilailla. Lisäksi suun kuivuminen saattaa vahingoittaa hampaita ja suun limakalvoja käytettäessä PEGINTRONin ja ribaviriinin yhdistelmähoitoa pitkäaikaisesti. Elinsiirtopotilaat: Pelkän PEGINTRONin tai PEGINTRONin ja ribaviriinin yhdistelmän turvallisuutta ja tehoa C-hepatiitin hoidossa maksa- tai muilla elinsiirtopotilailla ei ole tutkittu. Muuta: Koska on raportoitu alfainterferonin pahentavan psoriaasia ja sarkoidoosia, PEGINTRONin käyttö psoriaasi- tai sarkoidoosipotilaille on suositeltavaa vain, jos hoidosta saatavan hyödyn uskotaan ylittävän mahdolliset haitat. Yhteisvaikutukset: Varovaisuutta tulee noudattaa, kun annetaan peginterferoni alfa-2b:tä sellaisten lääkeaineiden kanssa, jotka metaboloituvat CYP2D6:n ja CYP2C8/9:n avulla, erityisesti jos lääkeaineiden terapeuttinen indeksi on kapea kuten varfariinilla ja fenytoiinilla (CYP2C9) ja flekainidilla (CYP2D6). Metadoni: Potilaita on tarkkailtava lisääntyvän sedatiivisen vaikutuksen merkkien ja oireiden varalta kuten myös hengityslaman varalta. Erityisesti metadonia suurina annoksina saavilla potilailla tulee huomioida QTC-ajan pidentymisen vaara. Samanaikainen HCV/HIV-infektio: Ribaviriinin ja didanosiinin samanaikaista käyttöä ei suositella. Ribaviriinin samanaikainen käyttö tsidovudiinin kanssa ei ole suositeltavaa lisääntyneen anemian riskin vuoksi Telbivudiini: PegIntronin ja telbivudiinin samanaikainen käyttö on kontraindisoitu.raskaus ja imetys: PEGINTRON-valmisteen käyttöä hedelmällisessä iässä oleville naisille suositellaan vain mikäli he käyttävät tehokasta ehkäisymenetelmää hoidon aikana. Imetys pitäisi lopettaa ennen hoidon aloittamista. Vaikutus ajokykyyn ja koneiden käyttökykyyn: Potilaita, joilla ilmenee väsymystä, uneliaisuutta tai sekavuutta PEGINTRON-hoidon aikana, tulee varoittaa autolla ajosta ja koneiden käytöstä. Haittavaikutukset: Kolmoishoito: Tutustu bosepreviirin valmisteyhteenvetoon. Kaksoishoito: Aikuiset: Yleisimmät hoidosta aiheutuneet haittavaikutukset, joita havaittiin yli puolella aikuisista koehenkilöistä PEGINTRONilla ja ribaviriinillä tehdyissä kliinisissä tutkimuksissa, olivat väsymys, päänsärky ja pistokohdan reaktio. Muita haittavaikutuksia, joita esiintyi yli 25 %:lla koehenkilöistä, olivat pahoinvointi, vilunväreet, unettomuus, anemia, kuume, lihassärky, astenia, kipu, alopesia, ruokahaluttomuus, painon lasku, masentuneisuus, ihottuma ja ärtyneisyys. Yleisimmin raportoidut haittavaikutukset olivat lieviä tai kohtalaisia vaikeusasteeltaan ja olivat hoidettavissa ilman tarvetta annosten muuttamiseen tai hoidon keskeyttämiseen. Lapset ja nuoret: Kliinisessä tutkimuksessa 107:llä 3 17-vuotiaalla lapsella ja nuorella potilaalla, jotka saivat PEGINTRONin ja ribaviriinin yhdistelmähoitoa, annosta piti muuttaa 25 %:lla potilaista, yleisimmin anemian, neutropenian tai painon alenemisen vuoksi. Yleensä haittavaikutusprofiili oli lapsilla ja nuorilla samanlainen kuin aikuisilla, vaikkakin lapsipotilailla oli lisäksi huolena kasvun hidastuminen. Hyvin yleiset ( 1/10) ja yleiset ( 1/100, <1/10) raportoidut haittavaikutukset: hyvin yleiset: virusinfektio, nielutulehdus, anemia, neutropenia, ruokahaluttomuus,masentuneisuus, ahdistuneisuus, mielialan horjuvuus, keskisttymiskyvyn heikkeneminen, unettomuus, päänsärky, heitehuimaus,hengenahdistus, yskäoksentelu, pahoinvointi, vatsakipu, ripuli, suun kuivuminen, alopesia, kutina, ihon kuivuminen, ihottuma, lihassärky, nivelkipu, lihaksiin ja luustoon liittyvä kipu, pistokohdan reaktio, pistokohdan tulehdus, väsymys, astenia, ärtyisyys, vilunväreet, kuume, influenssan kaltainen sairaus, kipu, painon aleneminen. Yleiset: bakteeri-infektio (mukaan lukien sepsis), sieni-infektio, influenssa, ylähengitysinfektio, bronkiitti, herpes simplex, sinuiitti, välikorvantulehdus, riniitti, hemolyyttinen anemia, leukopenia, tromposytopenia, lymfadenopatia, kilpirauhasen vajaatoiminta, kilpirauhasen liikatoiminta, hypokalsemia, hyperurikemia, kuivuminen, lisääntynyt ruokahalu, aggressio, agitaatio, kiukkuisuus, mielialan muutos, epänormaali käytös, hermostuneisuus, unihäiriöt, libidon aleneminen, apatia, epänormaalit unet, itkeminen, muistinmenetys, muistin heikkeneminen, pyörtyminen, migreeni, ataksia, sekavuus, neuralgia, tuntoharha, hypoestesia, hyperestesia, hypertonia, uneliaisuus, tarkkaavaisuuden häiriintyminen, vapina, makuhäiriö, näkökyvyn häiriöt, näön sumentuminen, valonarkuus, sidekalvontulehdus, silmän ärsytys, kyynelrauhasen häiriö, kipu silmässä, kuivasilmäisyys, kuulon heikkeneminen/menetys, tinnitus, huimaus, sydämen tykytys, takykardia, hypotensio, hypertensio, punoitus,äänen käheys, nenäverenvuoto, hengitykseen liittyvä häiriö, hengitysteiden tukkoisuus, nenän sivuonteloiden tukkoisuus, nenän tukkoisuus, rinorrea, lisääntynyt eritys ylähengitysteissä, nielun ja kurkunpään kipu, ruoansulatushäiriö, gastroesofageaalinen refluksisairaus, suutulehdus, suun haavaumat, kipu kielessä, verenvuoro ikenistä, ummetus, ilmavaivat, peräpukamat, huulitukehdus, vatsan turvotus, ientulehdus, kielitulehdus, hammashäiriö, hyperbilirubinemia, hepatomegalia, psoriaasi, valoherkkyysreaktio, makulopapulaarinen ihottuma, ihotulehdus, punoittava ihottuma, ekseema, yöhikoilu, liikahikoilu, akne, furunkuloosi, eryteema, urtikaria, epänormaali karvan rakenne, kynnen häiriö, niveltulehdus, selkäkipu, lihaskouristus, kipu raajoissa, lisääntynyt virtsaamistarve, polyuria, epänormaali virtsa, amennorrea, kipu rinnoissa, menorragia, kuukautishäiriöt, munasarjaan liittyvä häiriö, emättimeen liittyvä häiriö, seksuaalinen toimintahäiriö, eturauhastulehdus, erektiohäiriö, rintakipu, epämukava tunne rinnassa, kipu pistokohdassa, huonovointisuus, kasvojen turvotus, perifeerinen turvotus, epänormaali tunne, jano Säilytys: Avaamattomana 2 C 8 C:ssa 3 vuotta. Käyttövalmiiksi sekoittamisen jälkeen: Mikrobiologiselta kannalta tuote tulee käyttää välittömästi käyttövalmiiksi sekoittamisen jälkeen. Jos sitä ei käytetä välittömästi, säilytysaika ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä normaalisti saisi ylittää 24 tuntia 2 C 8 C:ssa. Annostus: PegIntron annetaan kerran viikossa injektiona ihonalaisesti. Tarvittavan annoksen suuruus aikuisille riiippuu siitä, annetaanko se yhdistelmähoitona (kaksoishoitona tai kolmoishoitona) vai yksinään. Aikuiset: Yhdistelmähoito PegIntronilla (kaksoishoito tai kolmoishoito): PegIntronia 1,5 mikrogrammaa/kg/ viikko yhdessä ribaviriinikapseleiden kanssa. PegIntron yksinään: Käytettäessä pelkkää PegIntronia annos on 0,5 tai 1,0 µg/kg/viikko. Pediatriset potilaat: Vain kaksoishoito: PegInrtonin annos 3 vuotta täyttäneille lapsille ja nuorille lasketaan ihon pinta.alan mukaan. Suositeltava pegintronin annos on 60 µg/m 2 /viikko ihon alle yhdessä ribaviriiniannoksen 15 mg/kg/vrk suun kautta ruoan kanssa jaettuna kahteen annokseen (aamuisin ja iltaisin). Pakkauskoot ja hinnat (TOH 06/2013, alv 0 %): 4 kynää sisältäen kuiva-aineen ja liuottimen injektionestettä varten, 4 injektioneulaa ja 8 puhdistuspyyhettä vahvuuksissa 50 μg (501,07 ), 80 μg (773,07 ), 100 μg (912,66 ), 120 μg (1095,18 ), 150 μg (1368,98 ). Lääkkeen lailliset toimittamisehdot: Reseptilääke. Ei SV-korvattavuuden piirissä. Tutustu valmisteyhteenvetoon ennen hoidon aloittamista, Lisätietoja: Valmisteyhteenveto (tekstin muuttamispäivämäärä ), Pharmaca Fennica tai MSD, Keilaranta 3, Espoo, puh (09) Tutustu valmisteyhteenvetoon ennen lääkkeen määräämistä. Copyright 2013 Merck Sharp & Dohme Corp., a Copyright 2014 Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., Whitehouse Station, NJ, USA. All rights reserved INFC subsidiary of Merck & Co., Inc., Whitehouse Station, NJ, USA. All rights reserved INFC
INFLECTRA SEULONTAKORTTI
 Demyelinoiva sairaus Jos potilaalla on aiempi tai äskettäin puhjennut demyelinioiva sairaus, anti-tnf-hoidon hyödyt ja haitat on arvioitava huolellisesti ennen INFLECTRA -hoidon aloitusta. INFLECTRA -hoidon
Demyelinoiva sairaus Jos potilaalla on aiempi tai äskettäin puhjennut demyelinioiva sairaus, anti-tnf-hoidon hyödyt ja haitat on arvioitava huolellisesti ennen INFLECTRA -hoidon aloitusta. INFLECTRA -hoidon
Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin
 Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto
 EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman hoitoon.
 KEYTRUDA (pembrolitsumabi) Terveydenhuollon ammattilaiset Usein kysytyt kysymykset KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman
KEYTRUDA (pembrolitsumabi) Terveydenhuollon ammattilaiset Usein kysytyt kysymykset KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
Histadin- valmisteen tehoa ja turvallisuutta ei ole osoitettu alle 2-vuotiailla lapsilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
Propyyliheksedriini. Eventin. Postfach 210805 Ludwigshafen DE 67008 Germany. Tämä päätös Huomioitava ennen lääkkeen Lääkevalmisteen
 Liite I 3 Aine: Propyyliheksedriini Tämä päätös Huomioitava ennen lääkkeen Lääkevalmisteen ottamista kauppanimi Saksa Knoll AG Postfach 210805 Ludwigshafen DE 67008 Germany Eventin 4 Aine Fenbutratsaatti
Liite I 3 Aine: Propyyliheksedriini Tämä päätös Huomioitava ennen lääkkeen Lääkevalmisteen ottamista kauppanimi Saksa Knoll AG Postfach 210805 Ludwigshafen DE 67008 Germany Eventin 4 Aine Fenbutratsaatti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
Hoidon aloittavan ja sitä valvovan lääkärin tulee olla perehtynyt kroonisen C-hepatiitin hoitoon.
 1. LÄÄKEVALMISTEEN NIMI Rebetol 40 mg/ml oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra oraaliliuosta sisältää 40 mg ribaviriinia. Rebetol sisältää 142 mg sorbitolia ja 300 mg sakkaroosia
1. LÄÄKEVALMISTEEN NIMI Rebetol 40 mg/ml oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra oraaliliuosta sisältää 40 mg ribaviriinia. Rebetol sisältää 142 mg sorbitolia ja 300 mg sakkaroosia
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin Teva Pharma B.V. 200 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Ribavirin Teva Pharma B.V. tabletti sisältää
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin Teva Pharma B.V. 200 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Ribavirin Teva Pharma B.V. tabletti sisältää
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin Three Rivers 200 mg kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää 200 mg ribaviriinia. Apuaineet: yksi
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin Three Rivers 200 mg kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää 200 mg ribaviriinia. Apuaineet: yksi
Olmesartan medoxomil STADA. 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin BioPartners 200 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Ribavirin BioPartners kalvopäällysteinen tabletti
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin BioPartners 200 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Ribavirin BioPartners kalvopäällysteinen tabletti
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
Liite I. Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle
 Liite I Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle Tieteelliset johtopäätökset Kun otetaan huomioon lääketurvallisuuden riskinarviointikomitean (PRACin) arviointiraportti
Liite I Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle Tieteelliset johtopäätökset Kun otetaan huomioon lääketurvallisuuden riskinarviointikomitean (PRACin) arviointiraportti
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 25 BROMOKRIPTIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON MERKITYKSELLISIIN KOHTIIN TEHTÄVÄT MUUTOKSET 4.2 Annostus ja antotapa
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 25 BROMOKRIPTIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON MERKITYKSELLISIIN KOHTIIN TEHTÄVÄT MUUTOKSET 4.2 Annostus ja antotapa
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin Teva Pharma B.V. 200 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Ribavirin Teva Pharma B.V. tabletti sisältää
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Ribavirin Teva Pharma B.V. 200 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Ribavirin Teva Pharma B.V. tabletti sisältää
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi)
 Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI IntronA 3 miljoonaa IU/0,5 ml injektio- tai infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi injektiopullo injektio- tai infuusionestettä
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI IntronA 3 miljoonaa IU/0,5 ml injektio- tai infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi injektiopullo injektio- tai infuusionestettä
, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa. Tietoa terveydenhuollon ammattilaisille
 Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa Tietoa terveydenhuollon ammattilaisille Suositukset seuraavissa tilanteissa: - maksan toiminnan seuraaminen - yhteisvaikutukset
Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa Tietoa terveydenhuollon ammattilaisille Suositukset seuraavissa tilanteissa: - maksan toiminnan seuraaminen - yhteisvaikutukset
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
Paras tapa käyttää IntronA:a tässä indikaatiossa on yhdessä ribaviriinin kanssa.
 1. LÄÄKEVALMISTEEN NIMI IntronA 5 miljoonaa IU/0,5 ml injektio- tai infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi injektiopullo injektio- tai infuusionestettä sisältää 5 miljoonaa IU
1. LÄÄKEVALMISTEEN NIMI IntronA 5 miljoonaa IU/0,5 ml injektio- tai infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi injektiopullo injektio- tai infuusionestettä sisältää 5 miljoonaa IU
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
LIITE VALMISTEYHTEENVETO
 LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO. Lievän tai kohtalaisen vaikean polven nivelrikon oireiden lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
LIITE III. Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin
 HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO ORION OYJ
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
1. ELÄINLÄÄKKEEN NIMI. Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
Euroopan lääkeviraston esittämät muutokset valmisteyhteenvedon ja pakkausselosteen muuttamiseksi
 Liite II Euroopan lääkeviraston esittämät muutokset valmisteyhteenvedon ja pakkausselosteen muuttamiseksi Tämä valmisteyhteenveto ja pakkausseloste on laadittu viitemaamenettelyssä. Jäsenvaltioiden toimivaltaiset
Liite II Euroopan lääkeviraston esittämät muutokset valmisteyhteenvedon ja pakkausselosteen muuttamiseksi Tämä valmisteyhteenveto ja pakkausseloste on laadittu viitemaamenettelyssä. Jäsenvaltioiden toimivaltaiset
Vuosiraportti 2013. Suomen munuaistautirekisteri. Lappi 710 potilasta/1 milj. as. Länsi- Pohja 872. Koko maa 822 potilasta/1 milj.
 Suomen munuaistautirekisteri Koko maa 822 potilasta/1 milj. asukasta Ahvenanmaa 977 < 785 potilasta/1 milj. as. 785 880 potilasta/1 milj. as. > 880 potilasta/1 milj. as. Vaasa 788 Etelä- Pohjanmaa 639
Suomen munuaistautirekisteri Koko maa 822 potilasta/1 milj. asukasta Ahvenanmaa 977 < 785 potilasta/1 milj. as. 785 880 potilasta/1 milj. as. > 880 potilasta/1 milj. as. Vaasa 788 Etelä- Pohjanmaa 639
Aripiprazole Sandoz (aripipratsoli)
 Aripiprazole Sandoz (aripipratsoli) Esite potilaille/heistä huolehtiville henkilöille Tämä esite sisältää tärkeitä turvallisuustietoja, joihin sinun on tutustuttava ennen aripipratsolihoidon aloittamista
Aripiprazole Sandoz (aripipratsoli) Esite potilaille/heistä huolehtiville henkilöille Tämä esite sisältää tärkeitä turvallisuustietoja, joihin sinun on tutustuttava ennen aripipratsolihoidon aloittamista
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
Kissa: Leikkauksen jälkeisen kivun lievitys kohdun ja munasarjojen poistoleikkauksen sekä pienten pehmytkudoskirurgisten toimenpiteiden jälkeen.
 1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
Perusseikkoja julkista yhteenvetoa varten
 Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
Elinluovutusta koskevan kansallisen toimintasuunnitelman toimeenpano. Jaakko Yrjö-Koskinen
 Elinluovutusta koskevan kansallisen toimintasuunnitelman toimeenpano Jaakko Yrjö-Koskinen 22.9.2016 Toimintasuunnitelma Ministeriön virallinen toimintasuunnitelma http://urn.fi/urn:isbn:978-952-00-3538-9
Elinluovutusta koskevan kansallisen toimintasuunnitelman toimeenpano Jaakko Yrjö-Koskinen 22.9.2016 Toimintasuunnitelma Ministeriön virallinen toimintasuunnitelma http://urn.fi/urn:isbn:978-952-00-3538-9
Lääkevalmisteella ei enää myyntilupaa
 1. LÄÄKEVALMISTEEN NIMI Viraferon 3 miljoonaa IU/0,5 ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kerta-annosinjektiopullo Viraferon injektionestettä sisältää 3 miljoonaa IU rekombinanttia
1. LÄÄKEVALMISTEEN NIMI Viraferon 3 miljoonaa IU/0,5 ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kerta-annosinjektiopullo Viraferon injektionestettä sisältää 3 miljoonaa IU rekombinanttia
Pioglitazone Actavis
 Tutustu Pioglitazone Actavis -valmisteyhteenvetoon ennen lääkkeen määräämistä Hoidollisten riskien minimointiohje Pioglitazone Actavis 15 mg ja 30 mg tabletit Päivitetty viimeksi 10/2018 Pioglitazone minimointiohje
Tutustu Pioglitazone Actavis -valmisteyhteenvetoon ennen lääkkeen määräämistä Hoidollisten riskien minimointiohje Pioglitazone Actavis 15 mg ja 30 mg tabletit Päivitetty viimeksi 10/2018 Pioglitazone minimointiohje
Aripiprazole Accord (aripipratsoli)
 Aripiprazole Accord (aripipratsoli) Esite terveydenhuoltohenkilöstölle Aripiprazole Accord (aripipratsoli) on tarkoitettu keskivaikean tai vaikean maniavaiheen enintään 12 viikkoa kestävään hoitoon 13
Aripiprazole Accord (aripipratsoli) Esite terveydenhuoltohenkilöstölle Aripiprazole Accord (aripipratsoli) on tarkoitettu keskivaikean tai vaikean maniavaiheen enintään 12 viikkoa kestävään hoitoon 13
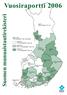 Vuosiraportti 6 Suomen munuaistautirekisteri Koko maa 22 potilasta/1 milj. asukasta Ahvenanmaa 55 Ryhmä 1 < 6 potilasta/1 milj. as. Ryhmä 2 6 potilasta/1 milj. as. Ryhmä 3 > potilasta/1 milj. as. Vaasa
Vuosiraportti 6 Suomen munuaistautirekisteri Koko maa 22 potilasta/1 milj. asukasta Ahvenanmaa 55 Ryhmä 1 < 6 potilasta/1 milj. as. Ryhmä 2 6 potilasta/1 milj. as. Ryhmä 3 > potilasta/1 milj. as. Vaasa
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
Liite III. Valmisteyhteenveto ja pakkausseloste, muutettavat kohdat
 Liite III Valmisteyhteenveto ja pakkausseloste, muutettavat kohdat Huomaa: Kansallinen viranomainen voi myöhemmin päivittää valmisteyhteenvetoihin ja pakkausselosteisiin tehtäviä muutoksia yhteistyössä
Liite III Valmisteyhteenveto ja pakkausseloste, muutettavat kohdat Huomaa: Kansallinen viranomainen voi myöhemmin päivittää valmisteyhteenvetoihin ja pakkausselosteisiin tehtäviä muutoksia yhteistyössä
Annosta tulee muuttaa eläimillä, joilla on munuaisten tai maksan vajaatoiminta, koska haittavaikutusriski on suurentunut.
 1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
Proscar. 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
VALMISTEYHTEENVETO. Nuhaan ja poskiontelotulehdukseen liittyvän limakalvojen turvotuksen lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Remeron. 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
Opas Tietoja potilaille
 Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Lemilvo (aripipratsoli)
 Lemilvo (aripipratsoli) Terveydenhuollon ammattilainen Usein kysytyt kysymykset Aripipratsoli on tarkoitettu keskivaikean tai vaikean maniavaiheen enintään 12 viikkoa kestävään hoitoon 13-17-vuotiaille
Lemilvo (aripipratsoli) Terveydenhuollon ammattilainen Usein kysytyt kysymykset Aripipratsoli on tarkoitettu keskivaikean tai vaikean maniavaiheen enintään 12 viikkoa kestävään hoitoon 13-17-vuotiaille
TÄRKEÄÄ MUNUAISTURVALLISUUSTIETOA VIREADIN KÄYTÖSTÄ
 TÄRKEÄÄ MUNUAISTURVALLISUUSTIETOA VIREADIN KÄYTÖSTÄ 30. huhtikuuta 2008 Arvoisa lääkäri, Viread (tenofoviiridisoproksiilifumaraatti, tenofoviiri DF) Koska Vireadin käyttö on hyväksytty HIV:in hoidon lisäksi
TÄRKEÄÄ MUNUAISTURVALLISUUSTIETOA VIREADIN KÄYTÖSTÄ 30. huhtikuuta 2008 Arvoisa lääkäri, Viread (tenofoviiridisoproksiilifumaraatti, tenofoviiri DF) Koska Vireadin käyttö on hyväksytty HIV:in hoidon lisäksi
Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi
 Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi Tärkeää tietoa TASIGNA-hoidosta Mitä TASIGNA ON? TASIGNA on reseptilääke, jota käytetään Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian
Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi Tärkeää tietoa TASIGNA-hoidosta Mitä TASIGNA ON? TASIGNA on reseptilääke, jota käytetään Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
Eläimiä koskevat erityiset varotoimet Jos haittavaikutuksia ilmenee, tulee hoito keskeyttää ja ottaa yhteys eläinlääkäriin.
 1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos. 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Calciumfolinat Fresenius Kabi 10 mg/ml injektio-/infuusioneste, liuos 11.8.2014, Versio 0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Akuutti maksan vajaatoiminta. Määritelmä Aiemmin terveen henkilön maksan pettäminen johtaa enkefalopatiaan kahdeksassa viikossa
 Vatsa 4: maksa 1. Akuutti maksan vajaatoiminta 2. Hepatiitti B ja C: tartunta, taudinkulku ja näiden vertailu 3. Kroonisen hepatiitin syyt 4. Maksakirroosin syyt, oireet ja hoito 5. Maksabiopsian aiheet
Vatsa 4: maksa 1. Akuutti maksan vajaatoiminta 2. Hepatiitti B ja C: tartunta, taudinkulku ja näiden vertailu 3. Kroonisen hepatiitin syyt 4. Maksakirroosin syyt, oireet ja hoito 5. Maksabiopsian aiheet
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
TYYPIN 2 DIABETES Lisäsairaudet - hoito ja seuranta
 TYYPIN 2 DIABETES Lisäsairaudet - hoito ja seuranta Sisällys T2D lisäsairaudet Sydän ja verisuonet Munuaiset Hermosto Jalat Silmät Suu 4 7 10 11 12 13 14 Sydän ja verisuonet Diabeetikoiden yleisin kuolinsyy
TYYPIN 2 DIABETES Lisäsairaudet - hoito ja seuranta Sisällys T2D lisäsairaudet Sydän ja verisuonet Munuaiset Hermosto Jalat Silmät Suu 4 7 10 11 12 13 14 Sydän ja verisuonet Diabeetikoiden yleisin kuolinsyy
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
Erityisturvallisuustiedote
 Erityisturvallisuustiedote Arava (leflunomidi) on tautiprosessia hidastava antireumaattinen lääke (DMARD), joka on tarkoitettu aikuisten aktiivista nivelreumaa tai aktiivista nivelpsoriaasia sairastavien
Erityisturvallisuustiedote Arava (leflunomidi) on tautiprosessia hidastava antireumaattinen lääke (DMARD), joka on tarkoitettu aikuisten aktiivista nivelreumaa tai aktiivista nivelpsoriaasia sairastavien
Attentin 5mg tabletti - opas reseptin kirjoittavalle lääkärille Tarkistuslista ennen lääkkeen määräämistä mahdollista web-pohjaista jakelua varten
 Attentin 5mg tabletti - opas reseptin kirjoittavalle lääkärille Tarkistuslista ennen lääkkeen määräämistä mahdollista web-pohjaista jakelua varten Tarkistuslista 1: ennen Attentin 5mg tablettien määräämistä
Attentin 5mg tabletti - opas reseptin kirjoittavalle lääkärille Tarkistuslista ennen lääkkeen määräämistä mahdollista web-pohjaista jakelua varten Tarkistuslista 1: ennen Attentin 5mg tablettien määräämistä
Versio 8, TOIMITTAMISOHJE APTEEKEILLE Instanyl -nenäsumute
 TOIMITTAMISOHJE APTEEKEILLE Instanyl -nenäsumute TÄRKEÄÄ TURVALLISUUSTIETOA: INSTANYL -NENÄSUMUTE SYÖPÄÄN LIITTYVÄN LÄPILYÖNTIKIVUN HOITOON ------------------------------------------------------------------------------
TOIMITTAMISOHJE APTEEKEILLE Instanyl -nenäsumute TÄRKEÄÄ TURVALLISUUSTIETOA: INSTANYL -NENÄSUMUTE SYÖPÄÄN LIITTYVÄN LÄPILYÖNTIKIVUN HOITOON ------------------------------------------------------------------------------
Version 6, 14 August Etukansi. TOIMITTAMISOHJE APTEEKEILLE Instanyl -nenäsumute
 Etukansi TOIMITTAMISOHJE APTEEKEILLE Instanyl -nenäsumute TÄRKEÄÄ TURVALLISUUSTIETOA: INSTANYL -NENÄSUMUTE SYÖPÄÄN LIITTYVÄN LÄPILYÖNTIKIVUN HOITOON ------------------------------------------------------------------------------
Etukansi TOIMITTAMISOHJE APTEEKEILLE Instanyl -nenäsumute TÄRKEÄÄ TURVALLISUUSTIETOA: INSTANYL -NENÄSUMUTE SYÖPÄÄN LIITTYVÄN LÄPILYÖNTIKIVUN HOITOON ------------------------------------------------------------------------------
NeuroBloc B-tyypin botulinumtoksiini injektioneste, liuos U/ml
 NeuroBloc B-tyypin botulinumtoksiini injektioneste, liuos 5 000 U/ml Tärkeitä turvallisuutta koskevia tietoja lääkäreille Tämän käyttöoppaan tarkoitus on antaa NeuroBloc -valmisteen määräämiseen ja antamiseen
NeuroBloc B-tyypin botulinumtoksiini injektioneste, liuos 5 000 U/ml Tärkeitä turvallisuutta koskevia tietoja lääkäreille Tämän käyttöoppaan tarkoitus on antaa NeuroBloc -valmisteen määräämiseen ja antamiseen
Tästä asiasta tiedottamisesta on sovittu Euroopan lääkeviraston (EMA) ja Lääkealan turvallisuus- ja kehittämiskeskuksen (Fimea) kanssa.
 24.10.2011 Helsinki TÄRKEÄÄ TURVALLISUUSTIETOA HÄDENSA -PERÄPUIKOISTA Hyvä terveydenhuollon ammattilainen Terpeenijohdoksia sisältävien peräpuikkojen käyttö on vastaaiheista alle 2½-vuotialla lapsilla
24.10.2011 Helsinki TÄRKEÄÄ TURVALLISUUSTIETOA HÄDENSA -PERÄPUIKOISTA Hyvä terveydenhuollon ammattilainen Terpeenijohdoksia sisältävien peräpuikkojen käyttö on vastaaiheista alle 2½-vuotialla lapsilla
TÄRKEITÄ TURVALLISUUSTIETOJA
 TÄRKEITÄ TURVALLISUUSTIETOJA Tärkeitä Truvada -valmisteen turvallisuustietoja lääkkeen määrääjille altistusta edeltävän estohoidon (Pre-exposure Prophylaxis, PrEP) käyttöaiheessa Truvada (emtrisitabiini/tenofoviiridisoproksiilifumaraatti)
TÄRKEITÄ TURVALLISUUSTIETOJA Tärkeitä Truvada -valmisteen turvallisuustietoja lääkkeen määrääjille altistusta edeltävän estohoidon (Pre-exposure Prophylaxis, PrEP) käyttöaiheessa Truvada (emtrisitabiini/tenofoviiridisoproksiilifumaraatti)
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
Potilaan päiväkirja. Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi
 Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
