Abacavir/Lamivudine STADA 600 mg/300 mg kalvopäällysteinen tabletti , versio 02 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
|
|
|
- Otto Laakso
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 Abacavir/Lamivudine STADA 600 mg/300 mg kalvopäällysteinen tabletti , versio 02 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä HIV-infektio HIV-infektion maailmanlaajuinen esiintyvyys on tällä vuosikymmenellä vakiintunut 0,8 %:iin. HIVinfektioon sairastuneiden ihmisten kokonaismäärä on kuitenkin kasvanut, koska uusia tartuntoja ilmaantuu jatkuvasti ja AIDS-kuolemien määrää on voitu vähentää yhä helpommin saatavilla olevalla, tehokkaalla antiretroviraalisella hoidolla. Vuonna 2007 maailmassa arvioitiin olevan 33,2 miljoonaa HIV-infektioon tai AIDSiin sairastunutta henkilöä, mikä on enemmän kuin vuonna 2001 arvioitu 29,5 miljoonaa. Uusien HIV-infektioiden vuotuinen ilmaantuvuus on vähentynyt vuoden 2001 arvioidusta 3,0 miljoonasta vuonna 2007 arvioituun 2,7 miljoonaan. Vuonna 2007 todettiin 2,0 miljoonaa HIV-infektioon liittyvää kuolemantapausta. Tämä luku on suurentunut vuonna 2001 arvioidusta 1,7 miljoonasta kuolemantapauksesta, mutta koska hoidon saatavuus on tällä vuosikymmenellä parantunut, vuotuinen kuolleisuus oli korkeimmillaan vuonna 2005 ja on sen jälkeen kääntynyt laskuun. Vuosina antiretroviraalista lääkitystä saavien henkilöiden määrä on kasvanut teollisuusmaissa :sta 3,0 miljoonaan, mikä oli 31 % hoitoa tarvitsevista. Saharan eteläpuolisessa Afrikassa HIV tarttuu pääasiassa heteroseksuaalisissa suhteissa, ja tämä on edelleen alue, jolla tautia esiintyy eniten 67 % koko maailman tautitaakasta. Useimmilla muilla alueilla tärkeimpiä riskitekijöitä ovat miesten välinen seksi, suonensisäisten huumeiden käyttö ja seksityö. Infektioiden määrä on vähenemässä joillakin alueilla, kuten joissakin Afrikan suuren esiintyvyyden maissa, mutta lisääntymässä muualla, kuten Itä-Euroopassa ja Keski-Aasiassa. VI.2.2 Yhteenveto hoidon hyödyistä HIV-infektio Ihmisen immuunikatoviruksen (HIV) aiheuttaman infektion hoito riippuu taudin vaiheesta ja mahdollisista samanaikaisista opportunisti-infektioista. Hoidon yleisenä tavoitteena on estää immuunijärjestelmän heikkeneminen niin paljon, että opportunisti-infektioiden todennäköisyys lisääntyy. Abakaviirin ja lamivudiinin yhdistelmää käytetään yhdessä muiden HIV-lääkkeiden kanssa HIVinfektion hallintaan. Se auttaa vähentämään HI-virusten määrää elimistössä ja siten parantaa immuunijärjestelmän toimintaa. Tämä pienentää HIV-infektion komplikaatioiden (kuten uusien infektioiden tai syövän) riskiä ja parantaa elämänlaatua. Sekä abakaviiri että lamivudiini kuuluvat nukleosidianalogisten käänteiskopioijaentsyymin estäjiksi (NRTI) kutsuttujen lääkkeiden ryhmään.
2 VI.2.3 Hoidon hyötyihin liittyvät asiat, joita ei tunneta Ei oleellinen VI.2.4 Yhteenveto turvallisuustiedoista Riski Mitä tiedetään Ehkäistävyys Abakaviirin käyttöön Tämä lääkevalmiste liittyvät vakavat allergiset sisältää abakaviiria reaktiot (joka on [abakaviiriyliherkkyysreakt vaikuttavana io (mukaan lukien aineena myös vähentynyt kliininen muissa valvonta HLA-B* samankaltaisissa testauksen jälkeen)] lääkkeissä). Joillekin abakaviiria saaneille potilaille saattaa kehittyä yliherkkyysreaktio (vakava allerginen reaktio), joka voi olla henkeä uhkaava, jos abakaviirin käyttöä jatketaan. Noin 3 4 sadasta kliinisessä tutkimuksessa abakaviiria saaneesta potilaasta, jolla ei ollut HLA-B*5701- geeniä, sai yliherkkyysreaktion (vakavan allergisen reaktion). Yliherkkyysreaktioille tyypillisiä ovat oireet, jotka viittaavat monia elimiä/elinjärjestelmi ä koskeviin vaikutuksiin. Lähes kaikissa yliherkkyysreaktioiss a ilmenee kuumetta ja/tai ihottumaa osana oireyhtymää. Potilaat eivät saa käyttää tätä lääkevalmistetta jos he ovat allergisia (yliherkkiä) abakaviirille (tai jollekin muulle abakaviiria sisältävälle lääkkeelle), lamivudiinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6). Potilaiden on luettava huolellisesti pakkausselosteen kohdan 4 yliherkkyysreaktioita koskevat tiedot. Jos potilas on lopettanut abakaviirin ja lamivudiinin yhdistelmän käytön mistä tahansa syystä varsinkin siitä syystä, että hän epäilee saaneensa haittavaikutuksia tai siksi että hänellä on muita sairauksia: o Potilaan täytyy keskustella lääkärin kanssa ennen hoidon aloittamista uudelleen. Lääkäri tarkistaa, liittyivätkö oireet yliherkkyysreaktioon. Jos lääkäri on sitä mieltä, että ne ovat voineet liittyä yliherkkyyteen, potilasta kielletään koskaan enää ottamasta tätä lääkevalmistetta tai muuta abakaviiria sisältävää lääkettä. On tärkeää, että potilas noudattaa tätä ohjetta. Potilaan täytyy ottaa yhteys lääkäriin välittömästi:
3 Muita oireita ja löydöksiä saattavat olla hengitystieoireet, kuten hengenahdistus, kurkkukipu, yskä ja poikkeava löydös keuhkokuvassa (enimmäkseen paikallistettavissa olevia infiltraatteja) sekä ruuansulatuskanava n oireet, kuten pahoinvointi, oksentelu, ripuli ja vatsakivut. Näiden oireiden perusteella yliherkkyysreaktio voidaan diagnosoida väärin hengitystiesairaudek si (keuhkokuumeeksi, keuhkoputkitulehduk seksi tai nielutulehdukseksi) tai mahasuolitulehdukseksi. Muita usein havaittuja yliherkkyysreaktion oireita ja löydöksiä saattavat olla esimerkiksi letargia tai yleinen huonovointisuus sekä lihaksiin ja luustoon liittyvät oireet (lihassärky, harvinaisena myolyysi ja nivelsärky). Yliherkkyysreaktioon liittyvät oireet pahenevat, jos 1. jos hänelle ilmaantuu ihottuma TAI 2. jos hän saa oireita vähintään kahdesta seuraavasta oireryhmästä: o o kuume hengenahdistus, kurkkukipu tai yskä o pahoinvointi tai oksentelu, ripuli tai vatsakivut o voimakas väsymys tai säryt tai yleinen huonovointisuus. Lääkäri saattaa kehottaa potilasta lopettamaan tämän lääkevalmisteen käytön. Tämän valmisteen pakkaus sisältää varoituskortin, jolla muistutetaan potilasta ja hoitohenkilökuntaa abakaviiriyliherkkyydestä. Tämä kortti on irrotettava ja potilaan on pidettävä se aina mukanaan. Tämän valmisteen mukana tuleva varoituskortti sisältää tärkeää turvallisuutta koskevaa tietoa. Jos potilas on lopettanut tämän lääkevalmisteen käytön yliherkkyysreaktion vuoksi, hän EI SAA ENÄÄ KOSKAAN ottaa tätä tai muuta abakaviiria sisältävää lääkettä uudestaan, koska jo muutamassa tunnissa potilaan verenpaine voi laskea hengenvaarallisen alas tai potilas voi kuolla. Jos lääkäri sanoo, että potilas voi aloittaa tämän valmisteen käytön
4 hoitoa jatketaan, ja ne voivat olla hengenvaarallisia. Oireet menevät yleensä ohi, kun abakaviirihoito lopetetaan. Yliherkkyysreaktion oireet ilmaantuvat yleensä ensimmäisten kuuden viikon aikana abakaviirihoidon aloittamisen jälkeen, mutta tällaisia reaktioita saattaa ilmetä milloin tahansa hoidon aikana. Potilaita on seurattava tarkoin erityisesti abakaviirihoidon ensimmäisten kahden kuukauden aikana, ja potilas on tavattava kahden viikon välein. Abakaviirin ja lamivudiinin yhdistelmän tai minkään muun abakaviiria sisältävän lääkevalmisteen käyttöä EI SAA KOSKAAN aloittaa uudelleen potilaille, jotka ovat lopettaneet valmisteen käytön yliherkkyysreaktion vuoksi. Jos abakaviirihoito aloitetaan uudelleen yliherkkyysreaktion jälkeen, oireet palaavat nopeasti, uudestaan, potilasta saatetaan pyytää ottamaan ensimmäiset annokset paikassa, jossa on tarvittaessa saatavilla lääketieteellistä apua. Jos potilas on yliherkkä tälle valmisteelle, hänen täytyy palauttaa kaikki käyttämättömät abakaviirilamivudiinitabletit hävitettäviksi turvallisesti. Potilaan on kysyttävä ohjeita lääkäriltä tai apteekkihenkilökunnalta.
5 muutamassa tunnissa. Yliherkkyysreaktio on uusiutuessaan yleensä vaikeampi kuin ensimmäisellä kerralla ja siihen voi liittyä hengenvaarallinen verenpaineen lasku ja kuolema. Diagnoosin viivästymisen välttämiseksi ja hengenvaarallisen yliherkkyysreaktion riskin minimoimiseksi abakaviirin ja lamivudiinin yhdistelmän käyttö on lopetettava pysyvästi, jos yliherkkyyden mahdollisuutta ei voida sulkea pois, vaikka muutkin diagnoosit (kuten hengityselinten sairaudet, flunssan kaltainen sairaus, maha-suolitulehdus tai reaktiot muille lääkevalmisteille) olisivat mahdollisia. On noudatettava erityistä varovaisuutta, jos potilas aloittaa hoidon abakaviirin ja lamivudiinin yhdistelmällä samanaikaisesti muiden sellaisten lääkevalmisteiden kanssa, joiden tiedetään aiheuttavan
6 Käyttö maksan vajaatoimintaa sairastaville potilaille ihotoksisuutta (kuten ei-nukleosidisten käänteiskopioijaents yymin estäjien eli NNRTI-lääkkeiden kanssa). Tämä johtuu siitä, että tällä hetkellä on vaikea erottaa näiden valmisteiden aiheuttamaa ihottumaa abakaviirin käyttöön liittyvästä yliherkkyysreaktiosta. Abakaviirin ja lamivudiinin yhdistelmän turvallisuutta ja tehoa ei ole varmistettu potilailla, joilla on taustalla merkittäviä maksasairauksia. Abakaviirin ja lamivudiinin yhdistelmää ei saa käyttää potilaille, joilla on vaikea maksan vajaatoiminta. Potilailla, joilla on hoitoa aloitettaessa maksan toimintahäiriö, kuten krooninen aktiivinen hepatiitti, on enemmän häiriöitä maksan toiminnassa antiretroviraalisen yhdistelmähoidon aikana, ja heitä on seurattava normaalin hoitokäytännön mukaisesti. Jos Potilaat, joilla on vaikea maksasairaus, eivät saa ottaa tätä lääkevalmistetta. Jotkut abakaviirin ja lamivudiinin yhdistelmää tai muita HIVyhdistelmähoitoja saavat ovat muita alttiimpia vakaville haittavaikutuksille. Potilaan on otettava huomioon, että riski voi olla suurempi: o jos hänellä on joskus ollut jokin maksasairaus, mukaan lukien hepatiitti B tai C (jos hänellä on hepatiitti B -infektio, abakaviirin ja lamivudiinin yhdistelmän käyttöä ei saa lopettaa ilman lääkärin kehotusta, koska hepatiitti voi uusiutua).
7 tällaisilla potilailla todetaan merkkejä maksasairauden pahenemisesta, hoidon keskeyttämistä tai lopettamista on harkittava. Potilailla, joilla on krooninen hepatiitti B- tai C -infektio ja jotka saavat antiretroviraalista yhdistelmähoitoa, on lisääntynyt riski saada vaikeita ja mahdollisesti kuolemaan johtavia maksaan liittyviä haittavaikutuksia. Maksaan liittyvät häiriöt, kuten ikterus (ihon tai silmänvalkuaisten muuttuminen keltaisiksi maksaan tai vereen liittyvien häiriöiden vuoksi), suurentunut maksa tai rasvamaksa ja maksatulehdus (hepatiitti) ovat harvinaisia haittavaikutuksia (voivat ilmetä alle yhdellä henkilöllä tuhannesta). Tärkeät mahdolliset riskit Riski Karsinogeenisuuden riski pitkällä aikavälillä ja pitkäkestoinen altistuminen nukleosidianalogin käänteiskopioijaentsyymin estäjille Mitä tiedetään (mukaan lukien syy, miksi seikka katsotaan mahdolliseksi riskiksi) Abakaviiri-lamivudiiniyhdistelmän vaikuttavat aineet saattavat estää solun DNA:n replikaatiota ja abakaviirin on osoitettu olevan karsinogeeninen
8 (NRTI) eläinmalleissa. Näiden havaintojen kliinistä merkitystä ei tiedetä. On osoitettu, että abakaviiri ja lamivudiini läpäisevät ihmisen istukan. Käyttö raskauden aikana Iskeemiset sydäntapahtumat Abakaviirin ja lamivudiinin yhdistelmän karsinogeenista potentiaalia ei ole tutkittu. Rotilla ja hiirillä tehdyissä pitkäaikaisissa karsinogeenisuustutkimuksissa, joissa käytettiin suun kautta annosteltua lamivudiinia, ei todettu karsinogeenisuuteen viittaavia vaikutuksia. Hiirillä ja rotilla tehdyt, suun kautta annosteltua abakaviiria koskevat karsinogeenisuustutkimukset osoittivat malignien ja ei-malignien kasvainten ilmaantuvuuden lisääntymistä. Maligneja kasvaimia oli molempien eläinlajien urosten esinahkarauhasessa ja naaraiden häpykielirauhasessa sekä urosrottien kilpirauhasessa ja naarasrottien maksassa, virtsarakossa, imusolmukkeissa ja ihonalaisessa kudoksessa. Abakaviirin ja lamivudiinin yhdistelmää ei suositella käytettäväksi raskauden aikana. Abakaviirin ja lamivudiinin yhdistelmä ja sen kaltaiset lääkkeet voivat aiheuttaa haittavaikutuksia syntymättömille lapsille. Jos nainen on ottanut abakaviirin ja lamivudiinin yhdistelmää raskauden aikana, lapselle saatetaan tehdä ylimääräisiä seurantatutkimuksia (kuten verikokeita) lapsen normaalin kehityksen varmistamiseksi. Potilaan täytyy ottaa välittömästi yhteyttä lääkäriin ja keskustella abakaviirin ja lamivudiinin yhdistelmään tai muiden HIV-infektion hoitoon käytettäviin lääkkeisiin liittyvistä riskeistä ja hyödyistä raskauden aikana. Seurantatutkimukset ovat osoittaneet yhteyden sydäninfarktin ja abakaviirin käytön välillä. Tutkitut olivat pääosin potilaita, jotka olivat saaneet antiretroviraalista hoitoa aikaisemmin. Kliinisistä tutkimuksista saaduissa tiedoissa oli joitakin sydäninfarktitapauksia, eikä tietojen perusteella voida sulkea pois sydäninfarktiriskin pientä kasvua. Kaiken kaikkiaan seurantaryhmistä ja satunnaistetuista tutkimuksista saatu tieto on jonkin verran ristiriitaista, joten syy-yhteyttä abakaviirihoidon ja sydäninfarktiriskin välillä ei voida vahvistaa eikä osoittaa vääräksi. Mahdolliselle riskin lisääntymiselle ei toistaiseksi tunneta biologista mekanismia. Kun abakaviirin ja lamivudiinin yhdistelmää määrätään potilaalle, on tehtävä kaikki mahdollinen kaikkien
9 Abakaviirin ja ribaviriinin mahdolliset yhteisvaikutukset Abakaviirin ja lamivudiinin yhdistelmän mahdolliset yhteisvaikutukset tenofoviiridisoproksiilifumaraatin kanssa vaikutettavissa olevien vaaratekijöiden (esim. tupakointi, korkea verenpaine ja hyperlipidemia) minimoimiseksi. Potilailla, joilla on myös hepatiitti C ja joita hoidetaan alfainterferonilla ja ribaviriinilla, saattaa olla erityisesti suurentunut riski. Koska abakaviiri ja ribaviriini fosforyloituvat samoja reittejä käyttäen, on oletettu, että näiden lääkeaineiden välillä voi olla intrasellulaarisia yhteisvaikutuksia. Nämä voisivat vähentää ribaviriinin solunsisäisten fosforyloituneiden metaboliittien määrää, mikä voisi heikentää hepatiitti C:n virologisen vasteen säilymismahdollisuuksia potilailla, joilla on myös hepatiitti C -infektio (HCV) ja jotka saavat pegyloitua interferonia ja ribaviriinia. Kirjallisuudessa on ristiriitaisia raportteja abakaviirin ja ribaviriinin yhteiskäyttöön liittyvistä kliinisistä löydöksistä. Joidenkin tietojen mukaan potilaat, joilla on sekä HIV- että HCV-infektio ja jotka saavat abakaviiria sisältävää antiretroviraalista hoitoa, voivat vastata huonommin hoitoon pegyloidun interferonin ja ribaviriinin yhdistelmällä. On noudatettava varovaisuutta, kun abakaviiria ja ribaviriinia sisältäviä valmisteita käytetään samanaikaisesti. - Kolmoisnukleosidihoito: On raportoitu, että hoito on usein epäonnistunut virologisesti ja resistenssiä on kehittynyt aikaisessa vaiheessa, kun abakaviiria ja lamivudiinia on annosteltu yhdessä tenofoviiridisoproksiilifumaraatin kanssa kerran vuorokaudessa. - Virologisen epäonnistumisen riski hoidossa abakaviirin ja lamivudiinin yhdistelmällä voi olla suurempi kuin muilla hoitovaihtoehtoilla. Virologiseen epäonnistumiseen kuluvan ajan lyhenemisen riski - Kolmoisnukleosidihoito: On raportoitu, että hoito on usein epäonnistunut virologisesti ja resistenssiä on kehittynyt aikaisessa vaiheessa, kun abakaviiria ja lamivudiinia on annosteltu yhdessä tenofoviiridisoproksiilifumaraatin kanssa kerran vuorokaudessa. - Virologisen epäonnistumisen riski hoidossa abakaviirin ja lamivudiinin yhdistelmällä voi olla suurempi kuin muilla hoitovaihtoehtoilla.
10 Puuttuvat tiedot Ei oleellinen VI.2.5 Yhteenveto toimenpiteistä riskien minimoimiseksi Kaikista lääkevalmisteista laaditaan valmisteyhteenveto, joka sisältää lääkäreille, apteekkihenkilökunnalle ja muille terveydenhuollon ammattilaisille suunnattua yksityiskohtaista tietoa lääkkeen käytöstä, riskeistä ja suosituksista riskien minimoimiseksi. Pakkausselosteessa kerrotaan valmisteyhteenvedon tiedot lyhyesti maallikkokielellä. Valmisteyhteenvedossa ja pakkausselosteessa mainitut toimet ovat tavanomaisia riskienminimointitoimia. Abacavir/Lamivudine 600 mg/300 mg kalvopäällysteisten tablettien valmisteyhteenveto ja pakkausseloste ovat saatavissa Fimean verkkosivujen kautta Tämän lääkkeen turvalliseen ja tehokkaaseen käyttöön liittyy erityisehtoja ja rajoituksia (riskien minimoinnin lisätoimia). Tällaisia lisätoimia seuraavien riskien minimoimiseksi ovat: Turvallisuustieto 1: Abakaviiriyliherkkyysreaktio (mukaan lukien vähentynyt kliininen valvonta HLA-B*-5701-testauksen jälkeen) Riskien minimoinnin lisätoimet Terveydenhuollon ammattilaisille toimitetaan koulutusmateriaalia maihin, joissa myyntiluvan haltijalla on myyntilupa abakaviirille. Tavoite ja perustelu: Lisätä ymmärrystä ja tietoisuutta abakaviiriyliherkkyysreaktioista. Keskeiset riskien minimoinnin lisätoimet Terveydenhuollon ammattilaisille toimitetaan koulutusmateriaalia maihin, joissa myyntiluvan haltijalla on myyntilupa abakaviirille. Myyntiluvan haltija valvoo koulutusohjelman toimeenpanoa ja toteutusta. VI.2.6 Kehityssuunnitelma myyntiluvan myöntämisen jälkeen Ei oleellinen VI.2.7 Yhteenveto riskienhallintasuunnitelman päivityksistä Ei oleellinen
Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit , Versio 1.3
 Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit 30.5.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Emtricitabine
Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit 30.5.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Emtricitabine
Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio)
 28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Propecia (finasteridi 0,2 ja 1 mg) tabletti , versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
Hoidon hyötyihin liittyvät asiat, joita ei tunneta (yksi lyhyt kappale kustakin käyttöaiheesta, enintään 50 sanaa)
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
Proscar. 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
Pramipexol Stada. 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pramipexol Stada 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Pramipexol STADA 0,088 mg tabletti Pramipexol STADA 0,18 mg tabletti Pramipexol STADA
Pramipexol Stada 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Pramipexol STADA 0,088 mg tabletti Pramipexol STADA 0,18 mg tabletti Pramipexol STADA
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Ibandronat Stada 150 mg kalvopäällysteiset tabletit. 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa , Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa 6.7.2016, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa 6.7.2016, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
19.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Symbicort Turbuhaler. Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Symbicort Turbuhaler Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on yleinen hengitysteiden tulehdussairaus,
Symbicort Turbuhaler Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on yleinen hengitysteiden tulehdussairaus,
Olmesartan medoxomil STADA. 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Telmisartan/ ratiopharm 4.12.2014, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Telmisartan/ ratiopharm on angiotensiini
Telmisartan/ ratiopharm 4.12.2014, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Telmisartan/ ratiopharm on angiotensiini
Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto
 EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
Exviera-valmisteen (dasabuviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775993/2014 Exviera-valmisteen (dasabuviiri) enhallintasuunnitelman yhteenveto Tämä on Exviera-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
EMA/775993/2014 Exviera-valmisteen (dasabuviiri) enhallintasuunnitelman yhteenveto Tämä on Exviera-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Julkisen yhteenvedon osiot
 Leflunomide STADA Versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Leflunomide STADA 10 mg tabletti, kalvopäällysteinen Leflunomide STADA 20 mg tabletti, kalvopäällysteinen
Leflunomide STADA Versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Leflunomide STADA 10 mg tabletti, kalvopäällysteinen Leflunomide STADA 20 mg tabletti, kalvopäällysteinen
Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 11 maaliskuuta 2016 Desloratadiini Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Heinänuha Pohjoismaiset tutkimukset
11 maaliskuuta 2016 Desloratadiini Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Heinänuha Pohjoismaiset tutkimukset
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi)
 Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
RMP section VI.2 Elements for Public Summary
 RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
Praluent. 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Praluent 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Praluent-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Praluent 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Praluent-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injektioneste, liuos 3.7.2015, Versio 2.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injektioneste, liuos 3.7.2015, Versio 2.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Remeron. 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO ORION OYJ
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
Lescol / Lescol Depot. 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lescol / Lescol Depot 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkea kolesteroli tarkoittaa kolesterolin
Lescol / Lescol Depot 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkea kolesteroli tarkoittaa kolesterolin
Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto
 EMA/738120/2014 Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto Tämä on Ofev-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
EMA/738120/2014 Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto Tämä on Ofev-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin
 Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
Betaserc 24 mg suussa hajoavat tabletit , versio 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Betaserc 24 mg suussa hajoavat tabletit 23.9.2014, versio 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Betahistiini on tarkoitettu
Betaserc 24 mg suussa hajoavat tabletit 23.9.2014, versio 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Betahistiini on tarkoitettu
Julkisen yhteenvedon osiot
 Erlotinib STADA 25 mg, 100 mg ja 150 mg kalvopäällysteiset tabletit 17.3.2017, versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Erlotinib STADA 25 mg, 100 mg ja 150 mg kalvopäällysteiset tabletit 17.3.2017, versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Julkisen yhteenvedon osiot
 Daptomycin STADA 350 mg ja 500 mg injektio /infuusiokuiva aine liuosta varten 4.5.2017, versio V1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
Daptomycin STADA 350 mg ja 500 mg injektio /infuusiokuiva aine liuosta varten 4.5.2017, versio V1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
INFLECTRA SEULONTAKORTTI
 Demyelinoiva sairaus Jos potilaalla on aiempi tai äskettäin puhjennut demyelinioiva sairaus, anti-tnf-hoidon hyödyt ja haitat on arvioitava huolellisesti ennen INFLECTRA -hoidon aloitusta. INFLECTRA -hoidon
Demyelinoiva sairaus Jos potilaalla on aiempi tai äskettäin puhjennut demyelinioiva sairaus, anti-tnf-hoidon hyödyt ja haitat on arvioitava huolellisesti ennen INFLECTRA -hoidon aloitusta. INFLECTRA -hoidon
Enstilar , Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Enstilar 21.1.2016, Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Psoriaasi on yleinen ihosairaus, jossa iholle ilmestyy
Enstilar 21.1.2016, Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Psoriaasi on yleinen ihosairaus, jossa iholle ilmestyy
Perusseikkoja julkista yhteenvetoa varten
 Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 TicoVac ja TicoVac Junior 29.12.2015, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Puutiaisaivotulehdus (TBE) on keskushermostoon
TicoVac ja TicoVac Junior 29.12.2015, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Puutiaisaivotulehdus (TBE) on keskushermostoon
Bimatoprosti. 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Bimatoprosti 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kohonneen silmänpaineen alentaminen kroonista avokulmaglaukoomaa
Bimatoprosti 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kohonneen silmänpaineen alentaminen kroonista avokulmaglaukoomaa
Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/702765/2014 Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Harvoni-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/702765/2014 Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Harvoni-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Ethambutol Orion 500 mg tabletit Päivämäärä: , Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ethambutol Orion 500 mg tabletit Päivämäärä: 21.10.2016, Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Etambutoli on
Ethambutol Orion 500 mg tabletit Päivämäärä: 21.10.2016, Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Etambutoli on
Xultophy-valmisteen riskienhallintasuunnitelman (RMP) julkinen yhteenveto (degludekinsuliini/liraglutidi)
 Xultophy-valmisteen riskienhallintasuunnitelman (RMP) julkinen yhteenveto (degludekinsuliini/liraglutidi) Tämä on Xultophy-valmisten riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
Xultophy-valmisteen riskienhallintasuunnitelman (RMP) julkinen yhteenveto (degludekinsuliini/liraglutidi) Tämä on Xultophy-valmisten riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
Primovist (dinatriumgadoksetaatti) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Primovist (dinatriumgadoksetaatti) 05/2013, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 2. Julkisen yhteenvedon osiot 2.1 Tietoa sairauden esiintyvyydestä Magneettikuvaus (MK) on yksi useasta
Primovist (dinatriumgadoksetaatti) 05/2013, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 2. Julkisen yhteenvedon osiot 2.1 Tietoa sairauden esiintyvyydestä Magneettikuvaus (MK) on yksi useasta
OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EU RMP Lääkeaine Bikalutamidi Version numero 2 Päivämäärä 2 toukokuu 2014 OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT Bikalutamidi (CASODEX 1 ) on hormonaalinen
EU RMP Lääkeaine Bikalutamidi Version numero 2 Päivämäärä 2 toukokuu 2014 OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT Bikalutamidi (CASODEX 1 ) on hormonaalinen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
Alteplaasi Versio 3.3
 Boehringer Ingelheim Sivu 1 / 5 OSA VI.2 Osa VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä Erilaiset sairaudet ja tilat edellyttävät laskimokatetrien eli laskimoon asetettavien ohuiden
Boehringer Ingelheim Sivu 1 / 5 OSA VI.2 Osa VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä Erilaiset sairaudet ja tilat edellyttävät laskimokatetrien eli laskimoon asetettavien ohuiden
Lamictal , versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lamictal 30.12.2015, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on vakava sairaus, jossa esiintyy
Lamictal 30.12.2015, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on vakava sairaus, jossa esiintyy
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
LIITE III. Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin
 HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 22 helmikuuta 2016 Drospirenoni/etinyyliestradioli Versionumero: 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Suun kautta
22 helmikuuta 2016 Drospirenoni/etinyyliestradioli Versionumero: 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Suun kautta
Pronaxen 250 mg tabletti OTC , Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pronaxen 250 mg tabletti OTC 25.9.2015, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Pronaxen 250 mg on tarkoitettu
Pronaxen 250 mg tabletti OTC 25.9.2015, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Pronaxen 250 mg on tarkoitettu
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 DUTASTERIDE RATIOPHARM 0,5 MG PEHMEÄT KAPSELIT Päivämäärä: 16.3.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
DUTASTERIDE RATIOPHARM 0,5 MG PEHMEÄT KAPSELIT Päivämäärä: 16.3.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Pioglitazone Actavis
 Tutustu Pioglitazone Actavis -valmisteyhteenvetoon ennen lääkkeen määräämistä Hoidollisten riskien minimointiohje Pioglitazone Actavis 15 mg ja 30 mg tabletit Päivitetty viimeksi 10/2018 Pioglitazone minimointiohje
Tutustu Pioglitazone Actavis -valmisteyhteenvetoon ennen lääkkeen määräämistä Hoidollisten riskien minimointiohje Pioglitazone Actavis 15 mg ja 30 mg tabletit Päivitetty viimeksi 10/2018 Pioglitazone minimointiohje
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Darunavir STADA 400 mg, 600 mg ja 800 mg kalvopäällysteiset tabletit , versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Darunavir STADA 400 mg, 600 mg ja 800 mg kalvopäällysteiset tabletit 7.9.2016, versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
Darunavir STADA 400 mg, 600 mg ja 800 mg kalvopäällysteiset tabletit 7.9.2016, versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Elidel 10 mg/g emulsiovoide 8.12.2015, Versio 11 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ekseemaa esiintyy lähinnä lapsilla
Elidel 10 mg/g emulsiovoide 8.12.2015, Versio 11 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ekseemaa esiintyy lähinnä lapsilla
Nucala. 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/661227/2015 Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Genvoya-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/661227/2015 Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Genvoya-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/601943/2014 Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Trulicity-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
EMA/601943/2014 Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Trulicity-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
Seretide. 12-2014, v05 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Seretide 12-2014, v05 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on keuhkosairaus, jossa pieniä keuhkoputkia ympäröivät
Seretide 12-2014, v05 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on keuhkosairaus, jossa pieniä keuhkoputkia ympäröivät
Pregabalin Pfizer. 8.11.2013, versio 10.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pregabalin Pfizer 8.11.2013, versio 10.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on pitkäaikainen aivoihin
Pregabalin Pfizer 8.11.2013, versio 10.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on pitkäaikainen aivoihin
Osio VI: Yhteenveto riskienhallintasuunnitelman toimista
 Osio VI: Yhteenveto riskienhallintasuunnitelman toimista VI.2 VI.2.1 Julkisen yhteenvedon osat Tietoa sairauden esiintyvyydestä Lääkevalmiste Dormix 12,5 mg ja 25 mg kalvopäällysteiset tabletit on tarkoitettu
Osio VI: Yhteenveto riskienhallintasuunnitelman toimista VI.2 VI.2.1 Julkisen yhteenvedon osat Tietoa sairauden esiintyvyydestä Lääkevalmiste Dormix 12,5 mg ja 25 mg kalvopäällysteiset tabletit on tarkoitettu
TÄRKEITÄ TURVALLISUUSTIETOJA
 TÄRKEITÄ TURVALLISUUSTIETOJA Tärkeitä Truvada -valmisteen turvallisuustietoja lääkkeen määrääjille altistusta edeltävän estohoidon (Pre-exposure Prophylaxis, PrEP) käyttöaiheessa Truvada (emtrisitabiini/tenofoviiridisoproksiilifumaraatti)
TÄRKEITÄ TURVALLISUUSTIETOJA Tärkeitä Truvada -valmisteen turvallisuustietoja lääkkeen määrääjille altistusta edeltävän estohoidon (Pre-exposure Prophylaxis, PrEP) käyttöaiheessa Truvada (emtrisitabiini/tenofoviiridisoproksiilifumaraatti)
Julkisen yhteenvedon osiot
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Hunterin oireyhtymä on harvinainen geneettinen sairaus, jota esiintyy pääasiallisesti miehillä kaikissa etnisissä ryhmissä. Esiintyvyys
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Hunterin oireyhtymä on harvinainen geneettinen sairaus, jota esiintyy pääasiallisesti miehillä kaikissa etnisissä ryhmissä. Esiintyvyys
Emtenef 600 mg/200 mg/245 mg kalvopäällysteiset tabletit , Versio 01.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Emtenef 600 mg/200 mg/245 mg kalvopäällysteiset tabletit 31.7.2017, Versio 01.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ihmisen
Emtenef 600 mg/200 mg/245 mg kalvopäällysteiset tabletit 31.7.2017, Versio 01.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ihmisen
Lipanthyl Penta 145 mg , versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lipanthyl Penta 145 mg 15.9.2015, versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Fenofibraatti: Julkisen yhteenvedon osiot Fenofibraatti: Tietoa sairauden esiintyvyydestä Arviolta
Lipanthyl Penta 145 mg 15.9.2015, versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Fenofibraatti: Julkisen yhteenvedon osiot Fenofibraatti: Tietoa sairauden esiintyvyydestä Arviolta
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Erivedge 150 mg kovat kapselit RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lokakuu 2013, v. 8.0 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ihon tyvisolusyöpä on yleisin
Erivedge 150 mg kovat kapselit RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lokakuu 2013, v. 8.0 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ihon tyvisolusyöpä on yleisin
OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN. Priapismi
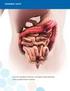 OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN VI1 EPAR-yhteenvetotaulukkojen osiot VI1.1 Yhteenvetotaulukko turvallisuustiedoista Yhteenveto turvallisuustiedoista - Priapismi -
OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN VI1 EPAR-yhteenvetotaulukkojen osiot VI1.1 Yhteenvetotaulukko turvallisuustiedoista Yhteenveto turvallisuustiedoista - Priapismi -
Opas Tietoja potilaille
 Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi)
 EMA/577184/2015 Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi) Tämä on Repatha-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden avulla
EMA/577184/2015 Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi) Tämä on Repatha-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden avulla
Kovaltry-valmisteen (oktokogialfa) riskienhallintasuunnitelman yhteenveto
 EMA/1560/2016 Kovaltry-valmisteen (oktokogialfa) riskienhallintasuunnitelman yhteenveto Tämä on Kovaltry-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet, joiden avulla
EMA/1560/2016 Kovaltry-valmisteen (oktokogialfa) riskienhallintasuunnitelman yhteenveto Tämä on Kovaltry-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet, joiden avulla
ZAVEDOS , versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 1 (6) ZAVEDOS 9.6.2016, versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akuuttia lymfaattista leukemiaa (ALL) esiintyy
1 (6) ZAVEDOS 9.6.2016, versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akuuttia lymfaattista leukemiaa (ALL) esiintyy
Triumeq (dolutegraviiri/abakaviiri/lamivudiini) versio 1 RISKIENHALLINTASUUNNITELMAN YHTEENVETO
 EMA /434464/ 2014 Triumeq (dolutegraviiri/abakaviiri/lamivudiini) 15.10.2014 versio 1 RISKIENHALLINTASUUNNITELMAN YHTEENVETO Tämä on Triumeq-valmisteen riskienhallintasuunnitelman yhteenveto, jossa kuvataan
EMA /434464/ 2014 Triumeq (dolutegraviiri/abakaviiri/lamivudiini) 15.10.2014 versio 1 RISKIENHALLINTASUUNNITELMAN YHTEENVETO Tämä on Triumeq-valmisteen riskienhallintasuunnitelman yhteenveto, jossa kuvataan
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
LÄÄKETTÄ MÄÄRÄÄVÄN LÄÄKÄRIN OPAS JA TARKISTUSLISTA
 PROTELOS OSSEOR LÄÄKETTÄ MÄÄRÄÄVÄN LÄÄKÄRIN OPAS JA TARKISTUSLISTA (strontiumranelaatti) Tämä opas on osa Protelos -valmisteen riskinhallintasuunnitelmaa. Oppaan on tarkoitus antaa tietoa Protelos -valmisteen
PROTELOS OSSEOR LÄÄKETTÄ MÄÄRÄÄVÄN LÄÄKÄRIN OPAS JA TARKISTUSLISTA (strontiumranelaatti) Tämä opas on osa Protelos -valmisteen riskinhallintasuunnitelmaa. Oppaan on tarkoitus antaa tietoa Protelos -valmisteen
Morphine Orion. Pvm: , Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Morphine Orion Pvm: 19.12.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Tämä lääke on tarkoitettu voimakkaan kivun
Morphine Orion Pvm: 19.12.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Tämä lääke on tarkoitettu voimakkaan kivun
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto
 EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
Menjugate. 22.06.2016, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Menjugate 22.06.2016, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä N. meningitidis -bakteeri voi aiheuttaa infektion
Menjugate 22.06.2016, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä N. meningitidis -bakteeri voi aiheuttaa infektion
