LIITE I VALMISTEYHTEENVETO
|
|
|
- Pirkko Kouki
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 LIITE I VALMISTEYHTEENVETO 1
2 Tämä lääkinnällinen tuote on lisävalvonnan alainen. Tämä mahdollistaa uusien turvatietojen pikaisen tunnistamisen. Terveydenhoidon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista. Katso kohdasta 4.8, miten voit ilmoittaa haittavaikutuksista. 1. LÄÄKEVALMISTEEN NIMI EVARREST-liimamatriksi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT EVARREST-liimamatriksi sisältää seuraavia aineita (cm 2 ) Ihmisen fibrinogeeni 8,1 mg Ihmisen trombiini 40 IU Apuaine(et), joiden vaikutus tunnetaan: Sisältää enintään 2,7 mmol (62 mg) natriumia liimamatriksia kohti. Täydellinen apuaineluettelo, ks. kohta LÄÄKEMUOTO Liimamatriksi. EVARREST-liimamatriksi on valkokellertävää biohajoavaa yhdistettä, joka on valmistettu joustavasta komposiittimatriksista, päällystetty ihmisen fibrinogeenilla ja ihmisen trombiinilla. Liimamatriksin aktiivinen puoli on jauhemaista ja ei-aktiivisella puolella on aaltomainen kohokuviointi. 4. KLIINISET TIEDOT 4.1 Käyttöaiheet EVARREST-liimamatriksi on tarkoitettu aikuisten potilaiden tukihoitoon leikkauksissa, joissa vakioleikkausmenetelmät eivät riitä hemostaasin parantamiseen (ks. osa 5.1). 4.2 Annostus ja antotapa EVARREST-liimamatriksin käyttö on rajoitettu kokeneiden kirurgien käyttöön. Annostus Potilaan kliiniset tarpeet sanelevat aina EVARREST-liimamatriksin käytettävän määrän ja kuinka usein sitä käytetään. EVARREST-liimamatriksin käytettävä määrä riippuu hoidettavan vuotoalueen koosta ja sijainnista. EVARREST-liimamatriksia on käytettävä siten, että se ulottuu noin 1 2 cm vuotavan kohdealueen reunojen ulkopuolelle. Se voidaan leikata vuotavaa aluetta vastaavaan kokoon ja muotoon. Kliinisissä tutkimuksissa ei ole tutkittu vuotavia alueita, jotka ovat suurempia kuin mitä yksi EVARREST-liimamatriksi voi peittää. EVARREST-liimamatriksia saa käyttää vain yhtenä kerroksena siten, että päällekkäisyyttä ei-vuotavan kudoksen tai viereisen EVARREST-liimamatriksin kanssa on noin 1 2 cm. Useita vuotavia alueita voidaan hoitaa samanaikaisesti. Yhteensä elimistössä saa käyttää enintään kahta 10,2 cm x 10,2 cm:n kokoa vastaavaa määrää matriksia, sillä suurempien määrien käytöstä on 2
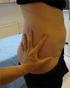
3 vain rajoitettua pitkäaikaista kokemusta. Yli neljän 10,2 cm x 10,2 cm:n kokoisen matriksin käyttöä tai käyttöä potilailla, joilla ei ole aiemmin käytetty EVARREST-liimamatriksia, ei ole tutkittu. Jos hemostaasia ei saada aikaan yhdellä EVARREST-liimamatriksilla, hoitoa voidaan jatkaa toisella matriksilla. Käyttöohjeet annetaan seuraavassa. Pediatriset potilaat EVARREST-liimamatriksin tehoa ja turvallisuutta ei ole tutkittu alle 18-vuotiaiden lasten hoidossa.tietoja ei ole saatavilla. Antotapa Vain kudosvaurion päälle. EVARREST-liimamatriksi asetetaan painamalla sitä tukevasti kädellä noin 3 minuuttia. 1. Leikkaa EVARREST-liimamatriksi tarpeen mukaan oikeankokoiseksi ja -muotoiseksi steriileillä saksilla siten, että se ulottuu noin 1 2 cm vuotavan alueen yli. Pidä EVARRESTliimamatriksin jauhomainen valkokellertävä aktiivinen puoli alaspäin, kun se on alustalla. 2. Poista ylimääräinen veri tai neste käyttökohdasta, jos se on tarpeen näkyvyyden parantamiseksi. Vuotava kohta on tunnistettava selvästi ja on varmistettava, että EVARREST-liimamatriksi asetetaan suoraan vuotavan kohdan päälle siten, että matriksi peittää sen kokonaan. EVARREST-liimamatriksia voidaan käyttää aktiivisesti vuotavalla alueella. 3. Aseta EVARREST-liimamatriksin aktiivinen puoli vuotavalle alueelle siten, että se on täysin kosketuksissa kudoksen kanssa. Valmiste aktivoidaan sen koskettaessa nestettä ja se tarttuu kudokseen ja muotoutuu kudoksen mukaan. 4. Aseta riittävän suuri pala EVARREST-liimamatriksia siten, että se peittää koko vuotavan alueen ja ulottuu noin 1 2 cm vuotamattoman alueen päälle, jotta se tarttuu kunnolla haavaan. 5a) Pidä kuivaa tai kosteaa sideharsotyynyä tai laparotomiatyynyä EVARREST-liimamatriksin päällä täyden kontaktin säilyttämiseksi vuotavan pinnan kanssa. 3
4 5b) Hemostaasi varmistetaan painamalla koko EVARREST-liimamatriksin pintaa välittömästi kädellä (mukaan lukien vuotavan pinnan ulkopuolelle ulottuvaa aluetta), jotta vuoto tyrehtyy kokonaan. Hallitse verenvuotoa painamalla matriksia noin 3 minuuttia. 6. Poista sideharso tai laparotomiatyynyt varovasti käyttökohdasta siirtämättä tai häiritsemättä EVARREST-liimamatriksia tai hyytymää. Tarkasta EVARREST-liimamatriksi ja varmista, että hemostaasi on saavutettu eikä vuotokohdan päällä ole ryppyjä. Jos et ole tyytyväinen sijoituskohtaan, poista EVARREST-liimamatriksi ja käytä uutta EVARREST-liimamatriksia. EVARREST-liimamatriksi pysyy paikallaan, tarttuu kudokseen ja imeytyy kehoon. 7. Sijoituskohtaa on tarkkailtava leikkauksen aikana ja on varmistettava, että hemostaasi ylläpidetään. Uudelleenhoito Uudelleenhoito voi olla tarpeen, jos EVARREST-liimamatriksissa on poimuja, taitoksia tai ryppyjä. Jos et ole tyytyväinen EVARREST-liimamatriksin sijoituskohtaan, poista käytetty EVARREST-liimamatriksi ja toista edellä esitetty asetustoimenpide uudella EVARRESTliimamatriksilla. Jos verenvuoto johtuu siitä, että vuotavaa aluetta ei ole peitetty kunnolla, EVARRESTliimamatrikseja voidaan käyttää useampia. Aseta yhtenä kerroksena ja varmista, että reunat ovat päällekkäin (noin 1 2 cm) olemassa olevan EVARREST-liimamatriksin kanssa. Jos verenvuodon jatkuminen johtuu epätäydellisestä tarttumisesta kudokseen (kun vuoto jatkuu sidoksen alla), poista EVARREST-liimamatriksi ja käytä uutta EVARRESTliimamatriksia. Jos vuoto jatkuu edelleen mainitun painamisajan aikana tai jälkeen, poista käytetty EVARREST-liimamatriksi ja tarkasta vuotokohta. Jos mitkään muut ensisijaiset hemostaattiset toimet (ts. kirurgiset vakiomenetelmät) eivät näytä olevan tarpeen, toista edellä kuvattu asetustoimenpide uudella EVARREST-liimamatriksilla. 4.3 Vasta-aiheet 4
5 EVARREST-liimamatriksia ei saa käyttää suurien valtimoiden tai laskimoiden suurten defektien runsaan verenvuodon hoitoon tai verenvuotoon sellaisissa verisuonissa, joissa vaurioitunut suonenseinämä on korjattava ja suonen avoimuutta ylläpidettävä, ja joka johtaisi pysyvään EVARREST-liimamatriksin altistumiseen verenvirtaukselle ja/tai paineelle paranemisprosessin ja valmisteen imeytymisen aikana. EVARREST-liimamatriksia ei saa käyttää suonensisäisesti. EVARREST-liimamatriksia ei saa käyttää suljetuissa tiloissa (esim. luun aukon läheisyydessä, sisällä tai ympärillä tai luiden rajoittamilla alueilla), sillä turpoaminen voi aiheuttaa hermon tai verisuonen puristumista. EVARREST-liimamatriksia ei saa käyttää aktiivisen infektion läsnä ollessa tai kehon kontaminoituneilla alueilla, koska seurauksena voi olla infektio. Yliherkkyys vaikuttaville aineille tai mille tahansa kohdassa 6.1 mainituille apuaineille. 4.4 Varoitukset ja käyttöön liittyvät varotoimet Vain kudosvaurion päälle. Suonensisäinen käyttö Ei saa käyttää suonensisäisesti. Hengenvaarallisia tromboembolia komplikaatioita voi esiintyä, jos valmistetta käytetään vahingossa suonensisäisesti. Valtimovuoto EVARREST-liimamatriksia ei saa käyttää ompeleiden tai muiden mekaanisten ligaatiomenetelmien sijasta huomattavan valtimovuodon hoitoon. Käytöt, joista ei ole saatavilla riittävästi tietoa Tietoa ei ole saatavilla riittävästi tukemaan tämän valmisteen käyttöä kudosliimana, hermokirurgiassa tai käyttöä joustavan endoskoopin kautta verenvuodon hoitoon, verisuonikirurgiassa tai ruuansulatuskanavan anastomooseissa. Vierasesinereaktiot Kaikkien implantoitavien valmisteiden yhteydessä voi esiintyä vierasesinereaktioita. EVARREST-liimamatriksia saa käyttää vain yhtenä kerroksena siten, että se ulottuu noin 1 2 cm sellaisen kudoksen päälle, joka ei vuoda, jotta se tarttuu kunnolla vuotokohtaan. EVARRESTliimamatriksin koko on rajoitettava vain hemostaasiin tarvittavaan määrään. Yliherkkyysreaktiot Kaikkien proteiinivalmisteiden yhteydessä voi esiintyä allergiatyyppisiä yliherkkyysreaktioita. Yliherkkyysreaktioiden merkkejä ovat muun muassa nokkosihottuma, laajalle levinnyt urtikaria, rintakehän ahdistus, hengityksen vinkuminen, alhainen verenpaine ja anafylaksia. Jos näitä oireita esiintyy, käyttö on lopetettava välittömästi. Sokkitapauksessa käytetään sokin hoidon lääketieteellisiä vakiomenetelmiä. Sisältää natriumia EVARREST-liimamatriksi sisältää enintään 2,7 mmol (62 mg) natriumia liimamatriksia kohti. Tämä on otettava huomioon potilailla, jotka noudattavat vähäsuolaista ruokavaliota. Tartuntavaaralliset aineet Ihmisen verestä tai plasmasta valmistettujen lääkevalmisteiden käytöstä aiheutuvien infektioiden estämiseen käytettyjä vakiomenetelmiä ovat muun muassa luovuttajien valinta, erillisten luovutusten ja plasmavarastojen seulonta tiettyjen infektiomarkkereiden osalta ja tehokkaiden valmistusmenetelmien käyttö virusten inaktivoimiseksi/poistamiseksi. Näistä toimista huolimatta, kun 5
6 ihmisen verestä tai plasmasta valmistettuja lääkkeitä käytetään, infektion tartuttamismahdollisuutta ei voi sulkea kokonaan pois. Tämä koskee myös tuntemattomia tai uusia viruksia ja muita patogeenejä. Näiden toimien katsotaan olevan tehokkaita vaipallisille viruksille kuten HIV-virus, hepatiitti B -virus ja hepatiitti C -virus, sekä ei-vaipalliselle hepatiitti A -virukselle. Suojauskeinoista voi olla rajallista apua ei-vaipallisia viruksia, kuten parvovirus B19:ää vastaan. Parvovirus B19 -infektio voi olla vakava raskaana oleville naisille (sikiöinfektio) ja henkilöille, joiden vastustuskyky on heikentynyt tai joilla on poikkeavaa erytropoieesia (esim. hemolyyttinen anemia). Suosittelemme, että aina kun EVARREST-liimamatriksia käytetään potilaalla, valmisteen nimi ja eränumero kirjataan muistiin, jotta potilaan ja valmiste-erän välille voidaan luoda yhteys. 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset Yhteisvaikutustutkimuksia ei ole tehty. Vastaavien valmisteiden tai trombiiniliuosten tavoin valmiste voi denaturoitua altistuttuaan alkoholia, jodia tai raskaita metalleja (esim. antiseptiset liuokset) sisältäville liuoksille. Kyseiset aineet on poistettava mahdollisimman hyvin ennen valmisteen käyttämistä. 4.6 Hedelmällisyys, raskaus ja imetys Fibriiniliimojen/hemostaattien turvallisuutta ihmisen raskauden tai rintaruokinnan aikana ei ole määritetty kontrolloiduissa kliinisissä tutkimuksissa. Eläimillä tehdyt kokeelliset tutkimukset eivät ole riittäviä arvioimaan valmisteen turvallisuutta suhteessa hedelmällisyyteen, lisääntymiskykyyn, sikiön kehitykseen ja raskauden kulkuun sekä kehitykseen ennen syntymää ja syntymän jälkeen. Tästä syystä EVARREST-liimamatriksia saa käyttää raskaana olevilla tai rintaruokkivilla naisilla vain, jos se on kliinisesti aiheellista. 4.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn Ei merkityksellinen. 4.8 Haittavaikutukset Yliherkkyyttä tai allergisia reaktioita (joihin voi kuulua angioödeema, kohdealueen poltto ja pistely, bronkospasmi, vilunväreet, punoitus, laajalle levinnyt urtikaria, päänsärky, nokkosihottuma, alhainen verenpaine, letargia, pahoinvointi, levottomuus, takykardia, rintakehän ahdistus, pistely, oksentelu, hengityksen vinkuminen) voi esiintyä harvinaisissa tapauksissa potilailla, joita hoidetaan fibriiniliimoilla/hemostaateilla. Yksittäisissä tapauksissa nämä reaktiot ovat edenneet vakavaan anafylaksiaan. Kyseisiä reaktioita voidaan nähdä etenkin, jos valmistetta käytetään toistuvasti tai jos sitä käytetään potilailla, joiden tiedetään olevan yliherkkiä valmisteen ainesosille. Fibriiniliima-/hemostaattivalmisteiden osien vasta-aineita voi esiintyä harvinaisissa tapauksissa. Myös anafylaktisen reaktion riski on olemassa (ks. kohta 4.4). Tromboembolisia komplikaatioita voi esiintyä, jos valmistetta käytetään vahingossa suonensisäisesti (ks. kohta 4.4). Lisätietoja tarttuviin aineisiin liittyvästä turvallisuudesta on kohdassa 4.4. Turvaprofiilin yhteenveto EVARREST-liimamatriksin turvallisuustiedot kuvastavat leikkauksenjälkeisiä komplikaatiotyyppejä, jotka liitetään yleensä leikkausolosuhteisiin, joissa tutkimukset tehtiin, ja potilaiden perussairauteen. Kliinisissä tutkimuksissa yleisimmin raportoidut haittavaikutukset olivat verenvuoto ja lisääntynyt fibrinogeeni ja vakavimmat haittavaikutukset olivat aspiraatio, keuhkoembolia ja verenvuoto. 6
7 Haittavaikutusten taulukko EVARREST-liimamatriksin neljän kliinisen kontrolloidun tutkimuksen ja yhden kontrolloimattoman kliinisen tutkimuksen tiedot on kerätty yhteen ja haittavaikutusten esiintymistaajuus seuraavassa taulukossa on peräisin näistä yhteenkerätyistä tiedoista. Yhdistetyissä analyyseissä 243 potilasta hoidettiin EVARREST-liimamatriksilla ja 110 potilasta hoidettiin kontrollihoidolla. Seuraavia kategorioita käytetään asettamaan haittavaikutukset järjestykseen niiden esiintymistiheyden mukaan: erittäin yleinen ( 1/10); yleinen ( 1/100 <1/10); epätavallinen ( 1/1 000 <1/100); harvinainen ( 1/10000 <1/1000); ja erittäin harvinainen (<1/10000), ei tiedetä (ei voida arvioida saatavilla olevan tiedon perusteella). Taulukko 1 EVARREST-liimamatriksin haittavaikutusten yhteenveto MedDRA-järjestelmän käyttämä termi Esiintyvyys elinluokituksen Verisuonitaudit Syvä laskimotromboosi Melko harvinainen Hengitystie-, rintakehä- ja välikarsinasairaudet Aspiraatio Pleuraalieffuusio Keuhkoembolia Melko harvinainen Melko harvinainen Melko harvinainen Ruuansulatuskanavan sairaudet Mahalaukun laajentuminen Askiitti Verenvuoto Ruuansulatuskanavan verenvuoto Vatsansisäinen verenvuoto Paikallinen vatsansisäinen nesteen kertyminen Nesteen kertyminen haiman ympärille Melko harvinainen Melko harvinainen Melko harvinainen Melko harvinainen Melko harvinainen Melko harvinainen Melko harvinainen Tutkimukset Kohonnut veren fibrinogeeni Yleinen Vamma, myrkytys ja toimenpiteeseen liittyvät komplikaatiot Toimenpiteen jälkeinen verenvuoto Yleinen Epäillyistä haittavaikutuksista ilmoittaminen Lääkinnällisen tuotteen hyväksynnän jälkeisistä epäillyistä haittavaikutuksista on tärkeää ilmoittaa. Näin lääkinnällisen tuotteen etujen ja riskien tasapainoa voidaan tarkkailla jatkuvasti. Terveydenhoidon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen raportointijärjestelmän kautta (ks. Appendix V). 4.9 Yliannostus Yhtään yliannostustapausta ei ole raportoitu. 5. FARMAKOLOGISET OMINAISUUDET 5.1 Farmakodynamiikka Farmakoterapeuttinen ryhmä: verenvuotoa estävät lääkkeet, paikalliset hemostaatit, ATC-koodi: B02BC30 EVARREST-liimamatriksi sisältää ihmisen fibrinogeeniä ja ihmisen trombiinia kuivattuna pinnoitteena resorboituvan komposiittimatriksin pinnalla. Joutuessaan kosketuksiin fysiologisten nesteiden, esim. veren, imunesteen tai fysiologisen suolaliuoksen kanssa päällyksen osat aktivoituvat 7
8 ja fibrinogeenin ja trombiinin reaktio käynnistää fysiologisen veren hyytymisen viimeisen vaiheen. Fibrinogeeni muunnetaan fibriinimonomeereiksi, jotka polymerisoituvat spontaanisti ja muodostavat fibriinihyytymän, joka pitää matriksin kunnolla kiinni haavan pinnalla. Fibriini ristilinkittyy sen jälkeen endogeenisen tekijän XIII toimesta ja muodostaa kiinteän, mekaanisesti vakaan fibriiniverkon, jonka tarttumisominaisuudet ovat hyvät. Komposiittimatriksi koostuu polyglaktiini 910:stä ja oksidoidusta regeneroidusta selluloosasta, jota käytetään tavallisesti hemostaattina. Matriksi toimii fyysisenä tukena ja suurena pinta-alueena biologisille osille, antaa valmisteelle luontaista mekaanista yhtenevyyttä ja tukee hyytymän muodostumista. EVARREST-liimamatriksin hyytymän muodostuminen on integroitu matriksiin. Se muodostaa mekaanisen esteen verenvuodolle ja vahvistaa haava-aluetta. Luonnollinen parantuminen tapahtuu samalla, kun fibriini hajoaa ja valmiste resorboituu elimistöön. Resorboitumisen katsotaan kestävän noin 8 viikkoa, kuten rotilla ja sioilla tehdyissä eläinkokeissa on osoitettu. Kliinisissä tutkimuksissa osoitettiin, että hemostaasi aikaansaatiin lievässä tai kohtalaisessa pehmytkudoksen vuodossa yhteensä 141 tutkittavalla (111 hoidettiin EVARREST-liimamatriksilla ja 30 kontrollivalmisteella), joille tehtiin vatsan, retroperitoneaalitilan, lantion ja (ei sydämeen liittyviä) rintakehän leikkauksia. Tämän lisäksi lisätutkimuksessa 91 tutkittavalla, joille tehtiin vatsan, retroperitoneaalitilan, lantion ja (ei sydämeen liittyviä) rintakehän leikkauksia (59 hoidettiin EVARREST-liimamatriksilla ja 32 kontrollivalmisteella) aikaansaatiin hemostaasi vakavassa pehmytkudoksen verenvuodossa. Jatkuvan parenkymaalisen vuodon hemostaasi saatiin aikaan kliinisessä tutkimuksessa 104 potilaalla, joille tehtiin maksaleikkaus (59 hoidettiin EVARRESTliimamatriksilla ja 45 kontrollivalmisteella). Euroopan lääkevirasto on lykännyt velvollisuutta esittää tutkimusten tulokset EVARRESTliimamatriksilla suoritetuista tutkimuksista yhdellä tai useammalla lapsista koostuvalla alaryhmällä leikkauksesta johtuvan verenvuodon hoitoon (lisätietoa käytöstä lapsilla on kohdassa 4.2). 5.2 Farmakokinetiikka EVARREST-liimamatriksi on tarkoitettu käytettäväksi vain kudosvaurion päällä. Suonensisäinen käyttö on vasta-aiheista ja voi aiheuttaa tromboemboliaa. Tästä syystä suonensisäisiä farmakokineettisiä tutkimuksia ei ole tehty ihmisillä. Kaneilla on tehty tutkimuksia trombiinin resorboitumisen ja poistumisen arvioimiseksi, kun sitä käytettiin osittaisen maksanpoistoleikkauksen aiheuttamassa, maksan pinnalla olevassa haavassa. 125 I- trombiinia käytettäessä osoitettiin, että trombiinin hajoamisesta johtuvaa, biologisesti inaktiivien peptidien hidasta resorboitumista esiintyi, saavuttaen C max -arvon plasmassa 6 8 tunnin kuluttua. C max - arvossa plasman pitoisuus edusti vain 1 2 % käytetystä annoksesta. Fibriiniliimat/hemostaatit metaboloituvat samalla tavalla kuin endogeeninen fibriini, fibrinolyysin ja fagosytoosin kautta. Kun biologiset osat ovat resorboituneet, matriksin osat (polyglaktiini 910 ja oksidoitu regeneroitu selluloosa) resorboituvat kokonaan. Eläinkokeissa EVARREST-matriksi resorboitui 56 päivässä, kun sitä käytettiin odotettu kliininen annos. 5.3 Prekliiniset tiedot turvallisuudesta EVARREST-liimamatriksin hemostaattinen teho on osoitettu useissa eläinkokeissa, joissa arvioitiin hemostaasiin kulunutta aikaa ja hoidonjälkeistä verenhukkaa muiden tulosmuuttujien ohessa. Matriksikomponentin ei-kliiniset tiedot eivät paljasta mitään erityistä vaaraa ihmisille seuraavien tutkimusten perusteella: sytotoksisuus, herkistyminen, ihonsisäinen reaktiivisuus, akuutti systeeminen toksisuus, materiaalin välittämä pyrogeenisyys, subkrooninen toksisuus, genotoksisuus, implantointi ja hemoyhteensopivuus. 8
9 90 päivän tutkimuksessa rotilla arvioitiin EVARREST-liimamatriksin subkroonista systeemistä toksisuutta ja immunogeenisyyttä ihonalaisen implantoinnin jälkeen, eikä mitään merkkejä toksisista vaikutuksista esiintynyt eikä näyttöä fibriiniliimavalmisteisiin liittyvästä lisääntyneestä immunogeenisyydestä löytynyt. 6. FARMASEUTTISET TIEDOT 6.1 Apuaineet Yhdistelmämatriksi (polyglaktiini 910 ja oksidoitu regeneroitu selluloosa) 20 mg/cm 2 Arginiinihydrokloridi Glysiini Natriumkloridi Natriumsitraatti Kalsiumkloridi Ihmisen albumiini Mannitoli Natriumasetaatti 6.2 Yhteensopimattomuudet Ei ole. 6.3 Kestoaika 2 vuotta. Kun foliopussi on avattu, EVARREST-matriksi voi jäädä steriilille alueelle, jotta se on käytettävissä koko toimenpiteen ajan. 6.4 Säilytys Ei saa säilyttää yli 25 C:n lämpötilassa. Ei saa pakastaa. 6.5 Pakkaustyyppi ja pakkauskoko 10,2 cm x 10,2 cm:n kokoinen alustalla oleva liimamatriksi (polyesteri) sinetöidyssä pussissa (polyesterilaminoitu alumiinifolio). Pakkauskoko on Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet Käyttöohjeet on kuvattu myös pakkausselosteessa. EVARREST-liimamatriksin käsittely EVARREST-liimamatriksi toimitetaan valmiina käytettäväksi steriileissä pakkauksissa ja sitä on käsiteltävä käyttäen steriiliä menetelmää aseptisissa olosuhteissa. Vaurioituneet pakkaukset on hävitettävä. Avaa valmiste ottamalla foliopussi kotelosta, vedä foliopussi varovasti auki välttäen koskettamasta folion sisäpuolta tai valkoista steriiliä alustaa, joka sisältää EVARRESTliimamatriksin. Ota valkoinen steriili alusta pussista ja vie se steriilille alueelle. 9
10 Pidä alustaa tukevasti kämmenellä varmistaen, että reiällinen sivu osoittaa ylöspäin. Poista sitten alustan yläosa toisella kädellä käyttämällä alustan sivussa olevia kielekkeitä. Alustan alaosa sisältää EVARREST-liimamatriksin sen aktiivinen puoli alaspäin. Aktiivinen puoli näyttää jauhemaiselta. Ei-aktiivisella puolella on aaltomainen kohokuvio. Pidä EVARREST-liimamatriksi kuivana avaamisen jälkeen. Tuote voi jäädä steriilille alueelle, jotta se on käytettävissä koko toimenpiteen ajan. EVARREST-liimamatriksi ei tartu käsineisiin, pihteihin eikä leikkausvälineisiin. Hävittäminen Kaikki käyttämättömät lääkevalmisteet tai jätemateriaalit tulee hävittää paikallisten säädösten mukaisesti. 7. MYYNTILUVAN HALTIJA Omrix Biopharmaceuticals NV Leonardo Da Vincilaan Diegem Belgia Puhelin: Faksi: MYYNTILUVAN NUMERO(T) EU/1/13/868/ MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ/UUDISTAMISPÄIVÄMÄÄRÄ Myyntiluvan myöntämisen päivämäärä: PP kuukausi VVVV 10. TEKSTIN MUUTTAMISPÄIVÄMÄÄRÄ Lisätietoa tästä lääkevalmisteesta on saatavana Euroopan lääkeviraston verkkosivuilla 10
11 LIITE II A. BIOLOGISTEN VAIKUTTAVIENAINEIDEN VALMISTAJAT JA ERÄN VAPAUTTAMISESTA VASTAAVATVALMISTAJAT B. TOIMITTAMISEEN JA KÄYTTÖÖN LIITTYVÄT EHDOT TAI RAJOITUKSET C. MYYNTILUVAN MUUT EHDOT JA EDELLYTYKSET D. EHDOT TAI RAJOITUKSET, JOTKA KOSKEVAT LÄÄKEVALMISTEEN TURVALLISTA JA TEHOKASTA KÄYTTÖÄ 11
12 A. BIOLOGISTEN VAIKUTTAVIEN AINEIDEN VALMISTAJAT JA ERÄN VAPAUTTAMISESTA VASTAAVATVALMISTAJAT Biologisten vaikuttavien aineidenvalmistajien nimet ja osoitteet Omrix Biopharmaceuticals Ltd. Plasma Fractionation Institute (PFI),MDA Blood Bank Sheba Hospital Ramat Gan POB 888 Kiryat Ono Israel Erän vapauttamisesta vastaavien valmistajien nimet ja osoitteet Omrix Biopharmaceuticals N.V. Leonardo Da Vinci Laan 15 B-1831 Diegem Belgia B. TOIMITTAMISEEN JA KÄYTTÖÖN LIITTYVÄT EHDOT TAI RAJOITUKSET Lääkevalmisteet "rajoitetulla" lääkemääräyksellä, varattu käyttöön tietyillä erityisalueilla (ks. liite I:valmisteyhteenvedon kohta 4.2). Virallinen erän vapauttaminen Direktiivin 2001/83/EY artiklan 114 mukaisesti erän virallinen vapauttaminen on suoritettava kansallisessa valvontalaboratoriossa tai muussa viranomaisen tähän tarkoitukseen hyväksymässä laboratoriossa. C. MYYNTILUVAN MUUT EHDOT JA EDELLYTYKSET Määräaikaiset turvallisuuskatsaukset Myyntiluvan haltijan on toimitettava tätä valmistetta koskeva ensimmäinen määräaikainen turvallisuuskatsaus kuuden kuukauden sisällä myyntiluvan myöntämisestä. Sen jälkeen myyntiluvan haltijan on toimitettava tätä valmistetta koskevat määräaikaiset turvallisuuskatsaukset niiden vaatimusten mukaisesti, jotka on esitetty unionin viitepäivien luettelossa (EURD-luettelo), josta säädetään direktiivin 2001/83/EY 107c artiklan 7 kohdassa ja joka julkaistaan Euroopan lääkealan verkkoportaalissa. D. EHDOT TAI RAJOITUKSET, JOTKA KOSKEVAT LÄÄKEVALMISTEEN TURVALLISTA JA TEHOKASTA KÄYTTÖÄ Riskinhallintasuunitelma (RMP) Myyntiluvan haltijan on suoritettava vaaditut lääketurvatoimet ja interventiot myyntiluvan moduulissa esitetyn sovitun riskinhallintasuunnitelman sekä mahdollisten sovittujen riskinhallintasuunnitelman myöhempien päivitysten mukaisesti. Päivitetty riskinhallintasuunnitelma tulee toimittaa:. 12
13 Euroopan lääkeviraston pyynnöstä kun riskinhallintajärjestelmää muutetaan, varsinkin kun saadaan uutta tietoa, joka saattaa johtaa hyöty-riskiprofiilin merkittävään muutokseen, tai kun on saavutettu tärkeä tavoite (lääketurvatoiminnassa tai riskien minimoinnissa). Jos määräaikaisen turvallisuuskatsauksen toimitus ja riskinhallintasuunnitelman päivitys sattuvat samalle ajankohdalle, ne voidaan toimittaa samanaikaisesti. 13
14 LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 14
15 A. MYYNTIPÄÄLLYSMERKINNÄT 15
16 ULKOPAKKAUKSESSA JA SISÄPAKKAUKSESSA ON OLTAVA SEURAAVAT MERKINNÄT Kotelo ja foliopussi 1. LÄÄKEVALMISTEEN NIMI EVARREST-liimamatriksi 2. VAIKUTTAVAT AINEET EVARREST-liimamatriksi sisältää seuraavia aineita (cm 2 ) Ihmisen fibrinogeeni 8,1 mg Ihmisen trombiini 40 IU 3. LUETTELO APUAINEISTA Yhdistelmämatriksi (polyglaktiini 910 ja oksidoitu regeneroitu selluloosa) Arginiinihydrokloridi Glysiini Natriumkloridi Natriumsitraatti Kalsiumkloridi Ihmisen albumiini Mannitoli Natriumasetaatti 4. LÄÄKEMUOTO JA SISÄLLÖN MÄÄRÄ Sisältää yhden liimamatriksin (10,2 cm x 10,2 cm) 5. ANTOTAPA JA ANTOREITIT Vain kudosvaurion päälle. Lue pakkausseloste ennen käyttöä. 6. ERITYISVAROITUS VALMISTEEN SÄILYTTÄMISESTÄ POISSA LASTEN ULOTTUVILTA JA NÄKYVILTÄ Ei lasten ulottuville eikä näkyville. 7. MUUT ERITYISVAROITUKSET, JOS TARPEEN 8. VIIMEINEN KÄYTTÖPÄIVÄMÄÄRÄ EXP 16
17 9. ERITYISET SÄILYTYSOLOSUHTEET Ei saa säilyttää yli 25 C:n lämpötilassa. Ei saa pakastaa. 10. ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMIEN LÄÄKEVALMISTEIDEN TAI NIISTÄ PERÄISIN OLEVAN JÄTEMATERIAALIN HÄVITTÄMISEKSI, JOS TARPEEN Kaikki käyttämättömät lääkevalmisteet tai jätemateriaalit tulee hävittää paikallisten säädösten mukaisesti. 11. MYYNTILUVAN HALTIJAN NIMI JA OSOITE Omrix Biopharmaceuticals NV Leonardo Da Vincilaan Diegem Belgia 12. MYYNTILUVAN NUMERO(T) EU/1/13/868/001/ 13. ERÄNUMERO Erä 14. YLEINEN TOIMITTAMISLUOKITTELU Lääkemääräyksen alainen lääkevalmiste. 15. KÄYTTÖOHJEET 16. TIEDOT PISTEKIRJOITUKSELLA Pistekirjoituksen poisjättämislupa hyväksytty. 17
18 B. PAKKAUSSELOSTE 18
19 Pakkausseloste: Valmisteen tiedot käyttäjälle EVARREST -liimamatriksi Ihmisen fibrinogeeni, ihmisen trombiini Tämä lääke on lisävalvonnan alainen. Tämä mahdollistaa uusien turvatietojen pikaisen tunnistamisen. Voit olla avuksi raportoimalla sivuvaikutuksista, joita sinulla on. Katso kohdan 4 lopusta, miten voit ilmoittaa sivuvaikutuksista. Lue koko pakkausseloste huolellisesti ennen kuin tätä lääkettä käytetään hoitoon, koska se sisältää tärkeitä tietoja. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla on lisäkysymyksiä, käänny lääkärisi puoleen. - Jos sinulla on sivuvaikutuksia, keskustele lääkärisi kanssa. Tämä koskee myös mahdollisia sivuvaikutuksia, joita ei ole lueteltu tässä pakkausselosteessa. Katso kohtaa 4. Mitä tämä pakkausseloste sisältää? 1. Mitä EVARREST on ja mihin sitä käytetään 2. Mitä sinun tulisi tietää ennen kuin sinua hoidetaan EVARREST-tuotteella 3. Miten EVARREST-tuotetta käytetään 4. Mahdolliset haittavaikutukset 5. Miten EVARREST-tuotetta säilytetään 6. Pakkauksen sisältö ja muita tietoja 1. Mitä EVARREST on ja mihin sitä käytetään EVARREST on yhdistelmävalmiste, joka on valmistettu ihmisen fibrinogeenillä ja trombiinilla päällystetyllä imukykyisellä materiaalilla (matriksi). Fibrinogeeni on verestä uutettua proteiinia, jonka entsyymitrombiini saa toimimaan siten, että se muodostaa fibriinihyytymän. Kun EVARREST-tuotteen kuiva jauhepinta kastellaan, trombiini alkaa nopeasti hyydyttää fibrinogeenia. Fibriinihyytymä sulautuu matriksiin, jonka ansiosta EVARREST tarttuu tiukasti ympäröivään kudokseen. EVARREST-tuotetta käytetään leikkaustoimenpiteiden aikana aikuispotilaille verenvuodon ja tihkumisen lopettamiseksi leikkauksen aikana. Se asetetaan suoraan kudoksen päälle, mihin se tarttuu tiukasti ja lopettaa verenvuodon. Se jätetään paikalleen leikkauksen jälkeen ja imeytyy kehoon. 2. Mitä sinun tulisi tietää ennen kuin sinua hoidetaan EVARREST -tuotteella Kirurgi ei saa hoitaa sinua EVARREST-tuotteella seuraavissa tilanteissa: EVARREST-tuotetta ei saa käyttää suurten valtimoiden tai laskimoiden vaurioituneen seinämän korjaamiseen, jos tuote altistuu jatkuvalle verenvirtaukselle ja paineelle. EVARREST-tuotetta ei saa käyttää verisuonten sisäpinnoilla. EVARREST-tuotetta ei saa käyttää suljetuissa tiloissa (esimerkiksi luun aukkojen tai tiehyeiden sisällä, ympärillä tai vieressä, tai muilla rajoitetuilla alueilla luun ympärillä, jossa se voi turvota ja painaa hermoja tai verisuonia. 19
20 EVARREST-tuotetta ei saa käyttää aktiivisen infektion yhteydessä tai kehon kontaminoituneilla alueilla, koska seurauksena voi olla infektio. EVARREST-tuotetta ei saa käyttää hoitoon, jos olet allerginen ihmisen fibrinogeenille tai ihmisen trombiinille tai tämän lääkkeen muille aineksille (lueteltu kohdassa 6). Varoitukset ja varotoimet Käyttökohteet, joista ei ole riittävästi tietoa EVARREST-tuotteen käyttöä ei ole tutkittu seuraavissa toimenpiteissä, minkä vuoksi ei ole tietoa sen tehokkuudesta: - kudosten liimaaminen yhteen - aivo- tai selkäydinkirurgia - vatsan tai suoliston verenvuodon hallinta siten, että tuotetta käytetään endoskoopin (tähystinlaite) kautta - suolistoon tehtyjen kirurgisten korjausten sulkeminen. Vierasesinereaktiot Kuten kaikkien implantoitujen tuotteiden yhteydessä, elimistö voi kehittää vierasainereaktioita. Tämä voi aiheuttaa parantumisongelmia. EVARREST-tuotetta saa käyttää vain yksikerroksisena siten, että se ulottuu noin 1 2 cm vuotamattoman alueen päälle, jotta sen tarttumista vuotavalle alueelle autetaan. EVARREST-tuotteen koko on rajoitettava kokoon, joka tarvitaan verenvuodon lopettamiseksi. Yliherkkyysreaktiot Allergiatyyppiset yliherkkyysreaktiot ovat mahdollisia. Merkkejä tällaisista reaktioista ovat muun muassa urtikaria, ihottuma, rintakehän ahdistus, hengityksen vinkuminen, verenpaineen lasku ja anafylaksia (nopeasti alkava vakava reaktio). Jos näitä oireita esiintyy leikkauksen aikana, tuotteen käyttö tulisi lopettaa välittömästi. Tartuntavaaralliset aineet Kun lääkkeitä valmistetaan ihmisen verestä tai plasmasta, on ryhdyttävä tiettyihin toimiin, jotta infektioiden leviäminen potilaisiin voidaan estää. Näitä ovat: - veren- ja plasmanluovuttajien huolellinen valinta, jotta infektioita mahdollisesti kantavat henkilöt jätetään pois - jokaisen luovutuksen ja plasman testaus virusten/infektioiden varalta - veren ja plasman käsittelyvaiheet, jotka voivat tehdä passiiviseksi tai poistaa virukset. Näistä toimista huolimatta, kun ihmisen verestä tai plasmasta valmistettuja lääkkeitä annetaan, infektion tartuttamismahdollisuutta ei voi sulkea kokonaan pois. Tämä koskee myös kaikkia tuntemattomia tai uusia viruksia tai muuntyyppisiä infektioita. Fibrinogeenin ja trombiinin valmistukseen käytettyjen suojauskeinojen katsotaan olevan tehokkaita vaipallisille viruksille, kuten HIV-virus, hepatiitti B -virus ja hepatiitti C -virus, ja ei-vaipalliselle hepatiitti A -virukselle. Suojauskeinoista voi olla rajallista apua ei-vaipallisia viruksia, kuten parvovirus B19:ää, vastaan. Parvovirus B19 -infektio saattaa olla vakava raskaana oleville naisille (sikiöinfektio) ja henkilöille, joiden vastustuskyky on heikentynyt tai joilla on jonkintyyppinen anemia (esimerkiksi sirppisoluanemia tai hemolyyttinen anemia). Suosittelemme erityisesti, että jokaisella EVARREST-hoitokerralla kirjataan muistiin lääkkeen nimi ja eränumero käytettyjen erien muistamiseksi. Lapset ja teini-ikäiset EVARREST-tuotetta ei suositella lapsille tai alle 18-vuotiaille. 20
21 Muut lääkkeet ja EVARREST Ilmoita lääkärille tai apteekkiin, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. Raskaus, imetys ja hedelmällisyys Käytettävissä ei ole tietoa EVARREST-tuotteen käyttöön liittyvistä riskeistä raskauden aikana tai imetettäessä, eikä sen vaikutuksesta hedelmällisyyteen. Jos olet raskaana, imetät, epäilet olevasi raskaana tai suunnittelet tulevasi raskaaksi, sinun pitää ottaa yhteyttä lääkäriisi ennen tämän lääkkeen käyttöä. EVARREST sisältää natriumia Tämä lääke sisältää enintään 2,7 mmol (62 mg) natriumia EVARREST-liimamatriksia kohden. Tämä on otettava huomioon potilailla, jotka noudattavat vähäsuolaista ruokavaliota. 3. Miten EVARREST -tuotetta käytetään Kirurgi asettaa EVARREST-tuotteen leikkauksen aikana. Se asetetaan painamalla lujasti vuotavaa kudosta noin 3 minuutin ajan. EVARREST aktivoituu, kun se koskettaa verta tai muita nesteitä ja tarttuu tiukasti kudokseen. Se jätetään paikalleen ja imeytyy kehoon noin 8 viikossa. EVARREST voidaan leikata vuotavaa aluetta vastaavaan kokoon ja muotoon. Käytetyn EVARRESTtuotteen määrä riippuu leikkauksen aikana hoidetun vuotavan kohdan koosta ja sijainnista. EVARREST-matriksia saa käyttää vain yksikerroksisena. Enintään kahta 10,2 cm x 10,2 cm:n yksikköä vastaavaa määrää on käytettävä tarvittaessa koko vuotavan alueen peittämiseen siten, että ne ovat päällekkäin noin 1 2 cm. Jos vuotoa esiintyy edelleen, EVARREST-liimamatriksi voidaan poistaa ja tilalle asentaa uusi. Leikkauksen jälkeen kehoon jäänyt kokonaismäärä EVARREST-tuotetta ei saa ylittää kahden 10,2 cm x 10,2 cm liimamatriksin kokoa. 4. Mahdolliset haittavaikutukset Kuten kaikki muutkin lääkkeet, tämä lääke voi aiheuttaa sivuvaikutuksia, mutta kaikki eivät saa niitä. Seuraavia haittavaikutuksia on havaittu EVARREST-tuotteen kliinisissä tutkimuksissa: Kaikkein vakavimmat sivuvaikutukset Verenvuoto - suolessa (ruoansulatuskanavan verenvuoto); esiintyvyys oli melko harvinaista (voi vaikuttaa enintään yhteen ihmiseen sadasta) - vatsassa (vatsansisäinen verenvuoto); esiintyvyys oli melko harvinaista (voi vaikuttaa enintään yhteen ihmiseen sadasta) - leikkauksen jälkeen (toimenpiteen jälkeinen verenvuoto); esiintyvyys oli yleistä (voi vaikuttaa enintään yhteen ihmiseen kymmenestä) Veritulppa (tromboembolia) - laskimoissa, etenkin alaraajojen laskimoissa (syvä laskimotromboosi) - keuhkoihin verta toimittavissa valtimossa (keuhkoembolia) Molempien näiden vaikutusten esiintyvyys oli melko harvinaista (voi vaikuttaa enintään yhteen ihmiseen sadasta). 21
22 Tahaton nesteenpääsy hengitystiehen (aspiraatio); esiintyvyys oli melko harvinaista (voi vaikuttaa enintään yhteen ihmiseen sadasta). Jos koet joitakin oireita, kuten veren oksentamista, veristä ulostetta, verta vatsadreenissä, raajojen turvotusta tai värimuutoksia ihossa, rintakipua ja hengenahdistusta tai muita leikkaukseen liittyviä oireita, ota välittömästi yhteys lääkäriin tai kirurgiin. Muut sivuvaikutukset Muita EVARREST-tuotteen kliinisten tutkimusten aikana esiintyneitä sivuvaikutuksia olivat muun muassa: Yleiset (vaikuttaa enintään yhteen ihmiseen kymmenestä) - haavakomplikaatiot leikkauksen jälkeen (mukaan lukien verenvuoto ja infektio leikkauksen aikana tai sen jälkeen) - veren fibrinogeenitason kohoaminen. Melko harvinaisia (vaikuttaa yhteen ihmiseen sadasta ja alle yhteen ihmiseen kymmenestä) - nesteen ja ilman kertyminen vatsaan tai keuhkoihin toimenpiteen jälkeen (keuhkoeffuusio, vatsan pullistuma, askites, haimanesteen kerääntyminen). - EVARREST sisältää fibriinikudosliiman osatekijät. Fibriinikudosliimat voivat harvoissa tapauksissa (enintään yhdellä tuhannesta) aiheuttaa allergisia reaktioita. Jos sinulla on allerginen reaktio, sinulla voi olla yksi tai useampia seuraavista oireista: ihonalainen turvotus (angioedeema), ihottuma, urtikaria (nokkosrokko), rintakehän kireys, vilunväristykset, kuumotus, päänsärky, alhainen verenpaine, letargia, pahoinvointi, levottomuus, sykkeen nousu, kihelmöinti, oksentelu tai hengityksen vinkuminen. Jos sinulla esiintyy jokin näistä oireista leikkauksen jälkeen, ota yhteys lääkäriin tai kirurgiin. On myös teoreettisesti mahdollista, että elimistösi kehittää vasta-aineita EVARREST-tuotteen proteiineille, mikä saattaa mahdollisesti häiritä veren hyytymistä. Tämäntyyppisen tapahtuman esiintymistiheyttä ei tunneta (ei voi arvioida käytettävissä olevien tietojen perusteella). Sivuvaikutuksista ilmoittaminen Jos sinulla on sivuvaikutuksia, keskustele lääkärin tai kirurgin kanssa. Tämä koskee myös mahdollisia sivuvaikutuksia, joita ei ole lueteltu tässä pakkausselosteessa. Voit myös ilmoittaa sivuvaikutuksista suoraan kansallisen ilmoitusjärjestelmän kautta, joka on lueteltu osoitteessa Appendix V. Ilmoittamalla sivuvaikutuksista voit auttaa antamaan lisätietoa tämän lääkkeen turvallisuudesta. 5. Miten EVARREST -tuotetta säilytetään EVARREST-tuotetta ei saa jättää lasten ulottuville. EVARREST-tuotetta ei saa käyttää sen foliopussiin ja pakkaukseen merkityn viimeisen käyttöpäivän jälkeen (edessä merkintä EXP). Viimeinen käyttöpäivä tarkoittaa kuukauden viimeistä päivää. EVARREST-tuotetta ei saa säilyttää yli 25 C:n lämpötilassa, eikä sitä saa pakastaa. EVARREST on pidettävä kuivana aina ennen käyttöä sen aktivoitumisen estämiseksi. Foliopussi suojaa EVARREST-tuotetta kosteudelta ja mikrobiologiselta kontaminaatiolta. 22
23 6. Pakkauksen sisältö ja muita tietoja Mitä EVARREST sisältää? - Aktiivisia aineita ovat seuraavat: - Ihmisen fibrinogeeni (8,1 mg/cm2) - Ihmisen trombiini (40 IU/cm2) - Muita aineita ovat: - yhdistelmämatriksi (polyglaktiini 910 ja oksidoitu regeneroitu selluloosa) - arginiinihydrokloridi - glysiini - natriumkloridi - natriumsitraatti - kalsiumkloridi - ihmisen albumiini - mannitoli - natriumasetaatti Miltä EVARREST näyttää ja pakkauksen sisältö EVARREST toimitetaan liimamatriksina, jonka koko on 10,2 cm x 10,2 cm. Pakkauskoko on 1. Myyntiluvan haltija ja valmistaja Omrix Biopharmaceuticals NV Leonardo Da Vincilaan 15B-1831 Diegem Belgia Puhelin: Faksi: Jos sinulla on kysyttävää tästä lääkkeestä, ota yhteys valmistajaan: Pharmacovigilance Department Omrix Biopharmaceuticals Ltd Plasma Fractionation Institute Sheba Hospital, Tel Hashomer Ramat Gan 52621, Israel Puhelin: Faksi: Tämän pakkausselosteen viimeisin versio on MM/YYYY Muut tiedonlähteet Tarkempaa tietoa tästä lääkkeestä on saatavilla Euroopan lääkeviraston kotisivuilta Tämä pakkausseloste on saatavilla kaikilla EU/EEA-kielillä Euroopan lääkeviraston Internet-sivuilla
24 Seuraavat tiedot on tarkoitettu ainoastaan terveysviranomaisten käyttöön: Käyttöohjeet Lue tämä ennen pakkauksen avaamista. EVARREST -tuotteen käsittely EVARREST toimitetaan valmiina käytettäväksi steriileissä pakkauksissa ja sitä on käsiteltävä käyttäen steriiliä menetelmää aseptisissa olosuhteissa. Hävitä vaurioituneet pakkaukset, koska niitä ei voi steriloida uudelleen. Avaa tuote ottamalla foliopussi kotelosta, vedä foliopussi varovasti auki välttäen koskettamasta folion sisäpuolta tai valkoista steriiliä alustaa, joka sisältää EVARREST-tuotteen. Ota valkoinen steriili alusta pussista ja vie se steriilille alueelle. Pidä alustaa tukevasti kämmenellä varmistaen, että reiällinen sivu osoittaa ylöspäin. Poista sitten alustan yläosa toisella kädellä käyttämällä alustan sivussa olevia kielekkeitä. Alustan alaosa sisältää EVARREST-tuotteen sen aktiivinen puoli alaspäin. Aktiivinen puoli näyttää jauhemaiselta. Ei-aktiivisella puolella on aaltomainen kohokuvio. Pidä EVARREST kuivana avaamisen jälkeen. Bioaktiivinen EVARREST-liimamatriksi voi jäädä steriilille alueelle, jotta se on käytettävissä koko toimenpiteen ajan. EVARREST ei tartu käsineisiin, pihteihin eikä leikkausvälineisiin. EVARREST -tuotteen säilytys Ei saa käyttää koteloon ja etikettiin merkityn viimeisen käyttöpäivän jälkeen. Ei lasten ulottuville. Ei saa säilyttää yli 25 C:n lämpötilassa. Ei saa pakastaa. EVARREST -tuotteen käyttö Käytettäväksi ainoastaan kudosvaurion päällä. EVARREST asetetaan painamalla sitä noin 3 minuuttia käsin. 1. Leikkaa EVARREST tarpeen mukaan oikeankokoiseksi ja -muotoiseksi steriileillä saksilla niin, että se ulottuu noin 1 2 cm vuotavan alueen yli. Pidä EVARREST-tuotteen jauhomainen kellertävä aktiivinen puoli alaspäin, kun se on alustalla. 2. Poista ylimääräinen veri tai neste käyttökohdasta, jos se on tarpeen näkyvyyden parantamiseksi. Vuotava kohta tulisi tunnistaa selvästi ja on varmistettava, että EVARREST asetetaan suoraan vuotavan kohdan päälle siten, että matriksi peittää sen kokonaan. EVARREST-tuotetta voidaan käyttää aktiivisesti vuotavalla alueella. 24
25 3. Aseta EVARREST-tuotteen aktiivinen puoli vuotavalle alueelle siten, että se on täysin kosketuksissa kudoksen kanssa. Tuote aktivoidaan sen koskettaessa nestettä ja se tarttuu kudokseen ja muotoutuu kudoksen mukaan. 4. Aseta riittävän suuri pala EVARREST-tuotetta siten, että se peittää koko vuotavan alueen ja ulottuu noin 1 2 cm vuotamattoman alueen päälle, jotta se tarttuisi kunnolla haavaan. 5a) Pidä kuivaa tai kosteaa sideharsotyynyä tai laparotomiatyynyjä EVARREST-tuotteen päällä täyden kontaktin säilyttämiseksi vuotavan pinnan kanssa. 5b) Hemostaasin varmistamiseksi paina koko EVARREST-tuotteen pintaa välittömästi kädellä (mukaan lukien vuotavan pinnan ulkopuolelle ulottuvaa aluetta), jotta vuoto tyrehtyy kokonaan. Hallitse verenvuotoa painamalla noin 3 minuuttia. 6. Poista sideharso tai laparotomiatyynyt varovasti käyttökohdasta siirtämättä tai häiritsemättä EVARREST-tuotetta tai hyytymää. Tarkasta EVARREST varmistaaksesi, että hemostaasi on saavutettu, ja vahvistaaksesi, ettei vuotokohdan päällä ole ryppyjä. Jos et ole tyytyväinen sijoituskohtaan, poista EVARREST ja käytä uutta EVARREST-liimamatriksia. EVARREST pysyy paikallaan, tarttuu kudokseen ja imeytyy kehoon. 25
26 7. Sijoituskohtaa on tarkkailtava leikkauksen aikana ja varmistettava, että hemostaasia ylläpidetään. Uudelleenhoito Uudelleenhoito voi olla tarpeen, jos EVARREST-liimamatriksissa on poimuja, taitoksia tai ryppyjä. Jos et ole tyytyväinen EVARREST-liimamatriksin sijoituskohtaan, poista käytetty matriksi ja toista yllä oleva asetustoimenpide uudella EVARREST-liimamatriksilla. Jos verenvuoto johtuu siitä, että vuotavaa aluetta ei ole peitetty kunnolla, EVARRESTliimamatrikseja voidaan käyttää useampia. Aseta yhtenä kerroksena ja varmista, että reunat ovat päällekkäin (noin 1 2 cm) olemassa olevan EVARREST-liimamatriksin kanssa. Jos verenvuoto johtuu epätäydellisestä tarttumisesta kudokseen (kun vuoto jatkuu siteen alla), poista EVARREST-liimamatriksi ja käytä uutta matriksia. Jos vuoto jatkuu edelleen mainitun painamisajan aikana tai jälkeen, poista käytetty EVARREST-liimamatriksi ja tarkasta vuotokohta. Jos mitkään muut ensisijaiset hemostaattiset toimet (ts. kirurgiset vakiomenetelmät) eivät näytä olevan tarpeen, toista yllä mainittu asetustoimenpide uudella EVARREST-liimamatriksilla. Hävittäminen Kaikki käyttämättömät lääkintätuotteet tai jätemateriaalit tulee hävittää paikallisten säädösten mukaisesti. 26
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
VALMISTEYHTEENVETO. Yksi tippa silmän sidekalvopussiin 4 kertaa päivässä tai tarpeen mukaan tilan vaikeusasteesta riippuen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO. Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia 20 mg (2 %).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4 injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
VALMISTEYHTEENVETO. Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
NOBIVAC RABIES VET. Adjuvantti: Alumiinifosfaatti (2 %) 0,15 ml (vastaten alumiinifosfaattia 3 mg)
 VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
VALMISTEYHTEENVETO. Neste- ja elektrolyyttihukka esim. leikkauksen, trauman tai palovammojen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO. Ruiskeina annettavien jauheiden, konsentraattien ja liuosten liuottamiseen ja laimentamiseen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Valmisteen kuvaus: pyöreä, merkintä BEPANTHEN kehässä, halkaisija n. 18 mm, paksuus n. 3,5 mm, harmaankeltainen, sitruunan tuoksu.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. BiQi 3 g jauhe oraalisuspensiota varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BiQi 3 g jauhe oraalisuspensiota varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 3 grammaa diosmektiittiä. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BiQi 3 g jauhe oraalisuspensiota varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 3 grammaa diosmektiittiä. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO. Liialliseen kaasunmuodostukseen liittyvät mahan ja suoliston vaivat
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
VALMISTEYHTEENVETO. 1 ml injektiopullo. 2 ml injektiopullo. 50 90 mg 100 180 mg 250 450 mg
 1. LÄÄKEVALMISTEEN NIMI EVICEL liuokset kudosliimaa varten VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttavat aineet: Komponentti 1 Ihmisen koaguloituva proteiini, sisältää pääasiassa
1. LÄÄKEVALMISTEEN NIMI EVICEL liuokset kudosliimaa varten VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttavat aineet: Komponentti 1 Ihmisen koaguloituva proteiini, sisältää pääasiassa
Apuaineet: Yksi gramma sisältää 1,56 mg metyyliparahydroksibentsoaattia (E 218) ja 0,17 mg propyyliparahydroksibentsoaattia (E 216), ks. kohta 4.4.
 1. LÄÄKEVALMISTEEN NIMI REGRANEX 0,01 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 100 μg bekaplermiiniä*. * Rekombinantti-DNA-tekniikalla tuotettu ihmisen BB-verihiutalekasvutekijä
1. LÄÄKEVALMISTEEN NIMI REGRANEX 0,01 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 100 μg bekaplermiiniä*. * Rekombinantti-DNA-tekniikalla tuotettu ihmisen BB-verihiutalekasvutekijä
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Purevax Rabies injektioneste, suspensio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: Rabies rekombinantti canarypox-virus
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Purevax Rabies injektioneste, suspensio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: Rabies rekombinantti canarypox-virus
VALMISTEYHTEENVETO. Shampoo Viskoosi liuos, joka on väriltään kirkkaan oljenkeltainen tai vaaleanoranssi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Equilis West Nile injektioneste, suspensio hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttava aine: Inaktivoitu
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Equilis West Nile injektioneste, suspensio hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttava aine: Inaktivoitu
VALMISTEYHTEENVETO. Hiuspohja pestään Ketoconazol ratiopharm shampoolla, jonka annetaan vaikuttaa 3-5 minuutin ajan ennen huuhtelua.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ketoconazol ratiopharm 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra shampoota sisältää 20 mg ketokonatsolia. Apuaineet: Täydellinen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ketoconazol ratiopharm 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra shampoota sisältää 20 mg ketokonatsolia. Apuaineet: Täydellinen
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
1. LÄÄKEVALMISTEEN NIMI. Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1. LÄÄKEVALMISTEEN NIMI Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää: 361-509 mg Arctostaphylos uva-ursi (L.) Spreng. folium (sianpuolukan
1. LÄÄKEVALMISTEEN NIMI Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää: 361-509 mg Arctostaphylos uva-ursi (L.) Spreng. folium (sianpuolukan
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4, injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Nobivac L4, injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttavat aineet: Inaktivoidut Leptospira
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO. Huom. Emätinpuikko tulee työntää syvälle emättimeen, ei mielellään kuukautisten aikana.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI TachoSil-kudosliimamatriksi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi neliösenttimetri TachoSil-valmistetta sisältää ihmisen fibrinogeeniä ihmisen
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI TachoSil-kudosliimamatriksi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi neliösenttimetri TachoSil-valmistetta sisältää ihmisen fibrinogeeniä ihmisen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.1 Käyttöaiheet. 4.2 Annostus ja antotapa
 1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
VALMISTEYHTEENVETO. Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia, joka vastaa 2,68 mg bentsydamiinia.
 1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO. Täydellisen parenteraalisen ravitsemuksen täydennyksenä vesiliukoisten vitamiinien päivittäisen tarpeen tyydyttämiseksi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO. Akrivastiinia ei pidä määrätä potilaille, joiden munuaistoiminta on merkittävästi heikentynyt.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
Kissa: Leikkauksen jälkeisen kivun lievitys kohdun ja munasarjojen poistoleikkauksen sekä pienten pehmytkudoskirurgisten toimenpiteiden jälkeen.
 1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
Injektioneste, suspensio. Vaaleanpunertava tai valkoinen neste, joka sisältää valkoista sakkaa. Sakka sekoittuu helposti ravisteltaessa.
 1. ELÄINLÄÄKKEEN NIMI Trilyme injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttavat aineet: Inaktivoitu Borrelia burgdorferi sensu lato: Borrelia
1. ELÄINLÄÄKKEEN NIMI Trilyme injektioneste, suspensio koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (1 ml) sisältää: Vaikuttavat aineet: Inaktivoitu Borrelia burgdorferi sensu lato: Borrelia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Harmaapilkullinen, pyöreä, kuperapintainen tabletti, halkaisija 13 mm
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI CARBO MEDICINALIS 250 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Aktiivihiili, 250 mg Täydellinen apuaineluettelo, ks. kohta 6.1 3. LÄÄKEMUOTO Tabletti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI CARBO MEDICINALIS 250 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Aktiivihiili, 250 mg Täydellinen apuaineluettelo, ks. kohta 6.1 3. LÄÄKEMUOTO Tabletti
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
Actinobacillus pleuropneumoniae, serotyyppi 2, kanta RP 1*
 1. ELÄINLÄÄKEVALMISTEEN NIMI Hyobac App Multi Vet., injektioneste, emulsio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttavat aineet: Annosta kohti (1,0 ml) Actinobacillus pleuropneumoniae, serotyyppi
1. ELÄINLÄÄKEVALMISTEEN NIMI Hyobac App Multi Vet., injektioneste, emulsio 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttavat aineet: Annosta kohti (1,0 ml) Actinobacillus pleuropneumoniae, serotyyppi
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystatin Orifarm 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet, joiden vaikutus tunnetaan: - metyyliparahydroksibentsoaatti
1. LÄÄKEVALMISTEEN NIMI Nystatin Orifarm 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet, joiden vaikutus tunnetaan: - metyyliparahydroksibentsoaatti
Lääkevalmisteella ei enää myyntilupaa
 LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Pruban 0,1 % emulsiovoide koiralle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava(t) aine(et): Resokortolibutyraatti 3. LÄÄKEMUOTO Valkoinen tai
LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Pruban 0,1 % emulsiovoide koiralle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava(t) aine(et): Resokortolibutyraatti 3. LÄÄKEMUOTO Valkoinen tai
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ditebooster Injektioneste, suspensio, esitäytetyissä ruiskuissa. Kurkkumätä- ja jäykkäkouristusrokote (adsorboitu, vähennetty antigeenimäärä) 2. VAIKUTTAVAT AINEET
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ditebooster Injektioneste, suspensio, esitäytetyissä ruiskuissa. Kurkkumätä- ja jäykkäkouristusrokote (adsorboitu, vähennetty antigeenimäärä) 2. VAIKUTTAVAT AINEET
Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen tai melkein valkoinen talkkimainen jauhe.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO. 1 annospussi sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg jauhe oraalisuspensiota varten, annospussi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 annospussi sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg jauhe oraalisuspensiota varten, annospussi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 annospussi sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita,
VALMISTEYHTEENVETO. 1 kapseli sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kapseli sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745. Apuaineet,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kapseli sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745. Apuaineet,
1. ELÄINLÄÄKKEEN NIMI. SUISENG vet. Injektioneste, suspensio, sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. Koostumus annosta kohti (2 ml):
 1. ELÄINLÄÄKKEEN NIMI SUISENG vet. Injektioneste, suspensio, sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Koostumus annosta kohti (2 ml): Vaikuttavat aineet: E. colin F4ab-fimbrian adhesiini 65 % ER
1. ELÄINLÄÄKKEEN NIMI SUISENG vet. Injektioneste, suspensio, sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Koostumus annosta kohti (2 ml): Vaikuttavat aineet: E. colin F4ab-fimbrian adhesiini 65 % ER
1. ELÄINLÄÄKKEEN NIMI. PARVOERYSIN vet injektioneste, emulsio sialle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. Yksi 2 ml:n annos sisältää:
 1. ELÄINLÄÄKKEEN NIMI PARVOERYSIN vet injektioneste, emulsio sialle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 2 ml:n annos sisältää: Vaikuttavat aineet: Parvovirus suis inaktivoitu (kanta S-27) Vähintään
1. ELÄINLÄÄKKEEN NIMI PARVOERYSIN vet injektioneste, emulsio sialle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 2 ml:n annos sisältää: Vaikuttavat aineet: Parvovirus suis inaktivoitu (kanta S-27) Vähintään
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto
 EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
VALMISTEYHTEENVETO. Lääkkeellinen hengitysilma on tarkoitettu lapsille, aikuisille ja vanhuksille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI AIRAPY 100%, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Hengitysilma lääkintäkäyttöön 100 % 200 baarin paineessa (15 C). 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI AIRAPY 100%, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Hengitysilma lääkintäkäyttöön 100 % 200 baarin paineessa (15 C). 3. LÄÄKEMUOTO
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Proteq West Nile injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: West Nile rekombinantti
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Proteq West Nile injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi 1 ml:n annos sisältää: Vaikuttava aine: West Nile rekombinantti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Ketokonatsoli 20 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ketokonatsoli 20 mg/g Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Emulsiovoide Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ketokonatsoli 20 mg/g Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Emulsiovoide Valmisteen
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Incurin 1 mg tabletti 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: estrioli 1 mg/tabletti Täydellinen apuaineluettelo, katso kohta 6.1. 3.
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI Incurin 1 mg tabletti 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: estrioli 1 mg/tabletti Täydellinen apuaineluettelo, katso kohta 6.1. 3.
VALMISTEYHTEENVETO. Duramune DAPPi injektiokuiva-aine, kylmäkuivattu ja liuotin suspensiota varten
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Duramune DAPPi injektiokuiva-aine, kylmäkuivattu ja liuotin suspensiota varten 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 annos (1 ml) sisältää: Vaikuttavat aineet:
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Duramune DAPPi injektiokuiva-aine, kylmäkuivattu ja liuotin suspensiota varten 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 annos (1 ml) sisältää: Vaikuttavat aineet:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml injektionestettä sisältää natriumkloridia Elektrolyyttipitoisuudet
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml injektionestettä sisältää natriumkloridia Elektrolyyttipitoisuudet
VALMISTEYHTEENVETO. Valmistetta ei saa antaa kanille, marsulle, hamsterille, gerbiilille eikä muille pienille jyrsijöille.
 1. ELÄINLÄÄKKEEN NIMI Amovet vet 150 mg/ml injektioneste, suspensio VALMISTEYHTEENVETO 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Amoksisilliinitrihydraatti (172,1 mg) vastaten
1. ELÄINLÄÄKKEEN NIMI Amovet vet 150 mg/ml injektioneste, suspensio VALMISTEYHTEENVETO 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml sisältää: Vaikuttava aine: Amoksisilliinitrihydraatti (172,1 mg) vastaten
Silmäinfektiot kuten keratiitti, konjunktiviitti, meibomiitti, blefariitti ym., jotka johtuvat fusidiinille herkistä bakteereista.
 1. LÄÄKEVALMISTEEN NIMI Fucithalmic 10 mg/g silmätipat 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma silmätippoja sisältää 10 mg fusidiinihappoa. Apuaine, jonka vaikutus tunnetaan: bentsalkoniumkloridi
1. LÄÄKEVALMISTEEN NIMI Fucithalmic 10 mg/g silmätipat 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma silmätippoja sisältää 10 mg fusidiinihappoa. Apuaine, jonka vaikutus tunnetaan: bentsalkoniumkloridi
1. ELÄINLÄÄKKEEN NIMI. Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
VALMISTEYHTEENVETO. Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu). 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 0,5
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu). 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 0,5
VALMISTEYHTEENVETO. Pediatriset potilaat Viscotears-silmägeelin turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Viscotears silmägeeli kerta-annospakkauksessa 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 2 mg karbomeeriä. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Viscotears silmägeeli kerta-annospakkauksessa 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 2 mg karbomeeriä. Täydellinen apuaineluettelo,
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI TachoSil-lääketyyny 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttavat aineet ja niiden määrät: Yksi neliösenttimetri TachoSil-valmistetta sisältää
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI TachoSil-lääketyyny 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttavat aineet ja niiden määrät: Yksi neliösenttimetri TachoSil-valmistetta sisältää
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
Annosta tulee muuttaa eläimillä, joilla on munuaisten tai maksan vajaatoiminta, koska haittavaikutusriski on suurentunut.
 1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
Farmakoterapeuttinen ryhmä: steroideihin kuulumaton anti-inflammatorinen lääkeaine, ATCvet-koodi QM01AE90
 VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Quadrisol 100 mg/ml oraaligeeli hevosille 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Quadrisol oraaligeeliä sisältää Vaikuttava(t) aine(et) Vedaprofeeni 100
VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Quadrisol 100 mg/ml oraaligeeli hevosille 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Quadrisol oraaligeeliä sisältää Vaikuttava(t) aine(et) Vedaprofeeni 100
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent Banana 0,25 mg F -imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent Banana 0,25 mg F -imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
Hoidon hyötyihin liittyvät asiat, joita ei tunneta (yksi lyhyt kappale kustakin käyttöaiheesta, enintään 50 sanaa)
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1/19 1. ELÄINLÄÄKKEEN NIMI Eurican Herpes 205 injektiokuiva-aine ja liuotin, emulsiota varten 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: 1 ml annos: koirien herpesvirus
LIITE I VALMISTEYHTEENVETO 1/19 1. ELÄINLÄÄKKEEN NIMI Eurican Herpes 205 injektiokuiva-aine ja liuotin, emulsiota varten 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: 1 ml annos: koirien herpesvirus
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
Yliherkkyys vaikuttavalle aineelle tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fusidic Acid Orifarm 20 mg/g, emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää fusidiinihappoa hemihydraattina, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fusidic Acid Orifarm 20 mg/g, emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää fusidiinihappoa hemihydraattina, joka vastaa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI EVICEL liuokset kudosliimaa varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttavat aineet: Komponentti 1 Ihmisen koaguloituva proteiini, sisältää
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI EVICEL liuokset kudosliimaa varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttavat aineet: Komponentti 1 Ihmisen koaguloituva proteiini, sisältää
VALMISTEYHTEENVETO. Tämä lääkevalmiste on tarkoitettu ainoastaan diagnostiseen käyttöön.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Indium ( 111 In) chloride kantaliuos radioaktiivista lääkettä varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yhden millilitran koostumus referenssiajankohtana:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Indium ( 111 In) chloride kantaliuos radioaktiivista lääkettä varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yhden millilitran koostumus referenssiajankohtana:
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI. Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Revertor vet 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 ml injektionestettä sisältää: Vaikuttava aine: Atipametsolihydrokloridi
Pakkausseloste: Tietoa käyttäjälle. Lomustine medac 40 mg kapselit, kova
 Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI ReproCyc ParvoFLEX injektioneste, suspensio sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (2 ml) sisältää: Vaikuttava aine: Sian parvovirus,
LIITE I VALMISTEYHTEENVETO 1 1. ELÄINLÄÄKKEEN NIMI ReproCyc ParvoFLEX injektioneste, suspensio sioille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi annos (2 ml) sisältää: Vaikuttava aine: Sian parvovirus,
VALMISTEYHTEENVETO. Hammaslääkärin tai lääkärin määräyksestä: Pre- ja postoperatiivinen desinfiointi suukirurgiassa ja parodontaalisessa kirurgiassa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
Histadin- valmisteen tehoa ja turvallisuutta ei ole osoitettu alle 2-vuotiailla lapsilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Equilis injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Annos (1 ml) sisältää: Vaikuttava(t) aine(et) Hevosen influenssaviruksien
LIITE I VALMISTEYHTEENVETO 1/16 1. ELÄINLÄÄKKEEN NIMI Equilis injektioneste, suspensio, hevoselle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Annos (1 ml) sisältää: Vaikuttava(t) aine(et) Hevosen influenssaviruksien
50 g/l ihmisen proteiinia, josta vähintään 96% on IgG:tä, ja joka sisältää vasta-aineita hepatiitti B - viruksen pinta-antigeeneille (HBs) 50 IU/ml.
 1. LÄÄKEVALMISTEEN NIMI Hepatect 50 IU/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ihmisen hepatiitti B -immunoglobuliini. 50 g/l ihmisen proteiinia, josta vähintään 96% on IgG:tä, ja
1. LÄÄKEVALMISTEEN NIMI Hepatect 50 IU/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ihmisen hepatiitti B -immunoglobuliini. 50 g/l ihmisen proteiinia, josta vähintään 96% on IgG:tä, ja
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Metronidatsoli 0,75 paino-%, 7,5 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO. Espumisan 100 mg/ml tipat, emulsio on tarkoitettu imeväisille, lapsille, nuorille ja aikuisille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 mg simetikonia. Apuaine, jonka vaikutus tunnetaan Sorbitoli (E420),
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 mg simetikonia. Apuaine, jonka vaikutus tunnetaan Sorbitoli (E420),
VALMISTEYHTEENVETO. Albuman 200 g/l on liuos, joka sisältää 200 g/l (20 %) kokonaisproteiinia. Tästä vähintään 95 % on ihmisen albumiinia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Albuman 200 g/l infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Albuman 200 g/l on liuos, joka sisältää 200 g/l (20 %) kokonaisproteiinia. Tästä vähintään
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Albuman 200 g/l infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Albuman 200 g/l on liuos, joka sisältää 200 g/l (20 %) kokonaisproteiinia. Tästä vähintään
VALMISTEYHTEENVETO. Lievän tai kohtalaisen vaikean polven nivelrikon oireiden lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Albumin Baxter 200 g/l infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Albumin Baxter 200 g/l infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Albumin Baxter 200 g/l on liuos, jossa on kaikkiaan 200 g/l proteiinia, josta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Albumin Baxter 200 g/l infuusioneste, liuos. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Albumin Baxter 200 g/l on liuos, jossa on kaikkiaan 200 g/l proteiinia, josta
4.1 Käyttöaihe Akuutteihin tai kroonisiin keuhko- ja keuhkoputkisairauksiin liittyvän limaa erittävän yskän limaa irrottava hoito.
 V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Wartec 5 mg/ml liuos penslaukseen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra liuosta sisältää 5 mg podofyllotoksiinia. Täydellinen apuaineluettelo,
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Wartec 5 mg/ml liuos penslaukseen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra liuosta sisältää 5 mg podofyllotoksiinia. Täydellinen apuaineluettelo,
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: etanoli 100 mg/ml. Valmisteen kuvaus: miedosti tuoksuva, väritön tai hieman kellertävä liuos
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Mucovin 0,8 mg/ml -oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bromiheksiinihydrokloridi, 0,8 mg/ml Apuaineet, joiden vaikutus tunnetaan: etanoli 100 mg/ml
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Mucovin 0,8 mg/ml -oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bromiheksiinihydrokloridi, 0,8 mg/ml Apuaineet, joiden vaikutus tunnetaan: etanoli 100 mg/ml
VALMISTEYHTEENVETO. Herpes simplex -viruksen aiheuttamien ihon tai limakalvojen infektioiden paikallishoitoon, esim. herpes labialis.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zovirax 5 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää asikloviiria 50 mg. Apuaineet, joiden vaikutus tunnetaan: 1
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zovirax 5 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää asikloviiria 50 mg. Apuaineet, joiden vaikutus tunnetaan: 1
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
