LIITE I LISTA LÄÄKKEEN NIMISTÄ, ANNOSMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVANHALTIJOISTA, PAKKAUKSISTA JA PAKKAUSKOISTA JÄSENVALTIOISSA
|
|
|
- Maija Lotta Auvinen
- 10 vuotta sitten
- Katselukertoja:
Transkriptio
1 LIITE I LISTA LÄÄKKEEN NIMISTÄ, ANNOSMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVANHALTIJOISTA, PAKKAUKSISTA JA PAKKAUSKOISTA JÄSENVALTIOISSA 1
2 Jäsenvaltio Myyntiluvanhaltija Käytetty nimi Vahvuus Annosmuoto Annostusreitti Pakkaus Itävalta Roche Austria GmbH, Engelhorngasse 3, 1211 ROACCUTANE «Roche» Wien ROACCUTANE «Roche» 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Belgia N.V. Roche S.A. Rue Dantestraat 75, B-1070 Brussels Belgia Roaccutane 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roaccutane 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Tanska Hoffmann-La Roche & Co Basel, Sveitsi Roaccutan 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roaccutan 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Suomi Roche Oy Sinimäentie 10 A FIN Espoo/Esbo, Suomi Roaccutan 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roaccutan 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Ranska Roche 52, boulevard du Parc Neuilly-sur-Seine Cedex, Ranska Roaccutane 5 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roaccutane 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roaccutane 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Saksa Hoffmann-La Roche AG, Emil-Barell-Straße 1, Grenzach-Wyhlen Roaccutan 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Pakkauskoko 30, , , 60 30, 60 30, 50, , 50, , 60 30, 60 30,
3 Kreikka Roche Hellas S.A., Αλαµάνας 4 & ελφών, GR Μαρούσι, Roaccutan 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus ROACCUTAN 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Αττική, Kreikka ROACCUTAN 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Irlanti Roche Products Limited P.O. Box 8 Welwyn Garden City Hertfordshire AL7 3AY, Yhdistynyt kuningaskunta Roaccutane 5 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Ruskea lasipullo Roaccutane 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Ruskea lasipullo Italia ROCHE S.p.A. Piazza Durante Milano, Italia ROACCUTAN 2.5 mg Pehmeät kapselit Suun kautta Läpipainopakkaus ROACCUTAN 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus ROACCUTAN 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Luxemburg N.V. Roche S.A. Rue Dantestraat 75, B-1070 Bryssel Roaccutane 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Belgia Roaccutane 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Portugali Roche Farmacêutica Química, Lda. Estrada Nacional 249-1, Amadora, Portugali Roaccutan 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus , , , 60 30, 60 20, 50 3
4 Espanja Roche Farma S.A., c/ Josefa Valcárcel, nº 42, Roaccutan 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roacutan 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Madrid, Espanja Roacutan 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Alankomaat Roche Nederland B.V., Nijverheidsweg 38, 3641 Roaccutane 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus RR Mijdrecht, Alankomaat Roaccutane 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Yhdistynyt kuningaskunta Roche Products Limited 40 Broadwater Road Welwyn Garden City Hertfordshire AL7 3AY, Yhdistynyt kuningaskunta Roaccutane 5 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Ruskea lasipullo Roaccutane 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Ruskea lasipullo 20, , ,
5 Jäsenvaltio Myyntiluvanhaltija Käytetty nimi Vahvuus Annosmuoto Annostusreitti Pakkaus Islanti F. Hoffmann La-Roche Ltd. Postfach CH-4002 Basel Roaccutan 10 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Roaccutan 20 mg Pehmeät kapselit Suun kautta Läpipainopakkaus Pakkauskoko
6 LIITE II EMEA:N ESITTÄMÄT TIETEELLISET JOHTOPÄÄTÖKSET JA VALMISTEYHTEENVEDON MUUTTAMISEN PERUSTEET 6
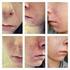
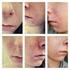
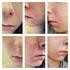
7 TIETEELLISET JOHTOPÄÄTÖKSET YHTEENVETO ROACCUTANEN JA LIITÄNNÄISNIMIEN TIETEELLISESTÄ ARVIOINNISTA (ks. liite I) Isotretinoiini (13-cis-retinoiinihappo), Roaccutanen vaikuttava aine, on retinoidiyhdiste ja A- vitamiinin johdannainen. Roaccutane-kapselit ovat suun kautta annettavaa isotretinoiinia, jota käytetään aknen systeemiseen hoitoon. Kaikkien retinoidien tavoin isotretinoiini on teratogeeni ja vasta-aiheinen raskauden aikana parantumattomien vaurioiden ehkäisemiseksi. Roaccutane hyväksyttiin EU:n jäsenvaltioissa (paitsi Ruotsissa ja [Norjassa], joissa tuotetta saa myydä erikoisluvalla) vuonna artiklan Roaccutanea koskeva viittaus perustuu siihen tosiseikkaan, että Roaccutanen valmisteyhteenvedoissa esiintyy eroavuuksia eri jäsenvaltioissa erilaisten kansallisten päätösten takia. Tärkeimmät harmonisoitavat kohdat olivat Käyttöaiheet, Annostus ja antotapa, Vasta-aiheet, Varoitukset ja käyttöä koskevat varotoimet ja Haittavaikutukset. Kongenitaalisten vaurioiden suuren riskin takia myyntiluvan haltija ehdotti harmonisoitua riskienhallintaohjelmaa sen varmistamiseksi, että hedelmälliset naiset eivät ole raskaana, kun he aloittavat Roaccutane-hoidon, eivätkä tule raskaaksi Roaccutane-hoidon aikana tai vähintään kuukauden kuluttua sen päättymisestä. Laatua koskevat kysymykset Merkittäviä laatuun liittyviä kysymyksiä ei todettu. Valmisteyhteenvedon farmaseuttiset tiedot harmonisoitiin lukuun ottamatta kohtia, jotka on lisättävä jäsenvaltioissa kansallisesti harmonisoidun valmisteyhteenvedon toteuttamisen yhteydessä. Myyntiluvan haltijaa pyydettiin kommentoimaan eri vahvuuksia ja saatavilla olevia pakkauskokoja riskinhallintaohjelman kannalta. Vahvuuksia ja EU:ssa saatavilla olevia pakkauskokoja koskeva tuleva päätös riippuu suoraan lopullisesti sovitusta riskinhallintaohjelmasta. Tämä voi tapahtua toisessa vaiheessa tämänhetkisen harmonisointivaiheen jälkeen. Tehokkuutta koskevat kysymykset Tuotteen tehokkuus on vahvistettu, mutta hoidettava populaatio kyseenalaistettiin. CPMP pani merkille, että käyttö ensisijaisena vakavan aknen hoitomuotona ei perustu muodollisiin kliinisiin tutkimuksiin vaan julkaistuun kliiniseen mielipiteeseen. Koska CPMP katsoi, että käyttöaiheiden yhteydessä olisi ilmaistava isotretinoiinin riski-hyötysuhde hoidettavassa populaatiossa isotretinoiiniin liittyvä teratogeeninen riski ja muut vakavat haittavaikutukset huomioiden, se ehdotti käyttöaiheita koskevaksi tekstiksi seuraavaa: Vaikea akne (esimerkiksi nodulokystinen akne, acne conglobata tai akne, johon liittyy pysyvien arpien vaara) silloin, kun standardihoito systeemisillä bakteerilääkkeillä ja paikallinen hoito ei tehoa. Aikuisilla isotretinoiinihoito on aloitettava 0,5 mg:n/kg päiväannoksella. Isotretinoiinin hoitovaste ja jotkut haittavaikutukset riippuvat annoksesta ja vaihtelevat eri potilailla. Siksi annostus on sovitettava yksilöllisesti hoidon aikana. Useimmilla potilailla annos on 0,5 1,0 mg/kg päivässä. Pitkän aikavälin paraneminen ja sairauden uusiminen liittyvät läheisemmin kokonaisannokseen kuin hoidon kestoon tai päiväannokseen. On osoitettu, ettei lisähyötyä ole odotettavissa, jos kokonaisannos on mg/kg. Hoidon kesto riippuu yksilöllisestä päiväannoksesta viikon hoitojakso riittää yleensä paranemisen saavuttamiseksi. Turvallisuutta koskevat kysymykset Tärkein turvallisuutta koskeva kysymys oli määritellä myyntiluvan haltijan harmonisoitua raskaudenehkäisyohjelmaa koskevan ehdotuksen perusteella valmisteyhteenvedon suositukset sen 7
8 varmistamiseksi, etteivät hedelmälliset naiset ole raskaana aloittaessaan isotretinoiinihoidon eivätkä tule raskaaksi isotretinoiinihoidon aikana tai alle kuukauden kuluttua sen päättymisestä. Tässä suhteessa CPMP esitti seuraavaa: - Isotretinoiinia (suun kautta annettavaa) tulee määrätä hedelmällisille naisille ainoastaan myyntiluvan haltijan raskaudenehkäisyohjelmaan kuuluvia tarkkoja raskaudenehkäisytoimenpiteitä käytettäessä. Tämä koskee myös sellaisia naisia, jotka eivät ole parhaillaan seksuaalisesti aktiivisia, paitsi jos määrääjän mielestä pakottavat syyt osoittavat, ettei raskauden vaaraa ole. - Isotretinoiini on vasta-aiheinen hedelmällisillä naisilla, paitsi jos kaikki seuraavat edellytykset täyttyvät: Naisella on vaikea akne (esimerkiksi nodulokystinen akne, acne conglobata tai akne, johon liittyy pysyvien arpien vaara), johon standardihoito systeemisillä bakteerilääkkeillä ja paikallinen hoito ei tehoa. Hän ymmärtää teratogeenisen riskin. Hän ymmärtää tarkan, kuukausittaisen seurannan tarpeen. Hän ymmärtää ja hyväksyy tarvitsevansa luotettavaa raskaudenehkäisyä keskeytyksettä 1 kuukauden ajan ennen hoidon aloittamista, koko hoidon ajan ja 1 kuukauden ajan hoidon päättymisen jälkeen. On käytettävä vähintään yhtä ja mielellään kahta toisiaan täydentävää ehkäisymenetelmää estemenetelmä mukaan luettuna. Vaikka naisella olisi amenorrea, hänen on noudatettava kaikkia ehkäisyyn liittyviä ohjeita. Hänen on pystyttävä noudattamaan luotettavaa ehkäisyä. Hänelle on tiedotettu ja hän on selvillä raskauden mahdollisista seurauksista ja nopean yhteydenoton välttämättömyydestä, jos raskauden riski on olemassa. Hän ymmärtää ja hyväksyy sen, että raskaustesti on suoritettava ennen hoitoa, hoidon aikana ja 5 viikon kuluttua hoidon päättymisestä. Hän on ilmoittanut ymmärtävänsä isotretinoiinin käyttöön liittyvät vaarat ja välttämättömät varotoimet. - Isotretinoiinia saa määrätä vain vaikean aknen hoitoon tarkoitettujen systeemisten retinoidien käyttöön perehtynyt ja isotretinoiinihoidon vaarat ja valvonnan välttämättömyyden ymmärtävä lääkäri tai tällaisen lääkärin valvonnassa oleva henkilö. - Kaikille potilaille, niin miehille kuin naisillekin, on annettava täydellinen potilastiedote, jossa kerrotaan teratogeenisestä riskistä ja tarkoista raskaudenehkäisytoimenpiteistä. - Auttaakseen isotretinoiinin määrääjiä, farmaseutteja ja potilaita välttämään sikiön altistuminen isotretinoiinille myyntiluvan haltija toimittaa koulutusmateriaalia, joka tukee isotretinoiinin teratogeenisuutta koskevia varoituksia, antaa ohjeita ehkäisystä ennen hoidon aloittamista ja antaa tietoja raskaustestin välttämättömyydestä. - Ehkäisyn, raskaustestin ja käyntien suhteen on noudatettava valmisteyhteenvedossa kuvattuja suosituksia. - Hedelmällisille naisille isotretinoiinia tulisi määrätä korkeintaan 30 päiväksi, ja hoidon jatkaminen edellyttää uutta määräystä. Raskaustestin suorittamisen, määräyksen annon ja isotretinoiinin toimittamisen olisi tapahduttava samana päivänä. Isotretinoiini tulisi toimittaa 7 päivän kuluessa määräyksestä. - Potilaita on kiellettävä antamasta tätä lääkevalmistetta toisille ja neuvottava palauttamaan käytetyt kapselit apteekkiin hoidon päätyttyä. - Potilaat eivät saa luovuttaa verta hoidon aikana tai alle 1 kuukauden kuluttua isotretinoiinin käytön lopettamisesta raskaana olevan verensiirron vastaanottajan sikiöön kohdistuvan mahdollisen riskin takia. 8
9 - Myyntiluvan haltijan on vakuutettava, ettei se jaa tuotteista ilmaisia näytteitä. Koska CPMP katsoi, että raskaudenehkäisyohjelman yleiset periaatteet on kuvailtava valmisteyhteenvedossa, mutta että sen yksityiskohdat on sovitettava paikallisiin säädöksiin, se vaati, että myyntiluvan haltija sopii raskaudenehkäisyohjelman yksityiskohdista toimivaltaisten kansallisten viranomaisten kanssa ja panee tällaisen ohjelman täytäntöön kansallisesti. Tämä vaatimus määritellään tarkemmin liitteessä Myyntiluvan ehdot. Lisäksi myyntiluvan haltijan on toimitettava vuosittain PSUR-turvallisuusraportit. Myyntiluvan haltijan on toimitettava CPMP:lle, viitejäsenvaltiolle ja osallistuville jäsenvaltioille raskauksia koskeva katsaus, joka sisältää raportin raskaudenehkäisyohjelmasta ja arvioinnin raskaudenaikaisista altistuksista ja tuloksista, 6 kuukauden välein ensimmäisten kahden vuoden ajan Euroopan komission päätöksen hyväksymisestä ja tämän jälkeen vuoden välein. Raportin on sisällettävä tietoja toteutetuista toimenpiteistä, joiden tarkoituksena on varmistaa ja arvioida raskaudenehkäisyohjelman tehokkuus. CPMP vaati lisäksi seuraavaa: - Yritys toimittaa CPMP:lle kahden kuukauden kuluessa CPMP:n lausunnosta seurantatoimenpiteenä katsauksen, joka sisältää ehdotuksia varoituksia ja haittavaikutuksia koskevien kohtien päivittämisestä psykiatrisia häiriöitä koskevilla tiedoilla. - PSUR-turvallisuusraporttia arvioidessaan viitejäsenvaltion on tarkasteltava seuraavia haittavaikutuksia: näköhäiriöt, punoitus, mustelmat, kuukautishäiriöt, palpitaatio ja takykardia sekä mahdolliset oireet yhteisvaikutuksesta karbamatsepiinin kanssa. Valmisteyhteenvedon kohdat 4 ja 5 harmonisoitiin kokonaisuudessaan käsittelyssä. Hyöty/riskinäkökohdat Myyntiluvan haltijan toimittaman dokumentaation, joka sisälsi ehdotuksen raskaudenehkäisyohjelman täytäntöönpanosta, ja komiteassa käydyn tieteellisen keskustelun perusteella CPMP katsoi, että Roaccutanen (ja liitännäisnimien) hyöty-riskisuhde on suotuisa sovituissa käyttöaiheissa. VALMISTEYHTEENVEDON MUUTTAMISEN PERUSTEET Sen johdosta, että - pyyntö koski valmisteyhteenvedon harmonisointia - myyntiluvan haltijoiden ehdottamat valmisteyhteenvedot on arvioitu toimitetun dokumentaation, joka sisälsi ehdotuksen raskaudenehkäisyohjelmaksi, ja komitean tieteellisen keskustelun pohjalta CPMP suositteli Roaccutanen ja liitenimien (ks. liite I), joiden valmisteyhteenvedot ovat liitteessä III, myyntilupien muuttamista. 9
10 LIITE III VALMISTEYHTEENVETO 10
11 1. LÄÄKEVALMISTEEN NIMI <Roaccutan ja vastaavat kauppanimet> <2.5 mg><5 mg><10 mg><20 mg> pehmeät kapselit (Katso liite I täytetään kansallisesti) 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen pehmeä kapseli sisältää <2.5 mg><5 mg><10 mg><20 mg>isotretinoiinia (Katso liite I täytetään kansallisesti) Apuaineet, ks LÄÄKEMUOTO Kapselit, pehmeät. 4. KLIINISET TIEDOT 4.1 Käyttöaiheet Vaikea, aikaisempaan asianmukaiseen systeemiseen antibioottihoitoon ja paikalliseen hoitoon reagoimaton akne, kuten nodulaarinen akne, acne conglobata tai akne, johon liittyy pysyvän arpeutumisen vaara. 4.2 Annostus ja antotapa Isotretinoiinia voivat määrätä ainoastaan erikoislääkärit tai heidän valvonnassaan toimivat lääkärit, joilla on kokemusta systeemisten retinoidien käytöstä vaikean aknen hoidossa. Lääkärin pitää ymmärtää isotretinoiinihoidon riskit ja tuntea hoidon seurantavaatimukset. Kapselit otetaan ruokailun yhteydessä kerran tai kaksi kertaa vuorokaudessa. Aikuiset, mukaan lukien nuoret ja vanhukset: Isotretinoiinihoito aloitetaan annoksella 0,5 mg/kg/vrk. Vaste isotretinoiinihoidolle ja joidenkin haittavaikutusten ilmeneminen ovat annosriippuvaisia ja vaihtelevat potilaskohtaisesti. Tämän vuoksi annoksen säätäminen yksilöllisesti on välttämätöntä hoidon aikana. Suurimmalle osalle potilaista sopiva vuorokausiannos on 0,5-1,0 mg/kg. Taudin oireiden pitkäaikaisen lievenemisen ja taudin uusiutumisen on todettu olevan riippuvaisia pikemmin kokonaisannoksesta kuin pelkästään hoidon kestosta tai päivittäisestä annoksesta. On osoitettu, ettei mg/kg kumulatiivisen annoksen ylittävistä annoksista ole todellista lisähyötyä. Hoidon kesto määräytyy päivittäisen annoksen mukaan viikon hoito on normaalisti riittävä oireiden lievittymiseksi. Suurimmalle osalle potilaista yksi hoitokerta riittää aknen parantamiseen. Jos akne selvästi uusiutuu, voidaan harkita hoidon uusimista samalla päivittäisellä annoksella ja samalla kumulatiivisella kokonaisannoksella. Aknen paraneminen jatkuu usein jopa kahdeksan viikon ajan hoidon lopettamisen jälkeen, eikä hoidon uusimista tulisi harkita ennen tämän ajanjakson päättymistä. Potilaat, joilla on vaikea munuaisten vajaatoiminta Vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoito tulisi aloittaa suositeltua annosta alhaisemmalla annoksella (esimerkiksi 10 mg/vrk). Annosta nostetaan myöhemmin korkeintaan 11
12 annokseen 1 mg/kg/vrk tai kunnes suurin potilaan sietämä annos on saavutettu (ks. 4.4 Varoitukset ja käyttöön liittyvät varotoimet ). Lapset Isotretinoiinia ei ole tarkoitettu ennen puberteetti-ikää ilmenevän aknen hoitoon, eikä sitä suositella alle 12-vuotiaille potilaille. Potilaat, jotka eivät siedä suositeltua annosta Potilaille, jotka eivät siedä suositeltua annosta, lääkitystä voidaan jatkaa pienemmällä annoksella, jolloin hoidon keston on oltava pidempi. Tällöin taudin uusiutumisen riski kasvaa. Lääkehoidon enimmäistehon saavuttamiseksi hoitoa pitäisi tavallisesti jatkaa suurimmalla siedetyllä annoksella. 4.3 Vasta-aiheet Isotretinoiini on vasta-aiheinen naisilla, jotka ovat raskaana tai imettävät (ks. 4.6 Raskaus ja imetys ). Isotretinoiini on vasta-aiheinen myös hedelmällisessä iässä olevilla naisilla, elleivät kaikki Raskaudenehkäisyohjelmassa mainitut edellytykset täyty (ks. 4.4 Varoitukset ja käyttöön liittyvät varotoimet ). Isotretinoiini on lisäksi vasta-aiheinen potilailla, joilla on maksan vajaatoiminta huomattavasti kohonneet veren lipidiarvot A-vitamiinimyrkytys yliherkkyys isotretinoiinille tai jollekin valmisteen apuaineelle samanaikainen tetrasykliinilääkitys (ks. 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset ). 4.4 Varoitukset ja käyttöön liittyvät varotoimet Raskaudenehkäisyohjelma Tämä lääkevalmiste on TERATOGEENINEN. Isotretinoiini on vasta-aiheinen hedelmällisessä iässä olevilla naisilla, elleivät kaikki seuraavat Raskaudenehkäisyohjelman ehdot täyty: Hänellä on vaikea, aikaisempaan asianmukaiseen systeemiseen antibioottihoitoon ja paikalliseen hoitoon reagoimaton akne, kuten nodulaarinen akne, acne conglobata tai akne, johon liittyy pysyvän arpeutumisen vaara (ks. 4.1 Käyttöaiheet ). Hän ymmärtää teratogeenisuusriskin merkityksen. Hän ymmärtää kuukausittain tapahtuvan tarkan hoidon seurannan merkityksen. Hän ymmärtää raskauden ehkäisyn merkityksen ja hyväksyy luotettavan keskeytymättömän ehkäisymenetelmän käytön, joka aloitetaan kuukautta ennen lääkityksen alkua ja jota jatketaan koko lääkityksen ajan sekä kuukauden ajan lääkityksen lopettamisen jälkeen. Hoidon aikana on käytettävä ainakin yhtä, mieluummin kahta toisiaan täydentävää ehkäisymenetelmää. Yhtenä ehkäisymenetelmänä on aina käytettävä kondomia tai muuta estemenetelmää. Vaikka hänellä ei olisi kuukautisia, hänen täytyy noudattaa kaikkia luotettavasta raskauden ehkäisystä annettuja neuvoja. Hänen on kyettävä noudattamaan luotettavaa raskauden ehkäisyä. Häntä on informoitu ja hän ymmärtää raskauden mahdolliset seuraukset sekä tarpeen hakeutua välittömästi lääkärin vastaanotolle raskauden ollessa mahdollinen. Hän ymmärtää raskaustestien merkityksen ja hyväksyy, että testit tehdään ennen hoidon aloittamista, hoidon aikana ja viiden viikon kuluttua hoidon loppumisesta. Hän vahvistaa ymmärtäneensä isotretinoiinihoitoon liittyvät riskit ja varoitukset. 12
13 Nämä ehdot koskevat lääkkeen määräämistä myös naisille, jotka eivät sillä hetkellä ole seksuaalisesti aktiivisia, ellei lääkäri erikseen arvioi, että raskaaksi tulemisen riskiä ei ole olemassa. Lääkärin on varmistettava, että: Potilas täyttää raskauden ehkäisyn vaatimukset, jotka on listattu edellä. Tähän on sisällytettävä varmistus siitä, että hänellä on riittävä ymmärrys käsiteltävistä asioista. Potilas osoittaa hyväksyvänsä edellä mainitut vaatimukset. Potilas on käyttänyt ainakin yhtä, mieluummin kahta toisiaan täydentävää ehkäisymenetelmää vähintään kuukauden ajan ennen lääkityksen alkua, koko hoidon ajan ja vähintään kuukauden ajan hoidon lopettamisen jälkeen. Kondomia tai muuta estemenetelmää on aina käytettävä. Raskaustesteillä on saatu negatiiviset tulokset ennen hoitoa, hoidon aikana ja viisi viikkoa hoidon lopettamisen jälkeen. Seurantatestien päivämäärät ja tulokset on dokumentoitava. Ehkäisy Naispotilaille on tarjottava perustietoa raskauden ehkäisystä ja heidät on ohjattava ehkäisyneuvontaan, jos he eivät ole aikaisemmin käyttäneet tehokasta ehkäisymenetelmää. Hoidon aikana on käytettävä ainakin yhtä, mieluummin kahta toisiaan täydentävää ehkäisymenetelmää. Kondomia tai muuta estemenetelmää on aina käytettävä. Ehkäisymenetelmän käyttöä on jatkettava vähintään kuukauden ajan hoidon lopettamisen jälkeen, vaikka potilaalla ei olisikaan kuukautisia. Raskaustestin tekeminen Herkkyydeltään vähintään 25 miu/ml olevat raskaustestit on suositeltu suoritettavan kuukautiskierron kolmen ensimmäisen päivän aikana. Raskaustestit suoritetaan terveydenhuoltohenkilöstön valvonnassa paikallisen käytännön mukaisesti seuraavaa ohjeistusta noudattaen. Ennen hoidon aloittamista: On suositeltavaa, että ensimmäinen terveydenhuoltohenkilöstön valvoma raskaustesti suoritetaan ennen luotettavan ehkäisyn aloittamista. Tällä suljetaan pois raskauden mahdollisuus ehkäisyä aloitettaessa. Raskaustestin päivämäärä sekä testin tulos dokumentoidaan. Potilailla, joilla ei ole säännöllisiä kuukautisia, raskaustestin ajoitus on riippuvainen potilaan seksuaalisesta aktiivisuudesta, ja testi on tehtävä noin kolmen viikon kuluttua viimeisestä suojaamattomasta yhdynnästä. Lääkärin on neuvottava potilasta ehkäisyyn liittyvissä asioissa. Terveydenhuoltohenkilöstön valvoma raskaustesti on suoritettava myös ensimmäisellä hoitokäynnillä, jolloin isotretinoiinia määrätään, tai kolmen päivän aikana ennen vastaanotolle tuloa. Testi suoritetaan silloin, kun potilas on käyttänyt vähintään kuukauden ajan luotettavaa ehkäisymenetelmää. Näin poissuljetaan raskauden mahdollisuus ennen isotretinoiinilääkityksen aloittamista. Seurantakäynnit Seurantakäynnit on järjestettävä 28 päivän välein. Säännöllisten, terveydenhuoltohenkilöstön valvomien raskaustestien tarve arvioidaan paikallisen käytännön mukaisesti potilaan seksuaalielämän ja hänen kuukautiskiertonsa (epäsäännölliset kuukautiset, taukoja kuukautisissa tai kuukautisten puuttuminen) perusteella. Jos seurantatestejä päätetään järjestää, ne pitäisi suorittaa vastaanottopäivänä tai kolmen päivän aikana ennen vastaanottoa. Hoidon lopettaminen Viimeinen raskaustesti on suoritettava viisi viikkoa hoidon lopettamisen jälkeen raskauden mahdollisuuden poissulkemiseksi. Lääkkeen määrääminen ja toimittamista koskevat rajoitukset Lääkkeen määrääminen hedelmällisessä iässä oleville naisille on rajoitettu 30 päivän lääkitykseen yhdellä reseptillä, ja hoidon jatkaminen vaatii uuden lääkemääräyksen. Ihanteellisessa tilanteessa raskaustestin tekeminen, lääkkeen määrääminen ja lääkkeen luovuttaminen apteekista tapahtuvat samana päivänä. Isotretinoiinin toimittamisen apteekista on tapahduttava seitsemän päivän kuluessa reseptin kirjoittamisesta. 13
14 Miespotilaat Ei ole olemassa viitteitä siitä, että isotretinoiinilääkityksellä olevien miespotilaiden hedelmällisyys heikkenisi tai lääkitys vaikuttaisi heidän jälkeläisiinsä. Miespotilaita on kuitenkin muistutettava siitä, että heidän ei pidä luovuttaa lääkkeitään kenellekään muulle henkilölle, erityisesti ei naisille. Lisävaroitukset Potilaita on neuvottava olemaan luovuttamatta tätä lääkettä toiselle henkilölle ja palauttamaan käyttämättömät kapselit apteekkiin hoidon loputtua. Potilaiden ei pidä luovuttaa verta isotretinoiinihoidon aikana eikä yhden kuukauden aikana hoidon lopettamisen jälkeen, koska verta voidaan antaa raskaana olevalle naiselle, mikä voi aiheuttaa vaaraa kehittyvälle sikiölle. Koulutusmateriaali Myyntiluvanhaltija tarjoaa koulutusmateriaalia isotretinoiinin teratogeenisuudesta lääkkeen määrääjille, apteekkihenkilöstölle ja potilaille varoitusten selventämiseksi ja sikiöaltistusten välttämiseksi. Materiaaleissa annetaan lisäksi ohjeita ehkäisystä ja siitä, milloin raskaustestien tekeminen on välttämätöntä. Lääkärin on annettava kaikille potilaille, sekä miehille että naisille, kaikki tieto teratogeenisuuden vaarasta ja Raskaudenehkäisyohjelmassa kerrottu potilasinformaatio tiukoista raskauden ehkäisymenetelmistä. Psykiatriset häiriöt Masennusta, psykoottisia oireita ja harvoin itsemurhayrityksiä ja itsemurhia on raportoitu isotretinoiinia saaneilla potilailla (ks. 4.8 Haittavaikutukset ). Sen tähden potilaita, joilla on aiemmin esiintynyt masennuksen oireita, on tarkkailtava erityisen huolellisesti, ja kaikki potilaat on ohjattava asianmukaiseen hoitoon, jos heillä ilmenee masennukseen viittaavia oireita. Isotretinoiinihoidon keskeytys ei välttämättä ole riittävä toimenpide oireiden helpottamiseksi, ja siksi psykiatriset tai psykologiset lisätutkimukset voivat olla tarpeen. Ihon ja ihonalaiskerrosten häiriöt Hoidon aloitusvaiheessa tapahtuu joskus akuuttia taudin pahenemista, joka laantuu hoidon jatkuessa yleensä 7-10 päivän kuluessa. Annoksen säätö ei yleensä ole tarpeen. Altistusta voimakkaalle auringonvalolle tai UV-säteilylle tulee välttää. Mahdollisen altistuksen yhteydessä on käytettävä vähintään suojakertoimella 15 varustettuja aurinkosuojatuotteita. Aggressiivista kemiallista dermabraasiota ja ihoon kohdistuvaa laserhoitoa on vältettävä isotretinoiinihoidon aikana ja 5-6 kuukauden aikana hoidon lopettamisen jälkeen, sillä toimenpide voi tällöin aiheuttaa hypertrofista arpeutumista epätyypillisillä alueilla ja harvemmin tulehduksen jälkeistä hyper- tai hypopigmentaatiota hoitoalueella. Karvojen poistoa vahalla isotretinoiinihoidon aikana tai kuuden kuukauden sisällä hoidon päättymisestä pitää välttää koska se voi aiheuttaa orvaskeden kuoriintumista. Isotretioniinin kanssa samanaikaista keratolyyttistä tai eksfoliatiivista aknen paikallishoitoa ei pidä käyttää, koska ihon paikallinen ärtyminen saattaa voimistua. Potilaita on neuvottava käyttämään kosteuttavaa voidetta tai emulsiovoidetta sekä huulivoidetta hoidon alusta alkaen, koska isotretinoiini voi aiheuttaa ihon ja huulien kuivumista. Silmäsairaudet Silmien kuivuminen, sarveiskalvon samentumat, hämäränäön heikentyminen ja sarveiskalvotulehdus ovat yleensä lääkityksen loputtua korjaantuvia haittavaikutuksia. Silmien kuivumista voi estää käyttämällä mietoa silmävoidetta tai silmää kostuttavia tippoja. Piilolinssit voivat hoidon aikana aiheuttaa silmä-ärsytystä, minkä vuoksi niiden asemesta on käytettävä silmälaseja. 14
15 Hämäränäön heikentyminen on joissain tapauksissa ilmaantunut nopeasti. (ks. 4.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn ). Jos näkökyvyssä todetaan heikkenemistä, potilas tulisi ohjata silmälääkärin tutkimuksiin. Isotretinoiinilääkityksen lopettaminen voi olla välttämätöntä. Tuki- ja liikuntaelimistön, sidekudosten ja luuston häiriöt Lihaskipuja, nivelkipuja ja kohonneita seerumin kreatiinifosfokinaasiarvoja on todettu isotretinoiinilääkityksellä olleilla potilailla, erityisesti niillä, jotka harrastavat pontevaa liikuntaa (ks. 4.8 Haittavaikutukset ). Luumuutoksia on havaittu useiden vuosien korkeiden annosten käytön jälkeen hoidettaessa keratinisaatiohäiriöitä. Luumuutoksiin ovat kuuluneet ennenaikainen epifyysilevyjen sulkeutuminen, luun liikakasvu ja jänteiden sekä nivelsiteiden kalkkiutuminen. Näissä tapauksissa annostasot, hoidon kesto ja kokonaisannos ovat yleensä ylittäneet selvästi aknen hoidossa suositellut rajat. Hyvänlaatuinen kallonsisäisen paineen nousu Joitakin hyvänlaatuisia kallonsisäisen paineen nousuja on todettu. Jotkut näistä tapauksista liittyvät tetrasykliinien samanaikaiseen käyttöön (ks. 4.3 Vasta-aiheet ja 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset ). Hyvänlaatuisen kallonsisäisen paineen nousun oireisiin sisältyvät päänsärky, pahoinvointi ja oksentelu, näkökyvyn häiriöt ja näköhermon nystyn turvotus. Kun hyvänlaatuinen kallonsisäisen paineen nousu havaitaan, isotretinoiinilääkitys on keskeytettävä välittömästi. Maksa- ja sappihäiriöt Maksaentsyymien arvot tulee tutkia ennen hoidon alkua, ensimmäisen hoitokuukauden jälkeen sekä hoidon aikana säännöllisesti kolmen kuukauden välein, ellei vieläkin tiheämpi seuranta ole kliinisesti tarpeellista. Lyhytaikaista ja korjaantuvaa maksan transaminaasiarvojen nousua on raportoitu. Useissa tapauksissa nämä muutokset ovat olleet normaalirajojen sisällä, ja pitoisuudet ovat palautuneet lähtötasolleen hoidon aikana. Jos transaminaasipitoisuudet kuitenkin kohoavat pysyvästi normaaliarvoista, on annoksen pienentämistä tai hoidon keskeyttämistä harkittava. Munuaisten vajaatoiminta Munuaisten vajaatoiminta ja munuaissairaus eivät vaikuta isotretinoiinin farmakokinetiikkaan. Isotretinoiinia voidaan antaa munuaisten vajaatoiminnasta kärsiville potilaille. On kuitenkin suositeltavaa aloittaa hoito pienellä annoksella ja titrata annos suurimpaan siedettyyn annokseen (ks. 4.2 Annostus ja antotapa ). Rasva-aineenvaihdunta Seerumin rasva-arvot (paastoarvot) tulee tutkia ennen hoidon alkua, ensimmäisen hoitokuukauden jälkeen sekä hoidon aikana säännöllisesti kolmen kuukauden välein, ellei tiheämpi seuranta ole kliinisesti aiheellista. Seerumin rasva-arvot palautuvat yleensä normaaleiksi annoksen pienentämisen myötä tai hoidon keskeyttämisen jälkeen. Seerumin rasva-arvot voivat korjaantua myös ruokavalioon liittyvien muutosten avulla. Isotretinoiinihoito on yhdistetty kohonneisiin plasman triglyseridiarvoihin. Isotretinoiinihoito on keskeytettävä, mikäli hypertriglyseridemiassa triglyseridien arvoja ei pystytä pitämään hyväksyttävällä tasolla tai pankreatiitin oireita esiintyy (ks. kohta 4.8 Haittavaikutukset ). Arvot, jotka ylittävät 800 mg/dl tai 9 mmol/l, on joskus yhdistetty akuuttiin pankreatiittiin, joka voi johtaa kuolemaan. Ruoansulatuskanavan häiriöt Isotretinoiini on yhdistetty tulehdukselliseen suolistosairauteen (mukaan lukien regionaalinen ileiitti) potilailla, joilla ei ole todettu aiempia suolistosairauksia. Vaikeaa (veristä) ripulia saavien potilaiden pitäisi lopettaa isotretinoiinihoito välittömästi. Allergiset reaktiot Anafylaktisia reaktioita on raportoitu harvoin. Joissain tapauksissa anafylaktisia reaktioita on ilmennyt silloin, kun potilas on altistunut aikaisemmin paikallisesti käytetyille retinoideille. Allergisia 15
16 ihoreaktioita on raportoitu harvoin. Vakavaa allergista vaskuliittia, johon on kuulunut purppuraa (mustelmia ja punaisia läikkiä) raajoissa ja vaskuliittia muuallakin kuin ihossa, on raportoitu. Vakavat allergiset reaktiot edellyttävät hoidon keskeyttämistä ja huolellista potilaan tilan seuraamista. Riskipotilaat Diabeetikoilla, lihavilla potilailla, alkoholisteilla tai potilailla, joilla on rasva-aineenvaihdunnan häiriöitä, saattaa seerumin rasva-arvojen ja/tai glukoosiarvojen tiheä mittaaminen olla tarpeellista. Suurentuneita veren paastosokeriarvoja on todettu ja uusia diabetestapauksia diagnosoitu isotretinoiinihoidon aikana. 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset Samanaikaista isotretinoiini- ja A-vitamiinihoitoa tulee välttää A-vitamiinimyrkytysriskin takia. Isotretinoiinin ja tetrasykliinien samanaikaisen hoidon aikana on raportoitu hyvänlaatuisia kallonsisäisen paineen nousuja (pseudotumor cerebri). Tetrasykliinien yhdistämistä isotretinoiinihoitoon on siksi vältettävä (ks. 4.3 Vasta-aiheet ja 4.4 Varoitukset ja käyttöön liittyvät varotoimet ). 4.6 Raskaus ja imetys Raskaus on ehdoton vasta-aihe isotretinoiinihoidolle (ks. 4.3 Vasta-aiheet). Mikäli raskaus alkaa varotoimista huolimatta isotretinoiinihoidon aikana tai kuukauden sisällä hoidon lopettamisesta, hyvin vaikeiden ja vakavien sikiön epämuodostumien vaara on suuri. Isotretinoiinialtistukseen liittyvät sikiön epämuodostumat voivat olla keskushermoston poikkeavuuksia (vesipää, aivojen epämuodostumia/poikkeavuutta, pienipäisyyttä), kasvojen epämuodostumia, suulakihalkio, ulkokorvan epämuodostumia (korvalehden puuttuminen, pienet tai puuttuvat korvakäytävät), silmän epämuodostumia (pienisilmäisyyttä), kardiovaskulaarisia epämuodostumia (sydämen keskirakenteen epämuodostumia, kuten Fallot n tetralogia, valtasuonten transpositio, väliseinien aukot), kateenkorvan ja lisäkilpirauhasen epämuodostumia. Keskenmenojen määrä on myös lisääntynyt. Jos raskaus todetaan naisella, joka on käyttänyt isotretinoiinia, hoito on lopetettava. Potilas on ohjattava teratogeenisuuteen perehtyneelle lääkärille tilanteen arvioimiseksi. Imetys: Isotretinoiini on erittäin rasvaliukoinen molekyyli, joten sen kulkeutuminen äidinmaitoon on hyvin todennäköistä. Mahdollisten äitiin tai sikiöön kohdistuvien haittavaikutusten takia isotretinoiinin käyttö on vasta-aiheista imettävillä äideillä. 4.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn Isotretinoiinihoidon aikana on havaittu tapauksia, joissa hämäränäkökyky on heikentynyt ja joissain harvoissa tapauksissa oire on jatkunut vielä hoidon lopettamisen jälkeen (ks. 4.4 Varoitukset ja käyttöön liittyvät varotoimet ja 4.8 Haittavaikutukset ). Koska haittavaikutus on ilmaantunut joillakin potilailla äkisti, olisi tästä kerrottava potilaille ja varoitettava heitä olemaan varuillaan ajaessaan autoa tai käyttäessään koneita. 4.8 Haittavaikutukset Seuraavat haittavaikutukset ovat isotretinoiinihoidon aikana raportoiduista haittavaikutuksista yleisimpiä: limakalvojen kuivuus kuten esimerkiksi huulten kuivuus, huulitulehdus, nenän limakalvon kuivuus, nenäverenvuoto, silmien kuivuus, konjunktiviitti ja ihon kuivuminen. Jotkin haittavaikutuksista ovat annoksesta riippuvaisia. Useimmat haittavaikutukset poistuvat hoidon lopettamisen jälkeen. Jotkin haittavaikutuksista saattavat kuitenkin jatkua vielä hoidon lopettamisen jälkeen. 16
17 Infektiot: Erittäin harvinainen ( 1/10 000) Gram-positiivinen (ihon tai limakalvojen) bakteeri-infektio Veren ja imunestejärjestelmän häiriöt: Erittäin yleinen ( 1/10) Yleinen ( 1/100, < 1/10) Anemia, kohonnut La, trombosytopenia, trombosytoosi Neutropenia Erittäin harvinainen ( 1/10 000) Imusolmuketurvotus Immuunijärjestelmän häiriöt: Harvinainen ( 1/10 000, < 1/1000) Allergiset ihoreaktiot, anafylaktiset reaktiot, yliherkkyys Aineenvaihdunta- ja ravitsemushäiriöt: Erittäin harvinainen ( 1/10 000) Diabetes, hyperurikemia (veren virtsahapon runsaus) Psykiatriset häiriöt: Harvinainen ( 1/10 000, < 1/1000) Masennus Erittäin harvinainen ( 1/10 000) Epänormaali käyttäytyminen, psykoottiset oireet, itsemurhayritys, itsemurha Hermojärjestelmän häiriöt: Yleinen ( 1/100, < 1/10) Päänsärky Erittäin harvinainen ( 1/10 000) Hyvänlaatuinen kallonsisäisen paineen nousu, kouristukset, uneliaisuus Silmäsairaudet: Erittäin yleinen ( 1/10) Silmäluomien tulehdus, sidekalvon tulehdus, silmien kuivuminen, silmän ärsytys Erittäin harvinainen ( 1/10 000) Sumentunut näkö, kaihi, värisokeus (häiriöt värinäössä), piilolinssien aiheuttama ärsytys, sarveiskalvon samentuminen, hämäränäön heikentyminen, sarveiskalvotulehdus, näköhermon nystyn turvotus (merkkinä hyvänlaatuisesta kallonsisäisen paineen noususta), valoherkkyys Korva- ja sisäkorvahäiriöt: Erittäin harvinainen ( 1/10 000) Kuulon heikkeneminen Verisuonistohäiriöt: Erittäin harvinainen ( 1/10 000) Vaskuliitti (esimerkiksi Wegenerin granulomatoosi, allerginen vaskuliitti) Hengitys-, rintakehä- ja välikarsinahäiriöt: Yleinen ( 1/100, < 1/10) Erittäin harvinainen ( 1/10 000) Ruoansulatuskanavan häiriöt: Erittäin harvinainen ( 1/10 000) Nenäverenvuoto, nenän kuivuus, nenänielun tulehdus Bronkospasmi (erityisesti potilailla, joilla on astma), käheys Koliitti, ileiitti, kurkun kuivuus, ruoansulatuskanavan verenvuodot, veriripuli ja tulehduksellinen suolisairaus, pahoinvointi, pankreatiitti (ks. 4.4 Varoitukset ja käyttöön liittyvät varotoimet) Maksa- ja sappihäiriöt: Erittäin yleinen ( 1/10) Erittäin harvinainen ( 1/10 000) Ihon ja ihonalaiskerrosten häiriöt: Erittäin yleinen ( 1/10) Harvinainen ( 1/10 000, < 1/1000) Erittäin harvinainen ( 1/10 000) Transaminaasientsyymien nousu (ks. 4.4 Varoitukset ja käyttöön liittyvät varotoimet) Hepatiitti Huulitulehdus, ihotulehdus, kuiva iho, paikallinen hilseily, kutina, ihottuma, hauras iho (lisääntynyt hankaumien riski) Hiustenlähtö Acne fulminans, vaikeutunut akne (punoittava akne), punoitus (kasvoissa), eksanteema, hiusongelmat, hirsutismi, kynnen dystrofia, kynsivallintulehdus, valoyliherkyysreaktiot, pyogeeninen granulooma, ihon hyperpigmentaatio, lisääntynyt hikoilu 17
18 Tuki- ja liikuntaelimistön, Sidekudosten ja luuston häiriöt: Erittäin yleinen ( 1/10) Nivelkipu, lihaskipu, selkäkipu (erityisesti nuorilla potilailla) Erittäin harvinainen ( 1/10 000) Niveltulehdus, kalsinoosi (nivelsiteiden ja jänteiden kalkkeutumat), epifyysilevyjen ennenaikainen kiinnittyminen, eksostoosi, (hyperostoosi), alentunut luuntiheys, jännetulehdus Munuais- ja virtsatiehäiriöt: Erittäin harvinainen ( 1/10 000) Munuaiskerästulehdus Yleisluonteiset häiriöt: Erittäin harvinainen ( 1/10 000) Granulaatiokudoksen lisääntynyt muodostuminen, huono olo Tutkimukset: Erittäin yleinen ( 1/10) Kohonneet veren triglyseridiarvot, laskeneet HDL-arvot Yleinen ( 1/100, < 1/10) Kohonneet veren kolesteroliarvot, kohonneet verensokeriarvot, hematuria, proteinuria, Erittäin harvinainen ( 1/10 000) Kohonneet veren kreatiinifosfokinaasiarvot Haittavaikutusten ilmaantuvuus on laskettu yhdistämällä tuloksia niin, että yhteensä on saatu 824 potilaan haittavaikutusprofiilit kliinisistä tutkimuksista ja markkinoilletulon jälkeisistä tutkimuksista. 4.9 Yliannostus Isotretinoiini on A-vitamiinijohdannainen. Vaikka isotretinoiinin akuutti toksisuus on alhainen, voi yliannostus aiheuttaa A-vitamiinimyrkytyksen oireita. Akuutti A-vitamiinimyrkytys voi aiheuttaa päänsärkyä, pahoinvointia tai oksentelua, väsymystä, ärtyisyyttä ja kutinaa. Isotretinoiinin yliannostusoireet ovat luultavasti samankaltaisia. Oireiden voidaan olettaa korjaantuvan itsestään ilman hoitoa. 5. FARMAKOLOGISET OMINAISUUDET 5.1 Farmakodynamiikka Farmakoterapeuttinen ryhmä: Systeemisesti käytettävät aknelääkkeet ATC-koodi: D10BA01 Vaikutusmekanismi Isotretinoiini on all-trans retinoiinihapon, tretinoiinin stereoisomeeri. Isotretinoiinin tarkkaa vaikutusmekanismia ei ole selvitetty yksityiskohtaisesti, mutta kliinisen tilan paranemisen on todettu perustuvan talirauhasten vähentyneeseen aktiivisuuteen ja histologisesti osoitettuun talirauhasten koon pienenemiseen. Lisäksi isotretinoiinilla on havaittu olevan anti-inflammatorista vaikutusta iholla. Teho Talirauhaskarvatupen epiteelisolujen liikasarveistuminen aiheuttaa sarveissolujen kerääntymistä talirauhastiehyisiin. Sarveisaine ja liiallinen tali tukkivat tiehyen. Tällöin syntyy komedoja ja lopulta tulehtuneita leesioita. Isotretinoiini estää talirauhassolujen lisääntymistä ja vaikuttanee aknessa estämällä näiden solujen erilaistumista. Tali on Propionibacterium acnes -bakteerin tärkein kasvualusta, joten vähentynyt talivuoto vähentää talirauhastiehyen bakteerien määrää. 5.2 Farmakokinetiikka Imeytyminen Isotretinoiinin imeytyminen ruoansulatuskanavasta vaihtelee, mutta on hoitoannoksilla lineaarisesti sidoksissa annokseen. Isotretinoiinin absoluuttista hyötyosuutta ei ole määritelty, koska yhdisteestä ei ole saatavissa ihmisille laskimonsisäisesti annosteltavaa muotoa. Koirilla tehdyistä tutkimuksista voidaan päätellä, että hyötyosuus on suhteellisen alhainen ja vaihteleva. Kun isotretinoiini otetaan ruokailun yhteydessä, hyötyosuus kaksinkertaistuu verrattuna paasto-olosuhteisiin. 18
19 Jakautuminen Isotretinoiini sitoutuu voimakkaasti plasman proteiineihin, pääasiassa albumiiniin (99,9 %). Isotretinoiinin jakautumistilavuutta ihmisellä ei ole määritetty, koska isotretinoiinia ei ole saatavissa ihmisille laskimonsisäisesti annosteltavana muotona. Ihmisillä isotretinoiinin jakautumisesta kudoksiin tiedetään vain vähän. Isotretinoiinin pitoisuudet orvaskedessä ovat ainoastaan puolet sen pitoisuudesta seerumissa. Isotretinoiinin plasmapitoisuudet ovat noin 1,7-kertaiset koko veren pitoisuuksiin verrattuna. Tämä johtuu isotretinoiinin heikosta penetroitumisesta punasoluihin. Metabolia Oraalisen isotretinoiiniannostelun jälkeen plasmasta on todettu kolmea päämetaboliittia: 4-oksoisotretinoiinia, tretinoiinia (all-trans retinoiinihappoa) ja 4-okso-tretinoiinia. Nämä isotretinoiinin metaboliitit ovat osoittaneet biologista aktiivisuutta useissa in vitro -tutkimuksissa. 4-oksoisotretinoiinin havaittiin kliinisessä tutkimuksessa olevan merkittävä osatekijä isotretinoiinin vaikutuksessa (vähentää talineritystä vaikuttamatta plasman isotretinoiinin ja tretinoiinin pitoisuuksiin). Muihin metaboliitteihin kuuluu glukuronidikonjugaatteja. Isotretinoiinin päämetaboliitti on 4-okso-isotretinoiini, jonka vakaan tilan plasmapitoisuus on 2,5-kertainen kantaaineeseen verrattuna. Isotretinoiini ja tretinoiini (all-trans retinoiinihappo) ovat palautuvasti metaboloituvia (konvertoituvat keskenään) ja niiden metabolia on toisistaan riippuvaista. On arvioitu, että % isotretinoiiniannoksesta metaboloituu isomerisaation kautta. Enterohepaattisella kierrolla saattaa olla merkittävä osuus isotretinoiinin farmakokinetiikassa. Ihmisellä on in vitro -metaboliatutkimuksin todettu, että useat CYP-entsyymit osallistuvat isotretinoiinin metaboloitumiseen 4-okso-isotretinoiiniksi ja tretinoiiniksi. Yhdelläkään isoentsyymillä ei näytä olevan määräävää asemaa metaboliassa. Isotretinoiini tai sen metaboliitit eivät vaikuta merkittävästi CYP-entsyymiaktiivisuuteen. Eliminaatio Käyttämällä radioaktiivisesti leimattua isotretinoiinia, on havaittu suun kautta otetun annoksen jälkeen yhtä suuren määrän lääkeaineesta poistuvan virtsan ja ulosteiden mukana. Lopullinen muuttumattoman lääkeaineen eliminaation puoliintumisaika suun kautta otetun annoksen jälkeen on keskimäärin 19 tuntia. 4-okso-isotretinoiinin lopullinen eliminaation puoliintumisaika on pidempi, keskimäärin 29 tuntia. Isotretinoiini on fysiologinen retinoidi ja sisäsyntyiset retinoidipitoisuudet saavutetaan noin kahden viikon kuluttua isotretinoiinihoidon lopettamisesta. Farmakokinetiikka erityisryhmillä Koska isotretinoiini on vasta-aiheinen maksan vajaatoimintaa sairastavilla potilailla, ei tämän potilasryhmän kohdalla ole riittävästi tutkimustietoa isotretinoiinin farmakokinetiikasta. Munuaisten vajaatoiminta ei vähennä merkittävästi isotretinoiinin tai 4-okso-isotretinoiinin plasmapuhdistumaa. 5.3 Prekliiniset tiedot turvallisuudesta Akuutti toksisuus Isotretinoiinin akuutti oraalinen toksisuus määritettiin useilla eläinlajeilla. Kaniineilla LD50-arvo on noin 2000 mg/kg, hiirillä noin 3000 mg/kg ja rotilla yli 4000 mg/kg. Krooninen toksisuus Yli kaksi vuotta kestänyt pitkäaikaistutkimus (isotretinoiiniannokset 2, 8 ja 32 mg/kg/vrk) antoi rotilla näyttöä osittaisesta karvojen menetyksestä ja kohonneista plasman triglyseridiarvoista korkeampien annosten ryhmässä. Isotretinoiinin haittavaikutuskirjo muistuttaa näin ollen jyrsijöillä tavattuja A- vitamiinin haittavaikutuksia. Haittavaikutuskirjoon ei kuulu rotilla havaittu A-vitamiinin aiheuttama massiivinen kudosten ja elinten kalkkiutuminen. A-vitamiiniannostelun aikana havaittuja maksasolujen muutoksia ei ilmaantunut isotretinoiinihoidossa. 19
20 Kaikki A-vitamiinimyrkytyksen oireet poistuivat itsestään, kun isotretinoiinihoito lopetettiin. Jopa koe-eläimet, joiden yleiskunto oli huomattavasti heikentynyt, toipuivat suurelta osin isotretinoiinin haittavaikutuksista 1-2 viikon aikana annostelun lopettamisen jälkeen. Teratogeenisuus Kuten muidenkin A-vitamiinijohdosten, isotretinoiininkin on eläinkokeissa havaittu olevan teratogeeninen ja haitallinen alkiolle. Isotretinoiinin teratogeenisuudesta johtuen on tässä valmisteyhteenvedossa mainitut asiat otettava huomioon määrättäessä isotretinoiinia hedelmällisessä iässä olevalle naiselle (ks. 4.3 Vasta-aiheet, 4.4 Varoitukset ja käyttöön liittyvät varotoimet ja 4.6 Raskaus ja imetys ). Fertiilisyys Terapeuttisilla annoksilla käytetty isotretinoiini ei vaikuta siittiöiden määrään, liikkuvuuteen eikä rakenteeseen. Isotretinoiini ei myöskään aiheuta vaaraa kehittyvälle alkiolle raskauden aikana miehen puolelta tämän käyttäessä isotretinoiinia. Mutageenisuus Isotretinoiinin ei ole osoitettu olevan mutageeninen eikä karsinogeeninen in vitro -tutkimuksissa eikä in vivo -koe-eläintutkimuksissa. 6. FARMASEUTTISET TIEDOT 6.1 Apuaineet (Katso liite I täytetään kansallisesti) 6.2 Yhteensopimattomuudet Ei oleellinen. 6.3 Kestoaika <3 years><26 months> (Täytetään kansallisesti) 6.4 Säilytys Säilytä alle 25 C:ssa. <Säilytä kapselit läpipainopakkauksessa ja pidä läpipainopakkaukset ulkopakkauksessa lääkeaineen suojaamiseksi valolta ja kosteudelta.> (Katso liite I täytetään kansallisesti) 6.5 Pakkaustyyppi ja pakkauskoko (pakkauskoot) (Katso liite I täytetään kansallisesti) Kaikkia pakkauskokoja ei välttämättä ole myynnissä. 6.6 Käyttö- ja käsittelyohjeet Ei erityisohjeita. 20
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Lääkärin opas. Raskauden ja sikiöaltistuksen ehkäisyohjelma
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Lääkärin opas Raskauden ja sikiöaltistuksen ehkäisyohjelma Johdanto Isotretinoiinikapselit sisältävät vaikuttavana aineena isotretinoiinia,
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Lääkärin opas Raskauden ja sikiöaltistuksen ehkäisyohjelma Johdanto Isotretinoiinikapselit sisältävät vaikuttavana aineena isotretinoiinia,
Apteekkihenkilökunnan opas isotretinoiinia toimitettaessa
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Apteekkihenkilökunnan opas isotretinoiinia toimitettaessa Raskauden ja sikiöaltistuksen ehkäisyohjelma Johdanto Isotretinoiinikapselit
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Apteekkihenkilökunnan opas isotretinoiinia toimitettaessa Raskauden ja sikiöaltistuksen ehkäisyohjelma Johdanto Isotretinoiinikapselit
LIITE I LISTA LÄÄKKEEN NIMISTÄ, ANNOSMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVANHALTIJOISTA, PAKKAUKSISTA JA PAKKAUSKOISTA JÄSENVALTIOISSA
 LIITE I LISTA LÄÄKKEEN NIMISTÄ, ANNOSMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVANHALTIJOISTA, PAKKAUKSISTA JA PAKKAUSKOISTA JÄSENVALTIOISSA CPMP/2846/03 1/21 EMEA 2003 Jäsenvaltio Myyntiluvanhaltija
LIITE I LISTA LÄÄKKEEN NIMISTÄ, ANNOSMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVANHALTIJOISTA, PAKKAUKSISTA JA PAKKAUSKOISTA JÄSENVALTIOISSA CPMP/2846/03 1/21 EMEA 2003 Jäsenvaltio Myyntiluvanhaltija
VALMISTEYHTEENVETO. Apuaineet: puhdistettu soijaöljy, hydrattu soijaöljy, osittain hydrattu soijaöljy Täydellinen apuaineluettelo, ks. kohta 6.1.
 1. LÄÄKEVALMISTEEN NIMI Isotretinoin Orion 20 mg kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 20 mg isotretinoiinia. Apuaineet: puhdistettu soijaöljy,
1. LÄÄKEVALMISTEEN NIMI Isotretinoin Orion 20 mg kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 20 mg isotretinoiinia. Apuaineet: puhdistettu soijaöljy,
Osa A. Täytetään kaikkien naispotilaiden kohdalla
 Tarkastuslista määrättäessä isotretinoiinia naispotilaille: Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Raskauden ja sikiöaltistuksen ehkäisyohjelma Isotretinoiini on erittäin
Tarkastuslista määrättäessä isotretinoiinia naispotilaille: Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Raskauden ja sikiöaltistuksen ehkäisyohjelma Isotretinoiini on erittäin
Kapselit otetaan ruokailun yhteydessä kerran tai kaksi kertaa vuorokaudessa.
 1. LÄÄKEVALMISTEEN NIMI Roaccutan 10 mg pehmeät kapselit Roaccutan 20 mg pehmeät kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen pehmeä kapseli sisältää 10 mg tai 20 mg isotretinoiinia Apuaineet,
1. LÄÄKEVALMISTEEN NIMI Roaccutan 10 mg pehmeät kapselit Roaccutan 20 mg pehmeät kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen pehmeä kapseli sisältää 10 mg tai 20 mg isotretinoiinia Apuaineet,
Apuaineet, joiden vaikutus tunnetaan: Sisältää soijaöljyä (puhdistettua, hydrattua ja osittain hydrattua) sekä sorbitolia (E420)
 1. LÄÄKEVALMISTEEN NIMI Roaccutan 10 mg pehmeät kapselit Roaccutan 20 mg pehmeät kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen pehmeä kapseli sisältää 10 mg tai 20 mg isotretinoiinia Apuaineet,
1. LÄÄKEVALMISTEEN NIMI Roaccutan 10 mg pehmeät kapselit Roaccutan 20 mg pehmeät kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen pehmeä kapseli sisältää 10 mg tai 20 mg isotretinoiinia Apuaineet,
Valmisteyhteenveto. 1. Lääkevalmisteen nimi. Isotretinoin ratiopharm 20 mg kapseli, pehmeä. 2. Vaikuttavat aineet ja niiden määrät
 Valmisteyhteenveto Isotretinoin ratiopharm 20 mg kapseli, pehmeä 1. Lääkevalmisteen nimi Isotretinoin ratiopharm 20 mg kapseli, pehmeä 2. Vaikuttavat aineet ja niiden määrät Isotretinoiini 20 mg Apuaineet:
Valmisteyhteenveto Isotretinoin ratiopharm 20 mg kapseli, pehmeä 1. Lääkevalmisteen nimi Isotretinoin ratiopharm 20 mg kapseli, pehmeä 2. Vaikuttavat aineet ja niiden määrät Isotretinoiini 20 mg Apuaineet:
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Isotretinoin Orifarm 20 mg kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 20 mg Yksi kapseli, pehmeä, sisältää 20 mg isotretinoiinia. Apuaineet, joiden
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Isotretinoin Orifarm 20 mg kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 20 mg Yksi kapseli, pehmeä, sisältää 20 mg isotretinoiinia. Apuaineet, joiden
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Apteekkihenkilökunnan opas isotretinoiininia toimitettaessa Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Apteekkihenkilökunnan
Raskauden ja sikiöaltistuksen ehkäisyohjelma Apteekkihenkilökunnan opas isotretinoiininia toimitettaessa Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Apteekkihenkilökunnan
VALMISTEYHTEENVETO. Kapselit otetaan ruokailun yhteydessä kerran tai kaksi kertaa vuorokaudessa.
 1. LÄÄKEVALMISTEEN NIMI Isotretinoin Actavis 10 mg, kapseli, pehmeä Isotretinoin Actavis 20 mg, kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi pehmeä kapseli sisältää 10
1. LÄÄKEVALMISTEEN NIMI Isotretinoin Actavis 10 mg, kapseli, pehmeä Isotretinoin Actavis 20 mg, kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi pehmeä kapseli sisältää 10
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Lääkärin opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Lääkärin opas Johdanto Isotretinoin Actavis sisältää vaikuttavana
Raskauden ja sikiöaltistuksen ehkäisyohjelma Lääkärin opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Lääkärin opas Johdanto Isotretinoin Actavis sisältää vaikuttavana
Isotretinoin Orifarm Tietoja lääkärille. Raskaudenehkäisyohjelma Hoito-ohjeet
 Isotretinoin Orifarm Tietoja lääkärille Raskaudenehkäisyohjelma Hoito-ohjeet Johdanto Isotretinoin Orifarm -valmisteen hyväksytty käyttöaihe on vaikea, asianmukaiseen systeemiseen antibioottihoitoon ja
Isotretinoin Orifarm Tietoja lääkärille Raskaudenehkäisyohjelma Hoito-ohjeet Johdanto Isotretinoin Orifarm -valmisteen hyväksytty käyttöaihe on vaikea, asianmukaiseen systeemiseen antibioottihoitoon ja
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Tarkastuslista määrättäessä isotretinoiinia naispotilaille Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Tarkastuslista
Raskauden ja sikiöaltistuksen ehkäisyohjelma Tarkastuslista määrättäessä isotretinoiinia naispotilaille Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Tarkastuslista
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Apteekkihenkilökunnan
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Apteekkihenkilökunnan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Johdanto Neotigason sisältää vaikuttavana aineena asitretiinia, joka on
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Apteekkihenkilökunnan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Johdanto Neotigason sisältää vaikuttavana aineena asitretiinia, joka on
NIMET, LÄÄKEMUODOT, LÄÄKEVALMISTEIDEN VAHVUUDET, ANNOSTELUREITIT, MYYNTILUVAN HAKIJAT, MYYNTILUVAN HALTIJAT, PAKKAUKSET JA PAKKAUSKOOT JÄSENVALTIOISSA
 LIITE I NIMET, LÄÄKEMUODOT, LÄÄKEVALMISTEIDEN VAHVUUDET, ANNOSTELUREITIT, MYYNTILUVAN HAKIJAT, MYYNTILUVAN HALTIJAT, PAKKAUKSET JA PAKKAUSKOOT JÄSENVALTIOISSA 1 Jäsenvaltio Hakija / myyntiluvan haltija
LIITE I NIMET, LÄÄKEMUODOT, LÄÄKEVALMISTEIDEN VAHVUUDET, ANNOSTELUREITIT, MYYNTILUVAN HAKIJAT, MYYNTILUVAN HALTIJAT, PAKKAUKSET JA PAKKAUSKOOT JÄSENVALTIOISSA 1 Jäsenvaltio Hakija / myyntiluvan haltija
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Tarkastuslista määrättäessä asitretiinia naispotilaille
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Tarkastuslista määrättäessä asitretiinia naispotilaille (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Asitretiini on erittäin teratogeenistä ja
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Tarkastuslista määrättäessä asitretiinia naispotilaille (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Asitretiini on erittäin teratogeenistä ja
Toctino (alitretinoiini)
 Potilaskortti Potilaan nimi TOC-FI-003-04032009-C RASKAUDENEHKÄISYOHJELMA Toctino (alitretinoiini) Toctino kuuluu lääkeaineryhmään, jonka tiedetään aiheuttavan synnynnäisiä epämuodostumia. Sikiöepämuodostumien
Potilaskortti Potilaan nimi TOC-FI-003-04032009-C RASKAUDENEHKÄISYOHJELMA Toctino (alitretinoiini) Toctino kuuluu lääkeaineryhmään, jonka tiedetään aiheuttavan synnynnäisiä epämuodostumia. Sikiöepämuodostumien
(alitretinoiini) Potilaskortti RASKAUDENEHKÄISYOHJELMA. Potilaan nimi. alitretinoiini
 Cutterguide: No Printing Process: Offset GD: RR 37861 Size: 148 x 210mm Pages: 8 Colors: C M Y K (4 Colors) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller 9.0 RASKAUDENEHKÄISYOHJELMA
Cutterguide: No Printing Process: Offset GD: RR 37861 Size: 148 x 210mm Pages: 8 Colors: C M Y K (4 Colors) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller 9.0 RASKAUDENEHKÄISYOHJELMA
Apteekkihenkilökunnan opas
 Apteekkihenkilökunnan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Johdanto Asitretiinin teratogeeniset riskit Acitretin Orifarm sisältää vaikuttavana
Apteekkihenkilökunnan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Johdanto Asitretiinin teratogeeniset riskit Acitretin Orifarm sisältää vaikuttavana
Tarkastuslista määrättäessä asitretiinia naispotilaille
 Tarkastuslista määrättäessä asitretiinia naispotilaille Acitretin Orifarm 10 mg:n ja 25 mg:n kovat kapselit Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Asitretiini on erittäin teratogeenistä
Tarkastuslista määrättäessä asitretiinia naispotilaille Acitretin Orifarm 10 mg:n ja 25 mg:n kovat kapselit Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Asitretiini on erittäin teratogeenistä
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Potilaan opas. Acitretin Orifarm 10 mg ja 25 mg. Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Lääkärin opas
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Lääkärin opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Johdanto Neotigason sisältää vaikuttavana aineena asitretiinia, joka on erittäin teratogeenistä.»
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Lääkärin opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Johdanto Neotigason sisältää vaikuttavana aineena asitretiinia, joka on erittäin teratogeenistä.»
LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE. (alitretinoiini) Lääkärin materiaalit. Potilaan nimi.
 LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE (alitretinoiini) Lääkärin materiaalit Potilaan nimi alitretinoiini Lääkärin materiaalit Lääkärin tarkistuslista/vahvistuslomake
LÄÄKÄRIN TARKISTUSLISTA/VAHVISTUSLOMAKE MÄÄRÄTTÄESSÄ LÄÄKETTÄ NAISPOTILAILLE (alitretinoiini) Lääkärin materiaalit Potilaan nimi alitretinoiini Lääkärin materiaalit Lääkärin tarkistuslista/vahvistuslomake
Toctino (alitretinoiini)
 Raskauden ehkäisyohjelma TOC-FI-003-04032009-B OHJEET LÄÄKÄREILLE JA APTEEKKIHENKILÖKUNNALLE Toctino (alitretinoiini) Ohjeita Toctino-hoitoa määrääville lääkäreille Pyydämme teitä lukemaan nämä ohjeet
Raskauden ehkäisyohjelma TOC-FI-003-04032009-B OHJEET LÄÄKÄREILLE JA APTEEKKIHENKILÖKUNNALLE Toctino (alitretinoiini) Ohjeita Toctino-hoitoa määrääville lääkäreille Pyydämme teitä lukemaan nämä ohjeet
Histadin- valmisteen tehoa ja turvallisuutta ei ole osoitettu alle 2-vuotiailla lapsilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma. (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Lievän tai kohtalaisen vaikean polven nivelrikon oireiden lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
LIITE VALMISTEYHTEENVETO
 LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.1 Käyttöaiheet. 4.2 Annostus ja antotapa
 1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
Liite III. Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom. Nämä muutokset valmistetietojen asianmukaisiin kohtiin on laadittu referraalimenettelyssä. Direktiivin 2001/83/EY III otsikon 4. luvussa
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom. Nämä muutokset valmistetietojen asianmukaisiin kohtiin on laadittu referraalimenettelyssä. Direktiivin 2001/83/EY III otsikon 4. luvussa
VALMISTEYHTEENVETO. Valmisteen kuvaus: pyöreä, merkintä BEPANTHEN kehässä, halkaisija n. 18 mm, paksuus n. 3,5 mm, harmaankeltainen, sitruunan tuoksu.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO. Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia, joka vastaa 2,68 mg bentsydamiinia.
 1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
VALMISTEYHTEENVETO. Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia 20 mg (2 %).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO. Akrivastiinia ei pidä määrätä potilaille, joiden munuaistoiminta on merkittävästi heikentynyt.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
Kissa: Leikkauksen jälkeisen kivun lievitys kohdun ja munasarjojen poistoleikkauksen sekä pienten pehmytkudoskirurgisten toimenpiteiden jälkeen.
 1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Shampoo Viskoosi liuos, joka on väriltään kirkkaan oljenkeltainen tai vaaleanoranssi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO. Huom. Emätinpuikko tulee työntää syvälle emättimeen, ei mielellään kuukautisten aikana.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
Silmäinfektiot kuten keratiitti, konjunktiviitti, meibomiitti, blefariitti ym., jotka johtuvat fusidiinille herkistä bakteereista.
 1. LÄÄKEVALMISTEEN NIMI Fucithalmic 10 mg/g silmätipat 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma silmätippoja sisältää 10 mg fusidiinihappoa. Apuaine, jonka vaikutus tunnetaan: bentsalkoniumkloridi
1. LÄÄKEVALMISTEEN NIMI Fucithalmic 10 mg/g silmätipat 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma silmätippoja sisältää 10 mg fusidiinihappoa. Apuaine, jonka vaikutus tunnetaan: bentsalkoniumkloridi
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Metronidatsoli 0,75 paino-%, 7,5 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä
 mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen tai melkein valkoinen talkkimainen jauhe.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
Eläimiä koskevat erityiset varotoimet Jos haittavaikutuksia ilmenee, tulee hoito keskeyttää ja ottaa yhteys eläinlääkäriin.
 1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
Lääkärin opas. Acitretin Orifarm 10 mg ja 25 mg kovat kapselit. Raskauden ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Lääkärin opas Acitretin Orifarm 10 mg ja 25 mg kovat kapselit Raskauden ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Johdanto Acitretin Orifarm sisältää vaikuttavana aineena asitretiinia, joka
Lääkärin opas Acitretin Orifarm 10 mg ja 25 mg kovat kapselit Raskauden ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Johdanto Acitretin Orifarm sisältää vaikuttavana aineena asitretiinia, joka
VALMISTEYHTEENVETO. Yksi tippa silmän sidekalvopussiin 4 kertaa päivässä tai tarpeen mukaan tilan vaikeusasteesta riippuen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
Annosta tulee muuttaa eläimillä, joilla on munuaisten tai maksan vajaatoiminta, koska haittavaikutusriski on suurentunut.
 1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
1. ELÄINLÄÄKKEEN NIMI Metomotyl vet 2,5 mg/ml injektioneste, liuos kissoille ja koirille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS 1 millilitra sisältää: Vaikuttava aine: metoklopramidi (hydrokloridimonohydraattina)
VALMISTEYHTEENVETO. Viininpunainen, pitkulainen, pehmeä liivatekapseli (pituus: 12 mm), joka sisältää oranssinkeltaista, sameaa, tahmeaa nestettä
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Isotretinoin ratiopharm 20 mg kapseli, pehmeä Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Isotretinoin ratiopharm 20 mg kapseli, pehmeä Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa.
Yliherkkyys vaikuttavalle aineelle tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fusidic Acid Orifarm 20 mg/g, emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää fusidiinihappoa hemihydraattina, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fusidic Acid Orifarm 20 mg/g, emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää fusidiinihappoa hemihydraattina, joka vastaa
Erivedge -valmisteen raskaudenehkäisyohjelma
 Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski
 mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
VALMISTEYHTEENVETO. Yksi tabletti sisältää 120 mg feksofenadiinihydrokloridia, mikä vastaa 112 mg feksofenadiinia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nefoxef 120 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 120 mg feksofenadiinihydrokloridia, mikä vastaa 112
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nefoxef 120 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 120 mg feksofenadiinihydrokloridia, mikä vastaa 112
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen, läpikuultamaton emulsiovoide ja vaalean kellertävä peräpuikko.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Neoproct yhdistelmäpakkaus Rektaalivoide, creme ja peräpuikko 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 g rektaalivoidetta sisältää 1 mg fluokortoloni-21-pivalaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Neoproct yhdistelmäpakkaus Rektaalivoide, creme ja peräpuikko 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 g rektaalivoidetta sisältää 1 mg fluokortoloni-21-pivalaattia
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: soijaöljy, sorbitoli (E420), kokkeniilipunainen A (E124).
 1. LÄÄKEVALMISTEEN NIMI Isotretinoin Actavis 10 mg, kapseli, pehmeä Isotretinoin Actavis 20 mg, kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi pehmeä kapseli sisältää 10
1. LÄÄKEVALMISTEEN NIMI Isotretinoin Actavis 10 mg, kapseli, pehmeä Isotretinoin Actavis 20 mg, kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi pehmeä kapseli sisältää 10
1. ELÄINLÄÄKKEEN NIMI. Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
 1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
1. ELÄINLÄÄKKEEN NIMI Carprofelican vet 50 mg/ml injektioneste, liuos, koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Karprofeeni Apuaineet: Bentsyylialkoholi
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
NOBIVAC RABIES VET. Adjuvantti: Alumiinifosfaatti (2 %) 0,15 ml (vastaten alumiinifosfaattia 3 mg)
 VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
VALMISTEYHTEENVETO 1 ELÄINLÄÄKKEEN NIMI Nobivac RABIES Vet 2 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Per annos (1 ml): Vaikuttava aine: BHK-21-soluviljelmässä kasvatettua ja beeta-propionilaktonilla inaktivoitua
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
VALMISTEYHTEENVETO. Täydellinen apuaineluettelo, ks. kohta LÄÄKEVALMISTEEN NIMI. Isotretinoin Actavis 40 mg kapseli, pehmeä
 1. LÄÄKEVALMISTEEN NIMI Isotretinoin Actavis 40 mg kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi pehmeä kapseli sisältää 40 mg isotretinoiinia. Apuaineet, joiden vaikutus
1. LÄÄKEVALMISTEEN NIMI Isotretinoin Actavis 40 mg kapseli, pehmeä VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi pehmeä kapseli sisältää 40 mg isotretinoiinia. Apuaineet, joiden vaikutus
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Avitcid 0,025 % emulsiovoide Avitcid 0,05 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Avitcid 0,025 % emulsiovoide Avitcid 0,05 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Avitcid 0,025 % emulsiovoide Tretinoiini 0,25 mg/g Apuaineet:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Avitcid 0,025 % emulsiovoide Avitcid 0,05 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Avitcid 0,025 % emulsiovoide Tretinoiini 0,25 mg/g Apuaineet:
Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin
 Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
VALMISTEYHTEENVETO. Yliherkkyys mikonatsolille, muille imidatsolijohdannaisille tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 20 mg/ml emulsio iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää mikonatsolinitraattia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 20 mg/ml emulsio iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää mikonatsolinitraattia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. LAXOBERON 7,5 mg/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI LAXOBERON 7,5 mg/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml tippoja sisältää natriumpikosulfaattia 7,5 mg. Apuaineet, ks. 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI LAXOBERON 7,5 mg/ml tipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml tippoja sisältää natriumpikosulfaattia 7,5 mg. Apuaineet, ks. 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO. Valkoinen, pyöreä, kummaltakin puolelta litteä viistoreunainen tabletti, jossa jakouurre toisella puolella.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Terracort voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Terracort voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma voidetta sisältää 30 mg oksitetrasykliiniä (33,520 mg oksitetrasykliinihydrokloridina) ja
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Terracort voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma voidetta sisältää 30 mg oksitetrasykliiniä (33,520 mg oksitetrasykliinihydrokloridina) ja
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO. Herpes simplex -viruksen aiheuttamien ihon tai limakalvojen infektioiden paikallishoitoon, esim. herpes labialis.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zovirax 5 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää asikloviiria 50 mg. Apuaineet, joiden vaikutus tunnetaan: 1
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zovirax 5 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää asikloviiria 50 mg. Apuaineet, joiden vaikutus tunnetaan: 1
VALMISTEYHTEENVETO. Liialliseen kaasunmuodostukseen liittyvät mahan ja suoliston vaivat
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Espumisan 100 mg/ml tipat, emulsio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Vaikuttava aine: simetikoni 1 ml sisältää 100 mg simetikonia. Apuaine: sorbitoli (E420),
VALMISTEYHTEENVETO. 1 ml sisältää 0,54 mg levokabastiinihydrokloridia, joka vastaa 0,5 mg levokabastiinia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI LIVOSTIN 0,5 mg/ml silmätipat, suspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 0,54 mg levokabastiinihydrokloridia, joka vastaa 0,5 mg levokabastiinia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI LIVOSTIN 0,5 mg/ml silmätipat, suspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 0,54 mg levokabastiinihydrokloridia, joka vastaa 0,5 mg levokabastiinia.
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO. Nuhaan ja poskiontelotulehdukseen liittyvän limakalvojen turvotuksen lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: puhdistettu soijaöljy, hydrattu soijaöljy, osittain hydrattu soijaöljy
 VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
VALMISTEYHTEENVETO. Yliherkkyys vaikuttavalle aineelle, muille imidatsolijohdoksille tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 20 mg mikonatsolinitraattia. Apuaineet, joiden vaikutus
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 20 mg mikonatsolinitraattia. Apuaineet, joiden vaikutus
