Tenttikysymyksiä insinöörien kemian opintojaksolla
|
|
|
- Ella Karvonen
- 10 vuotta sitten
- Katselukertoja:
Transkriptio
1 1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU Tenttikysymyksiä insinöörien kemian opintojaksolla Millainen aine on inhibiittori? Reaktiota hidastava aine Mitä tarkoittaa karbonisoituminen? Betonin neutraloitumisreaktio eli karbonatisoituminen on seurausta hiilidioksidin tunkeutumisesta betoniin ja sen aiheuttamasta betonin huokosveden emäksisyyden (ph) alenemisesta. Miksi heliumkaasua (He) käytetään ilmapalloissa kaasuna, vaikka vetykaasu (H 2 ) olisi kevyempi kaasu? Heliumissa on oktetti (1s 2 ), joten ei reagoi. Vety muodostaa ilman hapen kanssa ns. räjähdyskaasun ja reagoi kiivaasti. Betoni on yksi yleisimmistä rakennusmateriaaleista. Miksi betonia valettaessa betoni on pidettävä koko ajan märkänä? Vesi on kovettumisreaktion lähtöaine. Betoni imee kosteutta huokosiinsa. Mikä tämän ilmiön nimi on ja mihin se perustuu? Kapillaari-ilmiö. Perustuu poolisuuteen eli elektronegatiivisuuseroon. Molemmat ovat poolisia, jolloin vetävät toisia puoleensa. Miksi huokostimen lisääminen parantaa betonin pakkasenkestävyyttä? Huokostin antaa betonin sisällä olevalle vedelle lisää tilaa laajeta. Vesi jäätyessään laajenee ja jos tilaa ei olisi, vesi rikkoisi betonin seinämän. Miksi lämpötilan nostaminen lisää kemiallista korroosiota? Lämpötilan noustessa ilman kosteus kasvaa. Kemiallinen korroosio on ilman kosteuden vaikutuksesta aiheutuvaa korroosiota. Yleisesti: kun lämpötila nousee, reaktionopeus kasvaa reagoivien lähtöaineiden törmätessä toisiinsa useammin ja voimakkaammin. Perustele, miksi alumiinikattilaa ei pidä puhdistaa natriumhydroksidia (NaOH) sisältävällä uuninpuhdistusaineella? Emäksinen uuninpuhdistusaine syövyttää alumiinia, koska alumiini on tuolloin korroosioalueella Pourbaix:n diagrammin mukaan. Mihin perustuu ruostumattoman teräksen ruostumattomuus? Teräksellä ulkopinnalla kromioksidikerros (Cr 2 O 3 ), joka suojaa ruostumiselta.
2 2 Perustele, miksi rakenteissa veden virtaus voidaan johtaa sinkitetyltä peltikatteelta kuparisiin syöksytorviin, mutta ei päinvastoin? Katolta tulevassa vedessä metalli on ionimuodossa ja kuparinen syöksytorvi on atomimuodossa. Sinkitetyn katon hapettuneesta pintakerroksesta voi Zn 2+- ioni vapautua ja lähteä sadeveden mukana jalompaan kupariseen syöksytorveen. Tällöin ei tapahdu mitään. Sinkki on epäjalompi kuin kupari, joten jos sinkki on ionimuodossa ja kupari atomimuodossa, ei reaktiota tapahdu. Toisinpäin, kuparin ollessa ionimuodossa ja sinkin atomimuodossa, tapahtuu hapetus-pelkistysreaktio, ja sinkitetty syöksytorvi alkaa hapettumaan. Miksi muoveissa käytetään stabilisaattoreita? Stabilisaattori estää muovin haurastumisen => vahvistaa ja pidentää käyttöikää Mihin perustuu öljymaalin kuivuminen? Happi reagoi ilman hapen kanssa ja sitoo maalin polymeeriketjut happisilloin toisiinsa. Miksi kiertovesisysteemiin tuleva vesi kuumennetaan ennen sen johtamista verkostoon? Vedestä poistetaan happi, jolloin korroosiota ei synny. Mihin tarkoitukseen käytetään korroosioinhibiittoria? Hidastamaan korroosion syntymistä. Selitä, miksi peltikatto voi ruostua, mikäli katolle jääneitä lehtiä ei poisteta? Piirrä selkeä kuva, merkitse siihen anodi ja katodi? Kun lehdet ovat märät, niin syntyy konsentraatiokenno niiden kohtien välille, jossa on ja ei ole lehtiä. Tällöin lehtikohdasta tulee anodi eli metalli hapettuu (ruostuu) ja avoimesta kohdasta katodi. Syy: ilmastusero (ero happipitoisuudessa).. Kumpi on parempi korroosioreaktion nopeuden kannalta, kupariruuvi hiiliteräslevyssä vai hiiliteräsruuvi kuparilevyssä? Perustele vastauksesi. Jalompi kupari, epäjalompi hiiliteräs => korroosioreaktio on hitaampaa, kun kupariruuvi hiiliteräslevyssä. Korroosio kiihtyy, kun katodin pinta-ala on suurempi kuin anodin (tällöin jalomman katodin pinnalla on enemmän elektroneja vastaanottavia happimolekyylejä).. Kysymyksessä on galvaaninen korroosio. Mitä eroa on kuumasinkitetyllä ja sähkösinkitetyllä tuotteella? Kuumasinkitty tuote on valmistettu upottamalla tuote kuumaan sinkkikylpyyn, kun taas sähkösinkitty on valmistettu elektrolyysillä.
3 3 Petrimaljalle laitettiin 10% NaCl-liuosta ja upotettiin siihen Pt-elektrodit. Liuoksen tiputettiin pieni KMnO 4 kide (MnO 4 - ionit ovat violetteja), kytkettiin tasajännite noin 5,5 V. Koe toistettiin happamissa olosuhteissa. Miten MnO 4 - ionit liikkuivat sähkökentässä kummassakin kokeessa? Perustele MnO 4 - ionien liikesuunta kummassakin kokeessa! (Katso muistitikulta video KMnO 4 ). -Neutraaleissa olosuhteissa ionien liikettä selittää: erimerkkiset varaukset vetävät toisiaan puoleensa. - Happamissa olosuhteissa: normaalipotentiaalitaulukosta todetaan, että permanganaatti-ioni on vahva hapetin, mutta hapettumis-pelkistymisreaktio vaatii lähtöaineiksi myös vetyioneja ja siksi se tapahtuu vain happamissa olosuhteissa. MnO H e - Mn H 2 O Voiko kloorikaasua tai kloridi-ionipitoista liuosta johtaa kupariputkea pitkin? Perustele. -Kloori kaasumuodossa (Cl 2 ) on vahva hapetin ja voi hapettaa kuparin. Kupariputki syöpyy. E 0 /V Cu e - Cu +0,34 Cl 2 (g) + 2 e - 2 Cl - (aq) +1,36 -Kloridi-ioni on oktetissa eikä voi hapettaa mitään. Kupariputki ei syövy, vaikka kloridiionipitoista liuosta johdetaan sitä pitkin. (HUOM! Oktetti EI ole sitä, että uloin kuori on täynnä. Kloridin uloin kuori ei ole täynnä, sillä 3. kuoren d-orbitaalilla ei ole elektroneja. Oktetissa atomilla on uloimmalla kuorella 8 elektronia eli s- ja p-orbitaalit ovat täynnä.)
4 4 Soveltavia tenttikysymyksiä eri koulutusohjelmissa AUTOMAATIOTEKNIIKKA 1. Kalsiumkloridia tarvitaan mm. sorateiden pölyn sidontaan. Sen valmistuksessa tarvitaan suolahappoa eli vetykloridia, joka valmistetaan reaktion (1) mukaisesti: H 2 (g) + Cl 2 (g) 2 HCl (g) H<0 (1) Kaasumaisessa HCl-molekyylissä esiintyy poolinen kovalenttinen sidos. HCl (g) johdetaan veteen, jolloin saadaan n. 30 massa-% liuos. Vesiliuoksessa HCl-molekyylit hajaantuvat täydelleen ioneiksi. Suolahapon vesiliuos pumpataan edelleen kalkkikivimurskeeseen, joka on muodostunut kalsiumkarbonaatista. Tapahtuu reaktio (2). Muodostunut CO 2 (g) nesteytetään kaupalliseksi tuotteeksi. CaCO HCl CaCl 2 + CO 2 (g) +??? (2) (a) Miten esität ilmaisun suolahapon vesiliuos lyhyesti kemian kielellä? (b) Mitä tarkoittaa H<0? (c) Miten reaktiotasapainoon vaikuttaa, jos reaktioseosta (1) lämmitetään? Perustele. (d) Esitä klooriatomin valenssielektronit? (e) Selitä, mitä tarkoittaa poolinen kovalenttinen sidos ja miten se muodostuu? (f) Suolahapon vesiliuosta voidaan käyttää moniin tarkoituksiin kuten mm. metallien syövytykseen. Tällöin metalli hapettuu. Mitä metallille tapahtuu sen hapettuessa? (g) Mikä on reaktiossa (2) muodostunut kolmas lopputuote? (a) HCl (aq) (c) Le Chatelieren periaatteen mukaan eksoterminen reaktio hidastuu lämmitettäessä. 2. Sinkkiä käytetään esimerkiksi teräslevyjen päällystämiseen. Sinkki antaa teräkselle hyvän suojan korroosiota vastaan. Sinkki esiintyy luonnossa sinkkivälkkeenä, ZnS, ja sinkkikarbonaattina, ZnCO 3. Sinkkiä valmistetaan sinkkivälkkeestä seuraavien vaiheiden kautta: 1. sinkkirikasteen pasutus: 2 ZnS + 3O 2 2 ZnO (s) + 2 SO 2 2. rikkihapon lisäys sinkkipasutteeseen: ZnO (s) + H 2 SO 4 Zn 2+ + SO H 2 O 3. metallisen sinkin erotus elektrolyyttisesti (a) Perustele, miksi sinkki on hyvä korroosiosuojamateriaali. (b) Selitä reaktio, joka tapahtuu yleensä metallille, kun se korrodoituu. (c) Selitä, miksi sinkkipasutteeseen lisätään rikkihappoa. (d) Esitä reaktio, joka tapahtuu sinkille elektrolyyttisessä erotuksessa. (e) Kertyykö sinkki elektrolyyttisessä erotuksessa anodille vai katodille? Perustele.
5 5 (a) Sinkki on ns. passivoituva metalli (kuten myös Al, Cr jati), joka muodostaa ollessaan ilman hapen kanssa kosketuksissa tiiviin metallioksidi-suojakerroksen. Myöhemmin siihen muodostuu edelleen sinkkioksidi-karbonaattia. (b) Se hapettuu. (c) Jotta sinkki saadaan liukoiseen Zn 2+ -muotoon (reaktio 2) (d) Zn e - Zn(s) (e) Katodille, joka on kytketty jännitelähteen miinusnapaan ja josta saadaan reaktioon tarvottavat elektronit TALOTEKNIIKKA 3. Omakotitalossa on öljylämmitys, jota kului 3750 litraa vuodessa. Oletetaan, että öljy sisältää C 18 H 38 molekyylejä (lämpöarvo on 44 MJ/kg, tiheys 0,845 kg/l). Öljy poltetaan kattilassa öljypolttimien avulla. Öljypolttimen tehtävä on hajottaa öljy pieniksi pisaroiksi tai kaasuttaa öljy. Palamisreaktiossa syntyy savukaasuja. Typen oksideja ei muodostu, sillä niitä alkaa muodostua vasta korkeissa lämpötiloissa. Palamisreaktio: C 18 H ½ O 2 18 CO H 2 O Asuntoon oli kymmeniä vuosia sitten asennettu vesipattereita ja asennuksen yhteydessä oli kiertoveteen lisätty inhibiittoreita, jotka eivät enää tehoa. Vuosien kuluessa teräksisten patterien ja putkistojen hapettumista oli tapahtunut ja sen seurauksena oli vapautunut vetykaasua. Kaasu oli noussut patterin yläosaan ja se pitää nykyisin patterin yläosan haaleana. Patterin pohjalle on puolestaan kertynyt ruostesakkaa, joka sisältää mm. korroosioreaktiossa muodostuneita erilaisia erilaisia ferro (Fe 2+ )- ja ferri (Fe 3+ )-ionien suoloja. Putkiin ja lämmityskattilaan on myös saostunut käytetyn huonolaatuisen kiertoveden vaikutuksesta ns. kattilakiveä. Remontin yhteydessä asunnon patteriverkosto puhdistetaan, kiertovesi vaihdetaan, tarkistetaan sen alkaliteetti, kovuus ja alumiini-ionipitoisuus. Lisäksi asennetaan uusia kupariputkia sekä messinkiliittimiä. (a) Laske omakotitalon tuottama hiilidioksidipäästö vuoden aikana. (b) Mitä savukaasu sisältää? (c) Selitä, miten kemialliset reaktiot etenevät palamisprosessin syttymis- ja etenemisvaiheissa. (d) Miksi typen oksideja muodostuu vain korkeissa lämpötiloissa? (e) Selitä, miksi öljy on hajotettava pieniksi pisaroiksi ennen palamista. (f) Mikä tehtävä inhibiittoreilla on kiertovedessä? (g) Selitä ja perustele, minkälainen kemiallinen sidos esiintyy vetymolekyylissä. (h) Mikä rakenteellinen ero on ferro- ja ferri-ioneilla? (i) Mitä kattilakivi on kemiallisesti? (j) Mitä vedestä tutkittava alkaliteetti kuvastaa sen laadusta? (k) Mitä tarkoittaa kova vesi? (l) Esitä alumiiniatomin valenssielektronit ja alumiini-ionin ionivaraus. (m) Selitä, mihin perustuu se, että kupariputkea voidaan asennettaessa taivutella vahingoittamatta sitä. (n) Selitä, mistä aiheutuu kuparin ja muiden metallien korkea sulamispiste. (o) Mitä on messinki?
6 6 (a) 9,9 tonnia (b) CO 2, H 2 O, N 2 ja ilmaylimäärää (typpeä ja happea) (c) Syttymisvaiheessä ensimmäiset kovalenttiset sidokset katkeavat sytytyksessä tuodun aktvoitumisenergian avulla. Tällöin muodostuu radikaaleja (parittoman, sitoutumattoman elektronin omaavia atomeja ja molekyyleejä), joilla on riittävän suuri energia uusien kovalenttisten sidosten katkaisemiseksi. Ketjureaktio etenee uusien radikaalien muodostuessa. (d) Typpimolekyylin kolminkertainen sidos on niin vahva, että palamislämpötila ei riitä sen katkaisemiseen. (e) Kun reaktion lähtöaineet ovat eri olomuodoissa, on lähtöaineiden yhteisen pintaalan oltava mahdollisimman suuri, jotta reaktio tapahtuisi mahdollisimman nopeasti. (f) Hidastaa korroosiota. (i) CaCO 3 (s) (j) Kun alkaliteetti on korkea, vesi sisältää aineita (humus, vetykarbonaatti, aluminaatti, silikaatti,fosfaatti ym), jotka kykenevät sitomaan itseensä vetyioneja ja puskuroimaan vettä happamia liuoksia vastaan. (k) Kalsium(ja magnesium)- ionipitoisuus on korkea. (m)tapahtuu dislokaatio eli metallin hilatasot liukuvat tai pyörivät toistensa suhteen. Metallisidos ei kuitenkaan katkea, vaan positiivisesti varautuneiden metalli-ionien ja liikkuvan elektronisumun välinen vetovoima säilyy. (n) Metallisidos on vahva sidos ja tarvitaan paljon energiaa sen rikkomiseen. TIETOTEKNIIKKA 4. Perinteisessä elektroniikassa käytetään monia materiaaleja: kuparia ja kultaa käytetään johdekerroksina, piitä ja galliumarsenidia (GaAs) käytetään puolijohdemateriaaleina, kuparilevyn syövytykseen voidaan käyttää ferrikloridia (FeCl 3 ), jne. Kuparilevyn syövytyksessä tapahtuva kemiallinen reaktio on:? Fe 3+ (aq) + Cu(s) +? H 2 O -> Cu 2+ (aq) + 2 Fe(OH) 2 (s) +? H + (a) Täydennä reaktioyhtälön kertoimet kysymysmerkkien kohdalle. (b) Mikä on reaktiotyyppi, joka tapahtuu kuparille sitä syövytettäessä? (c) Mihin perustuu sähkön kulku kultajohtimessa? (d) Selitä kemiallisen sidoksen avulla, miksi kulta on pehmeää ja muokattavaa. (e) Mikä on galliumin ionivaraus? Perustele. (f) Mitkä ovat kullan ja piin kemialliset merkit? (g) Selitä, miksi puhtaan piin ja galliumarsenidin rakenteet muistuttavat timantin rakennetta. (g) Timantissa hiilen neljä valenssielektronia ovat kovalenttisesti sitoutuneet neljään muuhun hiiliatomiin. Galliumarsenidissa galliumin kolme ja arseenin viisi elektronia muodostavat samanlaiset sidokset näiden atomien ympärille.
7 7 HYVINVOINTITEKNOLOGIA 5. Ihminen sisältää massastaan noin 70% vettä. Vettä on sekä solujen sisällä (intrasellulaarineste) että solujen ulkopuolella (ekstrasellulaarineste). Veteen, jota voidaan kutsua elektrolyyttiliuokseksi, on liuennut ioneina monia aineita kuten natriumia, kaliumia, kloridia, kalsiumia jne. Suurin osa elimistön kalsiumista on kuitenkin luissa. Solukalvo on pääasiassa rasvoista muodostunut. Vesiliukoinen insuliinihormoni vaikuttaa siten, että se sitoutuu solun pinnalla olevaan reseptorimolekyyliinsä (vastaanottajamolekyyli), minkä jälkeen viesti välittyy solussa eteenpäin toisten molekyylien avulla. Rasvaliukoiset steroidit kulkeutuvat itse solun sisälle, missä ne sitoutuvat omiin reseptoreihinsa. (a) Mitä voit sanoa ihmisen solun sisäisten ja ulkoisten vesiliuosten sähkönjohtavuudesta? Perustele! (b) Esitä kaliumin kemiallinen merkki (c) Perustele, miksi insuliinin reseptori sijaitsee solukalvolla, kun taas steroidien reseptorit sijaitsevat solun sisällä. (d) Mikä on kalsiumin ionivaraus? Perustele!. (e) Selitä, mihin perustuu kalsiumkloridin liukeneminen veteen? (f) Miksi luiden kalsiumfosfaatti ei liukene veteen? (g) Selitä, mihin perustuu kalsiumkloridin sulaminen? (a) Solun sisä- ja ulkopuolella on vettä ja siihen liuenneita ioneja. Molemmat voivat johtaa sähköä. (c) Insuliini on poolinen molekyyli eikä voi ilman aktiivista kuljettajamolekyyliä läpäistä poolitonta solukalvoa kuten pooliton steroidirakenteinen hormoni. Siksi insuliinin vastaanottajamolekyyli sijaitsee solukalvolla. (f) Ionisidosten vahvuus on erilainen eri ionien välillä. (g) Lämpöliike voittaa kemiallisen vetovoiman ja ionisidos katkeaa.
8 8 KONETEKNIIKKA 6. Tyypillisesti auton alustan osat ovat kuumasinkitettyjä ja auton kori sähkösinkitetty. Korissa on käytetty myös runsaasti muovisia osia. Tavallisesti polttoaineena käytetään bensiiniä tai dieseliä. Mutta esimerkiksi DaimlerChrysler on kehittänyt polttokennolla toimivia autoja, joissa voidaan käyttää polttoaineena vetyä. (a) Nimeä sähkökemiallinen kenno, joka toimii akkua käytettäessä? (b) Nimeä sähkökemiallinen kenno, joka toimii akkua ladattaessa? (c) Nimeä sähkökemiallinen kenno, joka toimii auton korin sähkösinkityksessä? (d) Selitä lyhyesti, miten sähkösinkitys suoritetaan. Piirrä, kuva, esitä kennon anodi ja katodi, plus- ja miinus-napa sekä elektronien liikesuunta. (e) Sinkityksellä pyritään hidastamaan teräksisen auton korin korroosiota. Selitä ne kemialliset reaktiot, jotka tapahtuvat, kun sinkkipintaan tulee teräkseen ulottuva naarmu. (f) Mitä muodostuu pakokaasuun, kun polttoaineena käytetään bensiiniä (C 8 H 18 )? (g) Mitä muodostuu pakokaasuun, kun polttoaineena käytetään vetyä (H 2 )? (h) Biodiesel on uusiutuva polttoaine. Miten uusiutuvien ja uusiutumattomien polttoaineiden kemialliset koostumukset eroavat toisistaan? (i) Miten auton alumiinivanteet kestävät (oletetaan käsittelemättömäksi alumiiniksi), kun pesuliuoksen ph on hyvin emäksinen. (j) Auton akun elektrodit ovat latauksen jälkeen lyijyä (Pb) ja lyijyoksidia (PbO 2 ). Selitä, mihin perustuu akun toiminta auton käynnistyksen yhteydessä. (k) Muodostuuko typen oksideja pakokaasuun käynnistyksen vai ajon aikana? Perustele.
9 9 (a) Sähköpari (b) Elektrolyysikenno (c) Elektrolyysikenno (d) Selitä lyhyesti, miten sähkösinkitys suoritetaan. Piirrä, kuva, esitä kennon anodi ja katodi, plus- ja miinus-napa sekä elektronien liikesuunta. (e) Sinkki epäjalompana korrodoituu ja reagoi hapen sekä kosteuden kanssa muodostaen Zn(OH) 2. Sinkkihydroksidi saostuu ja tukkii naarmun ja joka edelleen muuttuu tiiviiksi suojaavaksi sinkkioksidi/-karbonaattikerrokseksi (ZnCO 3 + ZnO) (h) Uusiutuvissa polttoaineissa on hiiltä, vetyä, happea ja vettä sekä pieniä määriä muita aineita. Uusiutumattomissa polttoaineissa ei ole happea eikä vettä. (j) Tarkastellaan normaalipotentiaalitaulukkoa, josta havaitaan lyijyoksidin olevan hyvä hapetin, joka riistää lyijyltä (Pb) elektroneja. (k) Typen oksideja muodostuu pakokaasuun ajon aikana eli vasta sitten, kun moottoritilassa on niin kuuma, että typpimolekyylin kolminkertainen kovalenttinen sidos katkeaa.
10 10 a. RAKENNUSTEKNIIKKA 7. Oheinen teksti on Kestopuu Oy:n kiinnitysohjeesta. (a) Perustele, miksi ohjeessa kielletään laittamasta eri metallista valmistettuja kiinnikkeitä kosketuksiin toistensa kanssa. Esitä reaktiot, mitä tapahtuu, kun kuparinaulaa on käytetty kuumasinkityn teräslevyn kiinnittämiseen puuhun. (b) Mikä on arseenin kemiallinen merkki? (c) Selitä kemiallisten sidosten avulla, mihin perustuu se, että hakattaessa naula vääntyy eikä murru. (d) Vertaa kuparinaulan ja sinkitetyn teräsnaulan korroosiokestävyyttä happamissa ja hapettomissa olosuhteissa. (e) Perustele, miksi betoniin ei voi kiinnittää sinkki- tai kuparikiinnikkeitä, mutta voi asettaa rautaisia kiinnikkeitä. (f) Perustele, miksi puunkyllästysaineen kuparisuolat syövyttävät sinkin nopeasti. (g) Perustele, miten kova vesi vaikuttaisi sinkitettyyn naulaan. (h) Perustele, miksi puu kostuu helposti.
11 11 (a) Epäjalompi metalli eli sinkki hapettuu ja elektronit virtaavat jalomman kuparin pinnalle. Kuparin pinnalla veteen liuennut happi ottaa elektronit vastaan ja reagoi veden kanssa. On huomattava, että atomimuotoinen jalompi metalli ei ota elektroneja vastaan. Muodostuu sähköpari, jossa sinkkilevy on anodi ja kuparinaula on katodi. Kysymyksessä on galvaaninen korroosio. (d) Tulos luetaan Pourbaix-diagrammista, missä y-akseli voidaan arkielämässä ajatella happipitoisuudeksi. (e) Betonin ph vaihtelee, mutta voi olla yli 13. vastaus luettavissa Pourbaixdiagrammeista. (f) Jalomman kuparin Cu 2+ -ionit voivat hapettaa atomimuotoisen sinkin. (g) Kovan veden Ca2+ - ionit eivät epäjalompina vaikuta atomimuotoiseen sinkkiin. (h) Puussa oleva selluloosan pooliset OH-ryhmät vetävät puoleensa polista vettä.
12 12 9. Yksityisiä kaivoja on maassamme noin Kaivoveden tulee olla terveydelle vaaratonta. Porakaivojen vesissä voi olla suuria pitoisuuksia mm. rautaa, mangaania, nitraatteja, fluoridia, radioaktiivista radonia ( 222 Rn) jne. Jos porakaivo on puhkaistu merenrannan läheisyydessä makean pohjavesikerroksen läpi suolaisen veden kerrokseen, voi vedessä olla myös natriumkloridia. Jos ph on alhainen ja vesi on pehmeää, on vaarana että vesi syövyttää metalliputkia ja muita järjestelmään kuuluvia metalliosia kuten messinkisiä liittimiä. (a) Mitkä ovat fluorin ja mangaanin kemialliset merkit? (b) Mitä alhainen ph kuvastaa veden laadusta? (c) Miten nitraatti (NO - 3 ) vaikuttaa rauta- tai kupariputkiin? (d) Talousveden laatua seurattaessa mitataan sen sähkönjohtavuutta. Mitä se kuvastaa veden laadusta? (e) Selitä molekyylitasolla, miksi veden kiehumispiste on korkea. (f) Mitä arvioisit radonin kemiallisesta reaktiivisuudesta? Perustele. (g) Mikä on radiumin ionivaraus sen muodostaessa kemiallisia yhdisteitä? Perustele. (h) Selitä, miten radon muodostuu radiumista ( 226 Ra) uraanin hajoamissarjassa: 226 Ra 222 Rn (c) NO 3 - on vahva hapetin ja kykenee hapettamaan sekä rauta-että kupariatomin. (d) Vesiliuoksessa ionit toimivat sähkön kuljettajina. Hyvä veden sähkönjohtavuus aiheutuu ionimuotoisten epäpuhtauksien suuresta pitoisuudesta. (e) Nestemäisessä vedessä vesimolekyylien välillä muodostuu ja katkeaa vetysidoksia koko ajan. Vetysidos on vahva ja tarvitaan runsaasti sen katkaisemiseksi kokonaan. (f) Radon on oktetissa eli energiaminimissä, minkä vuoksi se ei reagoi helposti. (h) Järjestysluku pienenee kahdella ja massaluku neljallä: radiumista poistuu alfahiukkanen eli 2 protonia ja 2 neutronia.
Workshop: Tekniikan kemia OAMK:ssa
 1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU 2012 Workshop: Tekniikan kemia OAMK:ssa Miksi betonissa rauta ruostuu ulkopuolelta ja puussa sisäpuolelta? Rautatanko betonissa:
1 Oulun seudun ammattikorkeakoulu Kemian opetuksen päivät Tekniikan yksikkö OULU 2012 Workshop: Tekniikan kemia OAMK:ssa Miksi betonissa rauta ruostuu ulkopuolelta ja puussa sisäpuolelta? Rautatanko betonissa:
1. Malmista metalliksi
 1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
1. Malmista metalliksi Metallit esiintyvät maaperässä yhdisteinä, mineraaleina Malmiksi sanotaan kiviainesta, joka sisältää jotakin hyödyllistä metallia niin paljon, että sen erottaminen on taloudellisesti
Käsitteitä. Hapetusluku = kuvitteellinen varaus, jonka atomi saa elektronin siirtyessä
 Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Sähkökemia Nopea kertaus! Mitä seuraavat käsitteet tarkoittivatkaan? a) Hapettuminen b) Pelkistyminen c) Hapetusluku d) Elektrolyytti e) Epäjalometalli f) Jalometalli Käsitteitä Hapettuminen = elektronin
Metallien ominaisuudet ja rakenne
 Metallien Kemia 25 Metallien ominaisuudet ja rakenne Metallit ovat käyttökelpoisia materiaaleja. Niiden ominaisuudet johtuvat metallin rakennetta koossa pitävästä metallisidoksesta. Metalleja käytetään
Metallien Kemia 25 Metallien ominaisuudet ja rakenne Metallit ovat käyttökelpoisia materiaaleja. Niiden ominaisuudet johtuvat metallin rakennetta koossa pitävästä metallisidoksesta. Metalleja käytetään
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Sähkökemia. Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali
 Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
Sähkökemia Sähkökemiallinen jännitesarja, galvaaninen kenno, normaalipotentiaali Esimerkki 1 Pohdi kertauksen vuoksi seuraavia käsitteitä a) Hapettuminen b) Pelkistin c) Hapetusluku d) Elektrolyytti e)
Johdantoa. Kemia on elektronien liikkumista/siirtymistä. Miksi?
 Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
Mitä on kemia? Johdantoa REAKTIOT JA ENERGIA, KE3 Kemia on elektronien liikkumista/siirtymistä. Miksi? Kaikissa kemiallisissa reaktioissa tapahtuu energian muutoksia, jotka liittyvät vanhojen sidosten
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Vesi. Pintajännityksen Veden suuremman tiheyden nesteenä kuin kiinteänä aineena Korkean kiehumispisteen
 Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
Vesi Hyvin poolisten vesimolekyylien välille muodostuu vetysidoksia, jotka ovat vahvimpia molekyylien välille syntyviä sidoksia. Vetysidos on sähköistä vetovoimaa, ei kovalenttinen sidos. Vesi Vetysidos
NIMI: Luokka: c) Atomin varaukseton hiukkanen on nimeltään i) protoni ii) neutroni iii) elektroni
 Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Peruskoulun kemian valtakunnallinen koe 2010-2011 NIMI: Luokka: 1. Ympyröi oikea vaihtoehto. a) Ruokasuolan kemiallinen kaava on i) CaOH ii) NaCl iii) KCl b) Natriumhydroksidi on i) emäksinen aine, jonka
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
luku2 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen
 Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
Kappale 2 Hapettumis pelkistymisreaktioiden ennustaminen ja tasapainottaminen 1 Ennakkokysymyksiä 2 Metallien reaktioita ja jännitesarja Fe(s) + CuSO 4 (aq) Cu(s) + AgNO 3 (aq) taulukkokirja s.155 3 Metallien
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet
 Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Kemiallisia reaktioita ympärillämme Fysiikan ja kemian pedagogiikan perusteet Kari Sormunen Syksy 2014 Kemiallinen reaktio Kemiallinen reaktio on prosessi, jossa aineet muuttuvat toisiksi aineiksi: atomien
Jaksollinen järjestelmä
 Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
Jaksollinen järjestelmä (a) Mikä on hiilen järjestysluku? (b) Mikä alkuaine kuuluu 15:een ryhmään ja toiseen jaksoon? (c) Montako protonia on berylliumilla? (d) Montako elektronia on hapella? (e) Montako
a) Puhdas aine ja seos b) Vahva happo Syövyttävä happo c) Emäs Emäksinen vesiliuos d) Amorfinen aine Kiteisen aineen
 1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
1. a) Puhdas aine ja seos Puhdas aine on joko alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi on liuos, ilma taas kaasuseos
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
AKKU- JA PARISTOTEKNIIKAT
 AKKU- JA PARISTOTEKNIIKAT H.Honkanen Kemiallisessa sähköparissa ( = paristossa ) ylempänä oleva, eli negatiivisempi, metalli syöpyy liuokseen. Akussa ei elektrodi syövy pois, vaan esimerkiksi lyijyakkua
AKKU- JA PARISTOTEKNIIKAT H.Honkanen Kemiallisessa sähköparissa ( = paristossa ) ylempänä oleva, eli negatiivisempi, metalli syöpyy liuokseen. Akussa ei elektrodi syövy pois, vaan esimerkiksi lyijyakkua
Normaalipotentiaalit
 Normaalipotentiaalit MATERIAALIT JA TEKNOLOGIA, KE4 Yksittäisen elektrodin aiheuttaman jännitteen mittaaminen ei onnistu. Jännitemittareilla voidaan havaita ja mitata vain kahden elektrodin välinen potentiaaliero
Normaalipotentiaalit MATERIAALIT JA TEKNOLOGIA, KE4 Yksittäisen elektrodin aiheuttaman jännitteen mittaaminen ei onnistu. Jännitemittareilla voidaan havaita ja mitata vain kahden elektrodin välinen potentiaaliero
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 9 Sisältö ja oppimistavoitteet Johdanto sähkökemiaan Hapetusluvun ymmärtäminen Hapetus-pelkistys reaktioiden kirjoittaminen 2 Hapetusluku
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Liuos voi olla hapan, emäksinen tai neutraali
 Hapot ja emäkset 19 Liuos voi olla hapan, emäksinen tai neutraali happamuuden aiheuttavat oksoniumionit Monet marjat, hedelmät ja esimerkiksi piimä maistuvat happamilta. Happamuus seuraa siitä kun happo
Hapot ja emäkset 19 Liuos voi olla hapan, emäksinen tai neutraali happamuuden aiheuttavat oksoniumionit Monet marjat, hedelmät ja esimerkiksi piimä maistuvat happamilta. Happamuus seuraa siitä kun happo
Elektrolyysi Anodilla tapahtuu aina hapettuminen ja katodilla pelkistyminen!
 Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
Elektrolyysi MATERIAALIT JA TEKNOLOGIA, KE4 Monet kemialliset reaktiot ovat palautuvia eli reversiibeleitä. Jo sähkökemian syntyvaiheessa oivallettiin, että on mahdollista rakentaa kahdenlaisia sähkökemiallisia
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
Ohjeita opetukseen ja odotettavissa olevat tulokset
 Ohjeita opetukseen ja odotettavissa olevat tulokset Ensimmäinen sivu on työskentelyyn orientoiva johdatteluvaihe, jossa annetaan jotain tietoja ongelmista, joita happamat sateet aiheuttavat. Lisäksi esitetään
Ohjeita opetukseen ja odotettavissa olevat tulokset Ensimmäinen sivu on työskentelyyn orientoiva johdatteluvaihe, jossa annetaan jotain tietoja ongelmista, joita happamat sateet aiheuttavat. Lisäksi esitetään
2.1 Sähköä kemiallisesta energiasta
 2.1 Sähköä kemiallisesta energiasta Monet hapettumis ja pelkistymisreaktioista on spontaaneja, jolloin elektronien siirtyminen tapahtuu itsestään. Koska reaktio on spontaani, vapautuu siinä energiaa, yleensä
2.1 Sähköä kemiallisesta energiasta Monet hapettumis ja pelkistymisreaktioista on spontaaneja, jolloin elektronien siirtyminen tapahtuu itsestään. Koska reaktio on spontaani, vapautuu siinä energiaa, yleensä
1. a) Selitä kemian käsitteet lyhyesti muutamalla sanalla ja/tai piirrä kuva ja/tai kirjoita kaava/symboli.
 Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Kemian kurssikoe, Ke1 Kemiaa kaikkialla RATKAISUT Maanantai 14.11.2016 VASTAA TEHTÄVÄÄN 1 JA KOLMEEN TEHTÄVÄÄN TEHTÄVISTÄ 2 6! Tee marinaalit joka sivulle. Sievin lukio 1. a) Selitä kemian käsitteet lyhyesti
Hapetus-pelkistymisreaktioiden tasapainottaminen
 Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Hapetus-pelkistymisreaktioiden tasapainottaminen hapetuslukumenetelmällä MATERIAALIT JA TEKNO- LOGIA, KE4 Palataan hetkeksi 2.- ja 3.-kurssin asioihin ja tarkastellaan hapetus-pelkistymisreaktioiden tasapainottamista.
Sähkökemiaa. Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio
 Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio Hapettuminen ja pelkistyminen 1. Hapetin ja pelkistin 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi
Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Faradayn laki Korroosio Hapettuminen ja pelkistyminen 1. Hapetin ja pelkistin 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi
Reaktioyhtälö. Sähköisen oppimisen edelläkävijä www.e-oppi.fi. Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava
 Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Reaktioyhtälö Sähköisen oppimisen edelläkävijä www.e-oppi.fi Empiirinen kaava, molekyylikaava, rakennekaava, viivakaava Empiirinen kaava (suhdekaava) ilmoittaa, missä suhteessa yhdiste sisältää eri alkuaineiden
Sukunimi: Etunimi: Henkilötunnus:
 K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
K1. Onko väittämä oikein vai väärin. Oikeasta väittämästä saa 0,5 pistettä. Vastaamatta jättämisestä tai väärästä vastauksesta ei vähennetä pisteitä. (yhteensä 10 p) Oikein Väärin 1. Kaikki metallit johtavat
REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos
 ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
ATOMIN JA IONIN KOKO
 ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
ATOMIN JA IONIN KOKO MATERIAALIT JA TEKNOLOGIA, KE4 Alkuaineen sijainti jaksollisessa järjestelmässä ja koko (atomisäde ja ionisäde) helpottavat ennustamaan kuinka helposti ja miten ko. alkuaine reagoi
Kemian opiskelun avuksi
 Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
Kemian opiskelun avuksi Ilona Kuukka Mukana: Petri Järvinen Matti Koski Euroopan Unionin Kotouttamisrahasto osallistuu hankkeen rahoittamiseen. AINE JA ENERGIA Aine aine, nominatiivi ainetta, partitiivi
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
KE2 Kemian mikromaailma 1. huhtikuuta 2015/S.. Tässä kokeessa ei ole aprillipiloja. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Tehtävät arvostellaan asteikolla 0 6. Joissakin tehtävissä
Reaktiosarjat
 Reaktiosarjat Usein haluttua tuotetta ei saada syntymään yhden kemiallisen reaktion lopputuotteena, vaan monen peräkkäisten reaktioiden kautta Tällöin edellisen reaktion lopputuote on seuraavan lähtöaine
Reaktiosarjat Usein haluttua tuotetta ei saada syntymään yhden kemiallisen reaktion lopputuotteena, vaan monen peräkkäisten reaktioiden kautta Tällöin edellisen reaktion lopputuote on seuraavan lähtöaine
Käytännön esimerkkejä on lukuisia.
 PROSESSI- JA Y MPÄRISTÖTEKNIIK KA Ilmiömallinnus prosessimet allurgiassa, 01 6 Teema 4 Tehtävien ratkaisut 15.9.016 SÄHKÖKEMIALLISTEN REAKTIOIDEN TERMODYNAMIIKKA JA KINETIIKKA Yleistä Tämä dokumentti sisältää
PROSESSI- JA Y MPÄRISTÖTEKNIIK KA Ilmiömallinnus prosessimet allurgiassa, 01 6 Teema 4 Tehtävien ratkaisut 15.9.016 SÄHKÖKEMIALLISTEN REAKTIOIDEN TERMODYNAMIIKKA JA KINETIIKKA Yleistä Tämä dokumentti sisältää
b) Reaktio Zn(s) + 2 Ag + (aq) Zn 2+ (aq) + 2 Ag (s) tapahtuu galvaanisessa kennossa. Kirjoita kennokaavio eli kennon lyhennetty esitys.
 KE4-KURSSIN KOE Kastellin lukio 2013 Vastaa kuuteen (6) kysymykseen. Tee pisteytysruudukko. 1. Tarkastele jaksollista järjestelmää ja valitse siitä a) jokin jalometalli. b) jokin alkuaine, joka reagoi
KE4-KURSSIN KOE Kastellin lukio 2013 Vastaa kuuteen (6) kysymykseen. Tee pisteytysruudukko. 1. Tarkastele jaksollista järjestelmää ja valitse siitä a) jokin jalometalli. b) jokin alkuaine, joka reagoi
YLEINEN KEMIA. Alkuaineiden esiintyminen maailmassa. Alkuaineet. Alkuaineet koostuvat atomeista. Atomin rakenne. Copyright Isto Jokinen
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
Helsingin yliopiston kemian valintakoe. Keskiviikkona klo Vastausselvitykset: Tehtävät:
 1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
1 elsingin yliopiston kemian valintakoe Keskiviikkona 9.5.2018 klo 10-13. Vastausselvitykset: Tehtävät: 1. Kirjoita seuraavat reaktioyhtälöt olomuotomerkinnöin: a. Sinkkipulveria lisätään kuparisulfaattiliuokseen.
Kaikki ympärillämme oleva aine koostuu alkuaineista.
 YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
YLEINEN KEMIA Yleinen kemia käsittelee kemian perusasioita kuten aineen rakennetta, alkuaineiden jaksollista järjestelmää, kemian peruskäsitteitä ja kemiallisia reaktioita. Alkuaineet Kaikki ympärillämme
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
Sähkökemiaa. Hapettuminen Jännitesarja Elektrolyysi Korroosio
 Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Korroosio Hapettuminen ja pelkistyminen 1. Määritelmät 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi ja sen sovelluksia
Sähkökemiaa Hapettuminen Jännitesarja Elektrolyysi Korroosio Hapettuminen ja pelkistyminen 1. Määritelmät 2. Hapetusluku Sähkökemiaa 1. Sähköpari 2. Metallien jännitesarja 3. Elektrolyysi ja sen sovelluksia
(Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen)
 KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
KE2-kurssi: Kemian mikromaalima Osio 1 (Huom! Oikeita vastauksia voi olla useita ja oikeasta vastauksesta saa yhden pisteen) Monivalintatehtäviä 1. Etsi seuraavasta aineryhmästä: ioniyhdiste molekyyliyhdiste
Hapettuminen ja pelkistyminen: RedOx -reaktiot. CHEM-A1250 Luento
 Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
Hapettuminen ja pelkistyminen: RedOx -reaktiot CHEM-A1250 Luento 5 25.1.2017 Hapettuminen ja pelkistyminen Alun perin hapettumisella tarkoitettiin aineen yhtymistä happeen l. palamista: 2 Cu + O 2 -> 2
KEMIAN MIKROMAAILMA, KE2 VESI
 VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
VESI KEMIAN MIKROMAAILMA, KE2 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä poikkeuksellisen
VESI JA VESILIUOKSET
 VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
VESI JA VESILIUOKSET KEMIAA KAIKKIALLA, KE1 Johdantoa: Vesi on elämälle välttämätöntä. Se on hyvä liuotin, energian ja aineiden siirtäjä, lämmönsäätelijä ja se muodostaa vetysidoksia, jotka tekevät siitä
MUUTOKSET ELEKTRONI- RAKENTEESSA
 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Kemian opetuksen keskus Helsingin yliopisto Veden kovuus Oppilaan ohje. Veden kovuus
 Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
Huomaat, että vedenkeittimessäsi on valkoinen saostuma. Päättelet, että saostuma on peräisin vedestä. Haluat varmistaa, että vettä on turvallista juoda ja viet sitä tutkittavaksi laboratorioon. Laboratoriossa
EPÄORGAANINEN KEMIA HARJOITUKSIA. Jaksollinen järjestelmä
 EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
EPÄORGAANINEN KEMIA HARJOITUKSIA Jaksollinen järjestelmä Mitkä alkuaineet ovat oheisesta jaksollisesta järjestelmästä peitetyt A ja B? Mitkä ovat A:n ja B:n muodostamien kloridien stoikiometriat? Jos alkuaineita
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Jännittävät metallit
 Jännittävät metallit Tästä alkaa tutkimusmatkamme sähkön syntymiseen! Varmaan tiedätkin, että sähköä saadaan sekä pistorasioista että erilaisista paristoista. Pistorasioista saatava sähkö tuotetaan fysikaalisesti,
Jännittävät metallit Tästä alkaa tutkimusmatkamme sähkön syntymiseen! Varmaan tiedätkin, että sähköä saadaan sekä pistorasioista että erilaisista paristoista. Pistorasioista saatava sähkö tuotetaan fysikaalisesti,
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013. a) K ja Cl IONISIDOS, KOSKA KALIUM ON METALLI JA KLOORI EPÄMETALLI.
 KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
KE1 KERTAUSTA SIDOKSISTA VASTAUKSET 2013 Atomien väliset VAVAT sidokset: Molekyylien väliset EIKOT sidokset: 1. IOISIDOS 1. DISPERSIOVOIMAT 2. KOVALETTIE SIDOS 2. DIPOLI-DIPOLISIDOS 3. METALLISIDOS 3.
Kertaus. Tehtävä: Kumpi reagoi kiivaammin kaliumin kanssa, fluori vai kloori? Perustele.
 Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Kertaus 1. Atomin elektronirakenteet ja jaksollinen järjestelmä kvanttimekaaninen atomimalli, atomiorbitaalit virittyminen, ionisoituminen, liekkikokeet jaksollisen järjestelmän rakentuminen alkuaineiden
Törmäysteoria. Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa
 Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
Törmäysteoria Törmäysteorian mukaan kemiallinen reaktio tapahtuu, jos reagoivat hiukkaset törmäävät toisiinsa tarpeeksi suurella voimalla ja oikeasta suunnasta. 1 Eksotermisen reaktion energiakaavio E
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta Insinöörivalinnan kemian koe MALLIRATKAISUT
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT 1 a) Vaihtoehto B on oikein. Elektronit sijoittuvat atomiorbitaaleille kasvavan
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT 1 a) Vaihtoehto B on oikein. Elektronit sijoittuvat atomiorbitaaleille kasvavan
Sähkökemian perusteita, osa 1
 Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Sähkökemian perusteita, osa 1 Ilmiömallinnus prosessimetallurgiassa Syksy 2015 Teema 4 - Luento 1 Teema 4: Suoritustapana oppimispäiväkirja Tehdään yksin tai pareittain Tehtävät/ohjeet löytyvät kurssin
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Lukion kemiakilpailu
 MAL ry Lukion kemiakilpailu/avoinsarja Nimi: Lukion kemiakilpailu 11.11.010 Avoin sarja Kaikkiin tehtäviin vastataan. Aikaa on 100 minuuttia. Sallitut apuvälineet ovat laskin ja taulukot. Tehtävät suoritetaan
MAL ry Lukion kemiakilpailu/avoinsarja Nimi: Lukion kemiakilpailu 11.11.010 Avoin sarja Kaikkiin tehtäviin vastataan. Aikaa on 100 minuuttia. Sallitut apuvälineet ovat laskin ja taulukot. Tehtävät suoritetaan
c) Tasapainota seuraava happamassa liuoksessa tapahtuva hapetus-pelkistysreaktio:
 HTKK, TTY, LTY, OY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 26.05.2004 1. a) Kun natriumfosfaatin (Na 3 PO 4 ) ja kalsiumkloridin (CaCl 2 ) vesiliuokset sekoitetaan keske- nään, muodostuu
HTKK, TTY, LTY, OY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 26.05.2004 1. a) Kun natriumfosfaatin (Na 3 PO 4 ) ja kalsiumkloridin (CaCl 2 ) vesiliuokset sekoitetaan keske- nään, muodostuu
TKK, TTY, LTY, OY, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 31.5.2006
 TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
TKK, TTY, LTY, Y, TY, VY, ÅA / Insinööriosastot Valintakuulustelujen kemian koe 1.5.006 1. Uraanimetallin valmistus puhdistetusta uraanidioksidimalmista koostuu seuraavista reaktiovaiheista: (1) U (s)
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
KE2 Kemian mikromaailma
 KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
KE2 Kemian mikromaailma 30. maaliskuuta 2017/S.H. Vastaa viiteen tehtävään. Käytä tarvittaessa apuna taulukkokirjaa. Kopioi vastauspaperisi ensimmäisen sivun ylälaitaan seuraava taulukko. Kokeen pisteet
Atomi. Aineen perusyksikkö
 Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Atomi Aineen perusyksikkö Aine koostuu molekyyleistä, atomeista tai ioneista Yhdiste on aine joka koostuu kahdesta tai useammasta erilaisesta atomista tai ionista molekyylit rakentuvat atomeista Atomit
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2 1/2 p = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 014 Insinöörivalinnan kemian koe 8.5.014 MALLIRATKAISUT ja PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu
Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei korotettu ylöspäin, esim. 2½ p. = 2 p.
 Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT JA PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei
Diplomi-insinöörien ja arkkitehtien yhteisvalinta dia-valinta 2015 Insinöörivalinnan kemian koe 27.5.2015 MALLIRATKAISUT JA PISTEET Lasku- ja huolimattomuusvirheet ½ p. Loppupisteiden puolia pisteitä ei
KEMIA HYVÄN VASTAUKSEN PIIRTEET
 BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
BILÄÄKETIETEEN enkilötunnus: - KULUTUSJELMA Sukunimi: 20.5.2015 Etunimet: Nimikirjoitus: KEMIA Kuulustelu klo 9.00-13.00 YVÄN VASTAUKSEN PIIRTEET Tehtävämonisteen tehtäviin vastataan erilliselle vastausmonisteelle.
MOOLIMASSA. Vedyllä on yksi atomi, joten Vedyn moolimassa M(H) = 1* g/mol = g/mol. ATOMIMASSAT TAULUKKO
 MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
MOOLIMASSA Moolimassan symboli on M ja yksikkö g/mol. Yksikkö ilmoittaa kuinka monta grammaa on yksi mooli. Moolimassa on yhden moolin massa, joka lasketaan suhteellisten atomimassojen avulla (ATOMIMASSAT
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET
 HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
HEIKOT VUOROVAIKUTUKSET MOLEKYYLIEN VÄLISET SIDOKSET Tunnin sisältö 2. Heikot vuorovaikutukset Millaisia erilaisia? Missä esiintyvät? Biologinen/lääketieteellinen merkitys Heikot sidokset Dipoli-dipolisidos
Luku 3. Protolyysireaktiot ja vesiliuoksen ph
 Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
Luku 3 Protolyysireaktiot ja vesiliuoksen ph 1 MIKÄ ALKUAINE? Se ei ole metalli, kuten alkalimetallit, se ei ole jalokaasu, vaikka onkin kaasu. Kevein, väritön, mauton, hajuton, maailmankaikkeuden yleisin
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Osio 1. Laskutehtävät
 Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Osio 1. Laskutehtävät Nämä palautetaan osion1 palautuslaatikkoon. Aihe 1 Alkuaineiden suhteelliset osuudet yhdisteessä Tehtävä 1 (Alkuaineiden suhteelliset osuudet yhdisteessä) Tarvitset tehtävään atomipainotaulukkoa,
Tehtäviä sähkökemiasta
 Tehtäviä sähkökemiasta 1. Millainen on sähkökemiallinen jännitesarja? Mitä sen avulla voidaan kuvata? Jännitesarjalla kuvataan metallien taipumusta muodostaa kemiallisia yhdisteitä. Metallit on järjestetty
Tehtäviä sähkökemiasta 1. Millainen on sähkökemiallinen jännitesarja? Mitä sen avulla voidaan kuvata? Jännitesarjalla kuvataan metallien taipumusta muodostaa kemiallisia yhdisteitä. Metallit on järjestetty
c) Nimeä kaksi alkuainetta, jotka kuuluvat jaksollisessa järjestelmässä samaan ryhmään kalsiumin kanssa.
 Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kurssikoe KE1.2, Ihmisen ja elinympäristön kemia, ke 6.4. 2016 Vastaa vain kuuteen tehtävään. Jokaisessa tehtävässä maksimi pistemäärä on kuusi pistettä (paitsi tehtävässä 7 seitsemän pistettä). Voit vapaasti
Kemian tehtävien vastaukset ja selitykset Lääketieteen ilmainen harjoituskoe, kevät 2017
 Kemian tehtävien vastaukset ja selitykset Lääketieteen ilmainen harjoituskoe, kevät 2017 Alla on esitetty vastaukset monivalintaväittämiin ja lyhyet perustelut oikeille väittämille. Tehtävä 3 A 2 B 5,8
Kemian tehtävien vastaukset ja selitykset Lääketieteen ilmainen harjoituskoe, kevät 2017 Alla on esitetty vastaukset monivalintaväittämiin ja lyhyet perustelut oikeille väittämille. Tehtävä 3 A 2 B 5,8
Lkm keski- maksimi Lkm keski- maksimi. Lkm keski- maksimi Lkm keski- maksimi
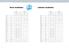 Firan vesilaitos Lahelan vesilaitos Lämpötila C 12 9,5 14,4 12 7,9 8,5 ph-luku 12 6,6 6,7 12 8,0 8,1 Alkaliteetti mmol/l 12 0,5 0,5 12 1,1 1,1 Happi mg/l 12 4,2 5,3 12 11,5 13,2 Hiilidioksidi mg/l 12 21
Firan vesilaitos Lahelan vesilaitos Lämpötila C 12 9,5 14,4 12 7,9 8,5 ph-luku 12 6,6 6,7 12 8,0 8,1 Alkaliteetti mmol/l 12 0,5 0,5 12 1,1 1,1 Happi mg/l 12 4,2 5,3 12 11,5 13,2 Hiilidioksidi mg/l 12 21
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus
 Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
Mamk / Tekniikka ja liikenne / Sähkövoimatekniikka / Sarvelainen 2015 T8415SJ ENERGIATEKNIIKKA Laskuharjoitus KEMIALLISIIN REAKTIOIHIN PERUSTUVA POLTTOAINEEN PALAMINEN Voimalaitoksessa käytetään polttoaineena
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017
 CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
CHEM-C2210 Alkuainekemia ja epäorgaanisten materiaalien synteesi ja karakterisointi (5 op), kevät 2017 Tenttikysymysten aihealueita eli esimerkkejä mistä aihealueista ja minkä tyyppisiä tehtäviä kokeessa
Kemia s2011 ratkaisuja. Kemian koe s 2011 lyhennettyjä ratkaisuja
 Kemian koe s 2011 lyhennettyjä ratkaisuja 1. a) Veden autoprotolyysin 2H 2 O(l) H 3 O + (aq) + OH (aq) seurauksena vedessä on pieni määrä OH ja H 3 O + ioneja, jotka toimivat varauksen kuljettajina. Jos
Kemian koe s 2011 lyhennettyjä ratkaisuja 1. a) Veden autoprotolyysin 2H 2 O(l) H 3 O + (aq) + OH (aq) seurauksena vedessä on pieni määrä OH ja H 3 O + ioneja, jotka toimivat varauksen kuljettajina. Jos
Tehtävä 2. Selvitä, ovatko seuraavat kovalenttiset sidokset poolisia vai poolittomia. Jos sidos on poolinen, merkitse osittaisvaraukset näkyviin.
 KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
KERTAUSKOE, KE1, SYKSY 2013, VIE Tehtävä 1. Kirjoita kemiallisia kaavoja ja olomuodon symboleja käyttäen seuraavat olomuodon muutokset a) etanolin CH 3 CH 2 OH höyrystyminen b) salmiakin NH 4 Cl sublimoituminen
Firan vesilaitos. Laitosanalyysit. Lkm keski- maksimi Lkm keski- maksimi
 Laitosanalyysit Firan vesilaitos Lämpötila C 3 8,3 8,4 4 8,4 9 ph-luku 3 6,5 6,5 4 7,9 8,1 Alkaliteetti mmol/l 3 0,53 0,59 4 1 1,1 Happi 3 2,8 4 4 11,4 11,7 Hiilidioksidi 3 23,7 25 4 1 1,9 Rauta Fe 3
Laitosanalyysit Firan vesilaitos Lämpötila C 3 8,3 8,4 4 8,4 9 ph-luku 3 6,5 6,5 4 7,9 8,1 Alkaliteetti mmol/l 3 0,53 0,59 4 1 1,1 Happi 3 2,8 4 4 11,4 11,7 Hiilidioksidi 3 23,7 25 4 1 1,9 Rauta Fe 3
17VV VV Veden lämpötila 14,2 12,7 14,2 13,9 C Esikäsittely, suodatus (0,45 µm) ok ok ok ok L. ph 7,1 6,9 7,1 7,1 RA2000¹ L
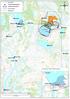 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, elokuu Näytteenottopvm: 22.8.2017 Näyte saapui: 23.8.2017 Näytteenottaja: Eerikki Tervo Analysointi
17VV VV 01021
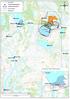 Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
Pvm: 4.5.2017 1/5 Boliden Kevitsa Mining Oy Kevitsantie 730 99670 PETKULA Tutkimuksen nimi: Kevitsan vesistötarkkailu 2017, huhtikuu Näytteenottopvm: 4.4.2017 Näyte saapui: 6.4.2017 Näytteenottaja: Mika
HEIKOT SIDOKSET. Heikot sidokset ovat rakenneosasten välisiä sidoksia.
 HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
HEIKOT SIDOKSET KEMIAN MIKRO- MAAILMA, KE2 Palautetaan mieleen (on tärkeää ymmärtää ero sisäisten ja ulkoisten voimien välillä): Vahvat sidokset ovat rakenneosasten sisäisiä sidoksia. Heikot sidokset ovat
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe
 Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian koe kurssi KE5 Reaktiot ja tasapaino koe 1.4.017 Tee kuusi tehtävää. 1. Tämä tehtävä koostuu kuudesta monivalintaosiosta, joista jokaiseen on yksi oikea vastausvaihtoehto. Kirjaa vastaukseksi numero-kirjainyhdistelmä
Kemian tentti 2017 / RATKAISUT
 Kemian tentti 2017 / RATKAISUT 1. Tunnista seuraavat alkuaineet a) Metallin oksidi on muotoa XO. Metalli värjää liekin tiilenpunaiseksi ja sen yhdisteet ovat käytännön elämässä varsin merkittäviä. b) Aineen
Kemian tentti 2017 / RATKAISUT 1. Tunnista seuraavat alkuaineet a) Metallin oksidi on muotoa XO. Metalli värjää liekin tiilenpunaiseksi ja sen yhdisteet ovat käytännön elämässä varsin merkittäviä. b) Aineen
Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta.
 Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Helsingin yliopiston kemian valintakoe 10.5.2019 Vastaukset ja selitykset Tehtävä 1. Avaruussukkulan kiihdytysvaiheen kiinteänä polttoaineena käytetään ammonium- perkloraatin ja alumiinin seosta. Reaktio
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille
 Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 22.1.2015 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
Fysiikan, kemian ja matematiikan kilpailu lukiolaisille 22.1.2015 Kemian tehtävät Kirjoita nimesi, luokkasi ja lukiosi tähän tehtäväpaperiin. Kirjoita vastauksesi selkeällä käsialalla tehtäväpaperiin vastauksille
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA
 MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
MITÄ SIDOKSILLE TAPAHTUU KEMIALLISESSA REAKTIOSSA REAKTIOT JA ENERGIA, KE3 Kaikissa kemiallisissa reaktioissa atomit törmäilevät toisiinsa siten, että sekä atomit että sidoselektronit järjestyvät uudelleen.
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko klo 8-10
 Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
