VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Minitran 5 mg/24 tuntia depotlaastari Minitran 10 mg/24 tuntia depotlaastari
|
|
|
- Toivo Sariola
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 1. LÄÄKEVALMISTEEN NIMI Minitran 5 mg/24 tuntia depotlaastari Minitran 10 mg/24 tuntia depotlaastari VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Minitran 5 mg -laastarin pinta-ala on 6,7 cm 2, ja laastari sisältää 18 mg glyseryylitrinitraattia, jota vapautuu keskimäärin 5 mg vuorokaudessa. Minitran 10 mg -laastarin pinta-ala on 13,3 cm 2, ja laastari sisältää 36 mg glyseryylitrinitraattia, jota vapautuu keskimäärin 10 mg vuorokaudessa. Täydellinen apuaineluettelo, ks. kohta LÄÄKEMUOTO Depotlaastari Minitran-depotlaastari on transdermaalinen järjestelmä, joka koostuu ohuesta, läpinäkyvästä huokoisesta polyetyleenikalvosta ja glyseryylitrinitraattia sisältävästä matriksista. Rakenteeltaan kolmiosainen matriksi säätelee vaikuttavan aineen vapautumisnopeutta. 4. KLIINISET TIEDOT 4.1. Käyttöaiheet Angina pectoris -kohtausten ehkäiseminen joko yksin tai yhdistettynä muuhun antianginaaliseen lääkehoitoon. Lisäksi Minitran 5 mg/24 tuntia -depotlaastaria voidaan käyttää laskimon aukipitämiseen perifeerisissä infuusiokohdissa Annostus ja antotapa Annostus Angina pectoris -kohtausten ehkäisy Hoitovaste on yksilöllinen ja kussakin tapauksessa tulee määrittää pienin tehokas annos. Suositellaan, että hoito aloitetaan yhdellä Minitran 5 mg/24 tuntia -depotlaastarilla päivässä. Annostusta voidaan suurentaa tarpeen mukaan tasolle 10 mg/24 tuntia tai 15 mg/24 tuntia. Depotlaastari tulee vaihtaa päivittäin. Tehon heikkenemistä on ilmennyt joillakin potilailla, jotka ovat käyttäneet pitkävaikutteisia nitraattivalmisteita pitkään. Kliinisten tutkimusten tulosten perusteella suositellaan, että tällaisissa tapauksissa Minitran-laastarin käytössä pidetään 8 12 tunnin tauko vuorokaudessa toleranssin välttämiseksi. Laastari voidaan poistaa esim. yön ajaksi. Laskimon aukipitäminen Yksi Minitran 5 mg/24 tuntia -depotlaastari kiinnitetään distaalisesti ja lähelle (noin ½ 1 cm) injektiokohtaa laskimopunktion yhteydessä. Depotlaastari tulee vaihtaa päivittäin. Minitran 5 mg/24 tuntia -depotlaastarin käyttö tulee lopettaa samalla kun iv-hoito lopetetaan. Iäkkäät potilaat Valmisteen käytöstä nimenomaan iäkkäiden potilaiden hoidossa ei ole erityisiä tietoja, mutta mikään ei viittaa siihen, että annoksen muuttaminen olisi tarpeen. 1
2 Pediatriset potilaat Minitran-valmisteen turvallisuutta ja tehoa lasten hoidossa ei ole vielä varmistettu, joten käyttösuosituksia ei voida antaa. Antotapa Minitran-depotlaastarit ovat sinetöidyissä yksittäispakkauksissa. Depotlaastarissa on suojakalvo, joka tulee poistaa ennen depotlaastarin kiinnittämistä iholle. Minitran-depotlaastari tulee kiinnittää puhtaalle, kuivalle ja terveelle ihoalueelle rintakehään tai olkavarteen. Seuraavan depotlaastarin saa kiinnittää samalle ihoalueelle vasta muutaman päivän kuluttua. Minitrandepotlaastari kiinnittyy helposti ihoon ja pysyy paikallaan myös kylvyn tai fyysisen rasituksen aikana, mutta se tulee poistaa ennen saunomista. Laastarin kiinnittäminen iholle 1. Pakkaus avataan repäisemällä varovasti merkitystä kulmasta katkoviivaa pitkin. Laastari otetaan ulos pakkauksesta. 2. Laastarista pidetään kiinni suojakalvot käyttäjään päin. 3. Toinen suojakalvoista poistetaan. 4. Laastari kiinnitetään rintakehään, olkavarteen tai selkään karvattomalle ihoalueelle. 5. Toinen suojakalvo poistetaan varovasti ja laastari painellaan hyvin paikoilleen. Irrotetut suojakalvot hävitetään. Mikäli laastari ei jostain syystä tartu kunnolla ihoon tai se irtoaa, uusi laastari kiinnitetään toiselle ihoalueelle. Irronnut laastari hävitetään. Samaa laastaria ei tule kiinnittää uudelleen, kun se on kerran irrotettu iholta Vasta-aiheet - Yliherkkyys vaikuttavalle aineelle, orgaanisille nitron sukulaisyhdisteille tai kohdassa 6.1 mainituille apuaineille. - Äkillinen verenkierron vajaatoiminta, johon liittyy merkittävä hypotensio (sokki, verenkierron pysähtyminen), sekä sokki mukaan lukien kardiogeeninen sokki, koska glyseryylitrinitraatti heikentää laskimovirtausta eli voi pahentaa näitä tiloja. - Akuutti sydäninfarkti, koska glyseryylitrinitraattia ei vapaudu Minitranista riittävästi akuutin infarktin hoitoon. - Hypertrofinen obstruktiivinen kardiomyopatia, aortta- tai mitraaliläpän ahtaumat, koska glyseryylitrinitraatin aiheuttama laskimovirtauksen heikentyminen voi ahtauttaa ulosvirtausta pahentaen näitä tiloja. - Konstriktiivinen perikardiitti ja sydämen tamponaatio, koska glyseryylitrinitraatti voi heikentää edelleen kammioiden täyttymistä. - Vaikea anemia. Glyseryylitrinitraatin aiheuttama veren laimeneminen voi pahentaa vaikean anemian oireita. - Kohonnut kallonsisäinen paine, koska glyseryylitrinitraatti voi lisätä kallonsisäistä painetta. - Samanaikainen käyttö fosfodiesteraasi tyyppi 5 -estäjien (PDE5) (sildenafiili, vardenafiili, tadalafiili) kanssa voi voimistaa Minitranin verisuonia laajentavaa vaikutusta ja siten laskea voimakkaasti verenpainetta sekä aiheuttaa iskemiaa ja verenkiertohäiriöitä, minkä seurauksena sydän tai aivot voivat vaurioitua. - Vaikea hypotensio (systolinen verenpaine alle 90 mmhg). - Vaikea hypovolemia 2
3 Liukoisen guanylaattisyklaasin stimulaattoria, riosiguaattia, ei saa käyttää samanaikaisesti nitraattien tai typpioksidin luovuttajien kanssa (ks. kohta 4.5) Varoitukset ja käyttöön liittyvät varotoimet Minitran ei sovi nopeaa lievitystä vaativan akuutin rintakipukohtauksen hoitoon. Jos potilaan pitkäaikainen lääkitys vaihdetaan toiseen, glyseryylitrinitraatin käyttö on lopetettava vähitellen ja uusi lääkitys on aloitettava jo annoksen pienentämisen aikana, kuten muidenkin nitraattivalmisteiden käytön yhteydessä. Jos potilaalla on äskettäin ollut sydäninfarkti tai akuutti sydämen vajaatoiminta, Minitran-hoidossa on noudatettava varovaisuutta ja potilaan on oltava tarkassa lääkärin valvonnassa ja/tai hemodynamiikan seurannassa. Etenkin pitkäaikainen paikallishoitovalmisteiden käyttö voi aiheuttaa herkistymistä. Tällöin paikallishoito on keskeytettävä ja muu asianmukainen hoito aloitettava. Minitran ei sisällä metallia, joten laastarin irrottamista diatermian ajaksi ei pidetä tarpeellisena. Minitrania on käytettävä varoen, jos potilaalla on: - hypotensio tai hypotensio, jota hoidetaan - verenkiertohäiriöitä tai ortostaattinen hypotensio - cor pulmonale tai hypoksemian riski - mitraaliläpän prolapsi - kohonnut silmänpaine (glaukooma) - hypotyreoidismi - serebrovaskulaaritauti - methemoglobiinireduktaasi-entsyymin vajaus tai methemoglobinemia. Nitraattipäänsärky voidaan välttää aloittamalla hoito pienemmällä annoksella ja suurentamalla annosta vähitellen hoitotasolle. Minitran-laastari on poistettava ennen saunomista ja sähköistä rytminsiirtoa. Minitran-laastarin poistamista tulee harkita, jos potilaalle kehittyy merkittävä hypotensio. Hypoksemia Varovaisuutta tulee noudattaa hoidettaessa potilaita, joilla on vaikeasta anemiasta johtuva arteriaalinen hypoksemia (myös G6PD-puutoksen indusoimat muodot), koska näillä potilailla glyseryylitrinitraatin biotransformaatio on vähentynyt. Samoin varovaisuutta tulee noudattaa hoidettaessa potilaita, joilla on hypoksemia ja ventilaatio/perfuusio-epätasapaino keuhkosairauden tai sydäninfarktin seurauksena. Alveolaarisen hypoventilaation yhteydessä keuhkoissa tapahtuu vasokonstriktio, joka siirtää perfuusiota alveolaarisen hypoksian alueilta keuhkojen paremmin ventiloiduille alueille (Euler- Liljestrandin mekanismi). Potilailla, joilla on angina pectoris, sydäninfarkti tai aivoverenkiertohäiriö, on usein poikkeavuuksista pienissä hengitysteissä (erityisesti alveolaarinen hypoksia). Näissä tiloissa keuhkoissa tapahtuu vasokonstriktio, joka siirtää perfuusiota alveolaarisen hypoksian alueilta keuhkojen paremmin ventiloiduille alueille. Voimakkaana vasodilataattorina glyseryylitrinitraatti voi estää edellä kuvatun suojaavan vasokonstriktion ja lisätä perfuusiota huonosti ventiloiduilla alueilla, mikä huonontaa ventilaatio/perfuusio-epätasapainoa ja vähentää hapen osapainetta verisuonissa entisestään. Hypertrofinen kardiomyopatia Nitraattihoito voi pahentaa hypertrofisen kardiomyopatian aiheuttamaa rasitusrintakipua. Lisääntynyt rasitusrintakipu Tihentyneiden angina pectoris -kohtausten mahdollisuus tulee ottaa huomioon aikoina, jolloin 3
4 Minitran-laastaria ei käytetä. On suositeltavaa käyttää samanaikaisesti toista rasitusrintakipukohtausten hoitoon tarkoitettua lääkettä. Lääkkeen käytön lopettaminen ja rebound -vaikutus Äkillistä lääkkeen käytön lopettamista tai annoksen pienentämistä tulisi välttää angina pectoris -kohtausvaaran vuoksi. Minitran-hoitoa lopetettaessa tulisi aloittaa korvaava hoito pitkävaikutteisella nitrovalmisteella ja sen jälkeen pienentää annosta vähitellen. Toleranssin kehittyminen Jos pitkävaikutteisia nitraatteja, mukaan lukien transdermaaliset lääkemuodot, käytetään jatkuvasti, saattaa kehittyä toleranssi tai teho saattaa heikentyä. Toleranssin kehittymisen välttämiseksi suositellaan 8 12 tunnin nitraatitonta jaksoa vuorokaudessa. Kun glyseryylitrinitraattilaastareihin kehittyy toleranssi, kielen alle laitettavan glyseryylitrinitraatin vaikutus rasitustoleranssiin voi osittain heiketä. Minitran 5 mg/24 tuntia: laskimon aukipitäminen perifeerisessä infuusiokohdassa Infuusiokohta tulee tarkastaa säännöllisesti. Jos havaitaan laskimotulehdus, se on hoidettava asianmukaisesti Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset Valmisteet, joiden samanaikainen käyttö on vasta-aiheista yhteisvaikutusten vuoksi PDE5-estäjien, kuten sildenafiilin, vardenafiilin tai tadalafiilin, samanaikainen käyttö Minitranin ja muiden vasodilataattorien kanssa on vasta-aiheista, koska se voi aiheuttaa voimakasta verenpaineen laskua, iskemiaa ja verenkiertohäiriöitä, jotka voivat aiheuttaa pysyviä vaurioita sydämeen ja aivoihin. Minitranin samanaikainen käyttö liukoisen guanylaattisyklaasin stimulaattorin, riosiguaatin, kanssa on vasta-aiheista (ks. kohta 4.3), koska se voi aiheuttaa hypotensiota. Huomioon otettavat yhteisvaikutukset Samanaikainen Minitranin ja muiden vasodilataattorien, kalsiumantagonistien, ACE:n estäjien, beetasalpaajien, diureettien, verenpainelääkkeiden, trisyklisten antidepressanttien, neuroleptien, rauhoittavien lääkkeiden ja alkoholin käyttö voi voimistaa Minitranin verenpainetta alentavaa vaikutusta. Minitran voi lisätä dihydroergotamiinin biologista hyötyosuutta. Sepelvaltimotautia sairastavilla potilailla dihydroergotamiini voi estää glyseryylitrinitraatin vaikutusta ja siten johtaa sepelvaltimoiden vasokonstriktioon. Tulehduskipulääkkeet (paitsi asetyylisalisyylihappo) voivat heikentää Minitranin hoitovastetta. Minitranin samanaikainen käyttö amifostiinin ja asetyylisalisyylihapon kanssa voi voimistaa Minitranin verenpainetta laskevaa vaikutusta Hedelmällisyys, raskaus ja imetys Raskaus Kuten muitakaan lääkkeitä, Minitrania ei pidä määrätä raskauden aikana, varsinkaan ensimmäisen kolmanneksen aikana, ellei siihen ole pakottavia syitä. On arvioitava, onko äidin lääkkeestä saama hyöty suurempi kuin lapseen kohdistuvat riskit. Imetys Vaikuttavan aineen erittymisestä äidinmaitoon tai eläinten maitoon on vain vähän tietoa. Imetettävään lapseen kohdistuvaa riskiä ei voida sulkea pois. On päätettävä, lopetetaanko imetys vai Minitran-hoito, sen mukaan, mitkä ovat imetyksen hyödyt 4
5 lapselle ja hoidon hyödyt äidille. Hedelmällisyys Minitranin vaikutuksesta ihmisen hedelmällisyyteen ei ole saatavilla tietoa Vaikutus ajokykyyn ja koneidenkäyttökykyyn Varovaisuutta tulee noudattaa autoa ajettaessa ja tarkkuutta vaativien laitteiden käytössä. Etenkin Minitran-hoidon alussa tai annosta muutettaessa voi esiintyä reaktiokyvyn heikkenemistä tai harvemmin ortostaattista hypotensiota tai huimausta (sekä poikkeuksellista pyörtymistä yliannostuksen jälkeen). Jos potilaalla on näitä oireita, hänen ei pidä ajaa autoa eikä käyttää tarkkuutta vaativia koneita Haittavaikutukset Useimmat haittavaikutukset ovat annosriippuvaisia ja farmakologisesti välittyviä. Haittavaikutusten esiintyvyys on luokiteltu elinjärjestelmittäin yleisyyden mukaan (eli sen mukaan, kuinka monella potilaalla haittavaikutuksia odotetaan esiintyvän): hyvin yleinen ( 1/10), yleinen ( 1/100, < 1/10), melko harvinainen ( 1/1 000, < 1/100), harvinainen ( 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) sisältää yksittäiset raportit, tuntematon (haittavaikutustiedot on kerätty Minitranin markkinoille tulon jälkeen spontaaneista haittavaikutusilmoituksista ja kirjallisuudessa esiintyneistä tapausselostuksista; koska tiedot perustuvat vapaaehtoisiin ilmoituksiin eikä lääkettä käyttäneiden määrä ole tiedossa, näiden haittavaikutusten yleisyyttä ei voida arvioida luotettavasti). Hermosto: Yleinen: päänsärky 1 Hyvin harvinainen: huimaus Tuntematon: pyörtyminen Sydän: Harvinainen: takykardia 2 Tuntematon: palpitaatio Verisuonisto: Harvinainen: ortostaattinen hypotensio, punastuminen 2 Ruoansulatuselimistö: Hyvin yleinen: pahoinvointi, oksentelu Iho ja ihonalainen kudos: Melko harvinainen: kosketusihottuma Tuntematon: yleistynyt ihottuma Yleisoireet ja antopaikassa todettavat haitat: Melko harvinainen: kiinnityskohdan eryteema, kutina, kirvely ja ärsytys 3 Tutkimukset: Harvinainen: sydämen sykkeen nousu. 1 Kuten muutkin nitraattilääkkeet, Minitran aiheuttaa yleisesti päänsärkyä. Tämä haittavaikutus on annosriippuvainen ja johtuu valmisteen vasodilatoivasta vaikutuksesta, joka kohdistuu aivoihin. Päänsärky häviää usein muutamassa päivässä hoidon jatkumisesta huolimatta. Jos lääkettä käytetään ajoittain eikä päänsärky häviä, sitä voidaan hoitaa miedoilla kipulääkkeillä. Jos päänsärky ei lievity, glyseryylitrinitraatin annosta tulee pienentää tai hoito tulee lopettaa. 2 Lievästi kohonnutta sydämen sykettä, joka aiheutuu refleksistä, voidaan tarvittaessa laskea 5
6 yhdistämällä Minitran-hoitoon beetasalpaaja. 3 Minitran-laastarin poistamisen jälkeen pieni punoitus häviää yleensä muutamassa tunnissa. Laastari tulee kiinnittää aina eri paikkaan, jotta vältytään paikalliselta ihoärsytykseltä. Epäillyistä haittavaikutuksista ilmoittaminen On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle: www-sivusto: Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL FIMEA 4.9. Yliannostus Oireet Suuret glyseryylitrinitraattiannokset saattavat aiheuttaa vaikean hypotension ja takykardiaa tai kollapsin ja pyörtymisen. Glyseryylitrinitraattiyliannoksen on ilmoitettu aiheuttaneen methemoglobinemiaa. Hoito Minitranin depotmuodon vuoksi yliannokset ovat harvinaisia. Jos epäillään yliannostusta, Minitrandepotlaastari tulee poistaa ja hypotensio sekä kollapsin oireet tulee hoitaa nostamalla potilaan jalat ylös tai sitomalla niihin kompressioside. 5. FARMAKOLOGISET OMINAISUUDET 5.1. Farmakodynamiikka Farmakoterapeuttinen ryhmä: Iskeemisen sydäntaudin lääkkeet, orgaaniset nitraatit. ATC-koodi: C01DA02 Minitranin vaikuttava aine glyseryylitrinitraatti laajentaa sileää lihaskudosta ja aiheuttaa sen relaksaation, mutta tämän aiheuttavaa mekanismia ei tunneta. Sillä ei ole suoraa inotrooppista eikä kronotrooppista vaikutusta sydämeen. Se vaikuttaa sydämen minuuttitilavuuteen pelkästään laskimoiden kapasitanssiin ja vastussuoniin kohdistuvan vaikutuksensa vuoksi. Nämä sydämen esikuormitukseen ja jälkikuormitukseen kohdistuvat vaikutukset vähentävät sydänlihaksen hapenkulutusta. Tämä on pääasiallinen mekanismi, jolla glyseryylitrinitraatti lievittää angina pectoris -oireita. Myös lääkkeen pääasialliset haittavaikutukset (päänsärky, punastuminen, huimaus, posturaalinen hypotensio ja takykardia) johtuvat tästä sileää lihaskudosta rentouttavasta vaikutuksesta Farmakokinetiikka Kun Minitran-laastari kiinnitetään iholle, glyseryylitrinitraatti imeytyy vähitellen ihon läpi systeemiseen verenkiertoon. Näin se kulkeutuu kohde-elimiin (sydämeen ja verisuonistoon) ennen kuin se deaktivoituu maksassa. Glyseryylitrinitraattia vapautuu Minitranista tasaisesti 24 tunnin ajan (keskimäärin 0,75 mg/cm 2 /24 tuntia), jolloin plasman glyseryylitrinitraattipitoisuus pysyy tasaisena. Haittavaikutukset ovat harvinaisia, koska korkeita pitoisuushuippuja ei esiinny. Glyseryylitrinitraatti metaboloituu hydrolysoitumalla dinitraateiksi ja mononitraatiksi Prekliiniset tiedot turvallisuudesta Ei sovelleta. 6
7 6. FARMASEUTTISET TIEDOT 6.1. Apuaineet Iso-oktyyliakrylaatti-akryyliamidikopolymeeri, etyylioleaatti, glyserolimonolauraatti, polyeteenikalvo ja silikonilla päällystetty polyesterikalvo Yhteensopimattomuudet Ei oleellinen Kestoaika 3 vuotta Säilytys Ei lasten ulottuville eikä näkyville. Säilytä alle 25 C:ssa. Säilytä alkuperäispakkauksessa. Käytetyt laastarit taitetaan kokoon ja hävitetään niin, etteivät lapset pääse niihin käsiksi Pakkaustyyppi ja pakkauskoot Depotlaastareissa on suojaava silikonipäällysteinen polyesterikalvo, joka poistetaan ennen käyttöä. Laastareissa on merkintä Minitran 5 tai Minitran 10. Laastarit on yksittäispakattu kuumasaumattuun alumiinipussiin. 5 mg/24 h ja 10 mg/24 h depotlaastarit: 30 ja 100 kappaleen pakkaukset. Kaikkia pakkauskokoja ei välttämättä ole myynnissä Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet Käytetyt laastarit taitetaan kokoon ja hävitetään. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. 7. MYYNTILUVAN HALTIJA Meda Oy Vaisalantie Espoo 8. MYYNTILUVAN NUMEROT 5 mg: mg: MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ/ UUDISTAMISPÄIVÄMÄÄRÄ 7
8 Myyntiluvan myöntämisen päivämäärä: Viimeisimmän uudistamisen päivämäärä: TEKSTIN MUUTTAMISPÄIVÄMÄÄRÄ
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO. Huom. Emätinpuikko tulee työntää syvälle emättimeen, ei mielellään kuukautisten aikana.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Celluvisc 1,0 % silmätipat, liuos kerta-annossäiliössä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra sisältää 10 mg karmelloosinatriumia. Yksi tippa
VALMISTEYHTEENVETO. Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia, joka vastaa 2,68 mg bentsydamiinia.
 1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO. Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia 20 mg (2 %).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Isosorbide mononitrate Vitabalans 10 mg tabletit Isosorbide mononitrate Vitabalans 20 mg tabletit
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Isosorbide mononitrate Vitabalans 10 mg tabletit Isosorbide mononitrate Vitabalans 20 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 10 mg: 1 tabletti sisältää
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Isosorbide mononitrate Vitabalans 10 mg tabletit Isosorbide mononitrate Vitabalans 20 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 10 mg: 1 tabletti sisältää
VALMISTEYHTEENVETO. Valmisteen kuvaus: pyöreä, merkintä BEPANTHEN kehässä, halkaisija n. 18 mm, paksuus n. 3,5 mm, harmaankeltainen, sitruunan tuoksu.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BEPANTHEN 100 mg imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 100 mg dekspantenolia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO. Hiuspohja pestään Ketoconazol ratiopharm shampoolla, jonka annetaan vaikuttaa 3-5 minuutin ajan ennen huuhtelua.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ketoconazol ratiopharm 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra shampoota sisältää 20 mg ketokonatsolia. Apuaineet: Täydellinen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ketoconazol ratiopharm 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra shampoota sisältää 20 mg ketokonatsolia. Apuaineet: Täydellinen
VALMISTEYHTEENVETO. Pyöreä (halkaisija 6 mm), valkoinen, tasainen tabletti, jossa ei ole jakouurretta.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitroglycerin Orion 0,5 mg resoribletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi resoribletti sisältää 0,50 mg glyseryylitrinitraattia. Apuaine, jonka vaikutus
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitroglycerin Orion 0,5 mg resoribletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi resoribletti sisältää 0,50 mg glyseryylitrinitraattia. Apuaine, jonka vaikutus
VALMISTEYHTEENVETO. Akrivastiinia ei pidä määrätä potilaille, joiden munuaistoiminta on merkittävästi heikentynyt.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Ketokonatsoli 20 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ketokonatsoli 20 mg/g Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Emulsiovoide Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ketokonatsoli 20 mg/g Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Emulsiovoide Valmisteen
Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 5 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 50 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. DINIT 1,25 mg/annos -sumute suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI DINIT 1,25 mg/annos -sumute suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Isosorbididinitraattia 1,25 mg/annos Täydellinen apuaineluettelo, ks. 6.1 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI DINIT 1,25 mg/annos -sumute suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Isosorbididinitraattia 1,25 mg/annos Täydellinen apuaineluettelo, ks. 6.1 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. BiQi 3 g jauhe oraalisuspensiota varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BiQi 3 g jauhe oraalisuspensiota varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 3 grammaa diosmektiittiä. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI BiQi 3 g jauhe oraalisuspensiota varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 3 grammaa diosmektiittiä. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Galieve Peppermint purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi purutabletti sisältää: Natriumalginaatti 250 mg Natriumvetykarbonaatti 133,5 mg Kalsiumkarbonaatti
VALMISTEYHTEENVETO. Shampoo Viskoosi liuos, joka on väriltään kirkkaan oljenkeltainen tai vaaleanoranssi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Nitro 5 mg/24 t depotlaastari Nitro 10 mg/24 t depotlaastari 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
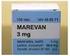 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitro 5 mg/24 t depotlaastari Nitro 10 mg/24 t depotlaastari 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 depotlaastari sisältää 250 tai 500 mg glyseryylitrinitraatti-laktoosimonohydraattihierrettä,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitro 5 mg/24 t depotlaastari Nitro 10 mg/24 t depotlaastari 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 depotlaastari sisältää 250 tai 500 mg glyseryylitrinitraatti-laktoosimonohydraattihierrettä,
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen, pyöreä, kaksoiskupera tabletti, jonka toisella puolella on jakoura. Merkintä M 2, halkaisija 7 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ismexin 20 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää isosorbidi-5-mononitraattia 20 mg Apuaineet, joiden vaikutus tunnetaan: laktoosimonohydraatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ismexin 20 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää isosorbidi-5-mononitraattia 20 mg Apuaineet, joiden vaikutus tunnetaan: laktoosimonohydraatti
VALMISTEYHTEENVETO. Yksi tippa silmän sidekalvopussiin 4 kertaa päivässä tai tarpeen mukaan tilan vaikeusasteesta riippuen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Oculac 50 mg/ml silmätipat, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml: 50 mg povidoni K 25 Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Silmätipat,
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen tai melkein valkoinen talkkimainen jauhe.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO. Ruiskeina annettavien jauheiden, konsentraattien ja liuosten liuottamiseen ja laimentamiseen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Fresenius Kabi 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Natriumkloridi 9,0 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Pediatriset potilaat Viscotears-silmägeelin turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Viscotears silmägeeli kerta-annospakkauksessa 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 2 mg karbomeeriä. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Viscotears silmägeeli kerta-annospakkauksessa 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 2 mg karbomeeriä. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. 1 annospussi sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg jauhe oraalisuspensiota varten, annospussi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 annospussi sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg jauhe oraalisuspensiota varten, annospussi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 annospussi sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita,
VALMISTEYHTEENVETO. Harmaapilkullinen, pyöreä, kuperapintainen tabletti, halkaisija 13 mm
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI CARBO MEDICINALIS 250 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Aktiivihiili, 250 mg Täydellinen apuaineluettelo, ks. kohta 6.1 3. LÄÄKEMUOTO Tabletti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI CARBO MEDICINALIS 250 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Aktiivihiili, 250 mg Täydellinen apuaineluettelo, ks. kohta 6.1 3. LÄÄKEMUOTO Tabletti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO. 1 kapseli sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kapseli sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745. Apuaineet,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Precosa 250 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kapseli sisältää 250 mg kylmäkuivattua Saccharomyces boulardiita, kanta CNCM I-745. Apuaineet,
VALMISTEYHTEENVETO. Apuaineet, joiden vaikutus tunnetaan: etanoli 100 mg/ml. Valmisteen kuvaus: miedosti tuoksuva, väritön tai hieman kellertävä liuos
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Mucovin 0,8 mg/ml -oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bromiheksiinihydrokloridi, 0,8 mg/ml Apuaineet, joiden vaikutus tunnetaan: etanoli 100 mg/ml
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Mucovin 0,8 mg/ml -oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bromiheksiinihydrokloridi, 0,8 mg/ml Apuaineet, joiden vaikutus tunnetaan: etanoli 100 mg/ml
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Metronidatsoli 0,75 paino-%, 7,5 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO. Täydellisen parenteraalisen ravitsemuksen täydennyksenä vesiliukoisten vitamiinien päivittäisen tarpeen tyydyttämiseksi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO. Yliherkkyys vaikuttavalle aineelle, muille imidatsolijohdoksille tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 20 mg mikonatsolinitraattia. Apuaineet, joiden vaikutus
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 20 mg mikonatsolinitraattia. Apuaineet, joiden vaikutus
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
VALMISTEYHTEENVETO. Yliherkkyys mikonatsolille, muille imidatsolijohdannaisille tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 20 mg/ml emulsio iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää mikonatsolinitraattia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 20 mg/ml emulsio iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää mikonatsolinitraattia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.1 Käyttöaiheet. 4.2 Annostus ja antotapa
 1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO. Yliherkkyys vaikuttavalle aineelle, muille imidatsolijohdoksille tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 2 % puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 20 mg mikonatsolinitraattia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 2 % puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 20 mg mikonatsolinitraattia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
Yliherkkyys vaikuttavalle aineelle tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fusidic Acid Orifarm 20 mg/g, emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää fusidiinihappoa hemihydraattina, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fusidic Acid Orifarm 20 mg/g, emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää fusidiinihappoa hemihydraattina, joka vastaa
VALMISTEYHTEENVETO. Bricanyl Turbuhaler 0,25 mg/annos ja 0,5 mg/annos inhalaatiojauheet
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Bricanyl Turbuhaler 0,25 mg/annos ja 0,5 mg/annos inhalaatiojauheet 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bricanyl Turbuhaler 0,25 mg/annos: 1 annos sisältää
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Bricanyl Turbuhaler 0,25 mg/annos ja 0,5 mg/annos inhalaatiojauheet 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bricanyl Turbuhaler 0,25 mg/annos: 1 annos sisältää
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Imdur 60 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1. LÄÄKEVALMISTEEN NIMI Imdur 60 mg depottabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 depottabletti sisältää 60 mg isosorbidi-5-mononitraattia. Täydellinen apuaineluettelo, ks.
1. LÄÄKEVALMISTEEN NIMI Imdur 60 mg depottabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 depottabletti sisältää 60 mg isosorbidi-5-mononitraattia. Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent Banana 0,25 mg F -imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent Banana 0,25 mg F -imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Wartec 5 mg/ml liuos penslaukseen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra liuosta sisältää 5 mg podofyllotoksiinia. Täydellinen apuaineluettelo,
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Wartec 5 mg/ml liuos penslaukseen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra liuosta sisältää 5 mg podofyllotoksiinia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Deponit NT 5 mg/24 tuntia depotlaastari Deponit NT 10 mg/24 tuntia depotlaastari
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Deponit NT 5 mg/24 tuntia depotlaastari Deponit NT 10 mg/24 tuntia depotlaastari 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 5 mg/24 h depotlaastari: Yksi 9 cm 2 :n
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Deponit NT 5 mg/24 tuntia depotlaastari Deponit NT 10 mg/24 tuntia depotlaastari 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 5 mg/24 h depotlaastari: Yksi 9 cm 2 :n
1. LÄÄKEVALMISTEEN NIMI. Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1. LÄÄKEVALMISTEEN NIMI Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää: 361-509 mg Arctostaphylos uva-ursi (L.) Spreng. folium (sianpuolukan
1. LÄÄKEVALMISTEEN NIMI Lyngonia kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää: 361-509 mg Arctostaphylos uva-ursi (L.) Spreng. folium (sianpuolukan
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
VALMISTEYHTEENVETO. Lievän tai kohtalaisen vaikean polven nivelrikon oireiden lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO. Maksimivuorokausiannos 40 ml (120 mg dekstrometorfaania)
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Resilar 3 mg/ml oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi ml sisältää 3 mg dekstrometorfaanihydrobromidia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Resilar 3 mg/ml oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi ml sisältää 3 mg dekstrometorfaanihydrobromidia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO. Yksi 8,5 ml ampulli sisältää 1 mg terlipressiiniasetaattia, vastaten 0,85mg terlipressiiniä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GLYPRESSIN 1 mg injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 8,5 ml ampulli sisältää 1 mg terlipressiiniasetaattia, vastaten 0,85mg terlipressiiniä.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GLYPRESSIN 1 mg injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 8,5 ml ampulli sisältää 1 mg terlipressiiniasetaattia, vastaten 0,85mg terlipressiiniä.
VALMISTEYHTEENVETO. Ensisijaisesti ripulin ja ilmavaivojen hoito. Voidaan käyttää myös akuuttien lääkeaine- ja muiden myrkytysten ensiapuun.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Carbo Medicinalis 250 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 250 mg aktiivihiiltä. Apuaine, jonka vaikutus tunnetaan: 1 tabletti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Carbo Medicinalis 250 mg -tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 250 mg aktiivihiiltä. Apuaine, jonka vaikutus tunnetaan: 1 tabletti
VALMISTEYHTEENVETO. Neste- ja elektrolyyttihukka esim. leikkauksen, trauman tai palovammojen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Ringer-acetat Fresenius Kabi, infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml infuusionestettä sisältää: Natr. chlorid. 5,9 g Natr. acet.
Käytetään ulkoisesti iholle/limakalvoille käyttötarkoituksen mukainen määrä desinfiointiin.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Travahex 0,5 mg/ml, liuos iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml liuosta sisältää 0,5 mg klooriheksidiinidiasetaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Travahex 0,5 mg/ml, liuos iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml liuosta sisältää 0,5 mg klooriheksidiinidiasetaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Terracort voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Terracort voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma voidetta sisältää 30 mg oksitetrasykliiniä (33,520 mg oksitetrasykliinihydrokloridina) ja
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Terracort voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma voidetta sisältää 30 mg oksitetrasykliiniä (33,520 mg oksitetrasykliinihydrokloridina) ja
VALMISTEYHTEENVETO. Hammaslääkärin tai lääkärin määräyksestä: Pre- ja postoperatiivinen desinfiointi suukirurgiassa ja parodontaalisessa kirurgiassa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
Yksi gramma Silkis-voidetta sisältää 3 mikrogrammaa kalsitriolia (INN). Täydellinen apuaineluettelo, ks. kohta 6.1.
 1. LÄÄKEVALMISTEEN NIMI Silkis 3 mikrog/g voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma Silkis-voidetta sisältää 3 mikrogrammaa kalsitriolia (INN). Täydellinen apuaineluettelo, ks. kohta 6.1.
1. LÄÄKEVALMISTEEN NIMI Silkis 3 mikrog/g voide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma Silkis-voidetta sisältää 3 mikrogrammaa kalsitriolia (INN). Täydellinen apuaineluettelo, ks. kohta 6.1.
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO. Riniitti. Sinuiitti. Lisälääkityksenä välikorvatulehduksessa vähentämään nenä-nielualueen limakalvon turvotusta. Rinoskopia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Otrivin Säilytysaineeton 0,5 mg/ml nenäsumute, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ksylometatsoliinihydrokloridi 0,5 mg/ml. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Otrivin Säilytysaineeton 0,5 mg/ml nenäsumute, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ksylometatsoliinihydrokloridi 0,5 mg/ml. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Viscotears 2 mg/g silmägeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Viscotears 2 mg/g silmägeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 2 mg karbomeeriä. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Viscotears 2 mg/g silmägeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma geeliä sisältää 2 mg karbomeeriä. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO. Yksi depotkapseli sisältää 20 mg, 40 mg, 80 mg tai 120 mg isosorbididinitraattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitrosid retard 20 mg depotkapseli, kova Nitrosid retard 40 mg depotkapseli, kova Nitrosid retard 80 mg depotkapseli, kova Nitrosid retard 120 mg depotkapseli,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitrosid retard 20 mg depotkapseli, kova Nitrosid retard 40 mg depotkapseli, kova Nitrosid retard 80 mg depotkapseli, kova Nitrosid retard 120 mg depotkapseli,
VALMISTEYHTEENVETO. 1 ml sisältää 0,54 mg levokabastiinihydrokloridia, joka vastaa 0,5 mg levokabastiinia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI LIVOSTIN 0,5 mg/ml silmätipat, suspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 0,54 mg levokabastiinihydrokloridia, joka vastaa 0,5 mg levokabastiinia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI LIVOSTIN 0,5 mg/ml silmätipat, suspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 0,54 mg levokabastiinihydrokloridia, joka vastaa 0,5 mg levokabastiinia.
VALMISTEYHTEENVETO. Tämä lääkevalmiste on tarkoitettu vain IgE-välitteisen allergian spesifiseen diagnostiseen käyttöön.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SOLUPRICK SQ hyönteismyrkyt, liuos ihopistotestiin - 801 Mehiläisen myrkky (Apis mellifera) - 802 Ampiaisen myrkky (Vespula spp.) 2. VAIKUTTAVAT AINEET JA NIIDEN
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SOLUPRICK SQ hyönteismyrkyt, liuos ihopistotestiin - 801 Mehiläisen myrkky (Apis mellifera) - 802 Ampiaisen myrkky (Vespula spp.) 2. VAIKUTTAVAT AINEET JA NIIDEN
VALMISTEYHTEENVETO. Angina pectoris. Vaikea (NYHA-luokat III-IV) sydämen vajaatoiminta, jonka hoito nitraateilla on syytä aloittaa sairaalassa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitrosid 5 mg tabletti Nitrosid 10 mg tabletti Nitrosid 20 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 5 mg, 10 mg tai 20 mg isosorbididinitraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nitrosid 5 mg tabletti Nitrosid 10 mg tabletti Nitrosid 20 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 5 mg, 10 mg tai 20 mg isosorbididinitraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. PAUSANOL 0,1 mg/g -emätinemulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAUSANOL 0,1 mg/g -emätinemulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emätinemulsiovoidetta sisältää estriolia 0,1 mg. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI PAUSANOL 0,1 mg/g -emätinemulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emätinemulsiovoidetta sisältää estriolia 0,1 mg. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
Yliherkkyys vaikuttavalle aineelle tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 10 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 100 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Basiron AC 10 % geeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi g sisältää bentsoyyliperoksidia, vesipitoinen, vastaten vedetöntä bentsoyyliperoksidia 100 mg.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
1 gramma emulsiovoidetta sisältää 20 mg fusidiinihappoa ja 1 mg beetametasonia (beetametasonivaleraattina)
 1(5) 1. LÄÄKEVALMISTEEN NIMI Fucicort 20 mg/g + 1 mg/g emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää 20 mg fusidiinihappoa ja 1 mg beetametasonia (beetametasonivaleraattina)
1(5) 1. LÄÄKEVALMISTEEN NIMI Fucicort 20 mg/g + 1 mg/g emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää 20 mg fusidiinihappoa ja 1 mg beetametasonia (beetametasonivaleraattina)
VALMISTEYHTEENVETO. Valkoinen, pyöreä, kummaltakin puolelta litteä viistoreunainen tabletti, jossa jakouurre toisella puolella.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO. Nuhaan ja poskiontelotulehdukseen liittyvän limakalvojen turvotuksen lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT - ksylometatsoliinihydrokloridi 0,5 mg/ml - ksylometatsoliinihydrokloridi 1 mg/ml Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO. Lääkkeellinen hengitysilma on tarkoitettu lapsille, aikuisille ja vanhuksille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI AIRAPY 100%, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Hengitysilma lääkintäkäyttöön 100 % 200 baarin paineessa (15 C). 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI AIRAPY 100%, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Hengitysilma lääkintäkäyttöön 100 % 200 baarin paineessa (15 C). 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO. 1 gramma voidetta sisältää 1 mg:n mometasonifuroaattia (1mg/g mometasonifuroaatti).
 1. LÄÄKEVALMISTEEN NIMI Mometasone furoate Auden Mckenzie 1mg/g voide VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma voidetta sisältää 1 mg:n mometasonifuroaattia (1mg/g mometasonifuroaatti).
1. LÄÄKEVALMISTEEN NIMI Mometasone furoate Auden Mckenzie 1mg/g voide VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma voidetta sisältää 1 mg:n mometasonifuroaattia (1mg/g mometasonifuroaatti).
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml injektionestettä sisältää natriumkloridia Elektrolyyttipitoisuudet
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Natriumklorid Braun 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml injektionestettä sisältää natriumkloridia Elektrolyyttipitoisuudet
1 ml siirappia sisältää 1,5 mg butamiraattisitraattia, joka vastaa 0,924 mg:aa butamiraattia.
 1. LÄÄKEVALMISTEEN NIMI Tinguri 1,5 mg/ml siirappi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml siirappia sisältää 1,5 mg butamiraattisitraattia, joka vastaa 0,924 mg:aa butamiraattia. Apuaineet, joiden
1. LÄÄKEVALMISTEEN NIMI Tinguri 1,5 mg/ml siirappi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml siirappia sisältää 1,5 mg butamiraattisitraattia, joka vastaa 0,924 mg:aa butamiraattia. Apuaineet, joiden
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
VALMISTEYHTEENVETO. Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500 mg:aa kalsiumia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
VALMISTEYHTEENVETO. Valmisteen kuvaus: kellertävän valkoinen, läpikuultava, homogeeninen voide.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Proctosedyl rektaalivoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma voidetta sisältää seuraavat vaikuttavat aineet: hydrokortisoni 5 mg sinkokaiinihydrokloridi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Proctosedyl rektaalivoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma voidetta sisältää seuraavat vaikuttavat aineet: hydrokortisoni 5 mg sinkokaiinihydrokloridi
VALMISTEYHTEENVETO. Ummetus, liikahappoisuuteen liittyvät mahavaivat, gastriitti, maha- ja pohjukaissuolihaava, meteorismi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Magnesiamaito 82,5 mg/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra oraalisuspensiota sisältää magnesiumhydroksidipastaa vastaten
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Magnesiamaito 82,5 mg/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra oraalisuspensiota sisältää magnesiumhydroksidipastaa vastaten
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Vectatone 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 1. LÄÄKEVALMISTEEN NIMI Vectatone 1 % emulsiovoide VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma Vectatone-emulsiovoidetta sisältää 10 mg pensikloviiria. Apuaineet, joiden vaikutus
1. LÄÄKEVALMISTEEN NIMI Vectatone 1 % emulsiovoide VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma Vectatone-emulsiovoidetta sisältää 10 mg pensikloviiria. Apuaineet, joiden vaikutus
Yksi 10 ml:n annos (annospussi) sisältää 500 mg natriumalginaattia, 213 mg natriumbikarbonaattia ja 325 mg kalsiumkarbonaattia.
 1. LÄÄKEVALMISTEEN NIMI Galieve 500 mg/213 mg/325 mg oraalisuspensio, annospussi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 10 ml:n annos (annospussi) sisältää 500 mg natriumalginaattia, 213 mg natriumbikarbonaattia
1. LÄÄKEVALMISTEEN NIMI Galieve 500 mg/213 mg/325 mg oraalisuspensio, annospussi 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 10 ml:n annos (annospussi) sisältää 500 mg natriumalginaattia, 213 mg natriumbikarbonaattia
VALMISTEYHTEENVETO. Apuaine, jonka vaikutus tunnetaan: metyyliparahydroksibentsoaatti (E218). Täydellinen apuaineluettelo, ks. kohta 6.1.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO. Ihon desinfektio ja merkintä ennen kirurgisia toimenpiteitä ja ihon läpäisyä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI KLORHEXOL 5 mg/ml, värjätty liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiinidiglukonaatti, 5 mg/ml Apuaineet, ks 6.1 3. LÄÄKEMUOTO Liuos Kirkas,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI KLORHEXOL 5 mg/ml, värjätty liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiinidiglukonaatti, 5 mg/ml Apuaineet, ks 6.1 3. LÄÄKEMUOTO Liuos Kirkas,
VALMISTEYHTEENVETO. Kroonisen ummetuksen hoito Kuivuneen, kovan ulostemassan (koprostaasin) pehmentäminen ja hajottaminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ColonSoft jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra valmista oraaliliuosta sisältää Natriumkloridia 1,46 mg Vedetöntä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ColonSoft jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi millilitra valmista oraaliliuosta sisältää Natriumkloridia 1,46 mg Vedetöntä
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO. Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu). 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 0,5
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Influvac, injektioneste, suspensio, esitäytetyssä ruiskussa (influenssarokote, pinta-antigeeni, inaktivoitu). 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 0,5
VALMISTEYHTEENVETO. Vero-soluissa kasvatetut poliovirukset tyyppi 1 (Brunhilde), tyyppi 2 (MEF-1) ja tyyppi 3 (Saukett) on puhdistettu ja inaktivoitu.
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI VeroPol Injektioneste, liuos, esitäytetty ruisku. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos = 0,5 ml: Poliovirus tyyppi 1, inaktivoitu Poliovirus tyyppi
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI VeroPol Injektioneste, liuos, esitäytetty ruisku. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annos = 0,5 ml: Poliovirus tyyppi 1, inaktivoitu Poliovirus tyyppi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Lääkeilma AWO 100 %, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Lääkeilma AWO 100 %, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Lääkkeellinen ilma 100 % (200 barin paineessa, 15 C). Täydellinen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Lääkeilma AWO 100 %, lääkkeellinen kaasu, puristettu 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Lääkkeellinen ilma 100 % (200 barin paineessa, 15 C). Täydellinen
Yksi gramma emulsiovoidetta sisältää 20 mg fusidiinihappoa ja 10 mg hydrokortisoniasetaattia.
 1. LÄÄKEVALMISTEEN NIMI Fucidin-Hydrocortison emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 20 mg fusidiinihappoa ja 10 mg hydrokortisoniasetaattia. Apuaineet,
1. LÄÄKEVALMISTEEN NIMI Fucidin-Hydrocortison emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 20 mg fusidiinihappoa ja 10 mg hydrokortisoniasetaattia. Apuaineet,
4.1 Käyttöaihe Akuutteihin tai kroonisiin keuhko- ja keuhkoputkisairauksiin liittyvän limaa erittävän yskän limaa irrottava hoito.
 V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Normofusin 50 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Normofusin 50 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml Normofusin 50 mg/ml infuusionestettä sisältää: Vaikuttava aine Määrä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Normofusin 50 mg/ml infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 000 ml Normofusin 50 mg/ml infuusionestettä sisältää: Vaikuttava aine Määrä
VALMISTEYHTEENVETO. Herpes simplex -viruksen aiheuttamien ihon tai limakalvojen infektioiden paikallishoitoon, esim. herpes labialis.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zovirax 5 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää asikloviiria 50 mg. Apuaineet, joiden vaikutus tunnetaan: 1
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zovirax 5 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 gramma emulsiovoidetta sisältää asikloviiria 50 mg. Apuaineet, joiden vaikutus tunnetaan: 1
