Valkoinen tai luonnonvalkoinen, kaksoiskupera, pyöreä tabletti, jonka toiselle puolelle on painettu BMS ja toiselle puolelle 527.
|
|
|
- Reijo Mäkinen
- 9 vuotta sitten
- Katselukertoja:
Transkriptio
1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 20 mg dasatinibia (dasatinibiamonohydraattina). Apuaineet: yksi tabletti sisältää 27 mg laktoosia. Täydellinen apuaineluettelo, ks. kohta LÄÄKEMUOTO Tabletti, kalvopäällysteinen (tabletti) Valkoinen tai luonnonvalkoinen, kaksoiskupera, pyöreä tabletti, jonka toiselle puolelle on painettu BMS ja toiselle puolelle KLIINISET TIEDOT 4.1 Käyttöaiheet SPRYCEL on tarkoitettu aikuisille kroonisessa, akseleraatio- tai blastikriisivaiheessa olevan kroonisen myelooisen leukemian (KML) hoitoon silloin, kun aikaisempi hoito, imatinibimesilaatti mukaan lukien, ei ole tuottanut tulosta tai potilas ei ole sietänyt sitä. SPRYCEL on myös tarkoitettu aikuisille Philadelphia-kromosomipositiivisen (Ph+) akuutin lymfaattisen leukemian (ALL) ja lymfaattisen blastikriisivaiheen KML:n hoitoon, kun aikaisempi hoito ei ole tuottanut tulosta tai potilas ei ole sietänyt sitä. 4.2 Annostus ja antotapa Hoidon saa aloittaa leukemian diagnosointiin ja hoitoon perehtynyt lääkäri. SPRYCELin suositeltu aloitusannos kroonisessa vaiheessa olevan KML:n hoidossa on 100 mg kerran vuorokaudessa, johdonmukaisesti joko aamulla tai illalla, suun kautta (ks. kohdat 4.4, 4.8 ja 5.1). SPRYCELin suositeltu aloitusannos akseleraatiovaiheessa, myelooisessa tai lymfaattisessa blastikriisivaiheessa (edenneessä vaiheessa) olevan KML:n tai Ph+ ALL:n hoidossa on 70 mg kahdesti vuorokaudessa, yksi tabletti aamulla ja yksi illalla, suun kautta (ks. kohdat 4.8 ja 5.1). Tabletteja ei saa murskata tai leikata, vaan ne tulee niellä kokonaisina. SPRYCEL voidaan ottaa joko aterian yhteydessä tai tyhjään mahaan. SPRYCEL-tabletit ovat saatavilla 20 mg, 50 mg ja 70 mg vahvuuksina suositellun annostuksen mahdollistamiseksi. Annoksen suurentamista tai pienentämistä suositellaan hoitovasteen ja potilaan sietokyvyn mukaan. Hoidon kesto: Kliinisissä tutkimuksissa SPRYCEL-hoitoa jatkettiin taudin etenemiseen saakka tai siihen saakka, kunnes potilas ei enää sietänyt sitä. Ei ole tutkittu, millainen vaikutus hoidon lopettamisella täydellisen sytogeneettisen vasteen saavuttamisen jälkeen on. Annoksen suurentaminen: Kliinisissä, aikuisilla KML ja Ph+ ALL -potilailla tehdyissä tutkimuksissa annoksen suurentaminen 140 mg:aan kerran vuorokaudessa (kroonisen vaiheen KML) tai 100 mg:aan kahdesti vuorokaudessa 2
2 (edenneen vaiheen KML tai Ph+ ALL) sallittiin potilailla, jotka eivät saavuttaneet hematologista tai sytogeneettistä vastetta suositeltua aloitusannostusta käytettäessä. Annoksen muuttaminen haittavaikutusten takia: Myelosuppressio: Kliinisissä tutkimuksissa hoito keskeytettiin, annosta pienennettiin tai tutkimushoito lopetettiin myelosuppression hoitamiseksi. Trombosyyttien ja punasolujen siirto suoritettiin tarvittaessa. Hematopoieettista kasvutekijää on käytetty potilailla, joilla oli resistentti myelosuppressio. Ohjeet annoksen muuttamiseen on esitetty Taulukossa 1. Taulukko 1: Annoksen muuttaminen neutropeniassa ja trombosytopeniassa Kroonisen vaiheen KML (aloitusannos 100 mg kerran vuorokaudessa) Akseleraatio- ja blastikriisivaiheen KML ja Ph+ ALL (aloitusannos 70 mg kahdesti vuorokaudessa) ANC < 0,5 x 10 9 /l ja/tai verihiutaleita < 50 x 10 9 /l ANC < 0,5 x 10 9 /l ja/tai verihiutaleita < 10 x 10 9 /l 1. Keskeytä hoito, kunnes ANC 1,0 x 10 9 /l ja verihiutaleita 50 x 10 9 /l. 2. Jatka hoitoa alkuperäisellä aloitusannoksella. 3. Jos verihiutaleita < 25 x 10 9 /l ja/tai ANC uudelleen < 0,5 x 10 9 /l yli 7 päivän ajan, toista kohta 1. ja jatka hoitoa pienennetyllä annoksella: 80 mg kerran vuorokaudessa (toinen jakso) tai lopeta hoito (kolmas jakso). 1. Varmista, liittyykö sytopenia leukemiaan (luuydinaspiraatio tai - biopsia). 2. Jos sytopenia ei liity leukemiaan, keskeytä hoito, kunnes ANC 1,0 x 10 9 /l ja verihiutaleita 20 x 10 9 /l ja jatka alkuperäisellä aloitusannoksella. 3. Jos sytopenia ilmenee uudelleen, toista kohta 1. ja jatka hoitoa pienennetyllä annoksella: 50 mg kahdesti vuorokaudessa (toinen jakso) tai 40 mg kahdesti vuorokaudessa (kolmas jakso). 4. Jos sytopenia liittyy leukemiaan, harkitse annoksen suurentamista 100 mg:aan kahdesti vuorokaudessa. ANC: absoluuttinen neutrofiilien määrä Ei-hematologiset haittavaikutukset: Jos SPRYCEL-hoidon yhteydessä kehittyy vaikeita ei-hematologisia haittavaikutuksia, hoito täytyy keskeyttää, kunnes haittavaikutus on saatu kuriin. Sen jälkeen hoitoa voidaan jatkaa pienennetyllä annoksella ottaen huomioon, kuinka vaikea haittavaikutus alunperin oli. Käyttö lapsille: SPRYCELin käyttöä alle 18-vuotiaille lapsille ja nuorille ei suositella, koska tiedot turvallisuudesta ja tehosta puuttuvat (ks. kohta 5.1). 3
3 Iäkkäät potilaat: Kliinisesti merkittäviä ikään liittyviä farmakokineettisiä eroavaisuuksia ei ole havaittu tässä potilasryhmässä. Annoksen muuttaminen ei ole tarpeen iäkkäillä potilailla. Maksan vajaatoiminta: Kliinisiä tutkimuksia SPRYCELin käytöstä ei ole tehty potilailla, joiden maksan toiminta on heikentynyt (tutkimuksista oli poissuljettu potilaat, joilla oli ALAT ja/tai ASAT > 2,5 kertaa normaalialueen yläraja ja/tai seerumin bilirubiinin kokonaismäärä > 2 kertaa normaalialueen yläraja). Koska dasatinibi metaboloituu pääasiassa maksan kautta, dasatinibialtistuksen odotetaan kasvavan maksan vajaatoiminnassa. SPRYCELia tulee käyttää varoen keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastavilla potilailla (ks. kohdat 4.4 ja 4.8). Munuaisten vajaatoiminta: Kliinisiä tutkimuksia SPRYCELin käytöstä ei ole tehty potilailla, joiden munuaisten toiminta on heikentynyt (tutkimuksista oli poissuljettu potilaat, joilla seerumin kreatiniinipitoisuus > 1,5 kertaa normaalialueen yläraja). Koska dasatinibin ja sen metaboliittien munuaispuhdistuma on < 4%, ei kokonaispuhdistuman odoteta pienenevän munuaisten vajaatoimintaa sairastavilla potilailla. 4.3 Vasta-aiheet Yliherkkyys vaikuttavalle aineelle tai apuaineille. 4.4 Varoitukset ja käyttöön liittyvät varotoimet Kliinisesti merkittävät interaktiot: Dasatinibi on CYP3A4:n substraatti ja inhibiittori. Siksi yhteisvaikutukset toisten samanaikaisesti annettavien, pääasiassa CYP3A4:n avulla metaboloituvien tai CYP3A4:n aktiivisuuteen vaikuttavien lääkevalmisteiden kanssa ovat mahdollista (ks. kohta 4.5). Dasatinibin samanaikainen käyttö voimakkaiden CYP3A4-entsyymiä inhiboivien lääkevalmisteiden kanssa (esim. ketokonatsoli, itrakonatsoli, erytromysiini, klaritromysiini, ritonaviiri, telitromysiini) saattaa lisätä dasatinibialtistusta. Sen vuoksi voimakkaan CYP3A4:n inhibiittorin antoa SPRYCELia saaville potilaille ei suositella (ks. kohta 4.5). Dasatinibin samanaikainen käyttö CYP3A4-entsyymiä indusoivien lääkevalmisteiden kanssa (esim. deksametasoni, fenytoiini, karbamatsepiini, rifampisiini, fenobarbitaali tai Hypericum perforatum eli mäkikuisma) saattaa vähentää dasatinibialtistusta huomattavasti ja mahdollisesti lisätä hoidon epäonnistumisen riskiä. Sen vuoksi SPRYCELia saavia potilaita tulee hoitaa vaihtoehtoisilla, vähemmän CYP3A4-entsyymiä indusoivilla valmisteilla (ks. kohta 4.5). Samanaikainen dasatinibin ja CYP3A4:n substraatin käyttö saattaa lisätä altistusta CYP3A4:n substraatille. Sen vuoksi varovaisuutta tulee noudattaa annettaessa SPRYCELia samanaikaisesti sellaisten CYP3A4:n substraattien kanssa, joilla on kapea terapeuttinen alue, kuten astemitsoli, terfenadiini, sisapridi, pimotsidi, kinidiini, bepridiili tai ergotalkaloidit (ergotamiini, dihydroergotamiini) (ks. kohta 4.5). Dasatinibin ja H 2 -antagonistien (esim. famotidiini), protonipumpun estäjien (esim. omepratsoli) tai alumiinihydroksidin/magnesiumhydroksidin samanaikainen käyttö saattaa vähentää dasatinibialtistusta. Siksi H 2 -antagonisteja ja protonipumpun estäjiä ei suositella ja alumiinihydroksidi/magnesiumhydroksidi-valmisteet tulisi antaa vähintään 2 tuntia ennen dasatinibin antamista tai 2 tuntia dasatinibin antamisen jälkeen (ks. kohta 4.5). Erityisryhmät: Tietoa SPRYCELilla tehdyistä kliinisistä tutkimuksista keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastavilla potilailla ei tällä hetkellä ole saatavilla. SPRYCELia tulisi antaa varoen keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastaville potilaille (ks. kohta 4.2). 4
4 Tärkeät haittavaikutukset: Myelosuppressio: SPRYCEL-hoitoon voi liittyä anemiaa, neutropeniaa ja trombosytopeniaa. Näitä ilmenee useammin potilailla, joilla on edenneen vaiheen KML tai Ph+ ALL kuin potilailla, joilla on kroonisen vaiheen KML. Täydellinen verenkuva tulee ottaa viikoittain kahden ensimmäisen kuukauden ajan ja sen jälkeen kuukausittain tai kliinisen tarpeen mukaan. Myelosuppressio oli yleensä palautuva ja tavallisesti se hoidettiin keskeyttämällä SPRYCEL-hoito väliaikaisesti tai vähentämällä annosta (ks. kohdat 4.2 ja 4.8 Poikkeavuudet laboratoriotesteissä, Hematologia). Annoksen optimointia koskeneessa faasin III tutkimuksessa potilailla, joilla oli kroonisen vaiheen KML, esiintyi useammin asteen 3 tai 4 myelosuppressiota, kun annostus oli 70 mg kahdesti vuorokaudessa, kuin annostuksen ollessa 100 mg kerran vuorokaudessa, ja myös nesteretentiota esiintyi yleisemmin potilailla, jotka saivat hoitoa kahdesti vuorokaudessa, kuin niillä, joille annettiin hoitoa kerran vuorokaudessa (ks. kohta 4.8). Siksi suositeltu aloitusannos kroonisen vaiheen KML:n hoidossa on 100 mg kerran vuorokaudessa. Verenvuoto: Kaikissa kliinisissä tutkimuksissa vaikeaa keskushermoston verenvuotoa ilmeni < 1%:lla potilaista. Kahdeksan tapausta johti kuolemaan ja 5:een niistä liittyi CTC (Common Toxicity Criteria) -asteikon mukainen 4. asteen trombosytopenia. Vaikeaa ruoansulatuskanavan verenvuotoa ilmeni 4%:lla potilaista ja yleensä se vaati lääkehoidon keskeyttämisen ja verensiirron. Muuta vaikeaa verenvuotoa esiintyi 2%:lla potilaista. Suurimpaan osaan verenvuototapahtumista liittyi tyypillisesti vaikea trombosytopenia (ks. kohta 4.8). Verihiutaleiden toimintaa estäviä lääkevalmisteita tai antikoagulantteja käyttävät potilaat poissuljettiin SPRYCELin kliinisistä tutkimuksista. Antikoagulanttien, asetyylisalisyylihapon ja ei-steroidisten tulehduskipulääkkeiden (NSAIDs) käyttö oli sallittua joissakin tutkimuksissa samanaikaisesti SPRYCELin kanssa, jos verihiutaleiden määrä oli > /mm 3. Varovaisuutta tulee noudattaa, jos potilaat käyttävät verihiutaleiden toimintaa estäviä lääkevalmisteita tai antikoagulantteja. Nesteretentio: SPRYCELin käyttöön liittyy nesteen kertymistä. Kaikissa kliinisissä tutkimuksissa vaikeaa nesteretentiota todettiin 9%:lla potilaista, ja 6%:lla nesteretentioon liittyi myös vaikea pleuraeffuusio ja 1%:lla vaikea perikardiaalinen effuusio. Sekä vaikeaa askitesta että yleistynyttä edeemaa raportoitiin kumpaakin < 1%:lla potilaista. Vaikeaa ei-sydänperäistä keuhkoedeemaa raportoitiin 1%:lla potilaista. Potilaille, jotka saavat pleuraeffuusioon viittaavia oireita, kuten dyspneaa tai kuivaa yskää, tulee suorittaa keuhkojen röntgenkuvaus. Vaikea pleuraeffuusio saattaa vaatia pleurapunktiota ja happihoitoa. Nesteretentiotapahtumia hoidettiin tyypillisesti tukihoitotoimenpiteillä, diureetti- ja lyhytkestoinen steroidihoito mukaan lukien. Vaikka SPRYCELin turvallisuusprofiili iäkkäämmillä henkilöillä on samanlainen kuin nuoremmilla henkilöillä, nesteretentiota esiintyy todennäköisemmin 65-vuotiailla ja sitä vanhemmilla potilailla ja heitä tulee seurata tarkasti (ks. kohta 4.8). QT-ajan piteneminen: In vitro -kokeista saadut tiedot viittaavat siihen, että dasatinibi voi pidentää sydämen kammioiden repolarisaatiota (QT-aika) (ks. kohta 5.3). Faasin II kliinisissä kokeissa leukemiaa sairastavilla, SPRYCELilla hoidetuilla 865 potilailla keskimääräiset QTc-ajan muutokset lähtötasosta Friderician menetelmällä (QTcF) olivat 4-6 millisekuntia; ylempi 95%:n luottamusväli kaikille lähtötason keskimääräisille muutoksille oli < 7 millisekuntia (ks. kohta 4.8). Faasi II/III kliinisissä kokeissa potilaalla, jotka saivat SPRYCELia, 18 QTc-ajan pitenemistapausta raportoitiin haittatapahtumaksi. 17 potilaalla (< 1%) esiintyi > 500 millisekunnin QTcF. SPRYCELia tulee antaa varoen potilaille, joilla QTc on pidentynyt tai se saattaa pidentyä. Näihin kuuluvat potilaat, joilla on hypokalemiaa tai hypomagnesemiaa, potilaat, joilla on synnynnäinen pitkä QT-aika sekä rytmihäiriölääkkeitä tai muita QT-ajan pidentymistä aiheuttavia lääkevalmisteita ja kumulatiivista suuriannoksista antrasykliinihoitoa saavat potilaat. Hypokalemia tai hypomagnesemia tulee korjata ennen SPRYCELin antoa. Kliinisissä tutkimuksissa ei ollut mukana potilaita, joilla oli hoitamaton tai merkittävä kardiovaskulaarisairaus. 5
5 Laktoosi: Tämä lääkevalmiste sisältää 135 mg laktoosimonohydraattia 100 mg:n päivittäisannoksessa ja 189 milligrammaa laktoosimonohydraattia 140 mg:n päivittäisannoksessa. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasinpuutos tai glukoosigalaktoosi-imeytymishäiriö, ei tule käyttää tätä lääkevalmistetta. 4.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset Lääkeaineet, jotka saattavat lisätä dasatinibin pitoisuuksia plasmassa: In vitro -tutkimukset osoittavat, että dasatinibi on CYP3A4:n substraatti. Dasatinibin ja voimakkaiden CYP3A4-inhibiittoreiden (esim. ketokonatsoli, itrakonatsoli, erytromysiini, klaritromysiini, ritonaviiri, telitromysiini) käyttö samanaikaisesti saattaa lisätä dasatinibialtistusta. Siksi voimakkaan CYP3A4- inhibiittorin systeemistä antoa SPRYCELia saaville potilaille ei suositella. In vitro -tutkimusten perusteella dasatinibi sitoutuu noin 96-prosenttisesti plasman proteiineihin kliinisesti merkityksellisinä pitoisuuksina. Dasatinibin yhteisvaikutuksia muiden proteiineihin sitoutuvien lääkevalmisteiden kanssa ei ole tutkittu. Syrjäytymisen mahdollisuutta ja sen kliinistä merkitystä ei tunneta. Lääkeaineet, jotka saattavat pienentää dasatinibin pitoisuuksia plasmassa: Kun dasatinibia annettiin sen jälkeen, kun rifampisiinia, voimakasta CYP3A4-induktoria, oli annettu 600 mg iltaisin 8 päivän ajan, dasatinibin AUC pieneni 82%. Myös muut CYP3A4-aktiivisuutta lisäävät lääkevalmisteet (esim. deksametasoni, fenytoiini, karbamatsepiini, fenobarbitaali tai Hypericum Perforatum eli mäkikuisma) saattavat lisätä dasatinibin metaboliaa ja pienentää sen pitoisuutta plasmassa. Sen vuoksi voimakkaiden CYP3A4-induktorien ja SPRYCELin samanaikaista käyttöä ei suositella. Potilaiden, joille rifampisiini tai muu CYP3A4-induktori on indisoitu, tulee käyttää vaihtoehtoisia, heikommin entsyymejä indusoivia lääkeaineita. H2-reseptorinsalpaajat ja protonipumpun estäjät: Pitkäaikainen vatsahappojen erityksen estäminen H 2 -salpaajilla tai protonipumpun estäjillä (esim. famotidiini ja omepratsoli) vähentää todennäköisesti dasatinibialtistusta. Kerta-annostutkimuksessa terveillä koehenkilöillä famotidiinin anto 10 tuntia ennen SPRYCELin kerta-annosta pienensi dasatinibialtistusta 61%. SPRYCEL-hoitoa saaville potilaille tulisi harkita antasidien antoa H 2 - salpaajien ja protonipumpun estäjien sijaan (ks. kohta 4.4). Antasidit: Ei-kliiniset tiedot osoittavat, että dasatinibin liukoisuus riippuu ph:sta. Kun terveille koehenkilöille annettiin samanaikaisesti alumiinihydroksidi/magnesiumhydroksidi-antasideja ja kerta-annos SPRYCELia, pieneni AUC 55% ja C max 58%. Kun antasidit annettiin 2 tuntia ennen SPRYCELin kerta-annosta, ei havaittu oleellisia dasatinibin pitoisuuden tai altistuksen muutoksia. Siten antasideja voidaan antaa vähintään 2 tuntia ennen SPRYCELia tai 2 tuntia SPRYCELin jälkeen (ks. kohta 4.4). Lääkeaineet, joiden pitoisuutta plasmassa SPRYCEL saattaa muuttaa: Dasatinibin ja CYP3A4:n substraatin samanaikainen käyttö saattaa lisätä altistusta CYP3A4- substraatille. Terveillä koehenkilöillä tehdyssä tutkimuksessa SPRYCELin 100 mg:n kerta-annos suurensi simvastatiinin, tunnetun CYP3A4-substraatin, AUC-arvoa 20% ja C max -arvoa 37%. Vaikutus voi olla suurempi toistuvien dasatinibiannosten jälkeen. Siksi CYP3A4-substraatteja, joilla on kapea terapeuttinen alue (esim. astemitsoli, terfenadiini, sisapridi, pimotsidi, kinidiini, bepridiili tai ergotalkaloidit (ergotamiini, dihydroergotamiini)) tulee antaa varoen potilaille, jotka saavat SPRYCELia (ks. kohta 4.4). In vitro -tutkimusten perusteella interaktiot CYP2C8-substraattien, kuten glitatsonien, kanssa ovat mahdollisia. 6
6 4.6 Raskaus ja imetys Raskaus: Ei ole olemassa tarkkoja tietoja dasatinibin käytöstä raskaana oleville naisille. Eläinkokeet osoittavat reproduktiivista toksisuutta (ks. kohta 5.3). Mahdollista riskiä ihmisille ei tunneta. SPRYCELia ei pitäisi käyttää raskauden aikana, mikäli käyttö ei ole selvästi välttämätöntä. Jos valmistetta käytetään raskauden aikana, potilaalle tulee kertoa mahdollisesta sikiöön kohdistuvasta riskistä. Dasatinibin vaikutusta spermaan ei tunneta, minkä takia hedelmällisessä iässä olevien miesten ja naisten pitäisi käyttää tehokkaita ehkäisymenetelmiä hoidon aikana. Imetys: Tiedot dasatinibin erittymisestä ihmisen tai eläimen maitoon ovat riittämättömät/rajalliset. Fysikaaliskemialliset ja saatavilla olevat farmakodynaamiset/toksikologiset tiedot dasatinibista viittaavat siihen, että dasatinibi erittyy rintamaitoon eikä riskiä imeväiselle voida poissulkea. Imetys on lopetettava SPRYCEL-hoidon ajaksi. 4.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty. Potilaille tulee kertoa, että heillä saattaa ilmetä haittavaikutuksia, kuten huimausta tai näön sumenemista, dasatinibihoidon aikana. Sen takia varovaisuutta suositellaan noudatettavaksi ajettaessa autoa tai käytettäessä koneita. 4.8 Haittavaikutukset Alla esitetyt tiedot perustuvat kliinisiin tutkimuksiin, joissa SPRYCEL-hoitoa on annettu yhteensä potilaalle (aloitusannostus 100 mg kerran vuorokaudessa, 140 mg kerran vuorokaudessa, 50 mg kahdesti vuorokaudessa tai 70 mg kahdesti vuorokaudessa). Hoidetuista potilaasta 25%:ia oli 65-vuotiaita ja 5%:ia oli 75-vuotiaita. Hoidon keston mediaani oli 11 kuukautta (vaihteluväli 0,03-31 kuukautta). Suurin osa SPRYCELilla hoidetuista potilaista sai haittavaikutuksia jossain vaiheessa. Suurin osa reaktioista oli lieviä tai keskivaikeita. Hoito keskeytettiin haittavaikutusten vuoksi 11%:lla kroonisen vaiheen KML-potilaista, 12%:lla akseleraatiovaiheen KML-potilaista, 15%:lla myelooisen blastikriisivaiheen KML-potilaista ja 8%:lla lymfaattisen blastikriisivaiheen KML-potilaista tai Ph+ ALL -potilaista. Annoksen optimointia koskeneessa faasin III tutkimuksessa potilailla, joilla oli kroonisen vaiheen KML, haittavaikutuksista johtuneita hoidon keskeyttämisiä oli vähemmän, kun annostus oli 100 mg kerran vuorokaudessa (3%), kuin annostuksen ollessa 70 mg kahdesti vuorokaudessa (11%). Suurin osa kroonisen vaiheen KML-potilaista, jotka eivät sietäneet imatinibia sietivät dasatinibia. Faasi II yksihaaraisessa tutkimuksessa kolmelle SPRYCELilla hoidetusta 99 kroonisen vaiheen KMLpotilaasta, jotka eivät sietaneet imatinibia, kehittyi samanlainen 3. ja 4. asteen ei-hematologinen toksisuus kuin aikaisemman imatinibihoidon aikana; kaikkien 3 potilaiden SPRYCEL-hoitoa jatkettiin annoksen pienentämisen jälkeen. Useimmin raportoidut haittavaikutukset olivat nesteretentio (mukaan lukien pleuraeffuusio), ripuli, päänsärky, pahoinvointi, ihottuma, dyspnea, verenvuoto, väsymys, lihas- ja luukipu, infektio, oksentelu, yskä, vatsakipu ja kuume (taulukko 3). Lääkkeeseen liittyvää kuumeista neutropeniaa raportoitiin 5%:lla potilaista. Sekalaisia haittavaikutuksia, kuten pleuraeffuusio, askites, keuhkoedeema ja perikardiaalinen effuusio, johon liittyy tai ei liity pinnallista turvotusta, voidaan yhteisesti kuvata termillä nesteretentio. Dasatinibin käyttöön liittyy vaikeaa nesteretentiota 9%:lla potilaista. Vaikeaa pleuraeffuusiota raportoitiin 6%:lla potilaista ja vaikeaa perikardiaalieffuusiota 1%:lla potilaista. Sekä vaikeaa askitesta että yleistynyttä edeemaa raportoitiin kumpaakin < 1%:lla potilaista. Yhdellä prosentilla potilaista todettiin ei-sydänperäinen keuhkoedeema. Nesteretentiotapaukset hoidettiin tyypillisesti 7
7 tukihoitotoimenpiteillä, joihin sisältyi diureettien anto tai lyhytkestoinen steroidien anto. Vaikka SPRYCELin turvallisuusprofiili iäkkäämillä henkilöillä on samanlainen kuin nuoremmilla henkilöillä, nesteretentiota esiintyy todennäköisemmin 65-vuotiailla ja sitä vanhemmilla potilailla ja heitä tulee seurata tarkasti (ks. kohta 4.4). SPRYCELia saavilla potilailla raportoitiin lääkkeen käyttöön liittyviä verenvuototapahtumia, jotka vaihtelivat pienistä verenpurkaumista ja nenäverenvuodosta vaikeisiin ruoansulatuskanavan ja keskushermoston verenvuotoihin (ks. kohta 4.4). Vaikeaa keskushermoston verenvuotoa ilmeni < 1%:lla potilaista; 8 tapausta johti kuolemaan ja 5:een niistä liittyi CTC-asteikolla 4. asteen trombosytopenia. Vaikeaa ruoansulatuskanavan verenvuotoa ilmeni 4%:lla potilaista ja se vaati yleensä hoidon keskeyttämistä ja verensiirtoa. Muuta vaikeaa verenvuotoa ilmeni 2%:lla potilaista. Suurimpaan osaan verenvuototapahtumista liittyi tyypillisesti vaikea trombosytopenia. SPRYCEL-hoitoon liittyy anemiaa, neutropeniaa ja trombosytopeniaa. Näitä ilmenee useammin potilailla, joilla on edenneen vaiheen KML tai Ph+ ALL kuin potilailla, joilla on kroonisen vaiheen KML (ks. kohta 4.4). Annoksen optimointia koskeneessa faasin III tutkimuksessa potilailla, joilla oli kroonisen vaiheen KML (hoidon mediaanikesto noin 8 kuukautta), pleuraeffuusiota ja sydämen kongestiivista vajaatoimintaa / sydämen vajaatoimintaa esiintyi vähemmän, kun SPRYCEL-annostus oli 100 mg kerran vuorokaudessa, kuin SPRYCEL-annostuksen ollessa 70 mg kahdesti vuorokaudessa (taulukko 2a). Myös myelosuppressiota esiintyi harvemmin, kun annostus oli 100 mg kerran vuorokaudessa (ks. Poikkeavuudet laboratoriotesteissä). Taulukko 2a: Valikoidut haittavaikutukset annoksen optimointia koskeneessa faasin III tutkimuksessa: kroonisen vaiheen KML 100 mg kerran vuorokaudessa n = mg kerran vuorokaudessa n = mg kahdesti vuorokaudessa n = 166 Kaikki asteet Aste 3/4 Kaikki asteet Aste 3/4 Kaikki asteet Aste 3/4 70 mg kahdesti vuorokaudessa n = 167 Kaikki asteet Aste 3/4 Suositustermi Prosenttia (%) potilaista Ripuli Nesteretentio Pinnallinen edeema Pleuraeffuusio Yleistynyt edeema Sydämen kongestiivinen vajaatoiminta/ sydämen vajaatoiminta Perikardiaalinen effuusio Keuhkoedeema Pulmonaarinen hypertensio Verenvuoto Ruoansulatus-kanavan verenvuoto Annoksen optimointia koskeneessa faasin III tutkimuksessa potilailla, joilla oli edenneen vaiheen KML ja Ph+ ALL, esiintyi harvemmin nesteretentiota (pleuraeffuusiota ja perikardiaalista effuusiota), kun SPRYCEL-annostus oli 140 mg kerran vuorokaudessa, kuin annostuksen ollessa 70 mg kahdesti vuorokaudessa (taulukko 2b). 8
8 Taulukko 2b: Valikoidut haittavaikutukset annoksen optimointia koskeneessa faasin III tutkimuksessa: Edenneen vaiheen KML ja Ph+ ALL 140 mg kerran vuorokaudessa n = mg kahdesti vuorokaudessa n = 305 Kaikki asteet Aste 3/4 Kaikki asteet Aste 3/4 Suositustermi Prosenttia (%) potilaista Ripuli Nesteretentio Pinnallinen edeema 12 < Pleuraeffuusio Yleistynyt edeema Sydämen kongestiivinen vajaatoiminta/ sydämen vajaatoiminta Perikardiaalinen effuusio Keuhkoedeema Askites Pulmonaarinen hypertensio < 1 Verenvuoto Ruoansulatuskanavan verenvuoto Kliinisissä tutkimuksissa suositeltiin, että imatinibihoito keskeytettäisiin vähintään 7 vuorokautta ennen SPRYCEL-hoidon aloittamista. Haittavaikutukset: Seuraavia haittavaikutuksia raportoitiin SPRYCEL-valmisteen kliinisissä tutkimuksissa. Haittavaikutukset on esitetty elinjärjestelmittäin ja esiintyvyyden mukaan. Esiintyvyydet on luokiteltu seuraavasti: hyvin yleinen ( 1/10); yleinen ( 1/100, < 1/10); melko harvinainen ( 1/1 000, < 1/100), harvinainen ( 1/10 000, < 1/1 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Lääkkeeseen liittyvät haittavaikutukset (lukuun ottamatta laboratoriotestipoikkeavuuksia), joita esiintyi 5%:lla potilaista SPRYCELin kliinisissä tutkimuksissa, on esitetty Taulukossa 3: Taulukko 3: Lääkkeeseen liittyvät haittavaikutukset, joita esiintyi 5%:lla kliinisissä tutkimuksissa Kaikki potilaat (n= 2 182) Prosenttia (%) potilaista Kaikki asteet Asteet 3/4 Veri ja imukudos Yleinen: kuumeinen neutropenia 5 5 Hermosto Hyvin yleinen: päänsärky 25 1 Yleinen: neuropatia (myös perifeerinen neuropatia) 6 < 1 Hengityselimet, rintakehä ja välikarsina Hyvin yleinen: pleuraeffuusio, 25 6 dyspnea, 21 4 yskä 10 < 1 Ruoansulatuselimistö Hyvin yleinen: ripuli, 32 4 pahoinvointi,
9 oksentelu, 13 1 vatsakipu 10 1 Yleinen: ruoansulatuskanavan verenvuoto, 8 4 limakalvon tulehdus (mukaan lukien mukosiitti/stomatiitti), 7 < 1 dyspepsia, 5 0 vatsan pinkkottuneisuus 5 0 Iho ja ihonalainen kudos Hyvin yleinen: ihottuma a 22 1 Yleinen: kutina 7 < 1 Luusto, lihakset ja sidekudos Hyvin yleinen: lihas- ja luukipu 14 1 Yleinen: nivelkipu, 8 1 myalgia 8 < 1 Aineenvaihdunta ja ravitsemus Yleinen: ruokahaluttomuus 9 < 1 Infektiot Hyvin yleinen: infektio (mukaan lukien bakteeri-, virus-, sieni- ja ei-spesifinen 10 3 infektio) Verisuonisto Hyvin yleinen: verenvuoto b 15 2 Yleisoireet ja antopaikassa todettavat haitat Hyvin yleiset: pinnallinen edeema c, 21 < 1 väsymys, 21 2 kuume 13 1 Yleiset: kipu, 7 < 1 astenia, 9 1 rintakipu 5 1 a Kattaa seuraavat: lääkeaineihottuma, punoitus, erythema multiforme, erytroosi, hilseilevä ihottuma, sieni-ihottuma, yleistynyt punoitus, genitaalialueen ihottuma, kuumuuden laukaisema ihottuma, milia (luufinnit), ihottuma, punoittava ihottuma, follikulaarinen ihottuma, yleistynyt ihottuma, makulaarinen ihottuma, makulopapulaarinen ihottuma, papulaarinen ihottuma, kutiava ihottuma, pustuloosinen ihottuma, rakkulaihottuma, ihoärsytys ja rakkulainen nokkosihottuma. b Ei kata seuraavia: ruoansulatuskanavan verenvuoto on esitetty otsikon ruoansulatuselimistö ja keskushermoston verenvuorto otsikon hermosto alla. c Kattaa seuraavat: silmien turpoaminen, silmän sidekalvon turvotus, silmien edeema, silmäluomien edeema, kasvojen edeema, gravitaatioedeema, huuliedeema, paikallistunut edeema, makulaarinen edeema, genitaaliedeema, suun edeema, perifeerinen edeema, silmäkuopan edeema, siittimen edeema, periorbitaalinen edeema, pittingedeema (kuoppaturvotus), kivespussin edeema, kasvojen turpoaminen ja kieli edeema. Seuraavia lääkkeeseen liittyviä haittavaikutuksia esiintyi < 5%:lla potilaista SPRYCELin kliinisissä tutkimuksissa: Tutkimukset Yleinen: painonlasku, painonnousu Melko harvinainen: kohonnut veren kreatiinikinaasiarvo Sydän Yleinen: sydämen kongestiivinen vajaatoiminta / sydämen vajaatoiminta, perikardiaalinen effuusio, rytmihäiriöt (myös takykardia), palpitaatiot Melko harvinainen: sydäninfarkti, perikardiitti, kammioarytmia (myös kammiotakykardia), angina pectoris, kardiomegalia Harvinainen: cor pulmonale, sydänlihastulehdus, akuutti sepelvaltimotautikohtaus 10
10 Veri ja imukudos Yleinen: pansytopenia Harvinainen: puhdas punasoluaplasia Hermosto Yleinen: huimaus, makuhäiriö, uneliaisuus Melko harvinainen: keskushermoston verenvuoto, pyörtyminen, vapina, amnesia Harvinainen: aivoverenkierron häiriöt, ohimenevät aivoverenkiertohäiriöt (TIA), kouristuskohtaus Silmät Yleinen: näön häiriöt (mukaan lukien näön samentuminen ja näön tarkkuuden alentuminen), kuivasilmäisyys Melko harvinainen: konjunktiviitti Kuulo ja tasapainoelin Yleinen: tinnitus Melko harvinainen: vertigo Hengityselimet, rintakehä ja välikarsina Yleinen: keuhkoedeema, keuhkoinfiltraatio, pneumoniitti Melko harvinainen: bronkospasmi, pulmonaarinen hypertensio, astma Harvinainen: akuutti hengitysvaikeusoireyhtymä Ruoansulatuselimistö Yleinen: koliitti (myös neutropeeninen koliitti), gastriitti, ummetus, suun pehmytkudossairaus Melko harvinainen: haimatulehdus, ylemmän maha-suolikanavan haavauma, esofagiitti, askites, peräaukon haavauma, dysfagia Munuaiset ja virtsatiet Melko harvinainen: munuaisten vajaatoiminta, tiheä virtsaamistarve, proteinuria Iho ja ihonalainen kudos Yleinen: hiustenlähtö, dermatiitti (myös ekseema), akne, kuiva iho, urtikaria, liikahikoilu Melko harvinainen: akuutti kuumeinen neutrofiilinen dermatoosi, valoyliherkkyys, pigmenttihäiriö, pannikuliitti, ihohaavauma, rakkulaihottumat, kynnen rakennehäiriöt, käsi-jalkaoireyhtymä (kämmenten ja jalkapohjien erytrodysestesia) Luusto, lihakset ja sidekudos Yleinen: lihastulehdus, lihasheikkous Melko harvinainen: rabdomyolyysi, muskuloskeletaalinen jäykkyys Harvinainen: jännetulehdus Aineenvaihdunta ja ravitsemus Yleinen: ruokahalun häiriöt Melko harvinainen: hyperurikemia Infektiot Yleinen: sepsis (jopa kuolemaan johtava), pneumonia (myös bakteeri-, virus- ja sieniperäinen), ylähengitysteiden infektio/tulehdus, herpesvirusinfektio, enterokoliitti Vammat ja myrkytykset Yleinen: ruhjeet Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) Melko harvinainen: tuumorilyysioireyhtymä 11
11 Verisuonisto Yleinen: hypertensio, punastuminen Melko harvinainen: hypotensio, tromboflebiitti Harvinainen: livedo reticularis (sinikalpeus) Yleisoireet ja antopaikassa todettavat haitat Yleinen: yleistynyt edeema, vilunväristykset Melko harvinainen: huonovointisuus Harvinainen: lämpöintoleranssi Immuunijärjestelmä Melko harvinainen: yliherkkyys (myös kyhmyruusu) Maksa ja sappi Melko harvinainen: hepatiitti, kolestaasi Harvinainen: kolekystiitti Sukupuolielimet ja rinnat Melko harvinainen: gynekomastia, epäsäännölliset kuukautiset Psyykkiset häiriöt Yleinen: depressio, unettomuus Melko harvinainen: ahdistuneisuus, sekavuustila, mielialan ailahtelu, heikentynyt libido Poikkeavuudet laboratoriotesteissä: Hematologia: KML:ssa sytopeniat (trombosytopenia, neutropenia ja anemia) olivat yleinen löydös. Sytopenioiden esiintyvyys riippui kuitenkin myös selkeästi sairauden vaiheesta. Asteen 3 tai 4 hematologiset poikkeavuudet esitetään Taulukossa 4. Taulukko 4: CTC asteet 3/4 hematologiset laboratoriotulosten poikkeavuudet kliinisissä tutkimuksissa Lymfaattinen Myelooinen blastikriisivaihe Krooninen vaihe a ja blastikriisi- Akseleraatiovaihe vaihe Ph+ ALL (n= 1 150) (n= 502) (n= 280) (n= 250) Prosenttia (%) potilaista Hematologiset parametrit Neutropenia Trombosytopenia Anemia a Kroonisen vaiheen tiedot sisältävät potilaat, joita hoidettiin eri SPRYCEL-annoksilla. CTC asteet: neutropenia (aste /l, aste 4 < /l); trombosytopenia (aste /l, aste 4 < /l); anemia (hemoglobiini aste g/l, aste 4 < 65 g/l). Annoksen optimointia koskeneessa faasin III tutkimuksessa potilailla, joilla oli kroonisen vaiheen KML, neutropeniaa, trombosytopeniaa ja anemiaa esiintyi vähemmän, kun SPRYCEL-annostus oli 100 mg kerran vuorokaudessa, kuin SPRYCEL-annostuksen ollessa 70 mg kahdesti vuorokaudessa. Vaikean myelosuppression saaneet potilaat toipuivat yleensä lyhyen annostelun keskeyttämisen ja/tai annoksen pienentämisen jälkeen; pysyvästi hoito lopetettiin 1%:lla potilaista. Suurin osa potilaista jatkoi hoitoa ilman myelosuppression uudelleen ilmaantumista. 12
12 Biokemia: Asteen 3 ja 4 transaminaasi- tai bilirubiinipitoisuuksien suurenemista raportoitiin < 5%:lla kroonisen vaiheen tai akseleraatiovaiheen KML-potilaista, mutta myelooisen tai lymfaattisen blastikriisivaiheen KML-potilailla ja Ph+ ALL -potilailla suurenemista raportoitiin 4-7%:lla. Se hoidettiin yleensä annosta pienentämällä tai hoidon lopettamisella. Annoksen optimointia koskeneissa faasin III tutkimuksissa asteen 3 tai 4 transaminaasi- tai bilirubiiniarvojen nousua todettiin 1%:lla kroonisen vaiheen KML:a sairastavista potilaista, ja se oli yhtä harvinaista kaikissa neljässä hoitoryhmässä. Edenneen vaiheen KML:ssa ja Ph+ ALL:ssa näiden arvojen kohoamista todettiin 1-4%:lla potilaista. Keskimäärin 5%:lla dasatinibia saaneista potilaista, joilla oli normaali lähtöarvo, ilmeni asteen 3 ja 4 ohimenevää hypokalsemiaa jossain vaiheessa tutkimusta. Vähentyneeseen kalsiumin määrään ei yleensä liittynyt kliinisiä oireita. Asteen 3 tai 4 hypokalsemia korjaantui yleensä suun kautta otettavalla korvaushoidolla. Asteen 3 tai 4 hypokalsemiaa ja hypofosfatemiaa todettiin kaikissa KML:n vaiheissa, mutta ne olivat yleisempiä myelooisen tai lymfaattisen blastikriisivaiheen KML:a ja Ph+ ALL:a sairastavilla potilailla. Elektrokardiogrammi (EKG): Viidessä leukemiapotilaalla tehdyssä faasin II kliinisessä tutkimuksessa oli mukana 865 potilasta, jotka saivat SPRYCELia 70 mg kahdesti vuorokaudessa. Toistetut EKG:t otettiin ennalta määrättyinä ajankohtina ennen hoitoa ja hoidon aikana. EKG:t tulkittiin keskitetysti. QT-aika suhteutettiin sydämen sykkeeseen Friderician menetelmällä. Kaikkina annoksen ottamisen jälkeisinä ajankohtina 8:na päivänä keskimääräiset muutokset lähtötason QTcF-ajasta olivat 4-6 millisekuntia; (95%:n luottamusvälin yläraja oli < 7 millisekuntia) potilaalla, jotka saivat. SPRYCEL-hoitoa, 18 QTcajan pitenemistapausta raportoitiin haittavaikutuksena. 17 potilaalla (< 1%) QTcF oli yli 500 millisekuntia (ks. kohta 4.4). 4.9 Yliannostus Kliinisissä tutkimuksissa saadut kokemukset SPRYCEL-yliannostuksesta rajoittuvat yksittäisiin tapauksiin. Suurin raportoitu annostus on ollut 280 mg vuorokaudessa viikon ajan, eikä siihen liittynyt kliinisiä oireita. SPRYCEL-hoitoon voi liittyä vaikeaa myelosuppressiota (ks. kohta 4.4), ja siksi potilaiden tilaa on seurattava tarkoin myelosuppression varalta, jos suositeltu annostus ylitetään, ja asianmukaista tukihoitoa on annettava. 5. FARMAKOLOGISET OMINAISUUDET 5.1 Farmakodynamiikka Farmakoterapeuttinen ryhmä: proteiinikinaasin estäjät, ATC-koodi: L01XE06 Dasatinibi ehkäisee BCR-ABL-kinaasin ja SRC-kinaasiperheeseen kuuluvien kinaasien aktiivisuutta sekä myös lukuisten muiden onkogeenisten kinaasien, mukaan lukien c-kit, efriini (EPH) -reseptorikinaasit ja PDGFβ-reseptori, aktiivisuutta. Dasatinibi on voimakas BCR-ABL-kinaasin subnanomolaarinen estäjä 0,6-0,8 nm pitoisuuksina. Dasatinibi sitoutuu sekä inaktiivisessa että aktiivisessa muodossa olevaan BCR-ABL-entsyymiin. Dasatinibi tehoaa in vitro leukeemisiin solulinjoihin, jotka ovat imatinibille herkkiä tai resistenttejä. Ei-kliiniset tutkimukset osoittavat, että dasatinibi voi tehota imatinibiresistenssiin, joka on seurausta BCR-ABL:n yli-ilmentymästä, BCR-ABL-kinaasidomeenien mutaatioista, vaihtoehtoisten signaalireittien, joihin liittyvät SRC-perheen kinaasit (LYN, HCK), aktivoitumisesta ja monilääkeresistenssiä aiheuttavasta geeniyli-ilmentymästä. Dasatinibi estää SRC-perheen kinaaseja subnanomolaarisina pitoisuuksina. Erillisissä in vivo -tutkimuksissa, joissa käytettiin KML:n hiirimalleja, dasatinibi esti kroonisen vaiheen KML:n etenemisen blastikriisivaiheeseen ja lisäsi elinaikaa hiirillä, joihin oli siirretty potilaiden eri elimistön alueilta, myös keskushermostosta, saatuja KML-solulinjoja. 13
13 Kliiniset tutkimukset: Faasin I tutkimuksessa havaittiin hematologinen ja sytogeneettinen vaste kaikissa KML:n vaiheissa ja Ph+ ALL:ssa ensimmäisillä 84 potilaalla, joita hoidettiin ja tutkittiin 27 kuukauden ajan. Vaste säilyi kaikkien KML- ja Ph+ ALL -tautivaiheiden ajan. Kliinisissä tutkimuksissa arvioitiin potilasta, joista 25% oli 65-vuotiaita ja 5% 75-vuotiaita. SPRYCELin turvallisuutta ja tehoa ei ole vielä tutkittu lapsipotilailla. Faasin II kliiniset tutkimukset KML-potilailla: Neljässä yksihaaraisessa, kontrolloimattomassa, avoimessa faasin II kliinisessä tutkimuksessa selvitettiin SPRYCELin turvallisuutta ja tehoa KML:n kroonista, akseleraatio- tai myelooista blastikriisivaihetta sairastavilla potilailla, jotka olivat imatinibiresistenttejä tai -intolerantteja. Yksi satunnaistettu ei-vertaileva tutkimus tehtiin kroonisen vaiheen potilailla, joiden hoito 400 tai 600 mg:lla imatinibia vuorokaudessa oli epäonnistunut. SPRYCELin aloitusannos oli 70 mg kahdesti vuorokaudessa. Annosmuutokset hyväksyttiin tehon parantamiseksi tai toksisuuden hoitamiseksi (ks. kohta 4.2). SPRYCELin tehokkuus perustuu hematologiseen ja sytogeneettiseen vasteeseen. Hoitovasteen kesto ja arvioitu eloonjäämisaste tuovat lisänäyttöä SPRYCELin kliinisistä eduista. Kroonisen vaiheen KML: Kaksi kliinistä tutkimusta tehtiin potilailla, jotka olivat imatinibiresistenttejä tai -intolerantteja; ensisijainen hoitotehon tulosmuuttuja näissä tutkimuksissa oli merkittävä sytogeneettinen vaste (MCyR): 1. Avoin, satunnaistettu, ei-vertaileva monikeskustutkimus tehtiin potilailla, joiden hoito 400 tai 600 mg:lla imatinibia epäonnistui. Potilaat satunnaistettiin (2:1) saamaan dasatinibia (70 mg kahdesti vuorokaudessa) tai imatinibia (400 mg kahdesti vuorokaudessa). Siirtyminen vaihtoehtoiseen hoitoryhmään sallittiin, jos potilailla havaittiin taudin etenemistä tai intoleranssia, jota ei voitu hoitaa annosta muuttamalla. Primaari päätetapahtuma oli merkittävä sytogeneettinen vaste (MCyR) 12 viikon kohdalla. Tuloksia on saatavilla 150 potilaasta: 101 satunnaistettiin SPRYCEL-hoitoon ja 49 imatinibihoitoon (kaikki imatinibiresistenttejä). Mediaaniaika diagnoosista satunnaistamiseen oli 64 kuukautta dasatinibiryhmässä ja 52 kuukautta imatinibiryhmässä. Kaikki potilaat olivat saaneet runsaasti aikaisempia hoitoja. Täydellisen hematologisen vasteen imatinibille oli aikaisemmin saavuttanut 93% koko potilaspopulaatiosta. Merkittävän sytogeneettisen vasteen imatinibille oli aikaisemmin saavuttanut 28% dasatinibiryhmän potilaista ja 29% imatinibiryhmän potilaista. Hoidon keston mediaani dasatinibilla oli 23 kuukautta (44%:a potilaista hoidettiin > 24 kuukautta) ja imatinibilla 3 kuukautta (10%:a potilaista > 24 kuukautta). Dasatinibiryhmässä 93% potilaista saavutti täydellisen hematologisen vasteen ennen siirtymistä toiseen hoitoon ja 82% imatinibiryhmän potilaista saavutti täydellisen hematologisen vasteen ennen toiseen hoitoon siirtymistä. Kolmen kuukauden seurannassa merkittävä sytogeneettinen vaste saavutettiin useammin dasatinibiryhmässä (36%) kuin imatinibiryhmässä (29%). 22% dasatinibiryhmän potilaista sai täydellisen sytogeneettisen vasteen, kun taas vain 8% imatinibiryhmän potilaista saavutti täydellisen sytogeneettisen vasteen (CCyR). Pidemmän hoitojakson ja seurannan aikana (hoidon mediaani 24 kk) 53%:lla SPRYCEL-hoitoa saaneesta potilaalla saavutettiin merkittävä sytogeneettinen vaste (44%:lla täydellinen hemologinen vaste, CCyR) ja 33%:lla 400 mg imatinibilla hoidetuista potilailla (18:lla täydellinen hemologinen vaste, CCyR) ennen siirtymistä toiseen hoitoon. SPRYCEL-hoitoa saaneesta potilaalla, jotka olivat saaneet 400 mg imatinibia ennen tutkimukseen osallistumista, 61%:lla saavutettiin merkittävä sytogeneettinen vaste SPRYCEL-tutkimushaarassa ja 50%:lla imatinibihaarassa. Kaplan-Meier arvion perusteella merkittävä sytogeneettinen vaste säilyi vuoden ajan 92%:lla (95% CI: [85%-100%]) SPRYCEL-ryhmässä (CCyR 97%, 95% CI: [92%-100%]) ja 74%:lla (95% CI: [49%-100%]) imatinibiryhmässä (CCyR 100%). Merkittävä sytogeneettinen vaste säilyi 18 kuukautta 14
14 90%:lla (95% CI: [82%-98%]) SPRYCEL-ryhmässä (CCyR 94%, 95% CI: [87%-100%]) ja 74%:lla (95% CI: [49%-100%]) imatinibiryhmässä (CCyR 100%). Kaplan-Meier arvion perusteella vuoden kuluttua eloon jääneitä ilman taudin etenemistä oli 91%:ia (95% CI: [85%-97%]) SPRYCEL-ryhmässä ja 73%:ia (95% CI: [54%-91%]) imatinibiryhmässä. 2 vuoden kuluttua oli elossa 86%:ia potilaista, joilla tauti ei ollut edennyt (95% CI: [78%-93%]) SPRYCEL-ryhmästä ja 65%:ia potilaista (95% CI: [43%-87%]) imatinibiryhmästä. Dasatinibiryhmän potilaista 43%:lla ja imatinibiryhmän potilaista 82%:lla hoito epäonnistui. Epäonnistumiseksi määritettiin sairauden eteneminen tai siirtyminen toiseen hoitoon (vasteen puute, tutkimuslääkeintoleranssi yms.). Merkittävä molekulaarisen vasteentaso (määritetty BCR-ABL/kontrollitranskriptio 0.1% RQ-PCR ääreisveren näytteistä) oli 29%:ia SPRYCEL-ryhmässä ja 12%:ia imatinibiryhmässä ennen siirtymistä toiseen hoitoon. 2. Avoin, yksihaarainen monikeskustutkimus tehtiin imatinibi-resistenteillä tai -intoleranteilla potilailla (potilaat, joilla oli merkittäviä haittavaikutuksia aikaisemman imatinibihoidon aikana). 387 potilasta sai dasatinibia 70 mg kahdesti vuorokaudessa (288 resistenttiä ja 99 intoleranttia). Mediaaniaika diagnoosista hoidon aloittamiseen oli 61 kuukautta. Suurin osa potilaista (53%) oli saanut aikaisemmin imatinibihoitoa yli 3 vuoden ajan. Resistenteimmät potilaat (72%) olivat saaneet > 600 mg imatinibia vuorokaudessa. 35% potilaista oli saanut imatinibin lisäksi aikaisemmin sytotoksista kemoterapiaa, 65% interferonia ja 10%:lle oli aikaisemmin tehty kantasolujensiirto. 38%:lla potilaista oli lähtötilanteessa mutaatioita, joiden tiedetään vaikuttavan imatinibiresistenssiin. SPRYCEL-hoidon keston mediaani oli 24 kuukautta ja 51%:a potilaista hoidettiin > 24 kuukautta. Tulokset hoitotehosta on esitetty Taulukossa 5. Merkittävä sytogeneettinen vaste (MCyR) saavutettiin 55% imatinibiresistenttillä potilaalla ja 82% imatinibi-intoleranttilla potilaalla. Vähintään 24 kuukauden seurantatutkimuksessa tauti oli edennyt vain 21 potilaalla 240 potilaasta, jotka olivat saavuttaneet merkittävän sytogeneettisen vasteen, eikä merkittävän sytogeneettisen vasteen mediaanikestoa saavutettu. Kaplan-Meier arvion perusteella merkittävä sytogeneettinen vaste (MCyR) säilyi 95%:lla (95% CI: [92%-98%]) potilaista vuoden ajan ja 88%:lla (95% CI: [83%-93%]) potilaista 2 vuotta. Täydellinen hemologinen vaste säilyi 97%:lla (95% CI: [94%-99%]) potilaista vuoden ajan ja 90%:lla (95% CI: [86%-95%]) potilaista 2 vuotta. 55% imatinibiresistenttillä potilaalla, joilla aiemmin ei saavutettu merkittävää sytogeneettistä vastetta imatinibille (n= 288), saavutettiin merkittävä sytogeneettinen vaste dasatinibille. 38%:lla potilaalla, jotka osallistuivat tähän tutkimukseen, oli 45 erilaista BCR-ABL-mutaatiota. Täydellinen hematologinen vaste tai merkittävä sytogeneettinen vaste saavutettiin potilailla, joilla oli erilaisia imatinibiresistenssiin liittyviä BCR-ABL -mutaatioita lukuun ottamatta T315I. 2 vuoden kohdalla potilailla oli samanlainen merkittävän sytogeneettisen vasteen taso riippumatta, jos heillä lähtötilanteessa oli BCR-ABL-mutaatio (63%), P-loopin mutaatio (61%) tai ei mutaatioita (62%). Arvioitu eloonjääminen ilman taudin etenemistä imatinibiresistenttille potilaille oli 88%:ia (95% CI: [84%-92%]) vuoden kuluttua ja 75%:ia (95% CI: [69%-81%]) 2 vuoden kuluttua. Arvioitu eloonjääminen ilman taudin etenemistä imatinibi-intoreranteille potilaille oli 98%:ia (95% CI: [95%-100%]) vuoden kuluttua ja 94%:ia (95% CI: [88%-99%]) 2 vuoden kuluttua. Merkittävän molekulaarisen vasteentaso 24 kuukauden kohdalla oli 45%:ia (35%:ia imatinibiresistenteille potilaille ja 74%:ia imatinibi-intoleranteille potilaille). Akseleraatiovaiheen KML: Avoin, yksihaarainen, monikeskustutkimus tehtiin imatinibiresistenteillä tai -intoleranteilla potilailla. 174 potilasta sai dasatinibia 70 mg kahdesti vuorokaudessa (161 imatinibiresistenttiä ja 13 imatinibiintoleranttia). Mediaaniaika diagnoosista hoidon aloittamiseen oli 82 kuukautta. SPRYCEL-hoidon keston mediaani oli 14 kuukautta ja 31%:a potilaista hoidettiin > 24 kuukautta. Tulokset tehokkuudesta on raportoitu Taulukossa 5. 15
15 Myelooisen blastikriisivaiheen KML: Avoin, yksihaarainen monikeskustutkimus tehtiin imatinibi-intoleranteilla tai -resistenteillä potilailla. 109 potilasta sai dasatinibia 70 mg kahdesti vuorokaudessa (99 imatinibiresistenttiä ja 10 imatinibiintoleranttia). Mediaaniaika diagnoosista hoidon aloittamiseen oli 48 kuukautta. SPRYCEL-hoidon mediaanikesto oli 3,5 kuukautta ja 12%:a potilaista hoidettiin > 24 kuukautta. Tulokset hoitotehosta on esitetty Taulukossa 5. Kliiniset tutkimukset lymfaattisen blastikriisivaiheen KML:ssa ja Ph+ ALL:ssa: Avoin, yksihaarainen monikeskustutkimus tehtiin lymfaattisen blastikriisivaiheen KML-potilailla tai Ph+ ALL -potilailla, jotka olivat resistenttejä tai intolerantteja aikaisemmalle imatinibihoidolle. 48 lymfaattisen blastikriisivaiheen KML-potilasta sai dasatinibia 70 mg kahdesti vuorokaudessa (42 imatinibiresistenttiä ja 6 imatinibi-intoleranttia). Mediaaniaika diagnoosista hoidon aloittamiseen oli 28 kuukautta. SPRYCEL-hoidon keston mediaani oli 3 kuukautta ja 2%:a potilaista hoidettiin > 24 kuukautta. Lisäksi 46 Ph+ ALL -potilasta sai dasatinibia 70 mg kahdesti vuorokaudessa (44 imatinibiresistenttiä ja 2 imatinibi-intoleranttia). Mediaaniaika diagnoosista hoidon aloittamiseen oli 18 kuukautta. SPRYCEL-hoidon keston mediaani oli 3 kuukautta ja 7%:a potilaista hoidettiin > 24 kuukautta. Tulokset hoitotehosta on raportoitu Taulukossa 45. Huomattavaa on, että merkittävät hematologiset vasteet (MaHR) saavutettiin nopeasti (suurin osa 35 päivän sisällä ensimmäisestä dasatinibiannoksesta lymfaattisen blastikriisivaiheen KML-potilailla ja 55 päivän sisällä Ph+ ALL -potilailla). 16
16 Taulukko 5: Hematologinen vaste b (%) Hoitoteho SPRYCELin faasi II yksihaaraisissa kliinisissä kokeissa a Krooninen (n= 387) Akseleraatio (n= 174) Myelooinen blastikriisi (n= 109) Lymfaattinen blastikriisi (n= 48) Ph+ ALL (n= 46) MaHR (95% CI) n/a 64% (57 72) 33% (24 43) 35% (22 51) 41% (27 57) CHR (95% CI) 91% (88 94) 50% (42 58) 26% (18 35) 29% (17 44) 35% (21 50) NEL (95% CI) n/a 14% (10 21) 7% (3 14) 6% (1 17) 7% (1 18) MaHR kesto (%; Kaplan-Meier arvio) 1 vuosi n/a 79% (71-87) 71% (55-87) 29% (3-56) 32% (8-56) 2 vuosi n/a 60% (50-70) 41% (21-60) 10% (0-28) 24% (2-47) Sytogeneettinen vaste c (%) MCyR (95% CI) 62% (57 67) 40% (33 48) 34% (25 44) 52% (37 67) 57% (41 71) CCyR (95% CI) 54% (48 59) 33% (26 41) 27% (19 36) 46% (31 61) 54% (39 69) Eloonjääminen (%; Kaplan-Meier arvio) Ilman taudin etenemistä 1 vuosi 91% (88-94) 64% (57-72) 35% (25-45) 14% (3-25) 21% (9-34) 2 vuosi 80% (75-84) 46% (38-54) 20% (11-29) 5% (0-13) 12% (2-23) Kokonaisvaste 1 vuosi 97% (95-99) 83% (77-89) 48% (38-59) 30% (14-47) 35% (20-51) 2 vuosi 94% (91-97) 72% (64-79) 38% (27-50) 26% (10-42) 31% (16-47) a Lihavoidutu numerot ovat primäärin päätetapahtuman tulokset. b Hematologisen vasteen kriteerit (kaikki vasteet vahvistetaan 4 viikon jälkeen): merkittävä hematologinen vaste (MaHR) = täydellinen hematologinen vaste (CHR) + ei merkkejä leukemiasta (NEL). CHR (kroonisen vaiheen KML): valkosoluja normaalin yläraja, verihiutaleita < 450,000/mm 3, ei blasteja tai promyelosyyttejä ääreisverenkierrossa, < 5% myelosyyttejä + metamyelosyyttejä ääreisverenkierrossa, basofiileja ääreisverenkierrossa < 20%, eikä extramedullaarista sairautta. CHR (edennyt KML/Ph+ ALL): valkosoluja normaalin yläraja, absoluuttinen neutrofiilien määrä 1 000/mm 3, verihiutaleiden 100,000/mm 3, ei blasteja tai promyelosyyttejä ääreisverenkierrossa, luuydinblasteja 5%, < 5% myelosyyttejä + metamyelosyyttejä ääreisverenkierrossa, basofiileja ääreisverenkierrossa < 20%, eikä extramedullaarista sairautta. NEL: samat kriteerit kuin CHR:ssa paitsi absoluuttinen neutrofiilien määrä 500/mm 3 ja < 1 000/mm 3 tai verihiutaleita 20,000/mm 3 ja 100,000/mm 3. c Sytogeneettisen vasteen kriteerit: täydellinen (0% Ph+ metafaaseja) tai osittainen (> 0% 35%). Merkittävässä hematologisessa vasteessa, MCyR (0% 35%) yhdistyvät sekä täydellinen että osittainen vaste. n/a = ei saatavilla, CI = luottamusväli, ULN = normaaliarvon yläraja (upper limit normal range) SPRYCEL-hoidon jälkeen luuytimensiirron saaneiden potilaiden lopullista hoitotulosta ei ole arvioitu. Faasin III kliiniset tutkimukset Kahdessa avoimessa satunnaistetussa tutkimuksessa verrattiin kerran vuorokaudessa annetun SPRYCEL-hoidon tehoa kahdesti vuorokaudessa annetun SPRYCEL-hoidon tehoon. 1. Tutkimuksessa, jossa oli mukana kroonisen vaiheen KML:a sairastavia potilaita, ensisijainen tulosmuuttuja oli imatinibille resistenttien potilaiden merkittävä sytogeneettinen vaste (MCyR). Tärkein toissijainen tulosmuuttuja oli imatinibille resistenttien potilaiden merkittävä sytogeneettinen vaste (MCyR) suhteessa kokonaisvuorokausiannokseen. Muita toissijaisia tulosmuuttujia olivat merkittävän sytogeneettisen vasteen kesto, elinaika ilman taudin etenemistä (PFS) ja kokonaiselinaika. Yhteensä 670 potilasta, joista 498 oli imatinibiresistenttejä, jaettiin satunnaistetusti ryhmiin, jotka saivat SPRYCEL-hoitoa 100 mg kerran vuorokaudessa, 140 mg kerran vuorokaudessa, 50 mg kahdesti vuorokaudessa tai 70 mg kahdesti vuorokaudessa. Hoidon keston mediaani oli noin 8 kuukautta (vaihteluväli < 1 15 kuukautta). 17
17 Hoitovasteet esitetään Taulukossa 6. Hoito todettiin tehokkaaksi kaikissa SPRYCEL-hoitoryhmissä, ja ensisijaiseen tehoa mittaavaan tulosmuuttujaan perustuva teho oli yhdenvertainen (non-inferiority) kerran vuorokaudessa ja kahdesti vuorokaudessa hoitoa saaneissa ryhmissä (merkittävän sytogeneettisen vasteen ero 2,8%, 95%:n luottamusväli [-6% - 11,6%]). Myös tutkimuksen tärkeimmän toissijaisen tulosmuuttujan perusteella 100 mg:n kokonaisvuorokausiannos ja 140 mg:n kokonaisvuorokausiannos olivat yhdenvertaiset (non-inferiority) (merkittävän sytogeneettisen vasteen ero -0,8%, 95%:n luottamusväli [-9,6% - 8,0%]). Merkittävän sytogeneettisen vasteen kesto, elinaika ilman taudin etenemistä ja kokonaiselinaika olivat samalla tasolla kaikissa neljässä hoitoryhmässä. Kokonaiselinajan mediaania ei ollut saavutettu yhdessäkään näistä neljästä hoitoryhmästä. Taulukko 6: SPRYCEL -hoidon teho annoksen optimointia koskeneessa faasin III tutkimuksessa: kroonisen vaiheen KML 100 mg kerran vuorokaudessa 50 mg kahdesti vuorokaudessa 140 mg kerran vuorokaudessa 70 mg kahdesti vuorokaudessa n = 167 n = 168 n = 167 n = 168 Prosenttia (%) potilaista Hematologinen vaste a (%) CHR Sytogeneettinen vaste b (%) MCyR Kaikki potilaat (95% CI) 59 (51-66) 54 (46-61) 56 (48-63) 55 (48-63) Imatinibiresistentit 53 (66/124) 47 (58/124) 50 (62/123) 51 (65/127) potilaat (n/n) CCyR Kaikki potilaat Imatinibiresistentit 34 (42/124) 35 (43/124) 36 (44/123) 39 (50/127) potilaat (n/n) a Hematologisen vasteen kriteerit (kaikki vasteet vahvistettu 4 viikon jälkeen): CHR (kroonisen vaiheen KML): valkosoluja normaalin yläraja (institutional ULN), verihiutaleita < /mm 3, ei blasteja tai promyelosyyttejä ääreisverenkierrossa, < 5% myelosyyttejä + metamyelosyyttejä ääreisverenkierrossa, < 20% basofiileja ääreisverenkierrossa eikä ekstramedullaarista sairautta. b Sytogeneettisen vasteen kriteerit: täydellinen (0% Ph+-metafaaseja) tai osittainen (> 0% 35%). Merkittävässä sytogeneettisessä vasteessa (MCyR) (0% 35%) yhdistyvät sekä täydellinen (CCyR) että osittainen vaste. 2. Tutkimuksessa, jossa oli mukana edenneen vaiheen KML:a ja Ph+ ALL:a sairastavia potilaita, ensisijainen tulosmuuttuja oli merkittävä hematologinen vaste (MaHR). Yhteensä 611 potilasta jaettiin satunnaistetusti ryhmiin, jotka saivat SPRYCEL-hoitoa joko 140 mg kerran vuorokaudessa tai 70 mg kahdesti vuorokaudessa. Hoidon keston mediaani oli noin 6 kuukautta (vaihteluväli < 1 16 kuukautta). Ensisijaiseen tehoa mittaavaan tulosmuuttujaan perustuva teho oli yhdenvertainen (non-inferiority) kerran vuorokaudessa ja kahdesti vuorokaudessa hoitoa saaneissa ryhmissä (merkittävän hematologisen vasteen ero 0,2%, 95%:n luottamusväli [-7,8% - 8,1%]). Kuuden kuukauden seurannan aikana vasteen kesto näyttäisi kuitenkin suosivan kahdesti vuorokaudessa tapahtuvaa annostelua edenneen taudin kaikissa eri vaiheissa, erityisesti vaiheissa, joihin liittyy lymfaattista transformaatiota. Siksi 70 mg kahdesti vuorokaudessa on edelleen suositeltu annostus edenneen vaiheen KML:a ja Ph+ ALL:a sairastavien imatinibiresistenttien tai -intoleranttien potilaiden hoidossa. 5.2 Farmakokinetiikka Dasatinibin farmakokinetiikkaa tutkittiin 229 terveellä aikuisella koehenkilöllä sekä 84 potilaalla. 18
18 Imeytyminen: Dasatinibi imeytyy nopeasti potilailla oraalisen annon jälkeen ja huippupitoisuudet saavutetaan 0,5-3 tunnissa. Oraalisen annon jälkeen keskimääräisen altistuksen lisääntyminen (AUC τ ) on suunnilleen suhteessa annoslisäyksiin, kun annos on mg kaksi kertaa vuorokaudessa. Dasatinibin keskimääräinen terminaalinen puoliintumisaika potilailla on noin 5-6 tuntia. Terveillä koehenkilöillä, joille annettiin 100 mg:n kerta-annos dasatinibia 30 minuuttia runsasrasvaisen aterian jälkeen, dasatinibin keskimääräinen AUC suureni 14%. Kun 30 minuuttia ennen dasatinibin antoa annettiin vähärasvainen ateria, kasvoi dasatinibin keskimääräinen AUC 21%. Havaitut ruoan vaikutukset altistukseen eivät ole kliinisesti merkittäviä. Jakaantuminen: Potilailla dasatinibin näennäinen jakautumistilavuus on suuri (2 505 l), mikä viittaa siihen, että lääkevalmiste kulkeutuu hyvin suuressa määrin verisuonien ulkopuolelle. In vitro -tutkimusten perusteella dasatinibi sitoutui noin 96-prosenttisesti plasman proteiineihin kliinisesti merkittävinä pitoisuuksina. Metabolia: Dasatinibi metaboloituu merkittävästi ihmisillä useiden entsyymien vaikutuksesta. Terveillä koehenkilöillä, joille annettiin 100 mg [ 14 C]-merkittyä dasatinibia, muuttumaton dasatinibi edusti 29% plasman radioaktiivisuudesta. Pitoisuudet plasmassa ja mitattu in vitro -aktiivisuus osoittavat, että dasatinibin metaboliiteilla ei todennäköisesti ole merkitystä lääkkeen farmakologiassa. CYP3A4 on tärkein dasatinibia metaboloiva entsyymi. Eliminaatio: Eliminaatio tapahtuu pääasiassa ulosteeseen, enimmäkseen metaboliitteina. [ 14 C]-merkityn dasatinibin oraalisen kerta-annoksen jälkeen noin 89% annoksesta eliminoitui 10 päivässä ja radioaktiivisuudesta 4% päätyi virtsaan ja 85% ulosteeseen. Virtsaan erittyneestä annoksesta 0,1% ja ulosteeseenn erittyneestä annoksesta 19% oli muuttumatonta dasatinibia ja loput metaboliitteja. Elimen vajaatoiminta: Dasatinibi ja sen metaboliitit erittyvät vähäisessä määrin munuaisten kautta. Dasatinibialtistus saattaa kasvaa maksan vajaatoiminnassa. 5.3 Prekliiniset tiedot turvallisuudesta Dasatinibin ei-kliinistä turvallisuusprofiilia arvioitiin in vitro- ja in vivo -tutkimussarjalla hiirillä, rotilla, apinoilla ja kaneilla. Tärkeimmät toksisuudet esiintyivät ruoansulatuskanavassa ja hematopoieettisessa tai lymfaattisessa järjestelmässä. Gastrointestinaalitoksisuus oli annosta rajoittava tekijä rotilla ja apinoilla. Rotilla vähäisiin tai pieniin punasoluparametrien laskuihin liittyi luuydinmuutoksia; samanlaisia muutoksia esiintyi apinoilla, mutta niitä esiintyi harvemmin. Lymfaattisen järjestelmän toksisuuteen kuului rotilla imusolmukkeiden, pernan ja kateenkorvan imukudostoiminnan heikkeneminen sekä lymfaattisen järjestelmän elinten painon pieneneminen. Muutokset ruoansulatuskanavassa sekä hematopoieettisen ja lymfaattisen järjestelmän muutokset palautuivat hoidon keskeyttämisen jälkeen. Munuaismuutokset apinoilla, joita hoidettiin enimmillään 9 kuukautta, rajoittuivat munuaisten normaalin mineralisaation lisääntymiseen. Ihoverenvuotoa esiintyi akuuteissa oraalisissa kertaannostutkimuksissa apinoilla, mutta ei toistuvan annon tutkimuksissa apinoilla eikä rotilla. Rotilla dasatinibi ehkäisi verihiutaleiden aggregaatiota in vitro ja pitkitti orvaskeden verenvuotoaikaa in vivo, mutta ei aiheuttanut spontaania verenvuotoa. Dasatinibin aktiivisuus in vitro herg- ja Purkinjen säikeillä suoritetuissa tutkimuksissa viittasi siihen, että sydänkammion repolarisaation piteneminen (QT-aika) on mahdollista. Kuitenkaan in vivo -kertaannostutkimuksissa tajuissaan olevilla, telemetrian avulla seuratuilla apinoilla ei esiintynyt QT-ajan tai EKG:n muutoksia. 19
19 Dasatinibi ei ollut mutageeninen in vitro -bakteerisolututkimuksissa (Amesin testi) eikä genotoksinen in vivo -mikronukleuskokeessa rotalla. Dasatinibi oli klastogeeninen in vitro kiinanhamsterin jakaantuvissa munasoluissa. Alkion- ja sikiönkehitystä koskevissa tutkimuksissa dasatinibi indusoi alkiokuolleisuutta, johon liittyi rottapoikueen koon pienenemistä sekä sikiön luuston muutoksia rotilla ja kaneilla. Nämä muutokset rotilla ja kaneilla ilmenivät annoksilla, jotka eivät aiheuttaneet toksisuutta emoille. Dasatinibin vaikutuksia urosten ja naaraiden hedelmällisyyteen ei tiedetä. Dasatinibi indusoi immunosuppressiota hiirillä. Vaikutus oli annoksesta riippuvainen ja saatiin hyvin hallintaan dasatinibin annosta pienentämällä ja/tai annosaikataulua muuttamalla. Dasatinibilla oli fototoksisia vaikutuksia in vitro -fototoksisuusanalyysissä (neutral red uptake) hiiren fibroblasteissa. Dasatinibilla ei ole tehty karsinogeenisuustutkimuksia. 6. FARMASEUTTISET TIEDOT 6.1 Apuaineet Tabletin ydin: Laktoosimonohydraatti Selluloosa, mikrokiteinen Kroskarmelloosinatrium Hydroksipropyyliselluloosa Magnesiumstearaatti Kalvopäällyste: Hypromelloosi Titaanidioksidi Makrogoli Yhteensopimattomuudet Ei oleellinen. 6.3 Kestoaika 2 vuotta 6.4 Säilytys Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita. 6.5 Pakkaustyyppi ja pakkauskoot Alumiini/alumiini-läpipainopakkaukset (kalenteriläpipainopakkaukset ja kertaannosläpipainopakkaukset) ja HDPE (suuritiheyksinen polyeteeni) -purkki, jossa lapsiturvallinen polypropyleenisuljin. Pahvipakkaukset, joissa 56 kalvopäällysteistä tablettia sisältäen 4 läpipainoliuskaa, joissa jokaisessa on 14 tablettia. Pahvipakkaukset, joissa 60 kalvopäällysteistä tablettia kerta-annosläpipainopakkauksissa. Pahvipakkaukset, joissa 60 kalvopäällysteistä tablettia sisältävä purkki. 20
20 Kaikkia pakkauskokoja ei välttämättä ole myynnissä. 6.6 Erityiset varotoimet hävittämiselle Tabletit koostuvat tablettiytimestä sekä sitä peittävästä kalvopäällysteestä, jonka tarkoitus on ehkäistä terveydenhuoltohenkilöstön altistus vaikuttavalle aineelle. Jos tabletit kuitenkin vahingossa murskautuvat tai hajoavat, terveydenhuoltohenkilöstön tulee käyttää lääkkeen hävittämisessä kertakäyttöisiä käsineitä ihoaltistusriskin minimoimiseksi. Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. 7. MYYNTILUVAN HALTIJA BRISTOL-MYERS SQUIBB PHARMA EEIG Uxbridge Business Park Sanderson Road Uxbridge UB8 1DH Yhdistynyt kuningaskunta 8. MYYNTILUVAN NUMERO(T) EU/1/06/363/ kalvopäällysteistä tablettia (läpipainopakkaus) EU/1/06/363/ x 1 kalvopäällysteistä tablettia (kerta-annosläpipainopakkaus) EU/1/06/363/ kalvopäällysteistä tablettia (pullo) 9. MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ/UUDISTAMISPÄIVÄMÄÄRÄ 20. marraskuuta TEKSTIN MUUTTAMISPÄIVÄMÄÄRÄ
Yksi tabletti sisältää dasatinibimonohydraattia, joka vastaa 20 mg dasatinibia.
 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää dasatinibimonohydraattia, joka vastaa 20 mg dasatinibia. Apuaineet: yksi
1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää dasatinibimonohydraattia, joka vastaa 20 mg dasatinibia. Apuaineet: yksi
Yksi kalvopäällysteinen tabletti sisältää 70 mg dasatinibia (dasatinibimonohydraattina).
 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 70 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 70 mg dasatinibia (dasatinibimonohydraattina). Apuaineet:
1. LÄÄKEVALMISTEEN NIMI SPRYCEL 70 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 70 mg dasatinibia (dasatinibimonohydraattina). Apuaineet:
Yksi kalvopäällysteinen tabletti sisältää dasatinibimonohydraattia vastaten 50 mg dasatinibia.
 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 50 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää dasatinibimonohydraattia vastaten 50 mg dasatinibia. Apuaineet
1. LÄÄKEVALMISTEEN NIMI SPRYCEL 50 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää dasatinibimonohydraattia vastaten 50 mg dasatinibia. Apuaineet
Yksi kalvopäällysteinen tabletti sisältää dasatinibimonohydraattia vastaten 100 mg dasatinibia.
 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 100 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää dasatinibimonohydraattia vastaten 100 mg dasatinibia.
1. LÄÄKEVALMISTEEN NIMI SPRYCEL 100 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää dasatinibimonohydraattia vastaten 100 mg dasatinibia.
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää dasatinibimonohydraattia, joka vastaa 20 mg
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää dasatinibimonohydraattia, joka vastaa 20 mg
Yksi kalvopäällysteinen tabletti sisältää 70 mg dasatinibia (dasatinibimonohydraattina).
 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 70 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 70 mg dasatinibia (dasatinibimonohydraattina). Apuaineet:
1. LÄÄKEVALMISTEEN NIMI SPRYCEL 70 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 70 mg dasatinibia (dasatinibimonohydraattina). Apuaineet:
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.1 Käyttöaiheet. 4.2 Annostus ja antotapa
 1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
1. LÄÄKEVALMISTEEN NIMI Betahistin Orifarm 8 mg tabletit Betahistin Orifarm 16 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää 8 mg tai 16 mg betahistiinidihydrokloridia Täydellinen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Dasatinib Sandoz 20 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dasatinib Sandoz 20 mg kalvopäällysteiset tabletit Dasatinib Sandoz 50 mg kalvopäällysteiset tabletit Dasatinib Sandoz 70 mg kalvopäällysteiset tabletit Dasatinib
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dasatinib Sandoz 20 mg kalvopäällysteiset tabletit Dasatinib Sandoz 50 mg kalvopäällysteiset tabletit Dasatinib Sandoz 70 mg kalvopäällysteiset tabletit Dasatinib
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 80 mg kalvopäällysteiset
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 80 mg kalvopäällysteiset
LIITE VALMISTEYHTEENVETO
 LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
LIITE VALMISTEYHTEENVETO 4 1. LÄÄKEVALMISTEEN NIMI Mizollen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mitsolastiini (INN) 10 mg 3. LÄÄKEMUOTO Depottabletti. 4. KLIINISET TIEDOT 4.1. Terapeuttiset indikaatiot
Histadin- valmisteen tehoa ja turvallisuutta ei ole osoitettu alle 2-vuotiailla lapsilla.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Histadin 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 94 mg laktoosimonohydraattia.
Liite I. Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle
 Liite I Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle Tieteelliset johtopäätökset Kun otetaan huomioon lääketurvallisuuden riskinarviointikomitean (PRACin) arviointiraportti
Liite I Tieteelliset johtopäätökset ja perusteet myyntilupien ehtojen muuttamiselle Tieteelliset johtopäätökset Kun otetaan huomioon lääketurvallisuuden riskinarviointikomitean (PRACin) arviointiraportti
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO. Aikuiset (myös iäkkäät): Suositeltu annos on 800 mg eli 2 kapselia vuorokaudessa kerta-annoksena kolmen kuukauden ajan.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Chondroitin Sulphate Rovi 400 mg, kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 400 mg kondroitiinisulfaattia. Täydellinen apuaineluettelo,
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Metronidatsoli 0,75 paino-%, 7,5 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zidoval 7,5 mg/g emätingeeli 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Metronidatsoli 0,75 paino-%, 7,5 mg/g Apuaineet, joiden vaikutus tunnetaan: Metyyliparahydroksibentsoaatti
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
VALMISTEYHTEENVETO. Yksi tabletti sisältää 120 mg feksofenadiinihydrokloridia, mikä vastaa 112 mg feksofenadiinia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nefoxef 120 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 120 mg feksofenadiinihydrokloridia, mikä vastaa 112
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nefoxef 120 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 120 mg feksofenadiinihydrokloridia, mikä vastaa 112
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
HBV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun Tärkeitä seikkoja huomioitavaksi: Tarkasta kaikkien potilaiden kreatiniinipuhdistuma ennen
VALMISTEYHTEENVETO. Lievän tai kohtalaisen vaikean polven nivelrikon oireiden lievittäminen.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin ratiopharm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää 1,5 g glukosamiinisulfaattia glukosamiinisulfaattinatriumkloridina
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 80 mg kalvopäällysteiset
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 80 mg kalvopäällysteiset
Tuulix tabletit on tarkoitettu allergisen nuhan sekä kroonisen idiopaattisen urtikarian oireiden hoitoon.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Tuulix 10 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Tuulix 10 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Bosulif 100 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää bosutinibimonohydraattia
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Bosulif 100 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää bosutinibimonohydraattia
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun
 HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
HIV-tartuntaan liittyvien munuaisongelmien koulutusesite, joka sisältää myös kreatiniinin poistuman mittatikun HIV-positivisilla potilailla on suurentunut munuaisten vajaatoiminnan riski, joka edellyttää
VALMISTEYHTEENVETO. Huom. Emätinpuikko tulee työntää syvälle emättimeen, ei mielellään kuukautisten aikana.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GYNO-TROSYD 100 mg emätinpuikko, tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi emätinpuikko sisältää 100 mg tiokonatsolia. Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 3. LÄÄKEMUOTO 4. KLIINISET TIEDOT. 4.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 1 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma emulsiovoidetta sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta
VALMISTEYHTEENVETO. Valkoinen, pyöreä, kummaltakin puolelta litteä viistoreunainen tabletti, jossa jakouurre toisella puolella.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 30 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 30 mg ambroksolihydrokloridia. Apuaineet: 40 mg laktoosimonohydraattia (ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI
 1. LÄÄKEVALMISTEEN NIMI Dasatinib Stada 20 mg kalvopäällysteiset tabletit Dasatinib Stada 50 mg kalvopäällysteiset tabletit Dasatinib Stada 70 mg kalvopäällysteiset tabletit Dasatinib Stada 80 mg kalvopäällysteiset
1. LÄÄKEVALMISTEEN NIMI Dasatinib Stada 20 mg kalvopäällysteiset tabletit Dasatinib Stada 50 mg kalvopäällysteiset tabletit Dasatinib Stada 70 mg kalvopäällysteiset tabletit Dasatinib Stada 80 mg kalvopäällysteiset
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Kestine 20 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Kestine 20 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 20 mg mikronisoitua ebastiinia. Apuaine, jonka vaikutus
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Kestine 20 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 20 mg mikronisoitua ebastiinia. Apuaine, jonka vaikutus
Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3 mg laktoosimonohydraattia. Täydellinen apuaineluettelo, ks. kohta 6.
 1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
4.1 Käyttöaihe Akuutteihin tai kroonisiin keuhko- ja keuhkoputkisairauksiin liittyvän limaa erittävän yskän limaa irrottava hoito.
 V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
V A LMIS T EYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Flavamed 60 mg poretabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi poretabletti sisältää 60 mg ambroksolihydrokloridia. Apuaineet: 110,00 mg vedetöntä
VALMISTEYHTEENVETO. Mesillinaamille herkkien gramnegatiivisten bakteerien aiheuttamat virtsatieinfektiot.
 1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Selexid 200 mg tabletti, kalvopäällysteinen Selexid 400 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti
1 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Selexid 200 mg tabletti, kalvopäällysteinen Selexid 400 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti
Pakkausseloste: Tietoa käyttäjälle
 Pakkausseloste: Tietoa käyttäjälle SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 80 mg kalvopäällysteiset tabletit
Pakkausseloste: Tietoa käyttäjälle SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 80 mg kalvopäällysteiset tabletit
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
VALMISTEYHTEENVETO. Tabletti. Tabletit ovat valkoisia, pyöreitä, kuperia ja niissä on merkintä 7. Tabletin halkaisija on 7 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Loraxin 10 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Loraxin 10 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
Eläimiä koskevat erityiset varotoimet Jos haittavaikutuksia ilmenee, tulee hoito keskeyttää ja ottaa yhteys eläinlääkäriin.
 1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
1. ELÄINLÄÄKKEEN NIMI Meloxoral 0,5 mg/ml oraalisuspensio kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml sisältää: Vaikuttava aine: Meloksikaami 0,5 mg Apuaine: Natriumbentsoaatti 1,75 mg Täydellinen
VALMISTEYHTEENVETO. Tabletit ovat pyöreitä, harmaansinisiä ja sokeripäällysteisiä, halkaisija n. 11 mm.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Songha Yö/Natt tabletti, päällystetty 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 tabletti sisältää: Valerianae (Valeriana officinalis L. s.l.) rad. extr. spir.
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib Teva 100 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää imatinibimesilaattia
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib Teva 100 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää imatinibimesilaattia
VALMISTEYHTEENVETO. Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia 20 mg (2 %).
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fucidin voideside 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Voideside sisältää Fucidin 2% voidetta noin 1,5 g/dm 2. 1 g voidetta sisältää vaikuttavaa ainetta: Natriumfusidaattia
VALMISTEYHTEENVETO. Päänahan seborrooinen ekseema ja muu päänahan hilseily (pityriasis capitis). Pityriasis versicolor.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Nizoral 20 mg/ml shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää ketokonatsolia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
Yksi kova kapseli sisältää nilotinibihydrokloridimonohydraattia joka vastaa 200 mg nilotinibia.
 1. LÄÄKEVALMISTEEN NIMI Tasigna 200 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää nilotinibihydrokloridimonohydraattia joka vastaa 200 mg nilotinibia. Apuaine Laktoosimonohydraatti:
1. LÄÄKEVALMISTEEN NIMI Tasigna 200 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää nilotinibihydrokloridimonohydraattia joka vastaa 200 mg nilotinibia. Apuaine Laktoosimonohydraatti:
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
VALMISTEYHTEENVETO. Valmisteen kuvaus: Valkoinen tai melkein valkoinen talkkimainen jauhe.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI TROSYD 10 mg/g puuteri 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma puuteria sisältää 10 mg tiokonatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
PAKKAUSSELOSTE. Dasatinibi
 PAKKAUSSELOSTE SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 100 mg kalvopäällysteiset tabletit Dasatinibi Lue tämä
PAKKAUSSELOSTE SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit SPRYCEL 100 mg kalvopäällysteiset tabletit Dasatinibi Lue tämä
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Iclusig 15 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Kukin kalvopäällysteinen tabletti sisältää ponatinibihydrokloridia
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Iclusig 15 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Kukin kalvopäällysteinen tabletti sisältää ponatinibihydrokloridia
PAKKAUSSELOSTE. SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit
 PAKKAUSSELOSTE SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit Dasatinibi Lue tämä seloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE SPRYCEL 20 mg kalvopäällysteiset tabletit SPRYCEL 50 mg kalvopäällysteiset tabletit SPRYCEL 70 mg kalvopäällysteiset tabletit Dasatinibi Lue tämä seloste huolellisesti, ennen kuin aloitat
Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa. Tietoa terveydenhuollon ammattilaisille
 Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa Tietoa terveydenhuollon ammattilaisille Suositukset seuraavissa tilanteissa: - maksan toiminnan seuraaminen - yhteisvaikutukset
Valdoxan (agomelatiini) aikuispotilaiden vakavien masennustilojen hoidossa Tietoa terveydenhuollon ammattilaisille Suositukset seuraavissa tilanteissa: - maksan toiminnan seuraaminen - yhteisvaikutukset
VALMISTEYHTEENVETO. Akrivastiinia ei pidä määrätä potilaille, joiden munuaistoiminta on merkittävästi heikentynyt.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Benadryl 8 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Akrivastiini 8 mg Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Kapseli, kova Valmisteen
VALMISTEYHTEENVETO. Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti. Osmolaliteetti: noin 4 000 mosm/kg vettä ph: noin 4
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addex-Kaliumklorid 150 mg/ml infuusiokonsentraatti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml Addex-Kaliumkloridia sisältää: Kaliumkloridi 150 mg/ml, joka vastaa
Yksi kapseli sisältää estramustiininatriumfosfaattimonohydraattia vastaten 140 mg estramustiinifosfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ESTRACYT 140 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää estramustiininatriumfosfaattimonohydraattia vastaten 140 mg estramustiinifosfaattia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI ESTRACYT 140 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää estramustiininatriumfosfaattimonohydraattia vastaten 140 mg estramustiinifosfaattia.
Kissa: Leikkauksen jälkeisen kivun lievitys kohdun ja munasarjojen poistoleikkauksen sekä pienten pehmytkudoskirurgisten toimenpiteiden jälkeen.
 1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
1. ELÄINLÄÄKKEEN NIMI Acticam 5 mg/ml injektioneste, liuos koirille ja kissoille 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi ml Acticam 5 mg/ml injektionesteliuosta sisältää: Vaikuttavat aineet Meloksikaami
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib Actavis 50 mg kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää imatinibimesilaattia vastaten 50 mg imatinibia.
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib Actavis 50 mg kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää imatinibimesilaattia vastaten 50 mg imatinibia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Pharma Nord 400 mg kapselit. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 400 mg glukosamiinia, joka vastaa 509 mg glukosamiinisulfaattia, vastaten 676 mg
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib ratiopharm 100 mg kalvopäällysteiset tabletit Imatinib ratiopharm 400 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib ratiopharm 100 mg kalvopäällysteiset tabletit Imatinib ratiopharm 400 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen
Glivecin vaikutusta luuytimensiirron lopputulokseen ei ole selvitetty.
 1. LÄÄKEVALMISTEEN NIMI Glivec 400 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 400 mg imatinibia (mesilaattina). Täydellinen apuaineluettelo,
1. LÄÄKEVALMISTEEN NIMI Glivec 400 mg kalvopäällysteiset tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 400 mg imatinibia (mesilaattina). Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 400 mg emätinpuikko, kapseli, pehmeä 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 400 mg/emätinpuikko Täydellinen apuaineluettelo,
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib Actavis 50 mg kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää imatinibimesilaattia vastaten 50 mg imatinibia.
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Imatinib Actavis 50 mg kovat kapselit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää imatinibimesilaattia vastaten 50 mg imatinibia.
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Tasigna 150 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää nilotinibi hydrokloridimonohydraattia joka vastaa 150
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Tasigna 150 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kova kapseli sisältää nilotinibi hydrokloridimonohydraattia joka vastaa 150
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
1. ELÄINLÄÄKKEEN NIMI. Loxicom 0,5 mg/ml oraalisuspensio kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS. Yksi millilitra sisältää: Vaikuttava aine:
 1. ELÄINLÄÄKKEEN NIMI Loxicom 0,5 mg/ml oraalisuspensio kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra sisältää: Vaikuttava aine: Meloksikaami Apuaineet: Natriumbentsoaatti 0,5 mg 1,5
1. ELÄINLÄÄKKEEN NIMI Loxicom 0,5 mg/ml oraalisuspensio kissalle 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Yksi millilitra sisältää: Vaikuttava aine: Meloksikaami Apuaineet: Natriumbentsoaatti 0,5 mg 1,5
Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin
 Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
VALMISTEYHTEENVETO 1
 VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Gyno-Daktarin 2 % emätinvoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Mikonatsolinitraatti 20 mg/g Apuaineet, joiden vaikutus tunnetaan: bentsoehappo, butyylihydroksianisoli.
VALMISTEYHTEENVETO. 1. ELÄINLÄÄKKEEN NIMI Canidryl 50 mg tabletti koirille Karprofeeni. 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine:
 VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Canidryl 50 mg tabletti koirille Karprofeeni 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: Karprofeeni 50 mg/tabletti Apuaineet Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO 1. ELÄINLÄÄKKEEN NIMI Canidryl 50 mg tabletti koirille Karprofeeni 2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS Vaikuttava aine: Karprofeeni 50 mg/tabletti Apuaineet Täydellinen apuaineluettelo,
VALMISTEYHTEENVETO. Loratadin Actavis tabletit on tarkoitettu allergisen nuhan sekä kroonisen idiopaattisen urtikarian oireiden hoitoon.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Loratadin Actavis 10 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Apuaine, jonka vaikutus tunnetaan: Yksi tabletti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Loratadin Actavis 10 mg tabletit 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Apuaine, jonka vaikutus tunnetaan: Yksi tabletti
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
VALMISTEYHTEENVETO. Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia, joka vastaa 2,68 mg bentsydamiinia.
 1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
1 LÄÄKEVALMISTEEN NIMI Zyx Minttu 3 mg imeskelytabletti Zyx Sitruuna 3 mg imeskelytabletti VALMISTEYHTEENVETO 2 VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää 3 mg bentsydamiinihydrokloridia,
VALMISTEYHTEENVETO. Valkoinen tai melkein valkoinen, tasainen, viistoreunainen, jakouurteellinen tabletti, halkaisija n. 9 mm, koodi ORN 276.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Tyrazol 5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 5 mg karbimatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Tyrazol 5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 5 mg karbimatsolia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT. Ketokonatsoli 20 mg/g
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ketokonatsoli 20 mg/g Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Emulsiovoide Valmisteen
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI NIZORAL 2 % emulsiovoide 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Ketokonatsoli 20 mg/g Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO Emulsiovoide Valmisteen
VALMISTE YHT E ENVET O
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Dormiplant tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää:valerianae (Valeriana officinalis L.)
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
VALMISTEYHTEENVETO. Bricanyl Turbuhaler 0,25 mg/annos ja 0,5 mg/annos inhalaatiojauheet
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Bricanyl Turbuhaler 0,25 mg/annos ja 0,5 mg/annos inhalaatiojauheet 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bricanyl Turbuhaler 0,25 mg/annos: 1 annos sisältää
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Bricanyl Turbuhaler 0,25 mg/annos ja 0,5 mg/annos inhalaatiojauheet 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Bricanyl Turbuhaler 0,25 mg/annos: 1 annos sisältää
VALMISTEYHTEENVETO. Shampoo Viskoosi liuos, joka on väriltään kirkkaan oljenkeltainen tai vaaleanoranssi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Sebiprox 1,5 % shampoo 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 100 g shampoota sisältää 1,5 g siklopiroksiolamiinia (1,5% w/w). Täydellinen apuaineluettelo, ks.
Uutta lääkkeistä: Palbosiklibi
 Page 1 of 5 JULKAISTU NUMEROSSA 1/2017 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Palbosiklibi Annikka Kalliokoski / Kirjoitettu 25.1.2017 / Julkaistu Ibrance 75 mg, 100 mg, 125 mg kovat kapselit, Pfizer Limited
Page 1 of 5 JULKAISTU NUMEROSSA 1/2017 UUTTA LÄÄKKEISTÄ Uutta lääkkeistä: Palbosiklibi Annikka Kalliokoski / Kirjoitettu 25.1.2017 / Julkaistu Ibrance 75 mg, 100 mg, 125 mg kovat kapselit, Pfizer Limited
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rennie Orange imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi imeskelytabletti sisältää: Kalsiumkarbonaatti 680 mg Magnesiumsubkarbonaatti, raskas
LIITE I VALMISTEYHTEENVETO
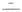 LIITE I VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GLIVEC 50 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 50 mg imatinibia (mesilaattina). Apuaineet, ks. 6.1. 3. LÄÄKEMUOTO
LIITE I VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI GLIVEC 50 mg kapseli, kova 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kapseli sisältää 50 mg imatinibia (mesilaattina). Apuaineet, ks. 6.1. 3. LÄÄKEMUOTO
INFLECTRA SEULONTAKORTTI
 Demyelinoiva sairaus Jos potilaalla on aiempi tai äskettäin puhjennut demyelinioiva sairaus, anti-tnf-hoidon hyödyt ja haitat on arvioitava huolellisesti ennen INFLECTRA -hoidon aloitusta. INFLECTRA -hoidon
Demyelinoiva sairaus Jos potilaalla on aiempi tai äskettäin puhjennut demyelinioiva sairaus, anti-tnf-hoidon hyödyt ja haitat on arvioitava huolellisesti ennen INFLECTRA -hoidon aloitusta. INFLECTRA -hoidon
VALMISTEYHTEENVETO. Yliherkkyys mikonatsolille, muille imidatsolijohdannaisille tai kohdassa 6.1 mainituille apuaineille.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 20 mg/ml emulsio iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää mikonatsolinitraattia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Daktarin 20 mg/ml emulsio iholle 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää mikonatsolinitraattia 20 mg. Täydellinen apuaineluettelo, ks. kohta 6.1.
VALMISTEYHTEENVETO. Maksimivuorokausiannos 40 ml (120 mg dekstrometorfaania)
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Resilar 3 mg/ml oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi ml sisältää 3 mg dekstrometorfaanihydrobromidia. Apuaineet, joiden vaikutus tunnetaan:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Resilar 3 mg/ml oraaliliuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi ml sisältää 3 mg dekstrometorfaanihydrobromidia. Apuaineet, joiden vaikutus tunnetaan:
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO. Pitkälle edenneen eturauhassyövän hoito yhdessä LHRH-analogihoidon tai kirurgisen kastraation kanssa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SKYLUTAMIDE 0 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 0 mg bikalutamidia. Apuaine, jonka
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SKYLUTAMIDE 0 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi kalvopäällysteinen tabletti sisältää 0 mg bikalutamidia. Apuaine, jonka
Valmisteyhteenveto. Deksametasonia (max 20 mg kerran vuorokaudessa) annetaan samanaikaisesti suun kautta.
 Valmisteyhteenveto 1. LÄÄKEVALMISTEEN NIMI Granisetron Bluefish 1 mg tabletti, kalvopäällysteinen Granisetron Bluefish 2 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 mg:n tabletti:
Valmisteyhteenveto 1. LÄÄKEVALMISTEEN NIMI Granisetron Bluefish 1 mg tabletti, kalvopäällysteinen Granisetron Bluefish 2 mg tabletti, kalvopäällysteinen 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 mg:n tabletti:
Silmäinfektiot kuten keratiitti, konjunktiviitti, meibomiitti, blefariitti ym., jotka johtuvat fusidiinille herkistä bakteereista.
 1. LÄÄKEVALMISTEEN NIMI Fucithalmic 10 mg/g silmätipat 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma silmätippoja sisältää 10 mg fusidiinihappoa. Apuaine, jonka vaikutus tunnetaan: bentsalkoniumkloridi
1. LÄÄKEVALMISTEEN NIMI Fucithalmic 10 mg/g silmätipat 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi gramma silmätippoja sisältää 10 mg fusidiinihappoa. Apuaine, jonka vaikutus tunnetaan: bentsalkoniumkloridi
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu referral-menettelyn tuloksena. Jäsenvaltion
VALMISTEYHTEENVETO. 1 kalvopäällysteinen tabletti sisältää kalsiumkarbonaattia vastaten 500 mg kalsiumia. Täydellinen apuaineluettelo, ks. kohta 6.
 1. LÄÄKEVALMISTEEN NIMI Kalcipos 500 mg tabletti, kalvopäällysteinen VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kalvopäällysteinen tabletti sisältää kalsiumkarbonaattia vastaten 500 mg
1. LÄÄKEVALMISTEEN NIMI Kalcipos 500 mg tabletti, kalvopäällysteinen VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 kalvopäällysteinen tabletti sisältää kalsiumkarbonaattia vastaten 500 mg
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
VALMISTEYHTEENVETO. Valkoinen, soikea, jakouurteellinen; toisella puolella merkintä LT 10.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Loratadin HEXAL 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 69,2 mg laktoosimonohydraatti.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Loratadin HEXAL 10 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 10 mg loratadiinia. Yksi tabletti sisältää 69,2 mg laktoosimonohydraatti.
Jokainen ml konsentraattia sisältää 20 mg dosetakselia trihydraattina. Jokainen 8 ml:n injektiopullo konsentraattia sisältää 160 mg dosetakselia.
 1. LÄÄKEVALMISTEEN NIMI TAXOTERE 160 mg/8 ml infuusiokonsentraatti, liuosta varten. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen ml konsentraattia sisältää 20 mg dosetakselia trihydraattina. Jokainen
1. LÄÄKEVALMISTEEN NIMI TAXOTERE 160 mg/8 ml infuusiokonsentraatti, liuosta varten. 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Jokainen ml konsentraattia sisältää 20 mg dosetakselia trihydraattina. Jokainen
VALMISTEYHTEENVETO. Kovia liivatekapseleita (koko 3), joissa on ruskea kansiosa ja valkoinen runko-osa ja joiden sisällä on vaaleankeltaisia rakeita.
 VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
EUROOPAN LÄÄKEVIRASTON TIETEELLISET JOHTOPÄÄTÖKSET JA PERUSTEET VALMISTEYHTEENVEDON, MYYNTIPÄÄLLYSMERKINTÖJEN JA PAKKAUSSELOSTEEN MUUTTAMISELLE
 LIITE II EUROOPAN LÄÄKEVIRASTON TIETEELLISET JOHTOPÄÄTÖKSET JA PERUSTEET VALMISTEYHTEENVEDON, MYYNTIPÄÄLLYSMERKINTÖJEN JA PAKKAUSSELOSTEEN MUUTTAMISELLE 11 Tieteelliset johtopäätökset Tiivistelmä tieteellisestä
LIITE II EUROOPAN LÄÄKEVIRASTON TIETEELLISET JOHTOPÄÄTÖKSET JA PERUSTEET VALMISTEYHTEENVEDON, MYYNTIPÄÄLLYSMERKINTÖJEN JA PAKKAUSSELOSTEEN MUUTTAMISELLE 11 Tieteelliset johtopäätökset Tiivistelmä tieteellisestä
VALMISTEYHTEENVETO. Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500 mg:aa kalsiumia.
 1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
1. LÄÄKEVALMISTEEN NIMI Calcichew appelsiini 500 mg -purutabletti VALMISTEYHTEENVETO 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi 500 mg:n purutabletti sisältää kalsiumkarbonaattia määrän, joka vastaa 500
