Laskuharjoitus 1 palautus mennessä Juha-Matti Alakoskela, jmalakos@cc.helsinki.fi
|
|
|
- Kristiina Uotila
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 Laskuharjoitus 1 palautus mennessä Juha-Matti Alakoskela, jmalakos@cc.helsinki.fi Yleistä Kurssin maksimipistemäärä on 44. Kaikista mahdollisista pisteistä 36 on jaossa kurssin tentissä, 4 laskuharjoituksista ja 4 laboratoriotöiden työselostuksista Toisin sanoen nämä saatavat pisteet eivät ole ylimääräisiä lisäpisteitä, vaan osa kurssin pisteytystä siinä kuin tenttikin. Kurssin hyväksyttyyn suorittamiseen vaaditaan 24 pistettä, minkä jälkeen arvosana kasvaa neljän pisteeen välein. Laskuharjoitusten ja tentin tehtävät tullevat myös olemaan luonteeltaan erilaisia eli laskuharjoitustehtäviä eivät ole tarkoitettu tenttitehtävien malleiksi, vaan pikemminkin erillisiksi oppimista tukeviksi harjoituksiksi. Lisäksi ehkä parempi olisi puhua vain harjoituksista, sillä laskemista ei läheskään kaikkiin tehtäviin liity. Laskuharjoituksista jaetaan raakapisteitä, joiden kokonaissumman perusteella jaetaan lopulliset neljä laskuharjoituspistettä lineaarisen asteikon mukaan. Esim. näistä laskuharjoituksista enimmillään saatavat 36 raakapistettä vastaavat 1,0 lopullista pistettä ja 18 pistettä vastaa 0,5 lopullista pistettä. Vastauksia ei tarvitse laskea/kirjoittaa käsin, vaan kaikkien tekstinkäsittely- ja laskentaohjelmien käyttö on sallittua. Käsinkin toki saa vastauksensa kirjoittaa. Vastaukset voi joko lähettää sähköpostina osoitteeseen jmalakos@cc.helsinki.fi (jos tiedosto kooltaan alle 500 kb) tai toimittaa TKK:lla laatikkoon, jonka sijainti ilmoitetaan (toivon mukaan) sähköpostitse. Tehtävä 1: Termodynamiikan perusteista 0 9 p. Tarkoituksena ei ole nyt perusteellisesti opettaa termodynamiikkaa, vaan pikemminkin antaa sen verran puolivillaisesti puolusteltuja muistisääntöjä, että olisi helpompi hahmottaa Gibbsin vapaaenergian merkitys ja oppikirjan sisältöä. Varsinainen termodynamiikan opetus jääköön fysiikan ja kemian kursseille. Lehningerissä esitetään kaava G= H-T S eli Gibbsin vapaaenergian muutos jollekin tapahtumalle on tapahtumaan liittyvän entalpian muutos miinus lämpötila kertaa tapahtumaan liittyvä entropian muutos. Entalpia H sinänsä lienee tuttu jo lukion kemiastakin. H=U+PV, missä U on lukion fysiikasta tuttu sisäenergia. Muistutukseksi huomautettakoon, että sisäenergian muutos U=Q+W, missä Q on siirtynyt lämpömäärä ja W on systeemiin tehty tai systeemin tekemä työ. Vastaavasti on entalpian muutos H= U+P V+V P. Useimmissa biologisissa systeemeissä paine on likimain vakio, jolloin H= U+P V (koska siis P=0). Jos systeemi tekee ainoastaan laajentumistyötä, on W=-P V ja H= Q. Entropia puolestaan kuvaa tilan todennäköisyyttä. Mitä todennäköisemmin tila saataisiin sattumalta sitä suurempi on tilan entropia. S=k B lnw, missä W on mahdolliset tavat toteuttaa kyseiset tilat. A. Kaasuista ja lipideistä Sinulla kaksi samankokoista kaasupulloa, jotka liittää toisiinsa ohut ja lyhyt kannas. Systeemissäsi sinulla on yhteensä 10 identtistä kaasumolekyyliä. Mitkä ovat systeemin mahdolliset tilat kaasumolekyylien jakautumiselle kahden pullon välillä ja mikä on kuhunkin kaasumolekyylien jakaumaan liittyvä entropia yllä esitetyn perusteella? Miten tämäntapaiset asiat mahdollisesti liittyvät vesimolekyyleihin lipidien ympärillä? B. Entropian muutos -tehtävä Useimmiten on kuitenkin käytännössä mahdotonta laskea entropiaa tuolla tavalla. Tiedetään, että johonkin muutokseen liittyvä maailmankaikkeuden entropian muutos S M = S+ S Y, missä S on systeemin itsensä entropian muutos ja S Y ympäristön entropian muutos. Toisaalta mille tahansa systeemille entropia on 1 S = S + dq T 0,
2 missä dq on systeemiin tuotu pienen pieni lämpömäärä, jonka yli integroidaan. Ts. S= Q/T. Systeemi puolestaan tietysti ottaa tai luovuttaa vastaavan määrän lämpöä ympäristöstään, joten ympäristölle muutos on S Y =- Q/T. Lämmön tuominen systeemiin lisää entropiaa. Vaikkei yhteyden täsmällinen muoto olekaan ilmeinen, niin sinänsä lienee ymmärrettävää, että systeemin energian lisääntyessä entropiakin kasvaa. Osoita edellä annettujen tietojen perusteella, että vakiopaineessa ja -lämpötilassa pelkästään laajentumistyötä tekevän systeemin johonkin tapahtumaan liittyvä G<0 vastaa sitä, S M >0 eli sitä, että maailmankaikkeuden kokonaisentropia lisääntyy. C. Tiettyyn reaktioon A?B liittyvät systeemin entropian ja entalpian muutokset ovat seuraavanlaiset: a) H>0, S>0 b) H>0, S<0 c) H<0, S>0 d) H<0, S<0 Miten on reaktion spontaanisuuden laita lämpötilan funktiona tilanteissa a d? Kuvitellaan nyt, että eri tapauksissa olisi kyseessä jonkin molekyylin ei-kovalentti assosiaatio (sitoutuminen) esim. proteiiniin ja että pysyttäisiin lämpötilavälillä, jolla itse proteiinissa ei tapahdu merkittäviä muutoksia, esim. denaturaatiota. Mitä lämpötilakäyttäytyminen tuossa tilanteessa kertoisi sitovista voimista? Luettele, millaiset voimat tai vuorovaikutukset saattaisivat ylipäätään tällaisessa tilanteessa merkittävästi vaikuttaa (esim. gravitaation vaikutus lienee vähäinen). Tehtävä 2: Reaktioista ja Gibbsin vapaaenergiasta 0 9 p. A. Reaktiotasapaino Kyseessä on yksinkertainen reaktio, jossa A B ja toisaalta vastakkaiseen suuntaan B A. Nopeusvakiot reaktioille ovat k 1 ja k -1 (oheinen kuva). Millainen lauseke tulee tasapainovakiolle K nopeusvakioiden ja toisaalta tasapainossa saavutettujen pitoisuuksien perusteella annettuna? B. Gibbsin vapaaenergia A-kohdan mallin mukaiseen reaktioon liittyväksi Gibbsin vapaaenergian muutokseksi annetaan Lehningerissä G= G 0 # +RTln([B]/[A]), missä G on vapaaenergian muutos reaktiolle tämänhetkisillä A:n ja B:n pitoisuuksilla ja tämänhetkisissä oloissa, G 0 # on standardivapaaenergian muutos, R on yleinen kaasuvakio, T on lämpötila absoluuttisella asteikolla ja [B] ja [A] ovat tietenkin reaktanttien konsentraatiot. Jos G 0 # =-10 kj/mol ja T=27 C, niin mikä on reaktion tasapainovakio? Mitä voit sanoa erisuuntaisten osareaktioiden suhteellisista nopeuksista alussa, jos sekä A:ta että B:tä on alussa sama pitoisuus? C. ATP:n energia Miten ATP:sta reaktiossa ATP+H 2 O ADP+P i enimmillään saatava vapaaenergia riippuu ATP:n, ADP:n ja P i :n pitoisuuksista? Tapahtukoon reaktiomme koeputkessa, joten veden pitoisuudesta voi tehdä karkean oletuksen, että se on likimain sama kuin vedessä (mikä tosin ei päde solun sisällä). G '=-30,5 kj/mol ko. reaktiolle ja adenosiinifosfaattien yhteiskonsentraatio [ATP]+[ADP] on vakio = 5 mm ja [P i ]=[ADP].
3 Tehtävä 3: Vedestä ja osmoosista 0 9 p. A. Osmoosista ja soluväliaineesta Nivelruston soluväliaineessa on nivelruston solujen tuottamia proteoglykaaneja, negatiivisesti varautuneita kondroitiini- ja keratiinisulfaatteja, joiden voidaan katsoa olevan kiinni ympäristössään. Varauksien neutraloimiseksi nivelrusto sisältää runsaasti myös Na + -ioneja. Enimmäkseen näiden aiheuttama osmoottinen paine puolestaan imee vettä nivelrustoon kunnes tasapaino on saavutettu, mikä aiheuttaa nivelruston turpoamisen. a) Mitä tapahtuu jalan nivelten nivelrustoissa, kun makuulla ollut henkilö nousee seisomaan ja kohdistaa painonsa nivelrustojen varaan? Mikä paineita koskeva ehto siis toteutuu uudessa tasapainotilassa? (Nivelväliaineen makromolekyylien välinen repulsio ei ole vielä pystyssäkään merkittävä.) Nivelen rakenteista tarvitset ainoastaan oheisen kaavakuvan. b) Nivelrusto pystyy ajan mittaan jossakin määrin sopeutumaan pitkään jatkuneeseen rasitukseen, esimerkiksi lisääntyneeseen liikunnan harrastamiseen. Mikä mekanismi on tehtävässä annettujen ja omien tietojesi perusteella ilmeinen? c) Millaisista osista proteoglykaanit muodostuvat? B. Vesi ja biomolekyylit a) Hemoglobiinilla on kaksi konformaatiota, joista toinen (R) sitoo happea hyvin ja toinen (T) huonosti. Happea hyvin sitovalla R- eli relaxed-muodolla on suurempi pinta-ala kuin T- eli tensemuodolla. R-muodon pinnalle on näin ollen ymmärrettävästi sitoutunut enemmän vettä kuin T-muodon pinnalle. Veden aktiivisuutta (jota voit pitää vapaan veden vaikuttavana tai tehollisena konsentraationa) voidaan alentaa lisäämällä liuokseen vettä sitovaa, melko inerttiä polyetyleeniglykolia. Mihin suuntaan ja miksi muuttuu hemoglobiiniin sitoutuneen hapen määrä, jos hemoglobiiniliuoksen polyetyleeniglykolipitoisuutta lisätään? b) Amfifiiliset lipidit voivat muodostaa vesiliuoksessa erilaisia rakenteita, esimerkiksi kaksoiskalvoja tai misellejä. Jos lipidimolekyylimme on muodoltaan sellainen, että molekyylit puhtaassa vesiliuoksessa muodostavat vielä juuri ja juuri (lieriömäisen) misellin eivätkä kaksoiskalvoa, niin mitä olisi syytä olettaa kenties muodostuvan ja miksi, jos laitammekin lipidimme väkevään polyteleeniglykoliliuokseen (katso a-kohtaa). c) Miten selittyy se, että pieni Na + -ioni ei pääse läpi kanavaproteiinista, josta suurempi K + -ioni pääsee läpi? C. Veden anomaalinen käyttäytyminen Vedellä on tunnetusti anomaalista käyttäytymistä, esimerkiksi normaalipaineessa tiheyden maksimi lämpötilassa 4 C. Veden käyttäytyminen poikkeaa muutenkin yksinkertaisesta ideaalinesteestä. Tee jollakin hakukoneella haku veden anomaalisesta käyttäytymisestä ja luettele ainakin osa mielestäsi mielenkiintoisista anomalioista.
4 Tehtävä 4: DNA:sta 0 9 p. Coxin ja Nelsonin teoksen Lehninger Principles of Biochemistry luvuista 10, 24, 25 ja 29 pitäisi olla apua tehtävien ratkaisussa, mikäli se ei kylmiltään suju. A. DNA:n replikaatio Oheinen huonosti piirretty kuva esittää tyypillistä eukaryootin replikaatiokuplaa auki levitettynä. a) Merkitse kuvaan replikaation alkamiskohta. b) Merkitse kuvaan kaikki leading strand ja lagging strand -juosteet. c) Merkitse nuolilla replikaation suunta. d) Merkitse nuolilla replikaatiohaarukan etenemissuunta. e) Merkitse paikat, joissa tapahtuu DNA-synteesiä. f) Merkitse Okazakin fragmenttien synteesijärjestys. g) Merkitse kohdat, jossa DNA-ligaasi toimii tai tulee toimimaan. h) Merkitse kohdat, jossa primaasi toimii. B. DNA:n rakenteesta ja topologiasta DNA:n topologian säätely on keskeinen osa solujen toimintaa. Replikaatiossa ja transkriptiossa DNA:n kierteisyyttä täytyy superkierteisyyden aiheuttamia jännitteitä purkaa. Lisäksi on viitteitä siitä, että bakteerit osittain myös edesauttavat transkription aktiivisuutta tekemällä negatiivisesti superkierteisiä jaksoja runsaasti transkriboitavien geenien alueelle. Toisaalta joillakin arkkibakteereilla on ns. käänteisgyraaseja, jotka synnyttävät DNA:han positiivista superkierteisyyttä. Tarkoituksena on mahdollisesti suojella DNA:ta denaturoitumiselta. Ohessa T. Devlinin kirjan Biochemistry taulukko: entsyymi tyyppi 1 DLk toiminnot E. colin topoisomeraasi I I +1 relaksoi negatiivisesti superkierteistä DNA:ta hiivan topoisomeraasi I I ±1 relaksoi positiivisesti tai negativiivisesti superkierteistä DNA:ta E. colin topoisomeraasi II (DNA-gyraasi) II ±2 synnyttää negatiivista superkierteisyyttä DNA:han; relaksoi sekä positiivisesti että negatiivisesti superkierteistä DNA:ta E. colin topoisomeraasi IV II ±2 relaksoi positiivisesti tai negatiivisesti superkierteistä DNA:ta, ei voi synnyttää superkierteistä DNA:ta hiivan topoisomeraasi II II ±2 relaksoi positiivisesti tai negatiivisesti superkierteistä DNA:ta, ei voi synnyttää superkierteistä DNA:ta E. colin topoisomeraasi III I +1 relaksoi negatiivisesti superkierteistä DNA:ta, selvittelee limittäisten DNA-silmukoiden takertumia (=decatenation activity, catanae=ketjun renkaiden lailla toisiinsa lukittuneet renkaat) hiivan topoisomeraasi III I +1 spesifisenä substraattina heterodupleksien yksijuosteinen DNA 1 tyypin I topoisomeraasit eivät käytä ATP:ia, tyypin II topoisomeraasit käyttävät.
5 a) Mikä olennainen ero gyraaseilla on muihin topoisomeraaseihin verrattuna? Mitä hyötyä transkriptiossa voisi olla siitä, jos DNA on negatiivisesti superkierteistä? b) Miten tavallisen (B-DNA:n) kierteisyyden vähentäminen (underwinding) vaikuttaa Z-DNA:n esiintymistodennäköisyyteen ko. molekyylissä? c) Miksi DNA:n kaksoiskierre ylipäätään kiertyy silmukoille, jos sitä kiertää tiukemmalle? Tähän jokin kierteinen johto kuten perinteinen puhelimenjohto on omiaan kokeellista testausta varten. C. PCR Sinulla on koeputkissasi potilaalta otettu DNA-näyte, josta haluat monistaa tiettyä sekvenssiä tutkiaksesi myöhemmin restriktioentsyymien avulla sitä, onko sekvenssissä tietty tuntemasi pistemutaatio. Luonnollisesti sinulla on myös kaksi vertailunäytettä: toinen, jossa DNA:ssa on mutaatio, ja toinen, jossa DNA:ssa ei ole mutaatiota. Ohessa DNA-näytteen oletettu sekvenssi. aagctgctgc caccaaatgg cggcacgttc ctgctggttt gctaatgggc caggcctctg tgtacaggta ccatctggtc ctggtggttg agcgcaggtc gacctatccc agcacaagtg aaccaaagct ttatataact gcccgtggct tttttttttt cccccgtcat ttggctgtca aaaatcataa cttgggaaat gggccattgg gtgatgtgcg cacgcatcca cgggtggcag cccagcatca gcttggaagt aagactctct gaaccttcca tccccaggag ctctggccac cactgagtac ctgtccttat agagttcaag gatttctaat cggggagcgt atttgtcaag gaatctggac gttgaaaaaa atgagagaac gtgagaagaa tacaaatcac agccagtcca gtgctccaac ccagaaaata cattgttctt aagttatgtg acgccagttt gcctccggag tgtccgttac tacacacctg cacacctgtc caggcctgtt tggccctcag ctatgttttc ctgggttcct atcctcaagt cagccggggc tctcattcag agcctaggaa agaaggaaag gaaggcagga aagtgtctag tgccacctgt acaggcacag cagaaaacta gccagagaat ccatcaggag gaagaccttg gatcctgagg ctccagaaca agaaagagat ttaggagaga aagtagcttc tagacctgga gtccttgact tctgtttccc aagacctgtg cctccaggac caggggtgcc acctggcatc ggagcactgg ctctgtctgg tttatctaga gacttgcaga tatcaagcct tctgggtgag cccggaggaa ctgcgcttct ctgacgtggg caggctaagt gaatatcttg aattgcaggt agggtccctg gagcaagcca tgctggatgc cctagtcctg gacagagtgg attttgtgaa attactcata gaaaatggag taagcatgca ccgttttctc accatctcca gactagagga actgtacaat acggtagggc caagctaaga tgccttttca tttctctttc tcttctgttt gtttccctca tcctgcctgc ccataccccc atgcctgtga ttctcttcct gtctctcctg tgatgcatgc gtcattcctc acttgcattc ccttacacct ggatagacga cagacaccga gtcaccaaga actcacttgt tctaactgct cagttgtcag catcttaggc aaaaggtgtc gtgatcacca tagggcgttg ttctcagatt ctaactcaaa accacaagca ggtctctgtc aattggaaca cacgcactct gtaagcccag ggaggtgttg gtgacaaata gtgcaaggag ggttggttta gcaccaacca tcaaatgatg cttattaagt agcttgtatc accatgccat cctcggagct actaagttca cacacacacg tgcacacgca cacacataca cacatgcaca cacacatgca cacaaacaca tacacacatg cacacatact cacacacaca tacacacatg cacacacaca cacacatgca cacacacaca tgcacacaca cgcatgcaca cacaccctgc acccccacac catgatagaa agtataaaat accctggaat catccaaaaa catgtgtggt agtggctgtt ctttgcagtg gcattcacta aaaaagccaa gtgtgtttaa agaactgatg ttgttttttt taaccatttc acagatgaga aaactgtggc agtcttagtc tatttgtgcg gccacaacag aatgcctgag gctgagtaat ttataaagaa catgctttcc tttgtcacag ttctggaggc tggacgtcca agatcaaggt gccaggagct tcactatgta gtgagagtca ctttgtcttt ccagaatgtg tccactggaa ggggcaaacg ctgtcctctt aggacagaaa ggttggaagt acagaaatat gaacctactt ctgtctagcc ctcaattcca cttacaaaga aggtaccctt gtaaccaagt cacctatcac ctaacagcct catctccccc actgcatagg aaatgcagca tgaattttgt agtcacaaaa gtgtaaaaca tacacagagt aaaacataca cagagactaa gaagtagttg attaaaggtc ctagatctct gaataacaac aacggcagaa agaactcagt aacaaattta agcctctttt cagaggttgc tttttgattc actggccaca atgtctgtcc cagcaccctg agtgtgatgg gatagagcta tggaccggcc cggactaaag gcagacggta ggtaatagca gctagcttca tcttaatgcc actgcaggaa gtaagtcagc tggcagaata gatccagact tctgcttccc ctacaagctt gtcttgcctc aacacactga gacttacagt aatgaataat gggcatcatg acttagaaat cagttagaga gttatggcgg tacgaagggt cattccaaag cctgg a) Millaiset alukkeet tarvitset sekvenssiäsi varten PCR-monistukseen?
6 PCR-sykli koostuu seuraavista toistettavista lämpötiloista: 95 C 54 C 72 C ( takaisin alkuun) b) Tehdessäsi tavalliseen tapaan PCR:ää, huomaat kuitenkin sellaisen kiusallisen seikan, että jostakin syystä alukkeesi tuntuu sitoutuvan epäspesifisesti muuallekin DNA:han. Kyse ei ole siitä, että DNA:ssa olisi muualla alukkeesi täsmällisiä vastinsekvenssejä, vaan siitä, että aluke sitoutuu sekvensseihin, jotka ovat lähellä sitä. Neuvoksi sinua kehotetaan kohottamaan PCR:n yhden vaiheen lämpötilaa. Mistä vaiheesta on kyse ja miksi lämpötilan nostaminen voisi auttaa? c) Miksi synteesivaiheen lämpötila voi olla korkeampi kuin alukkeen sitoutumisvaiheen lämpötila? d) Miksi sinun tarvitsee lisätä PCR-putkeesi ainoastaan lämmönkestävää DNA-polymeraasia eikä mitään muita replikaatiossa tarvittavia entsyymejä? e) Pilkot tuottamasi DNA-pätkän restriktioentsyymillä ja teet saman käsittelyn myös molemmille kontrolleillesi. Ajat reaktiotuotteistasi agaroosigeelielektroforeesin ja saat seuraavanlaisen kaavakuvan mukaisen tuloksen: Mistä on kyse? Onko potilaalla tauti vai ei? Voitko ylipäätään ratkaista sitä näillä tiedoilla? Mistä on kyse, jos potilaalla on tauti, ja mistä on kyse, jos potilaalla ei ole tautia?
Laskuharjoitus 1 palautus 21. 10. 2003 mennessä Juha-Matti Alakoskela, jmalakos@cc.helsinki.fi
 Laskuharjoitus 1 palautus 21. 10. 2003 mennessä Juha-Matti Alakoskela, jmalakos@cc.helsinki.fi Yleistä Kurssin maksimipistemäärä on 44. Kaikista mahdollisista pisteistä 36 on jaossa kurssin tentissä, 4
Laskuharjoitus 1 palautus 21. 10. 2003 mennessä Juha-Matti Alakoskela, jmalakos@cc.helsinki.fi Yleistä Kurssin maksimipistemäärä on 44. Kaikista mahdollisista pisteistä 36 on jaossa kurssin tentissä, 4
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 5: Termodynaamiset potentiaalit Ke 9.3.2016 1 AIHEET 1. Muut työn laadut sisäenergiassa
vetyteknologia Polttokennon termodynamiikkaa 1 DEE Risto Mikkonen
 DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
DEE-5400 olttokennot ja vetyteknologia olttokennon termodynamiikkaa 1 DEE-5400 Risto Mikkonen ermodynamiikan ensimmäinen pääsääntö aseraja Ympäristö asetila Q W Suljettuun systeemiin tuotu lämpö + systeemiin
= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]
![= P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ] = P 0 (V 2 V 1 ) + nrt 0. nrt 0 ln V ]](/thumbs/62/46694692.jpg) 766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
766328A Termofysiikka Harjoitus no. 7, ratkaisut (syyslukukausi 2014) 1. Sylinteri on ympäristössä, jonka paine on P 0 ja lämpötila T 0. Sylinterin sisällä on n moolia ideaalikaasua ja sen tilavuutta kasvatetaan
Bioteknologian perustyökaluja
 Bioteknologian perustyökaluja DNAn ja RNAn eristäminen helppoa. Puhdistaminen työlästä (DNA pestään lukuisilla liuottimilla). Myös lähetti-rnat voidaan eristää ja muuntaa virusten käänteiskopioijaentsyymin
Bioteknologian perustyökaluja DNAn ja RNAn eristäminen helppoa. Puhdistaminen työlästä (DNA pestään lukuisilla liuottimilla). Myös lähetti-rnat voidaan eristää ja muuntaa virusten käänteiskopioijaentsyymin
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA
 PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
PHYS-C0220 TERMODYNAMIIKKA JA STATISTINEN FYSIIKKA Kevät 2016 Emppu Salonen Lasse Laurson Arttu Lehtinen Toni Mäkelä Luento 8: Kemiallinen potentiaali, suurkanoninen ensemble Pe 18.3.2016 1 AIHEET 1. Kanoninen
1 Eksergia ja termodynaamiset potentiaalit
 1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
1 PHYS-C0220 Termodynamiikka ja statistinen fysiikka, kevät 2017 Emppu Salonen 1 Eksergia ja termodynaamiset potentiaalit 1.1 Suurin mahdollinen hyödyllinen työ Tähän mennessä olemme tarkastelleet sisäenergian
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 6: Vapaaenergia Pe 11.3.2016 1 AIHEET 1. Kemiallinen potentiaali 2. Maxwellin
Lämpöopin pääsäännöt
 Lämpöopin pääsäännöt 0. Eristetyssä systeemissä lämpötilaerot tasoittuvat. Systeemin sisäenergia U kasvaa systeemin tuodun lämmön ja systeemiin tehdyn työn W verran: ΔU = + W 2. Eristetyn systeemin entropia
Lämpöopin pääsäännöt 0. Eristetyssä systeemissä lämpötilaerot tasoittuvat. Systeemin sisäenergia U kasvaa systeemin tuodun lämmön ja systeemiin tehdyn työn W verran: ΔU = + W 2. Eristetyn systeemin entropia
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 /
 ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 / 7.11.2016 v. 02 / T. Paloposki Tämän päivän ohjelma: Sisäenergia (kertaus) termodynamiikan 1. pääsääntö Entropia termodynamiikan 2. pääsääntö 1 Termodynamiikan
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 8 / 7.11.2016 v. 02 / T. Paloposki Tämän päivän ohjelma: Sisäenergia (kertaus) termodynamiikan 1. pääsääntö Entropia termodynamiikan 2. pääsääntö 1 Termodynamiikan
Muita lämpökoneita. matalammasta lämpötilasta korkeampaan. Jäähdytyksen tehokerroin: Lämmityksen lämpökerroin:
 Muita lämpökoneita Nämäkin vaativat ovat työtälämpövoimakoneiden toimiakseen sillä termodynamiikan pääsääntö Lämpökoneita lisäksi laitteet,toinen jotka tekevät on Clausiuksen mukaan: laiteilmalämpöpumppu
Muita lämpökoneita Nämäkin vaativat ovat työtälämpövoimakoneiden toimiakseen sillä termodynamiikan pääsääntö Lämpökoneita lisäksi laitteet,toinen jotka tekevät on Clausiuksen mukaan: laiteilmalämpöpumppu
Tämän päivän ohjelma: ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 7 /
 ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 7 / 30.10.2017 v. 03 / T. Paloposki Tämän päivän ohjelma: Entropia Termodynamiikan 2. pääsääntö Palautuvat ja palautumattomat prosessit 1 Entropia Otetaan
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 7 / 30.10.2017 v. 03 / T. Paloposki Tämän päivän ohjelma: Entropia Termodynamiikan 2. pääsääntö Palautuvat ja palautumattomat prosessit 1 Entropia Otetaan
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 27.11. ja tiistai 28.11. Kotitentti Julkaistaan ti 5.12., palautus viim. ke 20.12.
PCR - tekniikka elintarvikeanalytiikassa
 PCR - tekniikka elintarvikeanalytiikassa Listerian, Salmonellan ja kampylobakteerien tunnistus elintarvikkeista ja rehuista 29.11.2012 Eva Fredriksson-Lidsle Listeria monocytogenes Salmonella (spp) Campylobacter
PCR - tekniikka elintarvikeanalytiikassa Listerian, Salmonellan ja kampylobakteerien tunnistus elintarvikkeista ja rehuista 29.11.2012 Eva Fredriksson-Lidsle Listeria monocytogenes Salmonella (spp) Campylobacter
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 5: Termodynaamiset potentiaalit Maanantai 28.11. ja tiistai 29.11. Kotitentti Julkaistaan to 8.12., palautus viim. to 22.12.
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 4: Entropia Maanantai 21.11. ja tiistai 22.11. Ideaalikaasun isoterminen laajeneminen Kaasuun tuodaan määrä Q lämpöä......
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 4: Entropia Maanantai 21.11. ja tiistai 22.11. Ideaalikaasun isoterminen laajeneminen Kaasuun tuodaan määrä Q lämpöä......
Nimi sosiaaliturvatunnus. Vastaa lyhyesti, selkeällä käsialalla. Vain vastausruudun sisällä olevat tekstit, kuvat jne huomioidaan
 1. Valitse listasta kunkin yhdisteen yleiskielessä käytettävä ei-systemaattinen nimi. (pisteet yht. 5p) a) C-vitamiini b) glukoosi c) etikkahappo d) salisyylihappo e) beta-karoteeni a. b. c. d. e. ksylitoli
1. Valitse listasta kunkin yhdisteen yleiskielessä käytettävä ei-systemaattinen nimi. (pisteet yht. 5p) a) C-vitamiini b) glukoosi c) etikkahappo d) salisyylihappo e) beta-karoteeni a. b. c. d. e. ksylitoli
kuonasula metallisula Avoin Suljettu Eristetty S / Korkealämpötilakemia Termodynamiikan peruskäsitteitä
 Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
Termodynamiikan peruskäsitteitä The Laws of thermodynamics: (1) You can t win (2) You can t break even (3) You can t get out of the game. - Ginsberg s theorem - Masamune Shirow: Ghost in the shell Systeemillä
Jos olet käynyt kurssin aikaisemmin, merkitse vuosi jolloin kävit kurssin nimen alle.
 1(4) Lappeenrannan teknillinen yliopisto School of Energy Systems LUT Energia Nimi, op.nro: BH20A0450 LÄMMÖNSIIRTO Tentti 13.9.2016 Osa 1 (4 tehtävää, maksimi 40 pistettä) Vastaa seuraaviin kysymyksiin
1(4) Lappeenrannan teknillinen yliopisto School of Energy Systems LUT Energia Nimi, op.nro: BH20A0450 LÄMMÖNSIIRTO Tentti 13.9.2016 Osa 1 (4 tehtävää, maksimi 40 pistettä) Vastaa seuraaviin kysymyksiin
Teddy 7. harjoituksen malliratkaisu syksy 2011
 Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
Teddy 7. harjoituksen malliratkaisu syksy 2011 1. Systeemin käyttäytymistä faasirajalla kuvaa Clapeyronin yhtälönä tunnettu keskeinen relaatio dt = S m. (1 V m Koska faasitasapainossa reaktion Gibbsin
REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos
 ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
ympäristö ympäristö 15.12.2016 REAKTIOT JA ENERGIA, KE3 Ekso- ja endotermiset reaktiot sekä entalpian muutos Kaikilla aineilla (atomeilla, molekyyleillä) on asema- eli potentiaalienergiaa ja liike- eli
Lämmityksen lämpökerroin: Jäähdytin ja lämmitin ovat itse asiassa sama laite, mutta niiden hyötytuote on eri, jäähdytyksessä QL ja lämmityksessä QH
 Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
Muita lämpökoneita Nämäkin vaativat työtä toimiakseen sillä termodynamiikan toinen pääsääntö Lämpökoneita ovat lämpövoimakoneiden lisäksi laitteet, jotka tekevät on Clausiuksen mukaan: Mikään laite ei
. Veden entropiamuutos lasketaan isobaariselle prosessille yhtälöstä
 LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
LH- Kilo vettä, jonka lämpötila on 0 0 asetetaan kosketukseen suuren 00 0 asteisen kappaleen kanssa Kun veden lämpötila on noussut 00 0, mitkä ovat veden, kappaleen ja universumin entropian muutokset?
Tasapainotilaan vaikuttavia tekijöitä
 REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
REAKTIOT JA TASAPAINO, KE5 Tasapainotilaan vaikuttavia tekijöitä Fritz Haber huomasi ammoniakkisynteesiä kehitellessään, että olosuhteet vaikuttavat ammoniakin määrään tasapainoseoksessa. Hän huomasi,
Luento 8 6.3.2015. Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit
 Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Luento 8 6.3.2015 1 Entrooppiset voimat Vapaan energian muunoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) 2 Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
PHYS-A0120 Termodynamiikka syksy 2016
 PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
PHYS-A0120 Termodynamiikka syksy 2016 Emppu Salonen Prof. Peter Liljeroth Viikko 6: Faasimuutokset Maanantai 5.12. Kurssin aiheet 1. Lämpötila ja lämpö 2. Työ ja termodynamiikan 1. pääsääntö 3. Lämpövoimakoneet
Nimi sosiaaliturvatunnus. Vastaa lyhyesti, selkeällä käsialalla. Vain vastausruudun sisällä olevat tekstit, kuvat jne huomioidaan
 1. a) Seoksen komponentit voidaan erotella toisistaan kromatografisilla menetelmillä. Mihin kromatografiset menetelmät perustuvat? (2p) Menetelmät perustuvat seoksen osasten erilaiseen sitoutumiseen paikallaan
1. a) Seoksen komponentit voidaan erotella toisistaan kromatografisilla menetelmillä. Mihin kromatografiset menetelmät perustuvat? (2p) Menetelmät perustuvat seoksen osasten erilaiseen sitoutumiseen paikallaan
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
T H V 2. Kuva 1: Stirling kiertoprosessi. Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista (kts. kuva 1):
 1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
1 c 3 p 2 T H d b T L 4 1 a V Kuva 1: Stirling kiertoprosessi. Stirlingin kone Ideaalisen Stirlingin koneen sykli koostuu neljästä osaprosessista kts. kuva 1: 1. Työaineen ideaalikaasu isoterminen puristus
Lämpöoppi. Termodynaaminen systeemi. Tilanmuuttujat (suureet) Eristetty systeemi. Suljettu systeemi. Avoin systeemi.
 Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Lämpöoppi Termodynaaminen systeemi Tilanmuuttujat (suureet) Lämpötila T (K) Absoluuttinen asteikko eli Kelvinasteikko! Paine p (Pa, bar) Tilavuus V (l, m 3, ) Ainemäärä n (mol) Eristetty systeemi Ei ole
Tehtävä 1. Tasapainokonversion laskenta Χ r G-arvojen avulla Alkyloitaessa bentseeniä propeenilla syntyy kumeenia (isopropyylibentseeniä):
 CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
CHEM-A1110 Virtaukset ja reaktorit Laskuharjoitus 10/017 Lisätietoja s-postilla reetta.karinen@aalto.fi tai tiia.viinikainen@aalto.fi vastaanotto huoneessa E409 Kemiallinen tasapaino Tehtävä 1. Tasapainokonversion
Biomolekyylit ja biomeerit
 Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
Biomolekyylit ja biomeerit Polymeerit ovat hyvin suurikokoisia, pitkäketjuisia molekyylejä, jotka muodostuvat monomeereista joko polyadditio- tai polykondensaatioreaktiolla. Polymeerit Synteettiset polymeerit
DNA:n informaation kulku, koostumus
 DNA:n informaation kulku, koostumus KOOSTUMUS Elävien bio-organismien koostumus. Vety, hiili, happi ja typpi muodostavat yli 99% orgaanisten molekyylien rakenneosista. Biomolekyylit voidaan pääosin jakaa
DNA:n informaation kulku, koostumus KOOSTUMUS Elävien bio-organismien koostumus. Vety, hiili, happi ja typpi muodostavat yli 99% orgaanisten molekyylien rakenneosista. Biomolekyylit voidaan pääosin jakaa
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko klo 8-10
 Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Kertausluennot: Mahdollisuus pisteiden korotukseen ja rästisuorituksiin Keskiviikko 25.10 klo 8-10 Jokaisesta oikein ratkaistusta tehtävästä voi saada yhden lisäpisteen. Tehtävä, joilla voi korottaa kotitehtävän
Lääketieteen ja biotieteiden tiedekunta Sukunimi Bioteknologia tutkinto-ohjelma Etunimet valintakoe pe Tehtävä 1 Pisteet / 15
 Tampereen yliopisto Henkilötunnus - Lääketieteen ja biotieteiden tiedekunta Sukunimi Bioteknologia tutkinto-ohjelma Etunimet valintakoe pe 18.5.2018 Tehtävä 1 Pisteet / 15 1. Alla on esitetty urheilijan
Tampereen yliopisto Henkilötunnus - Lääketieteen ja biotieteiden tiedekunta Sukunimi Bioteknologia tutkinto-ohjelma Etunimet valintakoe pe 18.5.2018 Tehtävä 1 Pisteet / 15 1. Alla on esitetty urheilijan
Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen
 KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
KEMA221 2009 PUHTAAN AINEEN FAASIMUUTOKSET ATKINS LUKU 4 1 PUHTAAN AINEEN FAASIMUUTOKSET Esimerkkejä faasimuutoksista? Tässä luvussa keskitytään faasimuutosten termodynaamiseen kuvaukseen Faasi = aineen
Laskuharjoitus 3 palautus 11. 11. 2003 mennessä. Entsyymillä on seuraavanlainen reaktiomekanismi (katso oheista kuvaa):
 Laskuharjoitus 3 palautus 11. 11. 2003 mennessä Tehtävä 1: Entsyymikinetiikkaa Entsyymillä on seuraavanlainen reaktiomekanismi (katso oheista kuvaa): 1. A:n sitoutuminen saa konformaatiossa aikaan muutoksen,
Laskuharjoitus 3 palautus 11. 11. 2003 mennessä Tehtävä 1: Entsyymikinetiikkaa Entsyymillä on seuraavanlainen reaktiomekanismi (katso oheista kuvaa): 1. A:n sitoutuminen saa konformaatiossa aikaan muutoksen,
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017 Emppu Salonen Lasse Laurson Toni Mäkelä Touko Herranen Luento 4: entropia Pe 3.3.2017 1 Aiheet tänään 1. Klassisen termodynamiikan entropia
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2017 Emppu Salonen Lasse Laurson Toni Mäkelä Touko Herranen Luento 4: entropia Pe 3.3.2017 1 Aiheet tänään 1. Klassisen termodynamiikan entropia
Luento 2: Lämpökemiaa, osa 1 Keskiviikko klo Termodynamiikan käsitteitä
 Luento 2: Lämpökemiaa, osa 1 Keskiviikko 12.9. klo 8-10 477401A - ermodynaamiset tasapainot (Syksy 2018) ermodynamiikan käsitteitä - Systeemi Eristetty - suljettu - avoin Homogeeninen - heterogeeninen
Luento 2: Lämpökemiaa, osa 1 Keskiviikko 12.9. klo 8-10 477401A - ermodynaamiset tasapainot (Syksy 2018) ermodynamiikan käsitteitä - Systeemi Eristetty - suljettu - avoin Homogeeninen - heterogeeninen
RATKAISUT: 12. Lämpöenergia ja lämpöopin pääsäännöt
 Physica 9 1. painos 1(7) : 12.1 a) Lämpö on siirtyvää energiaa, joka siirtyy kappaleesta (systeemistä) toiseen lämpötilaeron vuoksi. b) Lämpöenergia on kappaleeseen (systeemiin) sitoutunutta energiaa.
Physica 9 1. painos 1(7) : 12.1 a) Lämpö on siirtyvää energiaa, joka siirtyy kappaleesta (systeemistä) toiseen lämpötilaeron vuoksi. b) Lämpöenergia on kappaleeseen (systeemiin) sitoutunutta energiaa.
Kaksi yleismittaria, tehomittari, mittausalusta 5, muistiinpanot ja oppikirjat. P = U x I
 Pynnönen 1/3 SÄHKÖTEKNIIKKA Kurssi: Harjoitustyö : Tehon mittaaminen Pvm : Opiskelija: Tark. Arvio: Tavoite: Välineet: Harjoitustyön tehtyäsi osaat mitata ja arvioida vastukseen jäävän tehohäviön sähköisessä
Pynnönen 1/3 SÄHKÖTEKNIIKKA Kurssi: Harjoitustyö : Tehon mittaaminen Pvm : Opiskelija: Tark. Arvio: Tavoite: Välineet: Harjoitustyön tehtyäsi osaat mitata ja arvioida vastukseen jäävän tehohäviön sähköisessä
ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia)
 ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia) Elämän edellytykset: Solun täytyy pystyä (a) replikoitumaan (B) katalysoimaan tarvitsemiaan reaktioita tehokkaasti ja selektiivisesti eli sillä on oltava
ENTSYYMIKATA- LYYSIN PERUSTEET (dos. Tuomas Haltia) Elämän edellytykset: Solun täytyy pystyä (a) replikoitumaan (B) katalysoimaan tarvitsemiaan reaktioita tehokkaasti ja selektiivisesti eli sillä on oltava
FY9 Fysiikan kokonaiskuva
 FY9 Sivu 1 FY9 Fysiikan kokonaiskuva 6. tammikuuta 2014 14:34 Kurssin tavoitteet Kerrata lukion fysiikan oppimäärä Yhdistellä kurssien asioita toisiinsa muodostaen kokonaiskuvan Valmistaa ylioppilaskirjoituksiin
FY9 Sivu 1 FY9 Fysiikan kokonaiskuva 6. tammikuuta 2014 14:34 Kurssin tavoitteet Kerrata lukion fysiikan oppimäärä Yhdistellä kurssien asioita toisiinsa muodostaen kokonaiskuvan Valmistaa ylioppilaskirjoituksiin
Luku Pääsääntö (The Second Law)
 Luku 3 2. Pääsääntö (he Second Law) Some things happen naturally, some things don t Spontaneous must be interpreted as a natural tendency that may or may not be realized in prac=ce. hermodynamics is silent
Luku 3 2. Pääsääntö (he Second Law) Some things happen naturally, some things don t Spontaneous must be interpreted as a natural tendency that may or may not be realized in prac=ce. hermodynamics is silent
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016
 PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 1: Lämpötila ja Boltzmannin jakauma Ke 24.2.2016 1 YLEISTÄ KURSSISTA Esitietovaatimuksena
PHYS-C0220 Termodynamiikka ja statistinen fysiikka Kevät 2016 Emppu Salonen Lasse Laurson Toni Mäkelä Arttu Lehtinen Luento 1: Lämpötila ja Boltzmannin jakauma Ke 24.2.2016 1 YLEISTÄ KURSSISTA Esitietovaatimuksena
Solun Kalvot. Kalvot muodostuvat spontaanisti. Biologiset kalvot koostuvat tuhansista erilaisista molekyyleistä
 Solun Kalvot (ja Mallikalvot) Biologiset kalvot koostuvat tuhansista erilaisista molekyyleistä Biokemian ja Farmakologian erusteet 2012 Kalvot muodostuvat spontaanisti Veden rakenne => ydrofobinen vuorovaikutus
Solun Kalvot (ja Mallikalvot) Biologiset kalvot koostuvat tuhansista erilaisista molekyyleistä Biokemian ja Farmakologian erusteet 2012 Kalvot muodostuvat spontaanisti Veden rakenne => ydrofobinen vuorovaikutus
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Clausiuksen epäyhtälö
 1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
1 Kuva 1: Clausiuksen epäyhtälön johtaminen. Clausiuksen epäyhtälö otesimme Carnot n koneelle, että syklissä lämpötiloissa H ja L vastaanotetuille lämmöille Q H ja Q L pätee Q H H oisin ilmaistuna, Carnot
T F = T C ( 24,6) F = 12,28 F 12,3 F T K = (273,15 24,6) K = 248,55 K T F = 87,8 F T K = 4,15 K T F = 452,2 F. P = α T α = P T = P 3 T 3
 76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
76628A Termofysiikka Harjoitus no. 1, ratkaisut (syyslukukausi 2014) 1. Muunnokset Fahrenheit- (T F ), Celsius- (T C ) ja Kelvin-asteikkojen (T K ) välillä: T F = 2 + 9 5 T C T C = 5 9 (T F 2) T K = 27,15
Luento 9 Kemiallinen tasapaino CHEM-A1250
 Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Luento 9 Kemiallinen tasapaino CHEM-A1250 Kemiallinen tasapaino Kaksisuuntainen reaktio Eteenpäin menevän reaktion reaktionopeus = käänteisen reaktion reaktionopeus Näennäisesti muuttumaton lopputilanne=>
Termodynamiikan suureita ja vähän muutakin mikko rahikka
 Termodynamiikan suureita ja vähän muutakin mikko rahikka 2006 m@hyl.fi 1 Lämpötila Suure lämpötila kuvaa kappaleen/systeemin lämpimyyttä (huono ilmaisu). Ihmisen aisteilla on hankala tuntea lämpötilaa,
Termodynamiikan suureita ja vähän muutakin mikko rahikka 2006 m@hyl.fi 1 Lämpötila Suure lämpötila kuvaa kappaleen/systeemin lämpimyyttä (huono ilmaisu). Ihmisen aisteilla on hankala tuntea lämpötilaa,
Palautus yhtenä tiedostona PDF-muodossa viimeistään torstaina
 PHYS-A0120 Termodynamiikka, syksy 2018 Kotitentti Vastaa tehtäviin 1/2/3, 4, 5/6, 7/8, 9 (yhteensä viisi vastausta). Tehtävissä 1, 2, 3 ja 9 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
PHYS-A0120 Termodynamiikka, syksy 2018 Kotitentti Vastaa tehtäviin 1/2/3, 4, 5/6, 7/8, 9 (yhteensä viisi vastausta). Tehtävissä 1, 2, 3 ja 9 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla
Luku 2. Kemiallisen reaktion tasapaino
 Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Luku 2 Kemiallisen reaktion tasapaino 1 2 Keskeisiä käsitteitä 3 Tasapainotilan syntyminen, etenevä reaktio 4 Tasapainotilan syntyminen 5 Tasapainotilan syntyminen, palautuva reaktio 6 Kemiallisen tasapainotilan
Keski-Suomen fysiikkakilpailu
 Keski-Suomen fysiikkakilpailu 28.1.2016 Kilpailussa on kolme kirjallista tehtävää ja yksi kokeellinen tehtävä. Kokeellisen tehtävän ohjeistus on laatikossa mittausvälineiden kanssa. Jokainen tehtävä tulee
Keski-Suomen fysiikkakilpailu 28.1.2016 Kilpailussa on kolme kirjallista tehtävää ja yksi kokeellinen tehtävä. Kokeellisen tehtävän ohjeistus on laatikossa mittausvälineiden kanssa. Jokainen tehtävä tulee
Ohjeellinen pituus: 2 3 sivua. Vastaa joko tehtävään 2 tai 3
 PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
PHYS-A0120 Termodynamiikka, syksy 2017 Kotitentti Vastaa tehtäviin 1, 2/3, 4/5, 6/7, 8 (yhteensä viisi vastausta). Tehtävissä 1 ja 7 on annettu ohjeellinen pituus, joka viittaa 12 pisteen fontilla sekä
Oikeat vastaukset: Tehtävän tarkkuus on kolme numeroa. Sulamiseen tarvittavat lämmöt sekä teräksen suurin mahdollinen luovutettu lämpö:
 A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
A1 Seppä karkaisee teräsesineen upottamalla sen lämpöeristettyyn astiaan, jossa on 118 g jäätä ja 352 g vettä termisessä tasapainossa Teräsesineen massa on 312 g ja sen lämpötila ennen upotusta on 808
S , Fysiikka III (Sf) tentti/välikoeuusinta
 S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
S-114.45, Fysiikka III (Sf) tentti/välikoeuusinta.11.4 1. välikokeen alue 1. Osoita, että hyvin alhaisissa lämpötiloissa elektronin FD systeemin energia on U = (3/ 5) ε F. Opastus: oleta, että kaikki tilat
4) Törmäysten lisäksi rakenneosasilla ei ole mitään muuta keskinäistä tai ympäristöön suuntautuvaa vuorovoikutusta.
 K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
K i n e e t t i s t ä k a a s u t e o r i a a Kineettisen kaasuteorian perusta on mekaaninen ideaalikaasu, joka on matemaattinen malli kaasulle. Reaalikaasu on todellinen kaasu. Reaalikaasu käyttäytyy
SISÄLLYSLUETTELO SYMBOLILUETTELO 4
 1 SISÄLLYSLUETTELO SYMBOLILUETTELO 4 1 KEMIALLISESTI REAGOIVA TERMODYNAAMINEN SYSTEEMI 6 11 Yleistä 6 12 Standarditila ja referenssitila 7 13 Entalpia- ja entropia-asteikko 11 2 ENTALPIA JA OMINAISLÄMPÖ
1 SISÄLLYSLUETTELO SYMBOLILUETTELO 4 1 KEMIALLISESTI REAGOIVA TERMODYNAAMINEN SYSTEEMI 6 11 Yleistä 6 12 Standarditila ja referenssitila 7 13 Entalpia- ja entropia-asteikko 11 2 ENTALPIA JA OMINAISLÄMPÖ
Ideaalikaasulaki. Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua
 Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Ideaalikaasulaki Ideaalikaasulaki on esimerkki tilanyhtälöstä, systeemi on nyt tietty määrä (kuvitteellista) kaasua ja tilanmuuttujat (yhä) paine, tilavuus ja lämpötila Isobaari, kun paine on vakio Kaksi
Entrooppiset voimat. Entrooppiset voimat Vapaan energian muunnoksen hyötysuhde Kahden tilan systeemit
 Entrooppiset voimat Entrooppiset voimat Vapaan energian muunnoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Entrooppiset voimat Entrooppiset voimat Vapaan energian muunnoksen hyötysuhde Kahden tilan systeemit Entrooppiset voimat 3 2 0 0 S k N ln VE S, S f ( N, m) Makroskooppisia voimia, jotka syntyvät pyrkimyksestä
Biofysiikka Luento Entropia, lämpötila ja vapaa energia. Shannonin entropia. Boltzmannin entropia. Lämpötila. Vapaa energia.
 Biofysiikka Luento 7 1 6. Entropia, lämpötila ja vapaa energia Shannonin entropia Boltzmannin entropia M I NK P ln P S k B j1 ln j j Lämpötila Vapaa energia 2 Esimerkkiprobleemoita: Miten DNA-sekvenssistä
Biofysiikka Luento 7 1 6. Entropia, lämpötila ja vapaa energia Shannonin entropia Boltzmannin entropia M I NK P ln P S k B j1 ln j j Lämpötila Vapaa energia 2 Esimerkkiprobleemoita: Miten DNA-sekvenssistä
HSC-ohje laskuharjoituksen 1 tehtävälle 2
 HSC-ohje laskuharjoituksen 1 tehtävälle 2 Metanolisynteesin bruttoreaktio on CO 2H CH OH (3) 2 3 Laske metanolin tasapainopitoisuus mooliprosentteina 350 C:ssa ja 350 barin paineessa, kun lähtöaineena
HSC-ohje laskuharjoituksen 1 tehtävälle 2 Metanolisynteesin bruttoreaktio on CO 2H CH OH (3) 2 3 Laske metanolin tasapainopitoisuus mooliprosentteina 350 C:ssa ja 350 barin paineessa, kun lähtöaineena
Aluksi. 1.1. Kahden muuttujan lineaarinen yhtälö
 Aluksi Matematiikan käsite suora on tarkalleen sama asia kuin arkikielen suoran käsite. Vai oliko se toisinpäin? Matematiikan luonteesta johtuu, että sen soveltaja ei tyydy pelkkään suoran nimeen eikä
Aluksi Matematiikan käsite suora on tarkalleen sama asia kuin arkikielen suoran käsite. Vai oliko se toisinpäin? Matematiikan luonteesta johtuu, että sen soveltaja ei tyydy pelkkään suoran nimeen eikä
Mikrotila Makrotila Statistinen paino Ω(n) 3 Ω(3) = 4 2 Ω(2) = 6 4 Ω(4) = 1
 76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
ELEC-C2210 Molekyyli- ja solubiologia
 ELEC-C2210 Molekyyli- ja solubiologia Entsyymikatalyysi Vuento & Heino ss. 66-75 ECB: Luku 3, s. 90-93 & luku 4, s. 144- Dos. Tuomas Haltia, Biotieteiden laitos, biokemia ja biotekniikka Miten entsyymit
ELEC-C2210 Molekyyli- ja solubiologia Entsyymikatalyysi Vuento & Heino ss. 66-75 ECB: Luku 3, s. 90-93 & luku 4, s. 144- Dos. Tuomas Haltia, Biotieteiden laitos, biokemia ja biotekniikka Miten entsyymit
Matematiikan tukikurssi, kurssikerta 3
 Matematiikan tukikurssi, kurssikerta 3 1 Epäyhtälöitä Aivan aluksi lienee syytä esittää luvun itseisarvon määritelmä: { x kun x 0 x = x kun x < 0 Siispä esimerkiksi 10 = 10 ja 10 = 10. Seuraavaksi listaus
Matematiikan tukikurssi, kurssikerta 3 1 Epäyhtälöitä Aivan aluksi lienee syytä esittää luvun itseisarvon määritelmä: { x kun x 0 x = x kun x < 0 Siispä esimerkiksi 10 = 10 ja 10 = 10. Seuraavaksi listaus
1. van der Waalsin tilanyhtälö: 2 V m RT. + b2. ja C = b2. Kun T = 273 K niin B = cm 3 /mol ja C = 1200 cm 6 mol 2
 FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
FYSIKAALINEN KEMIA KEMA22) Laskuharjoitus 2, 28..2009. van der Waalsin tilanyhtälö: p = RT V m b a Vm V 2 m pv m = RT V m b = RT = RT a ) V m RT a b/v m V m RT ) [ b/v m ) a V m RT Soveltamalla sarjakehitelmää
H7 Malliratkaisut - Tehtävä 1
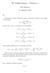 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
= 1 kg J kg 1 1 kg 8, J mol 1 K 1 373,15 K kg mol 1 1 kg Pa
 766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
766328A Termofysiikka Harjoitus no. 8, ratkaisut syyslukukausi 2014 1. 1 kg nestemäistä vettä muuttuu höyryksi lämpötilassa T 100 373,15 K ja paineessa P 1 atm 101325 Pa. Veden tiheys ρ 958 kg/m 3 ja moolimassa
Esimerkiksi ammoniakin valmistus typestä ja vedystä on tyypillinen teollinen tasapainoreaktio.
 REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
REAKTIOT JA TASAPAINO, KE5 REAKTIOTASAPAINO Johdantoa: Usein kemialliset reaktiot tapahtuvat vain yhteen suuntaan eli lähtöaineet reagoivat keskenään täydellisesti reaktiotuotteiksi, esimerkiksi palaminen
Veden ionitulo ja autoprotolyysi TASAPAINO, KE5
 REAKTIOT JA Veden ionitulo ja autoprotolyysi TASAPAINO, KE5 Kun hapot ja emäkset protolysoituvat, vesiliuokseen muodostuu joko oksoniumioneja tai hydroksidi-ioneja. Määritelmä: Oksoniumionit H 3 O + aiheuttavat
REAKTIOT JA Veden ionitulo ja autoprotolyysi TASAPAINO, KE5 Kun hapot ja emäkset protolysoituvat, vesiliuokseen muodostuu joko oksoniumioneja tai hydroksidi-ioneja. Määritelmä: Oksoniumionit H 3 O + aiheuttavat
1. Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta
 766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
766328A Termofysiikka Harjoitus no. 5, ratkaisut syyslukukausi 204). Yksiulotteisen harmonisen oskillaattorin energiatilat saadaan lausekkeesta E n n + ) ω, n 0,, 2,... 2 a) Oskillaattorin partitiofunktio
6. Entropia, lämpötila ja vapaa energia
 6. Entropia, lämpötila a vapaa energia 1 Luento 6 24.2.2017: Shannonin entropia M I NK P ln P 1 Boltzmannin entropia S k B ln Lämpötila Vapaa energia 2 Probleemoita: Miten DNA-sekvenssistä määräytyvän
6. Entropia, lämpötila a vapaa energia 1 Luento 6 24.2.2017: Shannonin entropia M I NK P ln P 1 Boltzmannin entropia S k B ln Lämpötila Vapaa energia 2 Probleemoita: Miten DNA-sekvenssistä määräytyvän
Biokemian perusteet 26.9.2012: Hemoglobiini, Entsyymikatalyysi
 Biokemian perusteet 26.9.2012: Hemoglobiini, Entsyymikatalyysi Dos. Tuomas Haltia Sirppisoluanemia, Hb-mutaatio Glu-6 Val Hemoglobiini allosteerinen hapen kuljettajaproteiini (ei ole entsyymi!) Allosteerinen
Biokemian perusteet 26.9.2012: Hemoglobiini, Entsyymikatalyysi Dos. Tuomas Haltia Sirppisoluanemia, Hb-mutaatio Glu-6 Val Hemoglobiini allosteerinen hapen kuljettajaproteiini (ei ole entsyymi!) Allosteerinen
Luku 20. Kertausta: Termodynamiikan 2. pääsääntö Lämpövoimakoneen hyötysuhde
 Luku 20 Kertausta: Termodynamiikan 2. pääsääntö Lämpövoimakoneen hyötysuhde Uutta: Termodynamiikan 2. pääsääntö Jäähdytyskoneen hyötykerroin ja lämpöpumpun lämpökerroin Entropia Tilastollista termodynamiikkaa
Luku 20 Kertausta: Termodynamiikan 2. pääsääntö Lämpövoimakoneen hyötysuhde Uutta: Termodynamiikan 2. pääsääntö Jäähdytyskoneen hyötykerroin ja lämpöpumpun lämpökerroin Entropia Tilastollista termodynamiikkaa
Spontaanissa prosessissa Energian jakautuminen eri vapausasteiden kesken lisääntyy Energia ja materia tulevat epäjärjestyneemmäksi
 KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
KEMA221 2009 TERMODYNAMIIKAN 2. PÄÄSÄÄNTÖ ATKINS LUKU 3 1 1. TERMODYNAMIIKAN TOINEN PÄÄSÄÄNTÖ Lord Kelvin: Lämpöenergian täydellinen muuttaminen työksi ei ole mahdollista 2. pääsääntö kertoo systeemissä
Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen
 KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
KEMA221 2009 YKSINKERTAISET SEOKSET ATKINS LUKU 5 1 YKSINKERTAISET SEOKSET Gibbsin energia ja kemiallinen potentiaali määräävät seosten käyttäytymisen Seoksia voidaan tarkastella osittaisten moolisuureitten
on hidastuvaa. Hidastuvuus eli negatiivinen kiihtyvyys saadaan laskevan suoran kulmakertoimesta, joka on siis
 Fys1, moniste 2 Vastauksia Tehtävä 1 N ewtonin ensimmäisen lain mukaan pallo jatkaa suoraviivaista liikettä kun kourun siihen kohdistama tukivoima (tässä tapauksessa ympyräradalla pitävä voima) lakkaa
Fys1, moniste 2 Vastauksia Tehtävä 1 N ewtonin ensimmäisen lain mukaan pallo jatkaa suoraviivaista liikettä kun kourun siihen kohdistama tukivoima (tässä tapauksessa ympyräradalla pitävä voima) lakkaa
1. Laske ideaalikaasun tilavuuden lämpötilakerroin (1/V)(dV/dT) p ja isoterminen kokoonpuristuvuus (1/V)(dV/dp) T.
 S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
S-35, Fysiikka III (ES) välikoe Laske ideaalikaasun tilavuuden lämpötilakerroin (/V)(dV/d) p ja isoterminen kokoonpuristuvuus (/V)(dV/dp) ehtävän pisteyttäneen assarin kommentit: Ensimmäisen pisteen sai
Helsingin yliopisto/tampereen yliopisto Henkilötunnus - Molekyylibiotieteet/Bioteknologia Etunimet valintakoe Tehtävä 3 Pisteet / 30
 Helsingin yliopisto/tampereen yliopisto Henkilötunnus - hakukohde Sukunimi Molekyylibiotieteet/Bioteknologia Etunimet valintakoe 20.5.2013 Tehtävä 3 Pisteet / 30 3. Osa I: Stereokemia a) Piirrä kaikki
Helsingin yliopisto/tampereen yliopisto Henkilötunnus - hakukohde Sukunimi Molekyylibiotieteet/Bioteknologia Etunimet valintakoe 20.5.2013 Tehtävä 3 Pisteet / 30 3. Osa I: Stereokemia a) Piirrä kaikki
Puhtaan kaasun fysikaalista tilaa määrittävät seuraavat 4 ominaisuutta, jotka tilanyhtälö sitoo toisiinsa: Paine p
 KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
KEMA221 2009 KERTAUSTA IDEAALIKAASU JA REAALIKAASU ATKINS LUKU 1 1 IDEAALIKAASU Ideaalikaasu Koostuu pistemäisistä hiukkasista Ei vuorovaikutuksia hiukkasten välillä Hiukkasten liike satunnaista Hiukkasten
kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin?
 Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
Esimerkki: Mihin suuntaan etenee reaktio CO (g) + H 2 O (g) CO 2 (g) + H 2 (g), K = 0,64, kun hiilimonoksidia ja vettä oli 0,0200 M kumpaakin ja hiilidioksidia ja vetyä 0,0040 M kumpaakin? 1 Le Châtelier'n
vi) Oheinen käyrä kuvaa reaktiosysteemin energian muutosta reaktion (1) etenemisen funktiona.
 3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
3 Tehtävä 1. (8 p) Seuraavissa valintatehtävissä on esitetty väittämiä, jotka ovat joko oikein tai väärin. Merkitse paikkansapitävät väittämät rastilla ruutuun. Kukin kohta voi sisältää yhden tai useamman
Nimi sosiaaliturvatunnus. Vastaa lyhyesti, selkeällä käsialalla. Vain vastausruudun sisällä olevat tekstit, kuvat jne huomioidaan
 1. a) Mitä tarkoitetaan biopolymeerilla? Mihin kolmeen ryhmään biopolymeerit voidaan jakaa? (1,5 p) Biopolymeerit ovat luonnossa esiintyviä / elävien solujen muodostamia polymeerejä / makromolekyylejä.
1. a) Mitä tarkoitetaan biopolymeerilla? Mihin kolmeen ryhmään biopolymeerit voidaan jakaa? (1,5 p) Biopolymeerit ovat luonnossa esiintyviä / elävien solujen muodostamia polymeerejä / makromolekyylejä.
Luento 4. Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit
 Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2.
Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2. pääsääntö Termodynaamiset potentiaalit Luento 4 Termodynamiikka Termodynaamiset prosessit ja 1. pääsääntö Entropia ja 2.
Kryogeniikan termodynamiikkaa DEE Kryogeniikka Risto Mikkonen 1
 DEE-54030 Kryogeniikka Kryogeniikan termodynamiikkaa 4.3.05 DEE-54030 Kryogeniikka Risto Mikkonen Open ystem vs. Closed ystem Open system Melting Closed system Introduced about 900 Cryocooler Boiling Cold
DEE-54030 Kryogeniikka Kryogeniikan termodynamiikkaa 4.3.05 DEE-54030 Kryogeniikka Risto Mikkonen Open ystem vs. Closed ystem Open system Melting Closed system Introduced about 900 Cryocooler Boiling Cold
"Geenin toiminnan säätely" Moniste sivu 13
 "Geenin toiminnan säätely" Moniste sivu 13 Monisteen alussa on erittäin tärkeitä ohjeita turvallisuudesta Lukekaa sivu 5 huolellisesti ja usein Vaarat vaanivat: Palavia nesteitä ja liekkejä on joskus/usein
"Geenin toiminnan säätely" Moniste sivu 13 Monisteen alussa on erittäin tärkeitä ohjeita turvallisuudesta Lukekaa sivu 5 huolellisesti ja usein Vaarat vaanivat: Palavia nesteitä ja liekkejä on joskus/usein
PHYS-A0120 Termodynamiikka syksy 2017
 PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
PHYS-A0120 Termodynamiikka syksy 2017 Emppu Salonen Prof. Peter Liljeroth Viikko 2: Työ ja termodynamiikan 1. pääsääntö Maanantai 6.11. ja tiistai 7.11. Pohdintaa Mitä tai mikä ominaisuus lämpömittarilla
Teddy 1. välikoe kevät 2008
 Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Teddy 1. välikoe kevät 2008 Vastausaikaa on 2 tuntia. Kokeessa saa käyttää laskinta ja MAOL-taulukoita. Jokaiseen vastauspaperiin nimi ja opiskelijanumero! 1. Ovatko seuraavat väitteet oikein vai väärin?
Diskreetin Matematiikan Paja Tehtäviä viikolle 2. ( ) Jeremias Berg
 Diskreetin Matematiikan Paja Tehtäviä viikolle 2. (24.3-25.3) Jeremias Berg Tämän viikon tehtävien teemoina on tulojoukot, relaatiot sekä kuvaukset. Näistä varsinkin relaatiot ja kuvaukset ovat tärkeitä
Diskreetin Matematiikan Paja Tehtäviä viikolle 2. (24.3-25.3) Jeremias Berg Tämän viikon tehtävien teemoina on tulojoukot, relaatiot sekä kuvaukset. Näistä varsinkin relaatiot ja kuvaukset ovat tärkeitä
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 9 /
 ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 9 / 14.11.2016 v. 03 / T. Paloposki Tämän päivän ohjelma: Vielä vähän entropiasta... Termodynamiikan 2. pääsääntö Entropian rooli 2. pääsäännön yhteydessä
ENY-C2001 Termodynamiikka ja lämmönsiirto Luento 9 / 14.11.2016 v. 03 / T. Paloposki Tämän päivän ohjelma: Vielä vähän entropiasta... Termodynamiikan 2. pääsääntö Entropian rooli 2. pääsäännön yhteydessä
3.3 Paraabeli toisen asteen polynomifunktion kuvaajana. Toisen asteen epäyhtälö
 3.3 Paraabeli toisen asteen polynomifunktion kuvaajana. Toisen asteen epäyhtälö Yhtälön (tai funktion) y = a + b + c, missä a 0, kuvaaja ei ole suora, mutta ei ole yhtälökään ensimmäistä astetta. Funktioiden
3.3 Paraabeli toisen asteen polynomifunktion kuvaajana. Toisen asteen epäyhtälö Yhtälön (tai funktion) y = a + b + c, missä a 0, kuvaaja ei ole suora, mutta ei ole yhtälökään ensimmäistä astetta. Funktioiden
ln2, missä ν = 1mol. ja lopuksi kaasun saama lämpömäärä I pääsäännön perusteella.
 S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
S-114.42, Fysiikka III (S 2. välikoe 4.11.2002 1. Yksi mooli yksiatomista ideaalikaasua on alussa lämpötilassa 0. Kaasu laajenee tilavuudesta 0 tilavuuteen 2 0 a isotermisesti, b isobaarisesti ja c adiabaattisesti.
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I
 Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Kemialliset reaktiot ja reaktorit Prosessi- ja ympäristötekniikan perusta I Juha Ahola juha.ahola@oulu.fi Kemiallinen prosessitekniikka Sellaisten kokonaisprosessien suunnittelu, joissa kemiallinen reaktio
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
P = kv. (a) Kaasun lämpötila saadaan ideaalikaasun tilanyhtälön avulla, PV = nrt
 766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
766328A Termofysiikka Harjoitus no. 2, ratkaisut (syyslukukausi 204). Kun sylinterissä oleva n moolia ideaalikaasua laajenee reversiibelissä prosessissa kolminkertaiseen tilavuuteen 3,lämpötilamuuttuuprosessinaikanasiten,ettäyhtälö
Henkilötunnus - Biokemian/bioteknologian valintakoe. Sukunimi Etunimet Tehtävä 1 Pisteet / 20
 elsingin yliopisto/tampereen yliopisto enkilötunnus - Biokemian/bioteknologian valintakoe Sukunimi 24. 5. 2004 Etunimet Tehtävä 1 Pisteet / 20 Solujen kalvorakenteet rajaavat solut niiden ulkoisesta ympäristöstä
elsingin yliopisto/tampereen yliopisto enkilötunnus - Biokemian/bioteknologian valintakoe Sukunimi 24. 5. 2004 Etunimet Tehtävä 1 Pisteet / 20 Solujen kalvorakenteet rajaavat solut niiden ulkoisesta ympäristöstä
- Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka: kappaleiden liike)
 KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
KEMA221 2009 TERMODYNAMIIKAN 1. PÄÄSÄÄNTÖ ATKINS LUKU 2 1 1. PERUSKÄSITTEITÄ - Termodynamiikka kuvaa energian siirtoa ( dynamiikkaa ) systeemin sisällä tai systeemien kesken (vrt. klassinen dynamiikka:
Työ 3: Veden höyrystymislämmön määritys
 Työ 3: Veden höyrystymislämmön määritys Työryhmä: Tehty (pvm): Hyväksytty (pvm): Hyväksyjä: 1. Tavoitteet Työssä vettä höyrystetään uppokuumentimella ja mitataan jäljellä olevan veden painoa sekä höyrystymiseen
Työ 3: Veden höyrystymislämmön määritys Työryhmä: Tehty (pvm): Hyväksytty (pvm): Hyväksyjä: 1. Tavoitteet Työssä vettä höyrystetään uppokuumentimella ja mitataan jäljellä olevan veden painoa sekä höyrystymiseen
