6.2 Vetymolekyyli-ioni Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 238
|
|
|
- Simo Kähkönen
- 7 vuotta sitten
- Katselukertoja:
Transkriptio
1 MOLEKYYLIT 6.1 Johdanto 7 6. Vetymolekyyli-ioni Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit Muutamien kaksiatomisten molekyylien elektronikonfiguraatio Moniatomiset molekyylit Orgaaniset ketjumolekyylit Molekyylien pyörimisliike Molekyylien värähtelyliike Elektroniset siirtymät molekyyleissä 70
2
3 Molekyylit 6.1 Johdanto Tutkimalla atomien välisten elektronisidosten muodostumista voimme ymmärtää molekyylien ja kiteiden ominaisuudet. Mikä sitoo toisiinsa vesimolekyylin kaksi vetyatomia ja yhden happiatomin? Miksi hiilidioksidimolekyyli CO on lineaarinen kun taas vesimolekyyli HO on V-kirjaimen muotoinen ja ammoniakki NH 3 on pyramidin muotoinen? Näihin kysymyksiin voidaan vastata analysoimalla atomien ja molekyylien elektronirakennetta kvanttimekaniikan lakien avulla. Molekyyleissä atomien väliset sidokset muodostuvat siten, että atomien uloimpien elektronien aaltofunktiot (spinorbitaalit) muuttavat muotoaan. Elektronit voivat saavuttaa uudelleenjärjestäytymisellä alemman energian kuin säilyttämällä alkuperäisen muotonsa erityisesti, jos atomien ytimet ovat sopivalla etäisyydellä toisistaan. Stabiilin molekyylin muodostumisen keskeinen lähtökohta on siis kvanttimekaaninen energiaminimiperiaate. Se energia, jonka molekyyliin kuuluvien atomien uloimmat elektronit säästävät niiden aaltofunktioiden muuttuessa atomien välistä sidosta suosivaksi, on tuotava takaisin, jos molekyyli halutaan hajottaa erillisiksi neutraaleiksi atomeiksi. Tämän energian suuruus määrää sen, kuinka stabiili molekyyli on. Voimme helposti erottaa ainakin kolme eri tapaa, jolla elektronitilat voivat muuttua kemiallisen sidoksen muodostuessa. 1. Ionisidoksessa jokin molekyyliin kuuluva atomi luovuttaa yhden tai useamman elektronin toiselle molekyylissä olevalle atomille osittain tai kokonaan. Tällöin molekyyli koostuu esimerkiksi positiivisesta ja negatiivisesta ionista ja sitä pitää kasassa ionien sähköstaattinen vetovoima.. Toinen yleinen kemiallisen sidoksen muoto perustuu uloimpien elektronien aaltofunktioiden muuttumiseen siten, että näihin aaltofunktioihin liittyvä todennäköisyystiheys saa suuren arvon atomien ydinten väli-
4 8 6. Vetymolekyyli-ioni sessä alueessa. Voimme ajatella ytimien yhteisillä orbitaaleilla olevien elektronien muodostavan negatiivisesti varatun liiman, jolla positiiviset ytimet sidotaan toisiinsa. Tällaista sidosta sanotaan kovalenttiseksi. 3. Kolmas kemiallinen sidostyyppi perustuu yksittäisten atomien uloimpien elektroniorbitaalien uudelleenjärjestäytymiseen siten, että niistä muodostuu sähködipoleja. Näin muodostuneet sähködipolit voivat vuorovaikuttaa keskenään ns. van der Waals voimien välityksellä. Sidoksia kutsutaan van der Waalsin sidoksiksi. Yleensä tähän vuorovaikutukseen perustuvat kemialliset sidokset ovat kohtalaisen heikkoja. 6. Vetymolekyyli-ioni Yksinkertaisin mahdollinen molekyyli on H + ioni (Kuva 6-1). Se koostuu kahdesta protonista, jotka jakavat yhden elektronin. Tämän molekyylin muodostumista kuvaa reaktio + + H + H H, missä H + tarkoittaa vetyatomia, joka on menettänyt yhden elektronin, eli protonia. Vetymolekyyli-ioni muodostuu siten, että neutraali vetyatomi kaappaa yhden ylimääräisen protonin. Sen jälkeen kun sidos on muodostunut, molekyylin ainoa elektroni liikkuu molempien protonien kentässä samalla a priori todennäköisyydellä. Elektroni ei muista kumpaan protoniin se oli alunperin sidottuna, kun molekyyli muodostui. Tämä käy selvästi ilmi ns. varauksen vaihtotörmäyksessä ks. kuva 6-. Oletetaan, että elektroni on alun- Kuva 6-1 Vetymolekyyli-ioni H +. Kuva 6- (a) ja (b) Vetyatomin H ja vetyionin H + törmäys. Lähialueen kuvaus: (c) elastinen törmäys (d) varauksenvaihtotörmäys. Liittyy myös esimerkkiin 6.1.
5 Molekyylit 9 perin kiinni protonissa p 1 ja protoni p lähestyy vetyatomia oikealta (kuva 6-a). Kun protonit ovat lähellä toisiaan, elektroni näkee lyhyen aikaa molempien protonien muodostaman yhteisen sähkökentän (kuva6-b). Tämän jälkeen systeemi hajoaa jälleen, protonit jatkavat matkaansa ja niiden välinen etäisyys kasvaa (kuva 6-c,d). Todennäköisyys sille, että tuleva protoni p kaappaa törmäyksen kuluessa alunperin protoniin p 1 kuuluneen elektronin itselleen voidaan havaita kokeellisesti. Reaktioyhtälö voidaan esittää muodossa ( ) ( ) + + +! H + H elastinen törmäys H + H H. " + H + H varauksenvaihto-törmäys Näiden kahden reaktion todennäköisyys voidaan myös laskea kvanttimekaanisen mallin avulla törmäävän protonin energian funktiona ja laskettu arvo on hyvässä sopusoinnussa kokeellisten mittaustulosten kanssa, ks. esimerkki 6.1. Tarkastellaan seuraavaksi lähemmin vetymolekyyli-ionin energiatasoja. Kirjoitamme aluksi elektronin ja protonien yhteisen sähköstaattisen potentiaalienergian muodossa E p e = + 4πε0 r1 r r. (6.1) Kaksi ensimmäistä termiä kuvaavat elektronin attraktiivista potentiaalienergiaa protonien kanssa, kun taas Kuva 6-3 Elektronien potentiaalienergia + vetymolekyyli-ionin H protoneja p 1 ja kolmas termi kuvaa protonien väliseen hylkivään voimaan liittyvää p yhdistävällä akselilla. potentiaalienergiaa. Kuvassa 6-3 on esitetty elektronin potentiaalienergia protonien yhdysjanalla. Tämä osuus potentiaalienergiasta sisältyy yhtälön 6.1 kahteen ensimmäiseen termiin. Vetymolekyyli-ioni on yksi niistä harvoista potentiaaleista, joita vastaava Schrödingerin yhtälö voidaan ratkaista analyyttisesti. Ratkaisu on kuitenkin yksityiskohdiltaan mutkikas ja esitämme ainoastaan lyhyen kvalitatiivisen päättelyn ratkaisun tärkeim-
6 30 6. Vetymolekyyli-ioni mästä ominaisuudesta. Tarkastellaan aluksi tilannetta, jossa protonit ovat kohtalaisen suurella etäisyydellä toisistaan. Tällöin elektroni viettää suurimman osan ajastaan jommankumman protonin läheisyydessä (Kuva 6-4a-b). Jos elektroni on protonin p 1 läheisyydessä, sitä kuvaava aaltofunktio keskittyy tämän protonin ympäristöön (Kuva 6-4a). Vastaavasti, jos elektroni on protonin p läheisyydessä, on aaltofunktio kuvan 6-4b kaltainen. Kun protonit lähestyvät toisiaan, alkaa elektroni vähitellen tuntea myös toisen protonin Coulombin kentän vaikutuksen. Kuva 6-4 Vetymolekyyli-ionin parilliset ja parittomat orbitaalit. Koska potentiaalienergia 6.1 on symmetrinen protonien yhdysjanan keskipisteen suhteen, täytyy todennäköisyystiheydellä olla systeemin Hamilton operaattorin symmetria. Aaltofunktiolla voi siis olla joko parillinen tai pariton symmetriakeskuksen O suhteen. Jos aaltofunktio on parillinen, sitä esittää kuva 6-4c. Parillisessa tilassa elektronilla on huomattavan suuri todennäköisyys sijaita protonien välisellä alueella, myös pisteen O läheisyydessä. Vastaavasti parittomassa tilassa (kuva 6-4d) elektronin todennäköisyystiheys pisteen O ympäristössä on nolla ja yleensäkin elektronin todennäköisyystiheys ytimien välisessä alueessa on paljon pienempi kuin parillisessa tilassa. Molekyylin muodostuminen perustuu kokonaisenergian, ts. elektronin stationäärisen tilan ja protonien hylkimisenergian summan minimoimiseen. Siksi parillinen tila on kokonaisenergian minimoimisen kannalta ratkaisevasti edullisempi kuin pariton tila. Parillisen tilan etu on siinä, että elektroni sijaitsee suurella todennäköisyydellä protonien välisessä tilassa pienentäen niiden keskinäistä hylkivää voimaa. Parillisen ja parittoman elektronitilan aaltofunktion tarkempaan laskemiseen voidaan käyttää atomiorbitaalien yhdistämismenetelmää, joka englan-
7 Molekyylit 31 ninkielisen lyhennyksensä mukaisesti kulkee nimellä LCAO-menetelmä (linear combination of atomic orbitals). LCAO-menetelmän perusajatuksena on, että elektronin aaltofunktio esitetään yksittäisiin (tarkasteltavana olevaan molekyyliin kuuluvien) atomeihin liittyvien spinorbitaalien lineaarikombinaationa. Näitä yksittäisiä atomeihin sidottuja orbitaaleja edustavat aaltofunktiot ψ 1(1 s) ja ψ (1 s) kuvassa 6-4. Kutsumme näitä spinorbitaaleja seuraavassa atomiorbitaaleiksi korostaaksemme niiden kuuluvan johonkin yksittäiseen atomiin molekyylissä. Protonien lähestyessä nämä atomiorbitaalit eivät alimmassa kertaluvussa muutu lainkaan, vaan elektroni siirtyy ominaistilaan, joka on näiden kahden atomiorbitaalin lineaarikombinaatio; summa tai erotus riippuen siitä, onko elektronin ominaistila parillinen vai pariton, protonien yhdysjanan keskipisteen suhteen. Tällaista protoneihin p 1 ja p liittyvien orbitaalien summaa edustavat parilliset ja parittomat lineaarikombinaatiot ( ) = ( - ) ± ( - ) ψ ψ ψ parillinen r 1(1 s) r R1 (1 s) r R, (6.) pariton Yhden elektronin aaltofunktioita yhtälössä 6. kutsutaan molekyyliorbitaaleiksi. Merkinnällä ψ1(1 s) ( r - R1 ) tarkoitetaan sitä, että vedyn 1s-orbitaalin arvo mielivaltaisessa pisteessä r lasketaan olettamalla orbitaalin keskittyvän pisteeseen R 1, jossa protoni p 1 sijaitsee. Vastaavasti, kun laskemme aaltofunktion ψ (1 s) ( r - R ) arvoa on etäisyys ilmoitettava ytimen p suhteen. Koska LCAO-orbitaaleilla 6. on määrätty pariteetti, on tullut tavaksi merkitä näitä kahta 1s-orbitaalien lineaarikombinaatioina saatavaa molekyyliorbitaalia kirjaimilla σ g1s Kuva 6-5 Todennäköisyystiheys parillisissa ja (parillinen tila) ja σ u1s (pariton parittomissa vetymolekyyli-ionin orbitaaleissa tila). Alaindeksit g ja u tulevat saksankielen sanoista gerade (parillinen) ja ungerade (pariton). Katsotaan vielä lähemmin näihin tiloihin liittyvää todennäköisyystiheyttä, joka esitetty kuvassa 6-5a. Ytimien välisellä
8 3 6. Vetymolekyyli-ioni alueella parillisen tilan todennäköisyystiheys on paljon suurempi kuin parittomalle tilalle. Usein parittomat tilat eivät voi johtaa stabiilin molekyylin muodostumiseen. Esimerkiksi vetymolekyyli-ionin tapauksessa vain parillinen tila johtaa stabiilin molekyylin muodostumiseen. Tarkastellaan vielä elektronin stationäärisen tilan ominaisenergian ja protonien välisen potentiaalienergian summan (kutsumme tätä kokonaisenergiaksi) käyttäytymistä protonien välisen etäisyyden funktiona. Kun protoneja tuodaan suurelta etäisyydeltä lähemmäksi toisinaan, elektronin negatiivinen ominaisenergia on aluksi itseisarvoltaan suurempi kuin ytimien välinen hylkivä potentiaalienergia, jos elektroni on parillisessa tilassa. Näin kokonaisenergia aluksi pienenee ytimien välisen etäisyyden pienentyessä. Kun protonien välinen etäisyys pienenee tietyn arvon r 0 alapuolelle, alkaa protonien välinen hylkivä potentiaalienergia dominoida parillisen tilan kokonaisenergiaa. Tämä johtaa lopulta kokonaisenergian jyrkkään kasvuun protonien välisen etäisyyden edelleen pienentyessä. Ero parittomaan tilaan on siinä, että parittoman tilan kokonaisenergia kasvaa monotonisesti Kuva H ionin kokonaisenergia protonien etäisyyden r pienentyessä, etäisyyden funktiona. kun taas parilliselle tilalle saadaan kokonaisenergian minimi, kuva 6-6. Etäisyys r 0 on protonien + tasapainoetäisyys stabiilissa H -molekyylissä. Koska parillinen aaltofunktio muodostaa stabiilin molekyylin, sitä kutsutaan myöskin sitovaksi molekyyliorbitaaliksi. Vastaavasti pariton tila ei voi muodostaa sidottua molekyyliä ja sitä kutsutaan hylkiväksi molekyyliorbitaaliksi. Tätä korostetaan laittamalla tähti vastaavan orbitaalin tunnukseen eli esimerkiksiσ u * 1s. Tasapainoetäisyys vetymolekyyli-ionille on parillisessa tilassa 10 1,06 10 m ja tätä etäisyyttä vastaava kokonaisenergia on,648ev verrattuna systeemiin, jossa elektroni on sidottuna toiseen protoniin ja toinen protoneista on viety äärettömän kauas ensin mainitusta vetyatomista.
9 Molekyylit 33 Tällä samalla etäisyydellä parittoman hylkivän tilan kokonaisenergia on + 10, ev. Kuva H -ionin potentiaalienergiat perustilalle ja muutamalle viritetylle tilalle. Edellä olemme tarkastelleet ainoastaan vetymolekyyli-ionin perustilaa. Useilla molekyyleillä on myös sellaisia viritettyjä elektronitiloja, joihin liittyy kokonaisenergian paikallinen minimi. Yleensä tämän energiaminimin syvyys on hyvin pieni. Siksi viritetyt tilat ovat usein metastabiileja, millä tarkoitetaan lyhyesti sitä, että molekyyli voi pysyä kasassa (äärellisen ajan) silloinkin kun yksi elektroni on viritetty jollekin korkeammalle molekyyliorbitaalille. Kuvasta 6-Kuva 6-7 huomataan, että elektronin ollessa viritetyssä tilassa kokonaisenergian minimi saavutetaan huomattavasti suuremmalla protonien välisen etäisyyden arvolla kuin perustilassa. Kuva 6-8 Elektroninkaappaustodennäköisyys varauksenvaihtotörmäyksessä saapuvan protonin nopeuden Esimerkki 6.1. Varauksenvaih- + + totörmäys H + H H + H. funktiona. Tarkastellaan nopeiden protoneiden eli vetyionien muodostamaa suihkua, joka läpäisee neutraaleista vetyatomeista koostuvan kaasun. Sironneet protonit havaitaan tietyssä kiinteässä kulmassa alkuperäiseen suuntaan nähden. Törmäyksen kuluessa jotkut ammuksena käytetyistä protoneista nappaavat elektronin joltakin kaasuun kuuluvalta vetyatomilta. Kun todennäköisyys elektroninvaihdolle esitetään törmäävien protoneiden energian funktiona, saadaan-kuva 6-8 esittämä tulos. Siinä havaitaan elektronikaappauksen maksimeja tietyillä energioilla. Kuva 6-8 kokeellinen tulos perustuu Lockwoodin ja Everhartin mittauksiin. Elektronikaappaustodennäköisyys on esitetty protonin nopeuden käänteisarvon funktiona. Kuvaan on myös merkitty kaappaustodennäköisyyden mi-
10 34 6. Vetymolekyyli-ioni nimejä ja maksimeja vastaavat protonien liike-energiat. Huomaamme, että maksimit esiintyvät säännöllisin välein kun ne esitetään suuren 1 v funktiona. Koetulokselle voidaan esittää yksinkertainen kvanttimekaniikkaan perustuva selitys. Alunperin protoni on hyvin kaukana vetyatomista, jolloin elektronin aaltofunktio on likimain kaasuun kuuluvan vetyatomin 1s tilaa vastaava aaltofunktio. Tätä vastaava tilanne on esitetty kuvassa 6-4a. Voimme siis kirjoittaa ( t 0 1 ) 1 ( parillinen pariton ) ψ ψ ψ ψ = = +. Tässä esiintyvät parilliset ja parittomat tilat on määritelty yhtälössä 6.. Kun protoni lähestyy vetyatomia, aaltofunktiosta tulee aikariippuva. Tämä johtuu siitä, että elektronin tuntiessa lähestyvän protonin Coulombin kentän sen aaltofunktioon alkaa tulla yhä enemmän sekoittumista törmäävän protonin 1s-aaltofunktiosta, jolla ei ole alunperin elektronia. Aikariippuvan Schrödingerin yhtälön 3.1 perusteella voimme esittää aikariippuvan aaltofunktion ei-stationäärisenä tilana 1 iet ie ' t () t ( parillinene # # = + paritone ) ψ ψ ψ 1 i Et ( ψparillinen ψparitone ) = + # iet e #, missä E = E' E on parillisen ja parittoman tilan, eli tilojen σ g 1s ja energioiden erotus. Ajanhetkellä t = π# E aaltofunktio on σ u * 1s, 1 ( ) ( ) iet iet t E parillinen pariton e # # = # = e. ψ π ψ ψ ψ Elektroni on hypännyt alkuperäiseltä kaasuun kuuluvalta vetyatomilta törmäävälle protonille, samalla kun alkuperäisen kaasuatomin protoni on jäänyt vaille elektronia. Kun aikaa on kulunut kaksi kertaa tämän verran, eli t = π# E, elektroni on siirtynyt takaisin alkuperäiselle protonille ja sen aaltofunktiota dominoi jälleen atomiorbtiaali ψ 1. Tämän voi havaita sijoittamalla edellä olevaan aikariippuvan aaltofunktion lausekkeeseen ajan arvoksi t = π# E. Päättelemme, että protonin p liikkuessa lähellä kaasuatomin protonia p 1 alunperin jälkimmäiseen kuulunut elektroni siirtyy edestakaisin protonilta toiselle periodin ollessa P = π# E = h E. Jotta elektronikaappaus voisi tapahtua täytyy, törmäävän protonin p poistua kaasuatomin p 1 läheisyydestä sellaisella hetkellä, jolloin elektroni on
11 Molekyylit 35 lähellä ammusprotonia p. Rutherfordin sironnan tuloksista (Luku 4) tiedämme, että protonien (protoni, kuten alfa-hiukkanenkin, on paljon raskaampi kuin elektroni) sironta tapahtuu atomien ytimistä, kun taas elektronien merkitys sirottajana on vähäinen. Siksi protonin p täytyy tulla hyvin lähelle vetyatomin ydintä p 1 sirotakseen siitä voimakkaasti. Elektronin aaltofunktion muutos tapahtuu protonin p ollessa alueella, jonka pituus olkoon a. Jos protonin nopeus on v, vuorovaikutusaika ytimen p 1 kanssa voidaan laskea yhtälöstä τ = a v. Oletamme, että maksimikaappaustodennäköisyys saavutetaan nopeuden arvolla v. Aika, jonka protoni p vuorovaikuttaa ytimen p 1 kanssa, on tällöin τ 1 = a v1. Seuraava kaappauksen maksimitodennäköisyys vastaa sellaista törmäykseen kuuluvaa aikaa, joka on yhtä aiemmin johtamaamme elektronin edestakaista värähdysjaksoa suurempi eli τ = τ1 + P. Tässä P on aika, jonka elektroni tarvitsee käydäkseen kerran kaasuatomin protonin läheisyydessä ja palatakseen takaisin siroavan protonin läheisyyteen. Ratkaisemalla P = τ τ1 voimme kirjoittaa h 1 1 P = = a. E v v1 Erotuksen ( 1 v 1 v ) 1 peräkkäisten kaappaustodennäköisyyksien maksimien välillä täytyy olla vakio. Tämän suureen keskiarvoksi on mitattu kokeellisesti 7-1 6,6 10 m s, josta saamme edelleen a E mj 6,3 10 m ev. Suureen E (joka on siis energiaerotus tilojen σ * 1s ja σ 1s energioiden välillä) arvo ei ole kiinteä vaan se riippuu protonien välisestä etäisyydestä. Vastaavasti suuretta a ei voida määrätä tarkasti. Jos valitsemme E keskiarvoksi 10 ev, joka on järkevä suuruusluokka-arvio kuvan 6-6 perusteella, saamme a = 6 10 m. Tämä on noin kuusi kertaa molekyylin hal- 10 kaisija ja uskottavaa suuruusluokkaa protonien välisen voimakkaan vuorovaikutuksen alueen ulottuvuudelle. Varauksenvaihtotörmäystä voidaan analysoida myös numeerisin menetelmin ratkaisemalla aikariippuvaa Schrödingerin yhtälöä protonien välisen etäisyyden funktiona. Tästä tarkemmasta laskusta saatava tulos on hyvässä sopusoinnussa kokeellisen tuloksen ja ylläolevan kvalitatiivisen päättelyn kanssa. u g
12 36 6. Vetymolekyyli-ioni Esimerkki 6.. Likiarvon laskeminen vetymolekyyli-ionin perustilan energialle käyttämällä LCAO-aaltofunktioita. Hamiltonin operaattori protonien kentässä liikkuvalle elektronille ja protonien potentiaalienergialle on ˆ # e H = + + m 4πε0 r1 r r, (6.3) missä ensimmäinen termi on liike-energiaoperaattori. Seuraavat kaksi termiä sulkulausekkeessa ovat elektronin potentiaalienergia ytimen kanssa ja viimeinen termi kuvaa protonien välisestä hylkivästä voimasta aiheutuva potentiaalienergiaa. Merkitsemme parillista ja paritonta molekyyliorbitaalia ψparillinen = ψ1 + ψ ja ψpariton = ψ1 ψ vastaavasti ja laskemme Hamilton operaattorin odotusarvon kuten yhtälössä 3.58 E = * ψ Ĥψdτ. (6.4) * ψψdτ Oletamme, että molemmat aaltofunktiot ψ 1 ja ψ viittaavat vetyatomin elektronin perustilan energiaan, jota merkitsemme suureella E a. Tiedämme, että ψ 1 ja ψ ovat reaalisia, sillä kyseessä on vetyatomin 1s-orbitaali. Sijoittamalla parillisen ja parittoman tilan odotusarvon 6.4 lausekkeeseen saamme e A± B E = Ea +, (6.5) 4πε r 1± S 0 missä positiivinen etumerkki viittaa parilliseen aaltofunktioon negatiivinen merkki parittomaan aaltofunktion ψ parillinen ja ψ pariton. Tässä yhtälössä olemme merkinneet S = ψψ 1 dτ. Kutsumme tätä peittointegraaliksi, koska sen arvo riippuu siitä, kuinka paljon orbitaalit ψ 1 ja ψ, jotka ovat eri protoneihin kuuluvia 1s-orbitaaleja, peittävät toisiaan. Peittointegraali on ytimien välisen etäisyyden funktio ja peittointegraali kasvaa kun ytimien välinen etäisyys pienenee ja päin vastoin. Yhtälössä 6.5 integraalit A ja B ovat ja ψ1 e ψ e A= dτ dτ 4πε = r 4πε r 0 0 1
13 Molekyylit 37 ψψ 1 e ψψ 1 e B = dτ = dτ 4πε r 4πε r parillinen Myös suureet A ja B riippuvat ytimien välisestä etäisyydestä. Jos piirrämme energian odotusarvon E ytimien välisen etäisyyden r funktiona, saamme kuvaajat, jotka ovat hyvin samanlaisia kuin kuvassa 6-6 esitetyt kokonaisenergian kuvaajat. Kahdesta ominaisenergiasta parillinen tila ψ liittyy alempaan energiaan. Yhtälössä 6.5 ensimmäinen termi viittaa neutraalin vetyatomin protoniin sidotun elektronin sidosenergiaan. Seuraava termi on protonien välinen hylkivä energia. Suure A on attraktiivinen energia elektronin ja toisen protonin välillä ja suureet B ja S liittyvät puhtaasti kvanttimekaanisiin efekteihin. Suure B on huomattava vain, jos ψ 1 ja ψ peittävät toisensa oleellisesti. Jos näiden aaltofunktioiden peittointegraali on pieni, sekä B että S ovat hyvin pieniä ja voimme kirjoittaa energian muodossa E = E + e 4πε A. Jos esitämme tämän lausekkeen arvon ytimien välisen a 0 etäisyyden r funktiona, sillä ei ole minimiarvoa vaan energia kasvaa monotonisesti etäisyyden pienentyessä. Näin ollen aaltofunktioiden välinen peittointegraali on keskeisessä asemassa stabiilin molekyylin muodostumisessa.
14 Kaksiatomiset molekyylit 6.3 Kaksiatomiset molekyylit Vetymolekyyli-ionin jälkeen yksinkertaisin mahdollinen molekyyli on neutraali vetymolekyyli H. Tämän molekyylin ominaisuuksia voidaan tarkastella paljolti samaan tapaan kuin vetymolekyyli-ionin. Ensimmäinen tärkeä ero ioniin verrattuna liittyy Paulin kieltosääntöön; molemmat elektronit eivät voi olla samalla spinorbitaalilla. Perustilassa elektroneilla on sama molekyyliorbitaalin avaruusosa. Tällöin niiden spinfunktion on oltava antisymmetrinen (vrt. heliumin perustila), Kuva 6-9 (a) Elektroniin kohdistuva voima joten spinit ovat vastak- kaksiatomisessa molekyylissä. Vastaava poten- kaiset, ja perustilassa vetymolekyylin tiaalienergia on aksiaalisymmetrinen. (b) Aksiaalisymmetrisessä kokonaisspin on nolla. Tar- z on liikevakio. potentiaalissa vain L kastelemme aluksi elektronien rataliikkeen ominaisuuksia. Kaksiatomisessa molekyylissä elektroniin kohdistuva voima on sylinterisymmetrinen, ts. se osoittaa aina kohden z-akselia. Tällöin vääntömomentin z-komponentti τ = ( r F ) = 0 molekyylin akselilla sijaitsevan pisteen O suhteen. Klassisen mekaniikan mukaan dl / dt = τ, joten kulmaliikemäärän z-komponentti on liikevakio (kuva 6- z z Kuva 6-9). z z Kuten aiemmin olemme oppineet, voimme kirjoittaa kulmaliikemäärän z- komponentin mahdolliset arvot muodossa L z = m l #, missä m l = 0, ± 1, ±,.... Magneettisen kvanttiluvun m l etumerkki määrää kiertoliikkeen suunnan z- akselin suhteen. Koska potentiaali on akselisymmetrinen, kiertosuunta ei voi vaikuttaa elektronin energiaan. Sylinterisymmetrisessä potentiaalikentässä elektronin energia voi riippua vain magneettisen kvanttiluvun itseisarvosta ja merkitsemme λ = m. Käytämme eri kulmaliikemäärän komponenttien arvoihin liittyville ominaistiloille merkintöjä: l
15 Molekyylit 39 Kuva 6-10 Samanytimisen kaksiatomisen molekyylin orbitaaleja. (a) s-atomiorbitaaleista muodostuvat molekyyliorbitaalit, (b) pz -atomiorbitaaleista muodostuvat molekyyliorbitaalit, (c) p x ja p -atomiorbitaaleista muodostuvat molekyyliorbitaalit. y elektroniin kohdistuva vääntömomentti pisteen O suhteen, joka sijaitsee
16 Kaksiatomiset molekyylit m l : 0 ± 1 ± ±3... λ : Symboli: σ π δ φ... σ -tiloja lukuun ottamatta kaikki elektronitilat ovat kahdesti degeneroituneita, sillä molemmat magneettisen kvanttiluvun etumerkit antavat saman energian. Lisäksi kaikissa tiloissa voi elektroneilla olla spin ylös tai spin alas. Sigmaorbitaalille voidaan siis sijoittaa kaksi elektronia, toisen spin ylös-tilaan ja toisen spin alas-tilaan. Vastaavasti kaikille muille orbitaaleille mahtuu yleensä yhteensä neljä elektronia. Molekyyliorbitaaleille käytämme merkintää λ nl, missä λ = σ, π, δ viittaa kulmaliikemäärän magneettisen kvanttiluvun itseisarvoon ja nl osoittaa, mistä atomiorbitaaleista kyseinen molekyyliorbitaali on ensisijaisesti muodostettu. Kullakin molekyyliorbitaalilla on eri energia. Jos kaksiatominen molekyyli + koostuu kahdesta saman alkuaineen atomista, kuten H ja H, puhumme homonuklearisista, samanytimisistä, molekyyleistä. Tällöin elektronin näkemällä potentiaalilla on symmetriakeskus ytimien yhdysjanan keskipisteessä ja elektronin aaltofunktiolla on hyvin määritelty pariteetti. Keskuksen suhteen symmetrisissä asemissa olevissa pisteissä aaltofunktio saa joko saman arvon tai vastakkaisen arvon. Tästä syystä voimme käyttää samanytimisille kaksiatomisille molekyyleille orbitaalin alaindeksinä määreitä parillinen ja pariton. Näin ollen samanytimisten kaksiatomisten molekyylien orbitaaleja merkitäänkin σ g, σ u, π g, π u, jne. Kuva 6-11 Energiatasot samanytimisessä kaksiatomisessa molekyylissä. Voidaksemme ymmärtää kemiallisen sidoksen muodostumista molekyyleissä meidän on tarkasteltava lähemmin erillisten atomien elektroniorbitaalien kulmajakaumia. Tähän olemme jo perehtyneet orbitaalien σ g1s ja σ u 1s osalta vetymolekyyli-ionissa kuvassa 6-5. Kaksi saman alkuaineen atomia on aluksi suurella etäisyydellä toisistaan. Seuraavaksi on pääteltävä kuinka vastaavat orbitaalit ψ 1 ja ψ yhdistyvät kun atomit lähestyvät toisiaan ja molekyyliorbitaalit muodostuvat. Kuva 6-10 esittää muutamia
17 Molekyylit 41 molekyyliorbitaaleja, jotka muodostuvat erillisten atomien orbitaalien lineaarikombinaationa atomien ytimien lähestyessä toisiaan. Näissä kuvissa on esitetty orbitaalien kulmajakauman tai oikeammin elektronien todennäköisyystiheyden eli orbitaalin itseisarvon neliön tasa-arvopinta. Kuvassa 6-10a kaksi s-symmetristä atomiorbitaalia lähestyy toisiaan. Muodostuvat molekyyliorbitaalit saadaan yhdistämällä näihin s-orbitaaleihin liittyvät aaltofunktiot ψ 1 ja ψ joko parillisessa tai parittomassa muodossa eli ψ1 ± ψ vastaavasti. Näin muodostuvat jo aiemmin mainitut σ g - ja σ u -tilat. Kuva 6-10b esittää molekyyliorbitaalin muodostumista kahden pz -atomiorbitaalin lineaarikombinaationa ytimien lähestyessä toisiaan ja kuva 6-10c lineaarikombinaation muodostumista p - ja p -atomiorbitaaleille. Kaikissa tapauksissa myös atomiorbitaalin radiaaliosa vaikuttaa siihen, kuinka molekyyliorbitaalin elektronitiheys, tai todennäköisyystiheys, jakaantuu ytimien ympäristöön. Esimerkiksi σ -tilojen ollessa kyseessä atomien 1s-, s-, jne. orbitaalien erilainen aaltofunktion radiaaliosa vaikuttaa siihen minkälaiseksi molekyyliorbitaalien todennäköisyystiheys muodostuu ytimien ympäristössä. Yleisesti ne molekyyliorbitaalit, joilla nooditaso leikkaa kohtisuorasti ytimien yhdysjanan ovat hylkiviä orbitaaleja, kun taas muut ovat sitovia orbitaaleja. Nooditasolla tarkoitetaan tasoa jolla aaltofunktio saa arvon nolla. Kaksiatomisissa molekyyleissä muodostuvien molekyyliorbitaalien energioiden järjestys on esitetty skemaattisesti kuvassa Todellisuudessa orbitaalien tarkka järjestys ja energiaerot vaihtelevat molekyylistä toiseen ja lisäksi kussakin molekyylissä ne riippuvat ytimien välisestä etäisyydestä. g x y
18 4 6.4 Kaksiatomisten molekyylien elektronikonfiguraatioita 6.4 Kaksiatomisten molekyylien elektronikonfiguraatioita Tarkastelemme seuraavaksi muutamia yksikertaisia samanytimisiä kaksiatomisia molekyylejä. Olemme tarkastelleet yksinkertaisinta tapausta eli vetymolekyyli-ionia H ja tiedämme, että sen + perustilassa elektroni on σ1s -orbitaalilla. Seuraavaksi tarkastelemme neutraalia vetymolekyyliä H (Kuva 6-11) Vetymolekyylissä on kaksi elektronia ja kaksi protonia. Voimme analysoida vetymolekyyliä kohtalaisen yksityiskohtaisesti ilman, että ratkaisemme likimää- Kuva 6-1 H molekyyli räisesti numeerisesti molekyylin Schrödingerin yhtälön. Kokonaispotentiaalienergia voidaan esittää muodossa E p e = + +. (6.6) 4πε0 r1 r1 r r r1 r Ensimmäiset kaksi termiä koostuvat elektronin e 1 vuorovaikutuksesta protonien p 1 ja p kanssa, kolmas ja neljäs termi liittyvät elektronin e vuorovaikutukseen protonien p 1 ja p kanssa, viides termi kuvaa elektronien välistä hylkivää voimaa ja kuudes termi protonien välistä hylkivää voimaa. Elektronit ovat identtisiä hiukkasia, joten elektronin e 1 ei kuulu erityisesti protoniin p 1 tai elektroni e protoniin p. Vetymolekyylin elektronit sisältävä Hamiltoni sisältää molempien elektronien kineettisen energian lisäksi potentiaalienergian 6.6, mistä on kuitenkin vähennettävä protonien keskinäinen potentiaalienergia. Elektronien Schrödingerin yhtälön ratkaisu johtaa numeerisiin laskutoimituksiin ja tästä syystä tyydymme seuraavassa kvalitatiiviseen tarkasteluun, jossa hyödynnämme vetymolekyyli-ionin elektronirakenteen perusominaisuuksia. Oletamme, että vetymolekyylin H molemmat elektronit sijaitsevat σ g1s -orbitaalilla ja että
19 Molekyylit 43 niiden spinit ovat vastakkaiset. Saamme elektronikonfiguraatioksi ( σ ) g 1s. Molemmat elektronit ovat sitovalla orbitaalilla ja tuloksena on hyvin stabiili molekyyli. Vetymolekyylin H energia on esitetty ytimien välisen etäisyyden funktion kuvassa Kokonaisenergia on annettu perustilaa vastaavalle parilliselle konfiguraatiolle ja lisäksi konfiguraatiolle, jossa toinen elektroneista on viritetty hylkivälle parittomalle σ u * 1s -orbitaalille samalla kääntäen viimeksi mainitun elektronin spin yhdensuuntaiseksi toisen elektronin kanssa. Näin saadaan hylkivä monielektronitila. Vaikka toinen elektroneista on yhä sitovalla orbitaalilla, hylkivä orbitaali dominoi kokonaisenergiaa. + Seuraavaksi tarkastelemme heliummolekyyli-ionia He jossa on kolme elektronia. Voimme ajatella tämän molekyylin muodostuvat siten, että neutraalia heliumatomia He lähestyy positiivinen heliumioni He +, joka on menettänyt yhden elektronin. Molekyylin muodostuessa kaksi elektroneista voidaan sijoittaa sitovalle σ g1s -orbitaalille, kun sen sijaan kolmas elektroni joudutaan sijoittamaan hylkivälle σ u * 1s -orbitaalille. Tämän molekyylin elektronikonfiguraatio on * σg1s σ u1s. Vaikka joudumme siis ( ) ( ) sijoittamaan yhden elektroneista hylkivälle orbitaalille, saamme yhä stabiilin molekyylin, jonka dissosiaatioenergia on,5 ev. Kolmen elektronin molekyylien ryhmään kuuluu vielä - negatiivinen vetymolekyyli-ioni H. Kuva 6-13 Vetymolekyylin ydinten välinen potentiaalienergia sitovassa ja hylkivässä tilassa. Se on molekyyli, joka muodostuu neutraalista vetymolekyylistä kun se sitoo yhden ylimääräisen elektronin. Tämän molekyylin sidosenergia on kuitenkin hyvin pieni ja elinaika hyvin lyhyt. Neutraalilla He -molekyylillä on neljä elektronia, joista kaksi on sijoitettu sitovalle σ g1s -orbitaa-
20 Kaksiatomisten molekyylien elektronikonfiguraatioita lille ja kaksi hylkivälle * ( 1s) ( 1s) g u σ u * 1s -orbitaalille. Konfiguraatio on siis σ σ. Jälleen hylkivät orbitaalit dominoivat, eikä stabiilia molekyyliä voi muodostua. Tämä selittää, miksi helium esiintyy normaaliolosuhteissa yksiatomisena kaasuna. Taulukossa 6-1 on esitetty samanytimisten kaksiatomisten molekyylien elektronikonfiguraatiot Ne -molekyyliin saakka. Taulukossa on esitetty myös sidosenergiat ja sidospituudet näiden molekyylien perustilalle. Huomaamme, että sidosenergiat ovat suuria, kun uloin täysi molekyyliorbitaali on sitova. Sidotuilla ja hylkivillä orbitaaleilla olevien elektronien lukumäärien suhde vaikuttaa sidosenergiaan; mitä suurempi osuus elektroneista sijaitsee sitovilla orbitaaleilla, sitä suurempi on molekyylin dissosiaatioenergia. Elektronien kokonaiskulmaliikemäärän komponenttia z-akselin suuntaan merkitsemme suureella M L#, missä ML = m i li. Tietyn tilan energia riippuu suureen M L itseisarvoista Λ = M L. Riippuen Λ arvosta merkitsemme tiloja, joissa Λ = 0,1,,3,..., kirjaimilla Σ, Π,, Φ,.... Jos S on elektronien kokonaisspinkvanttiluku molekyylissä, on vastaava monielektronitilan energian määräävä spektritermi esitettävissä symbolisesti muodossa S + 1 Λ. Taulukossa 6-1 on esitetty myös molekyylien perustilan termit. Taulukko 6.1 Samanytimisten kaksiatomisten molekyylien elektronikonfiguraatio Kun kaksiatominen molekyyli koostuu eri alkuaineiden atomeista, kuten kloorivety HCl, hiilimonoksidi CO tai natriumkloridi NaCl, sanomme mo- Dissosiaatio- Sidoksen Molekyyli Konfiguraatio Perustila energia, ev pituus, Å * * * * σg1s σu1s σgs σus πu p σgp πu p σup + H,65 1,06 Σg 1 H 4,48 0,74 Σg + He 3,1 1,08 Σu 1 He epävakaa Σg 1 Li 1,03,67 Σg 1 Be epävakaa Σg 3 B 3,6 1,59 Σg 1 C 3,6 1,31 Σg 1 N 7,37 1,09 Σg 3 O 5,08 1,1 Σg 1 F,8 1,44 Σg 1 Ne epävakaa Σ g
21 Molekyylit 45 lekyyliä eriytimiseksi. Näissä molekyyleissä elektronin vuorovaikutus ytimien kanssa on erilainen ja näin ollen molekyylillä ei ole symmetriakeskusta. Voimme yhä merkitä elektronitiloja σπδφ,,,,..., mutta emme voi Taulukko 6. Eräiden kaksiatomisten molekyylien* dissosiaatioenergiat D, sidospituudet r 0 ja sähköiset dipolimomentit p enää luokitella niiden pariteettia kirjaimilla g ja u. Tarkasteltaessa heteronuklearisten molekyylien ominaisuuksia riittää yleensä ottaa huomioon atomien uloimpien avoimien (vajaiden) elektronikuorien muuttuminen molekyyliorbitaalien muodostamisessa. Tarkastellaan esimerkkinä ruokasuolaa NaCl. Tiedämme, että natriumatomilla on 11 elektronia ja kloorilla 17. Edelleen tiedämme että kaasumaisessa olomuodossa natriumkloridimolekyylin sidospituus on,51 10 m. Palautamme lyhyesti mieliin 10 natriumin ja kloorin elektronikonfiguraatiot; Natriumin elektronikonfiguraatio on sama kuin neonin, mutta sillä on yksi 3s-elektroni neonin jalokaasukonfiguraation ulkopuolella. Vastaavasti kloorin elektronikonfiguraatio on sama kuin argonin, mutta siltä puuttuu yksi argonatomin 3pelektroneista. Kovalentti Ioni- Molekyyli D, ev r, Å p, D Molekyyli D, ev r, Å p, D 0 0 H 4,48 0,74 0 NaCl 3,58,51 8,5 Li 1,03,67 0 HCl 4,43 1,7 1,07 O 5,08 1,1 0 LiH,5 1,60 N 7,37 1,09 0 Cl,47 1,99 0 HI 3,06 1,61 0,38 CO 11,11 1,13 0,1 NO 5,3 1,15 0,15 5,88 KBr 3,96,94 1,9 KF 5,9,55 8,60 CsCl 3,76 3,06 9,97 KCl 4,9,79 8,0 KI 3,0 3,3 9,4 *Molekyylit on ryhmitelty sidoksen dominoivan komponentin mukaan. Sähköinen 30 dipolimomentti on ilmoitettu yksiköissä D = mc
22 Kaksiatomisten molekyylien elektronikonfiguraatioita Voidaan ajatella, että ne elektronit, jotka sijaitsevat natrium- ja klooriatomien suljetuilla elektronikuorilla eivät osallistu kemiallisen sidoksen muodostamiseen, koska ne ovat tiukasti sidottuja omiin ytimiinsä. Natriumin 1s, s ja p elektronit eivät siis osallistu kemiallisen sidoksen muodostamiseen. Klooriatomin suljetut elektronikuoret 1s, s, p, 3s ovat tiukasti sidottuja ytimeen ja näin kemiallisesti hyvin passiivisia. Huomaamme että kloorilta puuttuu yksi Kuva 6-14 NaCl ja Na + Cl - molekyylien 3p-elektroni uloimman kuoren suljetusta elektronikonfiguraatiosta. Jos funktiona. potentiaalienergiat ytimien välisen etäisyyden nyt jatkaisimme samaa pohdiskelua kuin samanytimisten kaksiatomisten molekyylien kohdalla, voisimme arvella, että natriumin 3s- ja kloorin 3p-elektronit ovat aktiivisia kemiallisen sidoksen muodostamisessa. Tilanne on kuitenkin oleellisesti erilainen johtuen siitä, että atomin ytimet ovat erilaisia. Natriumkloridissa molemmat atomit pyrkivät täydentämään oman elektronirakenteensa suljetuiksi kuoriksi, millä molekyyli saavuttaa energiaminimin. Kun natrium luovuttaa 3s-elektroninsa kloorille molemmat atomit saavat suljetun elektronikonfiguraation, natrium neonin ja kloori argonin. Samalla natriumista tulee positiivisesti varattu ioni ja klooriatomista negatiivisesti varattu ioni. Molekyylin stabiilisuus perustuu näiden vastakkaismerkkisten varausten väliseen Coulombin vuorovaikutukseen. Natriumkloridissa ionien tasapainoetäisyys on,51å. Dipolimomentiksi 9 saadaan 4,0 10 m C, jos oletetaan, että natriumin 3s elektroni on kokonaan siirtynyt klooriatomille. Kokeellisesti on havaittu että natriumkloridimolekyylin dipolimomentti kaasumaisessa olomuodossa on 9 3,0 10 mc, joten (dipolimallin perusteella) noin 75% natriumin 3selektronista on siirtynyt klooriatomille. Tässä ei tietenkään ole kysymyksessä yhden alkeisvarauksen jakamisesta näiden kahden ionin kesken, vaan siitä, että natriumin 3s-elektronin todennnäköisyystiheys on huomattavan suuri ytimien välisessä tilassa. Tässä esimerkissä kuvattua
23 Molekyylit 47 kemiallista sidosta kutsutaan ionisidokseksi. Aiemmin tarkastelemamme samanytimisten kaksiatomisten molekyylien sidos taas puolestaan on kovalenttinen sidos. Kuva 5-14 esittää potentiaalienergiaa natriumkloridimolekyylissä ytimien välisen etäisyyden funktiona. Oletamme, että NaCl-molekyyli on vapaana kaasussa eikä esimerkiksi ruokasuolakiteessä. Huomaamme, että suurilla etäisyyksillä natrium- ja klooriatomien vuorovaikutus on hyvin vähäistä ja niiden vuorovaikutuksen potentiaalienergia on likimain vakio. Kun etäisyys laskee alle 1,5Å, alkaa varauksen siirtyminen natriumilta kloorille ja samalla potentiaalienergia laskee. Kun etäisyys edelleen pienenee vuorovaikutus muistuttaa attraktiivista Coulombin vuorovaikusta Na + - ja Cl - -ionien välillä. Samoin kuin kovalenttisen sidoksen kohdalla, natriumkloridissa on ionien pienillä etäisyyksillä voimakas hylkivä vuorovaikutus. Potentiaalienergian minimi vastaa stabiilin natriumkloridimolekyylin sidospituutta,51å. Natriumkloridimolekyylin ominaisuuksia voidaan tutkia myös ratkaisemalla numeerisesti molekyylin elektroneja vastaava keskimääräisen kentän Schrödingerin yhtälö. Tarvittavia kvanttikemian tietokoneohjelmia on nykyään helposti saatavilla. Numeerisen laskun perusteella tullaan hyvin tarkasti samoihin johtopäätöksiin kuin edellä esitetyn varauksen siirtymiseen perustuvan mallin avulla. Eri ytimistä koostuvat kaksiatomisen molekyylin aaltofunktiota ei voida esittää samanlaisena erillisten atomien lineaarikombinaationa kuten yhtälössä 6.. Tämä johtuu siitä, että aaltofunktioilla ei ole hyvin määriteltyä pariteettia. Voimme kuitenkin yleistää yhtälön 6. siten, että atomiorbitaalien lineaarikombinaationa esitettävä molekyyliorbitaali tulee muotoon = A + B, ψ ψ λψ missä ψ A ja ψ B ovat eri ytimiin kuuluvat atomiset aaltofunktiot. Parametrin λ arvo voidaan määrätä siten, että aaltofunktiota vastaava ominaisenergia saa mahdollisimman alhaisen arvon. Riippuen kertoimen λ arvosta elektroni viettää suuren osan aikaa ytimien välissä tai vaihtoehtoisesti lähempänä jompaakumpaa ydintä. Ensimmäisessä tapauksessa on kyse lähinnä dominoivasti kovalenttisesta sidoksesta kun taas jälkimmäisessä on kyseessä lähinnä ionisidos. Useimmille eri ytimistä
24 Kaksiatomisten molekyylien elektronikonfiguraatioita koostuville kaksiatomisille molekyyleille todellinen sidostyyppi on jotain näiden kahden vaihtoehdon väliltä. Yleisesti mitä ionisempi sidos on sitä suurempi on molekyylin dipolimomentti. Jos ytimet ovat alkuaineiden jaksollisessa järjestelmässä lähellä toisiaan, kuten CO-molekyylissä, sidoksen ioninen luonne on vähäinen ja kyseessä on siis pääosin kovalenttinen sidos. Tämä nähdään myös suhteellisen alhaisesta dipolimomentista, 30 0,40 10 m C. Esimerkki 6.3. Morse-potentiaalin tarkastelua. Kaksiatomisen molekyylin potentiaalienergialle voidaan esittää yksinkertainen semiempiirinen lauseke, joka kohtuullisella tarkkuudella noudattaa tarkkaa numeerisesti laskettua potentiaalienergiaa. Tätä yksinkertaista analyyttista potentiaalin lauseketta kutsutaan Morse-potentiaaliksi. Morse-potentiaali voidaan esittää muodossa Kuva 6-15 Morse potentiaali. Dissosiaatioenergiassa D on jätetty huomiotta värähtelyn 0-pisteenergia. ar ( r0 E ) p ( r) = D 1 e. (6.7) Yhtälössä 6.7 vakiot D, a ja r 0 ovat sovitettavia parametreja. Ne valitaan sovittamalla dissosiaatioenergia ja sidospituus kullekin molekyylille saatuihin kokeellisiin tuloksiin. Myöhemmin tulemme osoittamaan, että myös vakiolla a on tietty helposti mitattavissa oleva yhteys molekyylin fysikaalisiin ominaisuuksiin. Morse potentiaali on esitetty kuvassa Huomaamme, että potentiaalin minimi, joka vastaa derivaatan nollakohtaa saadaan yhtälöstä ar ( r0) ar ( r0 Dae 1 e ) = 0. Tästä päättelemme, että r 0 on juuri molekyylin sidospituus. Minimikohdassaan potentiaalin lauseke on nolla. Hyvin suurilla arvoilla r eksponenttifunktio tulee häviävän pieneksi ja potentiaalienergia lähestyy
25 Molekyylit 49 vakioarvoa D. Siirtääksemme ytimet etäisyydeltä r 0 hyvin kauaksi toisistaan joudumme siis tuomaan systeemiin energiaa määrän D. Tästä päättelemme, että D on molekyylin dissosiaatioenergia. Kvanttimekaaninen systeemi ei voi koskaan omata tarkalleen potentiaalin minimiarvoa vastaavaa energiaa. Tämä ns. nollapiste-energia on jätetty huomiotta kuvassa Tähän palaamme myöhemmin molekyylin värähtelyenergian ar yhteydessä. Pienillä etäisyyden r arvoilla E p lähestyy arvoa D( 1 e ). Potentiaali ei siis saa hyvin suurta positiivista arvoa, mitä voidaan pitää Morse-potentiaalin rajoituksena. Myöhemmin tulemme osoittamaan vakion a yhteyden molekyylin värähtelytaajuuksiin. 0 Esimerkki 6.4. Ionisidoksen potentiaalienergia kaksiatomisessa molekyylissä. Voimme kirjoittaa semiempiirisen ionisidoksen potentiaalienergialle muodossa E p ( r) e b = +. (6.8) 4πε r 9 r 0 Ensimmäinen termi kuvaa Coulombin attraktiivista vuorovaikutusta ionien välillä ja toinen hylkivää efektiä, joka aiheutuu ytimien positiivisesta varauksesta ja suljetuista elektronikuorista atomeissa. Eksponentti yhdeksän on sovitusparametri ja valittu siksi, että se antaa hyvän yhteensopivuuden kokeellisten tulosten kanssa. Koska toinen termi pienenee kääntäen verrannollisesti etäisyyden yhdeksänteen potenssiin, se tulee hyvin nopeasti merkityksettömäksi kun ytimien välinen etäisyys kasvaa. Näin ollen sillä on merkitystä vain pienillä etäisyyksillä. Tasapainoetäisyys saadaan jälleen derivoimalla potentiaalienergian lauseke ja asettamalla derivaatta nollaksi. Saamme de p e 9b = dr 10 r= r 4πε 0 0r0 r0, mistä voimme ratkaista b= e r πε. Vastaavaa potentiaalienergian arvoa merkitsemme D ja sijoittamalla saatu parametrin b arvo potentiaalienergian lausekkeeseen 6.8 saamme ( ) 0 0 D= 89e 4πε r. Tämä on dissosiaatioenergia kaksiatomiselle molekyylille, jossa on ionisidos. Huomaa tärkeää ero kovalenttiseen sidokseen perustuvan kaksiatomisen molekyylin ja ionisidokseen perustuvan molekyylin välillä. Dissosiaatioenergia D antaa sen energian, joka tarvitaan molekyylin hajottamiseen kahdeksi ioniksi. Esi-
26 Moniatomiset molekyylit merkiksi natriumkloridin NaCl tapauksessa D kertoo, kuinka paljon energiaa tarvitaan hajottamaan natriumkloridi molekyyli yhdeksi positiiviseksi natriumioniksi Na + ja yhdeksi negatiiviseksi kloori-ioniksi Cl -. Kuvassa 6-14 olemme merkinneet tämän energian katkoviivalla. Koska kuvassa 6-14 energian nollataso viittaa äärettömän kaukana oleviin natrium- ja klooriatomeihin, huomataan, että molekyylin hajottamiseksi natrium- ja klooriioneiksi tarvitaan 1,4eV enemmän energiaa kuin atomien purkamiseksi neutraaleiksi atomeiksi. Tämä johtuu siitä, että Coulombin voima ionien välillä vaikuttaa vielä hyvin suurilla etäisyyksillä ja sen voittamiseen tarvitaan lisää työtä ja energiaa. Kun sijoitamme yhtälöön 6.8 tuntemamme 10 NaCl-molekyylin sidospituuden r 0 =,51 10 m, saamme dissosiaatioenergiaksi 5,1 ev. Koska haluamme tietää, mikä on dissosiaatioenergia neutraaleiksi atomiksi, meidän on vähennettävä tästä energiasta edellä mainittu 1,4eV. Dissosiaatioenergiaksi neutraaleiksi atomeiksi saadaan näin 3,7eV. Vastaava kokeellinen arvo on 3,58eV. Tämä on sopusoinnussa yksinkertaisen potentiaalienergiamallimme kanssa.
27 Molekyylit Moniatomiset molekyylit Tarkastellessamme useampiatomisten (ei-lineaaristen) molekyylien rakennetta joudumme ottamaan huomioon uutena ominaisuutena molekyylin geometrisen muodon. Kovalenttisten sidosten muodostuessa kaksiatomisissa molekyyleissä on sidoksen muodostumisen kannalta tärkeää, että yksittäisten atomien atomiorbitaalit muodostavat suuren todennäköisyystiheyden atomien väliin. Tämä sama periaate on lähtökohtana myös useampiatomisten molekyylien muodostumisessa. Stabiilissa useampiatomisessa molekyylissä atomit sijaitsevat siten, että yksittäisten atomien atomiorbitaalit voivat muodostaa sellaisia lineaarikombinaatioita (LCAO), joissa todennäköisyystiheys on suuri atomien omaavia lineaarikombinaatioita muihin atomeihin kuuluvien orbitaalien kanssa näiden atomien välisellä alueella. Kovalentissa sidoksessa elektronien suuri negatiivinen varaustiheys positiivisesti varattujen ytimien välissä toimii liimana, joka sitoo molekyylin stabiiliksi kokonaisuudeksi. Tarkastellaan esimerkkinä vesimolekyyliä HO. Siinä on yhteensä kymmenen elektronia ja kolme ydintä. Happiatomin 1s ja s elektronit eivät tässä molekyylissä osallistu sidoksen muodostamiseen. Kaksi hapen neljästä p elektronista muodostaa kemiallisen sidoksen yhdessä vetyatomien 1s elektronien kanssa. Toisen sidokseen osallistuvan p elektronin orbitaali suuntautuu pitkin x-akselia ja toinen pitkin y-akselia(kuva 6-16). Nämä hapen elektronit miehittävät ns. suunnatut p-tilat, p x ja p y. Muut kaksi p- elektronia ovat suunnatulla p z -orbitaalilla siten, että niillä on vastakkaissuuntaiset spinit. Kahdella veden vetyatomilla on molemmilla 1s-elektroni. Jotta saamme suurimman mahdollisen peiton (ja siihen liittyen suuren elektronitiheyden) vedyn 1s-orbitaalien ja hapen suunnattujen p x - ja p y -orbitaalien välille, on molekyylin geometrian oltava sellainen, että vetyatomit sijaitsevat x- ja y-akseleilla Kuva 6-16 Veden molekyyliorbitaalit kuvan 6-16 esittämällä tavalla. Kuvan 6-16 suunnatut orbitaalit p x ja p y eivät ole täsmälleen identtisiä ku-
28 5 6.5 Moniatomiset molekyylit vassa 6-17 esitettyjen suunnattujen orbitaalien kanssa (ks. myös kuva 4-14), sillä vetyatomien läsnäolo polarisoi p-elektronin ja vetää siihen liittyvää todennäköisyystiheyttä kohden vetyatomia. Myös hapen ja vedyn välisten sidosten välinen kulma on hieman suurempi kuin 90 $, kokeellisten mittausten mukaan 104,5 $, johtuen kahden vetyatomin välisestä hylkivästä voimasta. Yksityiskohtaisella numeerisella laskulla voidaan osoittaa, että vedyn 1s-elektroni työntyy osittain kohden happiatomia. Elektronitiheyden negatiivinen ja ytimen positiivinen varaus eivät tästä syystä sijaitse tarkalleen samassa pisteessä. Näin molekyyli polarisoituu ja siihen muodostuu sähködipolimomentti jonka suuruus on 30 6, 10 m C. Dipolimomentin suunta on yhdensuuntainen p x - ja p y -orbitaalien välisen kulman puolittavan janan Kuva 6-17 s, p x, p y ja p z suunnatut spinorbitaalit kanssa. Seuraavaksi tarkastellemme ammoniakkimolekyyliä NH 3. Typen kolme paritonta p-elektronia ovat suunnatuilla p-orbitaaleilla x-, y- ja z- suunnissa. Sidos muodostuu periaatteessa samaan tapaan kuin vesimolekyylissä. Ammoniakkimolekyyli on pyramidin muotoinen kaikkien kolmen suunnatun p-orbitaalien välisen kulman ollessa 90 $. Kokeellisesti on havaittu, että vetyatomien välinen kulma on 107,3 $, jälleen johtuen vetyatomien osittaisesta ionisoitumisesta. Samasta syystä ammoniakkimolekyylillä on pysyvä dipolimomentti, jonka suuruus on 30 5,0 10 m C ja suunta on pyramidin akselilla eli kuvassa 6-18 kohtisuorassa vetyatomien määräämää tasoa vasten. Seuraavaksi tarkastelemme hiiliatomia C. Sillä on perustilassaan kaksi paritonta p-elektronia. Miksi hiili muodostaa niin monia erilaisia molekyylejä? Voidaan osoittaa, että eräs hiilen viritetyistä (lähellä perustilaa olevista) tiloista sisältää yhden s-elektronin ja kolme p-elektronia. Ts. yksi hiilen s-elektroneista on viritetty p-orbitaalille. Vaikka elektronikonfiguraatioon ( )( ) 3 s p liittyvä ominaistila on vapaalla atomilla energia-as-
29 Molekyylit 53 teikolla korkeampana kuin perus- s p, on tällä viritetyllä tila ( ) ( ) tilalla keskeinen rooli kemiallisen sidoksen muodostumisessa metaanimolekyylissä CH 4, joka koostuu yhdestä hiili- ja neljästä vetyatomista. Vetyatomien tulee sijaita Kuva 6-18 NH 3 molekyylin elektronirakenne. molekyylissä symmetrisesti. Kokeellisesti onkin havaittu, että CH -molekyyli on muodoltaan tetraedri, jonka kärjissä on vetyatomit ja 4 keskellä hiiliatomi, ks. kuva Kuinka hiili voi muodostaa yhdestä selektronista ja kolmesta p-elektronista molekyyliorbitaaleja joilla on suuri todennäköisyystiheys jonkin vetyatomin suunnassa? On helposti ymmärrettävissä, että suunnattujen p-orbitaalien avulla voidaan luoda kolme suunnattua molekyyliorbitaalia, mutta s-orbitaali on pallosymmetrinen ja sillä ei ole tästä syystä suuntaominaisuuksia. Tetraedrin kärkiin suuntautuvien molekyyliorbitaalien muodostaminen on mahdollista hybridisaation kautta. Hiilen neljästä spinorbitaalista (s-, p x, p y, p z ), voidaan muodostaa neljä lineaarikombinaatiota, joilla on kaivatut suuntaominaisuudet. Nämä ns. sp 3 -hybridisoituneet suunnatut orbitaalit määritellään lineaarikombinaationa ( ) ψ 1 1 = + x + y + z, s p p p ( ) ψ 1 = + x y z, s p p p ( ) ψ 1 3 = x + y z, s p p p ( ) 1 4 x y z ψ = s p p + p. (6.9) Näitä orbitaaleja muodostaessamme olemme sekoittaneet eri kulmaliikemäärätiloihin liittyviä atomiorbitaaleja, joten saadut suunnatut orbitaalit eivät ole enää kulmaliikemäärän itseisarvon tai minkään sen komponentin ominaisfunktiota. Tämä on luonnollista siitäkin syystä, ettei elektronien näkemällä efektiivisellä potentiaalilla ole CH4 -molekyylissä
30 Moniatomiset molekyylit pallosymmetriaa sen enempää kuin aksiaalisymmetriakaan. Tästä seuraa, että keskimääräisessä muiden elektronien ja ytimien kentässä liikkuvalla elektronilla kulmaliikemäärän mikään komponentti ei ole liikevakio. CH4 -molekyylissä kemiallinen sidos muodostuu vetyjen 1s-elektronien ja hiilen edellä mainitun neljän sp 3 -hybridisointuneen suunnatun orbitaalin välillä. CH4 -molekyylin suunnatut orbitaalit ja vedyn 1s-orbitaalit on esitetty kuvassa Toisena esimerkkinä 3 sp -hybridisaatiosta tarkastelemme etaanimolekyyliä, jossa on kaksi hiiliatomia ja molempien yhteydessä kolmen vetyatomin ryhmä. Etaanin molekyylirakenne on esitetty kuvassa Myös tässä molekyylissä hiili muodostaa sp 3 -hybridi- Kuva 6-18 sp 3 -hybridiaaltofunktiot metaanimolekyylissä CH 4 saation avulla suunnattuja orbitaaleja. Näistä orbitaaleista yksi käytetään molemmissa hiiliatomeissa hiiliatomien 3 Kuva 6-19 sp -hybridisaatio etaanimolekyylissä välisen sigma-sidoksen muodostamiseen. Loput kolme sitovat kukin yhden CH 6 vetyatomin. sp 3 -hybridisaation ohella tavataan myös muita vastaavia atomiorbitaalien lineaarikombinaatioina muodostuvia suunnattujen orbitaalien hybridisaatiota. Toisena esimerkkinä mainitsemme sp - hybridisaation, jossa 1s-elektroni muodostaa suunnattujen p x - ja p y -orbitaalien kanssa kolme uutta suunnattua orbitaalia. Orbitaalit ovat kaikki xy-tasossa siten, että niiden maksimitodennäköisyyksien väliset kulmat ovat tarkalleen 10 $. sp - hybridisoituneet orbitaalit voidaan esittää lineaarikombinaationa s-, p x - ja p y -atomiorbitaaleista yhtälöiden
31 Molekyylit 55 ( x ) 1 ψ 1 = s + p, ψ = s px + py, ψ 3 = s px py 3 (6.10) mukaisesti. Hiilellä neljäs l-kuoren elektroni on tässä tapauksessa p z -orbitaalilla. Tämän tyyppinen hybridisaatio esiintyy esimerkiksi etyleenimolekyylissä HC=CH. Kaksoissidos hiiliatomien välillä seuraa yhdestä sp - hybridisaatioon kuuluvasta orbitaalista ja jäljelle jääneestä p z - orbitaalista. sp -hybridisoitunut orbitaali muodostaa σ -tyyppisen molekyyliorbitaalin ja p z -atomiorbitaalista muodostuu π -sidos. sp -hybridisaatiosta johtuen etyleenimolekyylin atomit ovat järjestäytyneet samaan tasoon. Molekyylillä on myös jäykkyyttä hiiliatomeja yhdistävän akselin suhteen johtuen yhdistetystä σπ -sidoksesta. Huomattakoon, että σ -sidokseen liittyvä todennäköisyystiheys hiiliytimien välissä on paljon suurempi kuin π - sidoksiin liittyvä todennäköisyystiheys. Tästä seuraa, että sigma-sidos vastaa pääosin kemiallisen sidoksen energiasta. Kolmas yleinen sidosrakenne perustuu sp-hybridisaatioon. Siinä muodostetaan LCAO-orbitaalit s-symmetrisestä atomiorbitaalista ja p z -suunnatusta orbitaalista. Näin saadaan todennäköisyystiheyden maksimit joko z-akselin positiiviseen tai negatiiviseen suuntaan. Esimerkkinä sp-hybridisaatiosta mainittakoon asetyleenimolekyyli HC CH. Kolmoissidos kahden hiiliatomin välillä muodostuu toisensa peittävistä sp-hybridisoituneista aaltofunktiosta ja jäljelle jääneistä hybridisaatioon osallistumattomista p - ja p - orbitaaleista, jotka muodostavat π -tyyppisen sidoksen. Vedyt ovat kiinni hiiliatomeissa siten, että vedyn 1s-orbitaali peittää hiilen sp-hybridisoitunutta aaltofunktiota. Seurauksena on lineaarinen molekyyli. x y
MOLEKYYLIT Johdanto Vetymolekyyli-ioni Kaksiatomiset molekyylit...239
 MOLEKYYLIT... 8 6.1 Johdanto...8 6. Vetymolekyyli-ioni...9 6.3 Kaksiatomiset molekyylit...39 6.4 Kaksiatomisten molekyylien elektronikonfiguraatioita...43 6.5 Moniatomiset molekyylit...5 6.6 Orgaaniset
MOLEKYYLIT... 8 6.1 Johdanto...8 6. Vetymolekyyli-ioni...9 6.3 Kaksiatomiset molekyylit...39 6.4 Kaksiatomisten molekyylien elektronikonfiguraatioita...43 6.5 Moniatomiset molekyylit...5 6.6 Orgaaniset
Molekyylit. Atomien välisten sidosten muodostuminen
 Molekyylit. Johdanto. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit 6. Orgaaniset
Molekyylit. Johdanto. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit 6. Orgaaniset
Luento 1: Sisältö. Vyörakenteen muodostuminen Molekyyliorbitaalien muodostuminen Atomiketju Energia-aukko
 Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Luento 1: Sisältö Kemialliset sidokset Ionisidos (suolat, NaCl) Kovalenttinen sidos (timantti, pii) Metallisidos (metallit) Van der Waals sidos (jalokaasukiteet) Vetysidos (orgaaniset aineet, jää) Vyörakenteen
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering, Micro- and Nanosciences Laboratory. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Kiteinen aine. Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne.
 Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Kiteinen aine Kide on suuresta atomijoukosta muodostunut säännöllinen ja stabiili, atomiseen skaalaan nähden erittäin suuri, rakenne. Kiteinen aine on hyvä erottaa kiinteästä aineesta, johon kuuluu myös
Molekyylit. Helsinki University of Technology, Laboratory of Computational Engineering. Atomien väliset sidokset
 Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
Molekyylit. Atomien väliset sidokset. Vetymolekyyli-ioni 3. Kaksiatomiset molekyylit ja niiden molekyyliorbitaalit 4. Muutamien kaksiatomisten molekyylien elektronikonfiguraatio 5. Moniatomiset molekyylit
S Fysiikka III (EST) Tentti ja välikoeuusinta
 S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
S-437 Fysiikka III (EST) Tentti ja välikoeuusinta 65007 Välikoeuusinnassa vastataan vain kolmeen tehtävään Kokeesta saatu pistemäärä kerrotaan tekijällä 5/3 Merkitse paperiin uusitko jommankumman välikokeen,
, m s ) täytetään alimmasta energiatilasta alkaen. Alkuaineet joiden uloimmalla elektronikuorella on samat kvanttiluvut n,
 S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
S-114.6, Fysiikka IV (EST),. VK 4.5.005, Ratkaisut 1. Selitä lyhyesti mutta mahdollisimman täsmällisesti: a) Keskimääräisen kentän malli ja itsenäisten elektronien approksimaatio. b) Monen fermionin aaltofunktion
11. MOLEKYYLIT. Kvanttimekaniikka on käyttökelpoinen molekyyleille, jos se pystyy selittämään atomien välisten sidosten syntymisen.
 11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
11. MOLEKYYLIT Vain harvat alkuaineet esiintyvät luonnossa atomeina (jalokaasut). Useimmiten alkuaineet esiintyvät yhdisteinä: pieninä tai isoina molekyyleinä, klustereina, nesteinä, kiinteänä aineena.
Nyt n = 1. Tästä ratkaistaan kuopan leveys L ja saadaan sijoittamalla elektronin massa ja vakiot
 S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
S-1146 Fysiikka V (ES) Tentti 165005 1 välikokeen alue 1 a) Rubiinilaserin emittoiman valon aallonpituus on 694, nm Olettaen että fotonin emissioon tällä aallonpituudella liittyy äärettömän potentiaalikuopan
Ch7 Kvanttimekaniikan alkeita. Tässä luvussa esitellään NMR:n kannalta keskeiset kvanttimekaniikan tulokset.
 Ch7 Kvanttimekaniikan alkeita Tässä luvussa esitellään NMR:n kannalta keskeiset kvanttimekaniikan tulokset. Spinnittömät hiukkaset Hiukkasta kuvaa aineaaltokenttä eli aaltofunktio. Aaltofunktio riippuu
Ch7 Kvanttimekaniikan alkeita Tässä luvussa esitellään NMR:n kannalta keskeiset kvanttimekaniikan tulokset. Spinnittömät hiukkaset Hiukkasta kuvaa aineaaltokenttä eli aaltofunktio. Aaltofunktio riippuu
Atomin elektronikonfiguraatiot (1)
 Atomin elektronikonfiguraatiot (1) Atomiin sidotun elektronin tilaa kuvataan neljällä kvanttiluvulla: n pääkvattiluku - aaltofunktion eli orbitaalin energia, keskimääräinen etäisyys ytimestä, saa arvot
Atomin elektronikonfiguraatiot (1) Atomiin sidotun elektronin tilaa kuvataan neljällä kvanttiluvulla: n pääkvattiluku - aaltofunktion eli orbitaalin energia, keskimääräinen etäisyys ytimestä, saa arvot
766334A Ydin- ja hiukkasfysiikka
 1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
1 76633A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 3 5-3 Kuorimalli Juhani Lounila Oulun yliopisto, Fysiikan laitos, 011 Kuva 7-13 esittää, miten parillis-parillisten ydinten ensimmäisen
Kvanttifysiikan perusteet 2017
 Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Kvanttifysiikan perusteet 207 Harjoitus 2: ratkaisut Tehtävä Osoita hyödyntäen Maxwellin yhtälöitä, että tyhjiössä magneettikenttä ja sähkökenttä toteuttavat aaltoyhtälön, missä aallon nopeus on v = c.
Luku 13: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 13: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Kvanttimekaaninen atomimalli. "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman
 Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
Kvanttimekaaninen atomimalli "Voi hyvin sanoa, että kukaan ei ymmärrä kvanttimekaniikkaa. -Richard Feynman Tunnin sisältö 1. 2. 3. 4. 5. 6. 7. Kvanttimekaaninen atomimalli Orbitaalit Kvanttiluvut Täyttymisjärjestys
(1) (2) Normalisointiehdoksi saadaan nytkin yhtälö (2). Ratkaisemalla (2)+(3) saamme
 S-446 Fysiikka IV (Sf) Tentti 3934 Oletetaan, että φ ja φ ovat ajasta riippumattoman Scrödingerin yhtälön samaan ominaisarvoon E liittyviä ominaisfunktioita Nämä funktiot ovat normitettuja, mutta eivät
S-446 Fysiikka IV (Sf) Tentti 3934 Oletetaan, että φ ja φ ovat ajasta riippumattoman Scrödingerin yhtälön samaan ominaisarvoon E liittyviä ominaisfunktioita Nämä funktiot ovat normitettuja, mutta eivät
Alikuoret eli orbitaalit
 Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
Alkuaineiden jaksollinen järjestelmä Alkuaineen kemialliset ominaisuudet määräytyvät sen ulkokuoren elektronirakenteesta. Seuraus: Samanlaisen ulkokuorirakenteen omaavat alkuaineen ovat kemiallisesti sukulaisia
ULKOELEKTRONIRAKENNE JA METALLILUONNE
 ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
ULKOELEKTRONIRAKENNE JA METALLILUONNE Palautetaan mieleen jaksollinen järjestelmä ja mitä siitä saa- Kertausta daan irti. H RYHMÄT OVAT SARAKKEITA Mitä sarakkeen numero kertoo? JAKSOT OVAT RIVEJÄ Mitä
766334A Ydin- ja hiukkasfysiikka
 1 766334A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 4 Juhani Lounila Oulun yliopisto, Fysiikan laitos, 01 6 Radioaktiivisuus Kuva 1 esittää radioaktiivisen aineen ydinten lukumäärää
1 766334A Ydin- ja hiukkasfysiikka Luentomonistetta täydentävää materiaalia: 4 Juhani Lounila Oulun yliopisto, Fysiikan laitos, 01 6 Radioaktiivisuus Kuva 1 esittää radioaktiivisen aineen ydinten lukumäärää
9. JAKSOLLINEN JÄRJESTELMÄ
 9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
9. JAKSOLLINEN JÄRJESTELMÄ Jo vuonna 1869 venäläinen kemisti Dmitri Mendeleev muotoili ajatuksen alkuaineiden jaksollisesta laista: Jos alkuaineet laitetaan järjestykseen atomiluvun mukaan, alkuaineet,
8. MONIELEKTRONISET ATOMIT
 8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
Luku 11: Molekyylien rakenne. Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H
 Luku 11: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Elektronien liike on hyvin
Luku 11: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Elektronien liike on hyvin
Luku 14: Elektronispektroskopia. 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi
 Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Luku 14: Elektronispektroskopia 2-atomiset molekyylit moniatomiset molekyylit Fluoresenssi ja fosforesenssi 1 2-atomisen molekyylin elektronitilan termisymbolia muodostettaessa tärkeä ominaisuus on elektronien
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012
 Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Aine koostuu atomeista Nimitys tulee sanasta atomos = jakamaton (400 eaa, Kreikka) Atomin kuvaamiseen käytetään atomimalleja Pallomalli
Luku 10: Molekyylien rakenne. Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H
 Luku 10: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Molekyylien elektronirakennetta
Luku 10: Molekyylien rakenne Valenssisidosteoria Kaksiatomiset ja moniatomiset molekyylit Molekyyliorbitaaliteoria H + 2 ja muut kaksiatomiset molekyylit Hückel approksimaatio 1 Molekyylien elektronirakennetta
Luku 9: Atomien rakenne ja spektrit. https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
 Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Luku 9: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit https://www.youtube.com/watch? v=bmivwz-7gmu https://www.youtube.com/watch? v=dvrzdcnsiyw
Ydin- ja hiukkasfysiikka: Harjoitus 1 Ratkaisut 1
 Ydin- ja hiukkasfysiikka: Harjoitus Ratkaisut Tehtävä i) Isotoopeilla on sama määrä protoneja, eli sama järjestysluku Z, mutta eri massaluku A. Tässä isotooppeja keskenään ovat 9 30 3 0 4Be ja 4 Be, 4Si,
Ydin- ja hiukkasfysiikka: Harjoitus Ratkaisut Tehtävä i) Isotoopeilla on sama määrä protoneja, eli sama järjestysluku Z, mutta eri massaluku A. Tässä isotooppeja keskenään ovat 9 30 3 0 4Be ja 4 Be, 4Si,
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka
 Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Kaikenlaisia sidoksia yhdisteissä: ioni-, kovalenttiset ja metallisidokset Fysiikan ja kemian perusteet ja pedagogiikka Kari Sormunen Kevät 2012 Kertausta IONIEN MUODOSTUMISESTA Jos atomi luovuttaa tai
Luku 2: Atomisidokset ja ominaisuudet
 Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
Luku 2: Atomisidokset ja ominaisuudet Käsiteltävät aiheet: Mikä aikaansaa sidokset? Mitä eri sidostyyppejä on? Mitkä ominaisuudet määräytyvät sidosten kautta? Chapter 2-1 Atomirakenne Atomi elektroneja
MUUTOKSET ELEKTRONI- RAKENTEESSA
 MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
MUUTOKSET ELEKTRONI- RAKENTEESSA KEMIAA KAIK- KIALLA, KE1 Ulkoelektronit ja oktettisääntö Alkuaineen korkeimmalla energiatasolla olevia elektroneja sanotaan ulkoelektroneiksi eli valenssielektroneiksi.
Korkeammat derivaatat
 Korkeammat derivaatat Jo kerran derivoitu funk6o voidaan derivoida uudelleen. d! df(x) $ dx " # dx % & = d2 f(x) = f''(x) = f (2) (x) dx 2 Yleisemmin merkitään: d n f(x) dx n = f (n) (x) Esimerkki: 2-
Korkeammat derivaatat Jo kerran derivoitu funk6o voidaan derivoida uudelleen. d! df(x) $ dx " # dx % & = d2 f(x) = f''(x) = f (2) (x) dx 2 Yleisemmin merkitään: d n f(x) dx n = f (n) (x) Esimerkki: 2-
Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin (pieni el.neg.) välille.
 2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
2.1 Vahvat sidokset 1. Ionisidokset 2. 3. Kovalenttiset sidokset Metallisidokset Ionisidos syntyy, kun elektronegatiivisuusero on tarpeeksi suuri (yli 1,7). Yleensä epämetallin (suuri el.neg.) ja metallin
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia
 Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
Kovalenttinen sidos ja molekyyliyhdisteiden ominaisuuksia 16. helmikuuta 2014/S.. Mikä on kovalenttinen sidos? Kun atomit jakavat ulkoelektronejaan, syntyy kovalenttinen sidos. Kovalenttinen sidos on siis
5.1 Johdanto 185. 5.2 Helium-atomi 186. 5.3 Keskeiskenttämalli 201. 5.4 Paulin kieltosääntö 206. 5.5 Atomien elektronirakenne 208
 MONIELEKTRONIATOMIT 5. Johdanto 85 5. Helium-atomi 86 5.3 Keskeiskenttämalli 0 5.4 Paulin kieltosääntö 06 5.5 Atomien elektronirakenne 08 5.6 L--kytkentä monen elektronin atomeissa 3 5.7 Röntgenspektrien
MONIELEKTRONIATOMIT 5. Johdanto 85 5. Helium-atomi 86 5.3 Keskeiskenttämalli 0 5.4 Paulin kieltosääntö 06 5.5 Atomien elektronirakenne 08 5.6 L--kytkentä monen elektronin atomeissa 3 5.7 Röntgenspektrien
Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin.
 1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
1.2 Elektronin energia Käytetään nykyaikaista kvanttimekaanista atomimallia, Bohrin vetyatomi toimii samoin. -elektronit voivat olla vain tietyillä energioilla (pääkvanttiluku n = 1, 2, 3,...) -mitä kauempana
Korkeammat derivaatat
 Korkeammat derivaatat Jo kerran derivoitu funk1o voidaan derivoida uudelleen. d df(x) dx dx = d2 f(x) dx 2 = f''(x) = f 2 (x) Yleisemmin merkitään: d n f(x) dx n = f n (x) Esimerkki: 2 atominen molekyyli
Korkeammat derivaatat Jo kerran derivoitu funk1o voidaan derivoida uudelleen. d df(x) dx dx = d2 f(x) dx 2 = f''(x) = f 2 (x) Yleisemmin merkitään: d n f(x) dx n = f n (x) Esimerkki: 2 atominen molekyyli
ψ(x) = A cos(kx) + B sin(kx). (2) k = nπ a. (3) E = n 2 π2 2 2ma 2 n2 E 0. (4)
 76A KIINTEÄN AINEEN FYSIIKKA Ratkaisut 4 Kevät 214 1. Tehtävä: Yksinkertainen malli kovalenttiselle sidokselle: a) Äärimmäisen yksinkertaistettuna mallina elektronille atomissa voidaan pitää syvää potentiaalikuoppaa
76A KIINTEÄN AINEEN FYSIIKKA Ratkaisut 4 Kevät 214 1. Tehtävä: Yksinkertainen malli kovalenttiselle sidokselle: a) Äärimmäisen yksinkertaistettuna mallina elektronille atomissa voidaan pitää syvää potentiaalikuoppaa
1 WKB-approksimaatio. Yleisiä ohjeita. S Harjoitus
 S-114.1427 Harjoitus 3 29 Yleisiä ohjeita Ratkaise tehtävät MATLABia käyttäen. Kirjoita ratkaisut.m-tiedostoihin. Tee tuloksistasi lyhyt seloste, jossa esität laskemasi arvot sekä piirtämäsi kuvat (sekä
S-114.1427 Harjoitus 3 29 Yleisiä ohjeita Ratkaise tehtävät MATLABia käyttäen. Kirjoita ratkaisut.m-tiedostoihin. Tee tuloksistasi lyhyt seloste, jossa esität laskemasi arvot sekä piirtämäsi kuvat (sekä
4 Yleinen potenssifunktio ja polynomifunktio
 4 Yleinen potenssifunktio ja polynomifunktio ENNAKKOTEHTÄVÄT 1. a) Tutkitaan yhtälöiden ratkaisuja piirtämällä funktioiden f(x) = x, f(x) = x 3, f(x) = x 4 ja f(x) = x 5 kuvaajat. Näin nähdään, monessako
4 Yleinen potenssifunktio ja polynomifunktio ENNAKKOTEHTÄVÄT 1. a) Tutkitaan yhtälöiden ratkaisuja piirtämällä funktioiden f(x) = x, f(x) = x 3, f(x) = x 4 ja f(x) = x 5 kuvaajat. Näin nähdään, monessako
Demo: Kahden elektronin spintilojen muodostaminen
 Demo: Kahden elektronin spintilojen muodostaminen Tämän demonstraation tarkoituksena on havainnollistaa kvanttimekaniikan operaattoriformalismin soveltamista kahden elektronin systeemin spintilojen muodostamiseen.
Demo: Kahden elektronin spintilojen muodostaminen Tämän demonstraation tarkoituksena on havainnollistaa kvanttimekaniikan operaattoriformalismin soveltamista kahden elektronin systeemin spintilojen muodostamiseen.
Luku 10: Atomien rakenne ja spektrit. Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit
 Luku 10: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit 1 n 1 = 3 n 1 = 4 n 1 = 2 n 1 =1 Vetyatomin spektri koostuu viivoista Viivojen sijainti
Luku 10: Atomien rakenne ja spektrit Vedyn kaltaiset atomit Atomiorbitaalit Spektrisiirtymät Monielektroniset atomit 1 n 1 = 3 n 1 = 4 n 1 = 2 n 1 =1 Vetyatomin spektri koostuu viivoista Viivojen sijainti
Voima ja potentiaalienergia II Energian kvantittuminen
 Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
Voima ja potentiaalienergia II Energian kvantittuminen Mene osoitteeseen presemo.helsinki.fi/kontro ja vastaa kysymyksiin Tavoitteena tällä luennolla Miten määritetään voima kun potentiaalienergia U(x,y,z)
FYSA242 Statistinen fysiikka, Harjoitustentti
 FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
FYSA242 Statistinen fysiikka, Harjoitustentti Tehtävä 1 Selitä lyhyesti: a Mikä on Einsteinin ja Debyen kidevärähtelymallien olennainen ero? b Mikä ero vuorovaikutuksessa ympäristön kanssa on kanonisella
S Fysiikka III (Est), 2 VK Malliratkaisut (Arvosteluperusteita täydennetään vielä)
 S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
S-.7 Fysiikka III (st), VK 8.5.008 Malliratkaisut (Arvosteluperusteita täydennetään vielä). Näytä, että sekä symmetrinen aaltofunktio ψn( x ) ψn ( x) + ψn( x) ψn, että antisymmetrinen aaltofunktioψn( x)
Kvanttifysiikan perusteet, harjoitus 5
 Kvanttifysiikan perusteet, harjoitus 5 February 4, 07 Tehtävä Oletetaan energian ominaisfunktiot φ n ortonormitetuiksi, dxφ nφ m = δ nm, jossa δ nm on Kroneckerin delta. Määritetään ensin superpositiotilan
Kvanttifysiikan perusteet, harjoitus 5 February 4, 07 Tehtävä Oletetaan energian ominaisfunktiot φ n ortonormitetuiksi, dxφ nφ m = δ nm, jossa δ nm on Kroneckerin delta. Määritetään ensin superpositiotilan
KEMIA. Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista.
 KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
KEMIA Kemia on tiede joka tutkii aineen koostumuksia, ominaisuuksia ja muuttumista. Kemian työturvallisuudesta -Kemian tunneilla tutustutaan aineiden ominaisuuksiin Jotkin aineet syttyvät palamaan reagoidessaan
Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen)
 Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen Vapaaseen hiukkaseen ei vaikuta voimia, joten U(x = 0. Vapaan hiukkasen energia on sen liike-energia eli E=p /m. Koska hiukkasella on määrätty energia,
Vapaan hiukkasen Schrödingerin yhtälö (yksiulotteinen Vapaaseen hiukkaseen ei vaikuta voimia, joten U(x = 0. Vapaan hiukkasen energia on sen liike-energia eli E=p /m. Koska hiukkasella on määrätty energia,
Ydinfysiikkaa. Tapio Hansson
 3.36pt Ydinfysiikkaa Tapio Hansson Ydin Ydin on atomin mittakaavassa äärimmäisen pieni. Sen koko on muutaman femtometrin luokkaa (10 15 m), kun taas koko atomin halkaisija on ångströmin luokkaa (10 10
3.36pt Ydinfysiikkaa Tapio Hansson Ydin Ydin on atomin mittakaavassa äärimmäisen pieni. Sen koko on muutaman femtometrin luokkaa (10 15 m), kun taas koko atomin halkaisija on ångströmin luokkaa (10 10
1. Tarkastellaan kaksiulotteisessa Hilbert avaruudessa Hamiltonin operaattoria
 Kvanttimekaniikka I, tentti 6.. 015 4 tehtävää, 4 tuntia 1. Tarkastellaan kaksiulotteisessa Hilbert avaruudessa Hamiltonin operaattoria ( { ( ( } E iδ H =, E, δ R, kannassa B = 1 =, =. iδ E 0 1 (a (p.
Kvanttimekaniikka I, tentti 6.. 015 4 tehtävää, 4 tuntia 1. Tarkastellaan kaksiulotteisessa Hilbert avaruudessa Hamiltonin operaattoria ( { ( ( } E iδ H =, E, δ R, kannassa B = 1 =, =. iδ E 0 1 (a (p.
m h = Q l h 8380 J = J kg 1 0, kg Muodostuneen höyryn osuus alkuperäisestä vesimäärästä on m h m 0,200 kg = 0,
 76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
76638A Termofysiikka Harjoitus no. 9, ratkaisut syyslukukausi 014) 1. Vesimäärä, jonka massa m 00 g on ylikuumentunut mikroaaltouunissa lämpötilaan T 1 110 383,15 K paineessa P 1 atm 10135 Pa. Veden ominaislämpökapasiteetti
H7 Malliratkaisut - Tehtävä 1
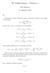 H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
H7 Malliratkaisut - Tehtävä Eelis Mielonen 7. lokakuuta 07 a) Palautellaan muistiin Maclaurin sarjan määritelmä (Taylorin sarja origon ympäristössä): f n (0) f(x) = (x) n Nyt jos f(x) = ln( + x) saadaan
Jakso 8: Monielektroniset atomit
 Jakso 8: Monielektroniset atomit Näytä tai palauta tämän jakson tehtävät viimeistään tiistaina 9.6.2015. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 6 ja 7. Suunnilleen samat asiat ovat
Jakso 8: Monielektroniset atomit Näytä tai palauta tämän jakson tehtävät viimeistään tiistaina 9.6.2015. Teoriaa näihin tehtäviin löytyy Beiserin kirjasta kappaleesta 6 ja 7. Suunnilleen samat asiat ovat
3.1 Varhaiset atomimallit (1/3)
 + 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
+ 3 ATOMIN MALLI 3.1 Varhaiset atomimallit (1/3) Thomsonin rusinakakkumallissa positiivisesti varautuneen hyytelömäisen aineen sisällä on negatiivisia elektroneja kuin rusinat kakussa. Rutherford pommitti
Korkeammat derivaatat
 Korkeammat derivaatat Jo kerran derivoitu funk1o voidaan derivoida uudelleen. d dx! " # df(x) dx $ % & = d2 f(x) = f''(x) = f (2) (x) dx 2 Yleisemmin merkitään: d n f(x) dx n = f (n) (x) Esimerkki: 2-
Korkeammat derivaatat Jo kerran derivoitu funk1o voidaan derivoida uudelleen. d dx! " # df(x) dx $ % & = d2 f(x) = f''(x) = f (2) (x) dx 2 Yleisemmin merkitään: d n f(x) dx n = f (n) (x) Esimerkki: 2-
Aikariippuva Schrödingerin yhtälö
 Aineaaltodynamiikka Aineaaltokenttien riippuvuus ajasta aikariippuva Schrödingerin yhtälö Stationääriset ja ei-stationääriset tilat Aaltopaketit Kvanttimekaniikan postulaatit Aikariippuva Schrödingerin
Aineaaltodynamiikka Aineaaltokenttien riippuvuus ajasta aikariippuva Schrödingerin yhtälö Stationääriset ja ei-stationääriset tilat Aaltopaketit Kvanttimekaniikan postulaatit Aikariippuva Schrödingerin
8. MONIELEKTRONISET ATOMIT
 8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
8. MONIELEKTRONISET ATOMIT 8.1. ELEKTRONIN SPIN Epärelativistinen kvanttimekaniikka selittää vetyatomin rakenteen melko tarkasti, mutta edelleen kokeellisissa atomien energioiden mittauksissa oli selittämättömiä
REAKTIOT JA TASAPAINO, KE5 KERTAUSTA
 KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
KERTAUSTA REAKTIOT JA TASAPAINO, KE5 Aineiden ominaisuudet voidaan selittää niiden rakenteen avulla. Aineen rakenteen ja ominaisuuksien väliset riippuvuudet selittyvät kemiallisten sidosten avulla. Vahvat
Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa
 Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
Potentiaalikuoppa Luento 9 Potentiaalikuopalla tarkoitetaan tilannetta, jossa potentiaalienergia U(x) on muotoa U( x ) = U U( x ) = 0 0 kun x < 0 tai x > L, kun 0 x L. Kuopan kohdalla hiukkanen on vapaa,
3.3 Paraabeli toisen asteen polynomifunktion kuvaajana. Toisen asteen epäyhtälö
 3.3 Paraabeli toisen asteen polynomifunktion kuvaajana. Toisen asteen epäyhtälö Yhtälön (tai funktion) y = a + b + c, missä a 0, kuvaaja ei ole suora, mutta ei ole yhtälökään ensimmäistä astetta. Funktioiden
3.3 Paraabeli toisen asteen polynomifunktion kuvaajana. Toisen asteen epäyhtälö Yhtälön (tai funktion) y = a + b + c, missä a 0, kuvaaja ei ole suora, mutta ei ole yhtälökään ensimmäistä astetta. Funktioiden
MAB3 - Harjoitustehtävien ratkaisut:
 MAB3 - Harjoitustehtävien ratkaisut: 1 Funktio 1.1 Piirretään koordinaatistoakselit ja sijoitetaan pisteet: 1 1. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä.
MAB3 - Harjoitustehtävien ratkaisut: 1 Funktio 1.1 Piirretään koordinaatistoakselit ja sijoitetaan pisteet: 1 1. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä.
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli
 KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
KEMIAN MIKROMAAILMA, KE2 Kvanttimekaaninen atomimalli Aineen rakenteen teoria alkoi hahmottua, kun 1800-luvun alkupuolella John Dalton kehitteli teoriaa atomeista jakamattomina aineen perusosasina. Toki
J 2 = J 2 x + J 2 y + J 2 z.
 FYSA5 Kvanttimekaniikka I, Osa B.. tentti: 4 tehtävää, 4 tuntia. Tarkastellaan pyörimismääräoperaattoria J, jonka komponentit toteuttavat kommutaatiorelaatiot [J x, J y ] = i hj z, [J y, J z ] = i hj x,
FYSA5 Kvanttimekaniikka I, Osa B.. tentti: 4 tehtävää, 4 tuntia. Tarkastellaan pyörimismääräoperaattoria J, jonka komponentit toteuttavat kommutaatiorelaatiot [J x, J y ] = i hj z, [J y, J z ] = i hj x,
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 2 Kevät 2017
 763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 2 Kevät 207. Nelinopeus ympyräliikkeessä On siis annettu kappaleen paikkaa kuvaava nelivektori X x µ : Nelinopeus U u µ on määritelty kaavalla x µ (ct,
763306A JOHDATUS SUHTEELLISUUSTEORIAAN 2 Ratkaisut 2 Kevät 207. Nelinopeus ympyräliikkeessä On siis annettu kappaleen paikkaa kuvaava nelivektori X x µ : Nelinopeus U u µ on määritelty kaavalla x µ (ct,
pääkiertoakseli #$%%ä 2C 2 C 2!"
 Tehtävä 1 Määritä seuraavien molekyylien pisteryhmät: (a) H 3 N H 3 N l o l NH 3 + NH 3 urataan lohkokaaviota: lineaari!"!" suuri symmetria 2s v #$%%ä 2v!" pääkiertoakseli #$%%ä 2 2 2!" s h Vastaavasti:
Tehtävä 1 Määritä seuraavien molekyylien pisteryhmät: (a) H 3 N H 3 N l o l NH 3 + NH 3 urataan lohkokaaviota: lineaari!"!" suuri symmetria 2s v #$%%ä 2v!" pääkiertoakseli #$%%ä 2 2 2!" s h Vastaavasti:
1240eV nm. 410nm. Kun kappaleet saatetaan kontaktiin jännite-ero on yhtä suuri kuin työfunktioiden erotus ΔV =
 S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
S-47 ysiikka III (ST) Tentti 88 Maksimiaallonpituus joka irroittaa elektroneja metallista on 4 nm ja vastaava aallonpituus metallille on 8 nm Mikä on näiden metallien välinen jännite-ero? Metallin työfunktio
Shrödingerin yhtälön johto
 Shrödingerin yhtälön johto Tomi Parviainen 4. maaliskuuta 2018 Sisältö 1 Schrödingerin yhtälön johto tasaisessa liikkeessä olevalle elektronille 1 2 Schrödingerin yhtälöstä aaltoyhtälöön kiihtyvässä liikkeessä
Shrödingerin yhtälön johto Tomi Parviainen 4. maaliskuuta 2018 Sisältö 1 Schrödingerin yhtälön johto tasaisessa liikkeessä olevalle elektronille 1 2 Schrödingerin yhtälöstä aaltoyhtälöön kiihtyvässä liikkeessä
Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden kanssa, joiden lakina on tietyn ominaisuuden samuus.
 Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden kanssa, joiden lakina on tietyn ominaisuuden samuus. Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden
Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden kanssa, joiden lakina on tietyn ominaisuuden samuus. Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden
5.10. HIUKKANEN POTENTIAALIKUOPASSA
 5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
5.10. HIUKKANEN POTENTIAALIKUOPASSA eli miten reunaehdot ja normitus vaikuttavat aaltofunktioihin Yleensä Schrödingerin yhtälön ratkaiseminen matemaattisesti on hyvin työlästä ja edellyttää vahvaa matemaattista
Königsbergin sillat. Königsberg 1700-luvulla. Leonhard Euler ( )
 Königsbergin sillat 1700-luvun Königsbergin (nykyisen Kaliningradin) läpi virtasi joki, jonka ylitti seitsemän siltaa. Sanotaan, että kaupungin asukkaat yrittivät löytää reittiä, joka lähtisi heidän kotoaan,
Königsbergin sillat 1700-luvun Königsbergin (nykyisen Kaliningradin) läpi virtasi joki, jonka ylitti seitsemän siltaa. Sanotaan, että kaupungin asukkaat yrittivät löytää reittiä, joka lähtisi heidän kotoaan,
(1) refleksiivinen, (2) symmetrinen ja (3) transitiivinen.
 Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden kanssa, joiden lakina on tietyn ominaisuuden samuus. Tietyn ominaisuuden samuus -relaatio on ekvivalenssi; se on (1) refleksiivinen,
Matematiikassa ja muuallakin joudutaan usein tekemisiin sellaisten relaatioiden kanssa, joiden lakina on tietyn ominaisuuden samuus. Tietyn ominaisuuden samuus -relaatio on ekvivalenssi; se on (1) refleksiivinen,
Mikrotila Makrotila Statistinen paino Ω(n) 3 Ω(3) = 4 2 Ω(2) = 6 4 Ω(4) = 1
 76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
76628A Termofysiikka Harjoitus no. 4, ratkaisut (syyslukukausi 204). (a) Systeemi koostuu neljästä identtisestä spin- -hiukkasesta. Merkitään ylöspäin olevien spinien lukumäärää n:llä. Systeemin mahdolliset
Jaksollinen järjestelmä ja sidokset
 Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Booriryhmä Hiiliryhmä Typpiryhmä Happiryhmä Halogeenit Jalokaasut Jaksollinen järjestelmä ja sidokset 13 Jaksollinen järjestelmä on tärkeä kemian työkalu. Sen avulla saadaan tietoa alkuaineiden rakenteista
Atomimallit. Tapio Hansson
 Atomimallit Tapio Hansson Atomin käsite Atomin käsite on peräisin antiikin Kreikasta. Filosofi Demokritos päätteli (n. 400 eaa.), että äärellisen maailman tulee koostua äärellisistä, jakamattomista hiukkasista
Atomimallit Tapio Hansson Atomin käsite Atomin käsite on peräisin antiikin Kreikasta. Filosofi Demokritos päätteli (n. 400 eaa.), että äärellisen maailman tulee koostua äärellisistä, jakamattomista hiukkasista
Kertausta 1.kurssista. KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä. Hiilen isotoopit
 KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
KEMIAN MIKROMAAILMA, KE2 Atomin rakenne ja jaksollinen järjestelmä Kertausta 1.kurssista Hiilen isotoopit 1 Isotoopeilla oli ytimessä sama määrä protoneja, mutta eri määrä neutroneja. Ne käyttäytyvät kemiallisissa
MAB3 - Harjoitustehtävien ratkaisut:
 MAB - Harjoitustehtävien ratkaisut: Funktio. Piirretään koordinaatistoakselit ja sijoitetaan pisteet:. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä. Funktiolla
MAB - Harjoitustehtävien ratkaisut: Funktio. Piirretään koordinaatistoakselit ja sijoitetaan pisteet:. a) Funktioiden nollakohdat löydetään etsimällä kuvaajien ja - akselin leikkauspisteitä. Funktiolla
Luku 8. Mekaanisen energian säilyminen. Konservatiiviset ja eikonservatiiviset. Potentiaalienergia Voima ja potentiaalienergia.
 Luku 8 Mekaanisen energian säilyminen Konservatiiviset ja eikonservatiiviset voimat Potentiaalienergia Voima ja potentiaalienergia Mekaanisen energian säilyminen Teho Tavoitteet: Erottaa konservatiivinen
Luku 8 Mekaanisen energian säilyminen Konservatiiviset ja eikonservatiiviset voimat Potentiaalienergia Voima ja potentiaalienergia Mekaanisen energian säilyminen Teho Tavoitteet: Erottaa konservatiivinen
Kemia 3 op. Kirjallisuus: MaoL:n taulukot: kemian sivut. Kurssin sisältö
 Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Kemia 3 op Kirjallisuus: MaoL:n taulukot: kemian sivut Kurssin sisältö 1. Peruskäsitteet ja atomin rakenne 2. Jaksollinen järjestelmä,oktettisääntö 3. Yhdisteiden nimeäminen 4. Sidostyypit 5. Kemiallinen
Ionisidos ja ionihila:
 YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
YHDISTEET KEMIAA KAIK- KIALLA, KE1 Ionisidos ja ionihila: Ionisidos syntyy kun metalli (pienempi elek.neg.) luovuttaa ulkoelektronin tai elektroneja epämetallille (elektronegatiivisempi). Ionisidos on
Erilaisia entalpian muutoksia
 Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Erilaisia entalpian muutoksia REAKTIOT JA ENERGIA, KE3 Erilaisille kemiallisten reaktioiden entalpiamuutoksille on omat terminsä. Monesti entalpia-sanalle käytetään synonyymiä lämpö. Reaktiolämmöllä eli
Määritelmä, metallisidos, metallihila:
 ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
ALKUAINEET KEMIAA KAIK- KIALLA, KE1 Metalleilla on tyypillisesti 1-3 valenssielektronia. Yksittäisten metalliatomien sitoutuessa toisiinsa jokaisen atomin valenssielektronit tulevat yhteiseen käyttöön
Kemiallinen reaktio
 Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
Kemiallinen reaktio REAKTIOT JA ENERGIA, KE3 Johdantoa: Syömme elääksemme, emme elä syödäksemme! sanonta on totta. Kun elimistömme hyödyntää ravintoaineita metaboliassa eli aineenvaihduntareaktioissa,
KE4, KPL. 3 muistiinpanot. Keuruun yläkoulu, Joonas Soininen
 KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
KE4, KPL. 3 muistiinpanot Keuruun yläkoulu, Joonas Soininen KPL 3: Ainemäärä 1. Pohtikaa, miksi ruokaohjeissa esim. kananmunien ja sipulien määrät on ilmoitettu kappalemäärinä, mutta makaronit on ilmoitettu
L a = L l. rv a = Rv l v l = r R v a = v a 1, 5
 Tehtävä a) Energia ja rataliikemäärämomentti säilyy. Maa on r = AU päässä auringosta. Mars on auringosta keskimäärin R =, 5AU päässä. Merkitään luotaimen massaa m(vaikka kuten tullaan huomaamaan sitä ei
Tehtävä a) Energia ja rataliikemäärämomentti säilyy. Maa on r = AU päässä auringosta. Mars on auringosta keskimäärin R =, 5AU päässä. Merkitään luotaimen massaa m(vaikka kuten tullaan huomaamaan sitä ei
Luku 27. Tavoiteet Määrittää magneettikentän aiheuttama voima o varattuun hiukkaseen o virtajohtimeen o virtasilmukkaan
 Luku 27 Magnetismi Mikä aiheuttaa magneettikentän? Magneettivuon tiheys Virtajohtimeen ja varattuun hiukkaseen vaikuttava voima magneettikentässä Magneettinen dipoli Hallin ilmiö Luku 27 Tavoiteet Määrittää
Luku 27 Magnetismi Mikä aiheuttaa magneettikentän? Magneettivuon tiheys Virtajohtimeen ja varattuun hiukkaseen vaikuttava voima magneettikentässä Magneettinen dipoli Hallin ilmiö Luku 27 Tavoiteet Määrittää
Potentiaali ja potentiaalienergia
 Luku 2 Potentiaali ja potentiaalienergia 2.1 Sähköstaattinen potentiaali ja sähkökenttä Koska paikallaan olevan pistemäisen varauksen aiheuttamalla Coulombin sähkökentällä on vain radiaalikomponentti,
Luku 2 Potentiaali ja potentiaalienergia 2.1 Sähköstaattinen potentiaali ja sähkökenttä Koska paikallaan olevan pistemäisen varauksen aiheuttamalla Coulombin sähkökentällä on vain radiaalikomponentti,
Tekijä Pitkä matematiikka
 K1 Tekijä Pitkä matematiikka 5 7..017 a) 1 1 + 1 = 4 + 1 = 3 = 3 4 4 4 4 4 4 b) 1 1 1 = 4 6 3 = 5 = 5 3 4 1 1 1 1 1 K a) Koska 3 = 9 < 10, niin 3 10 < 0. 3 10 = (3 10 ) = 10 3 b) Koska π 3,14, niin π
K1 Tekijä Pitkä matematiikka 5 7..017 a) 1 1 + 1 = 4 + 1 = 3 = 3 4 4 4 4 4 4 b) 1 1 1 = 4 6 3 = 5 = 5 3 4 1 1 1 1 1 K a) Koska 3 = 9 < 10, niin 3 10 < 0. 3 10 = (3 10 ) = 10 3 b) Koska π 3,14, niin π
Kemian syventävät kurssit
 Kemian syventävät kurssit KE2 Kemian mikromaailma aineen rakenteen ja ominaisuuksien selittäminen KE3 Reaktiot ja energia laskuja ja reaktiotyyppejä KE4 Metallit ja materiaalit sähkökemiaa: esimerkiksi
Kemian syventävät kurssit KE2 Kemian mikromaailma aineen rakenteen ja ominaisuuksien selittäminen KE3 Reaktiot ja energia laskuja ja reaktiotyyppejä KE4 Metallit ja materiaalit sähkökemiaa: esimerkiksi
DEE-11110 Sähkötekniikan perusteet
 DEE-11110 Sähkötekniikan perusteet Antti Stenvall Peruskäsitteet Luennon keskeinen termistö ja tavoitteet sähkövaraus teho ja energia potentiaali ja jännite sähkövirta Tarkoitus on määritellä sähkötekniikan
DEE-11110 Sähkötekniikan perusteet Antti Stenvall Peruskäsitteet Luennon keskeinen termistö ja tavoitteet sähkövaraus teho ja energia potentiaali ja jännite sähkövirta Tarkoitus on määritellä sähkötekniikan
d) Klooria valmistetaan hapettamalla vetykloridia kaliumpermanganaatilla. (Syntyy Mn 2+ -ioneja)
 Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Helsingin yliopiston kemian valintakoe: Mallivastaukset. Maanantaina 29.5.2017 klo 14-17 1 Avogadron vakio NA = 6,022 10 23 mol -1 Yleinen kaasuvakio R = 8,314 J mol -1 K -1 = 0,08314 bar dm 3 mol -1 K
Tilat ja observaabelit
 Tilat ja observaabelit Maksimaalinen informaatio systeemistä tietyllä ajanhetkellä sisältyy tilaan ψ (ket). Tila = vektori Hilbertin avaruudessa sisätulo ψ ψ C ψ c 1 ψ 1 + c 2 ψ 2 = c 1 ψ ψ 1 + c 2 ψ ψ
Tilat ja observaabelit Maksimaalinen informaatio systeemistä tietyllä ajanhetkellä sisältyy tilaan ψ (ket). Tila = vektori Hilbertin avaruudessa sisätulo ψ ψ C ψ c 1 ψ 1 + c 2 ψ 2 = c 1 ψ ψ 1 + c 2 ψ ψ
Yhtälöryhmä matriisimuodossa. MS-A0004/A0006 Matriisilaskenta. Tarkastellaan esimerkkinä lineaarista yhtälöparia. 2x1 x 2 = 1 x 1 + x 2 = 5.
 2. MS-A4/A6 Matriisilaskenta 2. Nuutti Hyvönen, c Riikka Kangaslampi Matematiikan ja systeemianalyysin laitos Aalto-yliopisto 5.9.25 Tarkastellaan esimerkkinä lineaarista yhtälöparia { 2x x 2 = x + x 2
2. MS-A4/A6 Matriisilaskenta 2. Nuutti Hyvönen, c Riikka Kangaslampi Matematiikan ja systeemianalyysin laitos Aalto-yliopisto 5.9.25 Tarkastellaan esimerkkinä lineaarista yhtälöparia { 2x x 2 = x + x 2
yleisessä muodossa x y ax by c 0. 6p
 MAA..0 Muista kirjoittaa jokaiseen paperiin nimesi! Tee vastauspaperin yläreunaan pisteytysruudukko! Valitse kuusi tehtävää! Perustele vastauksesi välivaiheilla! Jussi Tyni Ratkaise: a) x x b) xy x 6y
MAA..0 Muista kirjoittaa jokaiseen paperiin nimesi! Tee vastauspaperin yläreunaan pisteytysruudukko! Valitse kuusi tehtävää! Perustele vastauksesi välivaiheilla! Jussi Tyni Ratkaise: a) x x b) xy x 6y
S-114.1327 Fysiikka III (Est, 6,0 op) Viikko 11
 S-114.1327 Fysiikka III (Est, 6,0 op) LUENTOSUUNNITELMA KEVÄT 2007, 2. PUOLILUKUKAUSI Toisen puolilukukauden aikana käydään läpi keskeiset kohdat Kvanttifysiikan opetusmonisteen luvuista 3-7. Laskuharjoituksia
S-114.1327 Fysiikka III (Est, 6,0 op) LUENTOSUUNNITELMA KEVÄT 2007, 2. PUOLILUKUKAUSI Toisen puolilukukauden aikana käydään läpi keskeiset kohdat Kvanttifysiikan opetusmonisteen luvuista 3-7. Laskuharjoituksia
Esimerkki: 2- atominen molekyyli. Korkeammat derivaatat 1/24/13. Jo kerran derivoitu funk6o voidaan derivoida uudelleen. Yleisemmin merkitään:
 Korkeammat erivaatat Jo kerran erivoitu funk6o voiaan erivoia uuelleen.! f(x) x " # x % & = 2 f(x) = f''(x) = f (2) (x) x 2 Yleisemmin merkitään: n f(x) = f (n) (x) x n erkki: 2- atominen molekyyli Värähtelevän
Korkeammat erivaatat Jo kerran erivoitu funk6o voiaan erivoia uuelleen.! f(x) x " # x % & = 2 f(x) = f''(x) = f (2) (x) x 2 Yleisemmin merkitään: n f(x) = f (n) (x) x n erkki: 2- atominen molekyyli Värähtelevän
VIELÄ KÄYTÄNNÖN ASIAA
 VIELÄ KÄYTÄNNÖN ASIAA Kurssin luentomuis8inpanot (ja tulevat laskarimallit) näkyvät vain kun olet kirjautunut sisään ja rekisteröitynyt kurssille WebOodin kauga Kurssi seuraa oppikirjaa kohtuullisen tarkkaan,
VIELÄ KÄYTÄNNÖN ASIAA Kurssin luentomuis8inpanot (ja tulevat laskarimallit) näkyvät vain kun olet kirjautunut sisään ja rekisteröitynyt kurssille WebOodin kauga Kurssi seuraa oppikirjaa kohtuullisen tarkkaan,
Kertaus. x x x. K1. a) b) x 5 x 6 = x 5 6 = x 1 = 1 x, x 0. K2. a) a a a a, a > 0
 Juuri 8 Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty 8.9.07 Kertaus K. a) 6 4 64 0, 0 0 0 0 b) 5 6 = 5 6 = =, 0 c) d) K. a) b) c) d) 4 4 4 7 4 ( ) 7 7 7 7 87 56 7 7 7 6 6 a a a, a > 0 6 6 a
Juuri 8 Tehtävien ratkaisut Kustannusosakeyhtiö Otava päivitetty 8.9.07 Kertaus K. a) 6 4 64 0, 0 0 0 0 b) 5 6 = 5 6 = =, 0 c) d) K. a) b) c) d) 4 4 4 7 4 ( ) 7 7 7 7 87 56 7 7 7 6 6 a a a, a > 0 6 6 a
Coulombin laki. Sähkökentän E voimakkuus E = F q
 Coulombin laki Kahden pistemäisen varatun hiukkasen välinen sähköinen voima F on suoraan verrannollinen varausten Q 1 ja Q 2 tuloon ja kääntäen verrannollinen etäisyyden r neliöön F = k Q 1Q 2 r 2, k =
Coulombin laki Kahden pistemäisen varatun hiukkasen välinen sähköinen voima F on suoraan verrannollinen varausten Q 1 ja Q 2 tuloon ja kääntäen verrannollinen etäisyyden r neliöön F = k Q 1Q 2 r 2, k =
