Pakkausseloste: Tietoa käyttäjälle. gestodeeni/etinyyliestradioli
|
|
|
- Pirkko Lahtinen
- 7 vuotta sitten
- Katselukertoja:
Transkriptio
1 Pakkausseloste: Tietoa käyttäjälle Lisvy 60 mikrog/24 tuntia + 13 mikrog/24 tuntia depotlaastari gestodeeni/etinyyliestradioli Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Ks. kohdan 4 lopusta, miten haittavaikutuksista ilmoitetaan. Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista palautuvista raskaudenehkäisykeinoista. Ne hieman lisäävät laskimo- ja valtimoveritulppien riskiä erityisesti ensimmäisen käyttövuoden aikana tai kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään neljän viikon tauon jälkeen. Tarkkaile vointiasi ja mene lääkäriin, jos arvelet, että sinulla saattaa olla veritulpan oireita (ks. kohta 2 Veritulpat ). Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille. Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta 4. Tässä pakkausselosteessa kerrotaan: 1. Mitä Lisvy on ja mihin sitä käytetään Mitä sinun on tiedettävä, ennen kuin käytät Lisvy-valmistetta...2 Älä käytä Lisvy-valmistetta...2 Varoitukset ja varotoimet...3 VERITULPAT...4 Yhdistelmäehkäisyvalmisteet ja syöpä...7 Verenvuoto kuukautisten välillä...8 Mitä teet, jos kuukautisvuotoa ei tule...8 Lapset ja nuoret...8 Muut lääkevalmisteet ja Lisvy...8 Laboratoriokokeet...9 Lisvy ruuan, juoman ja alkoholin kanssa...9 Raskaus ja imetys...9 Ajaminen ja koneiden käyttö Miten Lisvy-valmistetta käytetään...9 Milloin Lisvy-valmisteen käytön voi aloittaa...9 Keskenmenon jälkeen Lapsen saannin jälkeen Mihin laastari kiinnitetään Mitä sait apteekista Laastarin valmistelu kiinnitystä varten Käyttöohjeet jakson aikana Laastarinvaihtopäivä Laastarittomat päivät Muistutuskortti ja muistutustarrat Jos käytät enemmän Lisvy-valmistetta kuin sinun pitäisi Jos unohdat käyttää Lisvy-valmistetta
2 Mitä tehdä, jos iho ärtyy Miten vaihdat laastarinvaihtopäiväksi jonkin toisen päivän Mitä tehdä, jos oksennat tai sinulla on vaikeaa ripulia Jos lopetat Lisvy-valmisteen käytön Mahdolliset haittavaikutukset Vakavat haittavaikutukset Lisvy-valmisteen käyttäjillä on ilmoitettu seuraavia haittavaikutuksia Tiettyjen haittavaikutusten kuvaus Haittavaikutuksista ilmoittaminen Lisvy-valmisteen säilyttäminen Laastareiden hävittäminen ja muut käsittelyohjeet Pakkauksen sisältö ja muuta tietoa Mitä Lisvy sisältää Lääkevalmisteen kuvaus ja pakkauskoot Myyntiluvan haltija ja valmistaja Muut tiedonlähteet Mitä Lisvy on ja mihin sitä käytetään Lisvy on laastari, jota käytetään raskauden ehkäisyyn. Yksi laastari sisältää kahta eri naishormonia, gestodeenia ja etinyyliestradiolia. Näitä imeytyy laastarista ihoon jatkuvasti pieninä määrinä seitsemän vuorokauden ajan. Koska Lisvy sisältää kahden hormonin yhdistelmää, se kuuluu yhdistelmäehkäisyvalmisteiden ryhmään. 2. Mitä sinun on tiedettävä, ennen kuin käytät Lisvy-valmistetta Yleistä Ennen kuin aloitat Lisvy-valmisteen käyttämisen, lue veritulppia koskevat tiedot kohdasta 2. On erityisen tärkeää, että luet veritulpan oireita kuvaavan kohdan ks. kohta 2 Veritulpat ). Ennen kuin voit aloittaa Lisvy-valmisteen käyttämisen, lääkäri kysyy sinulta muutamia omaan ja lähisukulaistesi terveyteen liittyviä kysymyksiä. Lääkäri mittaa verenpaineesi ja saattaa terveystilanteesi mukaan myös määrätä joitakin kokeita. Tässä selosteessa kuvataan useita tilanteita, joissa sinun täytyy lopettaa Lisvy-valmisteen käyttäminen tai joissa Lisvy-valmisteen luotettavuus voi olla alentunut. Näissä tilanteissa sinun on joko pidättäydyttävä sukupuoliyhteydestä tai käytettävä lisäksi ei-hormonaalisia ehkäisymenetelmiä, esimerkiksi kondomia tai muuta estemenetelmää. Älä käytä "varmat päivät"- tai lämpötilamenetelmiä. Nämä menetelmät voivat olla epäluotettavia, koska Lisvy vaikuttaa kehon lämpötilan ja kohdunkaulan limakalvon kuukausittaiseen muuttumiseen. Kuten muutkaan hormonaaliset ehkäisyvalmisteet, Lisvy-valmistekaan ei suojaa HIV-infektiolta (AIDS) eikä muilta sukupuoliteitse tarttuvilta taudeilta. Älä käytä Lisvy-valmistetta Älä käytä Lisvy-valmistetta, jos sinulla on jokin alla mainituista tiloista. Jos sinulla on jokin alla mainituista tiloista, sinun on kerrottava siitä lääkärille. Lääkäri keskustelee kanssasi muista, sinulle paremmin soveltuvista ehkäisymenetelmistä: jos sinulla on (tai on joskus ollut) veritulppa jalkojen verisuonessa (syvä laskimotukos, SLT), keuhkoissa (keuhkoembolia) tai muualla elimistössä 2
3 jos tiedät, että sinulla on jokin veren hyytymiseen vaikuttava sairaus esimerkiksi C-proteiinin puutos, S-proteiinin puutos, antitrombiini III:n puutos, Faktori V Leiden tai fosfolipidivastaaineita joudut leikkaukseen tai joudut olemaan vuodelevossa pitkän aikaa (ks. kohta Veritulpat ) jos sinulla on joskus ollut sydänkohtaus tai aivohalvaus jos sinulla on (tai on joskus ollut) angina pectoris (vaiva, joka aiheuttaa voimakasta rintakipua ja joka voi olla sydänkohtauksen ensimmäinen merkki) tai ohimenevä aivoverenkiertohäiriö (TIA ohimenevän aivohalvauksen oireita) jos sinulla on jokin seuraavista sairauksista, jotka saattavat lisätä tukosriskiä valtimoissasi: o vaikea diabetes, johon liittyy verisuonivaurioita o erittäin korkea verenpaine o erittäin korkea veren rasvapitoisuus (kolesteroli tai triglyseridit) o sairaus nimeltä hyperhomokysteinemia jos sinulla on (tai on joskus ollut) niin sanottu aurallinen migreeni jos sinulla on (tai on joskus ollut) maksasairaus (jonka oireita voivat olla ihon keltaisuus tai kutina joka puolella kehoa) eikä maksasi vieläkään toimi normaalisti jos sinulla on (tai on joskus ollut) syöpä, johon sukupuolihormonit vaikuttavat (esim. rinta- tai sukupuolielinten syöpä) jos sinulla on (tai on joskus ollut) hyvän- tai pahanlaatuinen maksakasvain jos sinulla on selittämätöntä verenvuotoa emättimestä jos olet allerginen etinyyliestradiolille, gestodeenille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6). Tämä voi aiheuttaa esimerkiksi kutinaa, ihottumaa tai turvotusta. Jos jokin näistä sairauksista tai vaivoista ilmenee ensimmäisen kerran Lisvy-valmisteen käytön yhteydessä, ota laastari heti pois, lopeta valmisteen käyttö ja kysy neuvoa lääkäriltä. Siirry väliaikaisesti käyttämään ei-hormonaalisia ehkäisymenetelmiä. Katso myös edellä oleva kohta 2 Yleistä. Varoitukset ja varotoimet Milloin sinun pitää ottaa yhteyttä lääkäriin? Hakeudu välittömästi lääkärin hoitoon jos huomaat mahdollisia veritulpan oireita, jotka saattavat merkitä, että sinulla on veritulppa jalassa (ts. syvä laskimotukos), veritulppa keuhkoissa (ts. keuhkoembolia), sydänkohtaus tai aivohalvaus (ks. kohta Veritulpat alempana). Näiden vakavien haittavaikutusten kuvaukset löydät kohdasta Miten tunnistan veritulpan. Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Lisvyvalmistetta. Joissakin tilanteissa sinun on oltava erityisen varovainen käyttäessäsi Lisvy-valmistetta tai jotain muuta yhdistelmäehkäisyvalmistetta, ja lääkärin on ehkä tutkittava sinut säännöllisesti. Kerro lääkärille, jos jokin seuraavista tiloista koskee sinua Kerro lääkärille myös, jos jokin näistä tiloista ilmaantuu tai pahenee sinä aikana, kun käytät Lisvyvalmistetta: jos tupakoit jos sinulla on diabetes jos olet ylipainoinen jos sinulla on korkea verenpaine jos sinulla on jokin sydänsairaus (läppävika tai rytmihäiriö) jos jollakin lähisukulaisellasi on joskus ollut veritulppa (jalassa, keuhkoissa [keuhkoembolia] tai muualla), sydänkohtaus tai aivohalvaus nuorella iällä jos sairastat migreeniä 3
4 jos sairastat epilepsiaa (ks. kohta 2 Muut lääkevalmisteet ja Lisvy ) jos lähisukulaisellasi on (tai on joskus ollut) rintasyöpä jos sinulla on jokin maksan tai sappirakon sairaus jos sinulla on masennusta jos sinulla on Crohnin tauti tai haavainen paksusuolentulehdus (krooninen tulehduksellinen suolistosairaus) jos sinulla on systeeminen lupus erythematosus (SLE immuunijärjestelmään vaikuttava sairaus) jos sinulla on hemolyyttis-ureeminen oireyhtymä (HUS munuaisten vajaatoimintaa aiheuttava veren hyytymishäiriö) jos sinulla on sirppisoluanemia (perinnöllinen, punasoluihin liittyvä sairaus) jos sinulla on suurentunut veren rasva-arvo (hypertriglyseridemia) tai jos tätä tilaa on esiintynyt suvussasi. Hypertriglyseridemiaan on liitetty suurentunut haimatulehduksen (pankreatiitin) kehittymisen riski. jos joudut leikkaukseen tai joudut olemaan vuodelevossa pitkän aikaa (ks. kohta Veritulpat ) jos olet äskettäin synnyttänyt, sinulla on suurentunut veritulppariski. Kysy lääkäriltä, kuinka pian synnytyksen jälkeen voit aloittaa Lisvy-valmisteen käytön. jos sinulla on ihonalainen verisuonitulehdus (pinnallinen laskimontukkotulehdus) jos sinulla on suonikohjuja jos sinulla on jokin sairaus, joka ilmeni ensimmäisen kerran tai paheni raskauden aikana tai kun aiemmin käytit sukupuolihormoneita (esim. kuulon menetys, porfyria-niminen aineenvaihduntasairaus, raskausrokahtuma-niminen ihosairaus (herpes gestationis) tai äkillisiä liikkeitä kehossa aiheuttava hermostosairaus nimeltä Sydenhamin tauti (Sydenhamin korea) jos sinulla on (tai on joskus ollut) kullanruskeita pigmenttiläiskiä (ns. raskaudenaikaisia maksaläiskiä), varsinkin kasvoilla (kloasma). Jos sinulla on näitä, vältä altistumista suoralle auringonvalolle tai ultraviolettivalolle. jos sinulla on perinnöllinen angioedeema. Ota välittömästi yhteys lääkäriin, jos sinulle tulee angioedeeman oireita. Näitä ovat mm. kasvojen, kielen tai kurkun turvotus ja/tai nielemisvaikeudet tai nokkosihottuma yhdessä hengitysvaikeuksien kanssa. Estrogeeneja sisältävät valmisteet voivat aiheuttaa tai pahentaa angioedeeman oireita. VERITULPAT Yhdistelmäehkäisyvalmisteen, kuten esimerkiksi Lisvy-valmisteen, käyttö lisää riskiäsi saada veritulppa verrattuna niihin, jotka eivät käytä tällaista valmistetta. Harvinaisissa tapauksissa veritulppa voi tukkia verisuonia ja aiheuttaa vakavia haittoja. Veritulppia voi kehittyä: laskimoihin (tällöin puhutaan laskimoveritulpasta, laskimotromboemboliasta tai VTE:stä) valtimoihin (tällöin puhutaan valtimoveritulpasta, valtimotromboemboliasta tai ATE:stä) Veritulpista ei aina toivu täydellisesti. Harvinaisissa tapauksissa voi ilmetä vakavia, pysyviä vaikutuksia, ja erittäin harvoin ne voivat johtaa kuolemaan. On tärkeää muistaa, että kokonaisriski saada vahingollinen veritulppa Lisvy-valmisteen käytön vuoksi on pieni. MITEN TUNNISTAT VERITULPAN Hakeudu välittömästi lääkärin hoitoon, jos huomaat jonkin seuraavista oireista tai merkeistä. Onko sinulla jokin näistä merkeistä? toisen jalan turvotus tai laskimon myötäinen turvotus jalassa, varsinkin kun siihen liittyy: o kivun tai arkuuden tunne jalassa, mikä saattaa tuntua ainoastaan Mikä sairaus sinulla mahdollisesti on? Syvä laskimoveritulppa 4
5 o o seistessä tai kävellessä lisääntynyt lämmöntunne samassa jalassa jalan ihon värin muuttuminen esim. kalpeaksi, punaiseksi tai sinertäväksi äkillinen selittämätön hengenahdistus tai nopea hengitys äkillinen yskä ilman selvää syytä; yskän mukana voi tulla veriysköksiä pistävä rintakipu, joka voi voimistua syvään hengitettäessä vaikea pyörrytys tai huimaus nopea tai epäsäännöllinen sydämen syke vaikea vatsakipu Keuhkoembolia (keuhkoveritulppa) Jos olet epävarma, keskustele lääkärin kanssa, sillä jotkin näistä oireista (esim. yskä ja hengenahdistus) voidaan sekoittaa lievempiin sairauksiin kuten hengitystieinfektioon (esim. tavalliseen flunssaan). Oireita esiintyy yleensä yhdessä silmässä: välitön näön menetys tai kivuton näön hämärtyminen, mikä voi edetä näön menetykseen Verkkokalvon laskimotukos (veritulppa silmässä) rintakipu, epämiellyttävä olo, paineen tunne, painon tunne puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana täysinäisyyden tunne, ruoansulatushäiriöt tai tukehtumisen tunne ylävartalossa epämiellyttävä olo, joka säteilee selkään, leukaan, kurkkuun, käsivarteen ja vatsaan hikoilu, pahoinvointi, oksentelu tai huimaus erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus nopea tai epäsäännöllinen sydämen syke äkillinen kasvojen, käsivarsien tai jalkojen tunnottomuus tai heikkous, varsinkin vartalon yhdellä puolella äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet äkillinen näön heikentyminen joko toisessa tai molemmissa silmissä äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaatiokyvyn menetys äkillinen, vaikea tai pitkittynyt päänsärky, jolle ei tiedetä syytä tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus. Sydänkohtaus Aivohalvaus Joskus aivohalvauksen oireet voivat olla lyhytkestoisia ja niistä toipuminen lähes välitöntä ja täydellistä. Sinun pitää silti hakeutua välittömästi lääkäriin, koska vaarana voi olla toinen aivohalvaus. raajan turvotus ja lievä sinerrys voimakas vatsakipu (akuutti vatsa). Muita verisuonia tukkivat veritulpat LASKIMOVERITULPAT Mitä voi tapahtua, jos laskimoon kehittyy veritulppa? Yhdistelmäehkäisyvalmisteiden käyttöön on liitetty laskimoveritulppien (laskimotromboosien) lisääntynyt riski. Nämä haittavaikutukset ovat kuitenkin harvinaisia. Useimmin niitä esiintyy yhdistelmäehkäisyvalmisteen ensimmäisen käyttövuoden aikana. 5
6 Jos jalan laskimossa kehittyy verihyytymä, se voi aiheuttaa syvän laskimotukoksen (SLT). Jos hyytymä lähtee liikkeelle jalasta ja asettuu keuhkoihin, se voi saada aikaan keuhkoveritulpan (keuhkoembolia). Hyvin harvoin tällainen hyytymä voi kehittyä jonkin toisen elimen laskimoon, esim. silmään (verkkokalvon laskimoveritulppa). Milloin laskimoveritulpan kehittymisen riski on suurin? Laskimoveritulpan kehittymisen riski on suurimmillaan ensimmäisen vuoden aikana, kun käytät yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässäsi. Riski voi olla suurempi myös silloin, jos aloitat yhdistelmäehkäisyvalmisteen käyttämisen uudelleen (sama valmiste tai eri valmiste) vähintään 4 viikon tauon jälkeen. Ensimmäisen vuoden jälkeen riski pienenee, mutta se on aina hieman suurempi kuin silloin, kun yhdistelmäehkäisyvalmistetta ei käytetä. Kun lopetat Lisvy-valmisteen käytön, veritulppariski palautuu normaalille tasolle muutaman viikon kuluessa. Kuinka suuri veritulpan kehittymisen riski on? Tämä riski riippuu yksilöllisestä veritulppariskistäsi ja käyttämäsi yhdistelmäehkäisyvalmisteen tyypistä. Riski veritulpan kehittymiselle jalkaan (syvä laskimotukos) tai keuhkoihin (keuhkoveritulppa) on kaiken kaikkiaan pieni Lisvy-valmistetta käytettäessä. Noin kahdelle naiselle :sta, jotka eivät käytä mitään yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy veritulppa vuoden aikana. Noin 5 7 naiselle :sta, jotka käyttävät levonorgestreelia tai noretisteronia tai norgestimaattia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy veritulppa vuoden aikana. Noin 9 12 naiselle :sta, jotka käyttävät gestodeenia sisältävää yhdistelmäehkäisytablettia, kehittyy veritulppa vuoden aikana. Vielä ei tiedetä, millainen Lisvy-valmisteen käyttöön liittyvä veritulpan riski on verrattuna levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden ja gestodeenia sisältävien yhdistelmäehkäisytablettien riskiin. Veritulppariski vaihtelee oman sairaushistoriasi mukaan (ks. jäljempää kohta Tekijöitä, jotka lisäävät riskiäsi saada laskimoveritulppa ). Naiset, jotka eivät käytä mitään yhdistelmäehkäisytablettia/-laastaria/-rengasta eivätkä ole raskaana Naiset, jotka käyttävät levonorgestreelia, noretisteronia tai norgestimaattia sisältävää yhdistelmäehkäisyvalmistetta Naiset, jotka käyttävät gestodeenia sisältävää yhdistelmäehkäisytablettia Veritulpan kehittymisen riski vuoden aikana Noin 2 naista :sta Noin 5 7 naista :sta Noin 9 12 naista :sta Tekijöitä, jotka lisäävät riskiäsi saada laskimoveritulppa Veritulpan riski on Lisvy-valmistetta käytettäessä pieni, mutta jotkin tilat tai sairaudet suurentavat riskiä. Riskisi on suurempi: jos olet merkittävästi ylipainoinen (painoindeksi eli BMI yli 30 kg/m 2 ); jos jollakin lähisukulaisellasi on ollut veritulppa jalassa, keuhkoissa tai muussa elimessä nuorella iällä (esim. alle 50-vuotiaana). Tässä tapauksessa sinulla saattaa olla perinnöllinen veren hyytymishäiriö. jos joudut leikkaukseen tai jos joudut olemaan vuodelevossa pitkään jonkin vamman tai sairauden takia, tai jos sinulla on jalassa kipsi. Lisvy-valmisteen käyttö on ehkä lopetettava muutamaa viikkoa ennen leikkausta tai sitä aikaa, jolloin et pääse juurikaan liikkumaan. Jos 6
7 sinun täytyy lopettaa Lisvy-valmisteen käyttö, kysy lääkäriltä, milloin voit aloittaa käytön uudelleen. iän myötä (erityisesti yli 35-vuotiailla) jos olet synnyttänyt muutaman viikon sisällä. Veritulpan kehittymisen riski suurenee sen myötä, mitä enemmän erilaisia sairauksia tai tiloja sinulla on. Lentomatka (> 4 tuntia) saattaa väliaikaisesti lisätä veritulpan riskiä, erityisesti jos sinulla on jokin toinen luettelossa mainittu riskitekijä. On tärkeää kertoa lääkärille, jos jokin näistä tiloista koskee sinua, myös vaikka olisit epävarma asiasta. Lääkäri saattaa päättää, että sinun on lopetettava Lisvy-valmisteen käyttö. Kerro lääkärille, jos jokin yllä olevista tiloista muuttuu sinä aikana, kun käytät Lisvy-valmistetta, esimerkiksi lähisukulaisella todetaan verisuonitukos, jonka syytä ei tiedetä, tai painosi lisääntyy huomattavasti. VALTIMOVERITULPAT Mitä voi tapahtua, jos valtimoon kehittyy veritulppa? Laskimoveritulpan tavoin valtimoonkin kehittynyt veritulppa voi aiheuttaa vakavia ongelmia. Se voi esimerkiksi aiheuttaa sydänkohtauksen tai aivohalvauksen. Tekijöitä, jotka lisäävät riskiäsi saada valtimoveritulppa On tärkeää huomata, että Lisvy-valmisteen käyttämisestä johtuvan sydänkohtauksen tai aivohalvauksen riski on hyvin pieni, mutta se voi suurentua: iän myötä (noin 35 ikävuoden jälkeen) jos tupakoit. Kun käytät yhdistelmäehkäisyvalmistetta, kuten esimerkiksi Lisvy-valmistetta, tupakoinnin lopettaminen on suositeltavaa. Jos et pysty lopettamaan tupakointia ja olet yli 35- vuotias, lääkäri saattaa kehottaa sinua käyttämään muun tyyppistä raskaudenehkäisyä. jos olet ylipainoinen jos sinulla on korkea verenpaine jos jollakin lähisukulaisellasi on ollut sydänkohtaus tai aivohalvaus nuorella iällä (alle 50-vuotiaana). Tässä tapauksessa myös sinulla voi olla suurempi sydänkohtauksen tai aivohalvauksen riski. jos sinulla tai jollakin lähisukulaisellasi on korkea veren rasvapitoisuus (kolesteroli tai triglyseridit) jos sinulla on migreenikohtauksia, erityisesti aurallisia jos sinulla on jokin sydänsairaus (läppävika tai rytmihäiriö, jota kutsutaan eteisvärinäksi) jos sinulla on diabetes. Jos yllämainituista tiloista useampi kuin yksi koskee sinua, tai jos yksikin niistä on erityisen vaikea, veritulpan kehittymisen riski voi olla vieläkin suurempi. Kerro lääkärille, jos jokin yllä olevista tiloista muuttuu sinä aikana, kun käytät Lisvy-valmistetta, esimerkiksi aloitat tupakoinnin, lähisukulaisella todetaan verisuonitukos, jonka syytä ei tiedetä, tai painosi lisääntyy huomattavasti. Yhdistelmäehkäisyvalmisteet ja syöpä Naisilla, jotka käyttävät hormonaalisia yhdistelmäehkäisyvalmisteita, on todettu rintasyöpää hieman useammin kuin niitä käyttämättömillä, mutta ei tiedetä, johtuuko tämä itse hoidosta. Saattaa esimerkiksi olla, että yhdistelmäehkäisyvalmisteita käyttävillä naisilla todetaan enemmän kasvaimia siksi, että he käyvät useammin lääkärintarkastuksissa. Rintasyöpäriski pienenee vähitellen sen jälkeen, kun yhdistelmäehkäisyvalmisteen käyttö on lopetettu. On tärkeää, että tutkit rintasi säännöllisesti. Jos havaitset kyhmyn, ota yhteys lääkäriin. 7
8 Harvinaisissa tapauksissa yhdistelmäehkäisyvalmisteiden käyttäjillä on ilmoitettu hyvänlaatuisia maksakasvaimia. Vieläkin harvinaisemmissa tapauksissa käyttäjillä on ilmoitettu pahanlaatuisia maksakasvaimia. Nämä kasvaimet ovat yksittäistapauksissa johtaneet hengenvaaralliseen sisäiseen verenvuotoon. Jos sinulla on epätavallisen voimakasta vatsakipua, ota yhteyttä lääkäriin. Kohdunkaulan syövän merkittävin riskitekijä on ihmisen papilloomaviruksen (HPV) aiheuttama pitkäaikainen infektio. Jotkin tutkimukset viittaavat siihen, että pitkäaikainen yhdistelmäehkäisyvalmisteiden käyttö lisää kohdunkaulasyövän riskiä. Ei kuitenkaan ole selvää, missä määrin seksuaalikäyttäytyminen tai muut tekijät, kuten esimerkiksi ihmisen papilloomavirus, lisäävät tätä riskiä. Verenvuoto kuukautisten välillä Kaikkien yhdistelmäehkäisyvalmisteiden käytön yhteydessä voi kuukautisten välillä esiintyä epäsäännöllistä verenvuotoa emättimestä (tiputtelua tai läpäisyvuotoa) muutaman ensimmäisen kuukauden ajan. Saatat joutua käyttämään kuukautissuojia, mutta jatka Lisvy-valmisteen käyttöä normaalisti. Yleensä epäsäännöllinen verenvuoto emättimestä loppuu elimistösi sopeuduttua Lisvy-valmisteeseen (yleensä noin kolmen kuukautiskierron jälkeen). Jos vuoto jatkuu, muuttuu runsaaksi tai jatkuu tauon jälkeen, kerro asiasta lääkärille. Mitä tehdä, jos kuukautisvuotoa ei tule Jos olet käyttänyt Lisvy-valmistetta oikein etkä ole ottanut muita lääkkeitä, on erittäin epätodennäköistä, että olisit raskaana. Jatka Lisvy-valmisteen käyttöä normaalisti. Jos olet käyttänyt Lisvy-valmistetta väärin, tai jos olet käyttänyt sitä oikein mutta odotettu vuoto jää puuttumaan kahdesti peräkkäin, saatat olla raskaana. Ota heti yhteys lääkäriin. Älä aloita seuraavan laastarin käyttöä ennen kuin olet varma, ettet ole raskaana. Siirry väliaikaisesti käyttämään eihormonaalisia ehkäisymenetelmiä. Katso myös edellä oleva kohta 2 Yleistä. Lapset ja nuoret Lisvy-valmisteen turvallisuutta ja tehoa ei ole osoitettu alle 18-vuotiailla nuorilla. Muut lääkevalmisteet ja Lisvy Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä tai rohdosvalmisteita, myös lääkkeitä, joita lääkäri ei ole määrännyt. Kerro myös jotain muuta lääkettä sinulle määräävälle lääkärille tai hammaslääkärille (tai apteekissa henkilölle, jolta sait tämän muun lääkkeen), että käytät Lisvy-valmistetta. He osaavat kertoa sinulle, pitääkö sinun käyttää lisäehkäisyä (esimerkiksi kondomia) ja jos pitää, miten kauan, tai onko toisen tarvitsemasi lääkkeen käyttöä muutettava. Jotkin lääkevalmisteet voivat vaikuttaa Lisvy-valmisteen lääkeainepitoisuuksiin veressä ja voivat vähentää sen ehkäisytehoa tai voivat aiheuttaa odottamatonta verenvuotoa. Näitä ovat mm.: lääkkeet, joita käytetään seuraavien sairauksien hoitoon: o epilepsia (esim. primidoni, fenytoiini, barbituraatit, karbamatsepiini, okskarbatsepiini, eslikarbatsepiini, topiramaatti, felbamaatti) o tuberkuloosi (esim. rifampisiini, rifabutiini) o narkolepsia-niminen unihäiriö (modafiniili) o keuhkoverisuonten korkea verenpaine (bosentaani) o HIV- ja hepatiitti C -virusinfektiot (nk. proteaasin estäjät ja ei-nukleosidiset käänteiskopioijaentsyymin estäjät), muut infektiot (griseofulviini) 8
9 mäkikuisma (rohdosvalmiste). Yhdistelmäehkäisyvalmisteet saattavat vaikuttaa muiden lääkkeiden tehoon. Tällainen lääke on esim. epilepsialääke lamotrigiini. Laboratoriokokeet Jos sinulta pitää ottaa verikoe tai muita laboratoriokokeita, kerro lääkärille tai näytteenottajalle, että käytät Lisvy-valmistetta. Hormonaaliset ehkäisyvalmisteet voivat nimittäin vaikuttaa joidenkin kokeiden tuloksiin. Lisvy ruuan, juoman ja alkoholin kanssa Ruuan, juoman tai alkoholin ei odoteta vaikuttavan Lisvy-valmisteen vaikutustapaan. Raskaus ja imetys Älä käytä Lisvy-valmistetta, jos olet raskaana tai jos epäilet olevasi raskaana. Jos tulet raskaaksi Lisvy-valmisteen käytön aikana, poista laastari välittömästi ja ota heti yhteys sinua hoitavaan lääkäriin. Jos haluat tulla raskaaksi, voit lopettaa Lisvy-valmisteen käytön milloin tahansa (ks. myös kohta 3, Jos lopetat Lisvy-valmisteen käytön ). Lisvy-valmistetta ei yleensä suositella käytettäväksi imetyksen aikana. Jos haluat käyttää Lisvyvalmistetta imetyksen aikana, ota yhteys lääkäriin. Ajaminen ja koneiden käyttö Voit ajaa ja käyttää koneita Lisvy-valmisteen käytön aikana. 3. Miten Lisvy-valmistetta käytetään Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Lisvy estää sinua tulemasta raskaaksi siirtämällä hormoneita elimistöösi ihosi läpi. Laastarin on oltava hyvin kiinni ihossasi, jotta se toimisi kunnolla. Lisvy-valmisteen teho riippuu siitä, kuinka hyvin noudatat laastarin käyttöohjeita. Mitä tarkemmin noudatat ohjeita, sitä pienempi riski sinulla on tulla raskaaksi. Käytä sen vuoksi Lisvy-valmistetta aina juuri siten kuin tässä pakkausselosteessa on kuvattu. Jos et noudata näitä ohjeita, riskisi tulla raskaaksi saattaa suurentua. Milloin Lisvy-valmisteen käytön voi aloittaa Merkitse ylös se viikonpäivä, jolloin asetat ensimmäisen laastarin ihollesi. Tästä viikonpäivästä tulee jokaviikkoinen laastarinvaihtopäiväsi (ks. jäljempänä kohta 3 Laastarinvaihtopäivä ). Noudata Lisvy-valmisteen käytön aloittamista tai siihen vaihtamista koskevia sääntöjä valitsemalla edellisessä kuussa käyttämäsi ehkäisymenetelmä alla olevan taulukon vasemmasta sarakkeesta. 9
10 Lisvy-valmisteen käytön aloittamista tai siihen vaihtamista koskevat säännöt Edellisessä kuussa käytetty ehkäisymenetelmä Ei hormonaalista ehkäisyä Lisvy-valmisteen käytön aloittamista tai siihen vaihtamista koskevat säännöt Aloita Lisvy-valmisteen käyttäminen kuukautiskiertosi ensimmäisenä päivänä (kuukautistesi ensimmäisenä päivänä). Lisvy alkaa vaikuttaa heti, eikä mitään lisäehkäisymenetelmiä tarvitse käyttää. Voit aloittaa laastarin käytön myös kuukautiskiertosi päivinä 2 5, mutta tällöin sinun on ehdottomasti käytettävä myös jotain toista ehkäisymenetelmää (esim. kondomia) ensimmäisten seitsemän laastarinkäyttöpäivän aikana. Yhdistelmäehkäisytabletti Suosittelemme, että aloitat Lisvy-valmisteen käyttämisen SEURAAVANA päivänä sen jälkeen, kun olet ottanut viimeisen hormonitabletin tablettipakkauksestasi. Tällöin sinulle ei siis tule tablettivapaata taukoa. Jos käyttämässäsi tablettipakkauksessa on myös tabletteja, jotka eivät sisällä hormoneja, voit aloittaa Lisvy-valmisteen käytön viimeisen hormoneja sisältävän tabletin ottopäivän JÄLKEISENÄ päivänä. Jos olet epävarma tableteista, kysy neuvoa lääkäriltä tai apteekista. Voit aloittaa laastarin käytön myöhemminkin, mutta kuitenkin viimeistään ensimmäisenä päivänä tablettitauon loppumisen jälkeen (tai viimeisen hormonia sisältämättömän tabletin ottopäivän jälkeisenä päivänä). Ehkäisyrengas Ehkäisylaastari Vain progestiinia sisältävä tabletti (minipilleri) Vain progestiinia sisältävä implantaatti Progestiinia vapauttava kohdunsisäinen ehkäisin Vain progestiinia sisältävä injektio Keskenmenon jälkeen Noudata lääkärin ohjeita. Synnytyksen jälkeen Aloita Lisvy-valmisteen käyttö samana päivänä jolloin poistat syklipakkauksen viimeisen renkaan, mutta viimeistään silloin kuin seuraava rengas olisi pitänyt asettaa. Aloita Lisvy-valmisteen käyttö samana päivänä jolloin poistat syklipakkauksen viimeisen laastarin, mutta viimeistään silloin kuin seuraava laastari olisi pitänyt asettaa. Voit vaihtaa Lisvy-valmisteeseen minä tahansa päivänä ilman taukoa. Sinun on käytettävä lisäehkäisyä (esim. kondomia) ensimmäisen laastarin ensimmäisten seitsemän käyttöpäivän ajan. Aloita Lisvy-valmisteen käyttö ehkäisimen poistopäivänä. Sinun on käytettävä lisäehkäisyä (esim. kondomia) ensimmäisen laastarin ensimmäisten seitsemän käyttöpäivän ajan. Aloita Lisvy-valmisteen käyttö ehkäisimen poistopäivänä. Sinun on käytettävä lisäehkäisyä (esim. kondomia) ensimmäisen laastarin ensimmäisten seitsemän käyttöpäivän ajan. Aloita Lisvy-valmisteen käyttö sinä päivänä, jolloin seuraava ruiske olisi ollut määrä pistää. Sinun on käytettävä lisäehkäisyä (esim. kondomia) ensimmäisen laastarin ensimmäisten seitsemän käyttöpäivän ajan. Jos olet juuri synnyttänyt, lääkäri saattaa neuvoa, että voit aloittaa Lisvy-valmisteen käytön vasta ensimmäisten normaalien kuukautisten jälkeen. Joskus voi olla mahdollista aloittaa aiemmin. Saat neuvoja lääkäriltä. Jos olet ollut yhdynnässä synnytyksen jälkeen ennen kuin aloitat Lisvy-valmisteen käytön, varmista, ettet ole raskaana, tai odota, että seuraavat kuukautiset tulevat ennen kuin asetat laastarin. 10
11 Jos haluat aloittaa Lisvy-valmisteen käytön synnytyksen jälkeen ja imetät, keskustele ensin lääkärin kanssa. Jos et tiedä, milloin sinun pitäisi aloittaa Lisvy-valmisteen käyttö, kysy neuvoa lääkäriltä. Mihin laastari kiinnitetään Käytä Lisvy-valmistetta vain seuraavilla alueilla: vatsa, pakarat tai olkavarren ulompi puoli, sellaisessa kohdassa, jossa kireä vaatetus ei pääse hankaamaan sitä (ks. alla oleva kuva). ÄLÄ aseta laastaria esimerkiksi vaatteesi vyötärönauhan kohdalle. Varmista, että laastarin asetuskohdassa ihosi on ehjä, terve, puhdas, kuiva ja mieluiten karvaton. ÄLÄ aseta laastaria rintoihisi, haavan kohdalle, punoittavalle tai ärtyneelle iholle äläkä samaan kohtaan, missä laastari oli viimeksi. ÄLÄ käytä nestemäisiä ihovoiteita, emulsiovoiteita, öljyä, jauhemaisia tuotteita, meikkiä tai muita tuotteita sille ihoalueelle, jolle laastari on tai jolle se asetetaan. Tällaisen tuotteen vaikutuksesta laastarin kiinnitys voi heiketä tai laastari voi irrota. Vaihtele laastarin asetuskohtaa saman alueen sisällä. Voit esimerkiksi vaihtaa kiinnityskohtaa vatsan vasemmalta puolelta oikealle tai vasemmasta pakarasta tai olkavarresta oikeaan. Voit myös käyttää eri kiinnitysaluetta joka viikko (esim. yhdellä viikolla olkavarren ulompi puoli, seuraavalla viikolla vatsa). Tarkista päivittäin, että laastari on kunnolla kiinni ihossa. Huomaa: Käytä vain YHTÄ laastaria kerralla. Jos laastari on asetettu oikein, voit käydä kylvyssä tai suihkussa tavalliseen tapaan. Myös esimerkiksi uinti, saunominen ja liikunta ovat sallittuja, kunhan laastari pysyy oikein kiinnitettynä. Läpinäkyvä laastari on suojattu UV- ja auringonsäteilyltä, joten se saa altistua auringonvalolle eikä sitä tarvitse peittää vaatteilla. Mitä sait apteekista Sait apteekista Lisvy-pahvirasian, jossa on tämä pakkausseloste sekä 3, 9 tai 18 sinetillä suljettua suojapussia, jossa kussakin on yksi Lisvy-laastari. Suojapussien määrä riippuu lääkäriltä saamastasi reseptistä. 11
12 Kussakin sinetöidyssä suojapussissa on yksi laastari, joka on tarkoitettu kiinnitettäväksi ihollesi. Laastari on pyöreä ja läpinäkyvä: Laastarissa on sen tarrapuolella kaksiosainen, neliönmuotoinen, kiiltävä ja kirkas suojakalvo. Toisella puolella laastaria peittää maidonvalkoinen, neliönmuotoinen suojapaperi, joka estää laastaria tarttumasta suojapussiin. Error! Reference source not found. Laastarin valmistelu kiinnitystä varten 1. Repäise suojapussi auki sormillasi pussin yläreunan myötäisesti. Kohdennusmerkit auttavat löytämään repäisylinjan. Älä käytä saksia. Älä leikkaa, vaurioita tai muuttele laastaria millään tavalla, koska tämä saattaa heikentää sen ehkäisytehoa. 2. Pyöreä ehkäisylaastari on kaksiosaisen, neliönmuotoisen, kirkkaan suojakalvon ja maidonvalkoisen neliönmuotoisen suojapaperin välissä. On tärkeää, että otat laastarin suojapussista siten, että sekä kirkas suojakalvo että maidonvalkoinen suojapaperi ovat mukana. Älä hävitä suojapussia. Laastari on tarkoitus hävittää käytön jälkeen suojapussissaan (ks. kohta 5 Laastareiden hävittäminen ). 12
13 3. Kiinnitä laastari välittömästi suojapussin avaamisen jälkeen seuraavalla tavalla: Irrota ensin yksiosainen, maidonvalkoinen, neliönmuotoinen suojapaperi laastarin päällipinnasta. Irrotettuasi laastarista maidonvalkoisen neliönmuotoisen suojapaperin, joka estää laastaria tarttumasta suojapussiin, hävitä suojapaperi. Kaksiosainen, neliömuotoinen, kiiltävä ja kirkas suojakalvo peittää pyöreän ja läpinäkyvän laastarin alapuolta (tarrapintaa). Vaikuttavat lääkeaineet ovat tarrapinnassa. Vältä koskettamasta laastarin tarrapintaa. Laastarin on pysyttävä tarttuvana. Poista seuraavaksi puolet kirkkaasta suojakalvosta. Pitäen kiinni laastarin siitä reunasta, jota suojakalvon toinen puolikas edelleen suojaa, laita laastari iholle siihen kohtaan, mihin haluat sen kiinnittää. Kun puolet laastarista on tarttunut kiinnityskohtaan, poista suojakalvon toinen puolikas. 13
14 Paina laastaria tiukasti kämmenellä 30 sekunnin ajan. Varmista, että reunat kiinnittyvät hyvin. Muista, että suojapussia ei pidä hävittää, sillä tarvitset sitä, kun hävität laastarin käytön jälkeen (ks. kohta 5 Laastareiden hävittäminen ). Käyttöohjeet jakson aikana Laastareita käytetään seuraavasti: kutakin kolmesta laastarista käytetään 1 viikon ajan. Sitten seuraa seitsemän päivää kestävä laastariton tauko. Nämä muodostavat neljän viikon jakson. Error! Reference source not found. Kiinnitä uusi laastari joka viikko samana päivänä, kolmen viikon ajan peräkkäin (laastarinvaihtopäivä ks. jäljempänä kohta 3 Laastarinvaihtopäivä ). Varmista, että olet poistanut vanhan laastarin ennen uuden laastarin kiinnittämistä, koska kerralla saa käyttää vain yhtä laastaria. Kiinnitä laastari joka kerralla eri kohtaan. ÄLÄ KÄYTÄ laastaria viikolla 4. Varmista, että olet poistanut vanhan laastarin. Kuukautisiesi pitäisi alkaa tämän viikon aikana. Jos kuukautisia ei tule, ks. kohta 2 Mitä tehdä, jos kuukautisvuotoa ei tule. Laastarien kiinnittämisen ja irrottamisen tarkan aikataulun löydät jäljempänä kohdasta 3 Laastarinvaihtopäivä. Aloita viikon 4 jälkeisenä päivänä uusi neljän viikon jakso. Kiinnitä uusi laastari samana viikonpäivänä (laastarinvaihtopäivänä) riippumatta siitä, jatkuuko kuukautisvuotosi vai ei. Error! Reference source not found. Toista samat vaiheet aina neljän viikon välein. Laastarinvaihtopäivä Kiinnitä uusi laastari aina samana viikonpäivänä. Tämä viikonpäivä on nk. laastarinvaihtopäivä. Esimerkiksi jos kiinnität ensimmäisen laastarin sunnuntaina, sinun on kiinnitettävä seuraavatkin laastarit sunnuntaisin. Käytä vain yhtä laastaria kerralla. 14
15 Ensimmäinen laastari Toinen laastari Kolmas laastari Ei laastaria Viikko 1 (jakson ensimmäinen päivä eli päivä 1): ensimmäisen laastarin kiinnitys Viikko 2 (jakson kahdeksas päivä eli päivä 8): ensimmäisen laastarin poisto ja heti sen jälkeen toisen laastarin kiinnitys Viikko 3 (jakson 15. päivä eli päivä 15): toisen laastarin poisto ja heti sen jälkeen kolmannen laastarin kiinnitys Viikko 4 (jakson 22. päivä eli päivä 22): kolmannen laastarin poisto, eikä laastaria jakson päivinä 22 28! Voit vaihtaa laastarin mihin kellonaikaan tahansa laastarinvaihtopäivänä. Aloita seuraava jakso taas samaisena laastarinvaihtopäivänä, seitsemän päivän laastarittoman tauon jälkeen (päivät 22 28). Laastarittomat päivät Älä käytä laastaria viikon 4 aikana (jakson päivinä 22 28). Error! Reference source not found. Laastari ei saa koskaan olla poissa käytöstä pitempään kuin 7 peräkkäistä päivää. Jos laastarittomia päiviä on yli seitsemän, SINULLA ON RISKI TULLA RASKAAKSI. Jos olet ollut yhdynnässä liian pitkän laastarittoman jakson aikana, voit mahdollisesti olla jo raskaana. Käytä lisäehkäisyä, esimerkiksi kondomia (ks. myös jäljempänä kohta 3 Mitä tehdä, jos laastari on irronnut tai olet unohtanut kiinnittää tai vaihtaa sen ). Muistutuskortti ja muistutustarrat Laastarinvaihtopäivän muistamisessa voivat olla avuksi tämän vihkosen lopusta löytyvät, irrotettavat muistutuskortti ja muistutustarrat. Voit merkitä kaikki neljän viikon jakson aikana olevat laastarinvaihtopäiväsi muistutuskorttiin. Voit myös kiinnittää muistutustarroja omaan kalenteriisi tai päiväkirjaasi. Error! Reference source not found. Kiinnitä oikein-merkillä varustettu tarra sen päivän kohdalle, jolloin sinun pitää kiinnittää viikon 1 ensimmäinen laastari. Tämä viikonpäivä on laastarinvaihtopäiväsi. Nuolisymbolilla varustetut muistutustarrat kiinnitetään viikoilla 2 ja 3 olevien laastarinvaihtopäivien kohdalle. Rastisymbolilla varustettu muistutustarra kiinnitetään viikon 4 laastarinvaihtopäivän kohdalle. ÄLÄ käytä laastaria viikolla 4. Kun neljän viikon jakso on kulunut, toista yllä mainitut vaiheet. Jos käytät enemmän Lisvy-valmistetta kuin sinun pitäisi Lisvy ei todennäköisesti aiheuta yliannostusta, koska laastarista vapautuu tasainen määrä hormoneja. Älä käytä enempää kuin yhtä laastaria kerralla. Vakavia haittavaikutuksia ei ole raportoitu, kun hormonaalisia ehkäisyvalmisteita on vahingossa otettu suuria annoksia. 15
16 Usean laastarin samanaikaisen käytön aiheuttama yliannostus voi aiheuttaa pahoinvointia tai oksentelua. Nuorilla tytöillä voi esiintyä verenvuotoa emättimestä. Jos olet kiinnittänyt liian monta laastaria tai vaikkapa lapsi on kiinnittänyt laastarin vahingossa, ota yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh ) riskien arvioimiseksi ja lisäohjeiden saamiseksi. Jos unohdat käyttää Lisvy-valmistetta Mitä sinun pitää tehdä, jos laastari on irronnut tai olet unohtanut kiinnittää tai vaihtaa sen: Jos laastari on osittain tai kokonaan irronnut alle yhden vuorokauden ajan (enintään 24 tuntia) Yritä kiinnittää laastari uudelleen samaan paikkaan tai vaihda se heti uuteen laastariin. Lisäehkäisyä ei tarvita. Laastarinvaihtopäiväsi pysyy samana. yli yhden vuorokauden ajan (24 tuntia tai kauemmin) tai jos et tiedä, kauanko laastari on ollut irronneena SINULLA ON RISKI TULLA RASKAAKSI. Keskeytä meneillään oleva ehkäisyjakso ja aloita uusi jakso välittömästi kiinnittämällä uusi laastari. Tällöin kyseessä on uusi päivä 1 ja uusi laastarinvaihtopäivä. Sinun on käytettävä lisäehkäisyä uuden jakson ensimmäisen viikon ajan (esim. kondomia, spermisidiä tai pessaaria). Älä kiinnitä laastaria uudestaan, jos se ei ole enää liimainen, se on tarttunut kiinni itseensä tai johonkin muuhun pintaan, siihen on tarttunut muuta materiaalia tai se on jo kerran aiemmin irronnut osittain tai kokonaan. Jos et pysty kiinnittämään laastaria uudelleen, kiinnitä heti uusi laastari. Älä käytä Lisvy-laastarin kiinnittämiseen teippejä tai muita kiinnitystarvikkeita. Jos unohdat vaihtaa laastarin minkä tahansa laastarijakson alussa (Viikko 1/päivä 1): SINULLA ON RISKI TULLA RASKAAKSI. Kiinnitä uuden jakson ensimmäinen laastari heti kun muistat asian. Tällöin kyseessä on uusi laastarinvaihtopäivä ja uusi päivä 1. Sinun on käytettävä lisäehkäisyä uuden jakson ensimmäisen viikon ajan (esim. kondomia, spermisidiä tai pessaaria). laastarijakson keskellä (Viikko 2/päivä 8 tai viikko 3/päivä 15): o Jos olet unohtanut vaihtaa laastarin yksi tai kaksi vuorokautta sitten (enintään 48 tuntia myöhässä): Kiinnitä uusi laastari välittömästi. Kiinnitä seuraava laastari normaalina laastarinvaihtopäivänä. Lisäehkäisyä ei tarvita. o Jos olet unohtanut vaihtaa laastarin yli kaksi vuorokautta sitten (48 tuntia tai enemmän myöhässä): SINULLA ON RISKI TULLA RASKAAKSI. Keskeytä meneillään oleva ehkäisyjakso ja aloita uusi neljän viikon jakso välittömästi kiinnittämällä uusi laastari. Tällöin kyseessä on uusi laastarinvaihtopäivä ja uusi päivä 1. Käytä lisäehkäisyä yhden viikon ajan. 16
17 laastarijakson lopussa (Viikko 4/päivä 22): Jos unohdat poistaa laastarin, poista se heti kun muistat asian (viimeistään päivänä 28). Aloita seuraava jakso tavallisena laastarinvaihtopäivänäsi, joka on päivän 28 jälkeinen päivä. Lisäehkäisyä ei tarvita. Seuraavassa taulukossa esitetään, mitä seuraa ja mitä pitää tehdä, jos laastari on irronnut tai et ole muistanut poistaa tai vaihtaa sitä ajallaan. Jos laastari on irronnut tai sitä ei ole poistettu tai vaihdettu ajallaan: seuraukset ja toimenpiteet Irronneet laastarit a Aika Vaikutukset ehkäisyn luotettavuuteen a Laastari irronnut < 24 tuntia Ehkäisyn teho riittävä > 24 tuntia Ehkäisyn teho heikentynyt Laastaria ei ole Aika Vaikutukset vaihdettu ajoissa a ehkäisyn Ensimmäistä laastaria (viikko 1, päivä 1) ei ole kiinnitetty ajoissa Ensimmäistä tai toista laastaria (viikko 1/2 tai 2/3) ei ole vaihdettu uuteen ajoissa Kolmatta laastaria (viikko 3/4) ei ole poistettu ajoissa Ensimmäistä laastaria ei ole kiinnitetty laastarinvaihtopäivänä luotettavuuteen a Ehkäisyn teho heikentynyt < 48 tuntia Ehkäisyn teho riittävä > 48 tuntia Ehkäisyn teho heikentynyt Tarvittavat toimenpiteet a - Kiinnitä uusi laastari välittömästi. - Lisäehkäisyä ei tarvita. - Laastarinvaihtopäivä ei muutu. - Aloita uusi neljän viikon jakso välittömästi kiinnittämällä uusi laastari. - Käytä lisäehkäisyä seuraavien seitsemän päivän ajan b. - Merkitse muistiin uusi laastarinvaihtopäiväsi. Tarvittavat toimenpiteet a - Aloita uusi neljän viikon jakso välittömästi kiinnittämällä uusi laastari. - Käytä lisäehkäisyä seuraavien seitsemän päivän ajan b. - Merkitse muistiin uusi laastarinvaihtopäiväsi. - Kiinnitä uusi laastari välittömästi. - Lisäehkäisyä ei tarvita. - Laastarinvaihtopäivä ei muutu. - Aloita uusi neljän viikon jakso välittömästi kiinnittämällä uusi laastari. - Käytä lisäehkäisyä seuraavien seitsemän päivän ajan b. - Merkitse muistiin uusi laastarinvaihtopäiväsi. Ehkäisyn teho - Poista laastari. riittävä c - Aloita seuraava neljän viikon jakso normaalina laastarinvaihtopäivänäsi. a Koskee jokaista jaksoa. b Lisäehkäisyllä tarkoitetaan mitä tahansa lisänä käytettävää ei-hormonaalista ehkäisymenetelmää paitsi ns. varmat päivät -menetelmää ja lämpötilan mittaamiseen perustuvaa menetelmää. c Edellyttäen että kolmas laastari on vaihdettu uuteen viimeistään uuden laastarijakson normaalina päivänä 1. Hanki resepti seuraavaa pakkausta varten hyvissä ajoin, ts. ennen kuin käytät nykyisen pakkauksesi viimeisen laastarin. Näin varmistat, etteivät laastarit lopu kesken. 17
18 Mitä tehdä, jos iho ärtyy Jos laastarin käyttö aiheuttaa epämiellyttävää ärsytystä sen kiinnityspaikassa, poista laastari ja aseta uusi laastari eri paikkaan. Käytä uutta laastaria seuraavaan, suunnitelman mukaiseen laastarinvaihtopäivään asti. Miten vaihdat laastarinvaihtopäiväksi jonkin toisen päivän Jos haluat siirtää laastarinvaihtopäivääsi, käytä laastareita normaalisti meneillään olevan jakson ajan ja poista kolmas laastari asianmukaisena päivänä. Laastarittoman viikon aikana voit kiinnittää uuden laastarin jonakin aikaisempana (ei koskaan myöhempänä) päivänä kuin siihenastinen laastarinvaihtopäiväsi. Laastari ei saa koskaan olla poissa käytöstä pitempään kuin seitsemän päivää. Mitä tehdä, jos oksennat tai sinulla on vaikeaa ripulia Oksentelun tai ripulin ei pitäisi vaikuttaa Lisvy-laastarista saamaasi lääkemäärään. Jos lopetat Lisvy-valmisteen käytön Voit lopettaa Lisvy-valmisteen käytön milloin tahansa. Jos et halua tulla raskaaksi, kysy lääkäriltä neuvoa muista luotettavista raskaudenehkäisymenetelmistä. Jos haluat tulla raskaaksi, lopeta Lisvyvalmisteen käyttö ja odota, että kuukautisvuoto tulee ennen kuin yrität tulla raskaaksi. Näin voit laskea odotettavissa olevan synnytysajankohdan helpommin. Jos lopetat Lisvy-valmisteen käytön, sinulla voi esiintyä epäsäännöllistä tai heikkoa kuukautisvuotoa, tai vuoto voi jäädä kokonaan pois, etenkin jos kuukautisesi olivat epäsäännölliset ennen Lisvyvalmisteen käytön aloitusta. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen. 4. Mahdolliset haittavaikutukset Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Jos havaitset jonkin haittavaikutuksen, varsinkin jos se on vaikea tai pitkään jatkuva, tai jos terveydentilassasi tapahtuu jokin muutos, jonka arvelet voivan johtua Lisvy-valmisteesta, kerro asiasta lääkärille. Kaikilla yhdistelmäehkäisyvalmisteita käyttävillä naisilla on suurentunut laskimoveritulppien (laskimotromboembolian) tai valtimoveritulppien (valtimotromboembolian) riski. Katso lisätietoja yhdistelmäehkäisyvalmisteiden käyttämisen riskeistä kohdasta 2 Mitä sinun on tiedettävä, ennen kuin käytät Lisvy-valmistetta. Vakavat haittavaikutukset Lisätietoa hormonaalisten yhdistelmäehkäisyvalmisteiden käyttöön liittyvistä haittavaikutuksista, mukaan lukien vakavat reaktiot, löydät kohdasta 2 Varoitukset ja varotoimet, Veritulpat ja Hormonaaliset yhdistelmäehkäisyvalmisteet ja syöpä ja kohdasta 2 Älä käytä Lisvy-valmistetta. Lue nämä kohdat huolellisesti ja kysy tarvittaessa heti neuvoa lääkäriltä. Lisvy-valmisteen käyttäjillä on ilmoitettu seuraavia haittavaikutuksia: Hyvin yleinen: voi esiintyä yli yhdellä naisella 10:stä kiinnityspaikan reaktio. Yleinen: voi esiintyä enintään yhdellä naisella 10:stä 18
19 mielialan vaihtelut migreeni pahoinvointi verenvuoto emättimestä rintakipu. Melko harvinainen: voi esiintyä enintään yhdellä naisella 100:sta masennus/masentunut mieliala seksuaalisen halun väheneminen ja katoaminen. Harvinainen: voi esiintyä enintään yhdellä naisella 1 000:sta haitalliset veritulpat laskimossa tai valtimossa. Tiettyjen haittavaikutusten kuvaus Alla luetellaan sellaiset haittavaikutukset, joiden arvellaan liittyvän hormonaalisten yhdistelmäehkäisyvalmisteiden käyttöön ja joita esiintyy hyvin harvoin tai joiden oireet alkavat viiveellä (ks. myös kohta 2 Älä käytä Lisvy-valmistetta ja Varoitukset ja varotoimet ): Veritulpat haitallisia veritulppia laskimossa tai valtimossa, esimerkiksi: o jalassa tai jalkaterässä (ts. syvä laskimotukos) o keuhkoissa (ts. keuhkoembolia) o sydänkohtaus o aivohalvaus o pieniä tai ohimeneviä aivohalvausta muistuttavia oireita (ohimenevä aivoverenkiertohäiriö eli TIA) o veritulppia maksassa, vatsassa/suolistossa, munuaisissa tai silmässä. Veritulpan mahdollisuus saattaa olla suurempi, jos sinulla on tätä riskiä suurentavia sairauksia tai tiloja (ks. kohdasta 2 lisätietoja veritulppien riskiä lisäävistä tiloista tai sairauksista ja veritulpan oireista) Kasvaimet Rintasyöpädiagnoosin esiintyvyys hormonaalisten yhdistelmäehkäisyvalmisteiden käyttäjillä on hyvin niukasti lisääntynyt. Koska rintasyöpä on alle 40-vuotiailla naisilla harvinainen, rintasyöpädiagnoosien lisääntynyt määrä on pieni suhteessa rintasyövän kokonaisriskiin. Ei tiedetä, onko sillä suora yhteys hormonaalisten yhdistelmäehkäisyvalmisteiden käyttöön. maksakasvaimet (hyvän- ja pahanlaatuiset). Muut vaivat ihosairaus, jolle ovat tyypillisiä kutiavat punaiset täplät tai turvonneet laikut ihossa (erythema multiforme) ihosairaus, jolle ovat tyypillisiä aristavat punaiset kyhmyt (erythema nodosum) veren kohonneet rasva-arvot (hypertriglyseridemia, mikä johtaa lisääntyneeseen pankreatiitin eli haimatulehduksen riskiin käytettäessä hormonaalista yhdistelmäehkäisyvalmistetta) korkea verenpaine sellaisten sairauksien esiintyminen tai paheneminen, joiden kohdalla yhteys hormonaalisiin yhdistelmäehkäisyvalmisteisiin ei ole varma, sapen virtauksen estymiseen (kolestaasiin) liittyvä keltaisuus ja/tai kutina, sappikivien muodostuminen, porfyria-niminen aineenvaihduntasairaus, punahukka (systeeminen lupus erythematosus [SLE], immuunijärjestelmän sairaus), hemolyyttis-ureeminen oireyhtymä (veren hyytymisen sairaus, joka aiheuttaa munuaisten vajaatoimintaa), Sydenhamin korea -niminen hermoston sairaus (aiheuttaa äkillisiä liikkeitä kehossa), raskausrokahtuma (raskauden aikana esiintyvä ihosairaus), kuulonalenema naisilla, joilla on perinnöllinen angioedeema (jolle on tyypillistä äkillinen esim. kasvojen, kielen tai kurkun turvotus), estrogeenit voivat aiheuttaa tai pahentaa angioedeeman oireita häiriintynyt maksan toiminta muutokset glukoosinsiedossa tai vaikutus perifeeriseen insuliiniresistenssiin 19
20 tulehduksellisen suolistosairauden paheneminen (Crohnin tauti, haavainen paksusuolentulehdus) epilepsian paheneminen kullanruskeat pigmenttiläiskät (nk. raskaudenaikaiset maksaläiskät varsinkin kasvoilla) yliherkkyys (mukaan lukien sen oireet, esim. ihottuma, nokkosihottuma). Yhteisvaikutukset Muiden lääkkeiden, kuten esimerkiksi mäkikuisma-nimisen rohdosvalmisteen tai epilepsiaan, tuberkuloosiin, HIV- tai hepatiitti C -virusinfektioihin käytettävien lääkkeiden ja hormonaalisten yhdistelmäehkäisyvalmisteiden yhteisvaikutukset voivat aiheuttaa odottamattomia verenvuotoja ja/tai heikentää ehkäisytehoa. Katso kohta 2 Muut lääkevalmisteet ja Lisvy. Haittavaikutuksista ilmoittaminen Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta. www-sivusto: Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL 55 FI Fimea 5. Lisvy-valmisteen säilyttäminen Ei lasten ulottuville eikä näkyville. Säilytä alkuperäisessä suojapussissa. Herkkä valolle ja kosteudelle. Ei saa jäätyä. Älä käytä Lisvy-valmistetta pahvirasiassa ja suojapussin etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää. Laastareiden hävittäminen ja muut käsittelyohjeet Laastari on kiinnitettävä välittömästi suojapussista ottamisen jälkeen. Meikkejä, emulsiovoiteita, nestemäisiä ihovoiteita, jauhemaisia tuotteita tai muita paikallisesti annosteltavia tuotteita ei saa levittää sille ihoalueelle, jolle Lisvy on kiinnitetty tai jolle se kiinnitetään. Vaikuttavat aineet gestodeeni ja etinyyliestradioli aiheuttavat vaaraa ympäristölle, erityisesti kaloille. Lisäksi gestodeeni ja etinyyliestradioli poistuvat hitaasti ympäristöstä. Käytettyjä laastareita ei saa huuhtoa alas WC:stä eikä hävittää nestemäisten jätteiden hävitysjärjestelmien kautta. Käytetty laastari on hävitettävä huolellisesti seuraavien ohjeiden mukaisesti: Säilytä laastarin alkuperäinen suojapussi, jotta voit hävittää laastarin siinä käytön jälkeen. Taita käytetty laastari kaksinkerroin siten, että kiinnittyvä/tarttuva pinta jää sisäpuolelle. Laita se alkuperäiseen suojapussiin. Sulje pussi taittamalla sen avoin reuna kiinni. Pussin päällä on kaksisivuinen etiketti. Nosta etiketin päällimmäistä sivua ja sulje suojapussin taitettu reuna sen avulla. Hävitysohjeet löytyvät toiselta sivulta, joka on ensimmäisen sivun alla. Hävitä turvallisesti siten, ettei jäte joudu lasten tai lemmikkieläinten ulottuville. Käytetyt ja käyttämättömät laastarit on hävitettävä paikallisten vaatimusten mukaisesti. Jos olet epävarma, kysy neuvoa apteekista. Näin menetellen suojelet luontoa. 20
NuvaRing. N.V. Organon. 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
Liite III. Valmisteyhteenvetojen ja pakkausselosteiden muutokset
 Liite III Valmisteyhteenvetojen ja pakkausselosteiden muutokset 39 VALMISTEYHTEENVETO 40 Kohta 4.1 Käyttöaiheet [Tällä hetkellä hyväksytyt käyttöaiheet poistetaan ja korvataan seuraavasti:] Keskivaikean
Liite III Valmisteyhteenvetojen ja pakkausselosteiden muutokset 39 VALMISTEYHTEENVETO 40 Kohta 4.1 Käyttöaiheet [Tällä hetkellä hyväksytyt käyttöaiheet poistetaan ja korvataan seuraavasti:] Keskivaikean
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
ZOELY -käyttäjäopas. nomegestroliasetaatti estradioli 2,5 mg/1,5 mg kalvopäällysteisiä tabletteja
 ZOELY -käyttäjäopas nomegestroliasetaatti estradioli 2,5 mg/1,5 mg kalvopäällysteisiä tabletteja SISÄLLYS Tietoja ZOELY-valmisteesta... 2 Miten ZOELY toimii?... 3 ZOELY on tehty sinua varten... 4 5 Lisätietoja
ZOELY -käyttäjäopas nomegestroliasetaatti estradioli 2,5 mg/1,5 mg kalvopäällysteisiä tabletteja SISÄLLYS Tietoja ZOELY-valmisteesta... 2 Miten ZOELY toimii?... 3 ZOELY on tehty sinua varten... 4 5 Lisätietoja
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
Evran luonnollinen koko
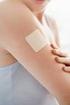 mielenrauhaa Evran luonnollinen koko Evra uudenlainen ehkäisyvalmiste Esitteestä lukemasi tiedon tarkoitus oli vastata yleisimmin kysyttyihin käytännön kysymyksiin Evrasta. Jos haluat lisää tietoa, käänny
mielenrauhaa Evran luonnollinen koko Evra uudenlainen ehkäisyvalmiste Esitteestä lukemasi tiedon tarkoitus oli vastata yleisimmin kysyttyihin käytännön kysymyksiin Evrasta. Jos haluat lisää tietoa, käänny
PAKKAUSSELOSTE. Vagifem 10 mikrog emätinpuikot. Estradioli
 PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Lisvy 60 mikrog/24 tuntia + 13 mikrog/24 tuntia depotlaastari 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
Pakkausseloste: Tietoa käyttäjälle. Kipupois 200 mg tabletit. ibuprofeeni
 Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
CYPRETYL RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CYPRETYL Päivämäärä: 29.6.2015, Versio: 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akne on yleinen ihovaiva, jonka tunnusmerkkejä
CYPRETYL Päivämäärä: 29.6.2015, Versio: 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akne on yleinen ihovaiva, jonka tunnusmerkkejä
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
PAKKAUSSELOSTE NUVARING
 PAKKAUSSELOSTE NUVARING Lue tämä pakkausseloste huolellisesti, ennen kuin alat käyttää NuvaRingemätinrengasta. Pakkausseloste sisältää tietoa, jonka avulla sinun on helpompi käyttää emätinrengasta turvallisesti
PAKKAUSSELOSTE NUVARING Lue tämä pakkausseloste huolellisesti, ennen kuin alat käyttää NuvaRingemätinrengasta. Pakkausseloste sisältää tietoa, jonka avulla sinun on helpompi käyttää emätinrengasta turvallisesti
Potilaan opas. Acitretin Orifarm 10 mg ja 25 mg. Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Ehkäisymenetelmät PP-PF--WHC-FI /
 Ehkäisymenetelmät Ehkäisyn aloitus & valinta Mikäli raskaus ei ole ajankohtainen toive ja seksistä haluaa nauttia huoletta, on syytä huolehtia luotettavasta raskauden ehkäisystä Keskustele terveydenhoitajan
Ehkäisymenetelmät Ehkäisyn aloitus & valinta Mikäli raskaus ei ole ajankohtainen toive ja seksistä haluaa nauttia huoletta, on syytä huolehtia luotettavasta raskauden ehkäisystä Keskustele terveydenhoitajan
PRIMOLUT N tabletti 5 mg
 PRIMOLUT N tabletti 5 mg Pakkausseloste: Tietoa käyttäjälle Primolut N 5 mg tabletit noretisteroni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat Primolut N -tablettien käyttämisen sillä se
PRIMOLUT N tabletti 5 mg Pakkausseloste: Tietoa käyttäjälle Primolut N 5 mg tabletit noretisteroni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat Primolut N -tablettien käyttämisen sillä se
Naisella on vapaus valita SINULLE SOPIVIN EHKÄISY
 Naisella on vapaus valita SINULLE SOPIVIN EHKÄISY Jos lasten hankinta ei ole ajankohtaista, on ehkäisyä käytettävä yhdyntöjen aloittamisesta vaihdevuosiin saakka. Niin hormonaalisia kuin muitakin ehkäisyvaihtoehtoja
Naisella on vapaus valita SINULLE SOPIVIN EHKÄISY Jos lasten hankinta ei ole ajankohtaista, on ehkäisyä käytettävä yhdyntöjen aloittamisesta vaihdevuosiin saakka. Niin hormonaalisia kuin muitakin ehkäisyvaihtoehtoja
VALMISTEYHTEENVETO. Viidestä kerroksesta koostuva ohut, matriksityyppinen depotlaastari.
 VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
VALMISTEYHTEENVETO Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä
Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
 PAKKAUSSELOSTE Gestinyl 20 mikrog/75 mikrog tabletti, päällystetty Gestinyl 30 mikrog/75 mikrog tabletti, päällystetty Etinyyliestradioli / gestodeeni Lue tämä seloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE Gestinyl 20 mikrog/75 mikrog tabletti, päällystetty Gestinyl 30 mikrog/75 mikrog tabletti, päällystetty Etinyyliestradioli / gestodeeni Lue tämä seloste huolellisesti, ennen kuin aloitat
Erivedge -valmisteen raskaudenehkäisyohjelma
 Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma. (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit
 Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma Potilaan opas (asitretiini) 10 mg:n ja 25 mg:n kovat kapselit Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
JADELLE. JADELLE -valmisteen seuranta
 Käyttäjän opas JADELLE Olet valinnut ehkäisymenetelmäksesi JADELLE -ehkäisykapselit. Lue huolellisesti tämä vihkonen niin saat vastauksen useimpiin kysymyksiisi, jotka koskevat JADELLE -valmistetta. Tärkeää
Käyttäjän opas JADELLE Olet valinnut ehkäisymenetelmäksesi JADELLE -ehkäisykapselit. Lue huolellisesti tämä vihkonen niin saat vastauksen useimpiin kysymyksiisi, jotka koskevat JADELLE -valmistetta. Tärkeää
Opas Tietoja potilaille
 Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Pakkausseloste: Tietoa käyttäjälle. Circlet 0,120 mg / 0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen. etonogestreeli / etinyyliestradioli
 Pakkausseloste: Tietoa käyttäjälle Circlet 0,120 mg / 0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen etonogestreeli / etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä
Pakkausseloste: Tietoa käyttäjälle Circlet 0,120 mg / 0,015 mg per 24 tuntia, depotlääkevalmiste, emättimeen etonogestreeli / etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Pakkausseloste: Tietoa käyttäjälle. Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi
 Pakkausseloste: Tietoa käyttäjälle Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Potilaan opas. Tietoa henkilöille, joille on määrätty botulinutoksiini B:tä (NeuroBloc ) servikaalisen dystonian hoitoon
 Potilaan opas Tietoa henkilöille, joille on määrätty botulinutoksiini B:tä (NeuroBloc ) servikaalisen dystonian hoitoon Oppaan on laatinut Eisai Europe Limited Tässä oppaassa kerrotaan NeuroBloc -lääkkeestä
Potilaan opas Tietoa henkilöille, joille on määrätty botulinutoksiini B:tä (NeuroBloc ) servikaalisen dystonian hoitoon Oppaan on laatinut Eisai Europe Limited Tässä oppaassa kerrotaan NeuroBloc -lääkkeestä
KÄYTTÖOHJEET JA LÄÄKITYSPÄIVÄKIRJA
 RIVSTOR-n (rivastigmiini) KÄYTTÖOJT J LÄÄKITYSPÄIVÄKIRJ Tämä tieto on tärkeää Rivastor-n turvallisen käytön varmistamiseksi. I Rivastor patch_educational material for patients_fi v01.1 05/2018 Käyttöohjeet
RIVSTOR-n (rivastigmiini) KÄYTTÖOJT J LÄÄKITYSPÄIVÄKIRJ Tämä tieto on tärkeää Rivastor-n turvallisen käytön varmistamiseksi. I Rivastor patch_educational material for patients_fi v01.1 05/2018 Käyttöohjeet
Rivastigmin ratiopharm 13,3 mg/24 h depotlaastari Käyttöohjeet ja lääkityspäiväkirja
 05-2017 Rivastigmin ratiopharm 13,3 mg/24 h depotlaastari Käyttöohjeet ja lääkityspäiväkirja Käyttöohjeet Jos sinulla on kysyttävää tai tarvitset lisätietoa tämän lääkkeen käytöstä, lue tämän lääkevalmisteen
05-2017 Rivastigmin ratiopharm 13,3 mg/24 h depotlaastari Käyttöohjeet ja lääkityspäiväkirja Käyttöohjeet Jos sinulla on kysyttävää tai tarvitset lisätietoa tämän lääkkeen käytöstä, lue tämän lääkevalmisteen
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Rivastigmin ratiopharm 13,3 mg/24 h depotlaastari Käyttöohjeet ja lääkityspäiväkirja
 05-2017 Rivastigmin ratiopharm 13,3 mg/24 h depotlaastari Käyttöohjeet ja lääkityspäiväkirja Rivastigim_ratiopharm_depotlaastari_ohje_v1_FI_GEN_17_0036_5_2017.indd 1 9.5.2017 13:53:49 Rivastigim_ratiopharm_depotlaastari_ohje_v1_FI_GEN_17_0036_5_2017.indd
05-2017 Rivastigmin ratiopharm 13,3 mg/24 h depotlaastari Käyttöohjeet ja lääkityspäiväkirja Rivastigim_ratiopharm_depotlaastari_ohje_v1_FI_GEN_17_0036_5_2017.indd 1 9.5.2017 13:53:49 Rivastigim_ratiopharm_depotlaastari_ohje_v1_FI_GEN_17_0036_5_2017.indd
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Raskauden ehkäisy. Jokaisella on oikeus raskauden ehkäisyyn. Siihen on monta keinoa eli menetelmää.
 Raskauden ehkäisy Jokaisella on oikeus raskauden ehkäisyyn. Siihen on monta keinoa eli menetelmää. Jokaisella on oikeus saada oikeaa tietoa ja neuvontaa raskauden ehkäisyn keinoista sekä niiden hyödyistä,
Raskauden ehkäisy Jokaisella on oikeus raskauden ehkäisyyn. Siihen on monta keinoa eli menetelmää. Jokaisella on oikeus saada oikeaa tietoa ja neuvontaa raskauden ehkäisyn keinoista sekä niiden hyödyistä,
Pakkausseloste: Tietoa käyttäjälle. Microgynon päällystetyt tabletit levonorgestreeli, etinyyliestradioli
 Pakkausseloste: Tietoa käyttäjälle Microgynon päällystetyt tabletit levonorgestreeli, etinyyliestradioli Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Microgynon päällystetyt tabletit levonorgestreeli, etinyyliestradioli Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle. Trikvilar päällystetyt tabletit levonorgestreeli, etinyyliestradioli
 Pakkausseloste: Tietoa käyttäjälle Trikvilar päällystetyt tabletit levonorgestreeli, etinyyliestradioli Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Trikvilar päällystetyt tabletit levonorgestreeli, etinyyliestradioli Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Pakkausseloste: Tietoa käyttäjälle. Dienorette 2 mg/0,03 mg kalvopäällysteiset tabletit dienogesti ja etinyyliestradioli
 Pakkausseloste: Tietoa käyttäjälle Dienorette 2 mg/0,03 mg kalvopäällysteiset tabletit dienogesti ja etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista
Pakkausseloste: Tietoa käyttäjälle Dienorette 2 mg/0,03 mg kalvopäällysteiset tabletit dienogesti ja etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista
HOITO EPCLUSA - VALMISTEELLA (SOFOSBUVIIRI/VELPATASVIIRI) Tietoa potilaille. Tähän lääkkeeseen kohdistuu lisäseuranta.
 HOITO EPCLUSA - VALMISTEELLA (SOFOSBUVIIRI/VELPATASVIIRI) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. 2 Tämä esite ei korvaa lääkkeen pakkausselostetta tai lääkärin antamia tietoja. Lue
HOITO EPCLUSA - VALMISTEELLA (SOFOSBUVIIRI/VELPATASVIIRI) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. 2 Tämä esite ei korvaa lääkkeen pakkausselostetta tai lääkärin antamia tietoja. Lue
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Pakkausseloste: Tietoa käyttäjälle. Cemisiana 0,03 mg/2 mg kalvopäällysteiset tabletit. etinyyliestradioli/dienogesti
 Pakkausseloste: Tietoa käyttäjälle Cemisiana 0,03 mg/2 mg kalvopäällysteiset tabletit etinyyliestradioli/dienogesti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se
Pakkausseloste: Tietoa käyttäjälle Cemisiana 0,03 mg/2 mg kalvopäällysteiset tabletit etinyyliestradioli/dienogesti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se
OPAS ETEISVÄRINÄPOTILAALLE. XARELTO -lääkkeen käyttäjälle
 OPAS ETEISVÄRINÄPOTILAALLE XARELTO -lääkkeen käyttäjälle SISÄLLYSLUETTELO ETEISVÄRINÄ Mikä on eteisvärinä? 3 XARELTO Mikä on XARELTO? 4 Miksi XARELTO -lääkkeen säännöllinen käyttö on tärkeää? 6 XARELTO
OPAS ETEISVÄRINÄPOTILAALLE XARELTO -lääkkeen käyttäjälle SISÄLLYSLUETTELO ETEISVÄRINÄ Mikä on eteisvärinä? 3 XARELTO Mikä on XARELTO? 4 Miksi XARELTO -lääkkeen säännöllinen käyttö on tärkeää? 6 XARELTO
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä
 mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
Nuoren naisen ehkäisymenetelmät L.FI.MKT.11.2015.3751
 Nuoren naisen ehkäisymenetelmät Pitkäaikaiset ehkäisymenetelmät Hormonikierukka 3 v ja 5 v Pitkäaikainen ehkäisy (pienempi 3 vuotta, isompi 5 vuotta) Sisältää paikallisesti vapautuvaa keltarauhashormonia
Nuoren naisen ehkäisymenetelmät Pitkäaikaiset ehkäisymenetelmät Hormonikierukka 3 v ja 5 v Pitkäaikainen ehkäisy (pienempi 3 vuotta, isompi 5 vuotta) Sisältää paikallisesti vapautuvaa keltarauhashormonia
Pakkausseloste: Tietoa käyttäjälle. Diza 0,02 mg / 3 mg kalvopäällysteiset tabletit. etinyyliestradioli / drospirenoni
 Pakkausseloste: Tietoa käyttäjälle Diza 0,02 mg / 3 mg kalvopäällysteiset tabletit etinyyliestradioli / drospirenoni Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista
Pakkausseloste: Tietoa käyttäjälle Diza 0,02 mg / 3 mg kalvopäällysteiset tabletit etinyyliestradioli / drospirenoni Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista
Pakkausseloste: Tietoa käyttäjälle. Modina 30 mikrog/75 mikrog tabletti, päällystetty etinyyliestradioli ja gestodeeni
 Pakkausseloste: Tietoa käyttäjälle Modina 30 mikrog/75 mikrog tabletti, päällystetty etinyyliestradioli ja gestodeeni Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista
Pakkausseloste: Tietoa käyttäjälle Modina 30 mikrog/75 mikrog tabletti, päällystetty etinyyliestradioli ja gestodeeni Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista
Potilaan päiväkirja. Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi
 Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Isotretinoin Actavis
 Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Raskauden ja sikiöaltistuksen ehkäisyohjelma Potilaan opas Isotretinoin Actavis (isotretinoiini) 10 mg:n ja 20 mg:n pehmeät kapselit Isotretinoin Potilaan opas Tämän esitteen tarkoitus Tämä esite sisältää
Seasonique 150 mikrog/30 mikrog + 10 mikrog tabletti, kalvopäällysteinen levonorgestreeli/etinyyliestradioli etinyyliestradioli
 Pakkausseloste: Tietoa käyttäjälle Seasonique 150 mikrog/30 mikrog + 10 mikrog tabletti, kalvopäällysteinen levonorgestreeli/etinyyliestradioli etinyyliestradioli Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa käyttäjälle Seasonique 150 mikrog/30 mikrog + 10 mikrog tabletti, kalvopäällysteinen levonorgestreeli/etinyyliestradioli etinyyliestradioli Tähän lääkkeeseen kohdistuu lisäseuranta.
Nexplanon. 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
Ohje Xarelto -lääkkeen käyttäjälle
 Ohje Xarelto -lääkkeen käyttäjälle 2 Ohje Xarelto -lääkkeen käyttäjälle Lääkärisi on määrännyt Sinulle Xarelto - lääkevalmistetta. Tekonivelleikkauksen jälkeen laskimotukoksen eli veritulpan riski on tavallista
Ohje Xarelto -lääkkeen käyttäjälle 2 Ohje Xarelto -lääkkeen käyttäjälle Lääkärisi on määrännyt Sinulle Xarelto - lääkevalmistetta. Tekonivelleikkauksen jälkeen laskimotukoksen eli veritulpan riski on tavallista
TIETOA POTILAALLE. Janssenin lääketieto
 Suomen eturauhassyöpäyhdistys ry Lisätietoa eturauhassyövästä ja sen hoidoista. Eturauhassyöpäyhdistyksellä on potilasyhdistyksiä koko maassa. Yhteydenottopyynnön voi jättää osoitteessa www.propo.fi PROPO
Suomen eturauhassyöpäyhdistys ry Lisätietoa eturauhassyövästä ja sen hoidoista. Eturauhassyöpäyhdistyksellä on potilasyhdistyksiä koko maassa. Yhteydenottopyynnön voi jättää osoitteessa www.propo.fi PROPO
19.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3 mg laktoosimonohydraattia. Täydellinen apuaineluettelo, ks. kohta 6.
 1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
1. LÄÄKEVALMISTEEN NIMI Levodonna 1,5 mg tabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää 1,5 mg levonorgestreeliä. Apuaine, jonka vaikutus tunnetaan: yksi tabletti sisältää 43,3
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
PAKKAUSSELOSTE. Gracial tabletit desogestreeli/etinyyliestradioli
 PAKKAUSSELOSTE Gracial tabletit desogestreeli/etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista palautuvista raskaudenehkäisykeinoista.
PAKKAUSSELOSTE Gracial tabletit desogestreeli/etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista palautuvista raskaudenehkäisykeinoista.
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta sikiöepämuodostumien
Pakkausseloste: Tietoa käyttäjälle. Kosidina 75 mikrog/30mikrog tabletti gestodeeni / etinyyliestradioli
 Pakkausseloste: Tietoa käyttäjälle Kosidina 75 mikrog/30mikrog tabletti gestodeeni / etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: - Oikein käytettyinä ne ovat yksi luotettavimmista
Pakkausseloste: Tietoa käyttäjälle Kosidina 75 mikrog/30mikrog tabletti gestodeeni / etinyyliestradioli Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: - Oikein käytettyinä ne ovat yksi luotettavimmista
LIITE III. Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin
 HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
HUOM! LIITE III Muutokset valmisteyhteenvedon ja pakkausselosteen olennaisiin osiin Kansallisten viranomaisten on mahdollisesti jälkeenpäin päivitettävä valmisteyhteenvedot ja pakkausselosteet tarpeen
Versio 7, INSTANYL -VALMISTEEN KÄYTTÖOPAS KERTA-ANNOSPAKKAUS Intranasaalinen fentanyylisumute
 INSTANYL -VALMISTEEN KÄYTTÖOPAS KERTA-ANNOSPAKKAUS Intranasaalinen fentanyylisumute TÄRKEÄÄ TURVALLISUUSTIETOA INSTANYL -VALMISTEESTA Tutustu huolellisesti tähän oppaaseen ja lue lääkepakkauksessa oleva
INSTANYL -VALMISTEEN KÄYTTÖOPAS KERTA-ANNOSPAKKAUS Intranasaalinen fentanyylisumute TÄRKEÄÄ TURVALLISUUSTIETOA INSTANYL -VALMISTEESTA Tutustu huolellisesti tähän oppaaseen ja lue lääkepakkauksessa oleva
Pakkausseloste: Tietoa potilaalle. Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi
 Pakkausseloste: Tietoa potilaalle Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita
Pakkausseloste: Tietoa potilaalle Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita
POTILASOPAS. Valproaatti* (Absenor, Deprakine, Orfiril, Orfiril Long, Valproat Sandoz) Ehkäisy ja raskaus: Mitä sinun on tiedettävä
 POTILASOPAS Valproaatti* (Absenor, Deprakine, Orfiril, Orfiril Long, Valproat Sandoz) Ehkäisy ja raskaus: Mitä sinun on tiedettävä Tämä opas on tarkoitettu tytöille ja naisille, jotka käyttävät valproaattia
POTILASOPAS Valproaatti* (Absenor, Deprakine, Orfiril, Orfiril Long, Valproat Sandoz) Ehkäisy ja raskaus: Mitä sinun on tiedettävä Tämä opas on tarkoitettu tytöille ja naisille, jotka käyttävät valproaattia
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
INSTANYL -VALMISTEEN KÄYTTÖOPAS KERTA-ANNOSPAKKAUS Intranasaalinen fentanyylisumute
 ETUKANSI INSTANYL -VALMISTEEN KÄYTTÖOPAS KERTA-ANNOSPAKKAUS Intranasaalinen fentanyylisumute TÄRKEÄÄ TURVALLISUUSTIETOA INSTANYL -VALMISTEESTA Tutustu huolellisesti tähän oppaaseen ja lue lääkepakkauksessa
ETUKANSI INSTANYL -VALMISTEEN KÄYTTÖOPAS KERTA-ANNOSPAKKAUS Intranasaalinen fentanyylisumute TÄRKEÄÄ TURVALLISUUSTIETOA INSTANYL -VALMISTEESTA Tutustu huolellisesti tähän oppaaseen ja lue lääkepakkauksessa
Firmagon eturauhassyövän hoidossa
 Firmagon eturauhassyövän hoidossa Käytännön tietoa ja ohjeita potilaalle Eturauhassyöpään sairastuminen ja sen hoito aiheuttavat uuden elämäntilanteen. Mielessä voi pyöriä monia kysymyksiä. Ajatusten kanssa
Firmagon eturauhassyövän hoidossa Käytännön tietoa ja ohjeita potilaalle Eturauhassyöpään sairastuminen ja sen hoito aiheuttavat uuden elämäntilanteen. Mielessä voi pyöriä monia kysymyksiä. Ajatusten kanssa
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
Pakkausseloste: Tietoa käyttäjälle. Zelle 0,02 mg/3 mg tabletit (etinyyliestradioli ja drospirenoni)
 Pakkausseloste: Tietoa käyttäjälle Zelle 0,02 mg/3 mg tabletit (etinyyliestradioli ja drospirenoni) Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista palautuvista
Pakkausseloste: Tietoa käyttäjälle Zelle 0,02 mg/3 mg tabletit (etinyyliestradioli ja drospirenoni) Tärkeitä tietoja yhdistelmäehkäisyvalmisteista: Oikein käytettyinä ne ovat yksi luotettavimmista palautuvista
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONS
 Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONSVÆSKE, OPLØSNING I FYLDT PEN 250 mikrogram/mikrogrammaa
Bruksanvisning Käyttöohjeet Brugsanvisning INJEKTIONSVÄTSKA, LÖSNING I FÖRFYLLD INJEKTIONSPENNA INJEKTIONESTE, LIUOS, ESITÄYTETYSSÄ KYNÄSSÄ INJEKTIONSVÆSKE, OPLØSNING I FYLDT PEN 250 mikrogram/mikrogrammaa
Pakkausseloste: Tietoa käyttäjälle. Lomustine medac 40 mg kapselit, kova
 Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle. estradiolivaleraatti/dienogesti
 Pakkausseloste: Tietoa käyttäjälle Qlaira kalvopäällysteiset tabletit estradiolivaleraatti/dienogesti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
Pakkausseloste: Tietoa käyttäjälle Qlaira kalvopäällysteiset tabletit estradiolivaleraatti/dienogesti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS
 EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
epalvelupolku - ehkäisypotilas
 epalvelupolku - ehkäisypotilas 1 Johdanto Tässä dokumentissa on kuvattu eppu palvelun hoidontarpeen arvioinnin testi ehkäisypotilaalle. Testiin kuuluu arviointiin liittyvät kysymykset, vastaukset ja hoidontarpeen
epalvelupolku - ehkäisypotilas 1 Johdanto Tässä dokumentissa on kuvattu eppu palvelun hoidontarpeen arvioinnin testi ehkäisypotilaalle. Testiin kuuluu arviointiin liittyvät kysymykset, vastaukset ja hoidontarpeen
Tärkeää tietoa GILENYA -hoidosta
 Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
OPAS KOTIPISTOSHOITOON
 OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
Gynekologinen tutkimus
 Gynekologinen tutkimus Gynekologinen tutkimus tarkoittaa sisätutkimusta, jonka lääkäri tekee naiselle emättimen kautta. Sisätutkimuksen tekijä on yleislääkäri tai erikoislääkäri. Jos hän on erikoislääkäri,
Gynekologinen tutkimus Gynekologinen tutkimus tarkoittaa sisätutkimusta, jonka lääkäri tekee naiselle emättimen kautta. Sisätutkimuksen tekijä on yleislääkäri tai erikoislääkäri. Jos hän on erikoislääkäri,
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Olmesartan medoxomil STADA. 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista.
 1 kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista. 2 3 Sisältö Miten Uptravi otetaan?............................................ 4 Miten
1 kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista. 2 3 Sisältö Miten Uptravi otetaan?............................................ 4 Miten
PAKKAUSSELOSTE. Pantoprazole Teva 40 mg enterotabletit. pantopratsoli
 PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
YASMIN, YASMINELLE, YAZ LINATERA, LIOFORA (drospirenoni + etinyyliestradioli) 06/2016, Versio 2.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 1/6 YASMIN, YASMINELLE, YAZ LINATERA, LIOFORA (drospirenoni + etinyyliestradioli) 06/2016, Versio 2.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden
1/6 YASMIN, YASMINELLE, YAZ LINATERA, LIOFORA (drospirenoni + etinyyliestradioli) 06/2016, Versio 2.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden
Caprelsa. Vandetanibi CAPRELSA (VANDETANIBI) POTILAAN JA POTILAAN HUOLTAJAN (PEDIATRINEN KÄYTTÖ) OPAS ANNOSTELUSTA JA SEURANNASTA
 Caprelsa Vandetanibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Caprelsa Vandetanibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
TIETOA MYOOMISTA JA ESMYA -HOIDOSTA
 TIETOA MYOOMISTA JA ESMYA -HOIDOSTA Olet saanut tämän esitteen lääkäriltäsi/sairaanhoitajaltasi Sisältö 3 Tietoa myoomista 6 Myoomien oireet 9 Myoomien hoito 10 Tietoa Esmyasta 13 Haittavaikutukset 14
TIETOA MYOOMISTA JA ESMYA -HOIDOSTA Olet saanut tämän esitteen lääkäriltäsi/sairaanhoitajaltasi Sisältö 3 Tietoa myoomista 6 Myoomien oireet 9 Myoomien hoito 10 Tietoa Esmyasta 13 Haittavaikutukset 14
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
Oppaasi tupakoinnin lopettamiseen CHAMPIX :in (varenikliinin) avulla
 Oppaasi tupakoinnin lopettamiseen CHAMPIX :in (varenikliinin) avulla Lue aina lääkepakkauksen mukana tuleva pakkausseloste. Lisätietoja haittavaikutusilmoituksen tekemisestä on osoitteessa https://www.terveydentukena.fi/eroontupakasta
Oppaasi tupakoinnin lopettamiseen CHAMPIX :in (varenikliinin) avulla Lue aina lääkepakkauksen mukana tuleva pakkausseloste. Lisätietoja haittavaikutusilmoituksen tekemisestä on osoitteessa https://www.terveydentukena.fi/eroontupakasta
