Aclasta -potilasopas. osteoporoosin hoidossa
|
|
|
- Otto Sariola
- 7 vuotta sitten
- Katselukertoja:
Transkriptio
1 Aclasta -potilasopas osteoporoosin hoidossa
2 Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa. Lue opas huolellisesti, sillä se sisältää tärkeää tietoa. Tutustu myös sivulta 8 alkavaan Aclasta-pakkausselosteeseen. Jos sinulla on kysyttävää tai olet epävarma jostakin, käänny lääkärin, sairaanhoitajan tai apteekkihenkilökunnan puoleen. Usein kysyttyä Mitä Aclasta on? Aclasta on lääke osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski. Aclasta kuuluu bisfosfonaattien lääkeryhmään. Aclastan vaikuttava aine on tsoledronihappo. Aclasta sisältää myös seuraavia apuaineita: mannitoli, natriumsitraatti ja vesi. Miten Aclasta vaikuttaa? Aclasta vaikuttaa sitoutumalla luuhun. Se estää luuta hajoamasta liian nopeasti ja suojaa sitä pahemmilta vaurioilta. Lääkärisi voi tarkistaa mineraalitiheyden mittauksella, esim. eräänlaisen röntgenkuvauksen tai ultraäänitutkimuksen avulla, että Aclasta vaikuttaa toivotulla tavalla. Miten Aclastaa annetaan? Tavanomainen annos on 5 mg, ja lääkäri tai hoitaja antaa sen sinulle infuusiona (tiputuksena) laskimoon. Infuusio kestää vähintään 15 minuuttia. Jos sinulla on kysyttävää infuusiosta, käänny lääkärin tai hoitajan puoleen. Kuinka usein Aclastaa pitää antaa? Aclasta-infuusio annetaan kerran vuodessa. Missä Aclastaa annetaan? Voit saada Aclasta-infuusion joko lääkärisi vastaanotolla, terveyskeskuksessa, sairaalassa tai muussa paikassa, johon lääkärisi on ohjannut sinut saamaan hoitoa. Se ei yleensä edellytä yöpymistä sairaalassa. 2 3
3 Mitä minun pitää kertoa lääkärilleni ENNEN Aclasta-infuusiota? Ennen Aclasta-infuusiota on tärkeää, että kerrot lääkärillesi: jos saat Zometa-hoitoa, koska sen vaikuttava aine on sama kuin Aclastan. jos sinulla on aiemmin esiintynyt munuaisvaivoja, sillä munuaisten on pystyttävä poistamaan luuhun imeytymätön Aclasta elimistöstä. jos kaulassasi sijaitsevat lisäkilpirauhaset on poistettu kokonaan tai osittain. jos sinulle on tehty suolen osittainen poistoleikkaus. jos sinulla on tai on aiemmin ollut leuan alueen kipua, turvotusta tai puutumista, tai jos jokin hampaistasi on löystynyt. kaikista käyttämistäsi lääkkeistä, mukaan lukien: - reseptilääkkeet - itsehoitolääkkeet - rohdosvalmisteet ja vitamiinit Et voi saada Aclastaa, jos: olet allerginen sille, sen apuaineille tai muille bisfosfonaateille. kalsiumarvosi on liian matala. sairastat vakavaa munuaistautia. olet raskaana, suunnittelet raskautta tai imetät. Mitä minun pitää tehdä ENNEN Aclasta-infuusiota? On tärkeää, että juot riittävästi nestettä (vähintään yksi tai kaksi lasillista) ENNEN Aclasta-infuusiota. Se auttaa ehkäisemään elimistön kuivumista. Voit syödä normaalisti Aclasta-infuusion antopäivänä. Mitä on odotettavissa Aclasta-infuusion JÄLKEEN? Kuten kaikki lääkkeet, Aclastakin voi aiheuttaa haittavaikutuksia joillekin ihmisille. Aclasta voi aiheuttaa seuraavan kaltaisia oireita: - kuume ja vilunväreet flunssankaltaiset oireet - lihas-, luu- tai nivelkipu - päänsärky Useimmat näistä oireista kehittyvät kolmen päivän sisällä Aclasta-infuusion antamisesta. Ne ovat useimmiten lieviä tai keskivaikeita ja häviävät kolmen päivän kuluessa oireiden alkamisesta. Lääkärisi voi suositella näiden haittavaikutusten hoitoon jotakin mietoa kipulääkettä, kuten parasetamolia tai ibuprofeenia. Jos oireet eivät häviä itsestään tai pahenevat, kerro asiasta lääkärillesi. Seuraavien Aclasta-infuusioiden yhteydessä näiden haittavaikutusten riski pienenee. Munuaisvaivat Munuaisvaivoja (kuten vähentynyttä virtsaamista) on esiintynyt Aclastahoitoa saavilla potilailla. Sydämen rytmihäiriöt (eteisvärinä) Aclastaa postmenopausaalisen osteoporoosin hoitoon käyttävillä potilailla on todettu sydämen rytmihäiriöitä. Toistaiseksi ei tiedetä, aiheuttaako Aclasta tällaisia rytmihäiriöitä vai ei. Jos sinulla esiintyy epäsäännöllistä rytmiä, tykytyksen tunnetta, huimausta tai hengenahdistusta, kerro niistä lääkärillesi. Allergia Allergisia reaktioita on raportoitu; mukaan lukien harvoja tapauksia, joissa on ilmennyt hengitysvaikeuksia, nokkosihottumaa ja angioedeemaa (esim. kasvojen, kielen tai nielun turpoaminen). Yksittäisiä hyvin vakavia allergisia reaktioita on myös raportoitu. Suun oireita Kipua suussa, hampaissa ja leuassa, turpoamista tai haavaumia suun sisäpuolella, tunnottomuutta tai paineen tunnetta leuassa tai hampaan irtoamista on esiintynyt Aclasta-hoitoa saavilla potilailla. Jos sinulle kehittyy tällaisia oireita, kerro niistä lääkärillesi tai hammaslääkärillesi. Matalat kalsiumarvot Bisfosfonaattien tiedetään voivan aiheuttaa kalsiumarvojen laskua (hypokalsemiaa). Tämän voi estää huolehtimalla siitä, että ruokavalio sisältää riittävästi kalsiumia tai käyttämällä kalsium- ja D-vitamiinilisää. Lääkärisi kertoo sinulle millaisia oireita hypokalsemia aiheuttaa. 4 5
4 Tavallisesta poikkeavat reisiluun murtumat Tavallisesta poikkeavia reisiluun murtumia voi harvoin ilmetä etenkin niillä potilailla, jotka saavat pitkäaikaista hoitoa osteoporoosiin. Ota yhteys lääkäriin, jos koet kipua, heikkoutta tai muutoin epämukavaa oloa reidessäsi, lonkassasi tai nivusissasi, sillä tällaiset oireet saattavat olla varhaisia merkkejä mahdollisesta reisiluun murtumasta. Tämä haittavaikutusluettelo ei ole tyhjentävä. Tutustu myös liitteenä olevaan pakkausselosteeseen ja käänny lääkärin puoleen, jos sinulla on kysyttävää haittavaikutuksista. Jos havaitset sellaisia haittavaikutuksia, joita ei ole tässä selosteessa mainittu tai kokemasi haittavaikutus muuttuu vakavaksi, kerro niistä lääkärillesi, apteekkihenkilökunnalle tai terveydenhoitajalle. Vaikuttaako Aclasta ajokykyyn? Haittavaikutukset, kuten huimaus, voivat vaikuttaa ajokykyyn tai kykyyn käyttää koneita, vaikka tähän liittyviä tutkimuksia Aclastalla ei olekaan tehty. Voit auttaa itseäsi seuraavin keinoin: Syö terveellisesti ja huolehdi riittävästä kalsiumin ja D-vitamiinin saannista. D-vitamiini edistää kalsiumin imeytymistä. Hyviä kalsiumin lähteitä ovat: maitotuotteet, esim. maito, jogurtti ja juusto Harrasta säännöllisesti liikuntaa (etenkin voimaharjoittelu on tärkeää), sillä se ylläpitää nivelten liikkuvuutta ja vahvistaa luita. Vähennä tupakointia tai lopeta se mieluiten kokonaan. Tupakka on haitallista myös luille. Myös alkoholinkäytön vähentämisellä voi olla myönteisiä vaikutuksia luuston terveyteen. Estä kaatumiset ennalta ja poista asunnostasi kaikki liukkaat lattiamateriaalit, hanki kylpyammeeseen ja suihkuun liukuestematot ja asenna tukitankoja tarpeellisiin paikkoihin. Mistä saan lisätietoa osteoporoosista? Novartis Finland Oy jakaa tämän tiedotteen kaikille potilaille, joille lääkäri määrää Aclastaa. Pyrkimyksenä on palvella sekä lääketiedettä että potilaiden hoitoa. Lisätietoja saa myös esim. Suomen Luustoliitto ry:stä ja sen paikallisista jäsenyhdistyksistä ( tai Suomalaisen Lääkäriseura Duodecimin Käypä hoito -suosituksesta osteoporoosin hoitoon potilaille ( Muistiinpanoja Hyviä D-vitamiinin lähteitä ovat: rasvainen kala, esim. lohi, sardiini ja silli vitaminoidut elintarvikkeet, esim. maitotuotteet (ei luomu-) ja ravintorasvat D-vitamiinia saat myös muista ruoka-aineista esim. kananmunat, tofu ja soijapavut 6 7
5 PAKKAUSSELOSTE: Tietoa käyttäjälle Aclasta 5 mg infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. - Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta 4. Tässä pakkausselosteessa kerrotaan 1. Mitä Aclasta on ja mihin sitä käytetään 2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Aclastaa 3. Miten Aclastaa annetaan 4. Mahdolliset haittavaikutukset 5. Aclastan säilyttäminen 6. Pakkauksen sisältö ja muuta tietoa 1. Mitä Aclasta on ja mihin sitä käytetään Aclasta sisältää vaikuttavana aineena tsoledronihappoa. Se kuuluu bisfosfonaattien lääkeryhmään ja sitä käytetään aikuisten miesten ja vaihdevuodet ohittaneiden naisten osteoporoosin hoitoon, tai tulehdusten hoitoon käytettävien kortikosteroidihoitojen aiheuttaman osteoporoosin hoitoon sekä Pagetin luutaudin hoitoon aikuisilla. Osteoporoosi Osteoporoosi on sairaus, jossa luut haurastuvat ja heikkenevät. Sitä esiintyy yleisesti naisilla vaihdevuosien jälkeen, mutta sitä voi esiintyä myös miehillä. Vaihdevuosien aikana naisen munasarjat lakkaavat tuottamasta naishormonia, estrogeenia, joka ylläpitää luiden kuntoa. Vaihdevuosien jälkeen luumassa pienenee, ja luut heikkenevät ja murtuvat helpommin kuin ennen. Osteoporoosia voi myös esiintyä miehillä ja naisilla pitkäaikaisen steroidien käytön johdosta, joka voi vaikuttaa luun lujuuteen. Monilla potilailla ei ole lainkaan osteoporoosin oireita, mutta heillä on silti tavallista suurempi riski saada murtumia, sillä osteoporoosi on ehtinyt heikentää luita. Veren sukupuolihormonien (lähinnä androgeenistä muodostuvan estrogeenin) määrän väheneminen saa myös miesten luumassan pienenemään, joskin hitaammin. Aclasta vahvistaa sekä miesten että naisten luuta ja ehkäisee näin murtumia. Aclastaa käytetään myös potilailla, jotka ovat murtaneet lonkkansa hiljattain vähäisen vamman kuten kaatumisen seurauksena ja ovat siksi alttiimpia uusille luunmurtumille. Pagetin luutauti Normaalisti vanha luu hajoaa ja korvautuu uudella luumateriaalilla. Tästä prosessista käytetään nimitystä uudelleenmuodostus. Pagetin luutaudissa luun uudelleenmuodostus on liian nopeaa ja uutta luuta muodostuu hallitsemattomasti. Tämä tekee luusta normaalia heikompaa. Ellei tautia hoideta, luut saattavat muuttua epämuodostuneeksi ja kipeytyä ja ne saattavat murtua. Aclastan vaikutuksesta luun uudelleenmuodostus palautuu normaaliksi, joka turvaa normaalin luun muodostumisen. Tästä syystä luu vahvistuu. 2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Aclastaa Noudata tarkoin lääkärin, apteekkihenkilökunnan tai sairaanhoitajan ohjeita ennen kuin sinulle annetaan Aclastaa. Sinulle ei saa antaa Aclastaa - jos olet allerginen tsoledronihapolle, muille bisfosfonaateille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6). - jos sinulla on hypokalsemia (eli veresi kalsiumtaso on liian alhainen). - jos sairastat vakavaa munuaistautia. - jos olet raskaana. - jos imetät. Varoitukset ja varotoimet Keskustele lääkärin kanssa ennen kuin sinulle annetaan Aclastaa: - jos saat mitä tahansa muuta tsoledronihappoa sisältävää lääkettä, joka on myös Aclastan vaikuttava aine (tsoledronihappoa käytetään aikuispotilailla tiettyjen syöpätyyppien hoidossa ehkäisemään luustokomplikaatioita tai vähentämään kalsiumin määrää). - jos sinulla on tai on ollut munuaisongelma. - jos et pysty ottamaan päivittäin kalsiumlisää. - jos kaulassasi sijaitsevat lisäkilpirauhaset on poistettu kokonaan tai osittain leikkauksella. - jos osia suolistostasi on poistettu. Haittavaikutus, jota kutsutaan leuan osteonekroosiksi (ONJ) (luuvaurio leuassa) on raportoitu markkinoille tulon jälkeen potilailla, jotka ovat saaneet Aclastaa (tsoledronihappo) osteoporoosin hoitoon. Leuan osteonekroosia voi ilmetä myös hoidon lopettamisen jälkeen. Leuan osteonekroosin kehittymisen estäminen on tärkeää, koska kyseessä on kivulias vaiva, jonka hoitaminen voi olla vaikeaa. Leuan osteonekroosin kehittymisen riskin pienentämiseksi on varotoimia, joita sinun tulee noudattaa. 8 9
6 Ennen kuin sinulle annetaan Aclastaa, kerro lääkärille, apteekkihenkilökunnalle tai hoitajalle, jos - sinulla on ongelmia suun tai hampaiden kanssa kuten esim. huono hampaiden kunto, iensairaus tai suunniteltu hampaan poisto; - et käy säännöllisesti tai et ole pitkään aikaan käynyt hammastarkastuksessa; - tupakoit (sillä tämä saattaa lisätä hammasongelmien riskiä); - olet aikaisemmin saanut bisfosfonaattihoitoa (käytetään luuhäiriöiden hoitoon tai estämiseen); - käytät lääkkeitä, joita kutsutaan kortikosteroideiksi (esim. prednisoloni tai deksametasoni); - sinulla on syöpä. Lääkäri saattaa pyytää sinua käymään hammastarkastuksessa ennen Aclasta-hoidon aloittamista. Sinun tulee säilyttää hyvä suuhygienia (mukaan lukien säännöllinen hampaiden pesu) ja käydä säännöllisesti hammastarkastuksessa Aclasta-hoidon aikana. Jos käytät hammasproteesia, pidä huoli, että se istuu kunnolla. Jos saat hammashoitoja tai sinun on määrä mennä hammasleikkaukseen (esim. hampaan poisto), kerro siitä lääkärille ja kerro hammaslääkärille, että saat Aclasta-hoitoa. Ota välittömästi yhteyttä lääkäriin ja hammaslääkäriin, jos sinulla ongelmia suun tai hampaiden kanssa (esim. hampaiden heiluminen, kipu tai turvotus tai haavaumien parantumattomuus tai märkiminen) sillä ongelmat saattavat olla oire leuan osteonekroosista. Seurantakokeet Lääkäri teettää verikokeita tarkistaakseen munuaistesi toiminnan (veren kreatiniinipitoisuuden) ennen jokaista Aclasta-annosta. On tärkeää, että juot vähintään 2 lasillista nestettä (esim. vettä) muutaman tunnin sisällä ennen Aclastan antoa terveydenhuoltohenkilöstön ohjeiden mukaan. Lapset ja nuoret Aclastaa ei suositella alle 18-vuotiaille. Aclastan käyttöä lapsilla ja nuorilla ei ole tutkittu. Muut lääkevalmisteet ja Aclasta Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. Lääkärin on tärkeä tietää kaikista käyttämistäsi lääkkeistä, erityisesti jos käytät lääkkeitä, joiden tiedetään olevan haitallisia munuaisillesi (esim. aminogykosideja) tai nesteenpoistolääkkeitä kuten diureetteja, jotka voivat aiheuttaa kuivumista. Raskaus ja imetys Sinulle ei saa antaa Aclastaa, jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista. Kysy lääkäriltä, apteekista tai sairaanhoitajalta neuvoa ennen tämän lääkkeen käyttöä raskauden tai imetyksen aikana. Ajaminen ja koneiden käyttö Älä aja autoa tai käytä koneita ennen kuin olosi paranee, jos tunnet huimausta Aclasta-hoidon aikana. Aclasta sisältää natriumia Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 100 ml:n Aclasta-injektiopullo, eli se on olennaisesti natriumiton. 3. Miten Aclastaa annetaan Seuraa tarkasti kaikkia lääkärin tai hoitajan sinulle antamia ohjeita. Tarkista ohjeet lääkäriltä tai sairaanhoitajalta, jos olet epävarma. Osteoporoosi Tavallinen annos on 5 mg, jonka lääkäri tai hoitaja antaa sinulle yhtenä infuusiona kerran vuodessa laskimoon. Infuusion kesto on vähintään 15 minuuttia. Jos sinulla on hiljattain ollut lonkkamurtuma, suositus on, että Aclasta annetaan kahden tai useamman viikon kuluttua lonkkasi korjausleikkauksesta. On tärkeää, että käytät kalsium- ja D-vitamiinilisää (esim. tabletteja) lääkärisi ohjeiden mukaisesti. Osteoporoosin hoidossa Aclastan vaikutus kestää vuoden ajan. Lääkärisi kertoo sinulle milloin tulet saamaan seuraavan annoksen. Pagetin luutauti Pagetin luutautia hoidettaessa Aclastaa saa määrätä vain Pagetin luutaudin hoitoon perehtynyt lääkäri. Tavallinen annos on 5 mg, jonka lääkärisi tai hoitaja antaa sinulle kerralla aloitusannoksena suoneen. Infuusio kestää vähintään 15 minuuttia. Aclastan vaikutus saattaa kestää yli vuoden ajan, ja lääkärisi kertoo sinulle, tuleeko hoito uusia. Lääkärisi saattaa neuvoa sinua ottamaan kalsiumia ja D-vitamiinia (esim. tabletteja) vähintään ensimmäiset kymmenen päivää Aclastan annon jälkeen. On tärkeää, että seuraat huolellisesti tätä neuvoa infuusion jälkeisen jakson ajan, jotta veren kalsiumpitoisuus ei laske liian alhaiseksi. Lääkärisi antaa sinulle tietoa hypokalsemiaan liittyvistä oireista
7 Aclasta ruuan ja juoman kanssa Juo riittävästi nestettä (vähintään 1 2 lasillista) ennen Aclasta-hoitoa ja sen jälkeen lääkärin ohjeiden mukaisesti. Tämä ehkäisee nestehukkaa. Voit syödä normaalisti Aclasta-hoitopäivänä. Tämä on erityisen tärkeää, jos käytät diureetteja (nesteenpoistolääkkeitä) tai jos olet iäkäs (vähintään 65-vuotias). Jos Aclasta-annos jää saamatta Ota mahdollisimman pian yhteys lääkäriin tai sairaalaan uuden ajan varaamiseksi. Ennen Aclasta-hoidon lopettamista Jos harkitset Aclasta-hoidon lopettamista, keskustele asiasta lääkärisi kanssa seuraavan vastaanottokäynnin yhteydessä. Lääkärisi neuvoo sinua ja päättää, miten pitkään Aclasta-hoitoa tulee jatkaa. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. 4. Mahdolliset haittavaikutukset Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Ensimmäiseen infuusioon liittyvät haittavaikutukset ovat hyvin yleisiä (esiintyvät yli 30 %:lla potilaista), mutta seuraavien infuusioiden yhteydessä ne vähenevät. Valtaosa haittavaikutuksista, kuten kuume, vilunväreet, lihas- tai nivelkipu ja päänsärky, ilmaantuvat ensimmäisten kolmen päivän aikana Aclasta-annoksen jälkeen. Oireet ovat yleensä lieviä ja keskivaikeita ja häviävät kolmen päivän kuluessa. Lääkäri voi suositella jotakin mietoa kipulääkettä kuten ibuprofeenia tai parasetamolia vähentääkseen näitä haittavaikutuksia. Seuraavien Aclasta-annosten yhteydessä näiden haittavaikutusten riski pienenee. Jotkin haittavaikutukset voivat olla vakavia Yleiset (enintään 1 käyttäjällä 10:stä) Potilailla, jotka ovat saaneet Aclastaa vaihdevuosien jälkeisen osteoporoosin hoitoon, on todettu sydämen rytmihäiriöitä (eteisvärinää). Ei tiedetä, aiheuttaako Aclasta kyseisiä rytmihäiriöitä. Ilmoita kuitenkin lääkärille, jos sinulla on tällaisia oireita Aclastan annon jälkeen. Melko harvinaiset (enintään 1 käyttäjällä 100:sta) Silmien turvotus, punoitus, kipu tai kutina tai silmien valoherkkyys. Hyvin harvinaiset haittavaikutukset (enintään 1 käyttäjällä :sta) Kerro lääkärille, jos sinulla on korvakipua, korvatulehdus ja/tai korvasta vuotaa eritettä. Ne voivat olla korvan luuvaurion oireita. Tuntematon (saatavissa oleva tieto ei riitä yleisyyden arviointiin) Suun ja/tai leuan kipu, turvotus tai parantumattomat haavaumat suussa tai leuassa, haavaumien märkiminen, leuan tunnottomuus tai painon tunne leuassa tai hampaan löystyminen. Nämä voivat olla leuan luuvaurion (osteonekroosin) merkkejä. Ota heti yhteys lääkäriin ja hammaslääkäriin, jos huomaat tällaisia oireita Aclasta-hoidon aikana tai hoidon lopettamisen jälkeen. Munuaishäiriöitä (esim. virtsanerityksen vähenemistä) voi esiintyä. Ennen kutakin Aclasta-annosta lääkäri teettää verikokeita munuaistoiminnan arvioimiseksi. On tärkeää, että juot vähintään 2 lasillista nestettä (esim. vettä) muutaman tunnin sisällä ennen Aclastan antoa terveydenhuoltohenkilöstön ohjeiden mukaan. Jos sinulla on jokin edellä mainituista haittavaikutuksista, ota heti yhteys lääkäriin. Aclasta voi aiheuttaa myös muita haittavaikutuksia Hyvin yleinen haittavaikutus (yli 1 käyttäjällä 10:stä) Kuume. Yleiset haittavaikutukset (enintään 1 käyttäjällä 10:stä) Päänsärky, huimaus, huonovointisuus, oksentelu, ripuli, lihaskipu, luu- ja/tai nivelkipu, kipu selässä, käsivarsissa tai jaloissa, flunssankaltaiset oireet (esimerkiksi väsymys, vilunväreet, nivel- ja lihaskipua), vilunväreet, tunne väsymyksestä ja kiinnostuksen puutteesta, heikotus, kipu, huonovointisuuden tunne, infuusiokohdan turvotus ja/tai kipu. Pagetin luutautipotilailla on ilmoitettu veren alhaisesta kalsiumpitoisuudesta johtuvia oireita kuten lihaskramppeja, tunnottomuutta tai kihelmöintiä etenkin suun ympärillä. Melko harvinaiset haittavaikutukset (enintään 1 käyttäjällä 100:sta) Flunssa, ylähengitysteiden infektiot, punasolujen väheneminen, ruokahalun menetys, unettomuus, uneliaisuus johon saattaa liittyä vireystason ja tietoisuuden aleneminen, kihelmöinti tai puutuminen, äärimmäinen uneliaisuus, vapina, tilapäinen tajunnan menetys, silmätulehdus tai kivulias tai punoittava ärsytys ja tulehdus, huimauksen tunne, verenpaineen kohoaminen, punastuminen, yskä, hengenahdistus, vatsavaivoja, vatsakipua, ummetus, suun kuivuminen, närästys, ihottuma, voimakas hikoilu, kutina, ihon punoitus, niskakipua, lihas-, luu ja/tai niveljäykkyys, nivelturvotus, lihaskouristuksia, olkapääkipua, rintalihas- tai rintakehänkipu, niveltulehdus, lihasheikkous, poikkeava tulos munuaiskokeessa, poikkeava tiheä virtsaaminen, käsien, nilkkojen ja jalkojen turpoaminen, jano, hammassärkyä, makuaistin häiriöitä. Harvinaiset haittavaikutukset (enintään 1 käyttäjällä 1 000:sta) Poikkeavia reisiluun murtumia voi esiintyä harvoin, etenkin potilailla, jotka saavat pitkäaikaista hoitoa osteoporoosiin. Ota yhteys lääkäriin, jos reidessä, lonkassa tai nivusessa tuntuu kipua, heikkoutta tai epämukavaa tunnetta, sillä kyseessä voi olla mahdollisen reisiluun murtuman varhainen merkki
8 Tuntematon (saatavissa oleva tieto ei riitä yleisyyden arviointiin) Vaikea allerginen reaktio, johon liittyy huimausta ja hengenahdistusta, turvotusta pääasiassa kasvoissa ja kurkussa, verenpaineen laskua, kuivuminen liittyen annostelun jälkeisiin oireisiin, kuten kuumeeseen, oksenteluun ja ripuliin. Haittavaikutuksista ilmoittaminen Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan(ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta. www-sivusto: Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL FIMEA 5. Aclastan säilyttäminen Lääkärisi, apteekki tai hoitajasi tietää miten Aclasta tulee säilyttää. - Ei lasten ulottuville eikä näkyville. - Älä käytä tätä lääkettä pakkauksessa ja pullossa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. - Avaamaton pullo ei vaadi erityisiä säilytysolosuhteita. - Pullon avaamisen jälkeen valmiste tulee käyttää välittömästi, jotta siihen ei pääsisi mikrobeja. Ellei valmistetta käytetä välittömästi, käytönaikaiset säilytysolosuhteet ovat käyttäjän vastuulla eikä käyttöä edeltävä säilytysaika normaalisti saa ylittää 24 tuntia 2 C - 8 C lämpötilassa. Jääkaappikylmän liuoksen annetaan lämmetä huoneenlämpöiseksi ennen sen antamista potilaalle. 6. Pakkauksen sisältö ja muuta tietoa Mitä Aclasta sisältää - Vaikuttava aine on tsoledronihappo. Yksi pullo, jossa on 100 ml liuosta, sisältää tsoledronihappoa monohydraattina vastaten 5 mg tsoledronihappoa. Yksi ml liuosta sisältää tsoledronihappoa monohydraattina vastaten 0,05 mg tsoledronihappoa. - Muut aineet ovat mannitoli, natriumsitraatti ja injektionesteisiin käytettävä vesi. Aclastan kuvaus ja pakkauskoot Aclasta on kirkas, väritön liuos. Se toimitetaan käyttövalmiina infuusionesteenä 100 ml muovipulloissa. Valmiste toimitetaan yhden pullon yksikköpakkauksissa tai kerrannaispakkauksissa, jotka sisältävät viisi pakkausta, joista jokainen sisältää yhden pullon. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. Myyntiluvan haltija Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Iso-Britannia Valmistaja Novartis Pharma GmbH Roonstraße 25 D Nürnberg Saksa Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja. Novartis Finland Oy Metsänneidonkuja Espoo Puh: Tämä pakkausseloste on tarkistettu viimeksi 12/2015 Muut tiedonlähteet Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta
9 Kysyttävää Novartiksen valmisteesta? Novartis Lääkeinformaatiopalvelu puh , FI Osa riskinhallintasuunnitelmaa 9.1
Novartis Finland Oy. Aclasta-potilasopas osteoporoosin hoidossa
 Novartis Finland Oy Aclasta-potilasopas osteoporoosin hoidossa Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa.
Novartis Finland Oy Aclasta-potilasopas osteoporoosin hoidossa Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa.
Aclasta -potilasopas. osteoporoosin hoidossa
 Aclasta -potilasopas osteoporoosin hoidossa Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa. Lue opas huolellisesti,
Aclasta -potilasopas osteoporoosin hoidossa Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa. Lue opas huolellisesti,
Pakkausseloste: Tietoa käyttäjälle. Aclasta 5 mg infuusioneste, liuos Tsoledronihappo
 Pakkausseloste: Tietoa käyttäjälle Aclasta 5 mg infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä
Pakkausseloste: Tietoa käyttäjälle Aclasta 5 mg infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä
Tsoledronihappo SUN 5 mg
 POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti. Opas sisältää
POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti. Opas sisältää
Tsoledronihappo SUN 5 mg
 POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti.
POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti.
Ibandronat Stada 150 mg kalvopäällysteiset tabletit. 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. Risedronat Teva 35 mg kalvopäällysteiset tabletit. risedronaattinatrium
 PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
Tärkeää tietoa GILENYA -hoidosta. Tähän lääkkeeseen kohdistuu lisäseuranta.
 Tärkeää tietoa GILENYA -hoidosta Tähän lääkkeeseen kohdistuu lisäseuranta. Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin
Tärkeää tietoa GILENYA -hoidosta Tähän lääkkeeseen kohdistuu lisäseuranta. Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE. Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 PAKKAUSSELOSTE Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan Zometaa. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan Zometaa. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
XGEVA. (denosumabi) POTILASOPAS
 XGEVA (denosumabi) POTILASOPAS SISÄLLYS Sisällysluettelo 2 Miksi saat XGEVAa 3 Ennen XGEVA-hoitoa sekä hoidon aikana 5 Raskaus ja imetys 8 XGEVAn haittavaikutukset 8 Mitä on hyvä muistaa 10 Anna tämä kortti
XGEVA (denosumabi) POTILASOPAS SISÄLLYS Sisällysluettelo 2 Miksi saat XGEVAa 3 Ennen XGEVA-hoitoa sekä hoidon aikana 5 Raskaus ja imetys 8 XGEVAn haittavaikutukset 8 Mitä on hyvä muistaa 10 Anna tämä kortti
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
EXELON -depotlaastarin KÄYTTÖOHJEET JA LÄÄKITYSPÄIVÄKIRJA
 EXELON -depotlaastarin KÄYTTÖOHJEET JA LÄÄKITYSPÄIVÄKIRJA Tämä tieto on tärkeää Exelon-depotlaastarin turvallisen käytön varmistamiseksi. Käytetty depotlaastari poistettu? Uusi depotlaastari kiinnitetty
EXELON -depotlaastarin KÄYTTÖOHJEET JA LÄÄKITYSPÄIVÄKIRJA Tämä tieto on tärkeää Exelon-depotlaastarin turvallisen käytön varmistamiseksi. Käytetty depotlaastari poistettu? Uusi depotlaastari kiinnitetty
PAKKAUSSELOSTE. Pantoprazole Teva 40 mg enterotabletit. pantopratsoli
 PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. Prolia 60 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. XGEVA 120 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
Aineisto julkista yhteenvetoa varten
 STADA Arzneimittel AG Sivu 1 / 7 VI.2 Aineisto julkista yhteenvetoa varten Paminject 3 mg/ml infuusiokonsentraatti liuosta varten VI.2.1 Katsaus sairauden epidemiologiaan Hyvää lääketurvatoimintatapaa
STADA Arzneimittel AG Sivu 1 / 7 VI.2 Aineisto julkista yhteenvetoa varten Paminject 3 mg/ml infuusiokonsentraatti liuosta varten VI.2.1 Katsaus sairauden epidemiologiaan Hyvää lääketurvatoimintatapaa
Potilaan päiväkirja. Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi
 Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Liite I Tieteelliset päätelmät ja perusteet, joiden perusteella myyntilupien ehdot on muutettava
 Liite I Tieteelliset päätelmät ja perusteet, joiden perusteella myyntilupien ehdot on muutettava Tieteelliset päätelmät Ottaen huomioon arviointiraportin, jonka lääketurvatoiminnan riskinarviointikomitea
Liite I Tieteelliset päätelmät ja perusteet, joiden perusteella myyntilupien ehdot on muutettava Tieteelliset päätelmät Ottaen huomioon arviointiraportin, jonka lääketurvatoiminnan riskinarviointikomitea
PAKKAUSSELOSTE. Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani
 PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä
PAKKAUSSELOSTE. Erbitux 2 mg/ml infuusioneste, liuos Setuksimabi
 PAKKAUSSELOSTE Erbitux 2 mg/ml infuusioneste, liuos Setuksimabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Erbitux 2 mg/ml infuusioneste, liuos Setuksimabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit
 PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Aclasta 5 mg infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Kukin pullo, jossa on 100 ml liuosta, sisältää 5 mg vedetöntä tsoledronihappoa,
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Aclasta 5 mg infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Kukin pullo, jossa on 100 ml liuosta, sisältää 5 mg vedetöntä tsoledronihappoa,
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Pakkausseloste: Tietoa käyttäjälle. Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
RISKINHALLINTASUUNNITELMAN (RMP:n) YHTEENVETO (lääkevalmisteittain)
 OSA VI RISKINHALLINTASUUNNITELMAN (RMP:n) YHTEENVETO (lääkevalmisteittain) Riskinhallintasuunnitelman yhteenvedon muoto ja sisältö Riskinhallintasuunnitelman yhteenvedossa (osa VI) esitetyt tiedot perustuvat
OSA VI RISKINHALLINTASUUNNITELMAN (RMP:n) YHTEENVETO (lääkevalmisteittain) Riskinhallintasuunnitelman yhteenvedon muoto ja sisältö Riskinhallintasuunnitelman yhteenvedossa (osa VI) esitetyt tiedot perustuvat
Liite III. Valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin tehtävät muutokset
 Liite III Valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin tehtävät muutokset Huomautus: Kyseessä olevat valmisteyhteenvedon ja pakkausselosteen kohdat ovat lausuntopyyntömenettelyn tuloksia.
Liite III Valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin tehtävät muutokset Huomautus: Kyseessä olevat valmisteyhteenvedon ja pakkausselosteen kohdat ovat lausuntopyyntömenettelyn tuloksia.
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
Pakkausseloste: Tietoa käyttäjälle. Lomustine medac 40 mg kapselit, kova
 Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle. Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä VI.2.2 Yhteenveto hoidon hyödyistä VI.2.3 Hoidon hyötyihin liittyvät asiat, joita
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä VI.2.2 Yhteenveto hoidon hyödyistä VI.2.3 Hoidon hyötyihin liittyvät asiat, joita
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
PAKKAUSSELOSTE. VANTAVO 70 mg/5600 IU tabletit Alendronihappo/kolekalsiferoli
 PAKKAUSSELOSTE VANTAVO 70 mg/5600 IU tabletit Alendronihappo/kolekalsiferoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE VANTAVO 70 mg/5600 IU tabletit Alendronihappo/kolekalsiferoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE. Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi
 PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste.
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste.
PAKKAUSSELOSTE. Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa
 PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
VALMISTEYHTEENVETO. Hammaslääkärin tai lääkärin määräyksestä: Pre- ja postoperatiivinen desinfiointi suukirurgiassa ja parodontaalisessa kirurgiassa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Pakkausseloste: Tietoa käyttäjälle. Kipupois 200 mg tabletit. ibuprofeeni
 Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
B. PAKKAUSSELOSTE 40
 B. PAKKAUSSELOSTE 40 PAKKAUSSELOSTE Focetria injektioneste, suspensio Rokote pandeemiseen influenssaan (H1N1) (pinta-antigeeni, inaktivoitu, adjuvantoitu) Lue tämä seloste huolellisesti, ennen kuin saat
B. PAKKAUSSELOSTE 40 PAKKAUSSELOSTE Focetria injektioneste, suspensio Rokote pandeemiseen influenssaan (H1N1) (pinta-antigeeni, inaktivoitu, adjuvantoitu) Lue tämä seloste huolellisesti, ennen kuin saat
Aripiprazole Sandoz (aripipratsoli)
 Aripiprazole Sandoz (aripipratsoli) Esite potilaille/heistä huolehtiville henkilöille Tämä esite sisältää tärkeitä turvallisuustietoja, joihin sinun on tutustuttava ennen aripipratsolihoidon aloittamista
Aripiprazole Sandoz (aripipratsoli) Esite potilaille/heistä huolehtiville henkilöille Tämä esite sisältää tärkeitä turvallisuustietoja, joihin sinun on tutustuttava ennen aripipratsolihoidon aloittamista
PAKKAUSSELOSTE. Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo
 PAKKAUSSELOSTE Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE. Comtan 200 mg kalvopäällysteiset tabletit Entakaponi
 PAKKAUSSELOSTE Comtan 200 mg kalvopäällysteiset tabletit Entakaponi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Comtan 200 mg kalvopäällysteiset tabletit Entakaponi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
Opas Tietoja potilaille
 Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti
 Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Julkisen yhteenvedon osiot
 Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Osteoporoosi (luukato)
 Osteoporoosi (luukato) Lääkärikirja Duodecim Pertti Mustajoki, sisätautien erikoislääkäri Osteoporoosi tarkoittaa, että luun kalkkimäärä on vähentynyt ja luun rakenne muuttunut. Silloin luu voi murtua
Osteoporoosi (luukato) Lääkärikirja Duodecim Pertti Mustajoki, sisätautien erikoislääkäri Osteoporoosi tarkoittaa, että luun kalkkimäärä on vähentynyt ja luun rakenne muuttunut. Silloin luu voi murtua
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Pakkausseloste: Tietoa potilaalle. Baraclude 0,05 mg/ml oraaliliuos entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Suositukset maksan haittavaikutusten välttämiseksi. Valdoxan voi aiheuttaa haittavaikutuksena mm. muutoksia maksan toimintaan.
 Potilaan opas VALDOXAN Suositukset maksan haittavaikutusten välttämiseksi Valdoxan voi aiheuttaa haittavaikutuksena mm. muutoksia maksan toimintaan. Tässä oppaassa kerrotaan suosituksista maksan haittavaikutusten
Potilaan opas VALDOXAN Suositukset maksan haittavaikutusten välttämiseksi Valdoxan voi aiheuttaa haittavaikutuksena mm. muutoksia maksan toimintaan. Tässä oppaassa kerrotaan suosituksista maksan haittavaikutusten
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Vastasairastuneen tyypin 1 diabeetikon hoidon seurantavihko
 Tämä vihko on tarkoitettu tuoreen tyypin 1 diabeetikon hoidon seurannan avuksi. Seurantavihko tukee omaa oppimistasi sairauden alkuvaiheessa. Tämän avulla sinä ja hoitajasi pystytte tarkkailemaan ohjattujen
Tämä vihko on tarkoitettu tuoreen tyypin 1 diabeetikon hoidon seurannan avuksi. Seurantavihko tukee omaa oppimistasi sairauden alkuvaiheessa. Tämän avulla sinä ja hoitajasi pystytte tarkkailemaan ohjattujen
PAKKAUSSELOSTE. Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi
 PAKKAUSSELOSTE Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
Pakkausseloste: Tietoa potilaalle. Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas)
 Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
PAKKAUSSELOSTE. Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit. Rivastigmiini
 PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VALSARTAN/HYDROCHLOROTHIAZIDE ORION 80 MG/12,5 MG KALVOPÄÄLLYSTEISET TABLETIT VALSARTAN/HYDROCHLOROTHIAZIDE ORION 160 MG/12,5 MG KALVOPÄÄLLYSTEISET TABLETIT
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VALSARTAN/HYDROCHLOROTHIAZIDE ORION 80 MG/12,5 MG KALVOPÄÄLLYSTEISET TABLETIT VALSARTAN/HYDROCHLOROTHIAZIDE ORION 160 MG/12,5 MG KALVOPÄÄLLYSTEISET TABLETIT
PAKKAUSSELOSTE: TIEDOT KÄYTTÄJÄLLE. MEPACT 4 mg infuusiokuiva-aine suspensiota varten Mifamurtidi
 PAKKAUSSELOSTE: TIEDOT KÄYTTÄJÄLLE MEPACT 4 mg infuusiokuiva-aine suspensiota varten Mifamurtidi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita
PAKKAUSSELOSTE: TIEDOT KÄYTTÄJÄLLE MEPACT 4 mg infuusiokuiva-aine suspensiota varten Mifamurtidi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita
PAKKAUSSELOSTE. Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta
 PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani
 PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
OPAS KOTIPISTOSHOITOON
 OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Rehydron Optim jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää: Glukoosi, vedetön 6,75 g Natriumkloridi 1,30 g Natriumsitraatti
LUUKUDOS ELÄÄ! vanhaa luuta. luu hajoaa. kuoppa. luu rakentuu. uusiutunut luukudos
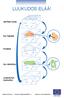 LUUKUDOS ELÄÄ! vanhaa luuta luu hajoaa kuoppa luu rakentuu uusiutunut luukudos VAHVA LUUSTO RAKENTUU kalsium + D-vitamiini + liikunta LUUN KUNTOA VOI KOHENTAA,LUUKATOA EHKÄISTÄ JA PYSÄYTTÄÄ 50 vuotta 60
LUUKUDOS ELÄÄ! vanhaa luuta luu hajoaa kuoppa luu rakentuu uusiutunut luukudos VAHVA LUUSTO RAKENTUU kalsium + D-vitamiini + liikunta LUUN KUNTOA VOI KOHENTAA,LUUKATOA EHKÄISTÄ JA PYSÄYTTÄÄ 50 vuotta 60
PAKKAUSSELOSTE. Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo
 PAKKAUSSELOSTE Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
POTILAAN OPAS. EYLEA likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoidossa
 POTILAAN OPAS EYLEA likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoidossa EYLEA Potilaan opas Lääkäri on määrännyt sinulle EYLEA -hoidon, koska sinulla on todettu likitaitteisuuden aiheuttama
POTILAAN OPAS EYLEA likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoidossa EYLEA Potilaan opas Lääkäri on määrännyt sinulle EYLEA -hoidon, koska sinulla on todettu likitaitteisuuden aiheuttama
Nucala. 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 25 BROMOKRIPTIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON MERKITYKSELLISIIN KOHTIIN TEHTÄVÄT MUUTOKSET 4.2 Annostus ja antotapa
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 25 BROMOKRIPTIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON MERKITYKSELLISIIN KOHTIIN TEHTÄVÄT MUUTOKSET 4.2 Annostus ja antotapa
VALMISTEYHTEENVETO. Tämä lääkevalmiste on tarkoitettu vain IgE-välitteisen allergian spesifiseen diagnostiseen käyttöön.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SOLUPRICK SQ hyönteismyrkyt, liuos ihopistotestiin - 801 Mehiläisen myrkky (Apis mellifera) - 802 Ampiaisen myrkky (Vespula spp.) 2. VAIKUTTAVAT AINEET JA NIIDEN
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI SOLUPRICK SQ hyönteismyrkyt, liuos ihopistotestiin - 801 Mehiläisen myrkky (Apis mellifera) - 802 Ampiaisen myrkky (Vespula spp.) 2. VAIKUTTAVAT AINEET JA NIIDEN
VALMISTEYHTEENVETO. Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia vastaten 1,5 g glukosamiinisulfaattia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Glucosamin Orifarm 1,5 g jauhe oraaliliuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi annospussi sisältää glukosamiinisulfaattinatriumkloridikompleksia
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Zoledronic acid Fair-Med 5 mg / 100 ml infuusioneste liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zoledronic acid Fair-Med 5 mg / 100 ml infuusioneste liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi injektiopullo, jossa on 100 ml liuosta, sisältää 5 mg tsoledronihappoa.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Zoledronic acid Fair-Med 5 mg / 100 ml infuusioneste liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi injektiopullo, jossa on 100 ml liuosta, sisältää 5 mg tsoledronihappoa.
Tavallisia lasten oireita kuinka hoidan ja milloin hoitoon?
 Korvakipu Kutina ja kipu, kuume, mahdollisesti märkävuotoa korvasta. Anna kipulääkettä ohjeen mukaan helpottamaan kipua ja laskemaan kuumetta. Kohoasento nukkuessa voi helpottaa kipua. Päivystyskäynti
Korvakipu Kutina ja kipu, kuume, mahdollisesti märkävuotoa korvasta. Anna kipulääkettä ohjeen mukaan helpottamaan kipua ja laskemaan kuumetta. Kohoasento nukkuessa voi helpottaa kipua. Päivystyskäynti
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
PAKKAUSSELOSTE. Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli
 PAKKAUSSELOSTE Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE. Pravafenix 40 mg / 160 mg, kovat kapselit Pravastatiini/fenofibraatti
 PAKKAUSSELOSTE Pravafenix 40 mg / 160 mg, kovat kapselit Pravastatiini/fenofibraatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Pravafenix 40 mg / 160 mg, kovat kapselit Pravastatiini/fenofibraatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS
 EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Trazec 60 mg kalvopäällysteiset tabletit Trazec 120 mg kalvopäällysteiset tabletit Trazec 180 mg kalvopäällysteiset tabletit Nateglinidi Lue tämä seloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE Trazec 60 mg kalvopäällysteiset tabletit Trazec 120 mg kalvopäällysteiset tabletit Trazec 180 mg kalvopäällysteiset tabletit Nateglinidi Lue tämä seloste huolellisesti, ennen kuin aloitat
Cozaar. Merck Sharp & Dohme BV. 26.2.2013, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Cozaar Merck Sharp & Dohme BV 26.2.2013, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkeaa verenpainetta, josta
Cozaar Merck Sharp & Dohme BV 26.2.2013, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkeaa verenpainetta, josta
VALMISTEYHTEENVETO. Täydellisen parenteraalisen ravitsemuksen täydennyksenä vesiliukoisten vitamiinien päivittäisen tarpeen tyydyttämiseksi.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Soluvit infuusiokuiva-aine, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi Soluvit-injektiopullo sisältää: Yksi pullo sisältää vaikuttavia aineita:
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Trulicity 0,75 mg injektioneste, liuos, esitäytetty kynä Trulicity 1,5 mg injektioneste, liuos, esitäytetty kynä dulaglutidi Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Trulicity 0,75 mg injektioneste, liuos, esitäytetty kynä Trulicity 1,5 mg injektioneste, liuos, esitäytetty kynä dulaglutidi Tähän lääkkeeseen kohdistuu lisäseuranta.
Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi
 Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi Tärkeää tietoa TASIGNA-hoidosta Mitä TASIGNA ON? TASIGNA on reseptilääke, jota käytetään Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian
Tasigna (nilotinibi) Tärkeää tietoa lääkehoidostasi Tärkeää tietoa TASIGNA-hoidosta Mitä TASIGNA ON? TASIGNA on reseptilääke, jota käytetään Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
Hivenaineiden perustarpeen sekä hiukan lisääntyneen tarpeen tyydyttämiseen laskimoravitsemuksen yhteydessä.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Addaven infuusiokonsentraatti, liuosta varten 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Addaven sisältää: 1 ml 1 ampulli (10 ml) Kromikloridi 6 H 2 O 5,33 mikrog
IBANDRONIHAPPO RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 IBANDRONIHAPPO Päivämäärä: 25.7.2016, Versio: 3.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Luustoon liittyvien tapahtumien
IBANDRONIHAPPO Päivämäärä: 25.7.2016, Versio: 3.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Luustoon liittyvien tapahtumien
Tärkeää tietoa GILENYA -hoidosta
 Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
