Aclasta -potilasopas. osteoporoosin hoidossa
|
|
|
- Pentti Seppälä
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 Aclasta -potilasopas osteoporoosin hoidossa
2 Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa. Lue opas huolellisesti, sillä se sisältää tärkeää tietoa. Tutustu myös sivulta 8 alkavaan Aclasta-pakkausselosteeseen. Jos sinulla on kysyttävää tai olet epävarma jostakin, käänny lääkärin, sairaanhoitajan tai apteekkihenkilökunnan puoleen. 2
3 Usein kysyttyä Mitä Aclasta on? Aclasta on lääke osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski. Aclasta kuuluu bisfosfonaattien lääkeryhmään. Aclastan vaikuttava aine on tsoledronihappo. Aclasta sisältää myös seuraavia apuaineita: mannitoli, natriumsitraatti ja vesi. Miten Aclasta vaikuttaa? Aclasta vaikuttaa sitoutumalla luuhun. Se estää luuta hajoamasta liian nopeasti ja suojaa sitä pahemmilta vaurioilta. Lääkärisi voi tarkistaa mineraalitiheyden mittauksella, esim. eräänlaisen röntgenkuvauksen tai ultraäänitutkimuksen avulla, että Aclasta vaikuttaa toivotulla tavalla. Miten Aclastaa annetaan? Tavanomainen annos on 5 mg, ja lääkäri tai hoitaja antaa sen sinulle infuusiona (tiputuksena) laskimoon. Infuusio kestää vähintään 15 minuuttia. Jos sinulla on kysyttävää infuusiosta, käänny lääkärin tai hoitajan puoleen. Kuinka usein Aclastaa pitää antaa? Aclasta-infuusio annetaan kerran vuodessa. Missä Aclastaa annetaan? Voit saada Aclasta-infuusion joko lääkärisi vastaanotolla, terveyskeskuksessa, sairaalassa tai muussa paikassa, johon lääkärisi on ohjannut sinut saamaan hoitoa. Se ei yleensä edellytä yöpymistä sairaalassa. 3
4 Mitä minun pitää kertoa lääkärilleni ENNEN Aclasta-infuusiota? Ennen Aclasta-infuusiota on tärkeää, että kerrot lääkärillesi: jos saat Zometa-hoitoa, koska sen vaikuttava aine on sama kuin Aclastan. jos sinulla on aiemmin esiintynyt munuaisvaivoja, sillä munuaisten on pystyttävä poistamaan luuhun imeytymätön Aclasta elimistöstä. jos kaulassasi sijaitsevat lisäkilpirauhaset on poistettu kokonaan tai osittain. jos sinulle on tehty suolen osittainen poistoleikkaus. jos sinulla on tai on aiemmin ollut leuan alueen kipua, turvotusta tai puutumista, tai jos jokin hampaistasi on löystynyt. kaikista käyttämistäsi lääkkeistä, mukaan lukien: - reseptilääkkeet - itsehoitolääkkeet - rohdosvalmisteet ja vitamiinit Et voi saada Aclastaa, jos: olet allerginen sille, sen apuaineille tai muille bisfosfonaateille. kalsiumarvosi on liian matala. sairastat vakavaa munuaistautia. olet raskaana, suunnittelet raskautta tai imetät. Mitä minun pitää tehdä ENNEN Aclasta-infuusiota? On tärkeää, että juot riittävästi nestettä (vähintään yksi tai kaksi lasillista) ENNEN Aclasta-infuusiota. Se auttaa ehkäisemään elimistön kuivumista. Voit syödä normaalisti Aclasta-infuusion antopäivänä. Mitä on odotettavissa Aclasta-infuusion JÄLKEEN? Kuten kaikki lääkkeet, Aclastakin voi aiheuttaa haittavaikutuksia joillekin ihmisille. Aclasta voi aiheuttaa seuraavan kaltaisia oireita: - kuume ja vilunväreet flunssankaltaiset oireet - lihas-, luu- tai nivelkipu - päänsärky 4
5 Useimmat näistä oireista kehittyvät kolmen päivän sisällä Aclasta-infuusion antamisesta. Ne ovat useimmiten lieviä tai keskivaikeita ja häviävät kolmen päivän kuluessa oireiden alkamisesta. Lääkärisi voi suositella näiden haittavaikutusten hoitoon jotakin mietoa kipulääkettä, kuten parasetamolia tai ibuprofeenia. Jos oireet eivät häviä itsestään tai pahenevat, kerro asiasta lääkärillesi. Seuraavien Aclasta-infuusioiden yhteydessä näiden haittavaikutusten riski pienenee. Munuaisvaivat Munuaisvaivoja (kuten vähentynyttä virtsaamista) on esiintynyt Aclastahoitoa saavilla potilailla. Sydämen rytmihäiriöt (eteisvärinä) Aclastaa postmenopausaalisen osteoporoosin hoitoon käyttävillä potilailla on todettu sydämen rytmihäiriöitä. Toistaiseksi ei tiedetä, aiheuttaako Aclasta tällaisia rytmihäiriöitä vai ei. Jos sinulla esiintyy epäsäännöllistä rytmiä, tykytyksen tunnetta, huimausta tai hengenahdistusta, kerro niistä lääkärillesi. Allergia Allergisia reaktioita on raportoitu; mukaan lukien harvoja tapauksia, joissa on ilmennyt hengitysvaikeuksia, nokkosihottumaa ja angioedeemaa (esim. kasvojen, kielen tai nielun turpoaminen). Yksittäisiä hyvin vakavia allergisia reaktioita on myös raportoitu. Suun oireita Kipua suussa, hampaissa ja leuassa, turpoamista tai haavaumia suun sisäpuolella, tunnottomuutta tai paineen tunnetta leuassa tai hampaan irtoamista on esiintynyt Aclasta-hoitoa saavilla potilailla. Jos sinulle kehittyy tällaisia oireita, kerro niistä lääkärillesi tai hammaslääkärillesi. Matalat kalsiumarvot Bisfosfonaattien tiedetään voivan aiheuttaa kalsiumarvojen laskua (hypokalsemiaa). Tämän voi estää huolehtimalla siitä, että ruokavalio sisältää riittävästi kalsiumia tai käyttämällä kalsium- ja D-vitamiinilisää. Lääkärisi kertoo sinulle millaisia oireita hypokalsemia aiheuttaa. 5
6 Tavallisesta poikkeavat reisiluun murtumat Tavallisesta poikkeavia reisiluun murtumia voi harvoin ilmetä etenkin niillä potilailla, jotka saavat pitkäaikaista hoitoa osteoporoosiin. Ota yhteys lääkäriin, jos koet kipua, heikkoutta tai muutoin epämukavaa oloa reidessäsi, lonkassasi tai nivusissasi, sillä tällaiset oireet saattavat olla varhaisia merkkejä mahdollisesta reisiluun murtumasta. Tämä haittavaikutusluettelo ei ole tyhjentävä. Tutustu myös liitteenä olevaan pakkausselosteeseen ja käänny lääkärin puoleen, jos sinulla on kysyttävää haittavaikutuksista. Jos havaitset sellaisia haittavaikutuksia, joita ei ole tässä selosteessa mainittu tai kokemasi haittavaikutus muuttuu vakavaksi, kerro niistä lääkärillesi, apteekkihenkilökunnalle tai terveydenhoitajalle. Vaikuttaako Aclasta ajokykyyn? Haittavaikutukset, kuten huimaus, voivat vaikuttaa ajokykyyn tai kykyyn käyttää koneita, vaikka tähän liittyviä tutkimuksia Aclastalla ei olekaan tehty. Voit auttaa itseäsi seuraavin keinoin: Syö terveellisesti ja huolehdi riittävästä kalsiumin ja D-vitamiinin saannista. D-vitamiini edistää kalsiumin imeytymistä. Hyviä kalsiumin lähteitä ovat: maitotuotteet, esim. maito, jogurtti ja juusto Hyviä D-vitamiinin lähteitä ovat: rasvainen kala, esim. lohi, sardiini ja silli vitaminoidut elintarvikkeet, esim. maitotuotteet (ei luomu-) ja ravintorasvat D-vitamiinia saat myös muista ruoka-aineista esim. kananmunat, tofu ja soijapavut 6
7 Harrasta säännöllisesti liikuntaa (etenkin voimaharjoittelu on tärkeää), sillä se ylläpitää nivelten liikkuvuutta ja vahvistaa luita. Vähennä tupakointia tai lopeta se mieluiten kokonaan. Tupakka on haitallista myös luille. Myös alkoholinkäytön vähentämisellä voi olla myönteisiä vaikutuksia luuston terveyteen. Estä kaatumiset ennalta ja poista asunnostasi kaikki liukkaat lattiamateriaalit, hanki kylpyammeeseen ja suihkuun liukuestematot ja asenna tukitankoja tarpeellisiin paikkoihin. Mistä saan lisätietoa osteoporoosista? Novartis Finland Oy jakaa tämän tiedotteen kaikille potilaille, joille lääkäri määrää Aclastaa. Pyrkimyksenä on palvella sekä lääketiedettä että potilaiden hoitoa. Lisätietoja saa myös esim. Suomen Luustoliitto ry:stä ja sen paikallisista jäsenyhdistyksistä ( tai Suomalaisen Lääkäriseura Duodecimin Käypä hoito -suosituksesta osteoporoosin hoitoon potilaille ( Muistiinpanoja 7
8 PAKKAUSSELOSTE: Tietoa käyttäjälle Aclasta 5 mg infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. - Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta 4. Tässä pakkausselosteessa kerrotaan 1. Mitä Aclasta on ja mihin sitä käytetään 2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Aclastaa 3. Miten Aclastaa annetaan 4. Mahdolliset haittavaikutukset 5. Aclastan säilyttäminen 6. Pakkauksen sisältö ja muuta tietoa 1. Mitä Aclasta on ja mihin sitä käytetään Aclasta sisältää vaikuttavana aineena tsoledronihappoa. Se kuuluu bisfosfonaattien lääkeryhmään ja sitä käytetään aikuisten miesten ja vaihdevuodet ohittaneiden naisten osteoporoosin hoitoon, tai tulehdusten hoitoon käytettävien kortikosteroidihoitojen aiheuttaman osteoporoosin hoitoon sekä Pagetin luutaudin hoitoon aikuisilla. Osteoporoosi Osteoporoosi on sairaus, jossa luut haurastuvat ja heikkenevät. Sitä esiintyy yleisesti naisilla vaihdevuosien jälkeen, mutta sitä voi esiintyä myös miehillä. Vaihdevuosien aikana naisen munasarjat lakkaavat tuottamasta naishormonia, estrogeenia, joka ylläpitää luiden kuntoa. Vaihdevuosien jälkeen luumassa pienenee, ja luut heikkenevät ja murtuvat helpommin kuin ennen. Osteoporoosia voi myös esiintyä miehillä ja naisilla pitkäaikaisen steroidien käytön johdosta, joka voi vaikuttaa luun lujuuteen. Monilla potilailla ei ole lainkaan osteoporoosin oireita, mutta heillä on silti tavallista suurempi riski saada murtumia, sillä osteoporoosi on ehtinyt heikentää luita. Veren sukupuolihormonien (lähinnä androgeenistä muodostuvan estrogeenin) määrän väheneminen saa myös miesten luumassan pienenemään, joskin hitaammin. Aclasta vahvistaa sekä miesten että naisten luuta ja ehkäisee näin murtumia. Aclastaa käytetään myös potilailla, jotka ovat murtaneet lonkkansa hiljattain vähäisen vamman kuten kaatumisen seurauksena ja ovat siksi alttiimpia uusille luunmurtumille. 8
9 Pagetin luutauti Normaalisti vanha luu hajoaa ja korvautuu uudella luumateriaalilla. Tästä prosessista käytetään nimitystä uudelleenmuodostus. Pagetin luutaudissa luun uudelleenmuodostus on liian nopeaa ja uutta luuta muodostuu hallitsemattomasti. Tämä tekee luusta normaalia heikompaa. Ellei tautia hoideta, luut saattavat muuttua epämuodostuneeksi ja kipeytyä ja ne saattavat murtua. Aclastan vaikutuksesta luun uudelleenmuodostus palautuu normaaliksi, joka turvaa normaalin luun muodostumisen. Tästä syystä luu vahvistuu. 2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Aclastaa Noudata tarkoin lääkärin, apteekkihenkilökunnan tai sairaanhoitajan ohjeita ennen kuin sinulle annetaan Aclastaa. Sinulle ei saa antaa Aclastaa - jos olet allerginen tsoledronihapolle, muille bisfosfonaateille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6). - jos sinulla on hypokalsemia (eli veresi kalsiumtaso on liian alhainen). - jos sairastat vakavaa munuaistautia. - jos olet raskaana. - jos imetät. Varoitukset ja varotoimet Keskustele lääkärin kanssa ennen kuin sinulle annetaan Aclastaa: - jos saat mitä tahansa muuta tsoledronihappoa sisältävää lääkettä, joka on myös Aclastan vaikuttava aine (tsoledronihappoa käytetään aikuispotilailla tiettyjen syöpätyyppien hoidossa ehkäisemään luustokomplikaatioita tai vähentämään kalsiumin määrää). - jos sinulla on tai on ollut munuaisongelma. - jos et pysty ottamaan päivittäin kalsiumlisää. - jos kaulassasi sijaitsevat lisäkilpirauhaset on poistettu kokonaan tai osittain leikkauksella. - jos osia suolistostasi on poistettu. Ennen kuin saat Aclasta-hoitoa, kerro lääkärillesi, jos sinulla on (tai on ollut) kipua, turvotusta tai tunnottomuutta ikenissä, leuassa tai molemmissa, tai jos leukasi tuntuu raskaalta, tai jos hampaasi on irronnut. Kerro hammaslääkärillesi, että saat Aclasta-hoitoa ennen hammashoitoa tai hammasleikkausta. Seurantakokeet Lääkäri teettää verikokeita tarkistaakseen munuaistesi toiminnan (veren kreatiniinipitoisuuden) ennen jokaista Aclasta-annosta. On tärkeää, että juot vähintään 2 lasillista nestettä (esim. vettä) muutaman tunnin sisällä ennen Aclastan antoa terveydenhuoltohenkilöstön ohjeiden mukaan. Lapset ja nuoret Aclastaa ei suositella alle 18-vuotiaille. Aclastan käyttöä lapsilla ja nuorilla ei ole tutkittu. 9
10 10 Muut lääkevalmisteet ja Aclasta Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. Lääkärin on tärkeä tietää kaikista käyttämistäsi lääkkeistä, erityisesti jos käytät lääkkeitä, joiden tiedetään olevan haitallisia munuaisillesi (esim. aminogykosideja) tai nesteenpoistolääkkeitä kuten diureetteja, jotka voivat aiheuttaa kuivumista. Raskaus ja imetys Sinulle ei saa antaa Aclastaa, jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista. Kysy lääkäriltä, apteekista tai sairaanhoitajalta neuvoa ennen tämän lääkkeen käyttöä askauden tai imetyksen aikana. Ajaminen ja koneiden käyttö Älä aja autoa tai käytä koneita ennen kuin olosi paranee, jos tunnet huimausta Aclastahoidon aikana. Aclasta sisältää natriumia Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 100 ml:n Aclasta-injektiopullo, eli se on olennaisesti natriumiton. 3. Miten Aclastaa annetaan Seuraa tarkasti kaikkia lääkärin tai hoitajan sinulle antamia ohjeita. Tarkista ohjeet lääkäriltä tai sairaanhoitajalta, jos olet epävarma. Osteoporoosi Tavallinen annos on 5 mg, jonka lääkäri tai hoitaja antaa sinulle yhtenä infuusiona kerran vuodessa laskimoon. Infuusion kesto on vähintään 15 minuuttia. Jos sinulla on hiljattain ollut lonkkamurtuma, suositus on, että Aclasta annetaan kahden tai useamman viikon kuluttua lonkkasi korjausleikkauksesta. On tärkeää, että käytät kalsium- ja D-vitamiinilisää (esim. tabletteja) lääkärisi ohjeiden mukaisesti. Osteoporoosin hoidossa Aclastan vaikutus kestää vuoden ajan. Lääkärisi kertoo sinulle milloin tulet saamaan seuraavan annoksen. Pagetin luutauti Pagetin luutautia hoidettaessa Aclastaa saa määrätä vain Pagetin luutaudin hoitoon perehtynyt lääkäri. Tavallinen annos on 5 mg, jonka lääkärisi tai hoitaja antaa sinulle kerralla aloitusannoksena suoneen. Infuusio kestää vähintään 15 minuuttia. Aclastan vaikutus saattaa kestää yli vuoden ajan, ja lääkärisi kertoo sinulle, tuleeko hoito uusia. Lääkärisi saattaa neuvoa sinua ottamaan kalsiumia ja D-vitamiinia (esim. tabletteja) vähintään ensimmäiset kymmenen päivää Aclastan annon jälkeen. On tärkeää, että seuraat huolellisesti tätä neuvoa infuusion jälkeisen jakson ajan, jotta veren kalsiumpitoisuus ei laske liian alhaiseksi. Lääkärisi antaa sinulle tietoa hypokalsemiaan liittyvistä oireista.
11 Aclasta ruuan ja juoman kanssa Juo riittävästi nestettä (vähintään 1 2 lasillista) ennen Aclasta-hoitoa ja sen jälkeen lääkärin ohjeiden mukaisesti. Tämä ehkäisee nestehukkaa. Voit syödä normaalisti Aclasta-hoitopäivänä. Tämä on erityisen tärkeää, jos käytät diureetteja (nesteenpoistolääkkeitä) tai jos olet iäkäs (vähintään 65 vuotias). Jos Aclasta-annos jää saamatta Ota mahdollisimman pian yhteys lääkäriin tai sairaalaan uuden ajan varaamiseksi. Ennen Aclasta-hoidon lopettamista Jos harkitset Aclasta-hoidon lopettamista, keskustele asiasta lääkärisi kanssa seuraavan vastaanottokäynnin yhteydessä. Lääkärisi neuvoo sinua ja päättää, miten pitkään Aclastahoitoa tulee jatkaa. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. 4. Mahdolliset haittavaikutukset Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Ensimmäiseen infuusioon liittyvät haittavaikutukset ovat hyvin yleisiä (esiintyvät yli 30 %:lla potilaista), mutta seuraavien infuusioiden yhteydessä ne vähenevät. Valtaosa haittavaikutuksista, kuten kuume, vilunväreet, lihas- tai nivelkipu ja päänsärky, ilmaantuvat ensimmäisten kolmen päivän aikana Aclasta-annoksen jälkeen. Oireet ovat yleensä lieviä ja keskivaikeita ja häviävät kolmen päivän kuluessa. Lääkäri voi suositella jotakin mietoa kipulääkettä kuten ibuprofeenia tai parasetamolia vähentääkseen näitä haittavaikutuksia. Seuraavien Aclastaannosten yhteydessä näiden haittavaikutusten riski pienenee. Jotkin haittavaikutukset voivat olla vakavia Yleiset (enintään 1 käyttäjällä 10:stä) Potilailla, jotka ovat saaneet Aclastaa vaihdevuosien jälkeisen osteoporoosin hoitoon, on todettu sydämen rytmihäiriöitä (eteisvärinää). Ei tiedetä, aiheuttaako Aclasta kyseisiä rytmihäiriöitä. Ilmoita kuitenkin lääkärille, jos sinulla on tällaisia oireita Aclastan annon jälkeen. Melko harvinaiset (enintään 1 käyttäjällä 100:sta) Silmien turvotus, punoitus, kipu tai kutina tai silmien valoherkkyys. Tuntematon (saatavissa oleva tieto ei riitä yleisyyden arviointiin) Suun, hampaiden ja leuan kipu, suunsisäinen turvotus tai limakalvohaavaumat, leuan tunnottomuus tai painon tunne leuassa tai hampaan löystyminen. Nämä voivat olla leuan luuvaurion (osteonekroosin) merkkejä. Ota heti yhteys hammaslääkäriin, jos huomaat tällaisia oireita. Munuaishäiriöitä (esim. virtsanerityksen vähenemistä) voi esiintyä. Ennen kutakin Aclastaannosta lääkäri teettää verikokeita munuaistoiminnan arvioimiseksi. On tärkeää, että juot vähintään 2 lasillista nestettä (esim. vettä) muutaman tunnin sisällä ennen Aclastan antoa terveydenhuoltohenkilöstön ohjeiden mukaan. Jos sinulla on jokin edellä mainituista haittavaikutuksista, ota heti yhteys lääkäriin. 11
12 Aclasta voi aiheuttaa myös muita haittavaikutuksia Hyvin yleinen haittavaikutus (yli 1 käyttäjällä 10:stä) Kuume. Yleiset haittavaikutukset (enintään 1 käyttäjällä 10:stä) Päänsärky, huimaus, huonovointisuus, oksentelu, ripuli, lihaskipu, luu- ja/tai nivelkipu, kipu selässä, käsivarsissa tai jaloissa, flunssankaltaiset oireet (esimerkiksi väsymys, vilunväreet, nivel- ja lihaskipua), vilunväreet, tunne väsymyksestä ja kiinnostuksen puutteesta, heikotus, kipu, huonovointisuuden tunne, infuusiokohdan turvotus ja/tai kipu. Pagetin luutautipotilailla on ilmoitettu veren alhaisesta kalsiumpitoisuudesta johtuvia oireita kuten lihaskramppeja, tunnottomuutta tai kihelmöintiä etenkin suun ympärillä. Melko harvinaiset haittavaikutukset (enintään 1 käyttäjällä 100:sta) Flunssa, ylähengitysteiden infektiot, punasolujen väheneminen, ruokahalun menetys, unettomuus, uneliaisuus johon saattaa liittyä vireystason ja tietoisuuden aleneminen, kihelmöinti tai puutuminen, äärimmäinen uneliaisuus, vapina, tilapäinen tajunnan menetys, silmätulehdus tai kivulias tai punoittava ärsytys ja tulehdus, huimauksen tunne, verenpaineen kohoaminen, punastuminen, yskä, hengenahdistus, vatsavaivoja, vatsakipua, ummetus, suun kuivuminen, närästys, ihottuma, voimakas hikoilu, kutina, ihon punoitus, niskakipua, lihas-, luu ja/tai niveljäykkyys, nivelturvotus, lihaskouristuksia, olkapääkipua, rintalihas- tai rintakehänkipu, niveltulehdus, lihasheikkous, poikkeava tulos munuaiskokeessa, poikkeava tiheä virtsaaminen, käsien, nilkkojen ja jalkojen turpoaminen, jano, hammassärkyä, makuaistin häiriöitä. Harvinaiset haittavaikutukset (enintään 1 käyttäjällä 1 000:sta) Poikkeavia reisiluun murtumia voi esiintyä harvoin, etenkin potilailla, jotka saavat pitkäaikaista hoitoa osteoporoosiin. Ota yhteys lääkäriin, jos reidessä, lonkassa tai nivusessa tuntuu kipua, heikkoutta tai epämukavaa tunnetta, sillä kyseessä voi olla mahdollisen reisiluun murtuman varhainen merkki. Tuntematon (saatavissa oleva tieto ei riitä yleisyyden arviointiin) Vaikea allerginen reaktio, johon liittyy huimausta ja hengenahdistusta, turvotusta pääasiassa kasvoissa ja kurkussa, verenpaineen laskua, kuivuminen liittyen annostelun jälkeisiin oireisiin, kuten kuumeeseen, oksenteluun ja ripuliin. Haittavaikutuksista ilmoittaminen Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta. www-sivusto: Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL FIMEA 12
13 5. Aclastan säilyttäminen Lääkärisi, apteekki tai hoitajasi tietää miten Aclasta tulee säilyttää. - Ei lasten ulottuville eikä näkyville. - Älä käytä tätä lääkettä pakkauksessa ja pullossa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. - Avaamaton pullo ei vaadi erityisiä säilytysolosuhteita. - Pullon avaamisen jälkeen valmiste tulee käyttää välittömästi, jotta siihen ei pääsisi mikrobeja. Ellei valmistetta käytetä välittömästi, käytönaikaiset säilytysolosuhteet ovat käyttäjän vastuulla eikä käyttöä edeltävä säilytysaika normaalisti saa ylittää 24 tuntia 2 C 8 C lämpötilassa. Jääkaappikylmän liuoksen annetaan lämmetä huoneenlämpöiseksi ennen sen antamista potilaalle. 6. Pakkauksen sisältö ja muuta tietoa Mitä Aclasta sisältää - Vaikuttava aine on tsoledronihappo. Yksi pullo, jossa on 100 ml liuosta, sisältää tsoledronihappoa monohydraattina vastaten 5 mg tsoledronihappoa. Yksi ml liuosta sisältää tsoledronihappoa monohydraattina vastaten 0,05 mg tsoledronihappoa. - Muut aineet ovat mannitoli, natriumsitraatti ja injektionesteisiin käytettävä vesi. Aclastan kuvaus ja pakkauskoot Aclasta on kirkas, väritön liuos. Se toimitetaan käyttövalmiina infuusionesteenä 100 ml muovipulloissa. Valmiste toimitetaan yhden pullon yksikköpakkauksissa tai kerrannaispakkauksissa, jotka sisältävät viisi pakkausta, joista jokainen sisältää yhden pullon. Kaikkia pakkauskokoja ei välttämättä ole myynnissä. 13
14 14
15 15
16 Lisätietoja Novartis Finland Oy, Metsänneidonkuja 10, Espoo. Puh , Tämä pakkausseloste on hyväksytty viimeksi 03/2015 Muut tiedonlähteet Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta FI Osa riskinhallintasuunnitelmaa 9.1
Novartis Finland Oy. Aclasta-potilasopas osteoporoosin hoidossa
 Novartis Finland Oy Aclasta-potilasopas osteoporoosin hoidossa Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa.
Novartis Finland Oy Aclasta-potilasopas osteoporoosin hoidossa Tämä potilasopas on tarkoitettu osteoporoosia sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Aclasta-hoitoa.
Tsoledronihappo SUN 5 mg
 POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti.
POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu sairastaville potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti.
Tsoledronihappo SUN 5 mg
 POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti. Opas sisältää
POTILASOPAS Tsoledronihappo SUN 5 mg Tämä potilasopas on tarkoitettu potilaille, joilla on suurentunut luunmurtumariski ja jotka saavat Tsoledronihappo SUN 5 mg-hoitoa. Lue opas huolellisesti. Opas sisältää
Pakkausseloste: Tietoa käyttäjälle. Aclasta 5 mg infuusioneste, liuos Tsoledronihappo
 Pakkausseloste: Tietoa käyttäjälle Aclasta 5 mg infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä
Pakkausseloste: Tietoa käyttäjälle Aclasta 5 mg infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. Risedronat Teva 35 mg kalvopäällysteiset tabletit. risedronaattinatrium
 PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
Ibandronat Stada 150 mg kalvopäällysteiset tabletit. 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
XGEVA. (denosumabi) POTILASOPAS
 XGEVA (denosumabi) POTILASOPAS SISÄLLYS Sisällysluettelo 2 Miksi saat XGEVAa 3 Ennen XGEVA-hoitoa sekä hoidon aikana 5 Raskaus ja imetys 8 XGEVAn haittavaikutukset 8 Mitä on hyvä muistaa 10 Anna tämä kortti
XGEVA (denosumabi) POTILASOPAS SISÄLLYS Sisällysluettelo 2 Miksi saat XGEVAa 3 Ennen XGEVA-hoitoa sekä hoidon aikana 5 Raskaus ja imetys 8 XGEVAn haittavaikutukset 8 Mitä on hyvä muistaa 10 Anna tämä kortti
Aineisto julkista yhteenvetoa varten
 STADA Arzneimittel AG Sivu 1 / 7 VI.2 Aineisto julkista yhteenvetoa varten Paminject 3 mg/ml infuusiokonsentraatti liuosta varten VI.2.1 Katsaus sairauden epidemiologiaan Hyvää lääketurvatoimintatapaa
STADA Arzneimittel AG Sivu 1 / 7 VI.2 Aineisto julkista yhteenvetoa varten Paminject 3 mg/ml infuusiokonsentraatti liuosta varten VI.2.1 Katsaus sairauden epidemiologiaan Hyvää lääketurvatoimintatapaa
Pakkausseloste: Tietoa käyttäjälle. Kipupois 200 mg tabletit. ibuprofeeni
 Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
Pakkausseloste: Tietoa käyttäjälle Kipupois 200 mg tabletit ibuprofeeni Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja. Käytä
AMGEVITA (adalimumabi)
 AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
AMGEVITA (adalimumabi) Potilaskortti - Lapset Tässä kortissa on tärkeitä turvallisuustietoja Amgevitavalmisteesta. Huom: Näytä tämä kortti aina, kun asioit lapsesi lääkärin tai muun terveydenhuoltohenkilöstön
PAKKAUSSELOSTE. Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 PAKKAUSSELOSTE Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan Zometaa. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan Zometaa. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
Miten Truvadaa otetaan
 Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Miten Truvadaa otetaan Ota Truvada-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma. Suositeltu annos on yksi Truvada-tabletti kerran vuorokaudessa
Osteoporoosi (luukato)
 Osteoporoosi (luukato) Lääkärikirja Duodecim Pertti Mustajoki, sisätautien erikoislääkäri Osteoporoosi tarkoittaa, että luun kalkkimäärä on vähentynyt ja luun rakenne muuttunut. Silloin luu voi murtua
Osteoporoosi (luukato) Lääkärikirja Duodecim Pertti Mustajoki, sisätautien erikoislääkäri Osteoporoosi tarkoittaa, että luun kalkkimäärä on vähentynyt ja luun rakenne muuttunut. Silloin luu voi murtua
Opas Tietoja potilaille
 Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Opas Tietoja potilaille Tärkeää turvallisuutta koskevaa tietoa immuunivälitteisten haittavaikutusten riskin minimoimiseksi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Pakkausseloste: Tietoa käyttäjälle. Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TUBERCULIN PPD RT 23 SSI Mantoux-tuberkuliinikoetta varten 2 T.U./0,1 ml Injektioneste, liuos. Vahvuus on ilmoitettu pakkauksessa. Lue tämä pakkausseloste huolellisesti
Julkisen yhteenvedon osiot
 Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
PAKKAUSSELOSTE. Pantoprazole Teva 40 mg enterotabletit. pantopratsoli
 PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
Mikä on HER2-positiivinen rintasyöpä?
 Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
Tietoa potilaalle HER2-positiivisen rintasyövän KANJINTI*-hoidosta *KANJINTI on trastutsumabi-biosimilaari. Ensimmäinen trastutsumabilääke, jonka kauppanimi on Herceptin, on ollut saatavilla jo useita
PAKKAUSSELOSTE. Prolia 60 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
Potilaan päiväkirja. Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi
 Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
Potilaan päiväkirja Avuksi maksa-arvojen ja käyntiaikojen seurantaan ensimmäisen hoitovuoden ajaksi POTILAAN TIEDOT Nimi: Osoite: Puh.: Erikoislääkäri: Erikoislääkärin puh.: Parkinsonhoitaja: Parkinsonhoitajan
PAKKAUSSELOSTE. Erbitux 2 mg/ml infuusioneste, liuos Setuksimabi
 PAKKAUSSELOSTE Erbitux 2 mg/ml infuusioneste, liuos Setuksimabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Erbitux 2 mg/ml infuusioneste, liuos Setuksimabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. XGEVA 120 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
Pakkausseloste: Tietoa käyttäjälle. Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi
 Pakkausseloste: Tietoa käyttäjälle Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Gliolan 30 mg/ml jauhe oraaliliuosta varten 5-aminolevuliinihappo-hydrokloridi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Ensimmäisen annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta
Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin
 Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Pakkausseloste: Tietoa potilaalle. Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi
 Pakkausseloste: Tietoa potilaalle Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita
Pakkausseloste: Tietoa potilaalle Olumiant 2 mg kalvopäällysteinen tabletti Olumiant 4 mg kalvopäällysteinen tabletti barisitinibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE TRISENOX 1 mg/ml infuusiokonsentraatti, liuosta varten Arseenitrioksidi Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Trulicity 0,75 mg injektioneste, liuos, esitäytetty kynä Trulicity 1,5 mg injektioneste, liuos, esitäytetty kynä dulaglutidi Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Trulicity 0,75 mg injektioneste, liuos, esitäytetty kynä Trulicity 1,5 mg injektioneste, liuos, esitäytetty kynä dulaglutidi Tähän lääkkeeseen kohdistuu lisäseuranta.
TÄRKEITÄ TURVALLISUUSTIETOJA RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE
 RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
RIXATHON (RITUKSIMABI) -HOITOA SAAVILLE POTILAILLE POTILASESITE MUIHIN KUIN ONKOLOGISIIN KÄYTTÖAIHEISIIN Tähän lääkkeeseen kohdistuu lisäseuranta. rituksimabi Fimean hyväksymä, heinäkuu/2018 2 3 TÄRKEÄÄ
Tärkeää tietoa GILENYA (fingolimodi) -hoidosta
 Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Tähän lääkkeeseen kohdistuu lisäseuranta. Tärkeää tietoa GILENYA (fingolimodi) -hoidosta Vanhemmille/huoltajille Ensimmäisen annoksen jälkeen lääkäri pyytää lasta jäämään vastaanotolle vähintään kuuden
Firmagon eturauhassyövän hoidossa
 Firmagon eturauhassyövän hoidossa Käytännön tietoa ja ohjeita potilaalle Eturauhassyöpään sairastuminen ja sen hoito aiheuttavat uuden elämäntilanteen. Mielessä voi pyöriä monia kysymyksiä. Ajatusten kanssa
Firmagon eturauhassyövän hoidossa Käytännön tietoa ja ohjeita potilaalle Eturauhassyöpään sairastuminen ja sen hoito aiheuttavat uuden elämäntilanteen. Mielessä voi pyöriä monia kysymyksiä. Ajatusten kanssa
PAKKAUSSELOSTE. Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani
 PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE. Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli
 PAKKAUSSELOSTE Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE Anastrozol medac 1 mg tabletti, kalvopäällysteinen Anastrotsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE. Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni
 PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
PAKKAUSSELOSTE: TIETOJA KÄYTTÄJÄLLE Granisetron Teva 1 mg kalvopäällysteinen tabletti Granisetron Teva2 mg kalvopäällysteinen tabletti Granisetroni Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
PAKKAUSSELOSTE. Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa
 PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
Liite I Tieteelliset päätelmät ja perusteet, joiden perusteella myyntilupien ehdot on muutettava
 Liite I Tieteelliset päätelmät ja perusteet, joiden perusteella myyntilupien ehdot on muutettava Tieteelliset päätelmät Ottaen huomioon arviointiraportin, jonka lääketurvatoiminnan riskinarviointikomitea
Liite I Tieteelliset päätelmät ja perusteet, joiden perusteella myyntilupien ehdot on muutettava Tieteelliset päätelmät Ottaen huomioon arviointiraportin, jonka lääketurvatoiminnan riskinarviointikomitea
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Pakkausseloste: Tietoa käyttäjälle. Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
Pakkausseloste: Tietoa käyttäjälle Tsoledronihappo medac 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
Pakkausseloste: Tietoa käyttäjälle. Lomustine medac 40 mg kapselit, kova
 Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa käyttäjälle Lomustine medac 40 mg kapselit, kova Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE. Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi
 PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste.
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste.
Tärkeää tietoa GILENYA -hoidosta
 Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
Tärkeää tietoa GILENYA -hoidosta Ensimmäisen GILENYA-annoksen jälkeen lääkärisi pyytää sinua jäämään vastaanotolle vähintään kuuden tunnin ajaksi, jotta tarvittaviin toimenpiteisiin voidaan ryhtyä, jos
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon
RISKINHALLINTASUUNNITELMAN (RMP:n) YHTEENVETO (lääkevalmisteittain)
 OSA VI RISKINHALLINTASUUNNITELMAN (RMP:n) YHTEENVETO (lääkevalmisteittain) Riskinhallintasuunnitelman yhteenvedon muoto ja sisältö Riskinhallintasuunnitelman yhteenvedossa (osa VI) esitetyt tiedot perustuvat
OSA VI RISKINHALLINTASUUNNITELMAN (RMP:n) YHTEENVETO (lääkevalmisteittain) Riskinhallintasuunnitelman yhteenvedon muoto ja sisältö Riskinhallintasuunnitelman yhteenvedossa (osa VI) esitetyt tiedot perustuvat
LUCENTIS (ranibitsumabi) Silmänpohjan kosteaan ikärappeumaan
 LUCENTIS (ranibitsumabi) Silmänpohjan kosteaan ikärappeumaan Potilasesite LUCENTIS-hoidosta Osa 1 Tietoja LUCENTIS-valmisteesta Tässä esitteessä kerrotaan silmänpohjan kosteasta ikärappeumasta ja sen hoidossa
LUCENTIS (ranibitsumabi) Silmänpohjan kosteaan ikärappeumaan Potilasesite LUCENTIS-hoidosta Osa 1 Tietoja LUCENTIS-valmisteesta Tässä esitteessä kerrotaan silmänpohjan kosteasta ikärappeumasta ja sen hoidossa
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 25 BROMOKRIPTIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON MERKITYKSELLISIIN KOHTIIN TEHTÄVÄT MUUTOKSET 4.2 Annostus ja antotapa
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 25 BROMOKRIPTIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON MERKITYKSELLISIIN KOHTIIN TEHTÄVÄT MUUTOKSET 4.2 Annostus ja antotapa
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Aclasta 5 mg infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Kukin pullo, jossa on 100 ml liuosta, sisältää 5 mg vedetöntä tsoledronihappoa,
LIITE I VALMISTEYHTEENVETO 1 1. LÄÄKEVALMISTEEN NIMI Aclasta 5 mg infuusioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Kukin pullo, jossa on 100 ml liuosta, sisältää 5 mg vedetöntä tsoledronihappoa,
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
Suositukset maksan haittavaikutusten välttämiseksi. Valdoxan voi aiheuttaa haittavaikutuksena mm. muutoksia maksan toimintaan.
 Potilaan opas VALDOXAN Suositukset maksan haittavaikutusten välttämiseksi Valdoxan voi aiheuttaa haittavaikutuksena mm. muutoksia maksan toimintaan. Tässä oppaassa kerrotaan suosituksista maksan haittavaikutusten
Potilaan opas VALDOXAN Suositukset maksan haittavaikutusten välttämiseksi Valdoxan voi aiheuttaa haittavaikutuksena mm. muutoksia maksan toimintaan. Tässä oppaassa kerrotaan suosituksista maksan haittavaikutusten
TIETOA POTILAALLE. Janssenin lääketieto
 Suomen eturauhassyöpäyhdistys ry Lisätietoa eturauhassyövästä ja sen hoidoista. Eturauhassyöpäyhdistyksellä on potilasyhdistyksiä koko maassa. Yhteydenottopyynnön voi jättää osoitteessa www.propo.fi PROPO
Suomen eturauhassyöpäyhdistys ry Lisätietoa eturauhassyövästä ja sen hoidoista. Eturauhassyöpäyhdistyksellä on potilasyhdistyksiä koko maassa. Yhteydenottopyynnön voi jättää osoitteessa www.propo.fi PROPO
Liite III. Muutokset tuotetietojen olennaisiin kohtiin
 Liite III Muutokset tuotetietojen olennaisiin kohtiin Huomautus: Nämä valmistetiedot ovat tulos referraaliprosessista, johon tämä komission päätös liittyy. Jäsenvaltioiden toimivaltaiset viranomaiset voivat
Liite III Muutokset tuotetietojen olennaisiin kohtiin Huomautus: Nämä valmistetiedot ovat tulos referraaliprosessista, johon tämä komission päätös liittyy. Jäsenvaltioiden toimivaltaiset viranomaiset voivat
Hoito: Yksilöllinen annos, joka säädetään seerumin kaliumarvojen mukaan.
 1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
1. LÄÄKEVALMISTEEN NIMI Kaliumklorid Orifarm 750 mg depottabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi depottabletti sisältää 750 mg kaliumkloridia. Täydellinen apuaineluettelo, ks. kohta 6.1. 3.
Aripiprazole Sandoz (aripipratsoli)
 Aripiprazole Sandoz (aripipratsoli) Esite potilaille/heistä huolehtiville henkilöille Tämä esite sisältää tärkeitä turvallisuustietoja, joihin sinun on tutustuttava ennen aripipratsolihoidon aloittamista
Aripiprazole Sandoz (aripipratsoli) Esite potilaille/heistä huolehtiville henkilöille Tämä esite sisältää tärkeitä turvallisuustietoja, joihin sinun on tutustuttava ennen aripipratsolihoidon aloittamista
PAKKAUSSELOSTE. Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit
 PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
IBANDRONIHAPPO RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 IBANDRONIHAPPO Päivämäärä: 25.7.2016, Versio: 3.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Luustoon liittyvien tapahtumien
IBANDRONIHAPPO Päivämäärä: 25.7.2016, Versio: 3.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Luustoon liittyvien tapahtumien
PAKKAUSSELOSTE. VANTAVO 70 mg/5600 IU tabletit Alendronihappo/kolekalsiferoli
 PAKKAUSSELOSTE VANTAVO 70 mg/5600 IU tabletit Alendronihappo/kolekalsiferoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE VANTAVO 70 mg/5600 IU tabletit Alendronihappo/kolekalsiferoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
Erivedge -valmisteen raskaudenehkäisyohjelma
 Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
Erivedge -valmisteen raskaudenehkäisyohjelma Tärkeää tietoa Erivedge -valmistetta käyttäville mies- ja naispotilaille raskauden ehkäisemisestä ja ehkäisystä. 1 2 Sisältö 1. Johdanto 1.1. Mitä Erivedge
SISÄLTÖ. Luuston viholliset: Luuston haurastuminen. Laihduttaminen ja syömishäiriöt Tupakka Alkoholi Huumeet Kofeiini Lääkkeet
 LUUSTO 17.11.2015 SISÄLTÖ Luuston viholliset: Laihduttaminen ja syömishäiriöt Tupakka Alkoholi Huumeet Kofeiini Lääkkeet Luuston haurastuminen 2 LUUSTON VIHOLLISET Nau+ntoaineista erityises+ alkoholilla,
LUUSTO 17.11.2015 SISÄLTÖ Luuston viholliset: Laihduttaminen ja syömishäiriöt Tupakka Alkoholi Huumeet Kofeiini Lääkkeet Luuston haurastuminen 2 LUUSTON VIHOLLISET Nau+ntoaineista erityises+ alkoholilla,
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI. Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Phybag 9 mg/ml injektioneste, liuos 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 9 mg natriumkloridia. 100 ml sisältää 15,4 mmol (vastaten 354 mg) natriumia.
CORTIMENT -LÄÄKITYKSESI
 CORTIMENT -LÄÄKITYKSESI MITÄ CORTIMENT ON?1 Cortiment-tabletit sisältävät lääkeainetta nimeltä budesonidi. Budesonidi kuuluu kortikosteroidien lääkeryhmään. Näitä lääkkeitä käytetään tulehduksen hoitoon.
CORTIMENT -LÄÄKITYKSESI MITÄ CORTIMENT ON?1 Cortiment-tabletit sisältävät lääkeainetta nimeltä budesonidi. Budesonidi kuuluu kortikosteroidien lääkeryhmään. Näitä lääkkeitä käytetään tulehduksen hoitoon.
Fimea kehittää, arvioi ja informoi
 Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
XELJANZ-HOITOA SAAVILLE HENKILÖILLE
 FINNISH XELJANZ Tämä esite on tarkoitettu henkilöille, joille lääkäri on määrännyt XELJANZ-valmistetta. Lisätietoja on lääkkeen mukana tulevassa pakkausselosteessa. XELJANZ-HOITOA SAAVILLE HENKILÖILLE
FINNISH XELJANZ Tämä esite on tarkoitettu henkilöille, joille lääkäri on määrännyt XELJANZ-valmistetta. Lisätietoja on lääkkeen mukana tulevassa pakkausselosteessa. XELJANZ-HOITOA SAAVILLE HENKILÖILLE
OPAS KOTIPISTOSHOITOON
 OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
OPAS KOTIPISTOSHOITOON (asfotase alfa) 40 mg/ml injektioneste, liuos for injection 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injektioneste, liuos 80 mg/0,8 ml asfotaasialfa Tähän lääkkeeseen kohdistuu
Tähän lääkkeeseen kohdistuu lisäseuranta. brentuksimabivedotiini. Adcetris-lääkehoito ihon T-solulymfoomaan POTILAAN OPAS
 brentuksimabivedotiini Tähän lääkkeeseen kohdistuu lisäseuranta. Adcetris-lääkehoito ihon T-solulymfoomaan POTILAAN OPAS LUKIJALLE Tässä esitteessä kerrotaan Adcetris-lääkehoidosta, miten siihen kannattaa
brentuksimabivedotiini Tähän lääkkeeseen kohdistuu lisäseuranta. Adcetris-lääkehoito ihon T-solulymfoomaan POTILAAN OPAS LUKIJALLE Tässä esitteessä kerrotaan Adcetris-lääkehoidosta, miten siihen kannattaa
PAKKAUSSELOSTE. Paraplatin 10 mg/ml infuusiokonsentraatti karboplatiini
 PAKKAUSSELOSTE Paraplatin 10 mg/ml infuusiokonsentraatti karboplatiini Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Paraplatin 10 mg/ml infuusiokonsentraatti karboplatiini Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
Vaaleankeltainen, opalisoiva piparmintun tuoksuinen ja makuinen suspensio.
 1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
1. LÄÄKEVALMISTEEN NIMI Nystimex, 100 000 IU/ml oraalisuspensio 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT 1 ml sisältää 100 000 IU nystatiinia. Apuaineet: metyyliparahydroksibentsoaatti 1 mg natrium1,2 mg/ml,
Caprelsa. Vandetanibi CAPRELSA (VANDETANIBI) POTILAAN JA POTILAAN HUOLTAJAN (PEDIATRINEN KÄYTTÖ) OPAS ANNOSTELUSTA JA SEURANNASTA
 Caprelsa Vandetanibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Caprelsa Vandetanibi Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista.
 1 kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista. 2 3 Sisältö Miten Uptravi otetaan?............................................ 4 Miten
1 kalvopäällysteiset tabletit Titrausopas Uptravi-hoidon aloitus Lue oheinen pakkausseloste ennen hoidon aloittamista. 2 3 Sisältö Miten Uptravi otetaan?............................................ 4 Miten
VALMISTEYHTEENVETO. Hammaslääkärin tai lääkärin määräyksestä: Pre- ja postoperatiivinen desinfiointi suukirurgiassa ja parodontaalisessa kirurgiassa.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Corsodyl 2 mg/ml liuos suuonteloon 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Klooriheksidiiniglukonaatti 2 mg/ml Täydellinen apuaineluettelo, ks. kohta 6.1. 3. LÄÄKEMUOTO
B. PAKKAUSSELOSTE 40
 B. PAKKAUSSELOSTE 40 PAKKAUSSELOSTE Focetria injektioneste, suspensio Rokote pandeemiseen influenssaan (H1N1) (pinta-antigeeni, inaktivoitu, adjuvantoitu) Lue tämä seloste huolellisesti, ennen kuin saat
B. PAKKAUSSELOSTE 40 PAKKAUSSELOSTE Focetria injektioneste, suspensio Rokote pandeemiseen influenssaan (H1N1) (pinta-antigeeni, inaktivoitu, adjuvantoitu) Lue tämä seloste huolellisesti, ennen kuin saat
PAKKAUSSELOSTE: TIEDOT KÄYTTÄJÄLLE. MEPACT 4 mg infuusiokuiva-aine suspensiota varten Mifamurtidi
 PAKKAUSSELOSTE: TIEDOT KÄYTTÄJÄLLE MEPACT 4 mg infuusiokuiva-aine suspensiota varten Mifamurtidi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita
PAKKAUSSELOSTE: TIEDOT KÄYTTÄJÄLLE MEPACT 4 mg infuusiokuiva-aine suspensiota varten Mifamurtidi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin 38/46 A. Valmisteyhteenveto 4.1 Käyttöaiheet [tällä hetkellä hyväksytyt käyttöaiheet on poistettava ja korvattava seuraavilla]
Potilaan opas. Tietoa henkilöille, joille on määrätty botulinutoksiini B:tä (NeuroBloc ) servikaalisen dystonian hoitoon
 Potilaan opas Tietoa henkilöille, joille on määrätty botulinutoksiini B:tä (NeuroBloc ) servikaalisen dystonian hoitoon Oppaan on laatinut Eisai Europe Limited Tässä oppaassa kerrotaan NeuroBloc -lääkkeestä
Potilaan opas Tietoa henkilöille, joille on määrätty botulinutoksiini B:tä (NeuroBloc ) servikaalisen dystonian hoitoon Oppaan on laatinut Eisai Europe Limited Tässä oppaassa kerrotaan NeuroBloc -lääkkeestä
Ohje Xarelto -lääkkeen käyttäjälle
 Ohje Xarelto -lääkkeen käyttäjälle 2 Ohje Xarelto -lääkkeen käyttäjälle Lääkärisi on määrännyt Sinulle Xarelto - lääkevalmistetta. Tekonivelleikkauksen jälkeen laskimotukoksen eli veritulpan riski on tavallista
Ohje Xarelto -lääkkeen käyttäjälle 2 Ohje Xarelto -lääkkeen käyttäjälle Lääkärisi on määrännyt Sinulle Xarelto - lääkevalmistetta. Tekonivelleikkauksen jälkeen laskimotukoksen eli veritulpan riski on tavallista
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Noviana 0,5 mg/0,1 mg kalvopäällysteiset tabletit 19.5.2014, Painos 3, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti
 Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Potilasturvallisuuden edistämisen ohjausryhmä. Potilasturvallisuus on yhteinen asia! Potilasturvallisuus. Kysy hoidostasi vastaanotolla!
 Potilasturvallisuus on yhteinen asia! Potilasturvallisuus on osa hyvää hoitoa kattaa tutkimuksen, hoidon ja laitteiden turvallisuuden tarkoittaa myös sitä, ettei hoidosta aiheutuisi potilaalle haittaa
Potilasturvallisuus on yhteinen asia! Potilasturvallisuus on osa hyvää hoitoa kattaa tutkimuksen, hoidon ja laitteiden turvallisuuden tarkoittaa myös sitä, ettei hoidosta aiheutuisi potilaalle haittaa
LUUKUDOS ELÄÄ! vanhaa luuta. luu hajoaa. kuoppa. luu rakentuu. uusiutunut luukudos
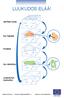 LUUKUDOS ELÄÄ! vanhaa luuta luu hajoaa kuoppa luu rakentuu uusiutunut luukudos VAHVA LUUSTO RAKENTUU kalsium + D-vitamiini + liikunta LUUN KUNTOA VOI KOHENTAA,LUUKATOA EHKÄISTÄ JA PYSÄYTTÄÄ 50 vuotta 60
LUUKUDOS ELÄÄ! vanhaa luuta luu hajoaa kuoppa luu rakentuu uusiutunut luukudos VAHVA LUUSTO RAKENTUU kalsium + D-vitamiini + liikunta LUUN KUNTOA VOI KOHENTAA,LUUKATOA EHKÄISTÄ JA PYSÄYTTÄÄ 50 vuotta 60
PAKKAUSSELOSTE. Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta
 PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
VALMISTEYHTEENVETO. Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Steriili vesi Baxter Viaflo, liuotin parenteraaliseen käyttöön 2. VAIKUTTAVAT AINEET NIIDEN MÄÄRÄT JA Injektionesteisiin käytettävä vesi. 3. LÄÄKEMUOTO Liuotin
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
POTILAAN OPAS. EYLEA likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoidossa
 POTILAAN OPAS EYLEA likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoidossa EYLEA Potilaan opas Lääkäri on määrännyt sinulle EYLEA -hoidon, koska sinulla on todettu likitaitteisuuden aiheuttama
POTILAAN OPAS EYLEA likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoidossa EYLEA Potilaan opas Lääkäri on määrännyt sinulle EYLEA -hoidon, koska sinulla on todettu likitaitteisuuden aiheuttama
(pembrolitsumabi) Tietoa potilaille
 Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
Tietoa KEYTRUDA - valmisteesta (pembrolitsumabi) Tietoa potilaille Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla
VALMISTEYHTEENVETO. Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia.
 VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
VALMISTEYHTEENVETO 1. LÄÄKEVALMISTEEN NIMI Fludent 0,25mg F- imeskelytabletti 2. VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT Yksi tabletti sisältää natriumfluoridia määrän, joka vastaa 0,25 mg:aa fluoridia. Yksi
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
