PAKKAUSSELOSTE. EVRA depotlaastari Norelgestromiini ja etinyyliestradioli
|
|
|
- Maria Järvenpää
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 PAKKAUSSELOSTE EVRA depotlaastari Norelgestromiini ja etinyyliestradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen. - Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. - Jos havaitset sellaisia haittavaikutuksia, joita ei ole tässä selosteessa mainittu, tai kokemasi haittavaikutus on vakava, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tässä pakkausselosteessa esitetään: 1. Mitä EVRA on ja mihin sitä käytetään 2. Ennen kuin käytät EVRAa 3. Hormonaalisten yhdistelmäehkäisyvalmisteiden käyttöön liittyvät riskit 4. Miten EVRAa käytetään 5. Mahdolliset haittavaikutukset 6. EVRAn säilyttäminen 7. Muuta tietoa 1. MITÄ EVRA ON JA MIHIN SITÄ KÄYTETÄÄN Tämä lääke on nimeltään EVRA depotlaastari ja tässä pakkausselosteessa siitä käytetään nimitystä EVRA. Valmistetta käytetään raskauden ehkäisyyn. EVRA sisältää kahta eri tyyppistä hormonia: norelgestromiini etinyyliestradioli Koska EVRAssa on kahta hormonia, sitä kutsutaan hormonaaliseksi yhdistelmäehkäisyvalmisteeksi. 2. ENNEN KUIN KÄYTÄT EVRAA Älä käytä EVRAa, jos: olet allerginen (yliherkkä) norelgestromiinille, etinyyliestradiolille tai EVRAn jollekin muulle aineelle (lueteltu kohdassa 7). sinulla on koskaan ollut sydäninfarkti tai angina pectoris rintakipua sinulla on koskaan ollut aivohalvaus tai oireita, jotka saattavat johtaa aivohalvaukseen, kuten lievä, ohimenevä aivohalvaus, jolla ei ole jälkivaikutuksia sinulla on korkea verenpaine (160/100 mmhg tai enemmän) sinulla on diabetes, johon liittyy vaurioituneita verisuonia sinulla on kovia päänsärkyjä, joihin liittyy neurologisia oireita, kuten näkömuutoksia tai minkä tahansa kehon alueen tunnottomuutta (migreeni, johon liittyy fokaalisia ennakko-oireita) jos sinulla on koskaan ollut verisuonitukos (verihyytymä) jaloissa (syvä laskimotukos), keuhkoissa (keuhkoveritulppa) tai muualla elimistössä sinulla on suvussasi esiintyvä sairaus, joka vaikuttaa veren hyytymiseen (kuten proteiini C:n tai proteiini S:n puutos) sinulla on erittäin korkeat veren rasva-arvot (kolesteroli tai triglyseridit) sinulla on suvussasi esiintyvä veren rasva-arvoihin vaikuttava sairaus (dyslipoproteinemia) sinulla on koskaan ollut maksakasvain tai mikä tahansa maksasairaus sinulla on koskaan epäilty rintasyöpää tai kohtu-, kohdunkaulan tai emätinsyöpää sinulla on selittämätöntä emätinverenvuotoa. 28
2 Älä käytä EVRAa, jos mikä tahansa yllä kuvatuista tiloista koskee sinua. Jos olet epävarma, kysy lääkäriltäsi tai apteekista neuvoa ennen EVRAn käyttöä. Ole erityisen varovainen EVRAn suhteen Lääkärintarkastukset Ennen EVRAn käyttöä sinun on käytävä lääkärintarkastuksessa. Ota yhteys lääkäriisi tai apteekkiin ennen EVRAn käyttöä, jos sinulla on jokin alla luetelluista tiloista, jos jokin niistä pahenee tai ilmenee ensimmäistä kertaa: painat 90 kg tai enemmän sinulla tai perheenjäsenelläsi on veren korkea rasvapitoisuus (triglyseridit tai kolesteroli) sinulla on korkea verenpaine tai verenpaineesi kohoaa sinulla on porfyriaksi kutsuttu aineenvaihduntasairaus sinulla on immuunijärjestelmään vaikuttava SLE-tauti (systeeminen lupus erythematosus) sinulla on hemolyyttis-ureeminen oireyhtymä (HUS), joka on munuaisvaurioita aiheuttava verisairaus sinulla on huonokuuloisuutta sinulla on epilepsia tai mikä tahansa muu sairaus, joka voi aiheuttaa kouristuskohtauksia sinulla on Sydenhamin korea (tanssitauti), johon liittyy äkillisiä kehon liikkeitä sinulla on diabetes sinulla on masennus sinulla on sappikivet sinulla on maksasairaus, kuten ihon ja silmänvalkuaisten keltaisuutta sinulla on tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) sinulla on raskausrokahtuma (herpes gestationis) sinulla on kellanruskeita läiskiä erityisesti kasvojen iholla, joita kutsutaan myös raskausajan maksaläiskiksi (kloasma) epäilet olevasi raskaana. Jos et ole varma, koskeeko jokin yllä kuvatuista tiloista sinua, kysy lääkäriltäsi tai apteekista neuvoa ennen EVRAn käyttöä. Muiden lääkkeiden käyttö: Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt ja rohdosvalmisteita. Eräät lääkkeet ja rohdosvalmisteet voivat estää EVRAa vaikuttamasta oikealla tavalla, joten saatat tulla raskaaksi. Kerro lääkärillesi, jos parhaillaan käytät: HIV-lääkkeitä (kuten ritonaviiri, nevirapiini) infektiolääkkeitä (kuten rifampisiini ja griseofulviini) epilepsialääkkeitä (kuten topiramaatti, barbituraatit, fenytoiininatrium, karbamatsepiini, primidoni, okskarbatsepiini ja felbamaatti) keuhkoverisuonissa todetun korkean verenpaineen hoitoon tarkoitettuja lääkkeitä (bosentaania mäkikuismaa, joka on rohdosvalmiste jota käytetään masennuksen hoitoon. Jos käytät jotakin yllä mainituista lääkkeistä tai rohdosvalmisteista, saatat tarvita jonkin toisen luotettavan ehkäisymenetelmän käyttämistä (esim. kondomi, pessaari tai ehkäisyvaahto). Jotkut mainituista lääkkeistä voivat vaikuttaa ehkäisytehoon jopa 28 päivää sen jälkeen, kun olet lopettanut niiden käytön. EVRA-laastareista vapautuvan estrogeenin pitoisuus plasmassa voi suureta, jos käytät tiettyjä lääkkeitä tai juot greippimehua. EVRA voi heikentää joidenkin lääkkeiden tehoa.tällaisia lääkkeitä voivat olla syklosporiinia sisältävät lääkevalmisteet 29
3 epilepsian hoitoon käytettävä lamotrigiini (Tämä voi lisätä kouristuskohtausten riskiä.) 30
4 Kysy lääkäriltä tai apteekista neuvoa ennen minkään lääkkeen käyttöä. EVRAn käyttö ruuan ja juoman kanssa: Ruuan ja juoman ei odoteta vaikuttavan EVRAn imeytymiseen. Raskaus ja imetys: Älä käytä EVRAa, jos olet raskaana tai epäilet olevasi raskaana. Älä käytä EVRAa, jos imetät tai suunnittelet imettämistä. Kysy lääkäriltä tai apteekista neuvoa ennen minkään lääkkeen käyttöä raskauden tai imetyksen aikana. Ajaminen ja koneiden käyttö: Voit ajaa ja käyttää koneita EVRAn käytön aikana. Sukupuolitauti EVRA ei suojaa HIV-infektiolta (AIDS) tai miltään muulta sukupuolitaudilta, kuten klamydia, genitaaliherpes, visvasyylä, tippuri, B-hepatiitti ja kuppa. Käytä aina kondomia suojaamaan itseäsi tartunnalta. Laboratoriokokeet Jos sinulle tehdään veri- tai virtsakokeita, ilmoita terveydenhuoltohenkilöstölle, että käytät EVRAa, koska se voi vaikuttaa joidenkin kokeiden tuloksiin. 3. HORMONAALISTEN YHDISTELMÄEHKÄISYVALMISTEIDEN KÄYTTÖÖN LIITTYVÄT RISKIT Seuraavat tiedot perustuvat yhdistelmäehkäisypillereitä koskeviin tietoihin. Koska EVRA depotlaastari sisältää samanlaisia hormoneja kuin yhdistelmäehkäisypilleritkin, sillä oletetaan olevan myös samat riskit. Kaikkiin yhdistelmäehkäisyvalmisteisiin liittyy haittoja, jotka voivat johtaa vammautumiseen tai kuolemaan. Ei ole osoitettu, että depotlaastarit, kuten EVRA, olisivat turvallisempia kuin suun kautta otettavat yhdistelmäehkäisypillerit. Hormonaaliset yhdistelmäehkäisyvalmisteet ja verisuonitukokset (verihyytymät) Hormonaalisten yhdistelmäehkäisyvalmisteiden, kuten EVRAn, käyttö lisää verisuonitukoksen (verihyytymien) mahdollisuutta. On mahdollista, että verisuonitukosten riski alaraajoissa ja/tai keuhkoissa on EVRAn käytön yhteydessä suurempi kuin yhdistelmäehkäisypillereiden käytön yhteydessä. Verihyytymien kehittymisen riski ei muutu lääkkeen käytön pituuden myötä, ja lisääntynyt riski palautuu tavanomaiselle tasolle muutamassa kuukaudessa yhdistelmäehkäisyvalmisteen käytön lopettamisen jälkeen. Verihyytymät voivat tukkia laskimoita tai valtimoita, mikä voi aiheuttaa pysyvän vammautumisen tai jopa kuoleman. Verisuonitukos voi muodostua jalan laskimoon (syvä laskimotukos) ja liikkua keuhkoihin. Tämä voi aiheuttaa rintakipua, hengenahdistusta tai tajunnanmenetyksen. Tätä tilaa kutsutaan keuhkoveritulpaksi. Hyvin harvoin verihyytymiä voi muodostua sydämen verisuonissa (sydänkohtaus) tai aivojen verisuonissa (aivohalvaus). Äärimmäisen harvoin verihyytymiä voi esiintyä muualla, kuten maksassa, suolessa, munuaisessa tai silmässä. Verihyytymä silmässä voi aiheuttaa näön menetyksen tai kahtena näkemistä. Ota välittömästi yhteyttä lääkäriisi, jos havaitset mitään verihyytymään viittaavia oireita tai merkkejä. Verihyytymän mahdollisia merkkejä ovat: kipu tai turvotus toisessa jalassa 31
5 rintakipu, joka saattaa säteillä käsivarteen äkillinen hengenahdistus tai yskänpuuska poikkeava, voimakas tai pitkään jatkuva päänsärky näköhäiriöt puhevaikeudet huimaus tai pyörtymiskohtaukset toispuoleinen kehon heikkouden tai tunnottomuuden tunne kävelyvaikeudet tai vaikeus esineiden käsittelemisessä äkillinen vatsakipu Jos epäilet, että sinulla voisi olla mikä tahansa näistä, ota välittömästi yhteys lääkäriisi. Verihyytymien riski lisääntyy: iän myötä jos suvussasi esiintyy verisuoniin (laskimoihin tai valtimoihin) muodostuneiden verihyytymien aiheuttamia sairauksia jos tupakoit, varsinkin jos olet yli 35-vuotias jos olet vuodelevossa usean päivän ajan jos olet runsaasti ylipainoinen jos olet äskettäin synnyttänyt, kokenut keskenmenon tai sinulle on tehty abortti jos sinulla on ollut vaikea vamma, varsinkin jalassa tai lonkassa jos sinulle on tehty tai tullaan tekemään suuri leikkaus tai sinun on oltava pitkään vuodelevossa. Tavallisesti EVRAa ei saa käyttää kahteen viikkoon ennen leikkausta ja leikkauksen jälkeen jos sinulla on koskaan ollut verihyytymiä jos sinulla on kohonneet veren rasva-arvot (kolesteroli tai triglyseridit) jos sinulla on korkea verenpaine jos sinulla on sydänvaivoja (sydänläpän aiheuttamia ongelmia tai poikkeava sydämen syke). Hormonaaliset yhdistelmäehkäisyvalmisteet ja syöpä Rintasyöpä Naisilla, jotka käyttävät hormonaalisia yhdistelmäehkäisyvalmisteita, on todettu rintasyöpää useammin kuin niitä käyttämättömillä naisilla. On kuitenkin mahdollista, että hormonaaliset yhdistelmäehkäisyvalmisteet eivät aiheuta rintasyövän lisääntymistä naisilla. Hormonaalisia yhdistelmäehkäisyvalmisteita käyttävät naiset saattavat käydä lääkärintarkastuksessa muita useammin, minkä vuoksi rintasyöpä heidän kohdallaan todennäköisemmin havaitaan. Lisääntynyt rintasyövän esiintymisvaara vähenee vähitellen, kun hormonaalisen yhdistelmäehkäisyvalmisteen käyttö lopetetaan. Kymmenen vuoden kuluttua rintasyövän esiintymismahdollisuus on sama kuin sellaisilla ihmisillä, jotka eivät ole koskaan käyttäneet hormonaalisia yhdistelmäehkäisyvalmisteita. Kohdunkaulan syöpä Myös kohdunkaulan syöpää esiintyy useammin hormonaalisia yhdistelmäehkäisyvalmisteita käyttävillä naisilla. Tämä syöpä saattaa kuitenkin olla yhteydessä muihin tekijöihin, kuten lisääntyneeseen sukupuolikumppaneiden määrään ja sukupuolitauteihin. Maksasyöpä Hormonaalisia yhdistelmäehkäisyvalmisteita käyttävillä naisilla on raportoitu harvoin hyvänlaatuisia maksakasvaimia. Pahanlaatuisia maksakasvaimia (syöpiä) on todettu vielä harvemmin. Maksakasvain voi aiheuttaa sisäisen verenvuodon, josta seuraa voimakas vatsakipu. Jos tällaista esiintyy, ota välittömästi yhteys lääkäriisi. 4. MITEN EVRAA KÄYTETÄÄN Käytä EVRAa aina tarkasti tässä pakkausselosteessa annettujen ohjeiden mukaisesti. Jos et noudata ohjeita, raskaaksi tulemisen riski saattaa kasvaa. Tarkista annostusohjeet lääkäriltä tai apteekista, jos olet epävarma. 32
6 Pidä aina varalla muita kuin hormonaalisia ehkäisyvalmisteita (kuten kondomi, ehkäisyvaahto tai -sieni) laastarin käyttöön liittyvien virheiden varalta. Neuvottele lääkärisi kanssa EVRAn käytön aloittamisesta synnytyksen, abortin tai keskenmenon jälkeen. Depotlaastareiden määrä Viikot 1, 2 ja 3: Kiinnitä yksi laastari ja jätä se paikalleen tarkalleen seitsemän päivän ajaksi. Viikko 4: Älä kiinnitä laastaria tällä viikolla. Tärkeää tietoa laastarin käytöstä Vaihda EVRA aina samana viikonpäivänä, sillä se on suunniteltu vaikuttamaan seitsemän päivän ajan. Älä koskaan pidä enempää kuin seitsemän laastaritonta päivää peräkkäin. Käytä vain yhtä laastaria kerrallaan. Älä kiinnitä laastaria punoittavalle, ärtyneelle äläkä rikkoontuneelle iholle. Laastarin on kiinnityttävä ihoon tiukasti, jotta se toimisi oikein. Paina laastaria voimakkaasti ihoa vasten, kunnes sen reunat tarttuvat kiinni. Älä käytä ihovoiteita, öljyjä, kosteusemulsioita, puuteria tai meikkiä kohdassa, johon kiinnität laastarin tai jonka lähellä laastari on jo kiinni. Se saattaa irrottaa laastarin. Älä laita uutta laastaria samalle ihoalueelle, jolla poistamasi laastari oli. Siitä saattaisi aiheutua herkemmin ihon ärtymistä. Tarkista päivittäin, ettei laastari ole irronnut. Älä lopeta laastareiden käyttöä, vaikka et olisi usein sukupuoliyhteydessä. KÄYTTÖOHJEET Jos tämä on ensimmäinen kerta, kun käytät EVRAa, odota siihen päivään asti, jolloin kuukautisesi alkavat. Kiinnitä ensimmäinen laastari kuukautistesi ensimmäisen 24 tunnin aikana. Jos laastari kiinnitetään kuukautistesi alkamispäivän jälkeen, käytä eihormonaalista ehkäisymenetelmää päivään kahdeksan asti, jolloin vaihdat laastarin. Päivä, jolloin kiinnität ensimmäisen laastarisi, on päivä 1. Laastarinvaihtopäiväsi tulee olemaan tänä samana viikonpäivänä joka viikko. Valitse laastarin kiinnityskohta vartaloltasi. Kiinnitä laastari aina puhtaalle, kuivalle, karvattomalle iholle Kiinnitä laastari pakaraan, vatsaan, olkavarren ulkopintaan tai yläselkään kohtaan, jossa tiukka vaatetus ei hankaa sitä. Älä koskaan kiinnitä laastaria rintoihisi. Repäise suojapussi auki sormin. Repäise suojapussi auki reunaa pitkin (älä käytä saksia). Ota kiinni laastarin kulmasta ja vedä se varovasti pois pussista. Laastarin suojana on läpinäkyvä suojakalvo Laastarit voivat joskus tarttua kiinni pussin sisäpintaan ole varovainen, että et vahingossa irrota läpinäkyvää suojakalvoa ottaessasi laastaria pussista. Vedä sitten puolet läpinäkyvästä suojakalvosta irti kuvan osoittamalla tavalla. Älä kosketa liimapintaa. 33
7 Aseta laastari ihollesi. Poista sitten suojakalvon toinen puolisko. Paina laastaria voimakkaasti kämmenelläsi 10 sekunnin ajan. Varmista, että laastarin reunat tarttuvat kunnolla kiinni. Käytä laastaria seitsemän päivää (yhden viikon ajan). Poista käytetty laastari ensimmäisenä laastarinvaihtopäivänä (päivä 8). Kiinnitä uusi laastari välittömästi. Poista käytetty laastari päivänä 15 (viikko 3). Kiinnitä uusi laastari. Laastareita käytetään siis yhteensä kolmen viikon ajan. Ärsytyksen välttämiseksi uusi laastari on hyvä kiinnittää eri kohtaan kuin edellinen laastari. Älä käytä laastaria viikon 4 aikana (päivät 22 28). Sinulla tulisi olla kuukautiset tämän ajanjakson aikana. Sinulla on raskauden ehkäisy tämän viikon aikana ainoastaan, jos otat seuraavan laastarin käyttöön aikataulun mukaisesti. Aloita seuraava neljän viikon jakso Kiinnitä uusi laastari normaalina laastarinvaihtopäivänäsi (päivää 28 seuraava päivä) Kiinnitä laastari riippumatta siitä, milloin kuukautisesi alkavat tai päättyvät. Jos haluat muuttaa laastarinvaihtopäiväsi toiseksi viikonpäiväksi, keskustele siitä lääkärisi kanssa. Päivittäiset toimet ja laastarien käyttö Tavanomaisten toimien, kuten suihkussa, kylvyssä tai saunassa käynnin tai liikunnan, ei pitäisi vaikuttaa laastarin toimintaan. Laastarin on tarkoitus pysyä paikallaan tämäntyyppisten toimien aikana. Tarkista kuitenkin näiden toimien jälkeen, ettei laastari ole irronnut. Jos sinun on kiinnitettävä laastari uuteen paikkaan muuna kuin laastarinvaihtopäivänä Jos käyttämäsi laastari aiheuttaa ihon ärtymistä tai tuntuu epämukavalta voit irrottaa laastarin ja laittaa uuden laastarin eri paikkaan. kerrallaan voit käyttää vain yhtä laastaria. Jos sinun on vaikea muistaa laastarin vaihto Keskustele lääkärisi tai muun hoitohenkilökunnan kanssa ehkäisyneuvolassa, miten laastarin vaihdon voisi tehdä helpommaksi, tai muiden ehkäisymenetelmien käytöstä. 34
8 Jos laastari on ollut osittain tai kokonaan irti alle yhden vuorokauden (enintään 24 tuntia): Yritä kiinnittää se uudelleen tai kiinnitä uusi laastari välittömästi. Lisäehkäisyä ei tarvita. Laastarinvaihtopäivä pysyy samana. Älä yritä kiinnittää laastaria uudelleen, jos - se ei ole enää tahmea - se on tarttunut kiinni itseensä tai johonkin muuhun pintaan - siihen on tarttunut muuta materiaalia - se on irronnut osittain tai kokonaan toisen kerran. Laastarin kiinnittämiseen ei saa käyttää lisäliimaa tai sidetarvikkeita. Jos et saa laastaria kiinnitetyksi uudelleen, kiinnitä uusi laastari välittömästi. yli yhden vuorokauden (24 tuntia tai kauemmin) tai et ole varma ajasta: Aloita uusi neljän viikon jakso välittömästi kiinnittämällä uusi laastari. Sinulla on nyt uusi päivä 1 ja uusi laastarinvaihtopäivä. Sinun täytyy käyttää jotakin ei-hormonaalista lisäehkäisymenetelmää uuden jakson ensimmäisen viikon ajan. Voit tulla raskaaksi, jos et noudata näitä ohjeita. Jos unohdat vaihtaa laastarin minkä tahansa laastarijakson alussa (viikko 1 (päivä 1)): Jos unohdat kiinnittää laastarin, sinulla saattaa olla erittäin suuri riski tulla raskaaksi. Käytä ei-hormonaalista lisäehkäisyä yhden viikon ajan. Kiinnitä uuden jakson ensimmäinen laastari heti kun muistat. Käytössäsi on nyt uusi laastarinvaihtopäivä ja uusi päivä 1. laastarijakson keskellä (viikko 2 tai 3): Jos laastarin vaihto unohtuu yhden tai kahden vuorokauden ajaksi (enintään 48 tuntia), kiinnitä uusi laastari niin pian kuin muistat. kiinnitä seuraava laastari normaalina Laastarinvaihtopäivänä. Lisäehkäisyä ei tarvita. yli kahden vuorokauden ajaksi (48 tuntia tai kauemmin) Jos laastarin vaihto unohtuu yli kahden vuorokauden ajaksi, saatat tulla raskaaksi. Aloita uusi neljän viikon jakso kiinnittämällä uusi laastari niin pian kuin muistat. Käytössä on nyt uusi laastarinvaihtopäivä ja uusi päivä 1. Käytä lisäehkäisyä uuden jakson ensimmäisen viikon ajan. laastarijakson lopussa (viikko 4): Jos unohdat poistaa laastarin, poista se heti kun muistat. aloita seuraava jakso normaalina laastarinvaihtopäivänä, joka on päivää 28 seuraava päivä. Lisäehkäisyä ei tarvita. Siirtyminen ehkäisypillereiden käytöstä EVRAn käyttöön Jos siirryt suun kautta otettavien ehkäisypillereiden käytöstä EVRAn käyttöön, odota, kunnes kuukautisesi alkavat. kiinnitä ensimmäinen laastari kuukautistesi ensimmäisen 24 tunnin aikana. Jos laastari kiinnitetään kuukautistesi alkamispäivän (päivä 1) jälkeen, sinun on käytettävä ei-hormonaalista ehkäisymenetelmää päivään 8 asti, jolloin vaihdat laastarin. Jos kuukautisesi eivät ala viiden päivän kuluessa viimeisen ehkäisypillerin ottamisesta, pyydä lääkäriltäsi ohjeita ennen EVRAn käytön aloittamista. 35
9 Siirtyminen minipillereiden käytöstä EVRAn käyttöön Voit siirtyä minipillereistä EVRA n käyttöön minä päivänä tahansa Kiinnitä laastari ensimmäisenä päivänä minipillereiden lopettamisen jälkeen. Käytä ei-hormonaalista ehkäisymenetelmää päivään 8 asti, jolloin vaihdat laastarin. Jos vuoto jää kokonaan pois tai sinulla esiintyy epäsäännöllistä vuotoa EVRAn käytön yhteydessä EVRA saattaa aiheuttaa odottamatonta emätinverenvuotoa tai tiputtelua niiden viikkojen aikana, jolloin käytät depotlaastaria. Tämä loppuu yleensä muutaman ensimmäisen kierron jälkeen. Myös käyttöohjeesta poikkeava laastareiden käyttö voi aiheuttaa tiputtelua tai vähäistä vuotoa. Jatka EVRAn käyttöä ja jos vuoto jatkuu kauemmin kuin kolmen ensimmäisen kierron ajan, käänny lääkärisi tai apteekin puoleen. Jos kuukautisesi jäävät pois EVRAn laastarittoman viikon (viikko 4) aikana, jatka kuitenkin laastarien käyttöä tavanomaisena laastarinvaihtopäivänä. Jos olet käyttänyt EVRAa käyttöohjeen mukaisesti eivätkä kuukautisesi ole alkaneet, tämä ei välttämättä tarkoita, että olet raskaana. Jos kuitenkin kahdet peräkkäiset kuukautiset jäävät pois, käänny lääkärisi tai apteekin puoleen, sillä saatat olla raskaana Jos käytät enemmän EVRAa kuin sinun pitäisi Irrota laastarit ja ota välittömästi yhteys lääkäriisi, jos olet kiinnittänyt useamman laastarin kuin sinulle on määrätty. Liian monen laastarin käyttö saattaa aiheuttaa pahoinvointia ja oksentelua tyhjennysvuotoa. Jos lopetat EVRAn käytön Sinulla voi esiintyä epäsäännöllistä, heikkoa vuotoa tai vuoto voi jäädä kokonaan pois. Tämä on tyypillistä kolmen ensimmäisen kuukauden aikana ja erityisesti, jos kuukautisesi eivät olleet säännölliset ennen EVRAn käytön aloittamista. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen. 5. MAHDOLLISET HAITTAVAIKUTUKSET Kuten kaikki lääkkeet, EVRAkin voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Kerro lääkärillesi, jos havaitset ei-toivottuja vaikutuksia. Jos sinulla mielestäsi on EVRAn käyttöön liittyvä vakava haittavaikutus, poista laastari ja kerro asiasta välittömästi lääkärillesi tai apteekkiin. Käytä sillä välin muuta ehkäisymenetelmää. Hormonaalisiin yhdistelmäehkäisyvalmisteisiin liittyvistä vakavista haittavaikutuksista on kerrottu edellä kohdassa 3 ( Hormonaalisten yhdistelmäehkäisyvalmisteiden käyttöön liittyvät riskit ). Lue tämä kohta lisätietojen saamiseksi. Hyvin yleiset haittavaikutukset (joita voi esiintyä yli yhdellä naisella 10:stä) päänsärky pahoinvointi rintojen arkuus Yleiset haittavaikutukset (joita voi esiintyä enintään yhdellä naisella 10:stä) emättimen hiivasieni-infektio, josta joskus käytetään nimitystä sammas mielialahäiriöt, kuten masennus, mielialan muutos tai mielialan vaihtelu 36
10 huimauksen tunne migreeni mahakipu tai vatsan turvotus oksentelu tai ripuli akne, kutina tai ihoärsytys lihaskouristukset rintarauhaskipu tai rintojen suurentuminen kohdun kouristelu, kivuliaat tai runsaat kuukautiset, välivuodot tai emätinvuoto laastarin kiinnityskohdan ihoreaktiot (kuten punoitus, ärsytys tai ihottuma) väsymys tai huonovointisuus painonnousu Melko harvinaiset haittavaikutukset (joita voi esiintyä enintään yhdellä naisella 100:sta) turvotus, joka johtuu veden kertymisestä elimistöön korkea veren rasvapitoisuus (kuten kolesteroli tai triglyseridit) hallitsemattomat tunteet ahdistuneisuus univaikeudet (unettomuus) vähentynyt seksuaalinen halukkuus ihottuma, ihon punoitus rintojen turvotus, kyhmy rinnassa tai maidoneritys ilman raskautta kuukautisia edeltävä oireyhtymä (PMS) emätinverenvuoto tai emättimen kuivuus laastarin kiinnityskohdan ihoreaktiot (kuten turvotus, ihon värimuutos, kipu, näppylät, rakkulat tai ihon liikaherkkyys) turvotus kohonnut verenpaine. Harvinaiset haittavaikutukset (joita voi esiintyä enintään yhdellä naisella 1 000:sta) poikkeava itkuisuus lisääntynyt seksuaalinen halukkuus verihyytymä keuhkoissa sappirakon tulehdus kellanruskeat maksaläiskät kasvoissa epäsäännölliset kuukautiset paukamainen ihottuma (nokkosihottuma) laastarin kiinnityskohdassa kohonnut veren kolesteroliarvo Hyvin harvinaiset haittavaikutukset (joita voi esiintyä enintään yhdellä naisella :sta) aggressiivisuus tavanomaista tiheämmät kuukautiset Muita ilmoitettuja haittavaikutuksia ovat muun muassa muut laastarin kiinnityskohdan reaktiot, ihoreaktiot tai allergiset reaktiot hyvänlaatuiset rintarauhasen tai maksan kasvaimet rinta-, kohdunkaulan tai maksasyöpä kohdun sidekudoskasvaimet poikkeavat veren sokeri-, kolesteroli- tai insuliiniarvot verihyytymät, tukkeutuneet valtimot, sydäninfarkti tai aivohalvaus piilolinssien käyttöön liittyvät ongelmat korkea verenpaine paksusuolitulehdus sappikivet tai sappitiehyen tukkeuma poikkeava maku 37
11 ihon ja silmänvalkuaisten keltaisuus hiustenlähtö valoherkkyys tavanomaista harvemmat tai niukemmat kuukautiset tai kuukautisten poisjäänti kiukku, ärtyneisyys tai turhautuneisuus. Jos sinulla on vatsavaivoja Oksentelun tai ripulin ei pitäisi vaikuttaa EVRAsta saamiesi hormonien määrään. Vatsavaivojen yhteydessä et tarvitse lisäehkäisyä. Sinulla voi esiintyä tiputtelua tai vähäistä vuotoa, rintojen arkuutta, tai voit tuntea itsesi huonovointiseksi kolmen ensimmäisen kuukauden ajan. Yleensä tilanne palautuu normaaliksi, mutta jos näin ei käy, keskustele tilanteesta lääkärin tai apteekkihenkilökunnan kanssa. Jos havaitset sellaisia haittavaikutuksia, joita ei ole tässä pakkausselosteessa mainittu, tai kokemasi haittavaikutus on vakava, kerro niistä lääkärille tai apteekkihenkilökunnalle. 6. EVRAN SÄILYTTÄMINEN Ei lasten ulottuville eikä näkyville. Säilytä alkuperäispakkauksessa. Herkkä valolle ja kosteudelle. Älä säilytä kylmässä. Ei saa jäätyä. Älä käytä EVRAa pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää. Laastareissa on vielä käytön jälkeenkin merkittäviä määriä vaikuttavia aineita, joten suojele luontoa ja hävitä käytetyt laastarit huolellisesti. Käytetyn laastarin hävittämiseksi, avaa tarraetiketti suojapussin ulkopinnasta. aseta käytetty laastari avatun tarraetiketin paikalle siten, että liimapinta peittää suojapussiin tummennetulla merkityn alueen. kiinnitä tarraetiketti sen jälkeen takaisin niin, että käytetty laastari jää sen alle. Laastari hävitetään pitäen se poissa lasten ulottuvilta. Älä huuhtele laastaria WC:n viemäriin tai jätevesijärjestelmien kautta. Kysy käyttämättömien laastareiden hävittämisestä apteekista. Näin menetellen suojelet luontoa. 7. MUUTA TIETOA Mitä EVRA sisältää EVRAn vaikuttavat aineet ovat norelgestromiini 6 mg ja etinyyliestradioli 600 mikrogrammaa. Vaikuttavat aineet vapautuvat 7 vuorokauden aikana siten, että keskimäärin 203 mikrogrammaa norelgestromiinia ja 34 mikrogrammaa etinyyliestradiolia vapautuu aina 24 tunnin aikana. Laastarin muita aineita ovat polyisobuteeni, polybuteeni, krospovidoni, polyesterikuitukangas ja lauryylilaktaatti. Miltä EVRA näyttää ja mitä pakkaus sisältää EVRA on ohut beigenvärinen muovinen depotlaastari. Sen tarttuva liimapinta kiinnitetään ihoon sen jälkeen, kun läpinäkyvä muovinen suojakalvo on poistettu. EVRA-laastareita on saatavana seuraavina pakkauskokoina: Pakkauksissa on 3, 9 tai 18 depotlaastaria yksittäispakattuina pinnoitelaminoituihin suojapusseihin, jotka on liitetty kolmen nipuiksi läpinäkyvällä rei itetyllä muovikelmulla. 38
12 Myyntiluvanhaltija ja valmistaja Myyntiluvan haltija: Janssen-Cilag International NV, Turnhoutseweg 30, B-2340 Beerse, Belgia. Valmistaja: Janssen Pharmaceutica N.V., Turnhoutseweg 30, Beerse B-2340, Belgia. Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja. België/Belgique/Belgien JANSSEN-CILAG N.V./S.A. Roderveldlaan 1 B-2600 Berchem Tél/Tel: България Johnson & Johnson d.o.o. Бизнес Парк София, Младост 4, сграда 4, етаж 3 София 1715 Тел.: (05) Česká republika JANSSEN-CILAG s.r.o. Karla Engliše 3201/6 CZ Praha 5 Tel Danmark JANSSEN-CILAG A/S Hammerbakken 19 Postboks 149 DK-3460 Birkerød Tlf: Deutschland JANSSEN-CILAG GmbH Johnson & Johnson Platz 1 D Neuss Tel: Eesti Janssen-Cilag Polska Sp.z o.o. Eesti filiaal Lõõtsa 2 EE Tallinn Tel: Ελλάδα JANSSEN-CILAG Φαρμακευτική Α.Ε.Β.Ε. Λεωφόρος Ειρήνης 56 GR Πεύκη, Αθήνα Tηλ: Luxembourg/Luxemburg JANSSEN-CILAG N.V./S.A. Roderveldlaan 1 B-2600 Berchem Tél: Magyarország JANSSEN-CILAG Kft. H-2045 Törökbálint, Tó Park Tel. : Malta A.M.Mangion Ltd Triq Ġdida fi Triq Valletta Luqa LQA 6000 Malta tel: Nederland JANSSEN-CILAG B.V. Postbus NL-5000 LT Tilburg Tel: Norge JANSSEN-CILAG A.S. Hoffsveien 1 D N Oslo Tlf: Österreich JANSSEN-CILAG Pharma GmbH. Pfarrgasse 75 A-1232 Wien Tel: Polska JANSSEN CILAG Polska Sp. z o.o., ul. Iłżecka 24, PL Warszawa Tel.:
13 España JANSSEN-CILAG, S.A. Paseo de las Doce Estrellas, 5-7 Campo de las Naciones E Madrid Tel: France JANSSEN-CILAG 1, rue de Camille Desmoulins TSA F Issy Les Moulineaux Cedex 9 Tel: / Ireland JANSSEN-CILAG Ltd Holmers Farm Way High Wycombe UK - HP12 4EG Buckinghamshire Tel: Ísland JANSSEN-CILAG AB c/o Vistor hf. Hörgatún 2 IS-210 Garðabær Iceland tel. (+354) Italia JANSSEN-CILAG SpA Via M.Buonarroti, 23 I Cologno Monzese MI Tel: / Κύπρος Βαρνάβας Χατζηπαναγής Λτδ 7 Ανδροκλέους CY-1060 Λευκωσία Tηλ: Latvija Janssen-Cilag Polska Sp. z o.o. filiāle Latvijā Matrožu iela 15 Rīga, LV-1048 Tel: Portugal JANSSEN-CILAG FARMACÊUTICA, LDA Estrada Consiglieri Pedroso, 69 A Queluz de Baixo Barcarena Tel: România Johnson & Johnson d.o.o. Rep.Office Janssen- Cilag Str. Tipogrfilor nr Bucureşti Tel: Slovenija Johnson & Johnson d.o.o. Šmartinska cesta 53 Sl-1000, Ljubljana Tel Slovenská republika Johnson&Johnson s.r.o. Plynárenská 7/B SK Bratislava 26 tel Suomi/Finland JANSSEN-CILAG OY Vaisalantie/Vaisalavägen 2 FI Espoo/Esbo Puh/Tel: Sverige JANSSEN-CILAG AB Box 7073 SE Sollentuna Tel: United Kingdom JANSSEN-CILAG Ltd Holmers Farm Way High Wycombe UK - HP12 4EG Buckinghamshire Tel: Lietuva UAB Johnson & Johnson Geležinio Vilko g. 18A LT Vilnius Tel:
14 Tämä pakkausseloste on hyväksytty viimeksi pvm Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston (EMEA) kotisivuilta 41
Liite I. Luettelo lääkevalmisteen nimistä, lääkemuodoista, vahvuuksista, antoreiteistä ja myyntiluvan haltijoista jäsenvaltioissa
 Liite I Luettelo lääkevalmisteen nimistä, lääkemuodoista, vahvuuksista, antoreiteistä ja myyntiluvan haltijoista jäsenvaltioissa 1 Itävalta Itävalta Itävalta Itävalta Pharma GmbH Vorgartenstraße 206B AT-1020
Liite I Luettelo lääkevalmisteen nimistä, lääkemuodoista, vahvuuksista, antoreiteistä ja myyntiluvan haltijoista jäsenvaltioissa 1 Itävalta Itävalta Itävalta Itävalta Pharma GmbH Vorgartenstraße 206B AT-1020
PAKKAUSSELOSTE. Airomir 5 mg/2,5 ml sumutinliuos. salbutamoli
 PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Airomir 5 mg/2,5 ml sumutinliuos salbutamoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE. Caelyx 2 mg/ml infuusiokonsentraatti, liuosta varten Pegyloitu liposomaalinen doksorubisiinihydrokloridi
 PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Caelyx 2 mg/ml infuusiokonsentraatti, liuosta varten Pegyloitu liposomaalinen doksorubisiinihydrokloridi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Caelyx 2 mg/ml infuusiokonsentraatti, liuosta varten Pegyloitu liposomaalinen doksorubisiinihydrokloridi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
Pakkausselostetekstillä on ihmislääkekomitean (CHMP) hyväksyntä 18. maaliskuuta 2010; Euroopan komission lopullista päätöstä odotetaan.
 B. PAKKAUSSELOSTE Pakkausselostetekstillä on ihmislääkekomitean (CHMP) hyväksyntä 18. maaliskuuta 2010; Euroopan komission lopullista päätöstä odotetaan. 1 PAKKAUSSELOSTE Exelon 4,6 mg/24 h depotlaastari
B. PAKKAUSSELOSTE Pakkausselostetekstillä on ihmislääkekomitean (CHMP) hyväksyntä 18. maaliskuuta 2010; Euroopan komission lopullista päätöstä odotetaan. 1 PAKKAUSSELOSTE Exelon 4,6 mg/24 h depotlaastari
Pakkausseloste: Tietoa potilaalle. Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas)
 Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
Pakkausseloste: Tietoa potilaalle Picato 150 mikrog/g geeli ingenolimebutaatti (ingenoli mebutas) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa
PAKKAUSSELOSTE. Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani
 PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Ifirmasta 300 mg tabletti, kalvopäällysteinen Irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE Nespo 15 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 25 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo 40 mikrogrammaa, injektioneste, liuos injektiopullossa Nespo
PAKKAUSSELOSTE. Eliquis 2,5 mg kalvopäällysteiset tabletit Apiksabaani
 1 2 B. PAKKAUSSELOSTE 3 PAKKAUSSELOSTE Eliquis 2,5 mg kalvopäällysteiset tabletit Apiksabaani Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
1 2 B. PAKKAUSSELOSTE 3 PAKKAUSSELOSTE Eliquis 2,5 mg kalvopäällysteiset tabletit Apiksabaani Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
Pakkausseloste: Tietoa potilaalle. Baraclude 0,05 mg/ml oraaliliuos entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
Pakkausseloste: Tietoa potilaalle Baraclude 0,05 mg/ml oraaliliuos entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja. Säilytä
PAKKAUSSELOSTE. Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit. Rivastigmiini
 PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Prometax 1,5 mg kovat kapselit Prometax 3,0 mg kovat kapselit Prometax 4,5 mg kovat kapselit Prometax 6,0 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE. Prolia 60 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE Prolia 60 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. CIALIS 10 mg kalvopäällysteinen tabletti tadalafiili
 PAKKAUSSELOSTE CIALIS 10 mg kalvopäällysteinen tabletti tadalafiili Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE CIALIS 10 mg kalvopäällysteinen tabletti tadalafiili Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. XGEVA 120 mg injektioneste, liuos denosumabi
 PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE XGEVA 120 mg injektioneste, liuos denosumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. -
PAKKAUSSELOSTE. Zylagren 75 mg kalvopäällysteiset tabletit Klopidogreeli
 PAKKAUSSELOSTE Zylagren 75 mg kalvopäällysteiset tabletit Klopidogreeli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE Zylagren 75 mg kalvopäällysteiset tabletit Klopidogreeli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE. IRESSA 250 mg kalvopäällysteiset tabletit gefitinibi
 PAKKAUSSELOSTE IRESSA 250 mg kalvopäällysteiset tabletit gefitinibi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE IRESSA 250 mg kalvopäällysteiset tabletit gefitinibi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi
 PAKKAUSSELOSTE Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Comtess 200 mg tabletti, kalvopäällysteinen Entakaponi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit
 PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Eucreas 50 mg/850 mg kalvopäällysteiset tabletit Eucreas 50 mg/1000 mg kalvopäällysteiset tabletit vildagliptiini/metformiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE. Vagifem 10 mikrog emätinpuikot. Estradioli
 PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Vagifem 10 mikrog emätinpuikot Estradioli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE. Comtan 200 mg kalvopäällysteiset tabletit Entakaponi
 PAKKAUSSELOSTE Comtan 200 mg kalvopäällysteiset tabletit Entakaponi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Comtan 200 mg kalvopäällysteiset tabletit Entakaponi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE
 LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 1 A. MYYNTIPÄÄLLYSMERKINNÄT 2 MIRAPEXIN 0,088 MG, 30 TABLETTIA LÄPIPAINOPAKKAUKSISSA Mirapexin 0,088 mg 0,088 mg pramipeksolia vastaa 0,125 mg pramipeksolidihydrokloridimonohydraattia
LIITE III MYYNTIPÄÄLLYSMERKINNÄT JA PAKKAUSSELOSTE 1 A. MYYNTIPÄÄLLYSMERKINNÄT 2 MIRAPEXIN 0,088 MG, 30 TABLETTIA LÄPIPAINOPAKKAUKSISSA Mirapexin 0,088 mg 0,088 mg pramipeksolia vastaa 0,125 mg pramipeksolidihydrokloridimonohydraattia
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Zenapax 5 mg/ml infuusiokonsentraatti Daklitsumabi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla
PAKKAUSSELOSTE Zenapax 5 mg/ml infuusiokonsentraatti Daklitsumabi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla
PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani
 PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Irbesartan Winthrop 75 mg kalvopäällysteiset tabletit irbesartaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Xenical 120 mg kovat kapselit Orlistaatti
 PAKKAUSSELOSTE Xenical 120 mg kovat kapselit Orlistaatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Xenical 120 mg kovat kapselit Orlistaatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE. Actos 15 mg tabletti Pioglitatsoni
 PAKKAUSSELOSTE Actos 15 mg tabletti Pioglitatsoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Actos 15 mg tabletti Pioglitatsoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. ZOSTAVAX Injektiokuiva-aine ja liuotin, suspensiota varten esitäytetyssä ruiskussa vyöruusurokote (herpes zoster), elävä
 PAKKAUSSELOSTE ZOSTAVAX Injektiokuiva-aine ja liuotin, suspensiota varten esitäytetyssä ruiskussa vyöruusurokote (herpes zoster), elävä Lue tämä pakkausseloste huolellisesti, ennen kuin sinut rokotetaan
PAKKAUSSELOSTE ZOSTAVAX Injektiokuiva-aine ja liuotin, suspensiota varten esitäytetyssä ruiskussa vyöruusurokote (herpes zoster), elävä Lue tämä pakkausseloste huolellisesti, ennen kuin sinut rokotetaan
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cervarix injektioneste, suspensio Ihmisen papilloomavirusrokote (tyypit 16 ja 18) (Rekombinantti, liitetty adjuvanttiin, adsorboitu) Lue tämä seloste huolellisesti ennen
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cervarix injektioneste, suspensio Ihmisen papilloomavirusrokote (tyypit 16 ja 18) (Rekombinantti, liitetty adjuvanttiin, adsorboitu) Lue tämä seloste huolellisesti ennen
PAKKAUSSELOSTE ProMeris paikallisvaleluliuos kissoille
 PAKKAUSSELOSTE ProMeris paikallisvaleluliuos kissoille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
PAKKAUSSELOSTE ProMeris paikallisvaleluliuos kissoille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
PAKKAUSSELOSTE. Tracleer 125 mg kalvopäällysteinen tabletti Bosentaani
 PAKKAUSSELOSTE Tracleer 125 mg kalvopäällysteinen tabletti Bosentaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Tracleer 125 mg kalvopäällysteinen tabletti Bosentaani Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE. Valdoxan 25 mg tabletti, kalvopäällysteinen Agomelatiini
 PAKKAUSSELOSTE Valdoxan 25 mg tabletti, kalvopäällysteinen Agomelatiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Valdoxan 25 mg tabletti, kalvopäällysteinen Agomelatiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
Evran luonnollinen koko
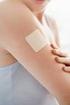 mielenrauhaa Evran luonnollinen koko Evra uudenlainen ehkäisyvalmiste Esitteestä lukemasi tiedon tarkoitus oli vastata yleisimmin kysyttyihin käytännön kysymyksiin Evrasta. Jos haluat lisää tietoa, käänny
mielenrauhaa Evran luonnollinen koko Evra uudenlainen ehkäisyvalmiste Esitteestä lukemasi tiedon tarkoitus oli vastata yleisimmin kysyttyihin käytännön kysymyksiin Evrasta. Jos haluat lisää tietoa, käänny
PAKKAUSSELOSTE. Protopic 0,1% voide Takrolimuusimonohydraatti
 PAKKAUSSELOSTE Protopic 0,1% voide Takrolimuusimonohydraatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Protopic 0,1% voide Takrolimuusimonohydraatti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Sildenafil Actavis 50 mg kalvopäällysteiset tabletit Sildenafiili
 PAKKAUSSELOSTE Sildenafil Actavis 50 mg kalvopäällysteiset tabletit Sildenafiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Sildenafil Actavis 50 mg kalvopäällysteiset tabletit Sildenafiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
LIITE I LUETTELO LÄÄKEVALMISTEEN NIMISTÄ, LÄÄKEMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVAN HALTIJOISTA JÄSENVALTIOISSA
 LIITE I LUETTELO LÄÄKEVALMISTEEN NIMISTÄ, LÄÄKEMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVAN HALTIJOISTA JÄSENVALTIOISSA 1 Jäsenvaltio Myyntiluvan haltija Kauppanimi Vahvuus Lääkemuoto Antoreitti
LIITE I LUETTELO LÄÄKEVALMISTEEN NIMISTÄ, LÄÄKEMUODOISTA, VAHVUUKSISTA, ANTOREITEISTÄ, MYYNTILUVAN HALTIJOISTA JÄSENVALTIOISSA 1 Jäsenvaltio Myyntiluvan haltija Kauppanimi Vahvuus Lääkemuoto Antoreitti
Pakkausseloste: Tietoa potilaalle
 Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
Pakkausseloste: Tietoa potilaalle Otezla tabletti, kalvopäällysteinen Otezla 20 mg tabletti, kalvopäällysteinen Otezla 30 mg tabletti, kalvopäällysteinen apremilasti Tähän lääkkeeseen kohdistuu lisäseuranta.
PAKKAUSSELOSTE. Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo
 PAKKAUSSELOSTE Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Ibandronic acid Sandoz 50 mg kalvopäällysteiset tabletit ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE. Rivastigmine Actavis 3 mg kovat kapselit Rivastigmiini
 PAKKAUSSELOSTE Rivastigmine Actavis 3 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Rivastigmine Actavis 3 mg kovat kapselit Rivastigmiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta
 PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Fertavid 600 IU/0,72 ml injektioneste, liuos follitropiini beeta Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE. korifollitropiini alfa
 PAKKAUSSELOSTE Elonva 150 mikrogrammaa injektioneste, liuos korifollitropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Elonva 150 mikrogrammaa injektioneste, liuos korifollitropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
NuvaRing. N.V. Organon. 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
NuvaRing N.V. Organon 20.1.2014, versio 6.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Etonogestreelia ja etinyyliestradiolia
Liite III. Valmisteyhteenvetojen ja pakkausselosteiden muutokset
 Liite III Valmisteyhteenvetojen ja pakkausselosteiden muutokset 39 VALMISTEYHTEENVETO 40 Kohta 4.1 Käyttöaiheet [Tällä hetkellä hyväksytyt käyttöaiheet poistetaan ja korvataan seuraavasti:] Keskivaikean
Liite III Valmisteyhteenvetojen ja pakkausselosteiden muutokset 39 VALMISTEYHTEENVETO 40 Kohta 4.1 Käyttöaiheet [Tällä hetkellä hyväksytyt käyttöaiheet poistetaan ja korvataan seuraavasti:] Keskivaikean
PAKKAUSSELOSTE. VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa
 PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE VPRIV 200 yksikköä infuusiokuiva-aine, liuosta varten VPRIV 400 yksikköä infuusiokuiva-aine, liuosta varten velagluseraasi alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat
PAKKAUSSELOSTE. Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen.
 PAKKAUSSELOSTE Mimpara 30 mg kalvopäällysteiset tabletit Mimpara 60 mg kalvopäällysteiset tabletit Mimpara 90 mg kalvopäällysteiset tabletit Sinakalseetti Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Mimpara 30 mg kalvopäällysteiset tabletit Mimpara 60 mg kalvopäällysteiset tabletit Mimpara 90 mg kalvopäällysteiset tabletit Sinakalseetti Lue tämä pakkausseloste huolellisesti, ennen kuin
PAKKAUSSELOSTE Dicural 15 mg päällystetyt tabletit koiralle Dicural 50 mg päällystetyt tabletit koiralle
 PAKKAUSSELOSTE Dicural 15 päällystetyt tabletit koiralle Dicural 50 päällystetyt tabletit koiralle Dicural 100 päällystetyt tabletit koiralle Dicural 150 päällystetyt tabletit koiralle 1. MYYNTILUVAN HALTIJAN
PAKKAUSSELOSTE Dicural 15 päällystetyt tabletit koiralle Dicural 50 päällystetyt tabletit koiralle Dicural 100 päällystetyt tabletit koiralle Dicural 150 päällystetyt tabletit koiralle 1. MYYNTILUVAN HALTIJAN
PAKKAUSSELOSTE. ABILIFY 7,5 mg/ml injektioneste, liuos aripipratsoli
 PAKKAUSSELOSTE ABILIFY 7,5 mg/ml injektioneste, liuos aripipratsoli Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE ABILIFY 7,5 mg/ml injektioneste, liuos aripipratsoli Lue tämä seloste huolellisesti ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE. Possia 90 mg kalvopäällysteinen tabletti tikagrelori
 PAKKAUSSELOSTE Possia 90 mg kalvopäällysteinen tabletti tikagrelori Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Possia 90 mg kalvopäällysteinen tabletti tikagrelori Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Neulasta 6 mg injektioneste, liuos esitäytetyssä ruiskussa pegfilgrastiimi
 PAKKAUSSELOSTE Neulasta 6 mg injektioneste, liuos esitäytetyssä ruiskussa pegfilgrastiimi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE Neulasta 6 mg injektioneste, liuos esitäytetyssä ruiskussa pegfilgrastiimi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE. Efficib 50 mg/1000 mg kalvopäällysteiset tabletit (sitagliptiini/metformiinihydrokloridi)
 PAKKAUSSELOSTE Efficib 50 mg/1000 mg kalvopäällysteiset tabletit (sitagliptiini/metformiinihydrokloridi) Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE Efficib 50 mg/1000 mg kalvopäällysteiset tabletit (sitagliptiini/metformiinihydrokloridi) Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE:TIETOA KÄYTTÄJÄLLE. Rotarix, oraalisuspensio Rotavirusrokote, elävä
 PAKKAUSSELOSTE:TIETOA KÄYTTÄJÄLLE Rotarix, oraalisuspensio Rotavirusrokote, elävä Lue tämä seloste huolellisesti, ennen kuin lapsesi saa tätä rokotetta. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE:TIETOA KÄYTTÄJÄLLE Rotarix, oraalisuspensio Rotavirusrokote, elävä Lue tämä seloste huolellisesti, ennen kuin lapsesi saa tätä rokotetta. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Pantoprazole Teva 40 mg enterotabletit. pantopratsoli
 PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE 40 mg enterotabletit pantopratsoli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. XEPLION 75 mg injektioneste, depotsuspensio. paliperidoni
 PAKKAUSSELOSTE XEPLION 75 mg injektioneste, depotsuspensio paliperidoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE XEPLION 75 mg injektioneste, depotsuspensio paliperidoni Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä
Pakkausseloste: Tietoa potilaalle. Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri
 Pakkausseloste: Tietoa potilaalle Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
Pakkausseloste: Tietoa potilaalle Baraclude 1 mg tabletti, kalvopäällysteinen entekaviiri Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä
PAKKAUSSELOSTE Ovitrelle 250 mikrogrammaa/0,5 ml injektioneste, liuos, esitäytetyssä ruiskussa. Koriongonadotropiini alfa
 PAKKAUSSELOSTE Ovitrelle 250 mikrogrammaa/0,5 ml injektioneste, liuos, esitäytetyssä ruiskussa. Koriongonadotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE Ovitrelle 250 mikrogrammaa/0,5 ml injektioneste, liuos, esitäytetyssä ruiskussa. Koriongonadotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE. Neupro 6 mg/24 h depotlaastari Rotigotiini
 PAKKAUSSELOSTE Neupro 6 mg/24 h depotlaastari Rotigotiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Neupro 6 mg/24 h depotlaastari Rotigotiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE : TIETOA KÄYTTÄJÄLLE
 PAKKAUSSELOSTE : TIETOA KÄYTTÄJÄLLE Prepandrix suspensio ja emulsio injektionestettä varten, emulsio Prepandemiainfluenssarokote (H5N1) (virusfragmentit, inaktivoitu, adjuvanttia sisältävä rokote) Lue
PAKKAUSSELOSTE : TIETOA KÄYTTÄJÄLLE Prepandrix suspensio ja emulsio injektionestettä varten, emulsio Prepandemiainfluenssarokote (H5N1) (virusfragmentit, inaktivoitu, adjuvanttia sisältävä rokote) Lue
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Akne Aikuisiän aknea esiintyy 25 prosentilla aikuisista miehistä ja 50 prosentilla
PAKKAUSSELOSTE. Cayston 75 mg jauhe ja liuotin sumutinliuosta varten Atstreonaami
 PAKKAUSSELOSTE Cayston 75 mg jauhe ja liuotin sumutinliuosta varten Atstreonaami Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Cayston 75 mg jauhe ja liuotin sumutinliuosta varten Atstreonaami Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE. Lamivudine Teva Pharma B.V. 150 mg kalvopäällysteiset tabletit lamivudiini
 PAKKAUSSELOSTE Lamivudine Teva Pharma B.V. 150 mg kalvopäällysteiset tabletit lamivudiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE Lamivudine Teva Pharma B.V. 150 mg kalvopäällysteiset tabletit lamivudiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE. Tredaptive 1000 mg/20 mg depottabletit nikotiinihappo/laropiprantti
 PAKKAUSSELOSTE Tredaptive 1000 mg/20 mg depottabletit nikotiinihappo/laropiprantti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Tredaptive 1000 mg/20 mg depottabletit nikotiinihappo/laropiprantti Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
LIITE 1. B. PAKKAUSSELOSTE
 LIITE 1. B. PAKKAUSSELOSTE 4 PAKKAUSSELOSTE Lue tämä seloste huolellisesti ennen lääkevalmisteen käyttöä - Tämä seloste sisältää hyödyllistä tietoa Tractocile-valmisteesta. - Säilytä seloste. Voit tarvita
LIITE 1. B. PAKKAUSSELOSTE 4 PAKKAUSSELOSTE Lue tämä seloste huolellisesti ennen lääkevalmisteen käyttöä - Tämä seloste sisältää hyödyllistä tietoa Tractocile-valmisteesta. - Säilytä seloste. Voit tarvita
LIITE II MAAHANTUONNISTA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA SEKÄ TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET
 LIITE II MAAHANTUONNISTA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA SEKÄ TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET 1 A. VALMISTUSLUVAN HALTIJA Maahantuonnista ja erän vapauttamisesta
LIITE II MAAHANTUONNISTA JA ERÄN VAPAUTTAMISESTA VASTAAVA VALMISTUSLUVAN HALTIJA SEKÄ TOIMITTAMISTA JA KÄYTTÖÄ KOSKEVAT EHDOT TAI RAJOITUKSET 1 A. VALMISTUSLUVAN HALTIJA Maahantuonnista ja erän vapauttamisesta
PAKKAUSSELOSTE 1. MITÄ ADVATE ON JA MIHIN SITÄ KÄYTETÄÄN
 PAKKAUSSELOSTE ADVATE 1500 IU -injektiokuiva-aine ja liuotin, liuosta varten Octocog alfa (ihmisen yhdistelmä-dna-tekniikalla valmistettu hyytymistekijä VIII) Lue tämä pakkausseloste huolellisesti, ennen
PAKKAUSSELOSTE ADVATE 1500 IU -injektiokuiva-aine ja liuotin, liuosta varten Octocog alfa (ihmisen yhdistelmä-dna-tekniikalla valmistettu hyytymistekijä VIII) Lue tämä pakkausseloste huolellisesti, ennen
PAKKAUSSELOSTE. INVANZ 1 g infuusiokuiva-aine konsentraattiliuosta varten (ertapeneemi)
 PAKKAUSSELOSTE INVANZ 1 g infuusiokuiva-aine konsentraattiliuosta varten (ertapeneemi) Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE INVANZ 1 g infuusiokuiva-aine konsentraattiliuosta varten (ertapeneemi) Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE. Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Baraclude 1 mg kalvopäällysteiset tabletit Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
Pakkausseloste: Tietoa käyttäjälle. Clopidogrel Mylan 75 mg kalvopäällysteiset tabletit. klopidogreeli
 B. PAKKAUSSELOSTE 1 Pakkausseloste: Tietoa käyttäjälle Clopidogrel Mylan 75 mg kalvopäällysteiset tabletit klopidogreeli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen,
B. PAKKAUSSELOSTE 1 Pakkausseloste: Tietoa käyttäjälle Clopidogrel Mylan 75 mg kalvopäällysteiset tabletit klopidogreeli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen,
PAKKAUSSELOSTE. CellCept 500 mg infuusiokuiva-aine konsentraattiliuosta varten mykofenolaattimofetiili
 PAKKAUSSELOSTE CellCept 500 mg infuusiokuiva-aine konsentraattiliuosta varten mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE CellCept 500 mg infuusiokuiva-aine konsentraattiliuosta varten mykofenolaattimofetiili Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE CEPROTIN 500 IU injektiokuiva-aine ja liuotin, liuosta varten Humaani proteiini C
 PAKKAUSSELOSTE CEPROTIN 500 IU injektiokuiva-aine ja liuotin, liuosta varten Humaani proteiini C Lue tämä seloste huolellisesti, ennen kuin aloitat CEPROTININ käyttämisen. - Säilytä tämä seloste. Voit
PAKKAUSSELOSTE CEPROTIN 500 IU injektiokuiva-aine ja liuotin, liuosta varten Humaani proteiini C Lue tämä seloste huolellisesti, ennen kuin aloitat CEPROTININ käyttämisen. - Säilytä tämä seloste. Voit
Lääkevalmisteella ei enää myyntilupaa
 PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE Nespo 10 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 15 mikrogrammaa, injektioneste, liuos esitäytetyssä ruiskussa Nespo 20 mikrogrammaa, injektioneste, liuos esitäytetyssä
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE. Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi
 PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste.
PAKKAUSSELOSTE: TIETOA KÄYTTÄJÄLLE Cerezyme 200 U infuusiokuiva-ainekonsentraatti, liuosta varten Imigluseraasi Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste.
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS
 EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
EFFENTORA - LÄÄKE SYÖVÄN LÄPILYÖNTIKIVUN HOITOON POTILAAN JA OMAISEN OPAS bukkaalinen fentanyylitabletti Sinulle on määrätty Effentora -lääkettä syövän läpilyöntikipukohtausten hoitoon. Tämän esitteen
PAKKAUSSELOSTE 1. MITÄ INVEGA ON JA MIHIN SITÄ KÄYTETÄÄN
 PAKKAUSSELOSTE INVEGA 1,5 mg depottabletit INVEGA 3 mg depottabletit INVEGA 6 mg depottabletit INVEGA 9 mg depottabletit INVEGA 12 mg depottabletit Paliperidoni Lue tämä pakkausseloste huolellisesti, ennen
PAKKAUSSELOSTE INVEGA 1,5 mg depottabletit INVEGA 3 mg depottabletit INVEGA 6 mg depottabletit INVEGA 9 mg depottabletit INVEGA 12 mg depottabletit Paliperidoni Lue tämä pakkausseloste huolellisesti, ennen
CYPRETYL RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CYPRETYL Päivämäärä: 29.6.2015, Versio: 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akne on yleinen ihovaiva, jonka tunnusmerkkejä
CYPRETYL Päivämäärä: 29.6.2015, Versio: 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akne on yleinen ihovaiva, jonka tunnusmerkkejä
B. PAKKAUSSELOSTE 45
 B. PAKKAUSSELOSTE 45 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla on lisäkysymyksiä, käänny lääkärisi
B. PAKKAUSSELOSTE 45 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla on lisäkysymyksiä, käänny lääkärisi
PAKKAUSSELOSTE. NeuroBloc 5000 U/ml injektioneste, liuosta varten. Vaikuttava aine on B-tyypin botulinumtoksiini.
 B. PAKKAUSSELOSTE 1 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla on lisäkysymyksiä, käänny
B. PAKKAUSSELOSTE 1 PAKKAUSSELOSTE Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä myöhemmin. - Jos Sinulla on lisäkysymyksiä, käänny
PAKKAUSSELOSTE. PREZISTA 400 mg kalvopäällysteiset tabletit darunaviiri
 PAKKAUSSELOSTE PREZISTA 400 mg kalvopäällysteiset tabletit darunaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE PREZISTA 400 mg kalvopäällysteiset tabletit darunaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE. Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos
PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos
PAKKAUSSELOSTE. Ebixa 20 mg tabletit, kalvopäällysteiset Memantiinihydrokloridi
 PAKKAUSSELOSTE Ebixa 20 mg tabletit, kalvopäällysteiset Memantiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE Ebixa 20 mg tabletit, kalvopäällysteiset Memantiinihydrokloridi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen - Säilytä tämä pakkausseloste. Voit tarvita sitä
PAKKAUSSELOSTE. Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri
 PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE Baraclude 1 mg tabletti, kalvopäällysteinen Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla
PAKKAUSSELOSTE. Visudyne 15 mg infuusiokuiva-aine, liuosta varten Verteporfiini
 PAKKAUSSELOSTE Visudyne 15 mg infuusiokuiva-aine, liuosta varten Verteporfiini Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Visudyne 15 mg infuusiokuiva-aine, liuosta varten Verteporfiini Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan tätä lääkettä. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE. Tolura 40 mg tabletit. telmisartaani
 PAKKAUSSELOSTE Tolura 40 mg tabletit telmisartaani Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE Tolura 40 mg tabletit telmisartaani Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos sinulla
PAKKAUSSELOSTE. Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo
 PAKKAUSSELOSTE Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Ibandronic Acid Teva 150 mg tabletti, kalvopäällysteinen ibandronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE. Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo
 PAKKAUSSELOSTE Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan Zometaa. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
PAKKAUSSELOSTE Zometa 4 mg/100 ml infuusioneste, liuos Tsoledronihappo Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle annetaan Zometaa. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
ESIMERKKIPAKKAUS AIVASTUX. Erä 1058350. MTnr 0000 Myyntiluvan haltija: Lääketehdas Oy, Lääkekylä, Suomi. Vnr 39 71 65. Vnr 39 71 65. tit q.s.
 ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
ESIMERKKIPAKKAUS AIVASTUX 12 2015 1058350 Käyt. viim.: 12 2015 Erä 1058350 Aivastux 10 mg 10 tabl. Vnr 04 36 79 Ibuprofen 400 mg Glycerol (85%) Sacchar Constit q.s. Käyttötarkoitus: Allergisen nuhan, allergisten
PAKKAUSSELOSTE. Avastin 25 mg/ml infuusiokonsentraatti, liuosta varten Bevasitsumabi
 PAKKAUSSELOSTE Avastin 25 mg/ml infuusiokonsentraatti, liuosta varten Bevasitsumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Avastin 25 mg/ml infuusiokonsentraatti, liuosta varten Bevasitsumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE DuoPlavin 75 mg/100 mg kalvopäällysteiset tabletit klopidogreeli/asetyylisalisyylihappo
 PAKKAUSSELOSTE DuoPlavin 75 mg/100 mg kalvopäällysteiset tabletit klopidogreeli/asetyylisalisyylihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE DuoPlavin 75 mg/100 mg kalvopäällysteiset tabletit klopidogreeli/asetyylisalisyylihappo Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste.
PAKKAUSSELOSTE. Circadin 2 mg depottabletti Melatoniini
 PAKKAUSSELOSTE Circadin 2 mg depottabletti Melatoniini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE Circadin 2 mg depottabletti Melatoniini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin. - Jos
PAKKAUSSELOSTE. Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa
 PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE Thyrogen 0,9 mg injektiokuiva-aine, liuosta varten. Tyreotropiini alfa Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
esimerkkipakkaus aivastux
 esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
esimerkkipakkaus aivastux Pakkausseloste: Tietoa käyttäjälle Aivastux 10 mg tabletit setiritsiini Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle
PAKKAUSSELOSTE. Sycrest 5 mg resoribletti Sycrest 10 mg resoribletti asenapiini
 PAKKAUSSELOSTE Sycrest 5 mg resoribletti Sycrest 10 mg resoribletti asenapiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE Sycrest 5 mg resoribletti Sycrest 10 mg resoribletti asenapiini Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. - Säilytä tämä pakkausseloste. Voit tarvita
Potilasesite. Jinarc (tolvaptaani)
 Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
Jinarc (tolvaptaani) Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista.
PAKKAUSSELOSTE. Recuvyra 50 mg/ml transdermaalinen liuos koirille
 PAKKAUSSELOSTE Recuvyra 50 mg/ml transdermaalinen liuos koirille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
PAKKAUSSELOSTE Recuvyra 50 mg/ml transdermaalinen liuos koirille 1. MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI Myyntiluvan
Nexplanon. 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
Nexplanon 30.3.2016, versio 5.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Implanon ja Implanon NXT/Nexplanon ovat pitkävaikutteisia
PAKKAUSSELOSTE. Baraclude 0,05 mg/ml oraaliliuos Entekaviiri
 PAKKAUSSELOSTE Baraclude 0,05 mg/ml oraaliliuos Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla on lisäkysymyksiä,
PAKKAUSSELOSTE Baraclude 0,05 mg/ml oraaliliuos Entekaviiri Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen ottamisen. Säilytä tämä seloste. Voit tarvita sitä myöhemmin. Jos sinulla on lisäkysymyksiä,
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti
 Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
Pakkausseloste: Tietoa potilaalle ORENCIA 125 mg injektioneste, liuos esitäytetyssä ruiskussa abatasepti Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää
PAKKAUSSELOSTE. Risedronat Teva 35 mg kalvopäällysteiset tabletit. risedronaattinatrium
 PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE Risedronat Teva 35 mg kalvopäällysteiset tabletit risedronaattinatrium Lue tämä seloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä seloste. Voit tarvita sitä
PAKKAUSSELOSTE. MabThera 100 mg infuusiokonsentraatti, liuosta varten rituksimabi
 PAKKAUSSELOSTE MabThera 100 mg infuusiokonsentraatti, liuosta varten rituksimabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE MabThera 100 mg infuusiokonsentraatti, liuosta varten rituksimabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit tarvita
PAKKAUSSELOSTE. RoActemra, 20 mg/ml, infuusiokonsentraatti, liuosta varten Tosilitsumabi
 PAKKAUSSELOSTE RoActemra, 20 mg/ml, infuusiokonsentraatti, liuosta varten Tosilitsumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE RoActemra, 20 mg/ml, infuusiokonsentraatti, liuosta varten Tosilitsumabi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. Säilytä tämä pakkausseloste. Voit
KÄYTTÄJÄN OPAS. Yksityiskohtainen käyttöoppaasi. BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten
 KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
KÄYTTÄJÄN OPAS Yksityiskohtainen käyttöoppaasi BYDUREON 2 mg injektiokuiva-aine ja liuotin depotsuspensiota varten Jos sinulla on kysymyksiä BYDUREON-valmisteen käytöstä Katso Tavallisia kysymyksiä ja
PAKKAUSSELOSTE. FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi
 PAKKAUSSELOSTE FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE FORSTEO 20 mikrogrammaa/80 mikrolitrassa, injektioneste, liuos esitäytetyssä injektiokynässä Teriparatidi Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen.
PAKKAUSSELOSTE TAXOTERE 20 mg/1 ml infuusiokonsentraatti, liuosta varten dosetakseli
 PAKKAUSSELOSTE TAXOTERE 20 mg/1 ml infuusiokonsentraatti, liuosta varten dosetakseli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
PAKKAUSSELOSTE TAXOTERE 20 mg/1 ml infuusiokonsentraatti, liuosta varten dosetakseli Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen. - Säilytä tämä pakkausseloste. Voit
