Adempas (riosiguaatti) Riskienhallintasuunnitelman yhteenveto
|
|
|
- Lotta Koskinen
- 8 vuotta sitten
- Katselukertoja:
Transkriptio
1 EMA/76215/2014 Adempas (riosiguaatti) Riskienhallintasuunnitelman yhteenveto Tietoa sairauden esiintyvyydestä Keuhkoverenpainetauti on sairaus, jonka yhteydessä verenpaine on korkea keuhkoissa. Kyseessä on pitkäaikainen toimintakykyä heikentävä sairaus. Keuhkoverenpainetautia sairastavilla ilmenee usein oireita, kuten hengenahdistusta, huimausta, väsymystä ja pyörtyilyä. Oireet yleensä hankaloituvat sairauden edetessä. Joissakin tilanteissa potilas joutuu vuodelepoon. Pitkittynyt korkea verenpaine keuhkoissa johtaa usein keuhkoverenpainetautia sairastavilla sydämen vajaatoimintaan ja kuolemaan. Kroonista tromboembolista keuhkoverenpainetautia (KTEPH) ilmenee pääasiassa aikuisilla. Se on harvinainen keuhkoverenpainetaudin muoto (3,2 tapausta miljoonaa aikuista kohti viimeisimpien arvioiden mukaan). KTEPH johtuu yleensä keuhkoissa olevista verihyytymistä. Kun keuhkoissa on verihyytymä, verenohennuslääkkeet palauttavat useimmissa tapauksissa normaalin verenvirtauksen keuhkoihin ja estävät tämän keuhkoverenpainetautimuodon kehittymisen. Verenohennuslääkkeet eivät kuitenkaan aina toimi riittävän hyvin, vaan pienelle osalle potilaista saattaa kehittyä KTEPH. Paras ja mahdollisesti myös parantava hoito niille potilaille, joille leikkaus soveltuu, on erittäin pitkälle erikoistunut kirurginen toimenpide eli keuhkovaltimoiden endarterektomia. Tämä leikkaushoito ei kuitenkaan sovi kaikille potilaille, ja osalla saattaa yhä olla KTEPH leikkauksen jälkeen. Keuhkovaltimoiden verenpainetauti (PAH) on toinen harvinainen keuhkoverenpainetaudin muoto (15 52 tapausta miljoonaa ihmistä kohti eurooppalaisten tutkimusten mukaan), joka johtaa sekä aikuisilla että lapsilla kuolemaan. Keuhkovaltimoiden verenpainetaudille ovat ominaisia rakenteelliset muutokset keuhkovaltimoissa (ns. verisuonten uudelleenmuotoutuminen). Valtimoiden seinämät paksuuntuvat, ja verisuonien sisäpuolinen tila pienenee. Tämä heikentää veren virtausta ja nostaa verenpainetta keuhkoissa. Tällä hetkellä keuhkovaltimoiden verenpainetaudin hoidossa käytetään kolmeen eri luokkaan kuuluvia lääkkeitä, jotka rentouttavat verisuonia: endoteliinireseptorin antagonistit (ERA), fosfodiesteraasin tyypin 5 (PDE-5) estäjät ja prostasykliinianalogit. Hoidosta huolimatta useimpien PAHpotilaiden sairaus etenee, eikä parannuskeinoa ole vielä löydetty. Yhteenveto hoidon hyödyistä KTEPH KTEPH-tautia sairastaville tehty tärkein kliininen Adempas-tutkimus on nimeltään CHEST-1. Tutkimus kesti 16 viikkoa, ja siihen osallistui 262 potilasta, joilla oli KTEPH (ja joille leikkaushoito ei soveltunut tai joilla sairaus jatkui tai uusiutui leikkaushoidon jälkeen). Potilaat jaettiin kahteen ryhmään toinen ryhmä sai Adempas-valmistetta (1,0 2,5 mg kolmesti päivässä) ja toinen ryhmä sai lumevalmistetta (valmistetta, joka ei sisällä vaikuttavaa lääkeainetta). Adempas paransi fyysistä suorituskykyä (matkaa, jonka potilas pystyi kävelemään kuudessa minuutissa) enemmän kuin lumevalmiste: 16 hoitoviikon jälkeen Adempas-hoitoa saaneet potilaat pystyivät Sivu 1/3
2 kävelemään kuudessa minuutissa pidemmän matkan (keskimäärin 39 metriä) kuin tutkimuksen alussa, kun taas lumevalmistetta saaneiden potilaiden kuuden minuutin kävelymatka oli (keskimäärin) 6 metriä lyhyempi kuin tutkimuksen alussa. PAH PAH-tautia sairastaville tehty tärkein kliininen Adempas-tutkimus on nimeltään PATENT-1. Tutkimus kesti 12 viikkoa, ja siihen osallistui 445 potilasta, joilla oli PAH. Potilaat jaettiin kolmeen ryhmään. Yhdessä ryhmässä potilaat saivat yksilöllisesti määritellyn annoksen Adempas-valmistetta (1,0 2,5 mg) kolmesti päivässä. Toisessa pienemmässä ryhmässä (63 henkilöä) potilaat saivat pienemmäksi sovitetun annoksen Adempas-valmistetta (1,0 1,5 mg) kolmesti päivässä. Kolmannessa ryhmässä potilaat saivat lumevalmistetta. Adempas-valmistetta ja lumevalmistetta käytettiin yhdessä muiden PAH-hoitojen (endoteliinireseptorin antagonistien tai prostasykliinien) kanssa tarpeen mukaan. Adempas joko yksin tai yhdessä endoteliinireseptorin antagonistin tai prostasykliinianalogin kanssa paransi fyysistä suorituskykyä enemmän kuin lumevalmiste: 12 viikon jälkeen Adempas-hoitoa saaneet potilaat pystyivät kävelemään kuudessa minuutissa pidemmän matkan (keskimäärin 30 metriä) kuin tutkimuksen alussa, kun taas lumevalmistetta saaneiden potilaiden kuuden minuutin kävelymatka oli (keskimäärin) 6 metriä lyhyempi kuin tutkimuksen alussa. Hoidon hyötyihin liittyvät asiat, joita ei tunneta KTEPH Tutkimuksiin osallistuneista potilaista suurin osa oli valkoihoisia ja/tai alle 65-vuotiaita. Mitään näyttöä ei ole saatu siitä, että tulokset olisivat erilaiset muilla kuin valkoihoisilla tai tätä vanhemmilla potilailla. Adempas-annosta täytyy ehkä muuttaa, jos potilas tupakoi tai aloittaa/lopettaa tupakoinnin hoidon aikana. PAH Tutkimuksiin osallistuneista potilaista suurin osa oli valkoihoisia ja/tai alle 65-vuotiaita. Mitään näyttöä ei ole saatu siitä, että tulokset olisivat erilaiset muilla kuin valkoihoisilla tai tätä vanhemmilla potilailla. Adempas-annosta täytyy ehkä muuttaa, jos potilas tupakoi tai aloittaa/lopettaa tupakoinnin hoidon aikana. Yhteenveto turvallisuustiedoista Tärkeät tunnistetut riskit Riski Mitä tiedetään Ehkäistävyys Hypotensio (matala verenpaine) Lumekontrolloiduissa kliinisissä tutkimuksissa kehittyi hypotensio (matala verenpaine) noin 10 %:lle potilaista, joilla oli KTEPH tai PAH ja jotka saivat Adempas-valmistetta; vakavat/vaikeat tapaukset olivat harvinaisia (0,2 0,4 % potilaista). Hypotension riski saattaa olla tavallista suurempi iäkkäillä potilailla ( 65-vuotiailla) ja potilailla, joilla munuaisten toiminta on heikentynyt. Adempas-hoidon ensimmäisten viikkojen aikana mitataan verenpaine, jotta voidaan määrittää sopiva Adempas-annos. Suurin osa hypotensiotapauksista ilmeni Adempas-annoksen ensimmäisen muutoksen yhteydessä CHEST-1- ja PATENT- 1-tutkimuksissa; kun potilaalle sopiva annos oli määritelty, tapauksia ilmeni vähemmän Sivu 2/3
3 Riski Mitä tiedetään Ehkäistävyys tutkimuksen loppuaikana. Ruoansulatuskanavan yläosassa ilmenevät liikkuvuushäiriöt Keuhkolaskimoita ahtauttavan taudin (PVOD) Adempas-valmisteen käyttö samaan aikaan korkean verenpaineen tai sydänsairauden hoitoon käytettävien nitraattien tai typpioksidin luovuttajien, kuten amyylinitriitin, kanssa saattaa johtaa verenpaineen alenemiseen ja pyörtyilyyn. Orgaanisia nitraattivalmisteita saavia potilaita ei otettu mukaan faasin 3 CHEST-1- ja PATENT-1-tutkimuksiin, joissa Adempas-valmistetta annettiin KTEPH-tautia ja PAH-tautia sairastaville. Adempas-valmisteen samanaikainen käyttö PDE-5-estäjien (esim. sildenafiili, tadalafiili tai vardenafiili) kanssa saattaa voimistaa verenpainetta alentavaa vaikutusta ja lisätä näin hypotension riskiä. PDE-5- estäjiä käyttäviä potilaita ei otettu mukaan faasin 3 Adempastutkimuksiin, joissa valmistetta annettiin KTEPH-tautia ja PAH-tautia sairastaville. Adempas-valmisteen samanaikainen käyttö voimakkaiden, useita reittejä käyttävien sytokromi P450:n (CYP) ja P-glykoproteiinin (P-gp) / rintasyövän resistenssiproteiinin (BCRP) estäjien (kuten ketokonatsolin [sienilääke] ja ritonaviirin [HIV-lääke]) kanssa lisää riosiguaatin määrää verenkierrossa. Adempas-valmisteen samanaikainen käyttö voimakkaan CYP1A1:n estäjän (kuten erlotinibin [syöpälääke]) tai voimakkaan P-gp/BCRP-estäjän (kuten siklosporiini A:n [käytetään ehkäisemään hylkimisreaktioita elinsiirron yhteydessä]) kanssa saattaa lisätä riosiguaatin määrää verenkierrossa. Kliinisissä tutkimuksissa ruoansulatuskanavan yläosassa ilmenevät liikkuuvuushäiriöt, kuten ruoansulatushäiriöt (närästys), gastroesofageaalinen refluksitauti (mahalaukun hapon virtaaminen ylöspäin ruokatorveen), dysfagia (nielemisvaikeudet) ja gastriitti (mahatulehdus), olivat yleisiä Adempas-hoitoa saavilla potilailla. Useimmat näistä oireista olivat lieviä tai kohtalaisia. Keuhkoverenpainetaudin erityinen muoto (PVOD), jota ei ole aiemmin Adempas-valmistetta ei saa käyttää samaan aikaan nitraattien tai typpioksidin luovuttajien kanssa niiden missään muodossa. Adempas-valmistetta ei saa käyttää samaan aikaan PDE-5- estäjien kanssa. Adempas-valmisteen samanaikaista käyttöä voimakkaiden, useita reittejä käyttävien CYP- ja P-gp/BCRPestäjien kanssa ei suositella. Näitä lääkevalmisteita on käytettävä varoen. Verenpainetta on tarkkailtava ja Adempasannoksen pienentämistä harkittava. Adempas-hoidon aikana ruoansulatuskanavan yläosassa ilmenevien liikkuvuuteen liittyvien häiriöiden lievittämiseen voi käyttää antasidia tai protonipumpun estäjää nämä lääkkeet on jo hyväksytty refluksitaudin hoitoon. Lääkärien tulisi kiinnittää huomiota keuhkopöhön mahdollisiin Sivu 3/3
4 Riski Mitä tiedetään Ehkäistävyys paheneminen Vakavat veriyskökset/keuhkoverenvu oto (veren yskiminen / verenvuoto keuhkoista) diagnosoitu, saattaa pahentua Adempas-hoidon vuoksi. Tämä sairaus saattaa aiheuttaa nesteen kertymistä keuhkoihin (keuhkopöhö), joka johtaa hengenahdistukseen, jopa viikkoja tai kuukausia Adempashoidon aloittamisen jälkeen. Tällaisissa tilanteissa Adempas-hoito on keskeytettävä välittömästi. Verenvuotoa keuhkoista saattaa ilmetä perussairauden vuoksi potilailla, joilla on KTEPH tai PAH. Vakavaa keuhkoverenvuotoa joka johti muutamassa tapauksessa kuolemaan todettiin harvoin potilailla, joilla oli KTEPH tai PAH ja jotka saivat Adempas-hoitoa kliinisissä tutkimuksissa. Riski saattaa olla tavallista suurempi, jos potilaalla on ollut äskettäin vakavaa verenvuotoa keuhkoista tai hän on saanut hoitoa keuhkovaltimoiden verenvuodon lopettamiseksi (keuhkovaltimoiden embolisaatiohoito). PAH-tautia tai KTEPH-tautia tarkastelleissa kliinisissä tutkimuksissa useimmat potilaat käyttivät verenohennuslääkettä. Verenohennuslääkitystä suositellaan osana PAH-taudin ja KTEPH-taudin hoitoa. Verenohennuslääkkeitä koskevat yleiset hoitosuositukset (mukaan lukien paras mahdollinen annostus) koskevat myös potilaita, jotka saavat Adempas-hoitoa. merkkeihin ja lopettaa Adempashoito, jos potilaalla ilmenee keuhkopöhö pian hoidon aloittamisen jälkeen. Lääkärien tulisi olla tietoisia vakavien veriyskösten / keuhkoverenvuodon riskistä. Adempas-valmisteen käyttöä tulisi välttää, jos potilaalla on ollut äskettäin vakavaa verenvuotoa keuhkoista tai hänelle on tehty keuhkovaltimoiden embolisaatio. Verenohennuslääkkeitä käyttävien potilaiden huolellinen seuranta tavanomaisen hoitokäytännön mukaan on suositeltavaa. Keuhkoverenvuototapauksissa lääkettä määränneen lääkärin on säännöllisesti arvioitava hoidon jatkamisen edut ja riskit. Tärkeät mahdolliset riskit Riski Verenvuoto Mitä tiedetään Faasin 3 kliinisissä CHEST-1- ja PATENT-1-tutkimuksissa todettiin vakavaa verenvuotoa muualla kuin keuhkoissa harvinaisissa tapauksissa KTEPH-tautia tai PAH-tautia sairastavilla potilailla, jotka saivat Adempas-valmistetta. Näitä vakavia verenvuotoja ilmeni potilailla, jotka käyttivät samaan aikaan verenohennuslääkkeitä, ja ne liittyivät usein taustasairauksiin. Kaiken kaikkiaan niiden yleisyys vastasi verenvuotojen odotettua määrää verenohennuslääkitystä saavilla potilailla. Vastaavia verenvuotoja ei kuitenkaan todettu potilailla, jotka saivat lumevalmistetta. PAH-tautia tai KTEPH-tautia tarkastelleissa kliinisissä tutkimuksissa useimmat potilaat käyttivät verenohennuslääkettä. Verenohennuslääkitystä suositellaan osana PAH-taudin ja KTEPH-taudin hoitoa. Verenohennuslääkkeitä koskevat yleiset hoitosuositukset (mukaan lukien paras mahdollinen annostus) koskevat myös potilaita, jotka saavat Adempas-hoitoa. Sivu 4/3
5 Riski Sikiötoksisuus (syntymättömän lapsen mahdolliset epämuodostumat) Lääkitysvirhe Munuaisten vajaatoiminta Myyntiluvan ulkopuolinen käyttö (ns. off-label-käyttö) alle 18-vuotiaille potilaille Potilaat, joilla on ennestään eteisvärinä (epäsäännöllinen sydämen syke) Mitä tiedetään Adempas-valmisteelle altistetuilla rotilla todettiin sydämen epämuodostumia kehittyvässä sikiössä. Adempas-valmisteelle altistetuilla kaneilla todettiin keskenmenoja ja sikiötoksisuutta. Adempas-valmisteen käytöstä raskaana oleville naisille ei ole tietoja. Siksi Adempas-valmistetta ei saa käyttää raskauden aikana. Raskaustesti suositellaan tehtäväksi kuukausittain, ja naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä Adempas-hoidon aikana. Joitakin lääkitysvirheitä (esim. yliannostus, lääkkeen otto vahingossa) dokumentoitiin kliinisen Adempas-tutkimusohjelman aikana. Adempas on reseptilääke, ja hoidon saa aloittaa vain PAH-taudin tai KTEPH-taudin hoitoon perehtyneen lääkärin määräyksestä ja toteuttaa hänen valvonnassaan. Potilaita tulee neuvoa käyttämään Adempas-valmistetta aina tarkasti lääkärin ohjeiden mukaan ja tarkistamaan lääkäriltä tai apteekkihenkilökunnalta, jos he eivät ole jostain asiasta varmoja. Faasin 3 kliinisissä Adempas-tutkimuksissa KTEPH-tautia tai PAH-tautia sairastavilla (CHEST-1- ja PATENT-1-tutkimukset) raportoitiin munuaisten vajaatoimintaa useammin Adempas-ryhmässä kuin lumeryhmässä, kun taas kliinisissä laboratoriokokeissa näkyi merkkejä munuaisten toiminnan heikkenemisestä useammin lumeryhmässä kuin Adempas-ryhmässä. Yleisesti ottaen munuaisten heikentynyt toiminta liittyi hyvin usein taustasairauksiin, joihin kuului esimerkiksi jo aiemmin todettu munuaisten vajaatoiminta. Munuaisten toiminta voi myös heikentyä perussairauden etenemisen vuoksi (sydämen oikeanpuoleisen vajaatoiminnan paheneminen) PAH-tautia sairastavilla potilailla. Tutkimuksissa ei löydetty erityistä merkkiä, joka olisi osoittanut Adempasvalmisteen mahdollisesti negatiivisen vaikutuksen munuaisten toimintaan. Lääkärin on määriteltävä huolellisesti sopiva Adempas-annos munuaisten vajaatoiminnan yhteydessä. Adempas-valmisteen turvallisuutta ja tehoa lasten ja alle 18-vuotiaiden nuorten hoidossa ei ole vielä varmistettu. Kliinisiä tietoja ei ole saatavilla. Jyrsijöillä tehdyissä tutkimuksissa todettiin haittavaikutuksia kasvuikäisessä luustossa. Adempas-valmisteen käyttöä lasten ja kasvuikäisten nuorten hoidossa on vältettävä, kunnes näiden löydösten merkityksestä saadaan enemmän tietoa. Kliinisessä Adempas-tutkimusohjelmassa eteisvärinää ja eteislepatusta (epäsäännöllisen sykkeen muotoja) raportoitiin useammin Adempas-ryhmässä (1,7 % ja 0,8 %) kuin lumeryhmässä (0 % ja 0,3 %). Tälle erolle ei kuitenkaan saatu vahvistusta rutiini-ekg:n tuloksista (EKG eli elektrokardiogrammi on sydämen sykkeen ja sähköisen toiminnan mittaamiseen käytettävä menetelmä). Eteisvärinää ja eteislepatusta ilmeni yleisemmin potilailla, joilla oli aiemmin ilmennyt jompikumpi sairaus, kuin potilailla, joilla ei ollut vastaavaa historiaa. Yhteenvetona voidaan sanoa, että kliiniset Adempas-tutkimustulokset vastaavat odotettua eteisvärinän/-lepatuksen ilmaantuvuutta keuhkoverenpainetautipotilailla. Hoito normaalin sykkeen palauttamiseksi on tärkeää ennusteen parantamiseksi, jos potilaalla on keuhkoverenpainetauti ja eteisvärinä/-lepatus. Luustomuutokset ja luunmurtumat Kliinisessä Adempas-tutkimusohjelmassa luunmurtumia ilmeni harvoin KTEPHtautia tai PAH-tautia sairastavilla sekä lumeryhmässä (0,3 %) että Adempasryhmässä (0,7 %). Kliinisten Adempas-tutkimusten tulokset vastaavat odotettua luunmurtumien esiintyvyyttä vakavasti sairailla potilailla. Samanaikainen tupakointi (CYP1A1:n indusointi) Tupakoijilla riosiguaatin määrä verenkierrossa vähenee %. Tämän vuoksi potilaita kehotetaan lopettamaan tupakointi. Adempas-annosta on ehkä muutettava, jos potilas tupakoi tai aloittaa tai lopettaa tupakoinnin hoidon aikana. Sivu 5/3
6 Puuttuvat tiedot Riski Potilaat, joiden systolinen verenpaine (verenpaine sydämen supistuessa) on < 95 mmhg hoidon alussa Potilaat, joilla on vakavia maksaongelmia (Child-Pugh C) Potilaat, joiden kreatiniinipuhdistuma on < 30 ml/min (vakava munuaisten vajaatoiminta) tai jotka saavat dialyysihoitoa Raskaus ja imetys Mitä tiedetään Adempas-hoito saattaa aiheuttaa hypotensiota (matala verenpaine). Adempasvalmisteen vaikutusta potilaisiin, joilla on matala verenpaine jo ennen hoidon aloittamista, ei tiedetä. Adempas-valmistetta ei sen vuoksi saa käyttää, jos systolinen verenpaine on < 95 mmhg hoidon alussa. Maksan toiminnan heikkeneminen johtaa riosiguaattipitoisuuksien suurenemiseen verenkierrossa. Adempas-valmisteen vaikutusta potilaisiin, joilla on vakava maksan vajaatoiminta (Child-Pugh C), ei ole tutkittu. Tämän vuoksi Adempasvalmistetta ei saa käyttää näille potilaille. Munuaisten toiminnan heikkeneminen johtaa riosiguaattipitoisuuksien suurenemiseen verenkierrossa. Tietoja potilaista, joiden kreatiniinipuhdistuma on < 30 ml/min (eli joilla on vakava munuaisten vajaatoiminta), on niukasti, eikä dialyysihoitoa saavista potilaista ole lainkaan tietoja. Sen vuoksi näille potilaille ei suositella Adempas-valmisteen käyttöä. Adempas-valmisteen käytöstä raskaana oleville naisille ei ole tietoja. Eläinkokeissa on todettu lisääntymistoksisuutta (haittavaikutuksia raskauden aikana), ja valmisteen on havaittu läpäisevän istukan. Tämän vuoksi Adempasvalmistetta ei saa käyttää raskauden aikana. Raskaustesti suositellaan tehtäväksi kuukausittain. Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä Adempas-hoidon aikana. Tietoja Adempas-valmisteen käytöstä imettäville naisille ei ole saatavilla. Eläintutkimukset ovat osoittaneet riosiguaatin erittyvän maitoon. Koska vakavien haittavaikutusten riski imeväiselle on mahdollinen, Adempas-valmistetta ei pidä käyttää imetyksen aikana. Imetettävään lapseen kohdistuvia riskejä ei voida poissulkea. Imetys on lopetettava tämän lääkkeen käytön aikana. < 18-vuotiaat potilaat Adempas-valmisteen turvallisuutta ja tehoa lasten ja alle 18-vuotiaiden nuorten hoidossa ei ole vielä varmistettu. Kliinisiä tietoja ei ole saatavilla. Jyrsijöillä tehdyissä tutkimuksissa todettiin haittavaikutuksia kasvuikäisessä luustossa. Adempas-valmisteen käyttöä lasten ja kasvuikäisten nuorten hoidossa on vältettävä, kunnes näiden löydösten merkityksestä saadaan enemmän tietoa. Potilaat, joilla on KTEPH tai PAH ja jotka kuuluvat WHOtoimintakykyluokkaan IV (kaikki fyysinen rasitus aiheuttaa oireita; hengästyneisyyttä ja/tai väsymystä saattaa esiintyä jopa levossa) Pitkäaikaisturvallisuus kliinisessä käytössä Potilaat, joilla on hoitamaton hypertensio (kohonnut verenpaine) WHO-toimintakykyluokkaan IV kuuluvat potilaat eivät olleet täysin edustettuina faasin 3 kliinisissä Adempas-tutkimuksissa (mukaan otettiin vain potilaat, jotka pystyivät kävelemään yli 150 metriä 6 minuutissa ennen hoidon alkua). Pitkäaikaisturvallisuudesta on jo saatavilla tietoja potilailta, jotka ovat käyttäneet Adempas-valmistetta enintään 5 vuoden ajan kliinisissä tutkimuksissa. Myyntiluvan haltija kerää kuitenkin lisätietoja varmistaakseen Adempas-valmisteen pitkäaikaisturvallisuuden myös kliinisen tutkimusasetelman ulkopuolella. Hoitamaton kohonnut verenpaine johtuu todennäköisesti sydämeen/verisuoniin vaikuttavasta taustasairaudesta eikä liity suoraan PAH-tautiin tai KTEPH-tautiin. Adempas-valmisteen vaikutusta potilaisiin, joilla on hoitamaton kohonnut verenpaine, ei tiedetä. Yhteenveto toimenpiteistä riskien minimoimiseksi Sivu 6/3
7 Kaikista lääkevalmisteista laaditaan valmisteyhteenveto, joka sisältää lääkäreille, apteekkihenkilökunnalle ja muille terveydenhoidon ammattilaisille suunnattua yksityiskohtaista tietoa lääkkeen käytöstä, riskeistä ja suosituksista riskien minimoimiseksi. Pakkausselosteessa kerrotaan valmisteyhteenvedon tiedot lyhyesti maallikkokielellä. Valmisteyhteenvedossa ja pakkausselosteessa mainitut toimet ovat tavanomaisia riskienminimointitoimia. Lääkkeen valmisteyhteenveto ja pakkausseloste ovat saatavissa Fimean verkkosivujen kautta Tällä lääkkeellä ei ole lisätoimia riskien minimoimiseksi. Kehityssuunnitelma myyntiluvan myöntämisen jälkeen Luettelo kehityssuunnitelmaan sisältyvistä tutkimuksista Tutkimus (tutkimuksen numero) EXPosurE Registry RiociguaT in patients with pulmonary hypertension (EXPERT) (riosiguaattialtistus rekisteri) Tavoitteet Tämän maailmanlaajuisen rekisterin päätarkoitus on riosiguaatin turvallisuusseuranta todellisessa kliinisessä käytössä Käsiteltävät turvallisuuteen tai tehoon liittyvät seikat Tärkeät tunnistetut riskit: Hypotensio Mukaan lukien hypotensio, joka johtuu yhteisvaikutuksista seuraavien lääkkeiden kanssa: o orgaaniset nitraatit o fosfodiesteraasi- 5:n estäjät o vahvat, usean reitin kautta vaikuttavat CYP- ja P-gp/BCRP-estäjät o vahvat CYP1A1- estäjät ja vahvat P- gp/bcrp-estäjät Vakava veriyskös / keuhkoverenvuoto Tärkeät mahdolliset riskit: Verenvuoto Sikiötoksisuus Munuaisten vajaatoiminta Myyntiluvan ulkopuolinen käyttö alle 18-vuotiaille Potilaat, joilla on ennestään eteisvärinä Luustomuutokset ja luunmurtumat Samanaikainen tupakointi (CYP1A1:n indusointi) Puuttuvat tiedot: Potilaat, joiden systolisen verenpaineen lähtötaso on < 95 mmhg Potilaat, joilla on vakava maksan vajaatoiminta Tila Suunnitelmissa Väli- ja loppuraporttien aikataulu Saatavilla olevat tiedot esitetään seuraavissa dokumenteissa: PSUR/PBRER Loppuraportin arvioitu aika 2019 alussa Sivu 7/3
8 Tutkimus (tutkimuksen numero) In vitro - tutkimukset, joissa määritellään riosiguaatin ja sen M-1-metaboliitin substraattiominaisuudet ihmisen kuljettajaproteiineja kohtaan In vitro - tutkimukset, joissa määritellään M-1:n mahdollisuuksia estää munuaisten MATE1- ja MATE2Keffluksikuljettajaproteiineja. Tavoitteet Määritellään yksityiskohtaisemmin riosiguaatin ja M-1:n mahdollisia yhteisvaikutuksia muiden lääkkeiden kanssa Määritellään yksityiskohtaisemmin riosiguaatin ja M-1:n mahdollisia yhteisvaikutuksia muiden lääkkeiden kanssa Käsiteltävät turvallisuuteen tai tehoon liittyvät seikat (Child-Pugh C) Potilaat, joiden kreatiniinipuhdistuma on < 30 ml/min tai jotka saavat dialyysihoitoa Raskaus ja imetys < 18-vuotiaat potilaat Potilaat, joilla on KTEPH tai PAH ja jotka kuuluvat WHO-toimintakykyluokkaan IV Pitkäaikaisturvallisuus kliinisessä käytössä Potilaat, joilla on hoitamaton hypertensio Ei sovellettavissa Lääkeyhteisvaikutusten riski tuntematon Tila Käynnissä/ aloitettu Käynnissä Väli- ja loppuraporttien aikataulu Arvioitu aika joulukuussa 2014 Arvioitu aika toukokuussa 2014 Myyntiluvan ehdoissa mainitut tutkimukset Mikään yllä mainituista tutkimuksista ei ole ehtona myyntiluvalle (ensimmäinen myyntilupahakemus). Yhteenveto riskienhallintasuunnitelman päivityksistä Ei sovellettavissa. Yhteenveto on päivitetty edellisen kerran helmikuussa Sivu 8/3
Propecia (finasteridi 0,2 ja 1 mg) tabletti , versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Propecia (finasteridi 0,2 ja 1 mg) tabletti 25.4.2017, versio 4.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Miestyyppinen hiustenlähtö
Olmesartan medoxomil STADA. 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Olmesartan medoxomil STADA 10.11.2015, Versio V1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Olmesartan medoxomil STADA 10 mg kalvopäällysteiset tabletit Olmesartan
Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto
 EMA/738120/2014 Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto Tämä on Ofev-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
EMA/738120/2014 Ofev-valmisteen (nintedanibi) riskienhallintasuunnitelman yhteenveto Tämä on Ofev-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/775985/2014 Viekirax-valmisteen (ombitasviiri/paritapreviiri/ritonaviiri) enhallintasuunnitelman yhteenveto Tämä on Viekirax-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0
 PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
PLENADREN RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VERSIO 3.0 VI.2 VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä PLENADREN-valmistetta käytetään lisämunuaisten vajaatoiminnan
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
CORTIMENT (budesonidi) 26.11.2013, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Haavainen paksusuolentulehdus (UC)
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Olysio (simepreviiri) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on yhteenveto Olysio-valmisteen riskienhallintasuunnitelmasta (risk management plan, RMP), jossa esitetään yksityiskohtaisesti
Proscar. 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Proscar 7.8.2015, versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT VI.2.1 Tietoa sairauden esiintyvyydestä Eturauhanen on ainoastaan miehillä oleva rauhanen. Eturauhanen
Hoidon hyötyihin liittyvät asiat, joita ei tunneta (yksi lyhyt kappale kustakin käyttöaiheesta, enintään 50 sanaa)
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Albiomin 5 % ja 20 % ovat laskimoon annettavia infuusioliuoksia, jotka on tarkoitettu kiertävän veritilavuuden palauttamiseen ja
Julkisen yhteenvedon osiot. Lerkanidipiinin käyttöä ei suositella alle 18-vuotiaille lapsille, koska tiedot turvallisuudesta ja tehosta puuttuvat.
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO ORIDIP 10 MG KALVOPÄÄLLYSTEISET TABLETIT ORIDIP 20 MG KALVOPÄÄLLYSTEISET TABLETIT ORION CORPORATION PÄIVÄMÄÄRÄ: 22.3.2016, VERSIO 1.1 VI.2 Julkisen yhteenvedon
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO ORIDIP 10 MG KALVOPÄÄLLYSTEISET TABLETIT ORIDIP 20 MG KALVOPÄÄLLYSTEISET TABLETIT ORION CORPORATION PÄIVÄMÄÄRÄ: 22.3.2016, VERSIO 1.1 VI.2 Julkisen yhteenvedon
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injektioneste, liuos 3.7.2015, Versio 2.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injektioneste, liuos 3.7.2015, Versio 2.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Naproxen Orion 25 mg/ml oraalisuspensio. 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Naproxen Orion 25 mg/ml oraalisuspensio 26.10.2015, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Naproxen Orion on
Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
EMA/188850/2014 Jardiance-valmisteen (empagliflotsiini) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Jardiance-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
10 maaliskuuta 2016 Mometasoni Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Nuha Allerginen nuha on ylähengitysteiden
Remeron. 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
Remeron 13.11.2013, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Masennus on sairaus, jossa surullisuuden tunne ja
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO ORION OYJ
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO CANDESARTAN/HYDROCHLOROTHIAZIDE ORION 8 MG/12,5 MG, 16 MG/12,5 MG, 32 MG/12,5 MG, 32 MG/25 MG ORION OYJ PÄIVÄYS: 17.4.2015, versio 2 Sivu 1/6 VI.2 Julkisen
Lescol / Lescol Depot. 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lescol / Lescol Depot 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkea kolesteroli tarkoittaa kolesterolin
Lescol / Lescol Depot 29.12.2014, Versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Korkea kolesteroli tarkoittaa kolesterolin
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO. Moventig-valmisteen (naloksegoli) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/611606/2014 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Moventig-valmisteen (naloksegoli) riskienhallintasuunnitelman (RMP) yhteenveto VI.2 Julkisen yhteenvedon osiot Tämä on Moventig-valmisteen
EMA/611606/2014 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Moventig-valmisteen (naloksegoli) riskienhallintasuunnitelman (RMP) yhteenveto VI.2 Julkisen yhteenvedon osiot Tämä on Moventig-valmisteen
RMP section VI.2 Elements for Public Summary
 RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
RMP section VI.2 Elements for Public Summary Product: RMP: Atosiban Stragen, 6,75mg/0,9ml solution for injection Atosiban Stragen, 37,5mg/5ml concentrate for solution for infusion RMP-PID-ATO-v03 DLP:
LIITE I VALMISTEYHTEENVETO
 LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
LIITE I VALMISTEYHTEENVETO 1 Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan
Pramipexol Stada. 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pramipexol Stada 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Pramipexol STADA 0,088 mg tabletti Pramipexol STADA 0,18 mg tabletti Pramipexol STADA
Pramipexol Stada 18.10.2013, Versio V01 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Pramipexol STADA 0,088 mg tabletti Pramipexol STADA 0,18 mg tabletti Pramipexol STADA
Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit , Versio 1.3
 Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit 30.5.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Emtricitabine
Emtricitabine / Tenofovir disoproxil Stada 200 mg/245 mg kalvopäällysteiset tabletit 30.5.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Emtricitabine
Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio)
 28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
28 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden epidemiologiasta (Enintään 150 sanaa per indikaatio) Parenteraalinen ravitsemus voi olla indikoitu suurelle määrälle sairauksia, kuten syöpä ja
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Telmisartan/ ratiopharm 4.12.2014, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Telmisartan/ ratiopharm on angiotensiini
Telmisartan/ ratiopharm 4.12.2014, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Telmisartan/ ratiopharm on angiotensiini
Pioglitazone Actavis
 Tutustu Pioglitazone Actavis -valmisteyhteenvetoon ennen lääkkeen määräämistä Hoidollisten riskien minimointiohje Pioglitazone Actavis 15 mg ja 30 mg tabletit Päivitetty viimeksi 10/2018 Pioglitazone minimointiohje
Tutustu Pioglitazone Actavis -valmisteyhteenvetoon ennen lääkkeen määräämistä Hoidollisten riskien minimointiohje Pioglitazone Actavis 15 mg ja 30 mg tabletit Päivitetty viimeksi 10/2018 Pioglitazone minimointiohje
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteiden asianmukaisiin kohtiin Huomautus: Seuraavat muutokset valmisteyhteenvedon ja pakkausselosteen tiettyihin kohtiin tehdään sovittelumenettelyn
Ibandronat Stada 150 mg kalvopäällysteiset tabletit. 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
Ibandronat Stada 150 mg kalvopäällysteiset tabletit 3.11.2014, versio V2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1b Tietoa sairauden esiintyvyydestä Vuonna
, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Entecavir STADA 0,5 mg ja 1 mg kalvopäällysteiset tabletit 14.6.2016, versio V1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Entecavir Stada 0,5 mg kalvopäällysteiset
Primovist (dinatriumgadoksetaatti) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Primovist (dinatriumgadoksetaatti) 05/2013, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 2. Julkisen yhteenvedon osiot 2.1 Tietoa sairauden esiintyvyydestä Magneettikuvaus (MK) on yksi useasta
Primovist (dinatriumgadoksetaatti) 05/2013, Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 2. Julkisen yhteenvedon osiot 2.1 Tietoa sairauden esiintyvyydestä Magneettikuvaus (MK) on yksi useasta
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi)
 Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
Entyvio 300 mg kuiva aine välikonsentraatiksi infuusionestettä varten, liuos (vedolitsumabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO 27.6.2014, versio 1.0 VI.2 Julkisen yhteenvedon osiot VI.2.1
Orisild 20 mg tabletit , versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Orisild 20 mg tabletit 8.7.2016, versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Tätä lääkevalmistetta käytetään aikuisten,
Orisild 20 mg tabletit 8.7.2016, versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Tätä lääkevalmistetta käytetään aikuisten,
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Paracetamol B. Braun 10 mg/ml infuusioneste, liuos 22.10.2014, versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Parasetamolia
Exviera-valmisteen (dasabuviiri) riskienhallintasuunnitelman yhteenveto
 EMA/775993/2014 Exviera-valmisteen (dasabuviiri) enhallintasuunnitelman yhteenveto Tämä on Exviera-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
EMA/775993/2014 Exviera-valmisteen (dasabuviiri) enhallintasuunnitelman yhteenveto Tämä on Exviera-valmisteen enhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan, että
Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto
 EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
EMA/775515/2014 Cosentyx-valmisteen (sekukinumabi) riskienhallintasuunnitelman yhteenveto Tämä on Cosentyx-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joilla varmistetaan,
innohep Päivämäärä: , Versio 5 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 innohep Päivämäärä: 27.2.2017, Versio 5 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Käyttöaihe: veritulppien hoito Jalkojen isoissa
innohep Päivämäärä: 27.2.2017, Versio 5 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Käyttöaihe: veritulppien hoito Jalkojen isoissa
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 BREVIBLOC 27.2.2015, Versio 6.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä BREVIBLOC kuuluu beetasalpaajien lääkeryhmään. Sitä
BREVIBLOC 27.2.2015, Versio 6.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä BREVIBLOC kuuluu beetasalpaajien lääkeryhmään. Sitä
Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto
 EMA/601943/2014 Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Trulicity-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
EMA/601943/2014 Trulicity-valmisteen (dulaglutidi) riskienhallintasuunnitelman (RMP) yhteenveto Tämä on Trulicity-valmisteen riskienhallintasuunnitelman (RMP) yhteenveto, jossa esitetään toimenpiteet,
Riskienhallintasuunnitelman julkinen yhteenveto Kyprolis (karfiltsomibi)
 EMA/639793/2015 Riskienhallintasuunnitelman julkinen yhteenveto Kyprolis (karfiltsomibi) Tämä on Kyprolis-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/639793/2015 Riskienhallintasuunnitelman julkinen yhteenveto Kyprolis (karfiltsomibi) Tämä on Kyprolis-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana
 Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Angitensiiniä konvertoivan entsyymin (ACE:n) estäjät ja angiotensiini II -reseptorin salpaajat: Käyttö raskauden ja imetyksen aikana Valmisteyhteenvedon ja pakkausselosteen hyväksytyt sanoitukset, PhVWP
Nucala. 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/671186/2015 Nucala 01.02.2016 Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Nucalan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Symbicort Turbuhaler. Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Symbicort Turbuhaler Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on yleinen hengitysteiden tulehdussairaus,
Symbicort Turbuhaler Päivämäärä, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on yleinen hengitysteiden tulehdussairaus,
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT
 RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
RISKINHALLINTASUUNNITELMAN JULKINEN YHTEENVETO PREGABALIN ORION 25, 50, 75, 100, 150, 225, 300 MG KOVAT KAPSELIT ORION CORPORATION PÄIVÄMÄÄRÄ: 15-6-2015, VERSIO 2 VI.2 Julkisen yhteenvedon osiot VI.2.1
19.2.2014, versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Femoston 1/10 tabletti, kalvopäällysteinen Femoston 2/10 tabletti, kalvopäällysteinen Femoston Conti 1/5 tabletti, kalvopäällysteinen Femoston Conti 0,5/2,5 tabletti, kalvopäällysteinen 19.2.2014, versio
Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/702765/2014 Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Harvoni-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/702765/2014 Harvoni RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Harvoni-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Morphine Orion. Pvm: , Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Morphine Orion Pvm: 19.12.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Tämä lääke on tarkoitettu voimakkaan kivun
Morphine Orion Pvm: 19.12.2016, Versio 1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Tämä lääke on tarkoitettu voimakkaan kivun
Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
EMA/198014/2014 Sylvant (siltuksimabi) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Sylvant-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden
Osio VI: Yhteenveto riskienhallintasuunnitelman toimista
 Osio VI: Yhteenveto riskienhallintasuunnitelman toimista VI.2 VI.2.1 Julkisen yhteenvedon osat Tietoa sairauden esiintyvyydestä Lääkevalmiste Dormix 12,5 mg ja 25 mg kalvopäällysteiset tabletit on tarkoitettu
Osio VI: Yhteenveto riskienhallintasuunnitelman toimista VI.2 VI.2.1 Julkisen yhteenvedon osat Tietoa sairauden esiintyvyydestä Lääkevalmiste Dormix 12,5 mg ja 25 mg kalvopäällysteiset tabletit on tarkoitettu
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin
 Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Liite III Muutokset valmistetietojen asianmukaisiin kohtiin Huom: Nämä muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin on laadittu lausuntopyyntömenettelyssä. Direktiivin 2001/83/EY
Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto
 EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
EMA/66782/2015 Raplixan (ihmisen fibrinogeeni / ihmisen trombiini) riskienhallintasuunnitelman yhteenveto Tämä asiakirja on Raplixa-lääkevalmisteen riskienhallintasuunnitelman yhteenveto. Siinä esitetään
Liite III. Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin
 Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
Liite III Muutokset valmisteyhteenvedon ja pakkausselosteen asianmukaisiin kohtiin Huom: Tämä valmisteyhteenveto, myyntipäällysmerkinnät ja pakkausseloste on laadittu sovittelumenettelyssä. Direktiivin
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Ei oleellinen. Tämä on geneerinen hakemus. Valmisteyhteenveto noudattaa alkuperäisvalmisteen
Praluent. 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Praluent 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Praluent-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Praluent 08-2015, Versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Praluent-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Enstilar , Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Enstilar 21.1.2016, Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Psoriaasi on yleinen ihosairaus, jossa iholle ilmestyy
Enstilar 21.1.2016, Versio 3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Psoriaasi on yleinen ihosairaus, jossa iholle ilmestyy
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 11 maaliskuuta 2016 Desloratadiini Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Heinänuha Pohjoismaiset tutkimukset
11 maaliskuuta 2016 Desloratadiini Versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Heinänuha Pohjoismaiset tutkimukset
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 JAYDESS 13,5 mg, kohdunsisäinen ehkäisin 5/2014 versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
JAYDESS 13,5 mg, kohdunsisäinen ehkäisin 5/2014 versio 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI2. VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Jaydess-hormonkierukkaa
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Latanoprost Pfizer 4.2.2014, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Glaukooma on toiseksi yleisin sokeuden aiheuttaja
Latanoprost Pfizer 4.2.2014, Versio 4.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Glaukooma on toiseksi yleisin sokeuden aiheuttaja
Bimatoprosti. 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Bimatoprosti 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kohonneen silmänpaineen alentaminen kroonista avokulmaglaukoomaa
Bimatoprosti 6.6.2014, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kohonneen silmänpaineen alentaminen kroonista avokulmaglaukoomaa
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä
 mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
mykofenolaattimefotiili Opas potilaalle Tietoa syntymättömään lapseen kohdistuvista riskeistä Laatimispäivä: Huhtikuu 2016 Sisällysluettelo Johdanto... 3 Mitkä hoidon riskit ovat?... 3 Ketä riski koskee?...
Alteplaasi Versio 3.3
 Boehringer Ingelheim Sivu 1 / 5 OSA VI.2 Osa VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä Erilaiset sairaudet ja tilat edellyttävät laskimokatetrien eli laskimoon asetettavien ohuiden
Boehringer Ingelheim Sivu 1 / 5 OSA VI.2 Osa VI.2.1 JULKISEN YHTEENVEDON OSIOT Tietoa sairauden esiintyvyydestä Erilaiset sairaudet ja tilat edellyttävät laskimokatetrien eli laskimoon asetettavien ohuiden
Pregabalin Pfizer. 8.11.2013, versio 10.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pregabalin Pfizer 8.11.2013, versio 10.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on pitkäaikainen aivoihin
Pregabalin Pfizer 8.11.2013, versio 10.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on pitkäaikainen aivoihin
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
Pregabalin Krka 17.2.2015, Versio 1.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Täydellisyyden vuoksi, viitaten Direktiivin 2001/83 artiklaan 11, hakija varaa mahdollisuuden
POTILAAN OPAS MAVENCLAD. Potilaan opas. Kladribiini (MAVENCLAD) RMP, versio 1.0 Fimean hyväksymä
 MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
MAVENCLAD Potilaan opas POTILAAN OPAS RISKIENHALLINNAN KOULUTUSMATERIAALI FI/CLA/1117/0050 Tärkeää tietoa MAVENCLAD-hoidon aloittaville potilaille Sisällys MAVENCLAD-valmisteen esittely Kuinka MAVENCLAD-hoito
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista
 Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Lääkäreille ja apteekkihenkilökunnalle lähetettävät tiedot Bupropion Sandoz 150 mg ja 300 mg säädellysti vapauttavista tableteista Valmisteyhteenveto on luettava huolellisesti ennen Bupropion Sandoz -valmisteen
Toctino (alitretinoiini)
 POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
POTILASESITE Toctino (alitretinoiini) Raskaudenehkäisyohjelma TOC-FI-004-051208-D Tästä esitteestä Tässä esitteessä on tärkeää tietoa Toctino-hoidostanne ja lääkkeen käyttöön liittyvästä mahdollisesta
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Erivedge 150 mg kovat kapselit RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lokakuu 2013, v. 8.0 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ihon tyvisolusyöpä on yleisin
Erivedge 150 mg kovat kapselit RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Lokakuu 2013, v. 8.0 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Ihon tyvisolusyöpä on yleisin
Tiedote terveydenhuollon ammattilaisille Sprycelin (dasatinibi) yhteydestä keuhkovaltimoiden verenpainetautiin
 P.O. Oy Bristol-Myers Box 15200, Gustavslundsvägen Squibb (Finland) Ab 12 SE-167 Metsänneidonkuja 15 Bromma, 8, Sweden 02130 Espoo Phone Puh. (09) (46) 251 8 704 21 230, 71 00, Faksi Fax (09) (46) 251
P.O. Oy Bristol-Myers Box 15200, Gustavslundsvägen Squibb (Finland) Ab 12 SE-167 Metsänneidonkuja 15 Bromma, 8, Sweden 02130 Espoo Phone Puh. (09) (46) 251 8 704 21 230, 71 00, Faksi Fax (09) (46) 251
OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN. Priapismi
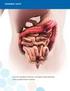 OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN VI1 EPAR-yhteenvetotaulukkojen osiot VI1.1 Yhteenvetotaulukko turvallisuustiedoista Yhteenveto turvallisuustiedoista - Priapismi -
OSA VI: YHTEENVETO RISKIENHALLINTASUUNNITELMAN TOIMISTA VALMISTEITTAIN VI1 EPAR-yhteenvetotaulukkojen osiot VI1.1 Yhteenvetotaulukko turvallisuustiedoista Yhteenveto turvallisuustiedoista - Priapismi -
Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/661227/2015 Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Genvoya-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/661227/2015 Genvoya RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Tämä on Genvoya-valmisteen riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Vokanamet (kanagliflotsiini/metformiini) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/137565/2014 Vokanamet (kanagliflotsiini/metformiini) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Vokanamet-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
EMA/137565/2014 Vokanamet (kanagliflotsiini/metformiini) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Vokanamet-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet,
Seretide. 12-2014, v05 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Seretide 12-2014, v05 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on keuhkosairaus, jossa pieniä keuhkoputkia ympäröivät
Seretide 12-2014, v05 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Astma Astma on keuhkosairaus, jossa pieniä keuhkoputkia ympäröivät
Isotretinoin riskinhallintaohjelma. Isotretinoin Orion (isotretinoiini) Potilaan opas. Raskauden ja sikiöaltistuksen ehkäisy
 Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Isotretinoin riskinhallintaohjelma Isotretinoin Orion (isotretinoiini) Potilaan opas Raskauden ja sikiöaltistuksen ehkäisy TÄMÄN ESITTEEN TARKOITUS Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä
Perusseikkoja julkista yhteenvetoa varten
 Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
Perusseikkoja julkista yhteenvetoa varten Yleiskatsaus taudin epidemiologiaan Elinajanodotteen kasvamisen ja väestön ikääntymisen oletetaan tekevän nivelrikosta neljänneksi suurimman työkyvyttömyyden syyn
PLENADREN EU-Riskienhallintasuunnitelma, versio 3.2. Julkisen yhteenvedon osa-alueet. Katsaus taudin epidemiologiaan. Yhteenveto hoidon hyödyistä
 PLENADREN EU-Riskienhallintasuunnitelma, versio 3.2 VI.2 VI.2.1 Julkisen yhteenvedon osa-alueet Katsaus taudin epidemiologiaan PLENADREN sisältää hydrokortisonia ja sitä käytetään lisämunuaisten vajaatoiminnan
PLENADREN EU-Riskienhallintasuunnitelma, versio 3.2 VI.2 VI.2.1 Julkisen yhteenvedon osa-alueet Katsaus taudin epidemiologiaan PLENADREN sisältää hydrokortisonia ja sitä käytetään lisämunuaisten vajaatoiminnan
ZAVEDOS , versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 1 (6) ZAVEDOS 9.6.2016, versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akuuttia lymfaattista leukemiaa (ALL) esiintyy
1 (6) ZAVEDOS 9.6.2016, versio 1.2 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Akuuttia lymfaattista leukemiaa (ALL) esiintyy
Betaserc 24 mg suussa hajoavat tabletit , versio 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Betaserc 24 mg suussa hajoavat tabletit 23.9.2014, versio 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Betahistiini on tarkoitettu
Betaserc 24 mg suussa hajoavat tabletit 23.9.2014, versio 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Betahistiini on tarkoitettu
Potilaan opas. Acitretin Orifarm 10 mg ja 25 mg. Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/FI/66949
 Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Potilaan opas Acitretin Orifarm 10 mg ja 25 mg Raskauden- ja sikiöaikaisen altistuksen ehkäisyohjelma 03/2018/ Tämän esitteen tarkoitus Tämä esite sisältää tärkeitä tietoja etenkin hedelmällisessä iässä
Julkisen yhteenvedon osiot
 Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Paminject 3 mg/ml, infuusiokonsentraatti, liuosta varten 25.2.2016, Versio V3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot Paminject 3 mg/ml, infuusiokonsentraatti,
Julkisen yhteenvedon osiot
 Olmestad Comp 20 mg/12,5 mg kalvopäällysteinen tabletti Olmestad Comp 20 mg/25 mg kalvopäällysteinen tabletti 17.12.2015, versio V1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon
Olmestad Comp 20 mg/12,5 mg kalvopäällysteinen tabletti Olmestad Comp 20 mg/25 mg kalvopäällysteinen tabletti 17.12.2015, versio V1.3 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN
 LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
LIITE III MUUTOKSET VALMISTEYHTEENVETOON JA PAKKAUSSELOSTEESEEN 41 KABERGOLIINIA SISÄLTÄVIEN LÄÄKEVALMISTEIDEN VALMISTEYHTEENVEDON 4.2 Annostus ja antotapa: Seuraava tieto tulee lisätä sopivalla tavalla:
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 ETORICOXIB RATIOPHARM KALVOPÄÄLLYSTEISET TABLETIT Päivämäärä: 4.8.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
ETORICOXIB RATIOPHARM KALVOPÄÄLLYSTEISET TABLETIT Päivämäärä: 4.8.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN MUUTOS Nämä muutokset valmisteyhteenvetoon ja pakkausselosteeseen ovat voimassa Komission päätöksestä. Jäsenvaltioiden viranomaiset päivittävät valmistetiedot
Fimea kehittää, arvioi ja informoi
 Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Fimea kehittää, arvioi ja informoi SELKOTIIVISTELMÄ JULKAISUSARJA 4/2012 Eteisvärinän hoito Verenohennuslääke dabigatraanin ja varfariinin vertailu Eteisvärinä on sydämen rytmihäiriö, joka voi aiheuttaa
Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi)
 EMA/577184/2015 Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi) Tämä on Repatha-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden avulla
EMA/577184/2015 Riskienhallintasuunnitelman julkinen yhteenveto Repatha (evolokumabi) Tämä on Repatha-valmistetta koskevan riskienhallintasuunnitelman yhteenveto, jossa esitetään toimenpiteet, joiden avulla
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski
 mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
mykofenolaattimefotiili Opas terveydenhuoltoalan ammattilaisille Teratogeenisyysriski Laatimispäivä: Huhtikuu 2016 Johdanto Tämä esite, Myfenax (mykofenolaattimofetiili) Opas terveydenhuoltoalan ammattilaisille,
OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EU RMP Lääkeaine Bikalutamidi Version numero 2 Päivämäärä 2 toukokuu 2014 OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT Bikalutamidi (CASODEX 1 ) on hormonaalinen
EU RMP Lääkeaine Bikalutamidi Version numero 2 Päivämäärä 2 toukokuu 2014 OSA VI: RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 JULKISEN YHTEENVEDON OSIOT Bikalutamidi (CASODEX 1 ) on hormonaalinen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT
 LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
LIITE III VALMISTEYHTEENVEDON JA PAKKAUSSELOSTEEN OLEELLISET OSAT Huomautus: Nämä valmisteyhteenvedon ja pakkausselosteen muutokset ovat voimassa komission päätöksen ajankohtana. Komission päätöksen jälkeen
Ethambutol Orion 500 mg tabletit Päivämäärä: , Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Ethambutol Orion 500 mg tabletit Päivämäärä: 21.10.2016, Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Etambutoli on
Ethambutol Orion 500 mg tabletit Päivämäärä: 21.10.2016, Versio 1.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 VI.2.1 Julkisen yhteenvedon osiot Tietoa sairauden esiintyvyydestä Etambutoli on
Lamictal , versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Lamictal 30.12.2015, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on vakava sairaus, jossa esiintyy
Lamictal 30.12.2015, versio 1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Epilepsia Epilepsia on vakava sairaus, jossa esiintyy
Sydämen vajaatoiminta. VEDOS TPA Tampere: sydämen vajaatoiminta
 Sydämen vajaatoiminta Perustieto Määritelmä Ennuste Iäkkäiden vajaatoiminta Seuranta Palliatiivisen hoidon kriteerit vajaatoiminnassa Syventävä tieto Diagnostiikka Akuuttien oireiden hoito Lääkehoidon
Sydämen vajaatoiminta Perustieto Määritelmä Ennuste Iäkkäiden vajaatoiminta Seuranta Palliatiivisen hoidon kriteerit vajaatoiminnassa Syventävä tieto Diagnostiikka Akuuttien oireiden hoito Lääkehoidon
Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa , Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa 6.7.2016, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
Influvac 15 mikrog HA / 0,5 ml injektioneste, suspensio esitäytetyssä ruiskussa 6.7.2016, Versio 3.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 DUTASTERIDE RATIOPHARM 0,5 MG PEHMEÄT KAPSELIT Päivämäärä: 16.3.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
DUTASTERIDE RATIOPHARM 0,5 MG PEHMEÄT KAPSELIT Päivämäärä: 16.3.2016, Versio: 2.0 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä
Liite I. Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle
 Liite I Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle 1 Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle 1. Pneumokefalus: Karmustiini-implantteihin
Liite I Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle 1 Tieteelliset päätelmät ja perusteet myyntiluvan (-lupien) ehtojen muuttamiselle 1. Pneumokefalus: Karmustiini-implantteihin
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 25 helmikuuta 2016 Kolkisiini Versio 3.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kihti i Kihtiä esiintyy kaikkialla maailmassa.
25 helmikuuta 2016 Kolkisiini Versio 3.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Kihti i Kihtiä esiintyy kaikkialla maailmassa.
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Kalii chloridum/glucosum B. Braun 1,5 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/glucosum B. Braun 3 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/natrii chloridum B. Braun 1,5 mg/ml
Kalii chloridum/glucosum B. Braun 1,5 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/glucosum B. Braun 3 mg/ml + 50 mg/ml infuusioneste, liuos Kalii chloridum/natrii chloridum B. Braun 1,5 mg/ml
Mitään eroja ei havaittu tehossa miesten ja naisten välillä eikä etnisten ryhmien tai rotujen välillä.
 VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Intuniv on lääke, jol hoidetaan tarkkaavaisuus- ja ylivilkkaushäiriötä (ADHD), käyttäytymishäiriötä, johon liittyy lyhyt tarkkaavaisuuskyky,
VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Intuniv on lääke, jol hoidetaan tarkkaavaisuus- ja ylivilkkaushäiriötä (ADHD), käyttäytymishäiriötä, johon liittyy lyhyt tarkkaavaisuuskyky,
RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 Atosiban EVER Pharma 6,75 mg/0,9 ml injektioneste, liuos Atosiban EVER Pharma 37,5 mg/5 ml infuusiokonsentraatti, liuosta varten Atosiban EVER Pharma 75 mg/10 ml infuusiokonsentraatti, liuosta varten 30.12.2015,
Atosiban EVER Pharma 6,75 mg/0,9 ml injektioneste, liuos Atosiban EVER Pharma 37,5 mg/5 ml infuusiokonsentraatti, liuosta varten Atosiban EVER Pharma 75 mg/10 ml infuusiokonsentraatti, liuosta varten 30.12.2015,
VALGANCICLOVIR TEVA RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 VALGANCICLOVIR TEVA Päivämäärä: 17.7.2013, Versio: 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Useimmat ihmiset joutuvat
VALGANCICLOVIR TEVA Päivämäärä: 17.7.2013, Versio: 2.1 RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO VI.2 Julkisen yhteenvedon osiot VI.2.1 Tietoa sairauden esiintyvyydestä Useimmat ihmiset joutuvat
Rezolsta (darunaviiri/kobisistaatti) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/608280/2014 Rezolsta (darunaviiri/kobisistaatti) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Rezolsta-valmistetta koskevan riskienhallintasuunnitelman julkinen yhteenveto, jossa esitetään
EMA/608280/2014 Rezolsta (darunaviiri/kobisistaatti) RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Rezolsta-valmistetta koskevan riskienhallintasuunnitelman julkinen yhteenveto, jossa esitetään
Incruse (umeklidiniumbromidi) 04-2014, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO
 EMA/208283/2014 Incruse (umeklidiniumbromidi) 04-2014, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Incruse-valmisteen riskienhallintasuunnitelman yhteenveto (RMP), jossa esitetään toimenpiteet,
EMA/208283/2014 Incruse (umeklidiniumbromidi) 04-2014, Versio RISKIENHALLINTASUUNNITELMAN JULKINEN YHTEENVETO Tämä on Incruse-valmisteen riskienhallintasuunnitelman yhteenveto (RMP), jossa esitetään toimenpiteet,
Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin
 Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
Liite III Muutoksia valmisteyhteenvedon merkittäviin kohtiin ja pakkausselosteisiin Huom.: Nämä muutokset valmisteyhteenvetoon, pakkausmerkintöihin ja pakkausselosteeseen saatetaan päivittää myöhemmin
